Dernière mise à jour le 01/12/2025
ADRENALINE AGUETTANT 0,1 mg/mL sans sulfite, solution injectable en seringue pré-remplie
Indications thérapeutiques
Agents adrénergiques et dopaminergiques - code ATC : C01 CA 24
Ce médicament est utilisé pour :
· le traitement de l’arrêt cardiaque (perte inattendue de la fonction cardiaque, la respiration et la conscience) ;
· le traitement de l’anaphylaxie aiguë chez l’adulte (choc ou collapsus grave résultant d’une réaction allergique sévère).
Présentations
> 10 seringue(s) préremplie(s) polypropylène suremballée(s) de 10 ml
Code CIP : 34009 300 549 7 0
Déclaration de commercialisation : 07/10/2016
Cette présentation est agréée aux collectivités
Service médical rendu (SMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprès de la HAS (plus d'informations dans l'aide). Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Important | Avis du 29/06/2016 | Inscription (CT) | Le service médical rendu par ADRENALINE AGUETTANT 0,1 mg/mL SANS SULFITE, solution injectable en seringue préremplie est important dans les indications de l’AMM. |
Amélioration du service médical rendu (ASMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprés de la HAS (plus d'informations dans l'aide). Les avis et synthéses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur de l'ASMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| V (Inexistant) | Avis du 29/06/2016 | Inscription (CT) | Cette spécialité est un complément de gamme qui n’apporte pas d’amélioration du service médical rendu (ASMR V) par rapport aux présentations déjà inscrites. |
ANSM - Mis à jour le : 19/02/2025
ADRENALINE AGUETTANT 0,1 mg/mL sans sulfite, solution injectable en seringue pré-remplie
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Chaque millilitre de solution injectable contient 0,1 mg d’adrénaline (sous forme d’adrénaline tartrate)
Chaque seringue pré-remplie de 10 mL contient 1 mg d’adrénaline (sous forme d’adrénaline tartrate).
Excipient à effet notoire : sodium
Chaque millilitre de solution injectable contient 3,54 mg de sodium, soit l’équivalent de 0,154 mmole.
Chaque seringue pré-remplie de 10 mL contient 35,4 mg de sodium, soit l’équivalent de 1,54 mmole.
Pour la liste complète des excipients, voir rubrique 6.1.
Solution injectable en seringue pré-remplie
Solution limpide et incolore dans une seringue pré-remplie de 10 mL
pH = 3,0 à 3,4
Osmolarité : 270 à 300 mOsm/l
4.1. Indications thérapeutiques
Anaphylaxie aiguë chez l’adulte
4.2. Posologie et mode d'administration
Réanimation cardio-pulmonaire :
Administration de 10 mL de solution d’adrénaline au 1:10 000 (1 mg), par voie intraveineuse ou intra‑osseuse, répétée toutes les 3 à 5 minutes jusqu’au rétablissement de la circulation spontanée.
La voie endotrachéale ne doit être utilisée qu’en dernier ressort, si aucune autre voie d’administration n’est accessible, à une dose de 20 à 25 mL de solution au 1:10 000 (soit l’équivalent de 2 à 2,5 mg).
En cas d’arrêt cardiaque suivant une intervention de chirurgie cardiaque, l’adrénaline est administrée par voie intraveineuse à des doses de 0,5 mL ou 1 mL de solution au 1:10 000 (50 ou 100 microgrammes), avec beaucoup de prudence et en dosant jusqu’à obtention de l’effet souhaité.
Anaphylaxie aiguë :
Titrer l’adrénaline intraveineuse en administrant des bolus de 0,5 mL de solution au 1:10 000 (0,05 mg) selon la réponse.
Adrenaline AGUETTANT 0.1 mg/mL sans sulfite, solution injectable en seringue pré-remplie, n’est pas recommandé pour une utilisation par voie intramusculaire dans les cas d’anaphylaxie aiguë. Pour une administration intramusculaire, une solution à 1 mg/mL (1:1000) doit être utilisée.
Population pédiatrique :
Ce médicament n’est pas adapté pour délivrer une dose inférieure à 0,5 mL et ne doit par conséquent pas être utilisé par voie intraveineuse ou intra-osseuse chez les nouveaux nés et les enfants de moins de 5 kg.
Arrêt cardiaque chez l’enfant :
Voie intraveineuse ou intra-osseuse (au-dessus de 5 kgs de poids corporel uniquement) : 0,1 mL/kg de solution d’adrénaline au 1:10 000 (10 microgrammes/kg) jusqu’ à une dose unique maximale de 10 mL de solution au 1:10 000 (soit l’équivalent de 1 mg), répétée toutes les 3 à 5 minutes jusqu’au rétablissement de la circulation spontanée.
La voie endotrachéale ne doit être utilisée, quel que soit le poids, qu’en dernier ressort, si aucune autre voie d’administration n’est accessible, à une dose de 1 mL/kg de solution au 1:10 000 (100 microgrammes/kg) jusqu’à un maximum de 25 mL de solution au 1:10 000, soit l’équivalent de 2,5 mg).
4.4. Mises en garde spéciales et précautions d'emploi
Pour une administration intramusculaire, une solution à 1 mg/mL (1:1000) doit être utilisée.
Dans le traitement de l’anaphylaxie et chez d’autres patients ayant une circulation spontanée, l’adrénaline intraveineuse peut provoquer une hypertension menaçant le pronostic vital, une tachycardie, des arythmies et une ischémie myocardique.
L’utilisation d’adrénaline intraveineuse est réservée aux professionnels de santé expérimentés dans l’administration et la titration des vasopresseurs dans le cadre de leur pratique clinique ordinaire. Les patients qui reçoivent de l’adrénaline IV nécessitent au minimum une surveillance continue de l’ECG, de l’oxymétrie de pouls et mesures fréquentes de la tension artérielle.
Le risque de toxicité est augmenté dans les situations suivantes :
· Hyperthyroïdie
· Hypertension
· Maladies cardiaques structurelles, arythmies cardiaques, cardiomyopathie obstructive sévère
· Insuffisance coronarienne
· Phéochromocytome
· Hypokaliémie
· Hypercalcémie
· Insuffisance rénale sévère
· Maladie vasculaire cérébrale, lésions cérébrales organiques ou artériosclérose
· Patients prenant des inhibiteurs de la monoamine oxydase (IMAO) (voir rubrique 4.5)
· Patients prenant des médicaments concomitants qui produisent des effets additifs ou sensibilisent le myocarde aux actions des agents sympathomimétiques (voir rubrique 4.5)
L’utilisation prolongée d’adrénaline peut entraîner une acidose métabolique sévère en raison des concentrations sanguines élevées d’acide lactique.
L’adrénaline peut augmenter la pression intraoculaire chez les patients atteints de glaucome à angle fermé.
L’adrénaline doit être utilisée avec prudence chez les patients atteints d’hyperplasie prostatique avec rétention urinaire.
L’adrénaline pouvant causer ou aggraver l’hyperglycémie, la glycémie doit être surveillée, en particulier chez les patients diabétiques.
L’adrénaline doit être utilisée avec prudence chez les patients âgés.
L’adrénaline ne doit pas être utilisée au cours du deuxième stade du travail (voir rubrique 4.6).
Ce médicament contient 35,4 mg de sodium par seringue pré-remplie, ce qui équivaut à 1,77% de l’apport alimentaire quotidien maximal recommandé par l’OMS de 2 g de sodium par adulte.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Antidépresseurs imipraminiques : hypertension paroxystique avec possibilité d’arythmie (inhibition de l’entrée des sympathomimétiques dans les fibres sympathiques).
Antidépresseurs sérotoninergiques-adrénergiques : hypertension paroxystique avec possibilité d’arythmie (inhibition de l’entrée des sympathomimétiques dans les fibres sympathiques).
Agents sympathomimétiques : l’administration concomitante d’autres sympathomimétiques pourrait augmenter la toxicité en raison des effets additifs possibles.
IMAO non sélectifs : augmentation de l’action vasopressive de l’adrénaline, habituellement modérée.
IMAO-A sélectifs, linézolide (par extrapolation à partir des IMAO non sélectifs) : Risque d’aggravation de l’action vasopressive.
Alpha-bloquants adrénergiques : Les alphabloquants antagonisent les effets vasopressifs et hypertenseurs de l’adrénaline, ce qui augmente le risque d’hypotension et de tachycardie.
Bêta-bloquants adrénergiques : Une hypertension artérielle sévère et une bradycardie réflexe peuvent survenir avec des agents bêtabloquants non-cardiosélectifs. Les bêtabloquants, en particulier les agents non-cardiosélectifs, antagonisent également les effets cardiaques et bronchodilatateurs de l’adrénaline.
Insuline ou hypoglycémiants oraux : L’hyperglycémie provoquée par l’adrénaline peut conduire à une perte de la maîtrise de la glycémie chez les patients diabétiques traités par insuline ou par hypoglycémiants oraux.
4.6. Fertilité, grossesse et allaitement
Grossesse
Un effet tératogène a été démontré lors des expériences chez l’animal.
L’adrénaline ne doit être utilisée pendant la grossesse que si les avantages potentiels l’emportent sur les risques éventuels pour le fœtus. En cas d’administration pendant la grossesse, l’adrénaline peut provoquer une anoxie chez le fœtus.
L’adrénaline inhibe habituellement les contractions spontanées (ou celles induites par l’ocytocine) de l’utérus chez la femme enceinte et peut retarder le deuxième stade du travail. À une dose suffisante pour réduire les contractions utérines, l’adrénaline peut provoquer une période prolongée d’atonie utérine avec hémorragie. Pour cette raison, l’adrénaline parentérale ne doit pas être utilisée au cours du deuxième stade du travail.
L’adrénaline passe dans le lait maternel. L’allaitement doit être évité chez les mères qui reçoivent de l’adrénaline.
Fertilité
On ne dispose d’aucune information concernant les répercussions de l’adrénaline sur la fertilité.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Sans objet dans les conditions normales d’utilisation.
Troubles du métabolisme et de la nutrition :
Fréquence indéterminée : hyperglycémie, hypokaliémie, acidose métabolique.
Affections psychiatriques :
Fréquence indéterminée : anxiété, nervosité, peur, hallucinations.
Affections du système nerveux :
Fréquence indéterminée : maux de tête, tremblements, vertiges, syncope.
Affections oculaires :
Fréquence indéterminée : mydriase.
Affections cardiaques :
Fréquence indéterminée : palpitations, tachycardie. Takotsubo cardiomyopathie (cardiomyopathie de stress) peut survenir. À haute dose ou chez les patients sensibles à l’adrénaline : arythmie cardiaque (tachycardie sinusale, fibrillation ventriculaire/arrêt cardiaque), crises angineuses et risque d’infarctus aigu du myocarde.
Affections vasculaires :
Fréquence indéterminée : pâleur, refroidissement des extrémités. À haute dose ou chez les patients sensibles à l’adrénaline : hypertension (avec risque d’hémorragie cérébrale), vasoconstriction (par exemple cutanée, au niveau des extrémités ou des reins).
Affections respiratoires, thoraciques et médiastinales :
Fréquence indéterminée : dyspnée.
Affections gastro-intestinales :
Fréquence indéterminée : nausées, vomissements.
Troubles généraux et anomalies au site d’administration :
Fréquence indéterminée : transpiration, faiblesse.
Des injections locales répétées peuvent produire une nécrose au niveau des sites d’injection résultant d’une constriction vasculaire.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/
Un surdosage ou l’administration intraveineuse accidentelle d’adrénaline pourrait entraîner une hypertension sévère. Des accidents cérébraux, cardiaques ou vasculaires potentiellement mortels pourraient ainsi se produire (hémorragie cérébrale, troubles du rythme tels que bradycardie transitoire suivie d’une tachycardie susceptible de conduire à une arythmie, une nécrose myocardique, un œdème pulmonaire aigu ou une insuffisance rénale).
Les effets de l’adrénaline peuvent être antagonisés, en fonction de l’état du patient, par l’administration de vasodilatateurs à action rapide, de médicaments alpha-bloquants adrénergiques à action rapide (comme la phentolamine) ou de médicaments bêta-bloquants adrénergiques (comme le propranolol). Cependant, la demi-vie de l'adrénaline étant très brève, il n'est pas toujours nécessaire d'avoir recours à ces médicaments. En cas de réaction hypotensive prolongée, l’administration d’un autre agent vasopresseur comme la noradrénaline pourrait s’avérer nécessaire.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
L’adrénaline est un agent sympathomimétique à action directe, qui agit sur les deux types, α et β, de récepteurs adrénergiques. Elle a des effets plus prononcés sur les récepteurs adrénergiques β que sur les récepteurs α, même si les effets sur les récepteurs α prévalent aux doses élevées.
Les effets de l’adrénaline comprennent une augmentation de la fréquence et de la force des contractions cardiaques, une vasoconstriction cutanée et une bronchodilatation. Aux doses plus élevées, la stimulation des récepteurs α périphériques conduit à une augmentation des résistances périphériques et de la pression artérielle.
5.2. Propriétés pharmacocinétiques
L’adrénaline est rapidement distribuée dans le cœur, la rate, plusieurs tissus glandulaires et le système nerveux adrénergiques. Elle traverse facilement le placenta et est liée à 50 % environ aux protéines plasmatiques.
L’adrénaline est rapidement inactivée dans l’organisme, principalement dans le foie par les enzymes catéchol-O-méthyltransférase (COMT) et monoamine oxydase (MAO). La majeure partie d’une dose d’adrénaline est excrétée sous forme de métabolites dans les urines.
Après administration intraveineuse, la demi-vie plasmatique est d’environ 2 à 3 minutes.
5.3. Données de sécurité préclinique
Acide chlorhydrique (pour l’ajustement du pH)
Hydroxyde de sodium (pour l’ajustement du pH)
Eau pour préparations injectables
En l’absence d’études de compatibilité, ce médicament ne doit pas être mélangé avec d’autres médicaments.
Avant ouverture : 2 ans.
6.4. Précautions particulières de conservation
À conserver à une température ne dépassant pas 25°C.
Ne pas congeler.
À conserver dans le sachet en aluminium à l’abri de la lumière et de l’oxygène.
6.5. Nature et contenu de l'emballage extérieur
10 mL de solution en seringue pré-remplie en polypropylène, sans aiguille, conditionnée individuellement dans un blister transparent et suremballée dans un sachet en aluminium contenant un sachet absorbant l’oxygène ; boîtes de 1 ou 10.
Toutes les présentations peuvent ne pas être commercialisées.
6.6. Précautions particulières d’élimination et de manipulation
N’ouvrir le sachet en aluminium et la plaquette thermoformée de la seringue qu’immédiatement avant l’administration.
Après l’ouverture du sachet, le produit doit être utilisé immédiatement.
La surface externe de la seringue et son contenu sont stériles si le blister est non-ouvert et en bon état.
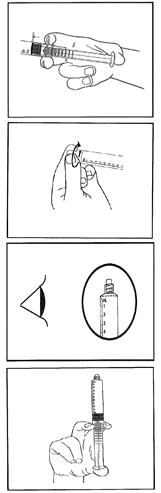
Respecter scrupuleusement le protocole ci-dessous
La seringue pré-remplie est à utiliser chez un seul patient. Jetez la seringue après usage. Ne pas réutiliser.
Inspectez visuellement le produit avant l’administration pour déceler la présence de particules ou d’une coloration anormale. Seule une solution limpide et incolore dépourvue de particules ou de précipités doit être utilisée.
Ne pas utiliser le produit si le sachet ou le blister ont été ouverts ou si la bande d’inviolabilité sur la seringue (film plastique à la base du capuchon) est rompue.
1) Déchirez le sachet en aluminium à la main uniquement le long des encoches préformées.
Ne pas utiliser d’instruments tranchants pour ouvrir le sachet.
2) Retirez la seringue pré-remplie du blister stérile.
|
|
3) Enfoncez le piston pour libérer le bouchon. Le procédé de stérilisation peut avoir fait adhérer le bouchon au corps de la seringue. |
|
4) Enlevez le capuchon en le dévissant pour rompre la bande d’inviolabilité. Ne pas toucher le raccord Luer nu afin d’éviter toute contamination. |
|
|
5) Vérifiez que la bande d’inviolabilité à la pointe de la seringue a été complètement retirée. Si ce n’est pas le cas, remettez le capuchon en place et dévissez à nouveau. |
|
|
6) Chassez l’air en enfonçant doucement le piston. |
7) Connectez la seringue au dispositif d’accès vasculaire ou à l’aiguille.
Enfoncez le piston pour injecter le volume requis.
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
1, RUE ALEXANDER FLEMING
69007 LYON
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 300 466 1 6 : 10 mL de solution en seringue préremplie (polypropylène) ; boite de 1.
· 34009 300 549 7 0 : 10 mL de solution en seringue préremplie (polypropylène) ; boite de 10.
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Liste I
ANSM - Mis à jour le : 19/02/2025
ADRENALINE AGUETTANT 0,1 mg/mL sans sulfite, solution injectable en seringue pré-remplie
Adrénaline
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin, votre pharmacien ou votre infirmier/ère.
· Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d’autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin, votre pharmacien ou votre infirmier/ère. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
1. Qu'est-ce que ADRENALINE AGUETTANT 0,1 mg/mL sans sulfite, solution injectable en seringue pré-remplie et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant d'utiliser ADRENALINE AGUETTANT 0,1 mg/mL sans sulfite, solution injectable en seringue pré-remplie ?
3. Comment utiliser ADRENALINE AGUETTANT 0,1 mg/mL sans sulfite, solution injectable en seringue pré-remplie ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver ADRENALINE AGUETTANT 0,1 mg/mL sans sulfite, solution injectable en seringue pré-remplie ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE ADRENALINE AGUETTANT 0,1 mg/mL sans sulfite, solution injectable en seringue pré-remplie ET DANS QUELS CAS EST-IL UTILISE ?
Agents adrénergiques et dopaminergiques - code ATC : C01 CA 24
Ce médicament est utilisé pour :
· le traitement de l’arrêt cardiaque (perte inattendue de la fonction cardiaque, la respiration et la conscience) ;
· le traitement de l’anaphylaxie aiguë chez l’adulte (choc ou collapsus grave résultant d’une réaction allergique sévère).
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D’UTILISER ADRENALINE AGUETTANT 0,1 mg/mL sans sulfite, solution injectable en seringue pré-remplie ?
· si vous êtes allergique (hypersensible) à la substance active ou à l’un des autres composants contenus dans ce médicament, mentionnés dans la rubrique 6 lorsqu’il existe une autre présentation d’Adrénaline ou un autre vasopresseur.
Avertissements et précautions
Adressez-vous à votre médecin, pharmacien ou votre infirmier/ère avant d’utiliser ADRENALINE AGUETTANT 0,1 mg/mL sans sulfite, solution injectable en seringue pré-remplie.
ADRENALINE AGUETTANT 0.1 mg/mL sans sulfite, solution injectable en seringue pré-remplie est indiqué pour le traitement d’urgence. Une surveillance médicale en continu est nécessaire après l’administration.
Le risque d’effets indésirables est augmenté dans les cas suivants :
· antécédents médicaux d’hyperthyroïdie (maladie de la glande thyroïde),
· insuffisance rénale grave,
· hypercalcémie (augmentation de la concentration de calcium dans le sang),
· hypokaliémie (diminution de la concentration de potassium dans le sang),
· diabète,
· cardiopathie ou hypertension artérielle,
· lésions cérébrales ou sclérose (durcissement) des artères dans le cerveau,
· glaucome (augmentation de la pression dans l’oeil),
· troubles de la prostate,
· patients âgés,
· grossesse.
Autres médicaments et ADRENALINE AGUETTANT 0,1 mg/mL sans sulfite, solution injectable en seringue pré-remplie
Informez votre médecin si vous utilisez, avez récemment utilisé ou pourriez utiliser tout autre médicament.
Les médicaments susceptibles d’interagir avec ADRENALINE AGUETTANT 0.1 mg/mL sans sulfite, solution injectable en seringue pré-remplie comprennent :
· anesthésiques halogénés volatils (gaz utilisés pendant l’anesthésie),
· certains antidépresseurs,
· médicaments pour traiter l’hypertension artérielle, les affections cardiaques,
· médicaments pour traiter le diabète.
Si vous êtes enceinte ou que vous allaitez, si vous pensez être enceinte ou planifiez une grossesse, demandez conseil à votre médecin ou pharmacien avant de prendre ce médicament.
Conduite de véhicules et utilisation de machines
Utiliser ADRENALINE AGUETTANT 0.1 mg/mL sans sulfite, solution injectable en seringue pré-remplie n’influe pas sur votre aptitude à conduire des véhicules et à utiliser des machines.
ADRENALINE AGUETTANT 0,1 mg/mL sans sulfite, solution injectable en seringue pré-remplie contient du sodium
Ce médicament contient 35,4 mg de sodium (composant principal du sel de cuisine/table) par seringue pré-remplie. Cela équivaut à 1,77% de l’apport alimentaire quotidien maximal recommandé de sodium pour un adulte.
3. COMMENT UTILISER ADRENALINE AGUETTANT 0,1 mg/mL sans sulfite, solution injectable en seringue pré-remplie ?
En cas de réactions allergiques menaçant le pronostic vital (anaphylaxie aiguë) :
Les adultes recevront une dose de 0,05 mg (0,5 mL de solution au 1:10 000 d’adrénaline), répétée si nécessaire jusqu’à l’obtention de la réponse souhaitée.
En cas d’arrêt cardiaque :
Adultes : 1 mg (10 mL de solution au 1:10 000 de d’adrénaline) est administré dans une veine ou dans un os toutes les 3 à 5 minutes jusqu’à ce que le coeur recommence à battre.
Enfants de plus de 5 kg : 10 microgrammes/kg (0,1 mL/kg de solution au 1:10 000 d’adrénaline) sont administrés dans une veine ou dans un os toutes les 3 à 5 minutes jusqu’à ce que le coeur recommence à battre.
Ce médicament n’est pas adapté pour délivrer une dose inférieure à 0.5 mL et il ne devrait par conséquent pas être utilisé chez les nouveaux nés et les enfants de moins de 5 kg.
Si vous avez utilisé plus de ADRENALINE AGUETTANT 0,1 mg/mL sans sulfite, solution injectable en seringue pré-remplie que vous n’auriez dû
Consultez immédiatement votre médecin ou votre pharmacien.
Si vous oubliez d’utiliser ADRENALINE AGUETTANT 0,1 mg/mL sans sulfite, solution injectable en seringue pré-remplie
Si vous arrêtez d’utiliser ADRENALINE AGUETTANT 0,1 mg/mL sans sulfite, solution injectable en seringue pré-remplie
Sans objet.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Les effets indésirables suivants ont été signalés :
· anxiété,
· dyspnée (difficultés à respirer),
· nervosité,
· peur,
· transpiration,
· palpitations (battements cardiaques irréguliers ou accélérés),
· tachycardie (accélération de la fréquence cardiaque),
· pâleur,
· tremblements,
· faiblesse,
· vertiges,
· maux de tête,
· nausées,
· vomissements,
· froideur des extrémités,
· hallucinations,
· syncopes,
· hyperglycémie (taux de sucre élevé dans le sang),
· hypokaliémie (faible taux de potassium dans le sang),
· acidose métabolique (augmentation de l’acidité dans le sang),
· mydriase (dilatation de la pupille).
À doses élevées ou chez les patients sensibles à l’adrénaline, les effets indésirables sont :
· arythmie cardiaque (battements cardiaques irréguliers/arrêt cardiaque),
· hypertension (avec risque d’hémorragie cérébrale),
· vasoconstriction (rétrécissement des vaisseaux sanguins, cutanés par exemple, au niveau des extrémités ou des reins),
· accès d’angine aigu,
· risque d’infarctus aigu du myocarde.
Des injections locales répétées peuvent produire une nécrose (lésions des tissus) au niveau des sites d’injection résultant d’une constriction vasculaire (constriction des vaisseaux sanguins).
Dans tous les cas, après administration d’ADRENALINE AGUETTANT 0.1 mg/mL sans sulfite, solution injectable en seringue pré-remplie, une surveillance médicale est nécessaire.
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin, votre pharmacien ou à votre infirmier/ère. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet: https://signalement.social-sante.gouv.fr/.
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER ADRENALINE AGUETTANT 0,1 mg/mL sans sulfite, solution injectable en seringue pré-remplie ?
Tenir ce médicament hors de la vue et de la portée des enfants.
N’utilisez pas ce médicament après la date de péremption indiquée sur l’étiquette après EXP. La date de péremption fait référence au dernier jour de ce mois.
À conserver dans le sachet en aluminium à l’abri de la lumière et de l’oxygène.
À conserver à une température ne dépassant pas 25°C.Après l’ouverture du sachet, le produit doit être utilisé immédiatement.
Ne pas congeler.
Ne pas ouvrir le sachet en aluminium jusqu’à son utilisation.
Ne pas utiliser d’instruments tranchants pour ouvrir le sachet.
N’utilisez pas ce médicament si vous remarquez des signes visibles de détérioration.
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
· La substance active est : l’adrénaline tartrate
Chaque millilitre de solution injectable contient 0,1 mg d’adrénaline (sous forme d’adrénaline tartrate).
Chaque seringue pré-remplie de 10 mL contient 1 mg d’adrénaline (sous forme d’adrénaline tartrate).
· Les autres composants sont :
Le chlorure de sodium, l’acide chlorhydrique, l’hydroxyde de sodium et l’eau pour préparations injectables.
ADRENALINE AGUETTANT 0.1 mg/mL sans sulfite, solution injectable en seringue pré-remplie est une solution limpide et incolore dans une seringue préremplie de 10 mL en polypropylène, conditionnée individuellement dans un blister transparent et suremballée dans un sachet en aluminium.
Les seringues préremplies sont disponibles en boîtes de 1 et 10 seringues.
Toutes les présentations peuvent ne pas être commercialisées.
Titulaire de l’autorisation de mise sur le marché
1, RUE ALEXANDER FLEMING
69007 LYON
Exploitant de l’autorisation de mise sur le marché
1, RUE ALEXANDER FLEMING
69007 LYON
1, RUE ALEXANDER FLEMING
69007 LYON
OU
LABORATOIRE AGUETTANT
LIEU DIT CHANTECAILLE
07340 CHAMPAGNE
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Ce médicament est autorisé dans les Etats membres de l'Espace Economique Européen sous les noms suivants : Conformément à la réglementation en vigueur.
[À compléter ultérieurement par le titulaire]
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
{mois AAAA}.
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).
Les informations suivantes sont destinées exclusivement aux professionnels de santé:
L’adrénaline intraveineuse est réservée aux professionnels de santé expérimentés dans l’administration et la titration des vasopresseurs dans le cadre de leur pratique clinique ordinaire.
Réanimation cardio-pulmonaire :
Administration de 10 mL de solution d’adrénaline au 1:10 000 (1 mg), par voie intraveineuse ou intra-osseuse, répétée toutes les 3 à 5 minutes jusqu’au rétablissement de la circulation spontanée.
La voie endotrachéale ne doit être utilisée qu’en dernier ressort, si aucune autre voie d’administration n’est accessible, à une dose de 20 à 25 mL de solution au 1:10 000 (soit l’équivalent de 2 à 2,5 mg).
En cas d’arrêt cardiaque suivant une intervention de chirurgie cardiaque, l’adrénaline est administrée par voie intraveineuse à des doses de 0,5 mL ou 1 mL de solution au 1:10 000 (50 ou 100 microgrammes), avec beaucoup de prudence et en dosant jusqu’à obtention de l’effet souhaité.
Anaphylaxie aiguë :
Titrer l’adrénaline intraveineuse en administrant des bolus de 0,5 mL de solution au 1:10 000 (0,05 mg) selon la réponse.
ADRENALINE AGUETTANT 0.1 mg/mL sans sulfite solution injectable en seringue pré-remplie, n’est pas recommandé pour une utilisation par voie intramusculaire dans les cas d’anaphylaxie aiguë. Pour une administration intramusculaire, une solution à 1 mg/mL (1:1000) doit être utilisée.
Population pédiatrique :
Ce médicament n’est pas adapté pour délivrer une dose inférieure à 0.5 mL et ne doit par conséquent pas être utilisé par voie intraveineuse ou intra-osseuse chez les nouveaux nés et les enfants de moins de 5 kg.
Arrêt cardiaque chez l’enfant :
Voie intraveineuse ou intra-osseuse (au-dessus de 5 kgs de poids corporel uniquement) : 0,1 mL/kg de solution d’adrénaline au 1:10 000 (10 microgrammes/kg) jusqu’ à une dose unique maximale de 10 mL de solution au 1:10 000 (soit l’équivalent de 1 mg), répétée toutes les 3 à 5 minutes jusqu’au rétablissement de la circulation spontanée.
La voie endotrachéale ne doit être utilisée, quel que soit le poids, qu’en dernier ressort, si aucune autre voie d’administration n’est accessible, à une dose de 1 mL/kg de solution au 1:10 000 (100 microgrammes/kg) jusqu’à un maximum de 25 mL de solution au 1:10 000, soit l’équivalent de 2,5 mg).
Respecter scrupuleusement le protocole ci-dessous :
La seringue pré-remplie est à utiliser chez un seul patient. Jetez la seringue après usage. Ne pas réutiliser.
Inspectez visuellement le produit avant l’administration pour déceler la présence de particules ou d’une coloration anormale. Seule une solution limpide et incolore dépourvue de particules ou de précipités doit être utilisée.
Ne pas utiliser le produit si le sachet ou le blister ont été ouverts ou si la bande d’inviolabilité sur la seringue (film plastique à la base du capuchon) est rompue.
1) Déchirez le sachet en aluminium à la main uniquement le long des encoches préformées.
Ne pas utiliser d’instruments tranchants pour ouvrir le sachet.
2) Retirez la seringue pré-remplie du blister stérile.