Dernière mise à jour le 08/01/2026
PRIORIX, poudre et solvant pour solution injectable en seringue préremplie. Vaccin rougeoleux, des oreillons et rubéoleux vivant
Indications thérapeutiques
Classe pharmacothérapeutique - code ATC :
Sans objet.
Comment agit Priorix
Lorsqu’une personne est vaccinée par Priorix, le système immunitaire (le système de défense naturelle de l’organisme) fabrique des anticorps protégeant la personne vaccinée contre les infections par les virus de la rougeole, des oreillons et de la rubéole.
Bien que Priorix contienne des virus vivants, ceux-ci sont trop faibles pour provoquer la rougeole, les oreillons ou la rubéole chez les personnes en bonne santé.
Composition en substances actives
-
Poudre ( Composition pour une dose de 0,5 ml de solution reconstitué )
- > virus de la rougeole, souche Schwartz, vivant, atténué au minimum 10^3,0 DICC50
- > virus des oreillons (souche RIT 4385 derivée de la souche Jeryl Lynn) attenué au minimum 10^3,7 DICC50
- > virus rubéoleux (souche Wistar RA 27/3) atténué au minimum 10^3,0 DICC50
-
Solvant ( Composition )
- > Pas de substance active.
Présentations
> 1 flacon(s) en verre de 1 dose(s) - 1 seringue(s) préremplie(s) en verre de 0,5 ml avec 2 aiguille(s)
Code CIP : 351 373-4 ou 34009 351 373 4 0
Déclaration de commercialisation : 13/10/1999
Cette présentation est agréée aux collectivités
- Prix hors honoraire de dispensation : 12,89 €
- Honoraire de dispensation : 1,02 €
- Prix honoraire compris : 13,91 €
- Taux de remboursement :65%
- Vaccination des personnes nées depuis 1980
- Vaccination des femmes nées avant 1980 non vaccinées contre la rubéole
- Vaccination des personnes nées avant 1980 en situation de cas groupés de rougeole, sans antécédent connu de rougeole ; JOURNAL OFFICIEL ; 11/07/12
Documents de bon usage du médicament
- Actualisation des recommandations et obligations vaccinales des professionnels (Volet 2/2 : coqueluche, grippe saisonnière, hépatite A, rougeole, oreillons, rubéole varicelle)
Auteur : Haute autorité de santé
Type : Recommandation vaccinale
Date de mise à jour :Juillet 2023
Service médical rendu (SMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprès de la HAS (plus d'informations dans l'aide). Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Important | Avis du 13/04/2018 | Renouvellement d'inscription (CT) | le service médical rendu par PRIORIX reste important dans l’indication de l’AMM, dans les populations recommandées dans le calendrier vaccinal en vigueur . |
Amélioration du service médical rendu (ASMR)
Pas d'ASMR disponible pour ce médicament (plus d'informations dans l'aide )
ANSM - Mis à jour le : 03/10/2025
Priorix, poudre et solvant pour solution injectable en seringue préremplie
Vaccin rougeoleux, des oreillons et rubéoleux vivant
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Après reconstitution, 1 dose (0,5 ml) contient :
Virus de la rougeole vivant atténué1 (souche Schwarz) ................................ au minimum 103,0 DICC503
Virus des oreillons vivant atténué1 (souche RIT 4385 dérivée
de la souche Jeryl Lynn)........................................................................... au minimum 103,7 DICC503
Virus de la rubéole vivant atténué2 (souche Wistar RA 27/3)......................... au minimum 103,0 DICC503
1produit sur cellules d'embryon de poulet.
2produit sur cellules diploïdes humaines (MRC-5).
3Dose Infectant 50 % des Cultures Cellulaires
Ce vaccin contient des traces de néomycine. Voir rubrique 4.3.
Excipients à effet notoire :
Ce vaccin contient 9 mg de sorbitol.
Ce vaccin contient 6,5 nanogrammes d'acide para-aminobenzoïque par dose et 334 microgrammes de phénylalanine par dose (voir rubrique 4.4).
Pour la liste complète des excipients, voir rubrique 6.1.
Poudre et solvant pour solution injectable en seringue préremplie.
Avant reconstitution, la poudre est blanchâtre à légèrement rose, dont une partie peut être jaunâtre à légèrement orange.
Le solvant est une solution limpide et incolore.
4.1. Indications thérapeutiques
Pour l’utilisation chez les enfants âgés de 9 à 12 mois, voir rubriques 4.2, 4.4 et 5.1.
4.2. Posologie et mode d'administration
L’utilisation de Priorix doit se baser sur les recommandations officielles.
Sujets âgés de 12 mois et plus
La dose est de 0,5 ml. Une seconde dose doit être administrée selon les recommandations officielles.
Priorix peut être utilisé chez les sujets ayant précédemment été vaccinés avec un autre vaccin monovalent ou combiné contre la rougeole, les oreillons et la rubéole.
Nourrissons âgés de 9 à 12 mois
Les nourrissons dans leur première année de vie peuvent ne pas répondre suffisamment aux composants des vaccins. Dans le cas d’une situation épidémiologique nécessitant la vaccination de nourrissons dans leur première année de vie (par exemple en cas d’épidémie ou de voyage en zone d’endémie), une seconde dose de Priorix doit être administrée dans la deuxième année de vie, de préférence dans les 3 mois suivant la première dose. En aucun cas l’intervalle entre les deux doses ne doit être inférieur à 4 semaines (voir rubrique 4.4 et 5.1).
Nourrissons âgés de moins de 9 mois
La sécurité et l’efficacité de Priorix chez les nourrissons âgés de moins de 9 mois n’ont pas été établies.
Mode d’administration
Priorix est destiné à l’injection par voie sous-cutanée, l’injection par voie intramusculaire est également possible, dans la région deltoïde ou dans la partie antérolatérale de la cuisse (voir rubriques 4.4 et 5.1).
Le vaccin doit être administré de préférence par voie sous-cutanée chez les patients présentant une thrombocytopénie ou un trouble de la coagulation (voir rubrique 4.4).
Pour les instructions concernant la reconstitution du médicament avant administration, voir rubrique 6.6.
Traitement immunosuppresseur en cours ou récent (y compris de fortes doses de corticostéroïdes). Priorix n'est pas contre-indiqué chez les sujets recevant des corticostéroïdes par voie locale ou par voie parentérale à faible dose (par exemple, pour la prophylaxie de l’asthme ou en traitement substitutif) (voir rubrique 4.4).
Déficit sévère de l'immunité humorale ou cellulaire (primaire ou acquis), par exemple déficit immunitaire combiné sévère, agammaglobulinémie et SIDA ou infection symptomatique due au VIH ou avec un taux âge-dépendant de lymphocytes T CD4+ chez les enfants de moins de 12 mois : CD4+ < 25 % ; enfants de 12 à 35 mois : CD4+ < 20 % ; enfants de 36 à 59 mois : CD4+ < 15 % (voir rubrique 4.4).
Grossesse. De plus, une grossesse doit être évitée dans le mois suivant la vaccination (voir rubrique 4.6).
Comme pour les autres vaccins, l’administration de Priorix doit être différée chez les sujets atteints de maladies fébriles sévères aiguës. Une infection bénigne, tel qu’un rhume, ne devrait pas entraîner de report de la vaccination.
4.4. Mises en garde spéciales et précautions d'emploi
Afin d'améliorer la traçabilité des médicaments biologiques, le nom et le numéro de lot du produit administré doivent être clairement enregistrés.
Comme pour tout vaccin injectable, il est recommandé de toujours effectuer une surveillance et de disposer d’un traitement médical approprié pour le cas rare où surviendrait une réaction anaphylactique suivant l’administration du vaccin.
Attendre l’évaporation de l’alcool ou d’autres agents désinfectants appliqués sur la peau avant toute injection du vaccin, car ils peuvent inactiver les virus atténués du vaccin.
Les enfants dans leur première année de vie peuvent ne pas répondre de façon satisfaisante aux composants du vaccin en raison de la possible interférence avec des anticorps maternels (voir rubriques 4.2 et 5.1).
Priorix doit être administré avec prudence chez les personnes ayant un trouble du Système Nerveux Central (SNC), une prédisposition aux convulsions fébriles ou des antécédents familiaux de convulsions. Les sujets vaccinés ayant des antécédents de convulsions fébriles doivent faire l’objet d’une surveillance étroite.
Les valences rougeole et oreillons du vaccin sont produites sur culture cellulaire d’embryon de poulet et peuvent donc contenir des traces de protéines d’œuf. Les sujets ayant des antécédents de réactions anaphylactiques, anaphylactoïdes ou autres réactions immédiates (par exemple urticaire généralisée, gonflement de la bouche et de la gorge, difficultés respiratoires, hypotension ou choc) suite à l’ingestion d’œufs peuvent être plus à risque de développer une réaction d’hypersensibilité immédiate suite à la vaccination, bien que ces types de réactions ne soient observés que très rarement. Les sujets ayant présenté une réaction anaphylactique suite à l’ingestion d’œufs doivent être vaccinés avec une extrême prudence, avec un traitement approprié à disposition pour le cas où surviendrait une réaction anaphylactique.
Une protection limitée contre la rougeole peut être obtenue par la vaccination jusqu’à 72 heures après une exposition naturelle au virus de la rougeole.
Une syncope (évanouissement) peut survenir après toute vaccination, voire même avant, en particulier chez les adolescents, comme réaction psychogène à l’injection avec une aiguille. Ceci peut s’accompagner de plusieurs signes neurologiques comme un trouble transitoire de la vision, des paresthésies et des mouvements tonico-cloniques des membres durant la phase de récupération. Il est important que des mesures soient mises en place afin d’éviter des blessures en cas d’évanouissement.
Comme pour tout vaccin, une réponse immunitaire protectrice peut ne pas être obtenue chez tous les sujets vaccinés.
PRIORIX NE DOIT EN AUCUN CAS ETRE ADMINISTRE PAR VOIE INTRAVASCULAIRE.
Thrombocytopénie
Des cas d’aggravation de thrombocytopénie et de récidive de thrombocytopénie chez des sujets ayant présenté une thrombocytopénie après la première dose ont été rapportés après une vaccination par des vaccins vivants rougeoleux, des oreillons et rubéoleux. La thrombocytopénie associée à la vaccination contre la rougeole, les oreillons et la rubéole est rare et généralement spontanément résolutive. Chez les patients présentant une thrombocytopénie ou ayant un antécédent de thrombocytopénie après une vaccination contre la rougeole, les oreillons ou la rubéole, le rapport bénéfice-risque de l’administration de Priorix doit être soigneusement évalué. Ces patients doivent être vaccinés avec précaution et de préférence par voie sous-cutanée.
Patients immunodéprimés
La vaccination peut être envisagée chez les patients présentant certains déficits immunitaires chez qui les bénéfices attendus sont supérieurs aux risques (par exemple sujets infectés par le VIH asymptomatiques, déficits en sous-classe d'IgG, neutropénie congénitale, maladie granulomateuse chronique, déficits en complément).
Les patients immunodéprimés ne présentant pas de contre-indication à cette vaccination (voir rubrique 4.3) peuvent ne pas répondre aussi bien que les sujets immunocompétents, par conséquent, certains de ces patients peuvent contracter la rougeole, les oreillons ou la rubéole en cas de contact, malgré l’administration appropriée du vaccin. Ces patients doivent être attentivement surveillés, afin de détecter tout signe de rougeole, oreillons et rubéole.
En raison du risque potentiel de diminution de la réponse vaccinale et/ou de maladies disséminées, il convient de prendre en compte l'intervalle de temps entre la vaccination par Priorix et le traitement immunosuppresseur (voir rubrique 4.3).
Transmission
La transmission du virus de la rougeole et des oreillons par des sujets vaccinés à des sujets contacts non immunisés n’a jamais été documentée. L’excrétion pharyngée des virus de la rubéole et de la rougeole est connue pour apparaître en général entre le 7ème et le 28ème jour après la vaccination, avec un pic d’excrétion autour du 11ème jour. Cependant, il n’y a aucune preuve de la transmission des virus vaccinaux excrétés à des sujets contacts non immunisés. La transmission du virus vaccinal de la rubéole aux nourrissons par le lait maternel ou par voie transplacentaire a été documentée sans signe clinique apparent.
Excipients à effet notoire
Priorix contient de l'acide para-aminobenzoïque. Cela peut provoquer des réactions allergiques (éventuellement retardées), et exceptionnellement, des bronchospasmes.
Ce vaccin contient 334 microgrammes de phénylalanine par dose. La phénylalanine peut être dangereuse pour les personnes atteintes de phénylcétonurie (PCU).
Ce vaccin contient moins de 1 mmol (23 mg) de sodium par dose, c'est-à-dire qu'il est essentiellement « sans sodium ».
Ce vaccin contient moins de 1 mmol (39 mg) de potassium par dose, c'est-à-dire qu’il est essentiellement « sans potassium ».
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Des études cliniques ont démontré que Priorix peut être administré simultanément avec l’un des vaccins monovalents ou combinés suivants [incluant les vaccins hexavalents (DTCa-HepB-IPV/Hib)] : vaccin diphtérie-tétanos-coqueluche acellulaire (DTCa), vaccin diphtérie-tétanos-coqueluche acellulaire à teneur réduite en antigènes (dTpa), vaccin Haemophilus influenzae type b (Hib), vaccin poliomyélitique inactivé (IPV), vaccin hépatite B (HepB), vaccin hépatite A (HepA), vaccin méningococcique du groupe B (MenB), vaccin conjugué méningococcique du groupe C (MenC), vaccin conjugué méningococcique des groupes A, C, W-135 et Y (MenACWY), vaccin contre la varicelle (VZV), vaccin poliomyélitique oral (OPV) et vaccin conjugué pneumococcique, selon les recommandations officielles.
En raison d’un risque accru de fièvre, de sensibilité au site d’injection, de changements des habitudes alimentaires et d’irritabilité lors de l’administration concomitante de Bexsero avec un vaccin combiné contre la rougeole-oreillons-rubéole-varicelle (MMR-V), une vaccination séparée avec Priorix peut être envisagée lorsque cela est possible.
Il n’existe pas de données concernant l’administration de Priorix avec tout autre vaccin.
Si Priorix est administré en même temps qu’un autre vaccin injectable, les vaccins doivent toujours être administrés en des sites d’injections différents
Si l’administration n’est pas simultanée, un intervalle d’au moins un mois est recommandé entre l’administration de Priorix et d’autres vaccins vivants atténués.
Si un test tuberculinique doit être fait, il est préférable de l’effectuer avant ou en même temps que la vaccination, car il a été rapporté que les vaccins rougeoleux, des oreillons et rubéoleux peuvent entraîner une diminution temporaire de la sensibilité tuberculinique de la peau. Etant donné que cette anergie peut durer au maximum jusqu’à 6 semaines, le test tuberculinique ne doit pas être fait pendant cette période post-vaccinale, afin d’éviter les résultats faussement négatifs.
Chez les patients ayant reçu des gammaglobulines humaines ou une transfusion sanguine, la vaccination devra être différée de 3 mois ou plus (jusqu’à 11 mois) selon la dose d’immunoglobulines humaines administrée, en raison du risque d’échec vaccinal du aux anticorps dirigés contre la rougeole, les oreillons et la rubéole acquis de façon passive.
4.6. Fertilité, grossesse et allaitement
Grossesse
Les femmes enceintes ne doivent pas être vaccinées avec Priorix.
Aucune étude n'a été conduite avec Priorix chez la femme enceinte.
Dans une revue portant sur plus de 3 500 femmes qui étaient sans le savoir, en début de grossesse lors de l'administration d’un vaccin contre la rubéole, aucun cas de syndrome de rubéole congénitale n’a été signalé. La surveillance après mise sur le marché a identifié un cas de syndrome de rubéole congénitale associé à une souche vaccinale contre la rubéole (Wistar RA 27/3), à la suite de la vaccination par inadvertance d’une femme enceinte avec un vaccin contre la rougeole, les oreillons et la rubéole.
Aucun effet délétère sur le fœtus n’a été documenté après l’administration de vaccins contre la rougeole ou les oreillons chez la femme enceinte.
Toute grossesse doit être évitée dans le mois suivant la vaccination. Il convient de conseiller aux femmes ayant l’intention de débuter une grossesse de différer leur projet.
Allaitement
Il existe des données limitées sur Priorix durant l’allaitement. Des études ont montré que des femmes allaitant en post-partum et vaccinées avec des vaccins vivants atténués contre la rubéole peuvent excréter le virus dans le lait maternel et le transmettre à l’enfant allaité sans symptôme clinique apparent. Seulement dans le cas où il est confirmé ou suspecté que l’enfant est immunodéficient, le rapport bénéfice-risque de la vaccination de la mère doit être évalué (voir rubrique 4.3).
Fertilité
Priorix n’a pas été évalué dans des études sur la fertilité.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Résumé du profil de tolérance
Le profil de tolérance décrit ci-dessous est basé sur un total d'environ 12 000 sujets vaccinés par Priorix durant les essais cliniques.
Les effets indésirables pouvant survenir suite à l’utilisation du vaccin combiné rougeoleux, des oreillons et rubéoleux correspondent à ceux observés après l’administration des vaccins monovalents seuls ou en association.
Dans des essais cliniques contrôlés, les signes et symptômes étaient surveillés activement sur une période de suivi de 42 jours. Il a également été demandé aux sujets vaccinés de rapporter tout événement clinique durant la période d’étude.
Les effets indésirables les plus fréquents après l’administration de Priorix étaient des rougeurs au site d’injection et de la fièvre ≥ 38 °C (rectale) ou ≥ 37,5 °C (axillaire/orale).
Liste tabulée des effets indésirables
Les effets indésirables rapportés sont listés selon les fréquences suivantes :
Très fréquent (≥ 1/10)
Fréquent (≥ 1/100 à <1/10)
Peu fréquent (≥ 1/1 000 à <1/100)
Rare (1/10 000 à <1/1 000)
Données des essais cliniques
|
Classes de systèmes d’organes |
Fréquence |
Effets indésirables |
|
Infections et infestations |
Fréquent |
infection des voies respiratoires supérieures |
|
Peu fréquent |
otite moyenne |
|
|
Affections hématologiques et du système lymphatique |
Peu fréquent |
lymphadénopathies |
|
Affections du système immunitaire |
Rare |
réactions allergiques |
|
Troubles du métabolisme et de la nutrition |
Peu fréquent |
anorexie |
|
Affections psychiatriques |
Peu fréquent |
nervosité, pleurs anormaux, insomnie |
|
Affections du système nerveux |
Rare |
Convulsions fébriles |
|
Affections oculaires |
Peu fréquent |
conjonctivite |
|
Affections respiratoires, thoraciques et médiastinales |
Peu fréquent |
bronchite, toux |
|
Affections gastro-intestinales |
Peu fréquent |
parotidite, diarrhée, vomissements |
|
Affections de la peau et du tissu sous-cutané |
Fréquent |
éruption cutanée |
|
Troubles généraux et anomalies au site d'administration
|
Très fréquent |
érythème au site d’injection, fièvre ³ 38 °C (rectale) ou ≥ 37,5 °C (axillaire/orale) |
|
Fréquent |
douleur et gonflement au site d’injection, fièvre > 39,5 °C (rectale) ou > 39 °C (axillaire/orale) |
En général, la fréquence des effets indésirables était identique pour la première et la seconde dose de vaccin, à l’exception de la douleur au site d’injection qui était « fréquente » après la première dose de vaccin et « très fréquente » après la seconde dose de vaccin.
Données post-commercialisation
Les effets indésirables suivants ont été identifiés dans de rares occasions pendant la surveillance post-commercialisation. Parce qu’ils ont été rapportés de manière volontaire à partir d’une population de taille inconnue, une estimation exacte de leur fréquence ne peut être donnée.
|
Classes de systèmes d’organes |
Effets indésirables |
|
Infections et infestations |
Méningite, syndrome morbilliforme, syndrome de type oreillon (incluant orchite, épididymite et parotidite) |
|
Affections hématologiques et du système lymphatique |
Thrombocytopénie, purpura thrombocytopénique |
|
Affections du système immunitaire |
Réactions anaphylactiques |
|
Affections du système nerveux |
Encéphalite*, cérébellite, syndrome cérébelleux (incluant une perturbation transitoire de la marche et une ataxie transitoire), syndrome de Guillain-Barré, myélite transverse, névrite périphérique |
|
Affections vasculaires |
Vascularite |
|
Affections de la peau et du tissu sous-cutané |
Erythème polymorphe |
|
Affections musculo-squelettiques et systémiques |
Arthralgie, arthrite |
*Des cas d’encéphalite ont été rapportés avec une fréquence inférieure à 1 sur 10 millions de doses. Le risque d’encéphalite suite à l’administration du vaccin est bien inférieur au risque d’encéphalite causé par les infections naturelles (rougeole : 1 sur 1 000 à 2 000 cas ; oreillons : 2-4 sur 1 000 cas ; rubéole : environ 1 sur 6 000 cas).
Une administration intravasculaire accidentelle peut conduire à des réactions graves voire même un choc. Les mesures immédiates dépendent de la gravité de la réaction (voir rubrique 4.4).
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Classe pharmacothérapeutique : vaccin viral, code ATC : J07BD52
Réponse immunitaire chez les enfants de 12 mois et plus
Dans des études cliniques réalisées chez des enfants âgés de 12 mois à 2 ans, Priorix a montré une immunogénicité élevée.
La vaccination par une seule dose de Priorix induit la production d’anticorps contre la rougeole, les oreillons et la rubéole chez respectivement 98,1 %, 94,4 % et 100 % des sujets initialement séronégatifs.
Deux ans après la primo-vaccination, les taux de séroconversion étaient de 93,4 % pour la rougeole, 94,4 % pour les oreillons et 100 % pour la rubéole.
Bien qu’aucune donnée ne soit disponible concernant l’efficacité protectrice de Priorix, l’immunogénicité est considérée comme une indication de l’efficacité protectrice. Cependant, certaines études de terrain ont rapporté que l’efficacité protectrice contre les oreillons pouvait être inférieure aux taux de séroconversion observés pour cette maladie.
Réponse immunitaire chez les nourrissons âgés de 9 à 10 mois
Un essai clinique a été mené sur 300 nourrissons en bonne santé âgés de 9 à 10 mois au moment de la première dose de vaccin. Parmi eux, 147 ont reçu Priorix et Varilrix simultanément. Les taux de séroconversion pour la rougeole, les oreillons et la rubéole étaient respectivement de 92,6 %, 91,5 % et 100 %. Les taux de séroconversion rapportés après la seconde dose de vaccination administrée 3 mois après la première dose étaient de 100 % pour la rougeole de 99,2 % pour les oreillons et de 100 % pour la rubéole. Il apparaît donc qu’une seconde dose de Priorix doit être administrée dans les 3 mois suivant la première dose afin d’obtenir des réponses immunitaires optimales.
Adolescents et adultes
La sécurité et l’immunogénicité de Priorix chez les adolescents et les adultes n’ont pas été spécifiquement étudiées au cours des essais cliniques.
Administration par voie intramusculaire
Un nombre limité de sujets a reçu Priorix par voie intramusculaire au cours des essais cliniques. Les taux de séroconversion pour les 3 valences du vaccin ont été comparables à ceux obtenus après une administration sous-cutanée.
5.2. Propriétés pharmacocinétiques
Les études de pharmacocinétique ne sont pas nécessaires pour les vaccins.
5.3. Données de sécurité préclinique
Acides aminés (contenant de la phénylalanine)
Lactose (anhydre)
Mannitol (E 421)
Sorbitol (E 420)
Milieu 199 (contenant de la phénylalanine, de l'acide para-aminobenzoïque, du sodium et du potassium)
Solvant :
Eau pour préparations injectables.
2 ans.
Le vaccin doit être injecté immédiatement après reconstitution. Si cela n’est pas possible, il doit être conservé entre 2 °C et 8 °C et utilisé dans les 8 heures suivant la reconstitution.
6.4. Précautions particulières de conservation
A conserver et transporter réfrigéré (entre 2 °C et 8 °C).
Ne pas congeler.
A conserver dans l’emballage d’origine à l’abri de la lumière.
Pour les conditions de conservation du médicament après reconstitution, voir la rubrique 6.3.
6.5. Nature et contenu de l'emballage extérieur
Poudre en flacon (verre de type I) muni d’un bouchon en caoutchouc.
0,5 ml de solution en seringue préremplie (verre de type I) munie d’un bouchon-piston en caoutchouc avec ou sans aiguilles dans les boîtes suivantes :
· avec 2 aiguilles séparées : boîtes de 1 ou 10.
· sans aiguille : boîtes de 1 ou 10.
Toutes les présentations peuvent ne pas être commercialisées.
6.6. Précautions particulières d’élimination et de manipulation
Le solvant et le vaccin reconstitué doivent être inspectés visuellement pour mettre en évidence la présence de particules étrangères et/ou tout changement de l’aspect physique avant reconstitution ou administration. Dans l’un et/ou l’autre de ces cas, n’utilisez pas le solvant ou le vaccin reconstitué.
Le vaccin doit être reconstitué en ajoutant la totalité du contenu en solvant de la seringue préremplie au flacon contenant la poudre.
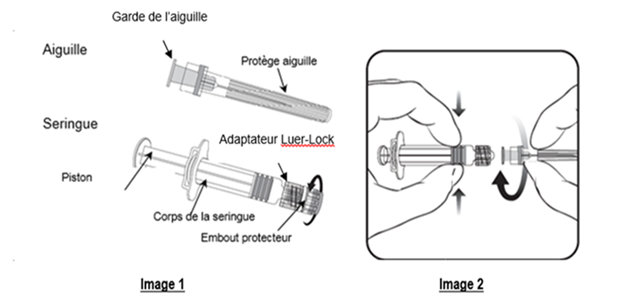
Pour fixer l’aiguille à la seringue, lire attentivement les instructions illustrées par les images 1 et 2. Cependant, la seringue fournie avec Priorix peut être légèrement différente (sans filetage) de la seringue de l’illustration.
Dans ce cas, l’aiguille doit être attachée sans visser.
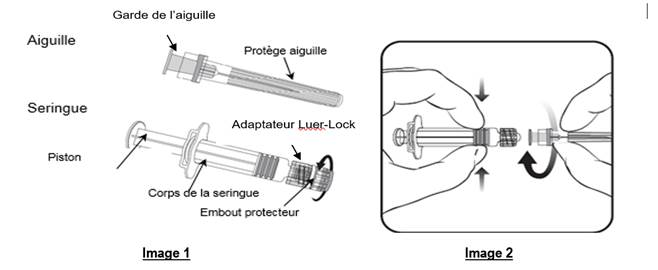
Toujours tenir la seringue par le corps, et non par le piston ou l’adaptateur Luer-Lock (LLA), et maintenir l’aiguille dans l’axe de la seringue (comme illustré dans l’image 2). Si vous ne respectez pas ces consignes, le LLA risque de se déformer et d’occasionner une fuite.
Lors de l’assemblage de la seringue, si le LLA se détache, une nouvelle dose de vaccin (nouvelle seringue et nouveau flacon) doit être utilisée.
1. Dévisser l’embout protecteur de la seringue en le tournant dans le sens inverse des aiguilles d’une montre (comme illustré dans l’image 1).
Veuillez suivre les étapes ci-dessous, que le LLA tourne ou pas autour de l’axe de la seringue :
2. Fixer l’aiguille sur la seringue en connectant doucement la garde de l’aiguille sur le LLA et tourner d’un quart de tour dans le sens des aiguilles d’une montre jusqu’à sentir un blocage (comme illustré dans l’image 2).
3. Retirer le protège aiguille, ce qui peut être difficile.
4. Ajouter le solvant à la poudre. Le mélange doit être bien agité, jusqu’à ce que la poudre soit complètement dissoute dans le solvant.
En raison de variations mineures de pH, la couleur du vaccin reconstitué peut varier de pêche clair à rose fuchsia sans détérioration de l’activité du vaccin.
5. Prélever la totalité du contenu du flacon.
6. Une nouvelle aiguille doit être utilisée pour administrer le vaccin. Dévisser l’aiguille du corps de la seringue et fixer l’aiguille d’injection en répétant l’étape 2 ci-dessus.
Les contacts avec les désinfectants doivent être évités (voir rubrique 4.4).
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
23, RUE FRANCOIS JACOB
92500 RUEIL-MALMAISON
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 351 369 7 8 : poudre en flacon (verre de type I) muni d’un bouchon + 0,5 ml de solvant en seringue préremplie (verre de type I) munie d’un bouchon-piston sans aiguille - boîte de 1.
· 34009 351 370 5 0 : poudre en flacon (verre de type I) muni d’un bouchon + 0,5 ml de solvant en seringue préremplie (verre de type I) munie d’un bouchon-piston sans aiguille - boîte de 10.
· 34009 351 373 4 0 : poudre en flacon (verre de type I) muni d’un bouchon + 0,5 ml de solvant en seringue préremplie (verre de type I) munie d’un bouchon-piston avec 2 aiguilles - boîte de 1.
· 34009 351 374 0 1 : poudre en flacon (verre de type I) muni d’un bouchon + 0,5 ml de solvant en seringue préremplie (verre de type I) munie d’un bouchon-piston avec 2 aiguilles - boîte de 10.
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[À compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[À compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Liste I
ANSM - Mis à jour le : 03/10/2025
Priorix, poudre et solvant pour solution injectable en seringue préremplie
Vaccin rougeoleux, des oreillons et rubéoleux (vivant)
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin ou votre pharmacien.
· Ce vaccin vous a été personnellement prescrit. Ne le donnez pas à d’autres personnes.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
Cette notice a été écrite en supposant que la personne qui reçoit le vaccin soit celle qui la lit, mais le vaccin peut être administré à des adultes et à des enfants, de sorte que vous pourriez être amené à la lire pour votre enfant.
1. Qu'est-ce que Priorix, poudre et solvant pour solution injectable en seringue préremplie et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant d'utiliser Priorix, poudre et solvant pour solution injectable en seringue préremplie ?
3. Comment utiliser Priorix, poudre et solvant pour solution injectable en seringue préremplie ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver Priorix, poudre et solvant pour solution injectable en seringue préremplie ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE Priorix, poudre et solvant pour solution injectable en seringue préremplie ET DANS QUELS CAS EST-IL UTILISE ?
Classe pharmacothérapeutique - code ATC :
Sans objet.
Comment agit Priorix
Lorsqu’une personne est vaccinée par Priorix, le système immunitaire (le système de défense naturelle de l’organisme) fabrique des anticorps protégeant la personne vaccinée contre les infections par les virus de la rougeole, des oreillons et de la rubéole.
Bien que Priorix contienne des virus vivants, ceux-ci sont trop faibles pour provoquer la rougeole, les oreillons ou la rubéole chez les personnes en bonne santé.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D’UTILISER Priorix, poudre et solvant pour solution injectable en seringue préremplie ?
· Si vous êtes allergique à l’un des composants contenus dans ce vaccin (mentionnés dans la rubrique 6). Les signes d’une réaction allergique peuvent inclure une éruption cutanée avec démangeaisons, un essoufflement et un gonflement du visage ou de la langue,
· Si vous présentez une allergie connue à la néomycine (antibiotique). Une dermatite de contact connue (éruption cutanée lorsque la peau est en contact direct avec des allergènes comme la néomycine) ne doit pas être un problème mais parlez-en d’abord à votre médecin,
· Si vous présentez une infection sévère avec une forte fièvre. Dans ce cas, la vaccination doit être reportée jusqu’à la guérison complète. Une infection bénigne comme un rhume ne doit pas être un problème, mais informez-en d’abord votre médecin,
· Si vous présentez une maladie (comme le virus d'immunodéficience humaine (VIH) ou le syndrome d'immunodéficience acquise (SIDA)) ou avez récemment reçu ou prenez encore des médicaments qui affaiblissent le système immunitaire (excepté les traitements par corticostéroïdes à faibles doses pour l’asthme ou tout traitement de substitution). Votre vaccination dépendra de vos niveaux de défense immunitaire,
· Si vous êtes enceinte. Par ailleurs, une grossesse doit être évitée pendant le mois suivant la vaccination.
Avertissements et précautions
Adressez-vous à votre médecin ou pharmacien avant que vous ne receviez Priorix si :
· vous avez des troubles du système nerveux central, des antécédents de convulsions accompagnées de fièvre ou des antécédents familiaux de convulsions. En cas de forte fièvre après la vaccination, consultez immédiatement votre médecin,
· vous avez déjà eu une réaction allergique sévère aux protéines d’œuf,
· vous avez eu un effet indésirable après une vaccination contre la rougeole, les oreillons ou la rubéole impliquant la formation facile de bleus ou des saignements plus longs que d’habitude (voir rubrique 4),
· vous avez un système immunitaire affaibli (par exemple, une infection par le VIH) ou allez commencer un médicament qui affaiblit le système immunitaire. Vous devez être étroitement surveillé car la réponse vaccinale peut ne pas être suffisante pour assurer une protection contre la maladie (voir rubrique 2 « N’utilisez jamais Priorix »).
Un évanouissement peut survenir (surtout chez les adolescents) après, voire même avant, toute injection avec une aiguille. Aussi parlez-en à votre médecin ou infirmier/ière si vous vous êtes évanoui lors d’une précédente injection.
Si vous avez été vacciné dans les 72 heures après un contact avec une personne infectée par le virus de la rougeole, Priorix pourra vous protéger, dans une certaine mesure, contre la maladie.
Enfants âgés de moins de 12 mois
Les enfants vaccinés dans leur première année de vie peuvent ne pas être complètement protégés. Votre médecin vous informera si des doses supplémentaires de vaccin sont nécessaires.
Comme avec tous les vaccins, Priorix peut ne pas protéger complètement toutes les personnes vaccinées.
Enfants et adolescents
Sans objet.
Autres médicaments et Priorix
Informez votre médecin si vous prenez, avez récemment pris ou pourriez prendre tout autre médicament (ou tout autre vaccin).
Priorix peut vous être administré, en même temps que d’autres vaccins comme le vaccin diphtérie-tétanos-coqueluche acellulaire, le vaccin Haemophilus influenzae type b, le vaccin contre la poliomyélite oral ou inactivé, le vaccin de l’hépatite A, le vaccin de l’hépatite B, le vaccin de la varicelle, le vaccin contre le méningocoque du groupe B et contre le méningocoque du groupe C, le vaccin contre les méningocoques des groupes A, C, W-135 et Y et le vaccin conjugué contre le pneumocoque. Parlez-en avec votre médecin ou votre infirmier/ière pour plus d’informations.
Des sites d’injection différents doivent être utilisés pour chaque vaccin.
Si Priorix n’est pas administré en même temps qu’un autre vaccin vivant atténué, un intervalle d’au moins un mois est recommandé entre les deux vaccins.
Votre médecin peut reporter la vaccination d’au moins trois mois si vous avez reçu une transfusion sanguine ou des anticorps humains (immunoglobulines).
Si un test tuberculinique doit être effectué, il doit être fait soit avant, soit en même temps ou soit 6 semaines après la vaccination par Priorix.
Priorix avec des aliments et boissons
Sans objet.
Grossesse, allaitement et fertilité
Priorix ne doit pas être administré aux femmes enceintes.
Si vous êtes enceinte ou que vous allaitez, si vous pensez être enceinte ou planifiez une grossesse, demandez conseil à votre médecin ou pharmacien avant de prendre ce vaccin. Il est également important de ne pas être enceinte dans le mois suivant la vaccination. Durant cette période, vous devez utiliser un moyen de contraception efficace pour éviter d'être enceinte.
Conduite de véhicules et utilisation de machines
Sans objet.
Priorix contient du sorbitol, de l'acide para-aminobenzoïque, de la phénylalanine, du sodium et du potassium
Ce vaccin contient 9 mg de sorbitol par dose.
Priorix contient de l’acide para-aminobenzoïque. Cela peut provoquer des réactions allergiques (éventuellement retardées), et exceptionnellement, des bronchospasmes.
Ce vaccin contient 334 microgrammes de phénylalanine par dose. La phénylalanine peut être dangereuse pour les personnes atteintes de phénylcétonurie (PCU), une maladie génétique rare caractérisée par l’accumulation de phénylalanine ne pouvant être éliminée correctement.
Ce vaccin contient moins de 1 mmol (23 mg) de sodium par dose, c'est-à-dire qu'il est essentiellement « sans sodium ».
Ce vaccin contient moins de 1 mmol (39 mg) de potassium par dose, c'est-à-dire qu’il est essentiellement « sans potassium ».
3. COMMENT UTILISER Priorix, poudre et solvant pour solution injectable en seringue préremplie ?
Priorix est destiné aux enfants à partir de 9 mois, aux adolescents et aux adultes.
La date de la vaccination et le nombre d’injections qui vous seront administrées seront déterminés par votre médecin sur la base des recommandations officielles.
Le vaccin ne doit jamais être administré dans une veine.
Si vous avez utilisé plus de Priorix que vous n’auriez dû :
Sans objet.
Si vous oubliez d’utiliser Priorix :
Si vous arrêtez d’utiliser Priorix :
Sans objet.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Les événements indésirables survenus durant les essais cliniques sont les suivants :
Très fréquents (effets indésirables pouvant survenir avec plus d’1 dose de vaccin sur 10) :
· rougeur au site d’injection
· fièvre supérieure ou égale à 38 °C
Fréquents (effets indésirables pouvant survenir avec au maximum 1 dose de vaccin sur 10) :
· douleur et gonflement au site d’injection
· fièvre supérieure à 39,5 °C
· éruption cutanée (boutons)
· infection des voies respiratoires supérieures
Peu fréquents (effets indésirables pouvant survenir avec au maximum 1 dose de vaccin sur 100) :
· infection de l’oreille moyenne
· augmentation de la taille des ganglions (au niveau du cou, des aisselles ou de l’aine)
· perte d’appétit
· nervosité
· pleurs anormaux
· difficulté à dormir (insomnie)
· rougeur, irritation et larmoiement des yeux (conjonctivite)
· bronchite
· toux
· gonflement des glandes parotides (glandes au niveau des joues)
· diarrhées
· vomissements
Rares (effets indésirables pouvant survenir avec au maximum 1 dose de vaccin sur 1 000) :
· convulsions accompagnées d’une forte fièvre
· réactions allergiques
Après commercialisation de Priorix, les effets indésirables suivants ont été rapportés dans de rares occasions :
· douleur des articulations et des muscles,
· petits points de saignements ou formation de bleus plus facilement que d’habitude dus à un taux anormalement bas des plaquettes,
· réaction allergique mettant en jeu le pronostic vital,
· infection ou inflammation du cerveau, de la moelle épinière et des nerfs périphériques provoquant une difficulté temporaire de la marche (instabilité) et/ou une perte temporaire du contrôle des mouvements corporels, inflammation de certains nerfs éventuellement accompagnés de fourmillements ou une perte de sensation ou de mouvement normal (syndrome de Guillain-Barré),
· rétrécissement ou blocage des vaisseaux sanguins,
· érythème polymorphe (les symptômes sont des boutons rouges souvent accompagnés de démangeaisons, similaires à ceux d’une éruption cutanée de type rougeole, qui commencent sur les membres puis s’étendent parfois au visage et au reste du corps),
· symptômes de type rougeole et oreillons (incluant un gonflement douloureux et transitoire des testicules et des glandes du cou).
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/.
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER Priorix, poudre et solvant pour solution injectable en seringue préremplie ?
Tenir ce vaccin hors de la vue et de la portée des enfants.
N’utilisez pas ce vaccin après la date de péremption indiquée sur l’emballage après EXP.
A conserver et transporter réfrigéré (entre 2 °C et 8 °C).
Ne pas congeler.
A conserver dans l'emballage d'origine à l'abri de la lumière.
Après reconstitution, le vaccin doit être administré immédiatement. Si cela n’est pas possible, il doit être conservé au réfrigérateur (entre 2 °C et 8 °C) et utilisé dans les 8 heures après reconstitution.
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient Priorix, poudre et solvant pour solution injectable en seringue préremplie
Les substances actives sont : les virus vivants atténués de la rougeole, des oreillons et de la rubéole.
Les autres composants sont :
Poudre : acides aminés (contenant de la phénylalanine), lactose (anhydre), mannitol (E 421), sorbitol (E 420), milieu 199 (contenant de la phénylalanine, de l'acide para-aminobenzoïque, du sodium et du potassium).
Solvant : eau pour préparations injectables
Priorix se présente sous forme de poudre et de solvant pour solution injectable (poudre en flacon pour 1 dose et solvant dans une seringue préremplie (0,5 ml)) avec ou sans aiguilles dans les boîtes suivantes :
· avec 2 aiguilles séparées : boîtes de 1 ou 10.
· sans aiguille : boîtes de 1 ou 10.
Priorix se présente sous la forme d’une poudre blanchâtre à légèrement rose, dont une partie peut être jaunâtre à légèrement orange, et d’un solvant limpide et incolore (eau pour préparations injectables) pour la reconstitution du vaccin.
Toutes les présentations peuvent ne pas être commercialisées.
Titulaire de l’autorisation de mise sur le marché
23, RUE FRANCOIS JACOB
92500 RUEIL-MALMAISON
Exploitant de l’autorisation de mise sur le marché
23, RUE FRANCOIS JACOB
92500 RUEIL-MALMAISON
GLAXOSMITHKLINE BIOLOGICALS S.A.
RUE DE L'INSTITUT, 89
1330 RIXENSART
BELGIQUE
Noms du médicament dans les Etats membres de l'Espace Economique Européen
[À compléter ultérieurement par le titulaire]
La dernière date à laquelle cette notice a été révisée est :
[À compléter ultérieurement par le titulaire]
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).
Les informations suivantes sont destinées exclusivement aux professionnels de santé :
Comme pour tout vaccin injectable, il est recommandé de toujours effectuer une surveillance et de disposer d’un traitement médical approprié pour le cas rare où surviendrait une réaction anaphylactique suivant l’administration du vaccin.
Attendre l’évaporation de l’alcool ou d’autres agents désinfectants appliqués sur la peau avant toute injection, car ils peuvent inactiver les virus atténués du vaccin.
Priorix ne doit en aucun cas être administré par voie intravasculaire.
En l’absence d’étude de compatibilité, ce médicament ne doit pas être mélangé avec d’autres médicaments.
Le solvant et le vaccin reconstitué doivent être inspectés visuellement pour mettre en évidence la présence de particules étrangères et/ou tout changement de l’aspect physique avant reconstitution ou administration. Dans l’un et/ou l’autre cas, n’utilisez pas le solvant ou le vaccin reconstitué.
Le vaccin doit être reconstitué en ajoutant la totalité du contenu en solvant de la seringue préremplie au flacon contenant la poudre.
Pour fixer l’aiguille à la seringue, lire attentivement les instructions illustrées par les images 1 et 2.
Cependant, la seringue fournie avec Priorix peut être légèrement différente (sans filetage) de la seringue de l’illustration.
Dans ce cas, l’aiguille doit être attachée sans visser.
Toujours tenir la seringue par le corps, et non par le piston ou l’adaptateur Luer-Lock (LLA), et maintenir l’aiguille dans l’axe de la seringue (comme illustré dans l’image 2). Si vous ne respectez pas ces consignes, le LLA risque de se déformer et d’occasionner une fuite.
Lors de l’assemblage de la seringue, si le LLA se détache, une nouvelle dose de vaccin (nouvelle seringue et nouveau flacon) doit être utilisée.
1. Dévisser l’embout protecteur de la seringue en le tournant dans le sens inverse des aiguilles d’une montre (comme illustré dans l’image 1).
Veuillez suivre les étapes ci-dessous, que le LLA tourne ou pas autour de l’axe de la seringue :
2. Fixer l’aiguille sur la seringue en connectant doucement la garde de l’aiguille sur le LLA et tourner d’un quart de tour dans le sens des aiguilles d’une montre jusqu’à sentir un blocage (comme illustré dans l’image 2).
3. Retirer le protège aiguille, ce qui peut être difficile.
4. Ajouter le solvant à la poudre. Le mélange doit être bien agité, jusqu’à ce que la poudre soit complètement dissoute dans le solvant.
En raison de variations mineures de pH, la couleur du vaccin reconstitué peut varier de pêche clair à rose fuchsia sans détérioration de l’activité du vaccin.
5. Prélever la totalité du contenu du flacon.
6. Une nouvelle aiguille doit être utilisée pour administrer le vaccin. Dévisser l’aiguille du corps de la seringue et fixer l’aiguille d’injection en répétant l’étape 2 ci-dessus.
Après reconstitution, le vaccin doit être utilisé immédiatement. Si ce n’est pas possible, il doit être conservé au réfrigérateur (entre 2 °C et 8 °C) et utilisé dans les 8 heures après reconstitution.
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.