Dernière mise à jour le 06/11/2025
EPIPEN 0,15 mg/0,3 ml, solution injectable en stylo pré-rempli
Indications thérapeutiques
Classe pharmacothérapeutique : Agents adrénergiques et dopaminergiques - code ATC : C01CA24
EPIPEN est une solution stérile en stylo pré-rempli pour une injection intramusculaire en urgence.
Indications thérapeutiques :
EPIPEN 0,15 mg/0,3 ml, solution injectable en stylo pré-rempli est indiqué dans le traitement d'urgence des réactions allergiques sévères (choc anaphylactique) provoquées par des allergènes comme les aliments, les médicaments, les piqûres ou morsures d'insecte ainsi que par l’exercice physique ou de cause inconnue.
Les auto-injecteurs EPIPEN sont destinés à une administration immédiate chez les patients qui ont un risque élevé de réaction allergique sévère, y compris ceux présentant des antécédents de réactions anaphylactiques.
Les symptômes indiquant le déclenchement d'une réaction anaphylactique incluent : démangeaison cutanée, éruption avec gonflement (type urticaire) ; rougeur de la peau ; gonflement des lèvres, de la gorge, de la langue, des mains et des pieds ; respiration sifflante ; enrouement ; nausées ; vomissements ; crampes abdominales et, dans certains cas, perte de conscience.
Le médicament contenu dans l'auto-injecteur (le stylo) est de l'adrénaline, un médicament adrénergique.
Il agit directement sur le système cardiovasculaire (cœur et circulation sanguine) et le système respiratoire (poumons). Il s’oppose aux effets potentiellement mortels de l'anaphylaxie en entraînant une constriction rapide des vaisseaux sanguins, une relaxation des muscles des poumons pour faciliter la respiration, une réduction de l'œdème et une stimulation des battements du cœur.
Présentations
> 2 cartouches en verre de 0,3 mL dans stylos préremplis
Code CIP : 275 647-5 ou 34009 275 647 5 8
Déclaration de commercialisation : 16/07/2014
Cette présentation est agréée aux collectivités
- Prix hors honoraire de dispensation : 91,32 €
- Honoraire de dispensation : 1,02 €
- Prix honoraire compris : 92,34 €
- Taux de remboursement :65%
Service médical rendu (SMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprès de la HAS (plus d'informations dans l'aide). Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Important | Avis du 03/04/2019 | Renouvellement d'inscription (CT) | Le service médical rendu d’EPIPEN 0,15 mg/0,3 ml et 0,30 mg/0,3 ml reste important dans les indications de l’AMM. |
Amélioration du service médical rendu (ASMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprés de la HAS (plus d'informations dans l'aide). Les avis et synthéses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur de l'ASMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| V (Inexistant) | Avis du 08/01/2014 | Inscription (CT) | Cette spécialité n’apporte pas d’amélioration du service médical rendu (ASMR V, inexistante) par rapport aux spécialités JEXT et ANAPEN. |
ANSM - Mis à jour le : 01/04/2024
EPIPEN 0,15 mg/0,3 ml, solution injectable en stylo pré-rempli
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
1 ml contient 0,5 mg d'adrénaline (épinéphrine). Une dose (0,3 ml) contient 150 microgrammes (0,15 mg) d'adrénaline.
Excipient à effet notoire : 0,5 mg/dose de métabisulfite de sodium (E223), 1,8 mg/dose de chlorure de sodium.
Pour la liste complète des excipients, voir rubrique 6.1.
Solution injectable en stylo pré-rempli (auto-injecteur).
Solution limpide et incolore.
4.1. Indications thérapeutiques
4.2. Posologie et mode d'administration
Population pédiatrique
La dose pédiatrique habituelle selon le poids du patient est de 0,01 mg/kg. Cependant, le médecin peut prescrire des doses supérieures ou inférieures sur la base de l'évaluation minutieuse de chaque patient et la prise en compte de la menace sur le risque vital des réactions pour lesquelles ce traitement est décrit. Le stylo Auto-injecteur d’adrénaline EPIPEN ne peut délivrer une dose inférieure à 150 microgrammes. Le médecin devra envisager d'utiliser d'autres formes d'adrénaline injectable si des doses inférieures sont nécessaires pour de petits enfants.
Enfants et adolescents de plus de 30kg* :
La dose usuelle est de 300 microgrammes en intramusculaire.
* Pour ces patients l’auto-injecteur EPIPEN contenant 300 microgrammes d’adrénaline par dose est disponible.
Enfants entre 15 kg et 30 kg :
La dose usuelle est de 150 microgrammes en intramusculaire.
Enfants de moins de 15 kg :
La pertinence de l’utilisation d’EPIPEN 0,15 mg/ 0,3 ml doit être évaluée au cas par cas.
Chez l’enfant de moins de 7,5 kg l'utilisation n’est pas recommandée sauf en cas de risque vital ou de décision du médecin.
Adultes
La dose usuelle est de 300 microgrammes en intramusculaire.
L’injection initiale doit être effectuée dès l’apparition des symptômes de choc anaphylactique.
En l’absence d’amélioration clinique ou en cas d'aggravation des symptômes, une seconde injection avec un nouvel auto-injecteur EPIPEN peut être nécessaire 5 à 15 minutes après la première injection. Il est recommandé de prescrire 2 stylos d’EPIPEN aux patients qui devront toujours les avoir sur eux.
Le médecin qui prescrit un auto-injecteur EPIPEN 0,15 mg/0,3 ml, solution injectable en stylo pré-rempli doit s’assurer que le patient en a compris parfaitement les indications et le mode d’administration.
Le médecin devra donc informer en détails le patient sur la notice, le mode d’emploi de l’auto-injecteur et les symptômes possibles du choc anaphylactique.
Mode d’administration
Les auto-injecteurs EPIPEN sont destinés à une administration immédiate chez les patients qui ont un risque élevé de réaction allergique sévère, y compris ceux présentant des antécédents de réactions anaphylactiques.
L’administration doit se faire en intramusculaire dans la face antérolatérale de la cuisse, pas dans la fesse. Elle peut être pratiquée au travers des vêtements ou directement au contact de la peau.
Voir rubrique 6.6 Précautions particulières d’élimination et manipulation.
Le patient / soignant doit être informé qu'après chaque utilisation d'EPIPEN :
· Il doit appeler les secours pour demander une assistance médicale immédiate et une ambulance, et indiquer qu'il s'agit d'un choc anaphylactique, même si les symptômes semblent s'améliorer (voir rubrique 4.4).
· S'il est conscient, le patient doit de préférence s'allonger avec les pieds surélevés, ou rester assis s'il présente des difficultés respiratoires. Le patient inconscient doit être allongé sur le côté en position de sécurité.
· Si possible, le patient doit rester sous la surveillance d'une autre personne jusqu'à l'arrivée des secours.
4.4. Mises en garde spéciales et précautions d'emploi
Le patient devra être informé de la nécessité de composer le 15 (pour la France) ou le 112, de demander une ambulance, d’indiquer qu’il a fait un choc anaphylactique afin de bénéficier, immédiatement après l'administration de la première dose, du suivi médical nécessaire comprenant la surveillance de l’épisode anaphylactique et les traitements complémentaires.
Les auto-injecteurs doivent être utilisés dans la face antérolatérale de la cuisse et non dans le muscle fessier.
Si l’injection est exécutée par un personnel soignant, la jambe du patient doit être immobilisée pendant l'injection pour minimiser le risque de lacération, aiguille recourbée ou autres lésions.
Le stylo est à usage unique et en aucun cas il ne doit être réutilisé.
L'adrénaline est habituellement administrée avec une grande prudence aux patients présentant une pathologie cardiaque. L'adrénaline ne doit être prescrite à ces patients, ainsi qu'aux patients atteints de diabète, d'hyperthyroïdie ou d'hypertension et aux patients âgés, que si le bénéfice potentiel justifie le risque potentiel. Chez les patients présentant une pression intraoculaire importante, une insuffisance rénale sévère, un adénome prostatique conduisant à des fuites urinaires, une hypercalcémie et une hypokaliémie, l’administration d’adrénaline peut entraîner un risque d’apparition d’effets indésirables. Chez les patients atteints de la maladie de Parkinson, l'adrénaline peut être associée à une dégradation transitoire des symptômes parkinsoniens comme la rigidité et le tremblement.
Le patient / soignant doit être informé de la possibilité d'un choc anaphylactique biphasique, caractérisé par une résolution initiale suivie d'une récidive des symptômes quelques heures plus tard.
Les patients avec un asthme concomitant peuvent présenter un plus grand risque de réaction anaphylactique sévère.
Une injection accidentelle dans la main ou le pied, entraînant une ischémie périphérique, a été rapportée. Un traitement peut être nécessaire après une injection accidentelle.
Chez les patients présentant une couche graisseuse sous-cutanée épaisse, l’adrénaline risque de ne pas atteindre le tissu musculaire aboutissant à une diminution de l’efficacité (voir rubrique 5.2). Une deuxième injection avec un EPIPEN supplémentaire peut être nécessaire (voir rubrique 4.2).
EPIPEN contient du métabisulfite de sodium et peut rarement provoquer des réactions allergiques sévères telles que des réactions anaphylactiques ou un bronchospasme chez les patients sensibilisés, en particulier chez les patients asthmatiques. Les patients sensibilisés aux sulfites doivent être soigneusement informés des circonstances dans lesquelles EPIPEN doit être utilisé.
Ce médicament contient moins de 1 mmol de sodium (23 mg) par dose, il est donc considéré « sans sodium ».
Les patients doivent être mis en garde à propos des facteurs allergènes liés et doivent être testés dans la mesure du possible afin de déterminer les allergènes spécifiques responsables.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Utiliser avec précaution chez les patients recevant des médicaments pouvant favoriser une arythmie cardiaque, y compris les digitaliques et la quinidine. Les effets de l'adrénaline peuvent être potentialisés par les antidépresseurs tricycliques, les inhibiteurs de la monoamine oxydase (IMAO) et les inhibiteurs de la catéchol-O-méthyl transférase (inhibiteurs COMT), les hormones thyroïdiennes, la théophylline, l’ocytocine, les agents parasympatholytiques, certains antihistaminiques (diphénhydramine, chlorphéniramine), la lévodopa et l’alcool.
L'adrénaline inhibe la sécrétion d'insuline et entraîne donc une augmentation de la glycémie. Il peut être nécessaire pour les patients diabétiques recevant de l'adrénaline d’augmenter leur dose d'insuline ou de médicaments hypoglycémiants oraux.
A noter, l'effet β-stimulant peut être inhibé par l’utilisation concomitante de β-bloquants.
4.6. Fertilité, grossesse et allaitement
Grossesse
L’expérience clinique chez la femme enceinte est limitée.
L'adrénaline ne doit être utilisée pendant la grossesse que lorsque le bénéfice attendu pour la mère justifie le risque potentiel pour le fœtus.
Allaitement
L’adrénaline n’est pas biodisponible par voie orale ; l’adrénaline excrétée dans le lait maternel ne devrait pas avoir d’effets sur le nourrisson.
Fertilité
L'adrénaline est une substance naturellement présente dans l'organisme. Il est donc peu probable qu'elle ait des effets néfastes sur la fertilité.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Sans objet.
Les effets indésirables associés à l’activation par l’adrénaline des récepteurs alpha et bêta peuvent inclure des symptômes tels qu'une tachycardie et une hypertension, ainsi que des effets indésirables sur le système nerveux central.
La fréquence des effets indésirables est évaluée de la façon suivante : très fréquent (≥ 1/10), fréquent (≥ 1/100 à < 1/10), peu fréquent (≥ 1/1000 à < 1/100), rare (≥ 1/10 000 à < 1/1 000), très rare (< 1/10 000), inconnue (ne peut être estimée sur la base des données disponibles).
|
Classes de systèmes d’organes |
Fréquence |
Effet indésirable |
|
Infections et infestations |
Inconnue |
Infection au niveau du site d’injection* |
|
Affections psychiatriques |
Inconnue |
Anxiété |
|
Affections du système nerveux |
Inconnue |
Maux de tête, étourdissements, tremblements |
|
Affections cardiaques |
Rare |
Cardiomyopathie de stress |
|
Inconnue |
Tachycardie, arythmie cardiaque, palpitations, angine de poitrine, fibrillation ventriculaire |
|
|
Affections vasculaires |
Inconnue |
Hypertension, pâleur, ischémie périphérique faisant suite à l’injection accidentelle dans les mains ou les pieds |
|
Troubles respiratoires, thoraciques et médiastinaux |
Inconnue |
Difficultés respiratoires |
|
Affections gastro-intestinales |
Inconnue |
Nausées, vomissements |
|
Affections de la peau et du tissu sous-cutané |
Inconnue |
Hyperhidrose |
|
Troubles généraux et anomalies au site d’administration |
Inconnue |
Asthénie |
|
Blessures, empoisonnement et complications liées à l’injection |
Inconnue |
Blessure accidentelle avec l’aiguille # |
# les injections accidentelles ou une utilisation inappropriée peuvent causer des blessures au point d’injection, ce qui peut entraîner des ecchymoses, des saignements, une décoloration, un érythème ou des lésions squelettiques.
* De rares cas d’infections sérieuses de la peau et du tissu mou, y compris des fasciites nécrosantes et des myonécroses causées par Clostridia (gangrène gazeuse) sont connus depuis la commercialisation.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : www.signalement-sante.gouv.fr
Un surdosage ou une injection intravasculaire accidentelle d'adrénaline peut provoquer une hémorragie cérébrale par augmentation brusque de la pression artérielle. Des décès peuvent aussi résulter d'un œdème pulmonaire dû à la vasoconstriction périphérique et à la stimulation cardiaque.
L'œdème pulmonaire peut être traité par des agents α-bloquants comme la phentolamine. Les cas d’arythmies peuvent être traités par bêtabloquants.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Classe pharmacothérapeutique : Agents adrénergiques et dopaminergiques
Code ATC : C01CA24.
L'adrénaline est une catécholamine qui stimule le système nerveux sympathique (récepteurs alpha et bêta), ce qui augmente la fréquence cardiaque, le débit cardiaque et la circulation coronarienne. L'adrénaline, par son action sur les récepteurs bêta des muscles lisses bronchiques, provoque une bronchodilatation, ce qui réduit le sifflement respiratoire et la dyspnée.
L'adrénaline est rapidement inactivée et la majorité de la dose d'adrénaline est excrétée sous forme de métabolites par voie urinaire.
5.2. Propriétés pharmacocinétiques
La demi-vie plasmatique de l'adrénaline est d'environ 2,5 minutes. Cependant, après administration d'adrénaline par voie sous-cutanée ou intramusculaire, la vasoconstriction locale retarde l'absorption, de sorte que les effets peuvent durer bien plus longtemps que ne le suggère la demi-vie plasmatique. Il est conseillé de masser doucement la zone d'injection.
5.3. Données de sécurité préclinique
Il n’existe pas de donnée préclinique utile au prescripteur.
19 mois.
6.4. Précautions particulières de conservation
Conserver l’auto-injecteur dans l’emballage extérieur à l’abri de la lumière.
À conserver à une température ne dépassant pas 25°C. Ne pas mettre au réfrigérateur. Ne pas congeler.
Vérifier périodiquement que l’aspect de la solution est toujours limpide et incolore dans la fenêtre de contrôle du stylo. Jeter ou remplacer l'auto-injecteur si la solution a changé de couleur ou contient un précipité, et au plus tard à la date de péremption. La date de péremption est mentionnée sur l'étiquette. L'auto-injecteur ne doit pas être utilisé après cette date.
6.5. Nature et contenu de l'emballage extérieur
Le conditionnement primaire/système de fermeture consiste en une cartouche de verre, scellée à une extrémité par un piston en caoutchouc et à l'autre extrémité par un diaphragme en caoutchouc inséré dans un moyeu en aluminium auquel est fixée une aiguille en acier inoxydable. Le médicament se trouve dans la cartouche en verre.
Auto-injecteur (dispositif d’administration) :
Cartouche en verre :
Type I, verre borosilicaté
Diaphragme - bouchon :
PH 701/50/noir (piston en caoutchouc butyle)
Aiguille - moyeu - tube :
Aiguille : acier inoxydable siliconisé type 304, longueur d’aiguille exposée et protégée après activation environ 13 mm
Moyeu : alliage d'aluminium anodisé 3003
Tube : polyisoprène synthétique
L'auto-injecteur contient 2 ml de solution injectable. Chaque auto-injecteur délivre une seule dose (0,3 ml) de 150 microgrammes d'adrénaline.
Présentations :
1 auto-injecteur.
2 x 1 auto-injecteur.
Toutes les présentations peuvent ne pas être commercialisées.
6.6. Précautions particulières d’élimination et de manipulation
À usage unique. L'auto-injecteur doit être jeté immédiatement après utilisation.
Pour former le patient à la bonne utilisation d'EPIPEN, le médecin prescripteur peut s’aider d’un EPIPEN® TRAINER (dispositif de démonstration sans solution injectable ni aiguille).
L'auto-injecteur EPIPEN 0,15 mg/0,3 ml, solution injectable en stylo pré-rempli contient 2 ml de solution injectable d'adrénaline à 0,5 mg/ml conçue pour délivrer une seule dose (0,3 ml) de 150 microgrammes d'adrénaline lors de son activation. Après activation de l'auto-injecteur, un volume de 1,7 ml reste dans l'auto-injecteur.
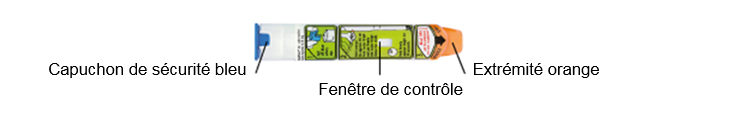
Ne pas enlever l’opercule bleu de sécurité avant d'être prêt à l’injection.
Ne jamais poser votre pouce, vos doigts ou votre main sur ou à proximité de l'extrémité orange de l'auto-injecteur EPIPEN. Une injection accidentelle dans la main ou dans un doigt, entraînant une ischémie périphérique, a été rapportée. Voir rubrique 4.4. Utiliser l'auto-injecteur EPIPEN sur la face extérieure de la cuisse. Le dispositif d’injection est immédiatement activé dès que l'extrémité orange de l'auto-injecteur EPIPEN entre en contact avec la peau ou une autre surface.
Les auto-injecteurs EPIPEN sont conçus de manière à être utilisés facilement par une personne non professionnelle et doivent être utilisés comme une mesure de premiers soins. Il suffit de placer l'auto-injecteur à environ 10 cm de la face extérieure de la cuisse et de l’enfoncer fermement. Il n'est pas nécessaire de choisir un endroit bien précis sur la face extérieure de la cuisse. Lorsque l'auto-injecteur EPIPEN a été enfoncé contre la cuisse, un piston à ressort est libéré ; celui-ci pousse dans le muscle de la cuisse l'aiguille qui était cachée afin d’administrer une dose d'adrénaline :
1. Prenez l'auto-injecteur EPIPEN dans votre main dominante en plaçant le pouce près de l'opercule de sécurité bleu.
2. De l'autre main, retirez l'opercule de sécurité bleu en le tirant vers le haut.
3. Tenez l'auto-injecteur EPIPEN à environ 10 cm de la face extérieure de la cuisse. L’extrémité orange est dirigée vers l’extérieure de la cuisse.
4. Enfoncez fermement l'auto-injecteur EPIPEN dans la face extérieure de la cuisse à angle droit (90°).
5. Maintenez fermement l'auto-injecteur contre la cuisse pendant 3 secondes. L'injection est maintenant terminée et la fenêtre de contrôle du liquide de l'auto-injecteur apparaît opaque. Retirez l'auto-injecteur EPIPEN (l’extrémité orange se déploie pour recouvrir l'aiguille) et jetez-le conformément aux règles de sécurité.
6. Massez doucement la zone d'injection pendant 10 secondes.
Il peut y avoir une petite bulle dans l'auto-injecteur EPIPEN, sans influence sur l'utilisation ni sur l'efficacité du produit.
Un mode d'emploi est inclus dans l'emballage.
Voir la rubrique 4.2 pour les instructions à donner au patient / soignant concernant les mesures à prendre après chaque utilisation de l'auto-injecteur EPIPEN.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
1 BIS PLACE DE LA DEFENSE – TOUR TRINITY
92400 COURBEVOIE
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 275 646 9 7 : 0,3 ml en stylo pré rempli (verre) ; boite de 1
· 34009 275 647 5 8 : 0,3 ml en stylo pré-rempli (verre) ; boite de 2
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Liste I
ANSM - Mis à jour le : 01/04/2024
EPIPEN 0,15 mg/0,3 ml, solution injectable en stylo pré-rempli
Adrenaline
Veuillez lire attentivement cette notice avant d’utiliser ce médicament car elle contient des informations importantes pour vous.
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin, votre pharmacien ou votre infirmier/ère.
· Ce médicament vous a été personnellement prescrit. Ne le donnez jamais à d’autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin, votre pharmacien ou votre infirmier/ère. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
1. Qu'est-ce que EPIPEN 0,15 mg/0,3 ml, solution injectable en stylo pré-rempli et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant d'utiliser EPIPEN 0,15 mg/0,3 ml, solution injectable en stylo pré-rempli ?
3. Comment utiliser EPIPEN 0,15 mg/0,3 ml, solution injectable en stylo pré-rempli ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver EPIPEN 0,15 mg/0,3 ml, solution injectable en stylo pré-rempli ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE EPIPEN 0,15 mg/0,3 ml, solution injectable en stylo pré-rempli ET DANS QUELS CAS EST-IL UTILISE ?
Classe pharmacothérapeutique : Agents adrénergiques et dopaminergiques - code ATC : C01CA24
EPIPEN est une solution stérile en stylo pré-rempli pour une injection intramusculaire en urgence.
Indications thérapeutiques :
EPIPEN 0,15 mg/0,3 ml, solution injectable en stylo pré-rempli est indiqué dans le traitement d'urgence des réactions allergiques sévères (choc anaphylactique) provoquées par des allergènes comme les aliments, les médicaments, les piqûres ou morsures d'insecte ainsi que par l’exercice physique ou de cause inconnue.
Les auto-injecteurs EPIPEN sont destinés à une administration immédiate chez les patients qui ont un risque élevé de réaction allergique sévère, y compris ceux présentant des antécédents de réactions anaphylactiques.
Les symptômes indiquant le déclenchement d'une réaction anaphylactique incluent : démangeaison cutanée, éruption avec gonflement (type urticaire) ; rougeur de la peau ; gonflement des lèvres, de la gorge, de la langue, des mains et des pieds ; respiration sifflante ; enrouement ; nausées ; vomissements ; crampes abdominales et, dans certains cas, perte de conscience.
Le médicament contenu dans l'auto-injecteur (le stylo) est de l'adrénaline, un médicament adrénergique.
Il agit directement sur le système cardiovasculaire (cœur et circulation sanguine) et le système respiratoire (poumons). Il s’oppose aux effets potentiellement mortels de l'anaphylaxie en entraînant une constriction rapide des vaisseaux sanguins, une relaxation des muscles des poumons pour faciliter la respiration, une réduction de l'œdème et une stimulation des battements du cœur.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D’UTILISER EPIPEN 0,15 mg/0,3 ml, solution injectable en stylo pré-rempli ?
N’utilisez jamais EPIPEN 0,15 mg/0,3 ml, solution injectable en stylo pré-rempli :
Il n'existe aucune raison connue empêchant d'utiliser EPIPEN en cas d'urgence allergique.
Si vous souffrez d'asthme, votre risque de réaction allergique sévère peut être plus important.
Toute personne qui a présenté un épisode d'anaphylaxie doit consulter son médecin afin de subir des tests destinés à déterminer les substances auxquelles elle peut être allergique, afin de les éviter rigoureusement dans l'avenir. Il est important que vous soyez conscient(e) qu'une allergie à une substance peut mener à des allergies à plusieurs substances liées.
Si vous souffrez d'allergies alimentaires, il est important de vérifier la composition de tout ce que vous avalez (y compris les médicaments) parce que même de petites quantités peuvent provoquer des réactions sévères.
Informez votre médecin si vous avez :
· une maladie cardiaque,
· une hyperthyroïdie,
· une hypertension,
· du diabète,
· une augmentation de la pression de l’œil (glaucome),
· des problèmes importants au niveau des reins,
· une tumeur à la prostate,
· des taux élevés de calcium ou des taux bas de potassium dans votre sang,
· la maladie de Parkinson.
Malgré ces cas précis, l'adrénaline est indispensable au traitement de l'anaphylaxie. Les patients concernés, et toute personne devant administrer EPIPEN à un patient présentant une réaction allergique, doivent correctement être informés des situations dans lesquelles EPIPEN doit être utilisé.
Le Mode d’emploi doit être strictement respecté pour éviter toute injection accidentelle.
EPIPEN 0,15 mg/0,3 ml, solution injectable en stylo pré-rempli doit être injecté uniquement dans la face externe de la cuisse. Il ne doit pas être utilisé dans la fesse en raison du risque d'injection accidentelle dans une veine.
Attention : Une injection accidentelle dans les mains ou les doigts peut entraîner une interruption de l'irrigation sanguine de l’extrémité du membre concerné. En cas d'injection accidentelle dans ces zones, consultez immédiatement le service des urgences de l'hôpital le plus proche pour recevoir un traitement.
Si vous avez une épaisse couche de graisse sous-cutanée, il y a un risque qu’une seule dose d’EPIPEN ne soit pas suffisante. Une deuxième injection peut être nécessaire. Suivre attentivement les instructions d’utilisation données à la rubrique 3.
Enfants et adolescents
Enfants de moins de 15 kg :
La pertinence de l’utilisation d’EPIPEN 0,15 mg/0,3 ml doit être évaluée au cas par cas par le médecin.
Chez l’enfant de moins de 7,5 kg l'utilisation n’est pas recommandée sauf en cas de risque vital ou de décision du médecin.
Enfants et adolescents de plus de 30 kg :
Pour ces patients l’auto-injecteur EPIPEN contenant 300 microgrammes d’adrénaline par dose est disponible.
Autres médicaments et EPIPEN 0,15 mg/0,3 ml, solution injectable en stylo pré-rempli
Informez votre médecin ou votre pharmacien si vous prenez ou si vous avez récemment pris ou pourriez utiliser tout autre médicament.
Cette précaution est particulièrement importante si vous prenez :
· des antidépresseurs, comme des antidépresseurs tricycliques ou des inhibiteurs de la monoamine oxydase (IMAO), car ils peuvent augmenter les effets de l'adrénaline,
· des médicaments pour la maladie de Parkinson, comme des inhibiteurs de la catéchol-O-méthyl transférase (inhibiteurs COMT), et de la lévodopa car ils peuvent augmenter les effets de l'adrénaline,
· des médicaments pouvant entraîner des battements cardiaques irréguliers (arythmies), comme les digitaliques ou la quinidine,
· des médicaments bêta-bloquants utilisés dans les maladies cardiaques ou des médicaments utilisés pour traiter les troubles du système nerveux, car ils peuvent diminuer les effets de l'adrénaline,
· des médicaments pour la maladie de la thyroïde,
· des médicaments pour améliorer votre souffle, utilisés dans l’asthme (théophylline),
· des médicaments utilisés lors de l’accouchement (ocytocine),
· des médicaments utilisés dans le traitement de l’allergie comme la diphénhydramine ou la chlorphéniramine (antihistaminiques),
· des médicaments agissant sur le système nerveux (parasympatholytiques).
Les patients diabétiques doivent soigneusement surveiller leur glycémie après l'utilisation d'EPIPEN, car l'adrénaline peut affecter la quantité d'insuline fabriquée par le corps et donc augmenter le taux de glucose dans le sang.
EPIPEN 0,15 mg/0,3 ml, solution injectable en stylo pré-rempli avec des aliments, boissons et de l’alcool
Les aliments et les boissons n'ont aucune influence sur l'utilisation d'EPIPEN.
Informez votre médecin si vous prenez de l’alcool car cela peut augmenter les effets de l’adrénaline.
Grossesse, allaitement et fertilité
Grossesse
Si vous êtes enceinte ou que vous allaitez, si vous pensez être enceinte ou planifiez une grossesse, demandez conseil à votre médecin ou votre pharmacien avant de prendre ce médicament.
L’expérience concernant l'utilisation de l'adrénaline pendant la grossesse est limitée. Cela ne doit pas vous empêcher d’utiliser EPIPEN en cas d'urgence pendant une grossesse car votre vie et celle de votre enfant peuvent être en danger.
Allaitement
Aucun effet n’est attendu sur l’enfant allaité après utilisation d’EPIPEN.
Conduite de véhicules et utilisation de machines
Sans objet.
EPIPEN 0,15 mg/0,3 ml, solution injectable en stylo pré-rempli contient du métabisulfite de sodium (E223) et du chlorure de sodium :
Le métabisulfite de sodium peut, rarement, provoquer des réactions allergiques sévères ou des difficultés à respirer (bronchospasme).
Ce médicament contient moins de 1 mmol de sodium (23 mg) par dose, il est donc considéré « sans sodium ».
3. COMMENT UTILISER EPIPEN 0,15 mg/0,3 ml, solution injectable en stylo pré-rempli ?
Lorsque votre médecin vous prescrit EPIPEN 0,15 mg/0,3 ml, solution injectable en stylo pré-rempli, vous devez vous assurer que vous comprenez bien la raison pour laquelle il vous l’a prescrit. Vous devez être certain de savoir exactement comment utiliser le dispositif d’administration. Utilisez toujours EPIPEN 0,15 mg/0,3 ml, solution injectable en stylo pré-rempli exactement comme votre médecin ou votre pharmacien vous l’a enseigné. Si vous avez le moindre doute concernant son utilisation, demandez à votre médecin, infirmier/ère ou pharmacien de répéter les instructions d’utilisation.
Il est recommandé que les membres de votre famille, le personnel soignant, les enseignants soient également formés à l’utilisation correcte d’EPIPEN.
Si l’injection est exécutée par un personnel soignant, la jambe du patient doit être immobilisée pendant l'injection pour minimiser le risque de lacération.
En aucun cas il ne faut réinsérer l’aiguille utilisée.
Un dispositif de démonstration d’EPIPEN (sans solution injectable ni aiguille) est disponible pour la formation et l’entrainement à son utilisation.
Le stylo de démonstration et le « vrai » stylo auto-injecteur EPIPEN ne doivent pas être transportés ensemble afin d’éviter toute confusion en cas de situation d’urgence.
EPIPEN 0,15 mg/0,3 ml, solution injectable en stylo pré-rempli est destiné aux personnes pesant entre 15 et 30 kg.
Pour les adultes, les adolescents, et les enfants pesant plus de 30 kg EPIPEN auto-injecteur d'adrénaline contenant 300 microgrammes par dose est disponible.
Pour les enfants pesant moins de 15 kg, voir la rubrique « Enfants et adolescents » ci-dessus.
Posologie
La dose sera déterminée par votre médecin, qui l'ajustera à votre cas. La dose pédiatrique usuelle (de 15 à 30 kg) en cas d'urgence allergique est de 150 microgrammes d'adrénaline par voie intramusculaire.
Si vous détectez les signes d'une réaction allergique aiguë, utilisez immédiatement EPIPEN 0,15 mg/0,3 ml, solution injectable en stylo pré-rempli.
Chaque auto-injecteur EPIPEN 0,15 mg/0,3 ml, solution en stylo pré-rempli délivre une seule dose de 0,3 ml de solution contenant 150 microgrammes d'adrénaline. Après utilisation, un petit volume reste dans l'auto-injecteur mais il ne peut pas être réutilisé.
Parfois, une seule dose d'adrénaline ne suffit pas à inverser complètement les effets d'une réaction allergique grave. Pour cette raison, votre médecin peut vous prescrire plus d'un EPIPEN. Si vos symptômes ne s’améliorent pas ou s’aggravent dans les 5 à 15 minutes qui suivent la première injection, vous ou la personne vous accompagnant procéderez à une seconde injection d’EPIPEN. C'est pourquoi vous devez avoir en permanence plus d'un EPIPEN sur vous.
Mode d'administration
EPIPEN est conçu pour être utilisé facilement par des personnes sans formation médicale. Il suffit de placer EPIPEN à environ 10 cm de la face extérieure de la cuisse et de l’enfoncer fermement. Il n'est pas nécessaire de choisir un endroit bien précis sur la face extérieure de la cuisse. Lorsque vous enfoncez EPIPEN dans la cuisse, un piston à ressort est libéré ; celui-ci pousse dans le muscle de la cuisse l'aiguille qui était cachée et une dose d'adrénaline est administrée. Si vous êtes habillés, EPIPEN peut être utilisé à travers les vêtements.
Suivez scrupuleusement le mode d’emploi d'EPIPEN.
Il est recommandé que les membres de votre famille, le personnel soignant, les enseignants soient également formés à l’utilisation correcte d’EPIPEN.
Vous devez injecter EPIPEN UNIQUEMENT sur la face extérieure de la cuisse. Vous ne devez pas l’injecter dans la fesse.
Mode d’emploi
Vous devez parfaitement connaître EPIPEN et savoir quand et comment l'utiliser.
Suivez ces instructions uniquement lorsque vous êtes prêt à utiliser le stylo.
Tenez toujours l'auto-injecteur par son centre et jamais par ses extrémités. Pour une bonne administration, référez-vous aux schémas et suivez les étapes suivantes :
Ne placez jamais votre pouce, vos doigts ou votre main sur l'extrémité orange. N'appuyez jamais sur l'extrémité orange avec le pouce, les doigts ou la main.
L'aiguille sort par l'extrémité orange.
Ne retirez PAS l'opercule de sécurité bleu avant d'être prêt à utiliser l'auto-injecteur.


Massez doucement la zone d'injection pendant 10 secondes. Composez le 15 (pour la France) ou le 112, demandez une ambulance, dîtes que vous avez eu un choc anaphylactique.
Il peut y avoir une petite bulle dans l'auto-injecteur EPIPEN. Ceci n'a pas d’influence sur l'efficacité du médicament.
Bien que la plus grande partie de la solution (environ 90 %) reste dans l’EPIPEN après utilisation, l'auto-injecteur ne peut pas être réutilisé. Cependant, vous avez reçu la bonne dose du médicament si l’extrémité orange s’est déployée et si la fenêtre de contrôle est devenue opaque. Après usage, remettez EPIPEN en toute sécurité dans le tube de rangement fourni et rapportez-le à votre médecin, à l'hôpital ou à la pharmacie.
EPIPEN est un traitement d'urgence. Vous devez toujours contacter un service médical immédiatement après avoir utilisé EPIPEN. Composez le 15 (pour la France) ou le 112, demandez une ambulance et indiquez que vous avez eu un choc anaphylactique, même si les symptômes semblent s'améliorer. Vous devrez vous rendre à l'hôpital pour une observation et un traitement complémentaires si nécessaire. Il existe en effet un risque de récidive de la réaction quelque temps plus tard.
En attendant l'ambulance, vous devez rester allongé(e) avec les pieds surélevés, sauf si cela entraîne un essoufflement ; dans ce cas, vous devez rester assis(e). Demandez à quelqu'un de rester à vos côtés jusqu'à l'arrivée de l'ambulance au cas où vous vous sentiriez de nouveau mal.
Le patient inconscient doit être allongé sur le côté en position de sécurité.
Si vous avez utilisé plus de EPIPEN 0,15 mg/0,3 ml, solution injectable en stylo pré-rempli que vous n’auriez dû :
En cas de surdosage ou d’injection accidentelle d’adrénaline, consultez immédiatement un service médical.
Si vous oubliez d’utiliser EPIPEN 0,15 mg/0,3 ml, solution injectable en stylo pré-rempli :
Sans objet.
Si vous arrêtez d’utiliser EPIPEN 0,15 mg/0,3 ml, solution injectable en stylo pré-rempli :
Sans objet.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Comme tous les médicaments, ce médicament peut provoquer des effets indésirables, mais ils ne surviennent pas systématiquement chez tout le monde.
De rares cas d’infections sérieuses de la peau et du tissu mou (infection au niveau du site d'injection) ont été rapportées. En cas de signes d’infection au site d’injection tels que gonflement, rougeur, échauffement ou douleur, vous devez toujours rechercher une aide médicale immédiate.
L’injection accidentelle dans les mains ou les pieds a été rapportée et peut entraîner une interruption de l'irrigation sanguine vers la zone concernée. En cas d'injection accidentelle, vous devez toujours rechercher une aide médicale immédiate.
Des réactions allergiques peuvent survenir chez les patients sensibilisés au métabisulfite de sodium. Dans de rares cas (jusqu’à 1 personne sur 1000), un stress myocardiopathique a été observé chez des patients traités par l'adrénaline.
Inconnue (les données disponibles ne permettent pas d’estimer la fréquence de survenue) :
Battements rapides ou irréguliers du cœur, parfois sévères, douleur dans la poitrine, hypertension, difficultés à respirer, pâleur, sueurs, nausées, vomissements, maux de tête, étourdissements, faiblesse, tremblement et nervosité ou anxiété, blessure au point d’injection, comme des ecchymoses, des saignements, rougeur.
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin, votre pharmacien ou à votre infirmier/ère. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet: www.signalement-sante.gouv.fr
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER EPIPEN 0,15 mg/0,3 ml, solution injectable en stylo pré-rempli ?
Tenir ce médicament hors de la vue et de la portée des enfants.
N’utilisez pas ce médicament après la date de péremption indiquée sur l’emballage et sur l’étiquette après la date d’expiration. La date de péremption fait référence au dernier jour de ce mois.
À conserver à une température ne dépassant pas 25°C. Ne pas mettre au réfrigérateur. Ne pas congeler.
Conservez l’auto-injecteur dans l’emballage extérieur à l’abri de la lumière. Lorsque l'adrénaline est exposée à l'air ou à la lumière, elle se détériore rapidement et elle prend une couleur rose ou marron.
N’oubliez pas de vérifier de temps en temps le contenu de la cartouche en verre de l'auto-injecteur EPIPEN 0,15 mg/0,3 ml, solution injectable en stylo pré-rempli afin de vérifier que la solution est toujours limpide et incolore. Remplacez l'auto-injecteur lorsque la date de péremption est atteinte ou plus tôt si la solution est colorée ou contient un précipité (matière solide).
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient EPIPEN 0,15 mg/0,3 ml, solution injectable en stylo pré-rempli
· La substance active est : l’adrénaline (chaque dose contient 150 microgrammes d’adrénaline)
· Les autres composants sont : chlorure de sodium, métabisulfite de sodium (E223), acide chlorhydrique, eau pour préparations injectables.
Solution limpide et incolore dans un stylo pré-rempli (auto-injecteur).
L'auto-injecteur contient 2 ml de solution injectable. Chaque auto-injecteur délivre une seule dose (0,3 ml) de 0,15 mg d'adrénaline.
Longueur d’aiguille exposée et protégée environ 13 mm.
Présentations :
1 auto-injecteur.
2 x 1 auto-injecteur.
Toutes les présentations peuvent ne pas être commercialisées.
Titulaire de l’autorisation de mise sur le marché
VIATRIS MEDICAL
1 BIS PLACE DE LA DEFENSE – TOUR TRINITY
92400 COURBEVOIE
Exploitant de l’autorisation de mise sur le marché
VIATRIS SANTE
1 BIS PLACE DE LA DEFENSE – TOUR TRINITY
92400 COURBEVOIE
MEDA PHARMA GmbH & Co. KG
BENZSTRASSE 1
61352 BAD HOMBURG
ALLEMAGNE
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Ce médicament est autorisé dans les Etats membres de l'Espace Economique Européen sous les noms suivants : Conformément à la réglementation en vigueur.
[À compléter ultérieurement par le titulaire]
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
< {MM/AAAA}>< {mois AAAA}.>
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).