Dernière mise à jour le 01/12/2025
MYRELEZ L.P. 120 mg, solution injectable à libération prolongée en seringue préremplie
Indications thérapeutiques
Le lanréotide diminue le taux de certaines hormones dans l’organisme, telles que l’hormone de croissance (GH) et le facteur de croissance insulinomimétique humain de type 1 (insulin-like growth factor 1 ou IGF-1) et inhibe la libération de certaines hormones au niveau du tractus gastro-intestinal, ainsi que des sécrétions intestinales. Il permet aussi la diminution ou l’arrêt de la croissance de certaines tumeurs avancées de l’intestin et du pancréas (appelées tumeurs neuroendocrines).
Dans quel cas MYRELEZ L.P. 120 mg, solution injectable à libération prolongée en seringue préremplie est-il utilisé :
· Dans le traitement de l’acromégalie (une maladie lors de laquelle l’organisme produit trop d’hormone de croissance).
· Dans le traitement des symptômes tels que bouffées de chaleur et diarrhée, qui peuvent survenir chez les patients souffrant de tumeurs carcinoïdes.
· Dans le traitement et le contrôle de la croissance de certaines tumeurs avancées de l’intestin et du pancréas appelées tumeurs neuroendocrines gastro-entéro-pancréatiques, lorsque ces tumeurs ne peuvent pas être retirées par la chirurgie.
Présentations
> 1 seringue préremplie polypropylène de 0,5 ml avec aiguille(s) avec système de sécurité automatique
Code CIP : 34009 302 283 6 4
Déclaration de commercialisation : 25/04/2022
Cette présentation est agréée aux collectivités
- Prix hors honoraire de dispensation : 659,50 €
- Honoraire de dispensation : 1,02 €
- Prix honoraire compris : 660,52 €
- Taux de remboursement :100 %
Service médical rendu (SMR)
Amélioration du service médical rendu (ASMR)
Ce médicament étant un générique, l'ASMR n'a pas été évalué par la commission de la transparence (CT), il est possible de se référer à la /aux spécialité(s) de référence du groupe générique auquel appartient ce médicament (cliquez ici pour aller à la rubrique des groupes génériques)
Autres informations
- Titulaire de l'autorisation : AMDIPHARM Ltd
- Conditions de prescription et de délivrance :
- liste I
- prescription initiale hospitalière annuelle
- Statut de l'autorisation : Valide
- Type de procédure : Procédure décentralisée
- Code CIS : 6 167 032 1
ANSM - Mis à jour le : 18/08/2025
MYRELEZ L.P. 120 mg, solution injectable à libération prolongée en seringue préremplie
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Lanréotide (sous forme d’acétate de lanréotide).................................................................... 120 mg
Pour une seringue préremplie.
La seringue préremplie contient une solution sursaturée d’acétate de lanréotide correspondant à 0,246 mg de lanréotide base/mg de solution, permettant l’injection d’une dose de 120 mg de lanréotide.
Pour la liste complète des excipients, voir rubrique 6.1.
Solution injectable en seringue préremplie.
Formulation semi-solide blanche à jaune pâle pratiquement exempte de particules étrangères.
4.1. Indications thérapeutiques
MYRELEZ L.P. est indiqué pour :
· Traitement des personnes atteintes d’acromégalie, lorsque les taux circulants d’hormone de croissance (GH) et/ou d’IGF-1 (insulin-like growth factor-1 ou facteur de croissance analogue à l’insuline-1) ne sont pas normalisés après chirurgie et/ou radiothérapie ou chez les patients qui nécessitent un traitement médicamenteux pour toute autre raison
· Traitement des tumeurs neuroendocrines (TNE) gastro-entéro-pancréatiques non résécables de l’adulte, localement avancées ou métastatiques, de grade 1 ou de grade 2 avec un index Ki67 ≤ 10%, ayant pour origine l’intestin moyen, le pancréas, ou d’origine inconnue après exclusion d’un site primitif au niveau de l’intestin postérieur (voir rubrique 5.1).
· Traitement des symptômes cliniques des tumeurs carcinoïdes.
4.2. Posologie et mode d'administration
Acromégalie
La dose de départ recommandée est de 60 à 120 mg tous les 28 jours.
La dose peut varier en fonction de la réponse du patient (jugée par symptomatologie et/ou effet biochimique) ou de l’expérience possible du patient avec les analogues de la somatostatine.
Par exemple :
· Chez les patients préalablement traités au lanréotide L.P. 30 mg avec une dose tous les 14 jours, la dose initiale de MYRELEZ L.P. doit être de 60 mg tous les 28 jours
· Chez les patients précédemment traités au lanréotide L.P. 30 mg avec une dose tous les 10 jours, la dose initiale de MYRELEZ L.P. doit être de 90 mg tous les 28 jours.
La dose doit être individualisée en fonction de la réponse du patient (évaluée par une réduction des symptômes et/ou une réduction des taux de GH et/ou d’IGF-1).
· Chez les patients chez qui les symptômes cliniques et les paramètres biochimiques ne sont pas suffisamment contrôlés (concentrations de GH demeurant supérieures à 2,5 ng/mL [environ 5 mU/l] ou IGF-1 supérieure à la normale [en fonction de l’âge]), la dose de MYRELEZ L.P. peut être augmentée jusqu’à un maximum de 120 mg tous les 28 jours.
· Si un contrôle complet est obtenu (basé sur des taux de GH inférieurs à 1 ng/mL, une normalisation des taux d’IGF1 et/ou la disparition des symptômes), la dose peut être réduite.
Les patients bien contrôlés sous un analogue de la somatostatine peuvent également être traités par MYRELEZ L.P. 120 mg tous les 42 à 56 jours (6 à 8 semaines).
Un suivi à long terme des symptômes et des taux de GH et d’IGF-1 doit être systématiquement instauré chez tous les patients.
Traitement des tumeurs neuroendocrines (TNE) gastro-entéro-pancréatiques non résécables de l’adulte, localement avancées ou métastatiques, de grade 1 ou de grade 2 avec un index Ki67 ≤ 10%, ayant pour origine l’intestin moyen, le pancréas, ou d’origine inconnue après exclusion d’un site primitif au niveau de l’intestin postérieur
La dose recommandée est d’une injection de MYRELEZ L.P. 120 mg tous les 28 jours. Le traitement par MYRELEZ L.P. doit se poursuivre aussi longtemps que nécessaire pour parvenir au contrôle de la tumeur.
Traitement des symptômes associés aux tumeurs neuroendocrines
La dose de départ recommandée est de 60 à 120 mg tous les 28 jours.
La dose doit être ajustée en fonction du degré de soulagement symptomatique obtenu.
Insuffisance rénale et/ou hépatique
Chez les patients présentant une insuffisance rénale ou hépatique, il n’est pas nécessaire d’ajuster la posologie en raison de la largeur de la marge thérapeutique du lanréotide (voir rubrique 5.2).
Patients âgés
Chez les patients âgés, il n’est pas nécessaire d’ajuster la posologie en raison de la largeur de la marge thérapeutique du lanréotide (voir rubrique 5.2).
Population pédiatrique
MYRELEZ L.P. n’est pas recommandé chez les enfants et les adolescents en raison du manque de données concernant sa sécurité et son efficacité.
Mode d’administration
MYRELEZ L.P. doit être injectée par injection sous-cutanée profonde dans le quadrant supéro-externe de la fesse ou dans la région supéro-externe de la cuisse.
Chez les patients qui reçoivent une dose stable de MYRELEZ L.P. et après une formation appropriée, le produit peut être administré par le patient lui-même ou par une personne formée à cet effet. En cas d’auto-injection, l’injection doit être administrée dans la région supéro-externe de la cuisse.
La décision d’administration par le patient ou par une autre personne formée doit être prise par un professionnel de santé.
Quel que soit le site d’injection, la peau ne doit pas être pincée et l’aiguille doit être introduite rapidement sur toute sa longueur, perpendiculairement à la peau. Les injections doivent être réalisées alternativement du côté droit et du côté gauche.
4.4. Mises en garde spéciales et précautions d'emploi
Des études pharmacologiques chez l’animal et chez l’homme ont montré que le lanréotide, comme la somatostatine et ses analogues, inhibe la sécrétion d’insuline et de glucagon. Dès lors, les patients traités au lanréotide sont susceptibles de présenter une hypoglycémie ou une hyperglycémie. La glycémie doit être surveillée lors de l’initiation du traitement par le lanréotide ou lors de toute modification de posologie et le traitement antidiabétique doit être ajusté en conséquence.
Une légère réduction de la fonction thyroïdienne a été observée au cours du traitement par le lanréotide chez les patients souffrant d’acromégalie, même si une hypothyroïdie clinique est rare (< 1%). Des tests de la fonction thyroïdienne doivent être réalisés si cliniquement indiqué.
Chez les patients sans problèmes cardiaques sous-jacents, le lanréotide peut entraîner une diminution de la fréquence cardiaque, sans atteindre nécessairement le seuil de bradycardie. Chez les patients qui souffrent de pathologies cardiaques avant le traitement au lanréotide, une bradycardie sinusale peut survenir. La prudence est de mise lors de l’instauration d’un traitement au lanréotide chez des patients atteints de bradycardie (voir rubrique 4.5).
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Des interactions avec les médicaments fortement liés aux protéines plasmatiques sont peu probables car le lanréotide se lie modérément aux protéines sériques.
Selon des données limitées de la littérature, l’administration concomitante d’analogues de la somatostatine et de bromocriptine peut augmenter la disponibilité de la bromocriptine.
L’administration concomitante de médicaments induisant une bradycardie (par ex. bêtabloquants) peut avoir un effet additif sur la légère diminution de la fréquence cardiaque induite par le lanréotide. Un ajustement posologique de ces médicaments peut s’avérer nécessaire.
Selon des données limitées de la littérature, les analogues de la somatostatine peuvent diminuer la clairance métabolique des composés métabolisés par les enzymes du cytochrome P450, ce qui pourrait être dû à l’inhibition de l’hormone de croissance. Un tel effet ne pouvant être exclu avec le lanréotide, les médicaments métabolisés principalement par le CYP3A4 et possédant un faible index thérapeutique (par ex. quinidine, terfénadine) doivent être utilisés avec prudence.
4.6. Fertilité, grossesse et allaitement
Grossesse
Il existe des données limitées (moins de 300 grossesses) sur l’utilisation du lanréotide chez la femme enceinte.
Les études effectuées chez l’animal ont mis en évidence une toxicité sur la reproduction mais aucune preuve d’effets tératogènes (voir rubrique 5.3). Le risque potentiel pour l’Homme est inconnu.
Par mesure de précaution, il est préférable d’éviter l’utilisation de MYRELEZ L.P. pendant la grossesse.
Il n’y a pas de données disponibles sur l’excrétion du lanréotide dans le lait maternel.
Un risque pour les nouveau-nés/nourrissons ne peut être exclu. MYRELEZ ne doit pas être utilisé pendant l’allaitement.
Fertilité
Une diminution de la fertilité a été observée chez la ratte en raison de l’inhibition de la sécrétion de GH, à des doses supérieures à celles utilisées chez l’homme en thérapeutique.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Les effets indésirables rapportés par des patients souffrant d’acromégalie et de tumeurs neuroendocrines gastro-entéro-pancréatique traités par le lanréotide au cours des études cliniques sont repris sous le système d’organes correspondant selon la classification suivante : très fréquent (≥ 1/10) ; fréquent (≥ 1/100 à < 1/10) ; peu fréquent (≥ 1/1 000 à < 1/100) ; indéterminé (ne peut être estimé sur la base des données disponibles).
Les effets indésirables les plus fréquents lors du traitement par le lanréotide sont des troubles gastro-intestinaux (le plus souvent diarrhée et douleurs abdominales, habituellement légères à modérées et transitoires), la lithiase biliaire (souvent asymptomatique) et des réactions au site d’injection (douleur, nodules et indurations).
Le profil de tolérance observé est similaire pour toutes les indications.
|
Classe de systèmes d’organes |
Très fréquent (≥ 1/10) |
Fréquent (≥ 1/100 à < 1/10) |
Peu fréquent (≥ 1/1 000 à < 1/100) |
Expérience dans le cadre de la pharmacovigilance (fréquence indéterminée) |
|
Infections et infestations |
|
|
|
Abcès au site d’injection |
|
Troubles du métabolisme et de la nutrition |
|
Hypoglycémie, diminution de l’appétit**, hyperglycémie, diabète |
|
|
|
Affections psychiatriques |
|
|
Insomnie* |
|
|
Affections du système nerveux |
|
Sensations vertigineuses, céphalées, léthargie** |
|
|
|
Affections cardiaques |
|
Bradycardie sinusale* |
|
|
|
Affections vasculaires |
|
|
Bouffées de chaleur* |
|
|
Affections gastro-intestinales |
Diarrhée, selles molles*, douleur abdominale |
Nausées, vomissements, constipation, flatulence, distension abdominale, inconfort abdominal*, dyspepsie, stéatorrhée** |
Décoloration des selles* |
Pancréatite |
|
Affections hépatobiliaires |
Lithiase biliaire |
Dilatation biliaire* |
|
Cholécystite, cholangite |
|
Affections musculo-squelettiques et systémiques |
|
Douleurs musculo-squelettiques**, myalgies** |
|
|
|
Affections de la peau et du tissu sous-cutané |
|
Alopécie, hypotrichose* |
|
|
|
Troubles généraux et anomalies au site d’administration |
|
Asthénie, fatigue, réactions au site d’injection (douleur, masse, induration, nodule, prurit) |
|
|
|
Investigations |
|
Élévation des ALT*, anomalies des AST et des ALT*, élévation de la bilirubinémie*, élévation de la glycémie*, élévation de l’hémoglobine glycosylée*, perte de poids, diminution des enzymes pancréatiques** |
Élévation des AST*, élévation des phosphatases alcalines*, anomalies de la bilirubinémie*, diminution de la natrémie* |
|
|
Affections du système immunitaire |
|
|
|
Réactions allergiques (y compris œdème angioneurotique, anaphylaxie, hypersensibilité) |
* sur la base d’un ensemble d’études effectuées chez des patients souffrant d’acromégalie
** sur la base d’un ensemble d’études effectuées chez des patients souffrant de TNE gastro-entéro-pancréatiques
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/.
En cas de surdosage, un traitement symptomatique est recommandé.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Mécanisme d’action
Le lanréotide est un octapeptide dérivé de la somatostatine endogène. Comme la somatostatine, le lanréotide est un inhibiteur de différentes fonctions endocrines, neuroendocrines, exocrines et paracrines. Il présente une forte affinité pour les récepteurs humains à la somatostatine (SSTR) 2 et 5 et une affinité faible pour les récepteurs humains SSTR 1, 3 et 4. L’activité au niveau des récepteurs humains SSTR 2 et 5 est considérée comme le principal mécanisme responsable de l’inhibition de l’hormone de croissance. Le lanréotide est plus actif que la somatostatine naturelle et présente une durée d’action plus longue.
Comme la somatostatine, le lanréotide inhibe la sécrétion exocrine comprenant la sécrétion basale de motiline, de peptide inhibiteur gastrique et de polypeptide pancréatique, mais n’a pas d’action significative sur la sécrétion à jeun de sécrétine ou de gastrine. En outre, il diminue le taux plasmatique de chromogranine A et le taux de 5-HIAA (acide 5-hydroxyindolacétique) dans l’urine des patients présentant une TNE gastro-entéro-pancréatique associée à des taux élevés de ces marqueurs tumoraux. Le lanréotide inhibe fortement l’augmentation du débit sanguin de l’artère mésentérique supérieure et de la veine porte en post-prandiale. Il diminue significativement la sécrétion hydro-électrolytique jéjunale (eau, sodium, potassium, chlorures) stimulée par la prostaglandine E1. Il diminue les taux de prolactine chez les patients acromégales traités à long terme.
Au cours d’une étude ouverte, le lanréotide L.P. 120 mg a été administré tous les 28 jours pendant 48 semaines chez 90 patients acromégales présentant un macroadénome hypophysaire diagnostiqué et non traités préalablement.
63% des patients ont montré une réduction cliniquement pertinente du volume tumoral ≥ 20% (critère principal d’efficacité), bien que cette réduction ne soit pas statistiquement significative (IC 95% : 52%-73%). À la semaine 48, le pourcentage moyen de réduction du volume tumoral était de 26,8%. La concentration de GH était inférieure à 2,5 μg/l chez 77,8% des patients et la concentration d’IGF-1 était normalisée chez 50% des patients. 43,5% des patients ont présenté à la fois une concentration d’IGF-1 normalisée et une concentration de GH inférieure à 2,5 µg/l. Des patients ont rapporté une amélioration des symptômes d’acromégalie tels que fatigue (56,5%), transpiration excessive (66,1%), arthralgies (59,7%) et gonflement des tissus mous (66,1%). Une moindre proportion de patients ont présenté une amélioration des céphalées (38,7%). Une réduction du volume tumoral et des concentrations de GH et d’IGF-1 a été mise en évidence dès la douzième semaine de traitement et s’est maintenue pendant 48 semaines. L’étude a exclu les patients qui devaient subir une intervention chirurgicale ou une radiothérapie hypophysaire au cours de la période.
Une étude multicentrique de phase III, randomisée, en double aveugle, contrôlée contre placebo, d’une durée fixe de 96 semaines a été menée en vue d’évaluer l’effet antiprolifératif du lanréotide chez des patients présentant une TNE gastro-entéro-pancréatique.
Les patients ont été randomisés selon un ratio 1:1 entre le groupe lanréotide L.P. 120 mg tous les 28 jours (n=101) et le groupe placebo (n=103). La randomisation était stratifiée en fonction des traitements reçus avant l’’entrée dans l’étude et de la présence/absence de progression à l’état initial, évaluée selon les critères RECIST 1.0 (Response Evaluation Criteria in Solid Tumours ou critères d’évaluation de la réponse dans les tumeurs solides) au cours d’une phase de sélection d’une durée de 3 à 6 mois.
Les patients présentaient une tumeur inopérable, métastatique et/ou localement avancée, confirmée au plan histologique comme étant bien ou modérément différenciée, avec une localisation primitive au niveau du pancréas (44,6% des patients), de l’intestin moyen (35,8%), de l’intestin postérieur (6,9%) ou d’origine autre/inconnue (12,7%).
69% des patients présentaient une TNE gastro-entéro-pancréatique de grade G1, définie soit par un index de prolifération Ki67 ≤ 2% (50,5% de la population totale), soit par un index mitotique < 2 mitoses /10 HPF (18,5% de la population totale). 30% des patients présentaient une TNE gastro-entéro-pancréatique se situant dans la fourchette inférieure du grade 2 (G2) (définie soit par un index de prolifération Ki67 > 2% et ≤ 10%). Le grade n’était pas connu chez 1% des patients. Les patients présentant une TNE gastro-entéro-pancréatique de grade G2 avec index de prolifération cellulaire plus élevé (Ki67 > 10% et ≤ 20%) ou présentant un carcinome neuroendocrine de grade G3 (index Ki67 > 20%) étaient exclus de l’étude.
Au total, la charge tumorale hépatique était ≤ 10% comprise entre 10 et 25% et > 25% chez 52,5% des patients, 14,5% et 33%.
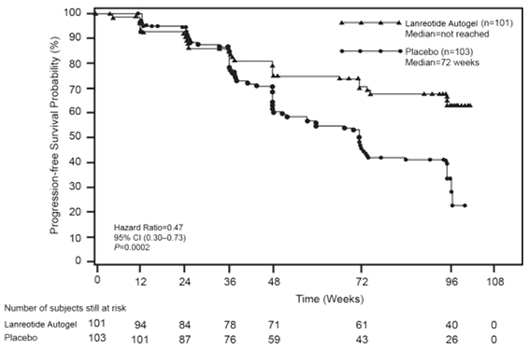
Le critère principal d’évaluation était la survie sans progression (SSP), définie comme le délai entre soit la progression de la maladie selon les critères RECIST 1.0, soit le décès, au cours des 96 semaines suivant la première administration du traitement. L’analyse de la SSP était basée sur une évaluation radiologique de la progression tumorale, effectuée de manière centralisée et indépendante.
Tableau 1 : Résultats d’efficacité de l’étude de phase III
|
Médiane de survie sans progression (semaines) |
Ratio de risque (IC 95%) |
Réduction du risque de progression ou de décès |
Valeur de p |
|
|
Lanréotide (n=101) |
Placebo (n=103) |
|||
|
> 96 semaines |
72,00 semaines (IC 95% : 48,57-96,00) |
0,470 (0,304-0,729) |
53% |
0,0002 |
Figure 1 : Courbes de Kaplan-Meier de survie sans progression
L’effet bénéfique du lanréotide L.P. sur la réduction du risque de progression ou de décès était cohérent, quel que soit le site primitif de la tumeur, la charge hépatique tumorale, la chimiothérapie antérieure, le Ki67 à l’était initial, le grade tumoral ou les autres caractéristiques pré-spécifiées (voir Figure 2).
Le bénéfice clinique du traitement par lanréotide L.P. a été observé chez les patients présentant une tumeur ayant pour origine le pancréas, l’intestin moyen ou une origine autre/inconnue, ainsi que dans la population totale de l’étude. Compte tenu du nombre limité de patients présentant une tumeur originaire de l’intestin postérieur (14/204) l’interprétation des résultats est difficile dans ce sous-groupe. Les données disponibles suggèrent une absence de bénéfice du lanréotide chez ces patients.
Figure 2 : Analyse des co-facteurs de la SSP par le modèle de Cox à risques proportionnels
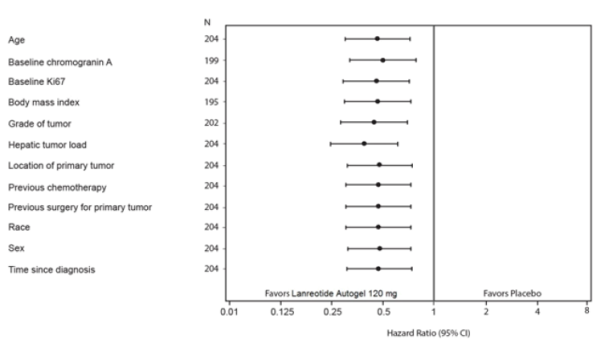
Note : Tous les ratios de risque expriment le risque relatif pour le lanréotide LP versus placebo. Les résultats des co-facteurs sont issus de modèles de Cox à risques proportionnels avec les facteurs traitement, progression à l’état initial, traitement antérieur à l’inclusion dans l’étude et le facteur identifié sur l’axe vertical.
Dans l’étude d’extension, 45,6% des patients (47/103) sont passés du placebo à un traitement ouvert par le lanréotide.
Population pédiatrique
L'Agence européenne des médicaments a accordé une dérogation à l’obligation de soumettre les résultats d’études avec le lanréotide LP dans tous les sous-groupes de la population pédiatrique, pour l’acromégalie et le gigantisme d’origine pituitaire (voir les informations concernant l'usage pédiatrique en rubrique 4.2). L'Agence européenne des médicaments a inscrit les TNE gastro-entéro-pancréatiques (à l’exception des neuroblastomes, des neuroganglioblastomes et des phéochromocytomes) sur la liste des exemptions de classe.
5.2. Propriétés pharmacocinétiques
Au cours des études d’élimination, moins de 5% du lanréotide était excrété par voie urinaire et moins de 0,5% était retrouvé sous forme inchangée dans les fèces, indiquant une excrétion biliaire.
Chez le volontaire sain, après injection sous-cutanée profonde de lanréotide L.P. 60, 90 et 120 mg, les concentrations sériques de lanréotide augmentent pour atteindre un pic de concentration (Cmax) de 4,25, 8,39 et 6,79 ng/mL. La Cmax est atteinte le jour de l’administration en 8, 12 et 7 heures (valeurs médianes). Les concentrations diminuent ensuite lentement en suivant une cinétique de premier ordre, avec une demi-vie terminale d’élimination de respectivement 23,3, 27,4 et 30,1 jours. Quatre semaines après l’administration, les concentrations sériques moyennes de lanréotide sont respectivement de 0,9, 1,11 et 1,69 ng/mL. La biodisponibilité absolue est de 73,4, 69,0 et 78,4%.
Chez le patient acromégale, après injection sous-cutanée profonde de lanréotide L.P. 60, 90 et 120 mg, les concentrations sériques de lanréotide augmentent pour atteindre un pic de concentration (Cmax) de 1,6, 3,5 et 3,1 ng/mL. La Cmax est atteinte le jour de l’administration après 6,6 et 24 heures. Les concentrations diminuent ensuite lentement en suivant une cinétique de premier ordre. Quatre semaines après l’administration, les concentrations sériques moyennes de lanréotide sont respectivement de 0,7, 1,0 et 1,4 ng/mL.
Les concentrations sériques de lanréotide à l’équilibre sont obtenues en moyenne après 4 injections pratiquées toutes les 4 semaines. Après administration répétée toutes les 4 semaines de lanréotide L.P. 60, 90 et 120 mg, la Cmax à l’équilibre est respectivement de 3,8, 5,7 et 7,7 ng/mL et la Cmin est respectivement de 1,8, 2,5 et 3,8 ng/mL. L’index de fluctuation pic-nadir est modéré, allant de 81 à 108%.
Après injection sous-cutanée profonde de lanréotide L.P. 60, 90 et 120 mg chez le patient acromégale, un profil pharmacocinétique de libération linéaire a été observé.
Une libération initiale rapide a été observée, avec une Cmax moyenne de 7,49 ± 7,58 ng/mL, atteinte au cours du 1er jour suivant une injection unique, lors d’une analyse pharmacocinétique de population portant sur 290 patients souffrant de TNE gastro-entéro-pancréatique recevant du lanréotide L.P. 120 mg, Les concentrations à l’équilibre ont été atteintes après 5 injections de lanréotide L.P. 120 mg tous les 28 jours ; elles ont été maintenues jusqu’à la dernière mesure (jusqu’à 96 semaines suivant la première injection). À l’équilibre, la Cmax moyenne était de 13,9 ± 7,44 ng/mL et la concentration sérique moyenne la plus basse était de 6,56 ± 1,99 ng/mL. La demi-vie terminale apparente moyenne était de 49,8 ± 28,0 jours.
Insuffisance hépatique/rénale
En cas d’insuffisance rénale sévère, on observe une réduction de moitié environ de la clairance sérique totale du lanréotide, avec pour conséquence une augmentation de la demi-vie et de l’ASC. En cas d’insuffisance hépatique modérée à sévère, on observe une diminution de la clairance de 30%. Le volume de distribution et le temps de résidence moyen augmentent quel que soit le degré d’insuffisance hépatique.
Aucun effet sur la clairance du lanréotide n’a été observé lors d’une analyse pharmacocinétique conduite sur une population de 165 patients atteints d’une insuffisance rénale légère et modérée (respectivement 106 et 59) et souffrant de TNE gastro-entéro-pancréatique traités par le lanréotide L.P. Les patients atteints d’une insuffisance rénale sévère et souffrant de TNE gastro-entéro-pancréatique n’ont pas été étudié. Aucun patient souffrant de TNE gastro-entéro-pancréatique présentant une insuffisance hépatique (selon le score de Child-Pugh) n’a été étudié.
Il n’est pas nécessaire de modifier la dose initiale en cas d’insuffisance hépatique ou rénale, dans la mesure où les concentrations sériques de lanréotide attendues chez ces patients restent dans la fourchette des concentrations bien tolérées chez le volontaire sain.
Sujets âgés
Une augmentation de la demi-vie et du temps de résidence moyen est observée chez le sujet âgé comparativement aux sujets sains jeunes. Il n’est pas nécessaire de modifier la dose initiale chez le sujet âgé, dans la mesure où les concentrations sériques de lanréotide attendues chez ces patients restent dans la fourchette des concentrations bien tolérées chez le volontaire sain.
Aucun effet de l’âge sur la clairance et le volume de distribution du lanréotide n’a été observé, lors d’une analyse pharmacocinétique de population portant chez 122 patients âgés de 65 à 85 ans souffrant de TNE gastro-entéro-pancréatique.
5.3. Données de sécurité préclinique
Au cours des études de cancérogenèse chez le rat et la souris, aucune modification néoplasique systémique n’a été observée à des doses supérieures à celles utilisées chez l’homme en thérapeutique. Une augmentation de l’incidence de tumeurs sous-cutanées a été observée au site d’injection, probablement en raison de la plus grande fréquence d’administration chez l’animal (quotidienne) que chez l’homme (administration mensuelle) et n’est donc pas pertinente en clinique.
Au cours des tests standard in vitro et in vivo, le lanréotide n’a pas montré de potentiel génotoxique.
Les études effectuées chez le rat et le lapin n’ont pas mis en évidence un effet tératogène. Une toxicité embryo-fœtale a été observée chez le rat (augmentation de pertes pré-implantatoires) et chez le lapin (augmentation de pertes post-implantatoires).
Les études sur la reproduction menées chez les rates gravides ayant reçues des injections sous-cutanées de 30 mg/kg toutes les 2 semaines (cinq fois la dose chez l’Homme, selon la surface corporelle) ont montré une diminution de la survie embryo-fœtale. Les études chez les lapines gravides ayant reçues des injections sous-cutanées de 0,45 mg/kg/jour (deux fois l’exposition thérapeutique chez l’Homme à la dose maximale recommandée de 120 mg, selon les comparaisons de la surface corporelle relative) montrent une diminution de la survie des fœtus et une augmentation des anomalies fœtales du squelette et des tissus mous.
Eau pour préparation injectable, acide acétique glacial (pour ajustement du pH).
3 ans.
Après ouverture du sachet en aluminium, le produit doit être administré immédiatement.
6.4. Précautions particulières de conservation
A conserver à une température comprise entre + 2° C et + 8° C (au réfrigérateur).
A conserver dans l’emballage d’origine, à l’abri de la lumière.
Après sortie du réfrigérateur, le produit qui est resté dans son sachet scellé peut être remis au réfrigérateur pour y être conservé en vue d’une utilisation ultérieure, à condition de ne pas avoir subi plus de trois excursions de température et d’avoir été conservé pendant moins de 72 heures au total à une température maximale de 40°C
6.5. Nature et contenu de l'emballage extérieur
MYRELEZ L.P.120 mg se présente sous forme d’une seringue préremplie (polypropylène), munie d’un système de sécurité automatique, d’un bouchon-piston (élastomère thermoplastique, fermé avec un bouchon en polypropylène), présentée dans une barquette en plastique et conditionnée dans un étui en aluminium, et d’une aiguille de sécurité (1,2 mm x 20 mm) conditionnée séparément. Toutes les deux sont conditionnées dans un étui en carton.
Boite contenant 1 seringue préremplie de 0,5 mL et 1 aiguille avec système de sécurité (1,2 mm x 20 mm).
Conditionnement multiple de 3 boîtes, contenant chacune une seringue de 0,5 mL et 1 aiguille avec système de sécurité (1,2 mm x 20 mm).
Toutes les présentations peuvent ne pas être commercialisées.
6.6. Précautions particulières d’élimination et de manipulation
La solution injectable en seringue préremplie est prête à l’emploi.
À usage immédiat et unique après ouverture.
Ne pas utiliser si le sachet est endommagé ou ouvert.
Le produit doit être injecté conformément aux instructions données dans la Notice.
Le dispositif d’injection usagé doit être éliminé dans un conteneur pour déchets pointus ou tranchants prévu à cet effet.
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
3 BURLINGTON ROAD
DUBLIN 4
IRLANDE
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 302 283 6 4 : 1 seringue préremplie (PP) avec aiguille avec système de sécurité automatique.
· 34009 550 813 7 1 : Conditionnement multiple de 3 seringues préremplies (PP) avec aiguille avec système de sécurité automatique.
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Médicament soumis à prescription initiale hospitalière annuelle.
ANSM - Mis à jour le : 18/08/2025
MYRELEZ L.P. 120 mg, solution injectable à libération prolongée en seringue préremplie
Lanréotide
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin, votre pharmacien ou votre infirmière.
· Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d’autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin, votre pharmacien ou votre infirmier/ère. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
1. Qu'est-ce que MYRELEZ L.P. 120 mg, solution injectable à libération prolongée en seringue préremplie et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant d'utiliser MYRELEZ L.P. 120 mg, solution injectable à libération prolongée en seringue préremplie ?
3. Comment utiliser MYRELEZ L.P. 120 mg, solution injectable à libération prolongée en seringue préremplie ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver MYRELEZ L.P. 120 mg, solution injectable à libération prolongée en seringue préremplie ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE MYRELEZ L.P. 120 mg, solution injectable à libération prolongée en seringue préremplie ET DANS QUELS CAS EST-IL UTILISE ?
Le lanréotide diminue le taux de certaines hormones dans l’organisme, telles que l’hormone de croissance (GH) et le facteur de croissance insulinomimétique humain de type 1 (insulin-like growth factor 1 ou IGF-1) et inhibe la libération de certaines hormones au niveau du tractus gastro-intestinal, ainsi que des sécrétions intestinales. Il permet aussi la diminution ou l’arrêt de la croissance de certaines tumeurs avancées de l’intestin et du pancréas (appelées tumeurs neuroendocrines).
Dans quel cas MYRELEZ L.P. 120 mg, solution injectable à libération prolongée en seringue préremplie est-il utilisé :
· Dans le traitement de l’acromégalie (une maladie lors de laquelle l’organisme produit trop d’hormone de croissance).
· Dans le traitement des symptômes tels que bouffées de chaleur et diarrhée, qui peuvent survenir chez les patients souffrant de tumeurs carcinoïdes.
· Dans le traitement et le contrôle de la croissance de certaines tumeurs avancées de l’intestin et du pancréas appelées tumeurs neuroendocrines gastro-entéro-pancréatiques, lorsque ces tumeurs ne peuvent pas être retirées par la chirurgie.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D’UTILISER MYRELEZ L.P. 120 mg, solution injectable à libération prolongée en seringue préremplie ?
N’utilisez jamais MYRELEZ L.P. 120 mg, solution injectable à libération prolongée en seringue préremplie :
· si vous êtes allergique au lanréotide, à la somatostatine ou à des médicaments de la même famille (analogue de la somatostatine) ou à l’un des autres composants contenus dans ce médicament mentionnés dans la rubrique 6.
Avertissements et précautions
Adressez-vous à votre médecin, pharmacien ou infirmier/ère avant d’utiliser MYRELEZ L.P. :
· Si vous êtes diabétique car MYRELEZ L.P. peut affecter votre glycémie. Votre médecin pourra surveiller votre glycémie et éventuellement modifier votre traitement antidiabétique pendant votre traitement par MYRELEZ L.P. .
· Si vous avez des calculs biliaires car MYRELEZ L.P. peut favoriser la formation de calculs dans la vésicule biliaire. Une surveillance régulière peut être nécessaire dans ce cas. Votre médecin peut décider d’arrêter le traitement par le lanréotide si des complications liées à des calculs biliaires surviennent.
· Si vous avez des problèmes de thyroïde car MYRELEZ L.P. peut diminuer légèrement la fonction thyroïdienne.
· Si vous souffrez de problèmes cardiaques car une bradycardie (ralentissement de la pulsation cardiaque) peut survenir sous traitement par MYRELEZ L.P. Une prudence toute particulière est nécessaire lors de l’instauration du traitement par MYRELEZ L.P. chez les patients souffrant de bradycardie.
Si l’une des mises en garde ci-dessus est d’application pour vous, parlez-en à votre médecin ou à votre pharmacien avant d’utiliser MYRELEZ L.P.
Enfants
MYRELEZ L.P. n’est pas recommandé chez les enfants.
Autres médicaments et MYRELEZ L.P. 120 mg, solution injectable à libération prolongée en seringue préremplie
Informez votre médecin ou pharmacien si vous prenez, avez récemment pris ou pourriez prendre tout autre médicament.
Il faut être particulièrement prudent si vous prenez en même temps :
· Ciclosporine (un médicament qui diminue la réaction immunitaire, par exemple après une transplantation d’organe ou en cas de maladie auto-immune)
· Bromocriptine (agoniste de la dopamine, utilisé dans le traitement de certains types de tumeurs du cerveau et de la maladie de Parkinson ou pour empêcher la production de lait après un accouchement)
· Médicaments qui ralentissent le rythme du cœur, (comme les bêtabloquants).
Dans ce cas, votre médecin pourra décider de modifier la dose des médicaments associés.
MYRELEZ L.P. 120 mg, solution injectable à libération prolongée en seringue préremplie avec des aliments et boissons
Sans objet.
Grossesse, allaitement et fertilité
Si vous êtes enceinte ou que vous allaitez, si vous pensez être enceinte ou planifiez une grossesse, demandez conseil à votre médecin ou pharmacien avant de prendre ce médicament.
Vous ne devez pas prendre MYRELEZ L.P. 120 mg durant votre grossesse sauf en cas de stricte nécessité.
Conduite de véhicules et utilisation de machines
Il est peu probable que votre capacité à conduire ou à utiliser des machines soit affectée par votre traitement. Toutefois, des effets indésirables comme des sensations de vertiges peuvent survenir avec MYRELEZ L.P. Si vous présentez de tels effets, il faudra être prudent en cas de conduite de véhicule ou d’utilisation de machines.
MYRELEZ L.P. 120 mg, solution injectable à libération prolongée en seringue préremplie contient
Sans objet.
3. COMMENT UTILISER MYRELEZ L.P. 120 mg, solution injectable à libération prolongée en seringue préremplie ?
Posologie
Traitement de l’acromégalie
La dose recommandée est d’une injection tous les 28 jours.
Votre médecin peut adapter la dose administrée en utilisant l’un des trois dosages disponibles de MYRELEZ L.P. (60, 90 ou 120 mg).
Si vous êtes bien contrôlé par votre traitement, votre médecin peut modifier la fréquence des injections de MYRELEZ L.P. 120 mg à une injection tous les 42 ou 56 jours. Toute modification de la posologie dépendra de vos symptômes et de votre réponse au médicament.
Votre médecin décidera également de la durée de votre traitement.
Soulagement des symptômes (tels que bouffées de chaleur et diarrhée) associés aux tumeurs neuroendocrines
La dose recommandée est d’une injection tous les 28 jours.
Votre médecin peut adapter la dose administrée en utilisant l’un des trois dosages existants de MYRELEZ L.P. (60, 90 ou 120 mg).
Si vous êtes bien contrôlé par votre traitement, votre médecin peut modifier la fréquence des injections de MYRELEZ L.P. 120 mg à une injection tous les 42 ou 56 jours.
Votre médecin décidera également de la durée de votre traitement.
Traitement des tumeurs avancées de l’intestin et du pancréas désignées sous le nom de tumeurs neuroendocrines gastro-entéro-pancréatiques ou TNE gastro-entéro-pancréatique lorsqu’il n’est pas possible d’éliminer chirurgicalement ces tumeurs
La dose recommandée est de 120 mg tous les 28 jours.
Votre médecin décidera de la durée de votre traitement par MYRELEZ L.P. pour le contrôle de la tumeur.
Mode d’administration
MYRELEZ L.P. doit être administré par injection sous-cutanée profonde.
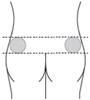
Si l’injection est administrée par un professionnel de santé ou par une personne formée à cet effet (un membre de votre famille ou un ami), elle doit être effectuée dans le quadrant supéro-externe de la fesse (voir les dessins dans la rubrique B6 ci-dessous).
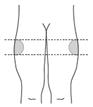
Si vous réalisez vous-même l’injection après une formation appropriée, elle doit être effectuée dans le haut de la face externe de la cuisse (voir les dessins dans la rubrique B6 ci-dessous).
La décision d’auto-administration ou d’administration par une autre personne formée doit être prise par votre médecin. À tout moment, si vous avez des doutes sur la façon d’administrer cette injection, veuillez contacter votre médecin ou votre professionnel de santé pour obtenir des conseils ou une formation supplémentaire.
INSTRUCTIONS POUR L’ADMINISTRATION DU PRODUIT
Attention : Veuillez lire attentivement toutes les instructions avant de commencer l’injection. L’injection est une injection sous-cutanée profonde qui nécessite une technique spécifique différente des injections sous-cutanées normales.
|
A. Contenu de la boîte Les instructions suivantes expliquent comment préparer la seringue/l’aiguille et comment injecter MYRELEZ L.P.
Le contenu de la seringue préremplie est une phase semi-solide ayant un aspect de gel, à caractère visqueux, et une couleur variant du blanc au jaune pâle. La solution sursaturée peut également contenir des microbulles qui peuvent disparaitre au cours de l’injection. Ces particularités sont normales et n’ont pas d’impact sur la qualité du produit. |
||||
|
B. Avant de commencer B1. Sortez MYRELEZ L.P. du réfrigérateur 30 minutes avant l’injection. Cela permet à la solution de lanréotide d’atteindre la température ambiante, afin de minimiser la réaction de douleur au médicament froid. Maintenez le sachet en aluminium scellé jusqu’au moment de l’injection.
B2. Attention : Avant l’ouverture, vérifiez que le sachet est intact et que la date de péremption n’est pas dépassée. La date de péremption est indiquée sur la boîte en carton et sur le sachet. Ne pas utiliser si la date de péremption est dépassée ou si l’emballage est endommagé. B3. Lavez-vous les mains au savon et séchez-les soigneusement avant de commencer. B4. Veillez à disposer d’une surface propre pour la préparation. B5. Déterminez un site d’injection - les sites possibles sont illustrés ci-dessous. B6. Veillez à nettoyer le site d’injection. |
||||
|
|
Si vous pratiquez l’injection sur quelqu’un d’autre : Injection dans le quadrant supéro-externe de la fesse.
|
|||
|
|
Si vous pratiquez vous-même l’injection (auto-injection) : injection dans le haut de la face externe de la cuisse.
|
|||
|
Alternez le site d’injection entre le côté droit et gauche lors de chaque injection de MYRELEZ L.P. Évitez les zones avec des grains de beauté, des tissus cicatriciels, une peau rougie ou une peau bosselée. Veuillez noter que le site d’injection ne peut pas être changé une fois l’aiguille insérée. B7. Ouvrir l’emballage et retirer la seringue préremplie.
Après ouverture de la pochette de protection, le produit doit être administré immédiatement.
|
||||
|
C. Préparation de la seringue |
||||
|
|
|
|||
|
|
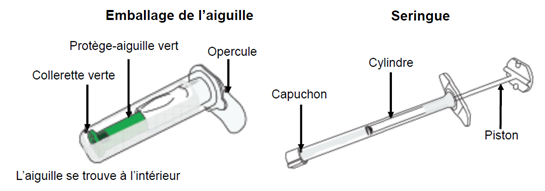
C1 : Ouvrez l’emballage de l’aiguille · Maintenez l’emballage de l’aiguille et tirez sur l’opercule pour le retirer. · Attention : Ne pas toucher le côté ouvert de l’emballage de l’aiguille. Celui-ci doit rester propre.
C2 : Retirez le capuchon de la seringue · Avec une main, maintenez le cylindre de la seringue (et non le piston). · De l’autre main, retirez le capuchon protecteur en le tournant.
|
|||
|
|
C3 : Placez l’embout de la seringue dans le côté ouvert de l’emballage de l’aiguille · Maintenez l’emballage de l’aiguille d’une main. · De l’autre main, maintenez le cylindre de la seringue (et non le piston) et visser la seringue dans le sens des aiguilles d’une montre sur l’aiguille pour fixer solidement ensemble la seringue et l’aiguille. · Elles sont entièrement fixées lorsqu’on ne peut plus tourner davantage. Important : Serrer la seringue à fond pour éviter toute fuite de médicament.
|
|||
|
|
C4 : Otez le capuchon protecteur de l’aiguille en tirant Maintenez le cylindre de la seringue (et non le piston). Tirez l’aiguille hors de son capuchon protecteur en ligne droite, sans tourner pour avoir la garantie que la seringue demeure solidement fixée à l’aiguille de sécurité.
|
|||
|
Attention : À partir de cette étape, l’aiguille est partiellement exposée. · NE JAMAIS TOUCHER OU ESSAYER D’OUVRIR LE PROTEGE-AIGUILLE VERT. · LE PROTEGE-AIGUILLE VERT n’est PAS un capuchon ou un couvercle amovible pour l’aiguille. · LE PROTEGE-AIGUILLE VERT s’active automatiquement pendant l’insertion de l’aiguille. · Une fois l’injection terminée, LE PROTEGE-AIGUILLE VERT recouvre l’aiguille et se verrouille . · LE PROTEGE-AIGUILLE VERT est un mécanisme de verrouillage de sécurité à fonctionnement automatique. |
||||
|
D. Réalisation de l’injection
|
||||
|
|
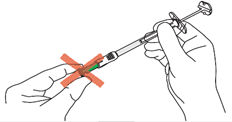
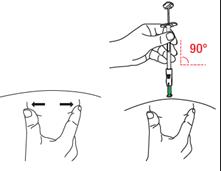
D1 : Positionnez la seringue · Pour le site d’injection à utiliser, se reporter à la section B. · Tendez la peau autour de la zone d’injection entre le pouce et l’index de la main qui ne tient pas la seringue pour aplatir cette zone. Ne pas pincer la peau. · De l’autre main, maintenez la partie inférieure du cylindre de la seringue (et non le piston). · Positionnez la seringue perpendiculairement à la peau.
|
|||
|
|
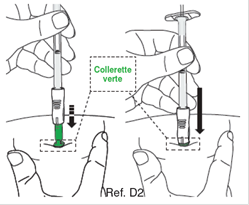
D2 : Insérez l’aiguille · Sans pincer ni presser la peau au site d’injection, insérez rapidement l’aiguille dans la peau. · Insérer l’aiguille perpendiculairement à la peau (angle de 90 degrés), jusqu’à ce qu’elle soit complètement dans la peau. Le protège-aiguille vert se rétracte et est maintenant activé. · Continuez d’insérer l’aiguille jusqu'à ce que seule la collerette de le protège-aiguille vert soit visible. · Remarque : Maintenez cette position jusqu’à ce que l’injection soit terminée. Éviter de tirer l’aiguille vers l’arrière/l’extérieur, car les mécanismes de sécurité peuvent être activées prématurément. · Ne pas enfoncer le piston à ce stade. Maintenez la seringue dans cette position pour l’étape suivante.
|
|||
|
Remarque : pendant l’injection, maintenir la pression sur l’aiguille pour éviter le recouvrement et le blocage du mécanisme de sécurité.
|
||||
|
|
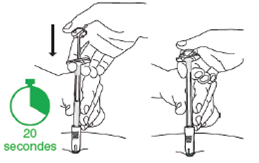
D3 : Appuyez sur le haut du piston · Relâchez le site d'injection qui était aplati avec la main · Déplacez la main de la peau vers le piston. · Enfoncez lentement avec une pression très ferme sans interruption jusqu’à ce que sa partie supérieure entre en contact avec le cylindre de la seringue (il est plus facile d’enfoncer le piston avec la main dominante). · Le médicament est plus épais et plus difficile à pousser que prévu. Injectez la dose complète et donnez une dernière impulsion pour vous assurer que vous ne pouvez pas l’enfoncer davantage. · En général, 20 secondes sont nécessaires. |
|||
|
E. Retrait et élimination de la seringue
|
||||
|
· |
E1 : Retrait de la peau · Retirez l’aiguille de la peau en ligne droite. · L’aiguille va se rétracter automatiquement dans un protège-aiguille vert où elle sera bloquée définitivement. |
|||
|
· |
E2 : Application d’une légère pression · Appuyez légèrement sur le point d’injection avec un coton sec ou de la gaze stérile afin d’éviter le saignement. · Ne pas frotter ni masser le point d’injection après administration |
|||
|
|
E3 : Élimination · Jetez la seringue usagée de manière appropriée. Votre médecin ou votre infirmière vous expliquera les précautions particulières d’élimination du matériel d’injection usagé. · Les aiguilles ne sont pas réutilisables. · Ne pas jeter la seringue ou l’aiguille usagées dans votre poubelle ménagère. |
|||
Si vous avez utilisé plus de MYRELEZ L.P. 120 mg, solution injectable à libération prolongée en seringue préremplie que vous n’auriez dû
Consultez votre médecin.
Si vous avez reçu une dose trop importante de MYRELEZ L.P, vous pouvez présenter plus d’effets indésirables ou des effets indésirables plus sévères (voir rubrique 4 « Quels sont les effets indésirables éventuels »).
Si vous oubliez d’utiliser MYRELEZ L.P. 120 mg, solution injectable à libération prolongée en seringue préremplie
Si vous arrêtez d’utiliser MYRELEZ L.P. 120 mg, solution injectable à libération prolongée en seringue préremplie
Une interruption de plus d’une injection ou un arrêt prématuré de votre traitement par MYRELEZ L.P. peut compromettre le succès du traitement. Demandez conseil à votre médecin avant d’arrêter le traitement.
Si vous avez d’autres questions sur l’utilisation de ce médicament, demandez plus d’informations à votre médecin ou à votre pharmacien.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Informez immédiatement votre médecin si vous présentez l’un des effets indésirables suivants :
· Si vous avez plus soif ou si vous vous sentez plus fatigué que d’habitude et si vous avez la bouche sèche Ces signes peuvent indiquer que vous avez un taux trop élevé de sucre dans le sang ou que vous développez un diabète.
· Si vous avez une sensation de faim, des tremblements, une transpiration plus importante que d’habitude, ou si vous vous sentez confus. Ces signes peuvent indiquer que vous avez un taux trop faible de sucre dans le sang.
Ces effets indésirables sont fréquents, ils peuvent concerner jusqu’à 1 personne sur 10.
Prévenez immédiatement votre médecin si vous remarquez que :
· Votre visage devient rouge ou gonflé ou vous présentez des boutons ou une éruption cutanée.
· Vous avez une sensation d’oppression au niveau de la poitrine, vous êtes essoufflé ou votre respiration est sifflante.
· Vous vous sentez faible, peut-être en relation avec une chute de la tension artérielle.
Ces effets peuvent être la conséquence d’une réaction allergique.
La fréquence de ces effets est indéterminée ; elle ne peut être estimée sur la base des données disponibles.
Autres effets indésirables
Si vous remarquez l’un des effets indésirables mentionnés ci-dessous, veuillez en informer votre médecin ou votre pharmacien.
Les effets indésirables les plus fréquents sont des troubles gastro-intestinaux, des problèmes au niveau de la vésicule biliaire et des réactions au site d’injection.
Les effets indésirables qui peuvent survenir avec MYRELEZ L.P. sont cités ci-dessous par ordre de fréquence.
Très fréquents : pouvant survenir chez plus de 1 personne sur 10 :
· Diarrhée, selles molles, douleur abdominale
· Calculs biliaires et autres problèmes affectant la vésicule biliaire. Vous pouvez présenter des symptômes tels que douleur abdominale sévère et soudaine, fièvre élevée, jaunisse (coloration jaune de la peau et du blanc des yeux), frissons, perte d’appétit, démangeaisons cutanées.
Fréquents : pouvant survenir chez jusqu’à 1 personne sur 10 :
· Perte de poids
· Manque d’énergie
· Battements cardiaques lents
· Sensation de fatigue très importante
· Diminution de l’appétit
· Sensation de faiblesse généralisée
· Excès de graisse dans les selles
· Sensation de vertiges, maux de tête
· Perte de cheveux ou diminution du développement des poils
· Douleurs au niveau des muscles, des ligaments, des tendons et des os
· Réactions au site d’injection telles que douleur ou induration
· Anomalies des tests hépatiques et pancréatiques ; modification de la glycémie
· Nausées, vomissements, constipation, flatulence, ballonnement ou inconfort gastrique, indigestion
· Dilatation biliaire (élargissement des canaux biliaires entre le foie et la vésicule biliaire et l’intestin). Vous pouvez ressentir des symptômes tels que douleurs de l’estomac, nausées, jaunisse et fièvre.
Peu fréquents : pouvant survenir chez jusqu’à 1 personne sur 100 :
· Bouffées de chaleur
· Difficultés d’endormissement
· Changement de couleur des selles
· Modification des taux sanguins de sodium et de phosphatases alcalines.
Fréquence indéterminée : ne peut être estimée sur la base des données disponibles :
· Douleur soudaine et intense dans la partie basse de l’estomac. Cela peut être un signe d’inflammation du pancréas (pancréatite).
· Rougeur, douleur, chaleur et gonflement au site d’injection qui peut sembler rempli de liquide lorsqu’il est pressé et fièvre.
· Douleur intense et soudaine en haut à droite de l’abdomen ou en son centre, pouvant irradier vers l’épaule ou le dos, une sensibilité de l’abdomen, des nausées, des vomissements et une forte fièvre. Ceci peut être le signe de calculs biliaires (cholécystite).
· Douleur dans la partie supérieure droite du ventre (abdomen), fièvre, frissons, jaunissement de la peau et des yeux (jaunisse), nausées, vomissements, selle couleur argile, urines foncées et fatigue. Il est peut s’agir d’une inflammation du canal biliaire (cholangite).
Comme MYRELEZ L.P. peut modifier la glycémie, votre médecin pourra juger nécessaire de vérifier votre glycémie, surtout lors de l’initiation du traitement.
De même, comme ce type de médicament peut entraîner des problèmes au niveau de la vésicule biliaire, votre médecin pourra juger nécessaire de surveiller votre vésicule biliaire au début du traitement par MYRELEZ L.P., puis périodiquement lors de la poursuite du traitement.
Informez votre médecin ou votre pharmacien si vous présentez l’un des effets indésirables ci-dessus.
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/.
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER MYRELEZ L.P. 120 mg, solution injectable à libération prolongée en seringue préremplie ?
Tenir ce médicament hors de la vue et de la portée des enfants.
N’utilisez pas ce médicament après la date de péremption indiquée sur l’emballage après EXP. La date de péremption fait référence au dernier jour de ce mois.
Conservez MYRELEZ L.P. 120 mg au réfrigérateur (2°C-8°C) dans son emballage d’origine, à l’abri de la lumière.
Après sortie du réfrigérateur, le produit qui est resté dans son sachet scellé peut être remis au réfrigérateur pour y être conservé en vue d’une utilisation ultérieure, à condition de ne pas avoir subi plus de trois excursions de température et d’avoir été conservé pendant moins de 72 heures au total à une température maximale de 40°C.
Après avoir ouvert l’étui de protection en aluminium, le produit doit être administré immédiatement.
Chaque seringue est conditionnée individuellement.
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
· La substance active est :
Lanréotide (sous forme d’acétate de lanréotide) .................................................................... 120 mg
Pour une seringue préremplie.
· Les autres composants sont : eau pour préparations injectables, acide acétique (pour ajustement du pH).
MYRELEZ L.P. 120 mg, solution injectable en seringue préremplie contient une solution injectable visqueuse dans une seringue en plastique semi-transparente de 0,5 mL accompagnée d’une aiguille de sécurité à usage unique. Le produit est une préparation semi-solide, blanche à jaune pâle.
Chaque seringue préremplie est conditionnée dans un sachet en aluminium et dans une boîte en carton.
Boîte contenant une seringue de 0,5 mL et une aiguille de sécurité (1,2 mm x 20 mm).
Conditionnement multiple de 3 boites, chacune contenant une seringue de 0,5 mL et une aiguille de sécurité (1,2 mm x 20 mm).
Toutes les présentations peuvent ne pas être commercialisées.
Titulaire de l’autorisation de mise sur le marché
3 BURLINGTON ROAD
DUBLIN 4
IRLANDE
Exploitant de l’autorisation de mise sur le marché
CORREVIO
15 RUE DU BICENTENAIRE
92800 PUTEAUX
DERVENAKION 6
PALLINI ATTIKI, 15351
GRECE
OU
PHARMATHEN INTERNATIONAL S.A
INDUSTRIAL PARK SAPES
RODOPI PREFECTURE, BLOCK NO 5
RODOPI 69300
GRECE
Amdipharm Limited fait partie du groupe ADVANZ PHARMA.
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Ce médicament est autorisé dans les Etats membres de l'Espace Economique Européen sous les noms suivants : Conformément à la réglementation en vigueur.
[À compléter ultérieurement par le titulaire]
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).