Dernière mise à jour le 01/12/2025
BOCOUTURE 50 unités, poudre pour solution injectable
Indications thérapeutiques
Classe pharmacothérapeutique : Code ATC : M03AX01
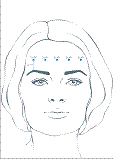
BOCOUTURE est indiqué dans la correction temporaire des rides du tiers supérieur du visage chez l'adulte de moins de 65 ans, lorsque la sévérité de ces rides entraîne un retentissement psychologique important chez le patient :
· rides verticales inter sourcilières modérées à sévères observées lors du froncement maximal des sourcils et/ou
· rides latérales périorbitaires modérées à sévères observées lors d’un sourire forcé et/ou
· rides horizontales du front modérées à sévères observées lors du haussement maximal des sourcils.
Présentations
> 1 flacon(s) en verre
Code CIP : 494 930-4 ou 34009 494 930 4 3
Déclaration de commercialisation : 30/09/2010
Cette présentation n'est pas agréée aux collectivités
Service médical rendu (SMR)
Pas de SMR disponible pour ce médicament ( plus d'informations dans l'aide )
Amélioration du service médical rendu (ASMR)
Pas d'ASMR disponible pour ce médicament (plus d'informations dans l'aide )
Autres informations
- Titulaire de l'autorisation : MERZ THERAPEUTICS GmbH
- Conditions de prescription et de délivrance :
- liste I
- prescription réservée aux spécialistes et services CHIRURGIE DE LA FACE ET DU COU
- prescription réservée aux spécialistes et services CHIRURGIE MAXILLO-FACIALE
- prescription réservée aux spécialistes et services CHIRURGIE PLASTIQUE, RECONSTRUCTRICE ET ESTHETIQUE
- prescription réservée aux spécialistes et services DERMATOLOGIE
- prescription réservée aux spécialistes et services OPHTALMOLOGIE
- réservé à l'usage professionnel
- réservé à l'usage professionnel selon l'article R.5121-80 du code de la santé publique
- Statut de l'autorisation : Valide
- Type de procédure : Procédure de reconnaissance mutuelle
- Code CIS : 6 159 276 2
ANSM - Mis à jour le : 04/07/2025
BOCOUTURE 50 unités, poudre pour solution injectable
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
1 flacon contient 50 unités de toxine botulinique de type A (150 kD), sans protéines complexantes*.
* Toxine botulinique de type A purifiée obtenue par culture de Clostridium botulinum (souche Hall).
Pour la liste complète des excipients, voir rubrique 6.1.
Poudre pour solution injectable.
Poudre blanche.
4.1. Indications thérapeutiques
· rides verticales intersourcilières (rides glabellaires) modérées à sévères observées lors du froncement maximal des sourcils et/ou,
· rides latérales périorbitaires (rides de la patte d’oie) modérées à sévères observées lors d’un sourire forcé et/ou
· rides horizontales du front modérées à sévères observées lors du haussement maximal des sourcils.
4.2. Posologie et mode d'administration
Pour une information détaillée sur les études cliniques comparant BOCOUTURE à la toxine botulinique de type A conventionnelle (900 kD), voir rubrique 5.1.
Généralités
BOCOUTURE doit être uniquement administré par des médecins ayant les qualifications adéquates et une bonne expérience de l’utilisation de la toxine botulinique de type A.
Posologie
· Rides verticales intersourcilières (rides glabellaires) observées lors du froncement maximal des sourcils
Après reconstitution de BOCOUTURE, une dose de 4 unités est injectée dans chacun des 5 sites d'injection : 2 injections dans chaque muscle corrugator et une injection dans le muscle procerus, soit une dose standard de 20 unités. Le médecin peut augmenter cette dose selon les besoins individuels du patient jusqu'à 30 unités. Un délai d'au moins 3 mois doit être respecté entre les traitements.
|
|
Une amélioration des rides verticales intersourcilières (rides glabellaires) lors du froncement maximal des sourcils est généralement observée en 2 à 3 jours ; l'effet maximal étant observé au 30ème jour. L'effet persiste jusqu'à 4 mois après l'injection.
· Rides latérales périorbitaires (rides de la patte d’oie) observées lors d’un sourire forcé
Après reconstitution de BOCOUTURE, 4 unités sont injectées bilatéralement dans chacun des 3 différents sites d'injection. Une injection est réalisée à environ 1 cm du rebord orbitaire en position latérale. Les deux autres injections sont réalisées à environ 1 cm au-dessus ou au-dessous du 1er point d’injection.
|
|
La dose totale standard recommandée par séance d’injection est de 12 unités par côté (soit une dose standard globale de 24 unités).
Une amélioration des rides latérales périorbitaires (rides de la patte d’oie) est observée lors d’un sourire forcé au cours des 6 premiers jours avec un effet maximal au 30ème jour. L’effet persiste jusqu’à 4 mois après l’injection.
· Rides horizontales du front observées lors du haussement maximal des sourcils
La dose totale recommandée est de 10 à 20 unités selon les besoins individuels du patient en respectant un intervalle d’au moins 3 mois entre les séances. Après reconstitution de BOCOUTURE, une dose totale de 10 à 20 unités est injectée dans le muscle frontal en 5 points alignés horizontalement et à au moins 2 cm au-dessus du rebord orbitaire. Des doses de2 unités, 3 unités ou 4 unités par point d’injection sont respectivement recommandées.
|
|
Une amélioration des rides frontales horizontales lors du haussement maximal des sourcils est généralement observée au cours des 7 jours suivant l’injection avec un effet maximal au 30ème jour. L’effet persiste jusqu’à 4 mois après l’injection.
Toutes les indications
En l’absence d’amélioration un mois après la première séance d’injection, il convient :
· d’analyser les causes de non-réponse, par exemple dose trop faible, mauvaise technique d’injection, développement possible d’anticorps neutralisant la neurotoxine,
· d’ajuster la dose en tenant compte de l’échec du traitement précédent,
· de réévaluer la pertinence du traitement par une toxine botulinique de type A,
· en l’absence d’effets indésirables lors de la première injection, de renouveler le traitement en respectant un intervalle minimal de 3 mois entre les deux traitements.
Sujet âgé
Les données des études cliniques de phase 3 chez des sujets de plus de 65 ans sont limitées. Jusqu'à ce que des données soient disponibles dans ce groupe d'âge, l'utilisation de BOCOUTURE chez des patients de plus de 65 ans n'est pas recommandée.
Population pédiatrique
La sécurité et l'efficacité de BOCOUTURE pour le traitement des rides verticales intersourcilières observées lors du froncement maximal des sourcils, des rides latérales périorbitaires observées lors d’un sourire forcé et des rides frontales horizontales observées lors du haussement maximal des sourcils n'ont pas été établies chez les enfants et les adolescents de moins de 18 ans. En conséquence BOCOUTURE n'est pas recommandé dans la population pédiatrique.
Mode d’administration
Toutes les indications
Après reconstitution, BOCOUTURE est destiné à la voie intramusculaire.
BOCOUTURE doit être immédiatement utilisé et est destiné à traiter un seul patient.
Une fois reconstitué, BOCOUTURE doit être injecté à l’aide d’une aiguille stérile fine (ex 30-33 gauge /0,20-0,30 mm de diamètre /13 mm de longueur). Un volume d’injection de 0,04 à 0,1 ml par site d’injection est recommandé.
Pour la reconstitution du produit avant administration et les instructions d’élimination des flacons, voir rubrique 6.6.
Les intervalles entre les traitements ne devraient pas être inférieurs à 3 mois. En cas d’échec thérapeutique ou de diminution de l’effet après des injections répétées, il convient d’envisager des méthodes de traitement alternatives.
Rides verticales intersourcilières (rides glabellaires) observées lors du froncement maximal des sourcils
Avant et pendant l'injection, le pouce ou l'index doivent être fermement placés sous le rebord orbitaire afin d'éviter l'extravasation du produit dans cette zone. L'aiguille doit être orientée vers le haut et vers la ligne médiane lors de l’injection. Afin de réduire le risque de ptosis, les injections à proximité du muscle releveur de la paupière supérieure et dans la partie crâniale du muscle orbiculaire doivent être évitées. Les injections dans le muscle corrugator doivent être effectuées dans la partie médiane de ce muscle et dans la partie centrale à au moins 1 cm au-dessus de l'arcade sourcilière.
Rides latérales périorbitaires (rides de la patte d’oie) observées lors d’un sourire forcé
Pour éviter la diffusion de BOCOUTURE, les injections doivent être réalisées par voie intramusculaire au niveau des muscles orbiculaires, directement sous le derme. Les injections trop proches du muscle grand zygomatique doivent être évitées de manière à prévenir une ptose de la lèvre.
Rides horizontales du front observées lors du haussement maximal des sourcils
Afin de réduire le risque de ptose du sourcil, BOCOUTURE ne doit pas être injecté au niveau des fibres musculaires situées à proximité du rebord orbitaire.
· Hypersensibilité à la substance active ou à l'un des excipients mentionnés dans la rubrique 6.1.
· Troubles généralisés de l'activité musculaire (ex: myasthénie grave, syndrome de Lambert-Eaton).
· Infection ou inflammation au site d'injection concerné.
4.4. Mises en garde spéciales et précautions d'emploi
Avant toute administration de BOCOUTURE, les médecins doivent se familiariser à l’anatomie du patient et à toute modification anatomique consécutive à des traitements chirurgicaux antérieurs.
Des précautions doivent être prises afin de s'assurer que BOCOUTURE n'est pas injecté dans un vaisseau sanguin. Il est important de noter que les rides horizontales du front peuvent être d’origine dynamique mais peuvent également résulter d’une perte d’élasticité du derme (par exemple liée au vieillissement ou aux méfaits du soleil). Dans ce cas, le patient peut ne pas répondre à un traitement par toxine botulinique.
BOCOUTURE doit être utilisé avec précaution :
· en cas de troubles hémorragiques, quels qu’ils soient,
· chez les patients sous traitement anticoagulant ou sous un autre traitement susceptible d’avoir un effet anticoagulant.
Diffusion locale ou à distance de la toxine
Des effets indésirables, liés à une injection mal ciblée de toxine botulinique de type A peuvent temporairement paralyser les muscles situés à proximité.
Des effets indésirables pouvant être liés à la diffusion de la toxine botulinique de type A à distance du site d'injection ont été rapportés (voir rubrique 4.8).
Les patients traités à dose thérapeutique peuvent présenter une faiblesse musculaire excessive.
Les patients et leur entourage doivent être avertis de la nécessité de consulter immédiatement un médecin en cas d'apparition de troubles de la déglutition, de l'élocution ou de troubles respiratoires.
Troubles neuromusculaires préexistants
L'injection de BOCOUTURE n’est pas recommandée chez les patients ayant des antécédents de pneumopathie d’inhalation ou de dysphagie.
BOCOUTURE doit être utilisé avec précaution :
· chez les patients souffrant de sclérose latérale amyotrophique
· chez les patients présentant d'autres troubles entraînant un dysfonctionnement neuromusculaire périphérique,
· dans les muscles cibles qui présentent une faiblesse prononcée ou une atrophie.
Réactions d’hypersensibilité
Des réactions d’hypersensibilité ont été rapportées avec la neurotoxine botulinique de type A. En cas de réactions d’hypersensibilité graves (ex : réaction anaphylactique) et/ou immédiates, un traitement médical approprié doit être instauré.
Formation d’anticorps
Des doses trop fréquentes peuvent augmenter le risque de formation d'anticorps et conduire à un échec thérapeutique (voir rubrique 4.2).
La formation potentielle d’anticorps peut être minimisée par l’administration de la plus petite dose efficace indiquée et ce, dans le respect des intervalles d’injection minimum entre 2 sessions.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Aucune étude d’interaction n’a été réalisée.
En théorie, l'effet de la neurotoxine botulinique peut être potentialisé par les aminosides ou par d'autres médicaments qui bloquent la transmission neuromusculaire, tels que les myorelaxants de type tubocurarine.
Par conséquent, l'administration concomitante de BOCOUTURE avec des aminosides ou de la spectinomycine doit être effectuée avec prudence. Les myorelaxants périphériques sont à utiliser avec précaution ; au besoin en diminuant leur dose de départ ou en utilisant une substance à action intermédiaire comme le vécuronium ou l'atracurium plutôt que des substances ayant des effets prolongés.
Les amino-4-quinoléines peuvent réduire l'effet de BOCOUTURE.
4.6. Fertilité, grossesse et allaitement
Grossesse
Il n'existe pas de données pertinentes sur l'utilisation de la toxine botulinique de type A pendant la grossesse. Les études chez l'animal ont mis en évidence une toxicité sur la reproduction (voir rubrique 5.3). Le risque potentiel chez l'Homme n'est pas connu. Par conséquent, BOCOUTURE ne doit pas être utilisé pendant la grossesse à moins d'une nécessité absolue et si le bénéfice potentiel justifie le risque.
Il n'existe pas de données quant à l’excrétion de la neurotoxine botulinique de type A dans le lait maternel. Par conséquent, BOCOUTURE ne doit pas être utilisé pendant l'allaitement.
Fertilité
Il n’existe pas de données cliniques concernant les effets de l’utilisation de BOCOUTURE sur la fertilité. Aucun effet sur la fertilité du lapin mâle ou femelle n’a été mis en évidence (voir rubrique 5.3).
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
En général, les effets indésirables sont observés au cours de la première semaine qui suit l'injection et sont transitoires. Ils peuvent être liés au principe actif et/ou à la technique d'injection.
Effets indésirables indépendants de l’indication
Effets indésirables liés à l’injection
Des douleurs localisées, une inflammation, des paresthésies, une hypoesthésie, une sensibilité, un gonflement/ œdème, un érythème, un prurit, une infection localisée, un hématome, un saignement et/ou des ecchymoses peuvent apparaître.
La douleur liée à la piqûre et/ou à l’anxiété peut induire une réponse vasovagale, avec hypotension symptomatique transitoire, nausées, acouphènes et syncope.
Effets indésirables liés à la classe
Une faiblesse musculaire localisée est un effet pharmacologique attendu de la toxine botulinique de type A. La ptose palpébrale, qui peut être causée par la technique d'injection, est en relation avec l'effet pharmacologique de BOCOUTURE.
Diffusion de la toxine
En traitant d’autres indications avec la toxine botulinique de type A, des effets indésirables liés à la diffusion de la toxine à distance du site d'injection – de type faiblesse musculaire excessive, dysphagie et pneumopathie d'inhalation d’issue parfois fatale – ont été très rarement rapportés (voir rubrique 4.4). De tels effets indésirables ne peuvent être exclus lors de l’utilisation de BOCOUTURE.
Réactions d’hypersensibilité
Des réactions d’hypersensibilité graves et/ou immédiates incluant des chocs anaphylactiques, des maladies sériques, une urticaire, un œdème des tissus mous et une dyspnée ont rarement été rapportées. Certaines de ces réactions ont été décrites à la suite d’injection de toxine botulinique de type A conventionnelle soit seule soit en association avec d’autres agents connus pour causer des réactions similaires.
Expérience clinique des effets indésirables
Les effets indésirables suivants ont été rapportés avec BOCOUTURE. La fréquence des effets indésirables présentée par indication et basée sur l'expérience clinique, est définie comme suit : très fréquent (≥ 1/10) ; fréquent (≥ 1/100 à < 1/10) ; peu fréquent (≥ 1/1 000 à < 1/100) ; rare (≥ 1/10 000 à < 1/1 000) ; très rare (< 1/10 000).
Rides verticales intersourcilières observées lors du froncement des sourcils (rides glabellaires)
|
Classes de systèmes d’organes MedDRA |
Réaction indésirable |
Fréquence |
|
Infections et infestations |
Bronchite, rhino-pharyngite, syndrome pseudo-grippal |
Peu fréquent |
|
Troubles psychiatriques |
Insomnie |
Peu fréquent |
|
Troubles du système nerveux |
Maux de tête |
Fréquent |
|
Troubles oculaires |
Œdème palpébral, Ptose, vision floue |
Peu fréquent |
|
Affections de la peau et du tissu sous-cutané |
Prurit, nodule, ptose du sourcil |
Peu fréquent |
|
Troubles musculo-squelettiques et du tissu conjonctif |
Effet Mephisto (élévation latérale du sourcil) |
Fréquent |
|
Tressautements musculaires, spasmes musculaires, asymétrie faciale (asymétrie du sourcil) |
Peu fréquent |
|
|
Troubles généraux et réactions au site d’administration |
Hématomes au site d'injection, douleur à l’injection, modification de la sensibilité (locale), fatigue, gêne (sensation de paupières ou de sourcils lourds) |
Peu fréquent |
|
Troubles vasculaires |
Hématomes |
Peu fréquent |
Rides latérales périorbitaires observées lors d’un sourire forcé (rides de la patte d’oie)
|
Classes de systèmes d’organes MedDRA |
Réaction indésirable |
Fréquence |
|
Troubles oculaires |
Œdème de la paupière, sécheresse oculaire |
Fréquent |
|
Troubles généraux et réactions au site d’administration |
Hématome au site d’injection |
Fréquent |
Rides du tiers supérieur du visage
|
Classes de systèmes d’organes MedDRA |
Réaction indésirable |
Fréquence |
|
Troubles du système nerveux |
Maux de tête |
Fréquent |
|
Hypoesthésie |
Peu fréquent |
|
|
Troubles généraux et réactions au site d’administration |
Hématome au site d’injection |
Fréquent |
|
Gêne (sensation de lourdeur au niveau du front) |
Peu fréquent |
|
|
Troubles oculaires |
Gonflement de la paupière, ptose de la paupière, sécheresse oculaire |
Peu fréquent |
|
Troubles cutanés et sous-cutanés |
Ptose du sourcil |
Peu fréquent |
|
Troubles musculo-squelettiques et du tissu conjonctif |
Asymétrie faciale, Effet Mephisto (élévation latérale du sourcil) |
Peu fréquent |
|
Troubles gastro-intestinaux |
Nausées |
Peu fréquent |
Données après commercialisation
Depuis la mise sur le marché de BOCOUTURE, les effets indésirables suivants ont été rapportés à une fréquence inconnue :
|
Classes de systèmes d’organes MedDRA |
Réaction indésirable |
|
Affections du système immunitaire |
Réactions d’hypersensibilité telles que gonflement, œdème (également à distance du site d’injection), érythème, prurit, rash (localisé ou généralisé) et cas d’essoufflements |
|
Troubles musculo-squelettiques et du tissu conjonctif |
Atrophie musculaire |
|
Troubles généraux et réactions au site d’administration |
Syndrome pseudo-grippal |
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/.
Des doses importantes de toxine botulinique peuvent provoquer, à distance du site d'injection, l’apparition d’une paralysie neuromusculaire prononcée avec une variété de symptômes. Les symptômes peuvent se traduire par une faiblesse généralisée, une ptose, une diplopie, un trouble de la respiration ou de l’élocution, une paralysie des muscles respiratoires ou des difficultés de déglutition pouvant conduire à une pneumopathie d'inhalation.
Mesures en cas de surdosage
En cas de surdosage, une surveillance médicale des symptômes évocateurs d’une faiblesse musculaire excessive ou une paralysie musculaire doit être mise en place. Un traitement symptomatique peut être nécessaire, voire une assistance respiratoire en cas de paralysie des muscles respiratoires.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Classe pharmacothérapeutique : autres myorelaxants, agent à action périphérique
Code ATC : M03AX01
La neurotoxine botulinique de type A bloque la transmission cholinergique au niveau de la jonction neuromusculaire en inhibant la libération d'acétylcholine. Ces terminaisons nerveuses ne répondent plus aux impulsions nerveuses empêchant la sécrétion des neurotransmetteurs au niveau des plaques motrices (dénervation chimique). La récupération d'une transmission par impulsion est rétablie par la formation de nouvelles terminaisons nerveuses et la reconnexion aux plaques motrices.
Mécanisme d’action
Le mécanisme d'action de la toxine botulinique de type A sur les terminaisons nerveuses cholinergiques peut être décrit par un procédé séquentiel en quatre temps :
· Liaison : la chaîne lourde de la neurotoxine botulinique de type A se fixe avec une sélectivité et une affinité exceptionnellement fortes aux récepteurs cholinergiques.
· Internalisation: invagination de la membrane nerveuse terminale et encapsulation de la toxine dans la terminaison nerveuse (endocytose).
· Translocation : la fonction amine terminale de la chaîne lourde de la neurotoxine forme un pore dans la membrane de la vésicule; le pont disulfure est rompu et la chaîne légère de la neurotoxine passe à travers ce pore dans le cytosol.
· Inhibition : lorsque la chaîne légère est libérée, elle clive de façon très sélective la protéine cible (SNAP 25) qui est indispensable à la libération d'acétylcholine.
Le rétablissement complet de la fonction motrice/conduction nerveuse après injection intramusculaire intervient normalement en l'espace de 3 à 4 mois, lorsque les terminaisons nerveuses se régénèrent et rétablissent leurs connexions avec la plaque motrice.
Efficacité et sécurité clinique
Rides verticales intersourcilières (rides glabellaires) observées lors du froncement maximal des sourcils
Un total de 994 sujets présentant des rides glabellaires d'intensité modérée à sévère au maximum du froncement des sourcils ont été inclus dans des études avec BOCOUTURE. 169 sujets (≥ 18 ans) ont été traités avec BOCOUTURE au cours de la 1ère période de l'étude pivot de phase III, contrôlée, en double-aveugle, et 236 sujets ont été traités dans la 2ème période de cette étude réalisée en ouvert (Open Label Extension : OLEX). Le critère d’efficacité était défini par les investigateurs à la semaine 4 comme un score nul ou faible sur une échelle en 4 points (Facial Wrinkle Scale) au maximum du froncement. Cette étude a montré une différence statistiquement significative et cliniquement pertinente en faveur de 20U BOCOUTURE vs placebo. Le taux global de répondeurs était de 51,5% dans le groupe BOCOUTURE contre 0% dans le groupe placebo. Aucune aggravation n’a été observée dans le groupe BOCOUTURE de l’étude pivot. Ceci a été confirmé par un plus grand nombre de répondeurs à J30 évalué par l'investigateur et le patient sur l'échelle Facial Wrinkle Scale au maximum de froncement, montrant une proportion significativement plus grande de répondeurs chez les patients recevant 20U de BOCOUTURE comparativement au groupe placebo.
Une analyse en sous-groupe a montré une efficacité moindre chez les patients ≥ 50 ans (n=56) par rapport aux patients < 50 ans (n=113) ainsi que chez les hommes (n=33) par comparaison aux femmes (n=136).
L’équivalence thérapeutique de BOCOUTURE a été démontrée par rapport au comparateur Vistabel contenant le complexe de toxine botulinique de type A (onabotulinumtoxin A- 900 kD) dans 2 études comparatives, prospectives, multicentriques, randomisées réalisées en double aveugle (n=631) et à des doses uniques de 20 et 24 unités respectivement. Les résultats de ces études ont démontré, chez des patients présentant des rides glabellaires modérées à sévères, une efficacité et un profil de sécurité comparables entre BOCOUTURE et le comparateur, pour un ratio de conversion de doses de 1:1 (voir rubrique 4.2).
La sécurité à long terme du traitement à doses répétées (20 unités) des rides glabellaires a été démontrée dans une étude de phase III sur une période allant jusqu’à 2 ans, avec un maximum de 8 cycles d’injection consécutifs (MRZ 60201-0609, N=796) [Rzany et al. 2013].
Rides latérales périorbitaires (rides de la patte d’oie) observées lors d’un sourire forcé
Dans une étude de phase III, 111 sujets présentant des rides latérales périorbitaires modérées à sévères (rides de la patte d’oie) lors d’un sourire forcé ont reçu 12 unités de BOCOUTURE ou de placebo sur chaque côté (zone périorbitaire droite/gauche) selon un schéma d’injection en 3 points ou en 4 points. L’efficacité du traitement définie comme une amélioration par rapport à l’état initial d’au moins un point sur une échelle en 4 points a été déterminée par un évaluateur indépendant à l’aide de photographies numériques standardisées prises au niveau de la zone périorbitaire lors d’un sourire forcé. BOCOUTURE a montré une efficacité supérieure par rapport au placebo quel que soit le schéma d’injection (en 3 ou 4 points). Pour le schéma en 3 points, une amélioration a été observée chez 69,9% des sujets du groupe BOCOUTURE contre 21,4% chez les sujets du groupe placebo et pour le schéma en 4 points, une amélioration chez 68,7% des sujets du groupe BOCOUTURE contre 14,3% des sujets du groupe placebo. Aucune aggravation n’a été observée dans le groupe BOCOUTURE. Le plus grand nombre de répondeurs a été observé à J30 selon une échelle en 4 points lors d’un sourire forcé au cours de l’évaluation de l’effet par l’investigateur et par le patient lui-même. La plus grande proportion de répondeurs a été retrouvée chez les patients traités par 12 unités de BOCOUTURE par zone périorbitaire comparé au placebo.
Rides du tiers supérieur du visage
L’efficacité et la tolérance d’injections de 54 à 64 unités de BOCOUTURE dans le traitement combiné des rides du tiers supérieur du visage (rides glabellaires, rides latérales périorbitaires, rides horizontales du front) ont été évaluées dans une étude de phase III incluant 156 sujets. Les répondeurs étaient définis par l’investigateur comme présentant un score nul ou faible lors du haussement maximal des sourcils sur une échelle en 5 points (Merz Aesthetic Scales). Les résultats ont montré une différence statistiquement significative et un taux de répondeurs plus élevé dans le groupe BOCOUTURE pour le traitement isolé des rides glabellaires, des rides latérales périorbitaires ou des rides du front ainsi que pour le traitement combiné de ces zones. Au total, 82,9% des sujets traités par BOCOUTURE ont répondu au traitement pour les rides glabellaires alors qu’aucun sujet n’a répondu dans le groupe placebo. Pour les rides latérales périorbitaires, une réponse a été observée pour 63,8% des sujets traités par BOCOUTURE contre 2% des sujets du groupe placebo. Dans le traitement des rides du front, 71,4% des sujets traités par BOCOUTURE ont répondu au traitement contre seulement un sujet (2%) dans le groupe placebo. Pour ces trois zones combinées, une réponse a été observée chez la majorité des sujets (54,3%) du groupe BOCOUTURE alors qu’aucun sujet n’a répondu dans le groupe placebo (0%).
La sécurité et la tolérance à long terme de 54 à 64 unités de BOCOUTURE ont été démontrées dans une étude phase III, prospective, en ouvert, à dose répétée sur une durée de traitement supérieure à 1 an, avec 4 injections consécutives pour un total de 125 patients traités pour des rides du tiers supérieur du visage modérées à sévères.
Population pédiatrique
L’Agence européenne des médicaments a accordé une dérogation à l’obligation de soumettre les résultats d’études réalisées avec BOCOUTURE dans tous les sous-groupes de la population pédiatrique dans le traitement des rides d’origine musculaire (voir rubrique 4.2 pour les informations concernant l’usage pédiatrique).
5.2. Propriétés pharmacocinétiques
Caractéristiques générales de la substance active
Les études de cinétique et de distribution classiques ne peuvent être réalisées avec la neurotoxine botulinique de type A car la substance active s'injecte en très petites quantités (picogrammes par injection) et se lie rapidement et de manière irréversible aux terminaisons nerveuses cholinergiques.
La toxine botulinique de type A naturelle est un complexe de haut poids moléculaire qui, en plus de la neurotoxine (150 kD), contient d'autres protéines complexantes non toxiques hémagglutinantes et non hémagglutinantes. Contrairement aux préparations conventionnelles de toxine botulinique de type A, BOCOUTURE contient la neurotoxine pure (150 kD) sans protéines complexantes et de ce fait, contient peu d’impuretés protéiques. La teneur en impuretés protéiques administrée est considérée comme l’un des facteurs d’échec secondaire au traitement.
La neurotoxine botulinique de type A a montré qu'elle subissait un transport axonal rétrograde après une injection intramusculaire. Le passage transsynaptique rétrograde de la neurotoxine botulinique de type A active dans le système nerveux central n'a pas été retrouvé aux doses thérapeutiques recommandées.
La neurotoxine botulinique de type A liée aux récepteurs est endocytosée dans la terminaison nerveuse avant d'atteindre sa cible (SNAP 25) puis est ensuite dégradée dans la cellule. Les molécules de neurotoxine botulinique de type A circulantes non liées aux récepteurs présynaptiques des terminaisons nerveuses cholinergiques, subissent un processus de phagocytose ou de pinocytose et sont dégradées comme toute autre protéine libre circulante.
Distribution
Pour les raisons précisées ci-dessus, aucune étude pharmacocinétique avec BOCOUTURE n'a été conduite chez l'homme.
5.3. Données de sécurité préclinique
Les données retrouvées chez l'animal dans les études de toxicité à doses répétées sont principalement liées à l’action pharmacodynamique de BOCOUTURE (ex : atonie, parésie ou atrophie du muscle ayant reçu l’injection).
Aucun signe d'intolérance locale n'a été noté. Dans une étude de reproduction, BOCOUTURE n'a pas montré d'effet indésirable sur la fertilité chez le lapin mâle ou femelle, ni d'effet direct sur le développement embryo-fœtal ou sur le développement pré- et post-natal chez le rat et/ou le lapin. Cependant, l'administration de BOCOUTURE à une femelle à des intervalles de temps variables (quotidien ou moins fréquemment) et à des doses exposant la femelle à une perte de poids, a montré une augmentation du nombre d'avortements chez le lapin et une légère diminution du poids du fœtus chez le rat. Pendant la phase sensible (inconnue) de l'organogenèse de femelles gravides, une exposition systémique continue, considérée comme prérequis pour l'induction d'effets tératogènes, ne laisse pas nécessairement supposer de tels effets. En conséquence, les marges de sécurité étaient généralement faibles pour de fortes doses utilisées en clinique.
Aucune étude de génotoxicité, ou de carcinogénicité n'a été conduite avec BOCOUTURE.
Saccharose
3 ans
Solution reconstituée
La stabilité physico-chimique a été démontrée pendant 24 heures entre 2°C et 8°C.
Toutefois, d’un point de vue microbiologique, le produit doit être utilisé immédiatement. En cas d’utilisation non immédiate, les durées et conditions de conservation après reconstitution du produit et avant utilisation relèvent de la seule responsabilité de l’utilisateur et ne devraient pas dépasser 24 heures à une température comprise entre 2°C et 8°C sauf en cas de reconstitution réalisée en conditions d’asepsie dûment contrôlées et validées.
6.4. Précautions particulières de conservation
A conserver à une température ne dépassant pas 25°C.
Pour les conditions de conservation du médicament après reconstitution, voir la rubrique 6.3.
6.5. Nature et contenu de l'emballage extérieur
Flacon (verre de type I), muni d'un bouchon (caoutchouc bromobutyle) et d'une bague de sécurité (aluminium).
Boîtes de 1, 2, 3 ou 6 flacons.
Toutes les présentations peuvent ne pas être commercialisées.
6.6. Précautions particulières d’élimination et de manipulation
Reconstitution
Avant utilisation, BOCOUTURE est reconstitué avec une solution injectable de chlorure de sodium à 9 mg/ml (0,9 %).
La reconstitution et la dilution doivent être réalisées selon les bonnes pratiques cliniques, notamment dans le respect de l'asepsie.
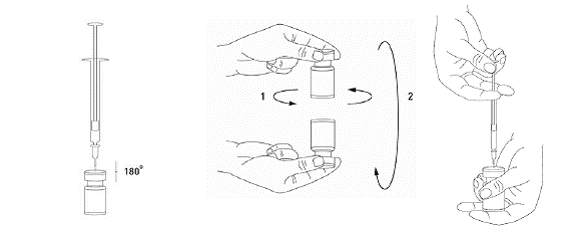
Il est de bonne pratique de reconstituer le produit et de préparer les seringues sur un support papier doublé de plastique pour récupérer tout déversement. Une quantité appropriée de chlorure de sodium est aspirée dans une seringue. Une aiguille courte en biseau de 20-27G est recommandée pour la reconstitution. Après insertion verticale de l’aiguille à travers le bouchon en caoutchouc, le solvant est injecté délicatement dans le flacon afin d’éviter la formation de mousse. Le flacon doit être jeté si la dépression n'entraîne pas l'aspiration du solvant à l'intérieur du flacon. Retirer la seringue du flacon et mélanger délicatement BOCOUTURE au solvant par des mouvements circulaires et par retournement du flacon. Ne pas mélanger vigoureusement. Si besoin, l’aiguille ayant servi à la reconstitution de la solution peut rester en place ; toutefois, une nouvelle seringue stérile compatible avec le volume d’injection doit être utilisée.
|
|
Une fois reconstitué, BOCOUTURE est une solution limpide et incolore.
BOCOUTURE ne doit pas être utilisé si la solution reconstituée est trouble ou contient des particules ou des matières floconneuses.
Les dilutions possibles de BOCOUTURE 50 unités sont indiquées dans le tableau ci-dessous :
|
Doses obtenues (unités par 0,1 ml) |
Volume de solvant ajouté (solution injectable de chlorure de sodium 9 mg/ml (0,9%) |
|
Flacon de 50 unités |
|
|
5 unités |
1 ml |
|
4 unités |
1,25 ml |
Toute solution injectable qui a été conservée durant plus de 24 heures ainsi que toute solution non utilisée doivent être éliminées.
Procédure à suivre pour une élimination en toute sécurité des flacons, des seringues et matériels utilisés.
Tous les flacons inutilisés ou contenant de la solution et/ou les seringues peuvent être autoclavés. La solution reconstituée de BOCOUTURE inutilisée peut également être inactivée par ajout de l’une des solutions suivantes : éthanol à 70%, isopropanol à 50%, laurylsulfate de sodium à 0,1% (détergent anionique), solution diluée d'hydroxyde de sodium (NaOH 0,1N) ou solution diluée d'hypochlorite de sodium (NaOCl à au moins 0,1%).
Les flacons, les seringues et matériels ne doivent pas être vidés mais doivent être placés dans des récipients adaptés pour être éliminés conformément à la réglementation locale en vigueur.
Recommandations en cas d'incident lors de la manipulation de la toxine botulinique de type A
· Toute projection doit être essuyée avec un matériel absorbant imbibé d'une des solutions listées ci-dessus pour la poudre ou bien avec un matériel absorbant sec pour le produit reconstitué.
· Les surfaces contaminées sont nettoyées avec un matériel absorbant, imbibé d'une des solutions listées ci-dessus puis séchées.
· En cas de bris de flacon, procéder comme indiqué ci-dessus au ramassage méticuleux des particules de verre et essuyer le produit, en évitant toute coupure cutanée.
· En cas de contact avec la peau, rincer la zone touchée abondamment à l'eau.
· En cas de contact avec les yeux, rincer abondamment avec de l'eau ou avec une solution pour lavage ophtalmique.
· En cas de contact du produit avec une blessure, une coupure ou une piqûre, rincer abondamment avec de l'eau et prendre les mesures médicales appropriées en fonction de la dose injectée.
Ces instructions d'utilisation, de manipulation et d'élimination doivent être scrupuleusement suivies.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
ECKENHEIMER LANDSTRASSE 100
60318 FRANCFORT AM MAIN
ALLEMAGNE
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 494 931 0 4 : poudre en flacon (verre de type 1), muni d’un bouchon (caoutchouc bromobutyle) et d’une bague de sécurité (aluminium). Boîte de 2 flacons.
· 34009 494 932 7 2 : poudre en flacon (verre de type 1), muni d’un bouchon (caoutchouc bromobutyle) et d’une bague de sécurité (aluminium). Boîte de 3 flacons.
· 34009 494 933 3 3 : poudre en flacon (verre de type 1), muni d’un bouchon (caoutchouc bromobutyle) et d’une bague de sécurité (aluminium). Boîte de 6 flacons.
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Liste I.
Médicament réservé à l'usage professionnel selon l'article R 5121-80 du Code la Santé Publique.
Prescription réservée aux spécialistes en chirurgie plastique, reconstructrice et esthétique, en dermatologie, en chirurgie de la face et du cou, en chirurgie maxillo-faciale et en ophtalmologie.
ANSM - Mis à jour le : 04/07/2025
BOCOUTURE 50 unités poudre pour solution injectable
Toxine botulinique de type A (150 kD), sans protéines complexantes
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin ou votre pharmacien.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
2. Quelles sont les informations à connaître avant d'utiliser BOCOUTURE 50 unités poudre pour solution injectable ?
3. Comment utiliser BOCOUTURE 50 unités poudre pour solution injectable ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver BOCOUTURE 50 unités poudre pour solution injectable ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE BOCOUTURE 50 unités poudre pour solution ET DANS QUELS CAS EST-IL UTILISE ?
Classe pharmacothérapeutique : Code ATC : M03AX01
BOCOUTURE est indiqué dans la correction temporaire des rides du tiers supérieur du visage chez l'adulte de moins de 65 ans, lorsque la sévérité de ces rides entraîne un retentissement psychologique important chez le patient :
· rides verticales inter sourcilières modérées à sévères observées lors du froncement maximal des sourcils et/ou
· rides latérales périorbitaires modérées à sévères observées lors d’un sourire forcé et/ou
· rides horizontales du front modérées à sévères observées lors du haussement maximal des sourcils.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D’UTILISER BOCOUTURE 50 unités poudre pour solution injectable ?
N’utilisez jamais BOCOUTURE 50 unités poudre pour solution injectable :
· Si vous êtes allergique (hypersensible) à la neurotoxine botulinique de type A ou à l'un des autres composants contenus dans ce médicament, mentionnés dans la rubrique 6 ;
· Si vous souffrez d’un trouble généralisé de l'activité musculaire (par ex : myasthénie grave, syndrome de Lambert-Eaton) ;
· Si vous présentez une infection ou une inflammation au site d'injection concerné.
Avertissements et précautions
En cas d’injection mal ciblée de neurotoxine botulinique de type A, des effets indésirables paralysant temporairement les muscles à proximité du site d’injection peuvent être observés. De très rares cas d’effets indésirables liés à la diffusion de la toxine à distance du site d'injection - de type faiblesse musculaire excessive, difficultés à avaler ou fausses routes accidentelles dans les poumons - ont été rapportés. Les patients qui reçoivent les doses recommandées peuvent ressentir une faiblesse musculaire excessive.
Contactez immédiatement votre médecin pour une surveillance médicale si vous présentez l’un des symptômes suivants :
· des difficultés à respirer, à déglutir ou à parler.
· en cas d’urticaire, de gonflement, y compris de la face ou de la gorge, de sifflement, de sensation d’évanouissement, d’essoufflement (symptômes possibles d’une réaction allergique sévère). (voir rubrique 4)
Si la dose est trop forte ou si les injections sont trop fréquentes, le risque de formation d'anticorps augmente. La formation d'anticorps peut entraîner un échec au traitement par la toxine botulinique de type A même si elle est utilisée dans d'autres indications.
Informez votre médecin avant d’utiliser BOCOUTURE :
· Si vous souffrez de tout type de trouble hémorragique ;
· Si vous recevez des substances qui empêchent le sang de coaguler (coumarine, héparine, aspirine, clopidogrel) ;
· Si vous souffrez de faiblesse importante ou d’une diminution du volume du muscle dans lequel les injections seront effectuées ;
· Si vous souffrez de sclérose latérale amyotrophique pouvant conduire à un affaiblissement musculaire généralisé ;
· Si vous souffrez d'autres maladies qui atteignent les nerfs et les muscles (dysfonctionnement neuromusculaire périphérique) ;
· Si vous avez ou avez eu des difficultés pour avaler ;
· Si vous avez déjà rencontré des problèmes à la suite d'un traitement par toxine botulinique de type A ;
· Si vous allez être opéré.
Injections répétées de BOCOUTURE
En cas d'injections répétées de BOCOUTURE, l'effet thérapeutique du produit peut augmenter ou diminuer. Les raisons possibles sont :
· différentes techniques de préparation du produit par votre médecin ;
· différents intervalles de traitement
· des injections dans d'autres muscles ;
· une non-réponse thérapeutique ou un échec en cours de traitement.
Personnes âgées
L’information concernant l’utilisation de ce médicament chez des patients de plus de 65 ans est limitée. Par conséquent, BOCOUTURE ne doit pas être utilisé chez des patients de plus de 65 ans.
Enfants et adolescents
BOCOUTURE n’est pas recommandé chez les enfants et les adolescents de moins de 18 ans.
Autres médicaments et BOCOUTURE 50 unités poudre pour solution injectable
Informez votre médecin ou votre pharmacien si vous prenez, avez récemment pris ou pourriez prendre tout autre médicament.
L'effet de BOCOUTURE peut être augmenté par :
· des médicaments utilisés pour traiter certaines maladies infectieuses (spectinomycine ou antibiotiques de type aminoside, tels que néomycine, kanamycine et tobramycine) ;
· les médicaments qui relaxent les muscles (par exemple les myorelaxants de type tubocurarine). Ces médicaments sont utilisés par exemple au cours d'une anesthésie générale. Avant une intervention chirurgicale, prévenez votre anesthésiste si vous avez été traité avec BOCOUTURE.
Dans ces cas, BOCOUTURE doit être utilisé avec prudence.
L'effet de BOCOUTURE peut être réduit par certains médicaments destinés à traiter le paludisme et les rhumatismes (aminoquinoléines).
BOCOUTURE 50 unités poudre pour solution injectable avec des aliments et boissons
Grossesse, allaitement et fertilité
Si vous êtes enceinte ou que vous allaitez, si vous pensez être enceinte ou que vous planifiez une grossesse, demandez conseil à votre médecin ou à votre pharmacien avant de prendre ce médicament.
BOCOUTURE ne devrait pas être utilisé pendant la grossesse. Votre médecin décidera de la nécessité et du bénéfice potentiel de ce traitement par rapport aux possibles risques pour le fœtus.
BOCOUTURE n'est pas recommandé pendant l'allaitement.
Sportifs
Sans objet.
Conduite de véhicules et utilisation de machines
Vous ne devez pas conduire ou avoir des activités potentiellement dangereuses en cas d’affaissement des paupières, de faiblesse (asthénie), de faiblesse musculaire, de vertiges ou de troubles de la vision.
En cas de doute, demandez conseil à votre médecin.
BOCOUTURE 50 unités poudre pour solution injectable contient du saccharose et de l’albumine humaine
3. COMMENT UTILISER BOCOUTURE 50 unités poudre pour solution injectable ?
Rides verticales intersourcilières (rides glabellaires) observées lors du froncement maximal des sourcils
Pour le traitement des rides intersourcilières (rides glabellaires) observées lors du froncement maximal des sourcils, la dose totale recommandée est de 20 unités. Votre médecin vous injectera 4 unités dans chacun des 5 sites d'injection. Votre médecin peut augmenter la dose totale à 30 unités si nécessaire en respectant un intervalle d'au moins 3 mois entre les séances de traitement.
L'effet du traitement sur la réduction des rides verticales intersourcilières observées lors du froncement maximal des sourcils apparaît en général en 2 à 3 jours, l'effet maximal étant observé à 30 jours. L'effet du traitement persiste jusqu'à 4 mois après l'injection.
Rides latérales périorbitaires (rides de la patte d’oie) observées lors d’un sourire forcé
Pour le traitement des rides verticales périorbitaires (rides de la patte d’oie) observées lors d’un sourire forcé, la dose totale recommandée est de 24 unités (12 unités par œil). Votre médecin vous injectera 4 unités de chaque côté des yeux en 3 points différents.
L’effet du traitement sur la réduction des rides latérales périorbitaires observées lors d’un sourire forcé apparaît dans les 6 jours, avec un effet maximal à 30 jours. L’effet du traitement persiste jusqu’à 4 mois après l’injection.
Rides horizontales du front observées lors du haussement maximal des sourcils
Pour le traitement des rides horizontales du front observées lors du haussement maximal des sourcils, votre médecin utilisera une dose entre 10 et 20 unités selon vos besoins individuels. La dose totale recommandée est de 10 à 20 unités réparties en 5 points alignés horizontalement soit 2 unités, 3 unités ou 4 unités respectivement par point d’injection.
L’effet du traitement apparaît généralement dans les 7 jours qui suivent l’injection avec un effet maximal à 30 jours. L’effet du traitement persiste jusqu’à 4 mois après l’injection.
Méthode d’administration
La solution reconstituée de BOCOUTURE est destinée à être injectée dans le muscle (voie intramusculaire ; se reporter à la fin de cette notice pour les informations destinées aux professionnels de la santé).
Les intervalles entre deux traitements ne doivent pas être inférieurs à 3 mois.
Si vous avez utilisé plus de BOCOUTURE 50 unités poudre pour solution injectable que vous n’auriez dû :
Les signes de surdosage ne sont pas visibles immédiatement après l'injection mais peuvent se traduire par une sensation de faiblesse généralisée, une chute de la paupière, une vision double, des difficultés à respirer, des difficultés d'élocution et une paralysie des muscles respiratoires ou des difficultés à avaler pouvant conduire à une pneumonie.
Mesures en cas de surdosage
Si vous ressentez ces symptômes, contacter immédiatement un service médical d'urgence ou demander à votre entourage de le faire afin de vous faire hospitaliser. Un contrôle médical pendant quelques jours, voire une assistance respiratoire, peut s'avérer nécessaire.
Si vous avez d’autres questions sur l’utilisation de ce médicament, demandez plus d’informations à votre médecin ou votre pharmacien.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Comme tous les médicaments, ce médicament peut provoquer des effets indésirables, mais ils ne surviennent pas systématiquement chez tout le monde.
Une réaction allergique peut survenir avec BOCOUTURE. Des réactions allergiques graves et/ou immédiates (anaphylaxie) ou des réactions allergiques à l’albumine contenue dans ce médicament peuvent par exemple être à l’origine de difficultés respiratoires (dyspnée), d’urticaire ou de gonflement des tissus mous (œdème), ont rarement été décrites. Certaines de ces réactions ont été observées à la suite d’un traitement par toxine botulinique de type A conventionnelle seule ou en association à d’autres produits connus pour causer des réactions similaires. Ces réactions ne peuvent être exclues lors de l’utilisation de BOCOUTURE.
Ces réactions peuvent se caractériser par un des symptômes suivants :
· difficultés à respirer ou à avaler, des difficultés d'élocution liées à un œdème de la face, des lèvres, de la bouche ou de la gorge ;
· gonflement des mains, des pieds ou des chevilles.
Si vous remarquez un de ces effets indésirables, informez immédiatement votre médecin ou allez au service d'urgence de l'hôpital le plus proche ou demandez à votre entourage de le faire.
Généralement, les effets indésirables se manifestent au cours de la première semaine suivant l'injection et sont transitoires Des effets indésirables peuvent être dus au médicament et/ou à la technique d'injection. Au site d'injection, l'action de la toxine botulinique de type A entraîne une faiblesse musculaire localisée. L'affaissement des paupières peut être causé par la technique d'injection et par l'effet du médicament.
Les réactions suivantes peuvent apparaître au site d'injection :
· douleur localisée;
· inflammation ;
· picotements ;
· engourdissement ;
· sensibilité modifiée ;
· démangeaisons ;
· gonflement (généralisé) ;
· gonflement des tissus mous (œdème) ;
· rougeurs cutanées (érythème) ;
· infection localisée ;
· hématome ;
· saignement ;
· ecchymose.
Chez les patients qui craignent les injections ou la douleur liée à la piqûre, des réactions générales temporaires peuvent être retrouvées telles que :
· perte de connaissance ;
· problèmes circulatoires ;
· nausée ;
· bourdonnements d'oreille.
Autres effets indésirables possibles
Les effets secondaires suivants ont été observés avec BOCOUTURE.
Rides verticales intersourcilières observées lors du froncement maximal des sourcils (rides glabellaires)
Fréquent (peut concerner jusqu’à 1 patient sur 10) :
· maux de tête ;
· effet Mephisto (élévation de la partie externe des sourcils).
Peu fréquent (peut concerner jusqu’à 1 patient sur 100) :
· rhinopharyngite ;
· bronchite ;
· syndrome pseudo-grippal ;
· affaissement des sourcils (ptose des sourcils);
· affaissement de la paupière (ptose des paupières) ;
· accumulation de liquide dans les paupières (œdème des paupières) ;
· gêne (sensation de paupières ou de sourcils lourds) ;vision floue ;
· contractions musculaires (spasme musculaire) ;
· Asymétrie des sourcils ;
· sensation de contraction au site d'injection ;
· fatigue ;
· douleur ou bleu au site d'injection ;
· prurit ;
· bleu ;
· nodule cutané ;
· insomnie.
Rides latérales périorbitaires observées lors d’un sourire forcé (rides de la patte d’oie)
Fréquent (peut concerner jusqu’à 1 patient sur 10) :
· gonflement de la paupière ;
· sécheresse oculaire ;
· hématome au site d’injection.
Rides du tiers supérieur du visage
Fréquent (peut concerner jusqu’à 1 patient sur 10) :
· maux de tête
· hématome au site d’injection
Peu fréquent (peut concerner jusqu’à 1 patient sur 100)
· engourdissement
· gêne (sensation de lourdeur au niveau du front)
· gonflement de la paupière
· affaissement des paupières (ptose des paupières)
· sécheresse oculaire
· affaissement des sourcils (ptose des sourcils)
· asymétrie du visage
· effet Mephisto (élévation de la partie externe des sourcils)
· nausée
Effets indésirables observés après commercialisation
Depuis la mise sur le marché de BOCOUTURE, les effets indésirables suivants ont été rapportés à une fréquence inconnue : syndrome pseudo-grippaux, diminution du volume du muscle injecté et des réactions allergiques telles qu'un gonflement et un gonflement des tissus mous (œdème), y compris à distance du site d’injection, une rougeur, des démangeaisons, un rash (local ou généralisé) ainsi que des cas d’essoufflement.
De très rares effets indésirables ont été observés lors du traitement par toxine botulinique de type A dans d’autres indications que les rides du tiers supérieur du visage (voir rubrique 2) :
· faiblesse musculaire excessive,
· difficultés à avaler,
· difficultés à avaler avec « fausses routes » entraînant une inflammation pulmonaire et, dans quelques cas, le décès.
Ces effets sont provoqués par le relâchement des muscles à distance du site d’injection.
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet: https://signalement.social-sante.gouv.fr/.
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER BOCOUTURE 50 unités poudre pour solution injectable ?
Tenir ce médicament hors de la vue et de la portée des enfants.
N’utilisez pas ce médicament après la date de péremption indiquée sur la boîte et sur l’étiquette du flacon après EXP. La date de péremption fait référence au dernier jour de ce mois.
Flacon non ouvert : à conserver à une température ne dépassant pas 25°C.
Après reconstitution : La stabilité physico-chimique de la solution reconstituée a été démontrée pendant 24 heures à une température comprise entre 2°C et 8°C.
Toutefois, d’un point de vue microbiologique, le produit doit être utilisé immédiatement. En cas d’utilisation non immédiate, les durées et conditions de conservation après reconstitution du produit et avant utilisation relèvent de la seule responsabilité de l’utilisateur et ne devraient pas dépasser 24 heures à une température comprise entre 2°C et 8°C à moins que le produit n’ait été reconstitué dans des conditions d’asepsie dûment contrôlées et validées.
Votre médecin ne doit pas utiliser BOCOUTURE si la solution reconstituée, conformément aux instructions, est trouble ou contient des particules visibles.
Ne jeter aucun médicament au tout-à-l’égout.
Pour les instructions relatives à l'élimination des déchets, reportez-vous à la rubrique correspondante destinée aux professionnels de santé et figurant à la fin de cette notice.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient BOCOUTURE 50 unités poudre pour solution injectable
· La substance active est :
Toxine botulinique de type A (150 kD) sans protéines complexantes.
1 flacon contient 50 unités de toxine botulinique de type A (150 kD) sans protéines complexantes.
· Les autres composants sont : l’albumine humaine, le saccharose.
Aspect de BOCOUTURE et contenu de l'emballage extérieur
BOCOUTURE est présenté sous forme de poudre pour solution injectable. La poudre est blanche.
La dissolution de la poudre donne une solution limpide et incolore.
Boîtes de 1, 2, 3 et 6 flacons.
Toutes les présentations peuvent ne pas être commercialisées.
Titulaire de l’autorisation de mise sur le marché
MERZ PHARMACEUTICALS GmbH
ECKENHEIMER LANDSTRASSE 100
60318 FRANKFURT AM MAIN
ALLEMAGNE
Exploitant de l’autorisation de mise sur le marché
2, AVENUE GAMBETTA
92400 COURBEVOIE
FRANCE
MERZ PHARMA GMBH & CO.KGAA
LUDWIGSTRASSE 22
64354 REINHEIM
ALLEMAGNE
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Ce médicament est autorisé dans les Etats membres de l'Espace Economique Européen sous les noms suivants : Conformément à la réglementation en vigueur.
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).
Les informations suivantes sont destinées exclusivement aux professionnels de
santé :
Reconstitution de la solution injectable
Avant utilisation, BOCOUTURE est reconstitué avec une solution injectable de chlorure de sodium à 9 mg/ml (0,9 %). BOCOUTURE est destiné à être utilisé pour le traitement d'un seul patient, au cours d'une même séance.
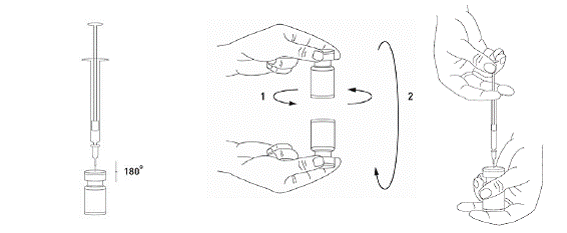
Il est de bonne pratique de reconstituer le produit et de préparer les seringues sur un support papier doublé de plastique pour récupérer tout déversement. Une quantité appropriée de solvant est aspirée dans une seringue. Une aiguille courte en biseau de 20-27G est recommandée pour la reconstitution. Après insertion verticale de l’aiguille à travers le bouchon en caoutchouc, le solvant est injecté délicatement dans le flacon afin d’éviter la formation de mousse. Le flacon doit être jeté si la dépression n'entraîne pas l'aspiration du solvant à l'intérieur du flacon.
Retirer la seringue du flacon et mélanger délicatement BOCOUTURE au solvant par des mouvements circulaires et par retournement du flacon. Ne pas mélanger vigoureusement. Si besoin, l’aiguille ayant servi à la reconstitution de la solution peut rester en place ; toutefois, une nouvelle seringue stérile compatible avec le volume d’injection doit être utilisée.
|
|
Une fois reconstitué, BOCOUTURE est une solution limpide et incolore.
BOCOUTURE ne doit pas être utilisé si la solution reconstituée (préparée comme indiqué ci-dessus) est trouble ou contient des particules ou des matières floconneuses.
Les dilutions possibles de BOCOUTURE 50 unités sont indiquées dans le tableau ci-dessous :
|
Doses obtenues (unités par 0,1 ml) |
Volume de solvant ajouté (solution injectable de chlorure de sodium 9 mg/ml (0,9%) |
|
Flacon de 50 unités |
|
|
5 unités |
1 ml |
|
4 unités |
1,25 ml |
Elimination
Toute solution injectable qui a été conservée durant plus de 24 heures ainsi que toute solution non utilisée doivent être éliminées.
Procédure à suivre pour une élimination en toute sécurité des flacons, des seringues et matériels utilisés
Tous les flacons inutilisés ou contenant de la solution et/ou les seringues peuvent être autoclavés. La solution reconstituée de Bocouture inutilisée peut également être inactivée par ajout de l’une des solutions suivantes : éthanol à 70%, isopropanol à 50%, laurylsulfate de sodium à 0,1% (détergent anionique), solution diluée d'hydroxyde de sodium (NaOH 0,1N) ou solution diluée d'hypochlorite de sodium (NaOCl à au moins 0,1%).
Après inactivation, les flacons, les seringues et matériels ne doivent pas être vidés mais doivent être placés dans des récipients adaptés pour être éliminés conformément à la réglementation en vigueur.
Recommandations en cas d'incident lors de la manipulation de la toxine botulique de type A
· Toute projection doit être essuyée avec un matériel absorbant imbibé d'une des solutions listées ci-dessus pour la poudre ou bien avec un matériel absorbant sec pour le produit reconstitué.
· Les surfaces contaminées sont nettoyées avec un matériel absorbant, imbibé d'une des solutions listées ci-dessus puis séchées.
· En cas de bris de flacon, procéder comme indiqué ci-dessus au ramassage méticuleux des particules de verre et essuyer le produit, en évitant toute coupure cutanée.
· En cas de contact avec la peau, rincer la zone touchée abondamment à l'eau.
· En cas de contact avec les yeux, rincer abondamment avec de l'eau ou avec une solution ophtalmique de rinçage oculaire.
· En cas de contact du produit avec une blessure, une coupure ou une piqûre, rincer abondamment avec de l'eau et prendre les mesures médicales appropriées en fonction de la dose injectée.
Ces instructions d'utilisation, de manipulation et d'élimination doivent être strictement respectées.