Dernière mise à jour le 02/02/2026
RIZATRIPTAN TEVA 10 mg, comprimé orodispersible
Présentations
> 12 plaquette(s) polyamide aluminium PVC-Aluminium de 1 comprimé(s)
Code CIP : 350 365-8 ou 34009 350 365 8 2
Déclaration de commercialisation : 19/08/2013
Cette présentation est agréée aux collectivités
- Prix hors honoraire de dispensation : 13,11 €
- Honoraire de dispensation : 1,02 €
- Prix honoraire compris : 14,13 €
- Taux de remboursement :65%
Service médical rendu (SMR)
Amélioration du service médical rendu (ASMR)
Ce médicament étant un générique, l'ASMR n'a pas été évalué par la commission de la transparence (CT), il est possible de se référer à la /aux spécialité(s) de référence du groupe générique auquel appartient ce médicament (cliquez ici pour aller à la rubrique des groupes génériques)
ANSM - Mis à jour le : 17/07/2024
RIZATRIPTAN TEVA 10 mg, comprimé orodispersible
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Benzoate de rizatriptan...................................................................................................... 14,53 mg
Equivalant à rizatriptan...................................................................................................... 10,00 mg
Pour un comprimé orodispersible
Substance à effet notoire :
Chaque comprimé orodispersible à 10 mg contient 4,5 mg de benzoate (sous forme de benzoate de rizatriptan).
Excipients à effet notoire :
Chaque comprimé orodispersible à 10 mg contient 2,0 mg d’aspartam.
Chaque comprimé orodispersible à 10 mg contient 110,20 mg de lactose.
Pour la liste complète des excipients, voir rubrique 6.1.
Comprimé orodispersible rond et plat, aux bords biseautés, de couleur blanc à blanc crème, gravé « IZ » sur une face et « 10 » sur l’autre.
4.1. Indications thérapeutiques
Traitement aigu de la phase céphalalgique des crises de migraine avec ou sans aura chez l’adulte.
4.2. Posologie et mode d'administration
RIZATRIPTAN TEVA ne doit pas être utilisé à titre prophylactique.
Adultes âgés de 18 ans et plus
La dose recommandée est de 10 mg.
Prise d’une deuxième dose : les prises doivent être espacées d'au moins 2 heures ; il ne faut pas dépasser 2 doses au total par période de 24 heures.
En cas de récidive de la céphalée dans les 24 heures : si la céphalée réapparaît après soulagement de la crise initiale, une dose supplémentaire peut être prise. Les doses limites précisées ci-dessus doivent être respectées.
En cas d'absence de réponse : lorsque la dose initiale est inefficace, l'efficacité d'une seconde dose pour le traitement de la même crise n'a pas été évaluée au cours d'essais contrôlés. Par conséquent, si un patient ne répond pas à la première dose, une seconde dose ne doit pas être prise pour la même crise.
Les essais cliniques ont montré que les patients ne répondant pas au traitement au cours d'une crise sont néanmoins susceptibles de répondre au traitement pour des crises ultérieures.
Certains patients doivent recevoir la dose plus faible de 5 mg derizatriptan, en particulier les groupes de patients suivants :
· patients sous propranolol. L'administration de rizatriptan doit être espacée d'au moins 2 heures de celle du propranolol (voir rubrique 4.5) ;
· patients ayant une insuffisance rénale légère à modérée ;
· patients ayant une insuffisance hépatique légère à modérée.
Les prises doivent être espacées d'au moins 2 heures ; il ne faut pas dépasser 2 doses au total par période de 24 heures.
Population pédiatrique
Enfants et adolescents (âgés de moins de 18 ans)
La sécurité et l'efficacité de RIZATRIPTAN TEVA chez les enfants et les adolescents âgés de moins de 18 ans n'ont pas encore été établies.
Les données actuellement disponibles sont décrites aux rubriques 5.1 et 5.2, mais aucune recommandation sur la posologie ne peut être donnée.
Personnes âgées
La sécurité d'emploi et l'efficacité du rizatriptan chez les patients âgés de plus de 65 ans n'ont pas été systématiquement évaluées.
Mode d’administration
Voie orale.
Il n’est pas nécessaire de prendre RIZATRIPTAN TEVA comprimé orodispersible avec du liquide.
Le comprimé orodispersible est conditionné sous plaquettes en aluminium. Les patients doivent être informés de ne sortir le comprimé orodispersible de la plaquette que juste avant la prise. La plaquette en aluminium doit être alors ouverte avec des mains sèches et le comprimé orodispersible doit être placé sur la langue afin qu'il se dissolve et qu'il soit avalé avec la salive.
Le comprimé orodispersible peut être utilisé dans les cas où il n’y a pas de boisson, ou pour éviter les nausées et les vomissements qui peuvent accompagner la prise de comprimés avec du liquide.
Hypersensibilité à la substance active ou à l’un des excipients mentionnés à la rubrique 6.1.
Administration concomitante avec des inhibiteurs de la monoamine oxydase (IMAO) ou utilisation au cours des deux semaines qui suivent l'arrêt d'un traitement avec un IMAO (voir rubrique 4.5).
Insuffisance hépatique sévère ou insuffisance rénale sévère.
Antécédents d'accident vasculaire cérébral (AVC) ou d'accident ischémique transitoire (AIT).
Hypertension artérielle modérée ou sévère, ou hypertension légère non contrôlée.
Maladie coronarienne avérée, incluant cardiopathie ischémique (angine de poitrine, antécédents d'infarctus du myocarde, ou ischémie silencieuse documentée), signes et symptômes de cardiopathie ischémique ou angor de Prinzmetal.
Maladie vasculaire périphérique.
Utilisation concomitante de rizatriptan et d’ergotamine, de dérivés de l'ergot de seigle (y compris le méthysergide) ou d'autres agonistes des récepteurs 5-HT1B/1D (voir rubrique 4.5).
4.4. Mises en garde spéciales et précautions d'emploi
RIZATRIPTAN TEVA ne doit pas être utilisé pour traiter des céphalées « atypiques », c'est-à-dire celles qui pourraient être associées à des pathologies potentiellement graves (par exemple AVC, rupture d'anévrisme) pour lesquelles une vasoconstriction cérébrovasculaire pourrait être dangereuse.
Le rizatriptan peut être associé à des symptômes transitoires comprenant des douleurs thoraciques ou une sensation d’oppression pouvant être intenses et pouvant s’étendre au niveau de la gorge (voir rubrique 4.8). Si la symptomatologie évoque une ischémie cardiaque, il ne faut pas prendre de doses supplémentaires et des explorations appropriées devront être réalisées.
Comme les autres agonistes des récepteurs 5-HT1B/1D, le rizatriptan ne doit pas être administré sans une évaluation préalable aux patients chez lesquels une maladie cardiaque non diagnostiquée est possible ou aux patients ayant un risque de maladie coronarienne (MC) (par exemple, les patients ayant une hypertension artérielle, les diabétiques, les fumeurs ou les consommateurs de substituts nicotiniques, les hommes âgés de plus de 40 ans, les femmes ménopausées, les patients ayant un bloc de branche, et ceux ayant des antécédents familiaux importants de MC). Le bilan cardiovasculaire peut ne pas identifier tous les patients qui ont une maladie cardiovasculaire et, dans de très rares cas, des événements cardiaques graves sont survenus chez des patients sans maladie cardiovasculaire sous-jacente lors de la prise d’agonistes des récepteurs 5-HT1. RIZATRIPTAN TEVA ne doit pas être administré chez les patients ayant une maladie coronarienne avérée (voir rubrique 4.3).
Les agonistes des récepteurs 5-HT1B/1D ont été associés à des vasospasmes des artères coronaires. Dans de rares cas, une ischémie myocardique ou un infarctus du myocarde ont été rapportés avec des agonistes des récepteurs 5-HT1B/1D dont le rizatriptan (voir rubrique 4.8).
D'autres agonistes 5-HT1B/1D (par exemple le sumatriptan) ne doivent pas être utilisés en association au RIZATRIPTAN TEVA (voir rubrique 4.5).
Il est conseillé d'attendre au moins 6 heures après la prise de rizatriptan, pour prendre des médicaments du type de l'ergotamine (par exemple ergotamine, dihydro-ergotamine ou méthysergide). 24 heures au moins doivent s’écouler après la prise d'un médicament contenant de l'ergotamine avant de prendre du rizatriptan. Bien que l’on n’ait pas observé d’effets vasospastiques additifs lors d'une étude de pharmacologie clinique chez 16 sujets masculins volontaires sains recevant du rizatriptan par voie orale et de l'ergotamine par voie parentérale, de tels effets additifs sont théoriquement possibles (voir rubrique 4.3).
Un syndrome sérotoninergique (incluant troubles de la conscience, dysautonomie et troubles neuromusculaires) a été rapporté lors de l’utilisation concomitante d’un traitement par triptans et des inhibiteurs sélectifs de la recapture de la sérotonine (ISRS) ou des inhibiteurs de la recapture de la sérotonine et de la noradrénaline (IRSN) – troubles qui peuvent être sévères. Si un traitement associant le rizatriptan et les ISRS/IRSN s’avère cliniquement nécessaire, une surveillance appropriée du patient est conseillée, particulièrement lors de l’instauration du traitement, lors de l’augmentation des doses ou lors de l’ajout d’un autre médicament sérotoninergique (voir rubrique 4.5).
Des effets indésirables peuvent être plus fréquents lors de l’utilisation concomitante de triptans (agonistes 5-HT1B/1D) et de préparations à base de plantes contenant du millepertuis (Hypericum perforatum).
Des cas d’angio-œdème (par exemple œdème de la face, de la langue ou du pharynx) peuvent être observés chez les patients traités par triptans, y compris par rizatriptan. En cas d’œdème de la langue ou du pharynx, le patient doit être mis sous surveillance médicale jusqu’à la disparition des symptômes. Le traitement doit être immédiatement arrêté et remplacé par un produit d’une autre classe thérapeutique.
La possibilité d'une interaction doit être envisagée lorsque le rizatriptan est administré chez des patients prenant des substrats du CYP 2D6 (voir rubrique 4.5).
Céphalée par abus médicamenteux (CAM)
L'utilisation prolongée d'un traitement antalgique pour traiter les céphalées peut entraîner une aggravation de celles-ci. Si ce type d’abus est avéré ou suspecté, un avis médical est nécessaire et le traitement doit être interrompu. Le diagnostic de céphalée par abus médicamenteux (CAM) doit être suspecté chez les patients présentant des céphalées fréquentes ou quotidiennes malgré (ou à cause de) l’utilisation régulière d’un traitement antimigraineux.
Substance
Benzoate
Ce médicament contient 4,5 mg de benzoate (sous forme de benzoate de rizatriptan) par comprimé orodispersible.
Excipient(s)
Lactose
Les patients présentant une intolérance au galactose, un déficit total en lactase ou un syndrome de malabsorption du glucose et du galactose (maladies héréditaires rares) ne doivent pas prendre ce médicament.
Aspartam (E 951)
L’aspartam est hydrolysé dans le tube gastro-digestif lorsqu’il est ingéré par voie orale. L’un des principaux produits de l’hydrolyse est la phénylalanine.
Sodium
Ce médicament contient moins de 1 mmol (23 mg) de sodium par comprimé orodispersible, c.-a-d. qu’il est essentiellement ≪ sans sodium ≫.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
En raison de leur effet additif, l’utilisation concomitante de rizatriptan et d’ergotamine, de dérivés de l’ergot de seigle (y compris méthysergide), ou d’autres agonistes 5-HT1B/1D (par exemple : sumatriptan, zolmitriptan, naratriptan) augmente le risque de vasoconstriction artérielle coronaire et d’hypertension artérielle. Cette association est contre-indiquée (voir rubrique 4.3).
Inhibiteurs de la monoamine oxydase
Le rizatriptan est principalement métabolisé par la monoamine oxydase de sous-type « A » (MAO-A). Les concentrations plasmatiques de rizatriptan et de son métabolite actif, le N-monodesméthyle, ont été augmentées par l'administration concomitante d'un inhibiteur sélectif réversible de la monoamine oxydase-A. Des effets similaires ou plus importants sont attendus avec des inhibiteurs non sélectifs réversibles (par exemple linézolide) et irréversibles de la MAO. En raison du risque de vasoconstriction artérielle coronaire et d’hypertension artérielle, l'administration de RIZATRIPTAN TEVA à des patients prenant des IMAO est contre-indiquée (voir rubrique 4.3).
Bêta-bloquants
Les concentrations plasmatiques de rizatriptan peuvent être augmentées par l'administration concomitante de propranolol. Cette augmentation est due le plus probablement à une interaction métabolique de premier passage entre les deux médicaments, car la MAO-A joue un rôle à la fois dans le métabolisme du rizatriptan et du propranolol. Cette interaction entraîne une augmentation moyenne de l’aire sous la courbe (ASC) et de la Cmax de 70-80 %. Chez les patients recevant du propranolol, il faut utiliser la dose de 5 mg de rizatriptan (voir rubrique 4.2).
Dans une étude d'interaction médicamenteuse, le nadolol et le métoprolol n'ont pas modifié les concentrations plasmatiques du rizatriptan.
Inhibiteurs sélectifs de la recapture de la sérotonine (ISRS) / inhibiteurs de la recapture de la sérotonine et de la noradrénaline (IRSN) et syndrome sérotoninergique
Des cas de patients présentant des symptômes compatibles avec un syndrome sérotoninergique (incluant troubles de la conscience, dysautonomie et troubles neuromusculaires) consécutifs à l’association d’inhibiteurs sélectifs de la recapture de la sérotonine (ISRS) ou d’inhibiteurs de la recapture de la sérotonine et de la noradrénaline (IRSN) et des triptans ont été décrits (voir rubrique 4.4).
Des études in vitro montrent que le rizatriptan inhibe le cytochrome P450 2D6 (CYP 2D6). Les données cliniques d'interaction ne sont pas disponibles. La possibilité d'une interaction doit être envisagée lorsque le rizatriptan est administré à des patients prenant des substrats du CYP 2D6.
4.6. Fertilité, grossesse et allaitement
Fertilité
Les effets sur la fertilité humaine n'ont pas été étudiés. Les études chez l'animal n'ont fait apparaître que des effets minimes sur la fertilité à des concentrations plasmatiques excédant de loin les concentrations thérapeutiques chez l’homme (plus de 500 fois).
Grossesse
Un nombre modéré de données sur les femmes enceintes (entre 300 et 1000 issues de grossesse) n’indiquent pas de toxicité malformative après l’exposition au premier trimestre. Les études chez l’animal n’indiquent pas de toxicité pour la reproduction (voir rubrique 5.3).
Il existe peu de données sur l’utilisation du rizatriptan au cours des deuxième et troisième trimestres de la grossesse. L’utilisation du rizatriptan peut être envisagée pendant la grossesse, si cela est cliniquement nécessaire.
Le rizatriptan est excrété en faible concentration dans le lait maternel avec en moyenne une dose relative reçue par l’enfant inférieure à < 1 % (moins de 6 % dans le pire des cas, selon la Cmax (concentration maximale) dans le lait maternel). Une prudence est de rigueur en cas d'administration du rizatriptan à des femmes qui allaitent. L'exposition du nourrisson peut être minimisée en évitant d'allaiter pendant 12 heures après le traitement.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Le rizatriptan (en comprimé et lyophilisat oral) a été évalué chez 8 630 patients adultes au cours d'études cliniques contrôlées dont la durée pouvait atteindre un an. Les effets indésirables les plus fréquents au cours des essais cliniques ont été : étourdissements, somnolence et asthénie/fatigue. Les effets indésirables suivants ont été rapportés lors des études cliniques et/ou après la commercialisation :
Très fréquent (≥ 1/10), fréquent (≥ 1/100, < 1/10), peu fréquent (≥ 1/1 000, < 1/100), rare (≥ 1/10 000, < 1/1 000), très rare (< 1/10 000), fréquence indéterminée (ne peut être estimée sur la base des données disponibles).
Affections du système immunitaire
Rare : Réactions d’hypersensibilité, anaphylaxie/réaction anaphylactoïde.
Affections psychiatriques
Fréquent : insomnie
Peu fréquent : désorientation, nervosité.
Affections du système nerveux
Fréquent : étourdissements, somnolence, paresthésie, céphalées, hypoesthésie, diminution de l'acuité mentale.
Peu fréquent : ataxie, vertige, dysgueusie/sensation de mauvais goût, tremblement, syncope.
Fréquence indéterminée : convulsions, syndrome sérotoninergique.
Affections oculaires
Peu fréquent : vision trouble.
Affections cardiaques
Fréquent : palpitations.
Peu fréquent : arythmie, anomalies de l’électrocardiogramme, tachycardie
Rare : accident vasculaire cérébral (la plupart de ces effets indésirables ont été rapportés chez des patients ayant des facteurs de risque prédictifs d’une maladie coronarienne), bradycardie.
Fréquence indéterminée : ischémie myocardique ou infarctus du myocarde (la plupart de ces effets indésirables ont été rapportés chez des patients ayant des facteurs de risque prédictifs d’une maladie coronarienne).
Affections vasculaires
Peu fréquent : hypertension artérielle, bouffées de chaleur
Fréquence indéterminée : ischémie vasculaire périphérique.
Affections respiratoires, thoraciques et médiastinales
Fréquent : gêne pharyngée.
Peu fréquent : dyspnée.
Rare : respiration sifflante.
Affections gastro-intestinales
Fréquent : nausées, sécheresse de la bouche, vomissements, diarrhée, dyspepsie.
Peu fréquent : soif.
Fréquence indéterminée : colite ischémique.
Affections de la peau et du tissu sous-cutané
Fréquent : bouffée vasomotrice.
Peu fréquent : prurit, urticaire, angio-œdème (par exemple œdème de la face, de la langue, du pharynx) (pour l’angio-œdème, voir aussi rubrique 4.4), rash, sueurs.
Fréquence indéterminée : nécrolyse épidermique toxique.
Affections musculo-squelettiques et systémiques
Fréquent : sensations de lourdeur localisées, douleur dans le cou, raideur.
Peu fréquent : oppression localisée, faiblesse musculaire, douleur de la face, myalgie.
Troubles généraux et anomalies au site d’administration
Fréquent : asthénie/fatigue, douleur abdominale ou thoracique.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/.
Le rizatriptan à la dose de 40 mg (administré soit en une prise unique soit en deux prises avec un intervalle de 2 heures entre les prises) a été généralement bien toléré chez plus de 300 patients adultes ; les étourdissements et la somnolence ont été les événements indésirables les plus fréquents ayant une relation de cause à effet avec le médicament.
Dans une étude de pharmacologie clinique au cours de laquelle 12 sujets adultes ont reçu du rizatriptan à des doses totales cumulées de 80 mg (administrées sur une période de 4 heures), 2 sujets ont présenté une syncope et/ou une bradycardie.
Un sujet, une femme âgée de 29 ans, a présenté des vomissements, une bradycardie et des étourdissements qui ont commencé 3 heures après avoir reçu 80 mg de rizatriptan au total (administrés sur une période de 2 heures). Un bloc auriculo-ventriculaire du 3ème degré, ayant répondu à l'atropine, a été observé une heure après le début des autres symptômes. Le second sujet, un homme âgé de 25 ans, a présenté un étourdissement transitoire, une syncope, une incontinence et une pause systolique de 5 secondes (au monitoring ECG) immédiatement après une ponction veineuse douloureuse. La ponction veineuse avait été effectuée 2 heures après que le sujet eut reçu un total de 80 mg de rizatriptan (administrés sur une période de 4 heures).
De plus, d'après la pharmacologie du rizatriptan, une hypertension artérielle ou d'autres symptômes cardiovasculaires plus graves pourraient survenir après surdosage. Une épuration gastro-intestinale (par exemple un lavage gastrique suivi de l'administration de charbon actif) doit être envisagée lorsque l'on suspecte un surdosage au RIZATRIPTAN TEVA. Une surveillance clinique et électrocardiographique doit être poursuivie pendant au moins 12 heures, même si l'on n'observe pas de signes cliniques.
Les effets de l'hémodialyse ou de la dialyse péritonéale sur les concentrations sériques de rizatriptan sont inconnus.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Mécanisme d’action
Agonistes sélectifs des récepteurs de la sérotonine (5HT1B/1D)
Le rizatriptan se lie sélectivement avec une grande affinité aux récepteurs humains 5-HT1B et 5-HT1D et a peu ou pas d'effet ni d'activité pharmacologique sur les récepteurs 5-HT2, 5-HT3, sur les récepteurs alpha1, alpha2 ou bêta-adrénergiques, dopaminergiques D1 ou D2, histaminergiques H1, muscariniques ou benzodiazépiniques.
L'activité thérapeutique du rizatriptan sur la migraine peut être attribuée à ces effets agonistes au niveau des récepteurs 5-HT1B et 5-HT1D des vaisseaux sanguins intracrâniens extra-cérébraux dont on suppose qu'ils se dilatent lors d'une crise de migraine et sur les voies nerveuses sensitives trigéminées les innervant. L'activation de ces récepteurs 5-HT1B et 5-HT1D peut entraîner la constriction des vaisseaux sanguins intracrâniens responsables de la douleur et l'inhibition de la libération de neuropeptides ; cette inhibition entraîne une diminution de l'inflammation dans les tissus sensibles et de la transmission du signal de la douleur au niveau central par la voie trigéminée.
Effets pharmacodynamiques
Adultes
L'efficacité du rizatriptan, lyophilisat oral dans le traitement aigu des crises de migraine a été établie dans deux études multicentriques, randomisées, contrôlées contre placebo dont le plan était similaire à celui des études réalisées avec les comprimés de rizatriptan.
Dans une étude (n = 311), deux heures après la prise, le pourcentage de patients soulagés dans le groupe de patients traités par rizatriptan a été approximativement de 66 % pour le rizatriptan 5 mg et 10 mg, comparé à 47 % dans le groupe de patients sous placebo. Dans une étude plus vaste (n = 547), deux heures après la prise, le pourcentage de patients soulagés a été de 59 % dans le groupe de patients traités par rizatriptan dosé à 5 mg, et de 74 % dans le groupe de patients traités par rizatriptan dosé à 10 mg, comparé à 28 % dans le groupe placebo.
Le rizatriptan a soulagé également l'incapacité fonctionnelle, les nausées, la photophobie et la phonophobie associées aux crises de migraine. Un effet significatif sur le soulagement de la douleur a été observé dès 30 minutes après la prise dans une des deux études cliniques avec la dose de 10 mg (voir rubrique 5.2).
Sur la base d’études réalisées avec la présentation en comprimés, le rizatriptan reste efficace dans les crises de migraine survenant pendant la période des règles, c’est-à-dire 3 jours avant ou après le début des règles.
Population pédiatrique
Adolescents (âgés de 12 à 17 ans)
L'efficacité de rizatriptan, lyophilisat oral chez des patients pédiatriques (âgés de 12 à 17 ans) a été évaluée dans une étude multicentrique, randomisée, en double aveugle, versus placebo en groupes parallèles (n = 570). La population de patients devait avoir des antécédents de non réponse au traitement par AINS ou par paracétamol. Les patients ayant des céphalées qualifiées de migraines recevaient initialement le placebo ou le rizatriptan dans les 30 minutes suivant l'apparition des symptômes. Les patients inclus dans le bras placebo qui après 15 minutes n'avaient pas répondu étaient alors traités par du placebo ou du rizatriptan pour une crise de migraine. En utilisant une posologie basée sur le poids, les patients de 20 kg à < 40 kg recevaient une dose de 5 mg de rizatriptan, et ceux de 40 kg ou plus recevaient une dose de 10 mg de rizatriptan.
Dans cette étude portant sur une population enrichie, une différence de 9 % entre le traitement actif et le placebo a été observée sur le critère principal d'efficacité, à savoir la disparition de la douleur (diminution de la douleur de sévère ou modérée à aucune douleur) 2 heures après le traitement (31 % sous rizatriptan contre 22 % sous placebo (p = 0,025)).
Aucune différence significative n'a été trouvée sur le critère secondaire d'efficacité, à savoir le soulagement de la douleur (diminution de la douleur sévère ou modérée en douleur légère ou aucune douleur).
Enfants (âgés de 6 à 11 ans)
L'efficacité de rizatriptan, lyophilisat oral a également été évaluée chez des patients pédiatriques âgés de 6 à 11 ans, dans le même essai clinique en phase aiguë, contrôlé contre placebo (n = 200). Le pourcentage de patients n'ayant plus de douleurs 2 heures après le traitement n'a pas été significativement différent sur le plan statistique chez les patients qui ont reçu du rizatriptan, lyophilisat oral 5 et 10 mg, comparé à ceux qui ont reçu du placebo (39,8 % contre 30,4 %, p = 0,269).
RIZATRIPTAN TEVA, comprimé orodispersible permet aux patients migraineux de traiter leurs crises de migraine sans devoir avaler de boissons. Cela peut permettre aux patients de prendre leur médicament plus tôt, par exemple, lorsqu’ils ne disposent pas de liquides, et leur éviter une aggravation possible des symptômes gastro-intestinaux liée à la prise de liquides.
5.2. Propriétés pharmacocinétiques
Le rizatriptan est rapidement et complètement absorbé après administration orale.
La biodisponibilité orale moyenne du comprimé orodispersible est d'environ 40-45 %, et les concentrations plasmatiques maximales moyennes (Cmax) sont atteintes en 1,58 heures environ (Tmax). La concentration plasmatique maximale après administration de rizatriptan sous forme de comprimé orodispersible est retardé de 30 à 60 minutes par rapport aucomprimé.
Alimentation
L’effet de l’alimentation sur l’absorption du rizatriptan en comprimé orodispersible n’a pas été étudié. Pour les comprimés de rizatriptan, le Tmax est retardé d’environ 1 heure quand les comprimés sont administrés après administration de nourriture. Un retard supérieur dans le délai d’absorption est possible quand le comprimé orodispersible est administré après les repas.
Distribution
Le rizatriptan est peu lié (14 %) aux protéines plasmatiques. Le volume de distribution est d'environ 140 litres chez l'homme, et 110 litres chez la femme.
Biotransformation
Le métabolisme du rizatriptan se fait principalement par désamination oxydative par la monoamine oxydase-A (MAO-A) en un métabolite indole acide acétique, qui n'est pas pharmacologiquement actif. Le N-monodesméthyl-rizatriptan, un métabolite ayant une activité similaire à celle de la molécule mère au niveau des récepteurs 5HT1B/1D, est formé à un degré mineur mais ne contribue pas significativement à l'activité pharmacodynamique du rizatriptan. Les concentrations plasmatiques de N-monodesméthyl-rizatriptan atteignent 14 % environ de celles de la molécule mère, et le N-monodesméthyl-rizatriptan est éliminé à un taux similaire. D'autres métabolites mineurs incluent le N-oxyde, le composé 6-hydroxy, et le conjugué sulfate du métabolite 6-hydroxy. Aucun de ces métabolites mineurs n'est pharmacologiquement actif. Après administration orale de rizatriptan marqué au 14C, le rizatriptan représente environ 17 % de la radioactivité plasmatique circulante.
Élimination
Après administration intraveineuse, l'aire sous la courbe (ASC) augmente proportionnellement chez les hommes et presque proportionnellement chez les femmes avec des doses allant de 10 à 60 µg/kg. Après administration orale, l'ASC augmente presque proportionnellement avec des doses allant de 2,5 mg à 10 mg. La demi-vie plasmatique du rizatriptan chez les hommes et les femmes est en moyenne de 2-3 heures. La clairance plasmatique du rizatriptan est en moyenne d'environ 1000-1500 ml/min chez l'homme et d'environ 900-1100 ml/min chez la femme ; environ 20-30 % de celle-ci est une clairance rénale. Après administration d'une dose orale de rizatriptan marqué au 14C, environ 80 % de la radioactivité est excrétée dans les urines, et environ 10 % de la dose est excrétée dans les fèces. Ceci indique que les métabolites sont excrétés principalement par les reins.
Environ 14 % d'une dose orale est excrétée dans les urines sous forme de rizatriptan inchangé, ce qui est cohérent avec un effet de premier passage, alors que 51 % est excrétée sous forme de métabolite indole acide acétique. Pas plus de 1 % est excrété dans les urines sous forme de métabolite actif N-monodesméthyle.
Aucune accumulation médicamenteuse ne survient dans le plasma d'un jour sur l'autre si le rizatriptan est administré selon le schéma posologique maximal.
Caractéristiques des patients
Les données suivantes sont basées sur des études avec la formulation orale en comprimé.
Patients ayant une crise de migraine
Une crise de migraine n'affecte pas la pharmacocinétique du rizatriptan.
Sexe
L'ASC du rizatriptan (10 mg par voie orale) a été de 25 % environ plus basse chez les hommes que chez les femmes, la Cmax a été de 11 % plus basse, et le Tmax est survenu environ au même moment. Cette différence pharmacocinétique apparente n’était pas cliniquement significative.
Personnes âgées
Les concentrations plasmatiques du rizatriptan observées chez les personnes âgées (de 65 à 77 ans) après administration de comprimé ont été similaires à celles observées chez des adultes jeunes.
Population pédiatrique
Une étude pharmacocinétique du rizatriptan (avec la présentation lyophilisat oral) a été conduite chez des patients migraineux âgés de 6 à 17 ans. Les expositions moyennes après l'administration d'une dose unique de 5 mg de rizatriptan en lyophilisat oral à des patients pédiatriques pesant entre 20 et 39 kg ou 10 mg de rizatriptan en lyophilisat oral à des patients pédiatriques pesant 40 kg ou plus, ont été respectivement 15 % inférieures et 17 % supérieures comparées à celles observées après l'administration d'une dose unique de 10 mg de rizatriptan sous forme de lyophilisat oral chez l'adulte. La pertinence clinique de ces différences n'est pas établie.
Insuffisance hépatique (score de Child-Pugh 5-6)
Après administration orale chez des patients ayant une insuffisance hépatique due à une cirrhose alcoolique d'intensité légère, les concentrations plasmatiques du rizatriptan ont été similaires à celles observées chez des hommes et des femmes jeunes. Une augmentation significative de l'ASC (50 %) et de la Cmax (25 %) a été observée chez des patients ayant une insuffisance hépatique modérée (score de Child-Pugh de 7). La pharmacocinétique n'a pas été étudiée chez des patients ayant un score de Child-Pugh > 7 (insuffisance hépatique sévère).
Insuffisance rénale
Chez des patients ayant une insuffisance rénale (clairance de la créatinine 10-60 ml/min/1,73 m2), l'ASC du rizatriptan administré en comprimé n'a pas été significativement différente de celle des sujets sains. Chez des patients hémodialysés (clairance de la créatinine < 10 ml/min/1,73 m2), l'ASC du rizatriptan a été supérieure d’environ 44 % à celle des patients ayant une fonction rénale normale. La concentration plasmatique maximale du rizatriptan chez des patients ayant une insuffisance rénale, quel qu'en soit le degré, a été similaire à celle des sujets sains.
5.3. Données de sécurité préclinique
2 ans
6.4. Précautions particulières de conservation
A conserver dans l’emballage d’origine à l’abri de l’humidité.
6.5. Nature et contenu de l'emballage extérieur
Plaquettes OPA/Aluminium/PVC/Aluminium unitaires pré-découpées.
Boîtes de 2, 3, 6, 12, 18, 28 ou 30 comprimés orodispersibles.
Toutes les présentations peuvent ne pas être commercialisées.
6.6. Précautions particulières d’élimination et de manipulation
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
100-110, ESPLANADE DU GENERAL DE GAULLE
92931 PARIS LA DEFENSE CEDEX
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 350 362 9 2 : 2 comprimés sous plaquette (OPA/Aluminium/PVC/Aluminium).
· 34009 350 363 5 3 : 3 comprimés sous plaquette (OPA/Aluminium/PVC/Aluminium).
· 34009 350 364 1 4 : 6 comprimés sous plaquettes (OPA/Aluminium/PVC/Aluminium).
· 34009 350 365 8 2 : 12 comprimés sous plaquettes (OPA/Aluminium/PVC/Aluminium).
· 34009 350 366 4 3 : 18 comprimés sous plaquettes (OPA/Aluminium/PVC/Aluminium).
· 34009 350 368 7 2 : 28 comprimés sous plaquettes (OPA/Aluminium/PVC/Aluminium).
· 34009 350 369 3 3 : 30 comprimés sous plaquettes (OPA/Aluminium/PVC/Aluminium).
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Liste I
ANSM - Mis à jour le : 17/07/2024
RIZATRIPTAN TEVA 10 mg, comprimé orodispersible
Veuillez lire attentivement cette notice avant de prendre ce médicament car elle contient des informations importantes pour vous.
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin ou votre pharmacien.
· Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d’autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
1. Qu'est-ce que RIZATRIPTAN TEVA 10 mg, comprimé orodispersible et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant de prendre RIZATRIPTAN TEVA 10 mg, comprimé orodispersible ?
3. Comment prendre RIZATRIPTAN TEVA 10 mg, comprimé orodispersible ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver RIZATRIPTAN TEVA 10 mg, comprimé orodispersible ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE RIZATRIPTAN TEVA 10 mg, comprimé orodispersible ET DANS QUELS CAS EST-IL UTILISE ?
RIZATRIPTAN TEVA est utilisé pour traiter les maux de tête de la crise de migraine chez l’adulte.
Le traitement par RIZATRIPTAN TEVA réduit le gonflement des vaisseaux qui entourent le cerveau. Ce gonflement est à l’origine des maux de tête de la crise de migraine.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT DE PRENDRE RIZATRIPTAN TEVA 10 mg, comprimé orodispersible ?
Ne prenez jamais RIZATRIPTAN TEVA 10 mg, comprimé orodispersible si :
· vous êtes allergique au rizatriptan ou à l’un des autres composants contenus dans ce médicament, mentionnés dans la rubrique 6,
· vous avez une hypertension artérielle modérée ou sévère, ou une hypertension artérielle légère non contrôlée par un traitement,
· vous avez ou avez eu une maladie du cœur, par exemple crise cardiaque ou douleur dans la poitrine (angine de poitrine), ou si vous avez déjà eu des symptômes de maladie du cœur,
· vous avez une maladie grave du foie ou du rein,
· si vous avez eu un accident vasculaire cérébral (AVC), ou un accident ischémique transitoire (AIT),
· vous avez des problèmes d’obstruction des artères (maladie vasculaire périphérique),
· vous prenez des inhibiteurs de la monoamine oxydase (IMAO), tels que moclobémide, phénelzine, tranylcypromine ou pargyline (médicaments utilisés dans le traitement de la dépression) ou le linézolide (un antibiotique) ou s’il y a moins de deux semaines que vous avez arrêté de prendre des IMAO,
· vous prenez des médicaments de type ergotamine tels que l’ergotamine ou la dihydro-ergotamine pour traiter votre migraine ou du méthysergide pour prévenir une crise de migraine,
· vous prenez d’autres médicaments de la même classe tels que sumatriptan, naratriptan ou zolmitriptan pour traiter votre migraine (voir aussi la rubrique « Autres médicaments et RIZATRIPTAN TEVA 10 mg, comprimé orodispersible »).
Si vous n’êtes pas sûr d’être concerné par l’une de ces situations, demandez conseil à votre médecin ou à votre pharmacien avant de prendre RIZATRIPTAN TEVA.
Avertissements et précautions
Adressez-vous à votre médecin ou votre pharmacien avant de prendre RIZATRIPTAN TEVA si :
· vous avez l’un des facteurs de risque de maladie cardiaque suivants : pression artérielle élevée, diabète, tabagisme ou prise de substituts nicotiniques, antécédents familiaux de maladie cardiaque, homme de plus de 40 ans ou femme ménopausée,
· vous avez une maladie du foie ou des reins,
· vous avez un problème particulier de battement du cœur (bloc de branche),
· vous avez ou avez eu des allergies,
· votre migraine est associée à des vertiges, des troubles de la marche ou de la coordination des mouvements ou à une faiblesse musculaire du bras ou de la jambe,
· vous prenez des préparations à base de plantes contenant du millepertuis,
· vous avez eu des réactions allergiques telles que : gonflement du visage, des lèvres, de la langue et/ou de la gorge qui peuvent provoquer une difficulté à respirer ou à avaler (angio-œdème),
· vous prenez des médicaments inhibiteurs sélectifs de la recapture de la sérotonine (ISRS) tels que la sertraline, l’oxalate d’escitalopram et la fluoxétine, ou des inhibiteurs de la recapture de la sérotonine et de la noradrénaline (ISRN) comme la venlafaxine et la duloxétine, utilisés pour traiter la dépression,
· vous avez eu des symptômes tels que douleur et oppression de la poitrine, même de courte durée.
Si vous prenez RIZATRIPTAN TEVA trop souvent, cela peut entraîner chez vous des maux de tête chroniques. Dans ce cas, prévenez votre médecin car vous devriez peut-être arrêter de prendre RIZATRIPTAN TEVA.
Veuillez parler à votre médecin ou à votre pharmacien de vos symptômes. Votre médecin déterminera si vous avez une migraine. Vous devez prendre RIZATRIPTAN TEVA seulement pour les crises de migraine. RIZATRIPTAN TEVA ne doit pas être utilisé pour traiter les maux de tête qui pourraient être dus à d’autres causes plus graves.
Enfants et adolescents
L’utilisation de RIZATRIPTAN TEVA chez les enfants et les adolescents de moins de 18 ans n'est pas recommandée.
Utilisation chez les patients de plus de 65 ans
Il n’y a pas eu d’études complètes sur la sécurité d’emploi et l’efficacité de RIZATRIPTAN TEVA chez les patients de plus de 65 ans.
Autres médicaments et RIZATRIPTAN TEVA 10 mg, comprimé orodispersible
Informez votre médecin ou votre pharmacien si vous prenez, avez récemment pris ou pourriez prendre tout autre médicament, y compris des médicaments obtenus sans ordonnance. Ceci comprend des médicaments à base de plantes et ceux que vous prenez normalement pour la migraine. RIZATRIPTAN TEVA peut en effet modifier l’action de certains médicaments, de même que d’autres médicaments peuvent modifier l’action de RIZATRIPTAN TEVA.
Ne prenez pas RIZATRIPTAN TEVA si :
· vous prenez déjà d’autres agonistes des récepteurs 5HT1B/1D (parfois appelés « triptans ») tels que le sumatriptan, le naratriptan ou le zolmitriptan,
· vous prenez des inhibiteurs de la monoamine oxydase (IMAO) tels que moclobémide, phénelzine, tranylcypromine, linézolide ou pargyline ou s’il y a moins de deux semaines que vous avez arrêté de prendre des IMAO,
· vous prenez des médicaments de type ergotamine tels que l’ergotamine ou la dihydro-ergotamine pour traiter votre migraine,
· vous prenez du méthysergide pour prévenir une crise de migraine.
Ces médicaments pris en même temps que RIZATRIPTAN TEVA peuvent augmenter le risque d’apparition d’effets indésirables.
Vous devez attendre au moins 6 heures avant de prendre des médicaments de type ergotamine tels que l’ergotamine, la dihydro-ergotamine ou le méthysergide si vous avez pris RIZATRIPTAN TEVA.
Vous devez attendre au moins 24 heures pour prendre RIZATRIPTAN TEVA si vous avez pris des médicaments de type ergotamine.
Demandez conseil à votre médecin pour la prise de RIZATRIPTAN TEVA et les risques possibles :
· si vous prenez du propranolol (voir la rubrique 3 « Comment prendre RIZATRIPTAN TEVA 10 mg, comprimé orodispersible »),
· si vous prenez des médicaments inhibiteurs sélectifs de la recapture de la sérotonine (ISRS) tels que la sertraline, l’oxalate d’escitalopram et la fluoxétine, ou des inhibiteurs de la recapture de la sérotonine et de la noradrénaline (ISRN) comme la venlafaxine et la duloxétine, utilisés pour traiter la dépression.
RIZATRIPTAN TEVA 10 mg, comprimé orodispersible avec des aliments et des boissons
RIZATRIPTAN TEVA peut mettre plus de temps à agir s’il est pris après un repas. Bien qu’il soit préférable de le prendre à jeun, vous pouvez quand même le prendre après avoir mangé.
Si vous êtes enceinte ou que vous allaitez, si vous pensez être enceinte ou planifiez une grossesse, demandez conseil à votre médecin ou votre pharmacien avant de prendre ce médicament.
Les données disponibles de sécurité du rizatriptan lorsqu’il est utilisé au cours des 3 premiers mois de la grossesse ne suggèrent pas d’augmentation du risque de malformations congénitales. On ne sait pas si RIZATRIPTAN TEVA, lorsqu’il est pris par une femme enceinte, est dangereux pour un bébé à naître après les 3 premiers mois de grossesse.
Rizatriptan passe dans le lait maternel. Si vous allaitez, un report de l’allaitement de 12 heures après la prise est possible pour éviter d’exposer votre bébé à ce médicament.
Conduite de véhicules et utilisation de machines
Vous pouvez ressentir une somnolence ou des étourdissements quand vous prenez RIZATRIPTAN TEVA. Si cela se produit, ne pas conduire ou utiliser d’outils ou de machines.
RIZATRIPTAN TEVA 10 mg, comprimé orodispersible contient du lactose
Si votre médecin vous a informé(e) d’une intolérance à certains sucres, contactez-le avant de prendre ce médicament.
RIZATRIPTAN TEVA 10 mg, comprimé orodispersible contient de l’aspartam (E 951)
Ce médicament contient 2,0 mg d’aspartam par comprimé orodispersible.
L’aspartam contient une source de phénylalanine. Peut être dangereux pour les personnes atteintes de phénylcétonurie (PCU), une maladie génétique rare caractérisée par l’accumulation de phénylalanine ne pouvant être éliminée correctement.
RIZATRIPTAN TEVA 10 mg, comprimé orodispersible contient du benzoate
Ce médicament contient 4,5 mg de benzoate (sous forme de benzoate de rizatriptan) par comprimé orodispersible.
RIZATRIPTAN TEVA 10 mg, comprimé orodispersible contient du sodium
Ce médicament contient moins de 1 mmol (23 mg) de sodium par comprimé orodispersible, c.-a-d. qu’il est essentiellement ≪ sans sodium ≫.
3. COMMENT PRENDRE RIZATRIPTAN TEVA 10 mg, comprimé orodispersible ?
Veillez à toujours prendre ce médicament en suivant exactement les indications de votre médecin ou pharmacien. Vérifiez auprès de votre médecin ou pharmacien en cas de doute.
La dose habituelle est de 10 mg.
Si vous prenez du propranolol ou en cas de maladie du foie ou des reins, vous devez prendre une dose de 5 mg de rizatriptan. Vous devez attendre au moins 2 heures entre la prise de propranolol et la prise de rizatriptan, sans dépasser 2 doses de rizatriptan par 24 heures.
Comment prendre RIZATRIPTAN TEVA
RIZATRIPTAN TEVA est un comprimé orodispersible qui se dissout dans la bouche.
Le comprimé orodispersible peut être utilisé dans des situations où la prise de liquides n’est pas possible ou pour éviter les nausées et vomissements pouvant accompagner la prise de comprimés avec des liquides.
Vos mains doivent être sèches lorsque vous manipulez le comprimé orodispersible car il risquerait de se désagréger au contact de l’humidité.
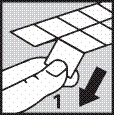
1. Tenir la plaquette par les coins et détacher une alvéole du reste de la plaquette en déchirant doucement le long des perforations.
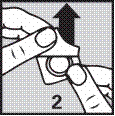
2. Retirer soigneusement l’opercule.
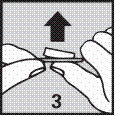
3. Pousser doucement sur le comprimé pour le faire sortir.
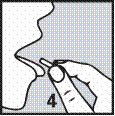
4. Le comprimé doit être placé sur la langue où il se dissoudra directement dans la bouche et pourra être avalé facilement.
Si la migraine réapparaît dans les 24 heures
Chez certains patients, les symptômes de la migraine peuvent réapparaître dans les 24 heures. Si votre migraine réapparaît, vous pouvez prendre une dose supplémentaire de RIZATRIPTAN TEVA. Vous devez toujours attendre au moins 2 heures entre les prises.
Si après 2 heures la migraine persiste
Si vous ne répondez pas à la première dose de RIZATRIPTAN TEVA durant une crise, vous ne devez pas prendre une seconde dose de RIZATRIPTAN TEVA pour le traitement de la même crise.
Il est probable, cependant, que vous répondrez à RIZATRIPTAN TEVA durant la prochaine crise.
Ne prenez pas plus de 2 doses de RIZATRIPTAN TEVA par 24 heures (par exemple, ne prenez pas plus de 2 comprimés orodispersibles à 10 mg ou à 5 mg par 24 heures). Vous devez toujours attendre au moins 2 heures entre les prises.
Si votre état s’aggrave, demandez un avis médical.
Si vous avez pris plus de RIZATRIPTAN TEVA 10 mg, comprimé orodispersible que vous n’auriez dû :
Si vous avez pris plus de RIZATRIPTAN TEVA que vous n’auriez dû, parlez-en immédiatement à votre médecin ou à votre pharmacien et prenez la boîte avec vous.
Signes de surdosage possibles : étourdissements, somnolence, vomissements, évanouissement ou rythme cardiaque lent.
Si vous avez d’autres questions sur l’utilisation de ce médicament, demandez plus d’informations à votre médecin ou à votre pharmacien.
Si vous oubliez de prendre RIZATRIPTAN TEVA 10 mg, comprimé orodispersible :
Si vous arrêtez de prendre RIZATRIPTAN TEVA 10 mg, comprimé orodispersible :
Sans objet.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Comme tous les médicaments, ce médicament peut provoquer des effets indésirables, mais ils ne surviennent pas systématiquement chez tout le monde. Les effets indésirables suivants peuvent se produire avec ce médicament.
Lors des études chez l’adulte, les effets indésirables le plus fréquemment rapportés étaient étourdissement, somnolence et fatigue.
Fréquent : pouvant affecter jusqu’à 1 personne sur 10
· sensation de fourmillement (paresthésie), maux de tête, sensibilité cutanée diminuée (hypoesthésie), diminution de l’acuité mentale, insomnie,
· battements de cœur rapides ou irréguliers (palpitations),
· rougeurs du visage de courte durée,
· gêne au niveau de la gorge,
· sensations de malaise (nausées), sécheresse de la bouche, vomissements, diarrhée, indigestion (dyspepsie),
· sensations de lourdeur dans certaines parties du corps, douleurs dans le cou, raideur,
· douleurs au ventre ou au thorax.
Peu fréquent : pouvant affecter jusqu’à 1 personne sur 100
· mauvais goût dans la bouche,
· difficultés à coordonner ses mouvements lors de la marche (ataxie), étourdissements (vertiges), vision trouble, tremblements, perte de connaissance (syncope),
· confusion, nervosité,
· pression artérielle élevée (hypertension) ; soif, bouffées de chaleur, sueurs,
· rash, démangeaisons et éruption cutanée étendue grumeleuse (urticaire), gonflement de la face, des lèvres, de la langue et/ou de la gorge, ce qui peut entraîner des difficultés respiratoires et/ou de déglutition (angio-œdème), difficulté respiratoire (dyspnée),
· oppression localisée, faiblesse musculaire,
· modifications du rythme ou de la fréquence des battements du cœur (arythmie), anomalies de l'électrocardiogramme (examen qui enregistre l'activité électrique de votre cœur), rythme cardiaque très accéléré (tachycardie),
· douleur de la face, douleur musculaire.
Rare : pouvant affecter jusqu’à une personne sur 1 000
· respiration sifflante,
· réaction allergique (hypersensibilité) ; réaction allergique soudaine menaçant le pronostic vital (choc anaphylactique),
· accident vasculaire cérébral (ce cas survient généralement chez les patients ayant des facteurs de risque de maladie cardiaque et vasculaire [hypertension, diabète, tabagisme, utilisation de substituts nicotiniques, antécédents familiaux de maladie cardiaque ou d’accident vasculaire cérébral, homme de plus de 40 ans, femme ménopausée, problème particulier de battement du cœur (bloc de branche)]),
· battements du cœur lents (bradycardie).
Fréquence indéterminée : ne peut être estimée sur la base des données disponibles
· crise cardiaque, spasmes des vaisseaux sanguins du cœur (ces cas surviennent généralement chez les patients ayant des facteurs de risque de maladie cardiaque et vasculaire [hypertension, diabète, tabagisme, utilisation de substituts nicotiniques, antécédents familiaux de maladie cardiaque ou d’accident vasculaire cérébral, homme de plus de 40 ans, femme ménopausée, problème particulier de battement du cœur (bloc de branche)]),
· syndrome appelé « syndrome sérotoninergique » qui peut occasionner des effets indésirables comme un coma, une tension artérielle instable, une fièvre très élevée, une perte de la coordination musculaire, une agitation et des hallucinations,
· décollement sévère de la peau avec ou sans fièvre (nécrolyse épidermique toxique),
· crises d’épilepsie (convulsions/crises convulsives),
· constriction des vaisseaux sanguins des extrémités avec sensation de froid et engourdissement des mains et des pieds,
· spasmes des vaisseaux sanguins du côlon (gros intestin) pouvant provoquer une douleur abdominale.
Informez votre médecin immédiatement en cas de symptôme suggérant une réaction allergique, un syndrome sérotoninergique, une crise cardiaque ou un accident vasculaire cérébral.
De plus, informez votre médecin de tout symptôme suggérant une réaction allergique (telle qu’un rash ou des démangeaisons) après la prise de RIZATRIPTAN TEVA.
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER RIZATRIPTAN TEVA 10 mg, comprimé orodispersible ?
Tenir ce médicament hors de la vue et de la portée des enfants.
N’utilisez pas ce médicament après la date de péremption indiquée sur la boîte et sur la plaquette après EXP. La date de péremption fait référence au dernier jour de ce mois.
A conserver dans l’emballage d’origine, à l’abri de l’humidité.
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient RIZATRIPTAN TEVA 10 mg, comprimé orodispersible
· La substance active est :
Benzoate de rizatriptan................................................................................................ 14,53 mg
Equivalant à rizatriptan................................................................................................ 10,00 mg
Pour un comprimé orodispersible
· Les autres composants sont :
Lactose monohydraté, amidon de maïs, mannitol (E421), amidon de maïs prégélatinisé, aspartam (E951), arôme menthe poivrée, silice colloïdale anhydre, stéaryl fumarate de sodium.
Qu’est-ce que RIZATRIPTAN TEVA 10 mg, comprimé orodispersible et contenu de l’emballage extérieur
Comprimé orodispersible rond et plat, aux bords biseautés, de couleur blanc à blanc crème, gravé « IZ » sur une face et « 10 » sur l’autre.
Boîtes de 2, 3, 6, 12, 18, 28 ou 30 comprimés orodispersibles.
Toutes les présentations peuvent ne pas être commercialisées.
Titulaire de l’autorisation de mise sur le marché
100-110, ESPLANADE DU GENERAL DE GAULLE
92931 PARIS LA DEFENSE CEDEX
FRANCE
Exploitant de l’autorisation de mise sur le marché
100-110, ESPLANADE DU GENERAL DE GAULLE
92931 PARIS LA DEFENSE CEDEX
FRANCE
TEVA PHARMACEUTICAL WORKS PRIVATE LIMITED COMPANY
Pallagi út 13,
4042 Debrecen
HONGRIE
ou
PHARMACHEMIE B.V.
Swensweg 5, 2031 GA Haarlem
PAYS BAS
ou
TEVA OPERATIONS POLAND Sp. Z.o.o
80 Mogilska Str.
31-546 KRAKOW
POLOGNE
ou
MERCKLE GMBH
ludwig-merckle-strasse 3
89143 Blaubeuren
allemagne
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Ce médicament est autorisé dans les Etats membres de l'Espace Economique Européen sous les noms suivants : Conformément à la réglementation en vigueur.
[à compléter ultérieurement par le titulaire]
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).