 Participez à la création d’un site d'informations accessibles sur les médicaments pensé pour le grand public !
Participez à la création d’un site d'informations accessibles sur les médicaments pensé pour le grand public !Inscrivez-vous ici pour le tester en avant-première, partager vos impressions, et nous aider à l’améliorer !
 Participez à la création d’un site d'informations accessibles sur les médicaments pensé pour le grand public !
Participez à la création d’un site d'informations accessibles sur les médicaments pensé pour le grand public !ANSM - Mis à jour le : 14/03/2023
DORZOLAMIDE VIATRIS 2%, collyre en solution
Dorzolamide
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin ou votre pharmacien.
· Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d’autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien.
· Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
1. Qu'est-ce que DORZOLAMIDE VIATRIS 2%, collyre en solution et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant de prendre DORZOLAMIDE VIATRIS 2%, collyre en solution ?
3. Comment utiliser DORZOLAMIDE VIATRIS 2%, collyre en solution ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver DORZOLAMIDE VIATRIS 2%, collyre en solution ?
6. Contenu de l’emballage et autres informations.

Classe pharmacothérapeutique : ANTIGLAUCOMATEUX ET MYOTIQUES, INHIBITEUR DE L'ANHYDRASE CARBONIQUE. Code ATC : S01EC03.
DORZOLAMIDE VIATRIS 2 %, collyre en solution est présenté sous forme de collyre en solution stérile. Le principe actif contenu dans DORZOLAMIDE VIATRIS 2 %, collyre en solution est le dorzolamide, un composé apparenté au sulfamide.
Le dorzolamide appartient à un groupe de médicaments appelé inhibiteurs de l'anhydrase carbonique à usage ophtalmique qui font baisser la pression intraoculaire élevée.
Le dorzolamide est utilisé pour diminuer la pression intraoculaire élevée et pour traiter le glaucome (glaucome à angle ouvert, glaucome pseudo-exfoliatif).
DORZOLAMIDE VIATRIS 2 %, collyre en solution peut être utilisé seul ou associé à d'autres médicaments qui font baisser la pression oculaire (appelés bêta-bloquants).

N’utilisez jamais DORZOLAMIDE VIATRIS 2%, collyre en solution :
· si vous êtes allergique (hypersensible) au dorzolamide ou à l'un des autres composants contenus dans DORZOLAMIDE VIATRIS 2 %, collyre en solution (listés à la rubrique 6.),
· si vous avez des problèmes rénaux sévères,
· si vous avez un trouble du pH (équilibre acido-basique) de votre sang.
Avertissements et précautions
Adressez-vous à votre médecin ou pharmacien avant d’utiliser DORZOLAMIDE VIATRIS 2 %, collyre en solution :
· si vous avez ou avez eu des problèmes hépatiques dans le passé
· si vous avez été informé que vous aviez une anomalie de la cornée
· si vous avez eu des allergies à des médicaments apparentés aux sulfamides, par exemple le co-trimoxazole
· si vous avez subi ou allez bientôt subir une intervention chirurgicale au niveau des yeux
· si vous avez souffert d'une lésion ou d’une très faible pression oculaire (hypotonie)
· si vous avez des antécédents de calculs rénaux
· si vous prenez un autre inhibiteur de l'anhydrase carbonique par voie orale, par exemple l’acétazolamide
· i vous portez des lentilles de contact (voir la rubrique «DORZOLAMIDE VIATRIS 2 %, collyre en solution contient du chlorure de benzalkonium comme conservateur »)
Au cours du traitement
Si vous développez une irritation oculaire ou tout autre nouveau problème oculaire tel que rougeur de l'œil, gonflement de la couche superficielle de l'œil ou des paupières, contactez immédiatement votre médecin.
Si vous pensez que DORZOLAMIDE VIATRIS 2 %, collyre en solution provoque une réaction allergique (par exemple éruption ou démangeaisons cutanées, inflammation de l'œil) arrêtez d'utiliser DORZOLAMIDE VIATRIS 2 %, collyre en solution et contactez immédiatement votre médecin.
Enfants et adolescents
DORZOLAMIDE VIATRIS 2 %, collyre en solution ne doit être utilisé chez l'enfant et l’adolescent que si les bénéfices sont supérieurs aux risques. Votre médecin sera en mesure de vous conseiller.
Autres médicaments et DORZOLAMIDE VIATRIS 2 %, collyre en solution
Informez votre médecin ou pharmacien si vous prenez ou utilisez, avez récemment pris ou utilisé ou pourriez prendre ou utiliser tout autre médicament, y compris un médicament obtenu sans ordonnance.
En particulier, vous devez informer votre médecin si vous prenez un autre inhibiteur de l'anhydrase carbonique par voie orale tel que l'acétazolamide.
DORZOLAMIDE VIATRIS 2%, collyre en solution avec des aliments et boissons
Sans objet.
Si vous êtes enceinte ou que vous allaitez, si vous pensez être enceinte ou planifiez une grossesse, demandez conseil à votre médecin ou pharmacien avant de prendre ce médicament.
Grossesse
Ce médicament ne doit pas être utilisé pendant la grossesse. Informez votre médecin si vous êtes enceinte ou prévoyez de l’être.
Allaitement
Si un traitement avec ce médicament est nécessaire, l'allaitement n'est pas recommandé. Si vous allaitez ou avez l'intention d'allaiter, parlez-en à votre médecin.
Conduite de véhicules et utilisation de machines
DORZOLAMIDE VIATRIS 2 %, collyre en solution peut provoquer des étourdissements et des troubles de la vision chez certains patients. Ne conduisez pas et n'utilisez pas de machines tant que les symptômes n'ont pas disparus.
DORZOLAMIDE VIATRIS 2%, collyre en solution contient du chlorure de benzalkonium comme conservateur
Ce médicament contient 0,075 mg de chlorure de benzalkonium par millilitre.
Le chlorure de benzalkonium peut être absorbé par les lentilles de contact souples et changeur leur couleur. Retirer les lentilles de contact avant application et attendre au moins 15 minutes avant de les remettre.
Le chlorure de benzalkonium peut également provoquer une irritation des yeux, surtout si vous souffrez du syndrome de l’œil sec ou de troubles de la cornée (couche transparente à l’avant de l’œil). En cas de sensation anormale, de picotements ou de douleur dans les yeux après avoir utilisé ce médicament, contactez votre médecin.

La posologie appropriée et la durée du traitement seront établies par votre médecin.
Lorsque DORZOLAMIDE VIATRIS 2 %, collyre en solution est utilisé seul, la dose recommandée est de une goutte dans l'œil (les yeux) affecté(s) trois fois par jour, par exemple le matin, l'après-midi et le soir.
Si votre médecin vous a recommandé d'utiliser DORZOLAMIDE VIATRIS 2 %, collyre en solution avec un bêta-bloquant en collyre (autre médicament qui abaisse la pression oculaire) la posologie recommandée est alors d'une goutte de DORZOLAMIDE VIATRIS 2 %, collyre en solution dans l'œil (les yeux) affecté(s) deux fois par jour, par exemple le matin et le soir.
Si vous utilisez DORZOLAMIDE VIATRIS 2 %, collyre en solution avec un autre collyre, attendez au moins 10 minutes entre l'instillation de DORZOLAMIDE VIATRIS 2 %, collyre en solution et celle de l'autre médicament.
Si vous allez utiliser DORZOLAMIDE VIATRIS 2 %, collyre en solution pour remplacer un autre médicament en collyre destiné à abaisser la pression oculaire, vous devez arrêter d'utiliser l'autre médicament après l'avoir pris à la posologie quotidienne recommandée et commencez DORZOLAMIDE VIATRIS 2 %, collyre en solution le lendemain.
Ne modifiez pas la posologie de ce médicament sans consulter votre médecin. Si vous devez arrêter le traitement, contactez immédiatement votre médecin.
Ne laissez pas l'embout du flacon entrer en contact avec votre œil ou les zones qui l'entourent. Il risquerait d'être contaminé par des bactéries qui peuvent provoquer des infections oculaires entraînant des lésions graves de l'œil ou même une perte de la vision. Pour éviter toute contamination du flacon, évitez de mettre l'embout du flacon au contact de toute surface.
Mode d’emploi
Il est recommandé de vous laver les mains avant l'instillation de votre collyre.
Il est peut-être plus facile d'instiller le collyre devant un miroir.
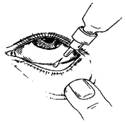
1. Avant d'utiliser le médicament pour la première fois, assurez-vous que la bague d'inviolabilité située au niveau du col du flacon n'est pas rompue. Un espace entre le flacon et le bouchon est normal sur un flacon non ouvert. Brisez ensuite cette bague.
2. Retirez le bouchon du flacon.
3. Inclinez votre tête en arrière et tirez légèrement la paupière inférieure vers le bas de manière à former une petite poche entre la paupière et l'œil.
4. Renversez le flacon et pressez-le doucement jusqu'à ce qu'une seule goutte tombe dans l'œil comme indiqué par votre médecin. NE TOUCHEZ PAS L'ŒIL OU LA PAUPIERE AVEC L'EMBOUT DU FLACON.
5. Répétez les étapes 3 et 4 pour l'autre œil si votre médecin vous l'a prescrit.
6. Remettez le bouchon et fermez le flacon immédiatement après l'avoir utilisé.
Fermez votre œil et appuyez sur le coin intérieur de l’œil avec votre doigt pendant environ deux minutes. Cela aide à stopper la propagation du médicament dans le reste du corps.
Si vous avez utilisé plus de DORZOLAMIDE VIATRIS 2%, collyre en solution que vous n’auriez dû :
Si vous avez instillé trop de gouttes dans votre œil ou si vous avez avalé du collyre, contactez immédiatement votre médecin.
Si vous oubliez d’utiliser DORZOLAMIDE VIATRIS 2%, collyre en solution :
Il est important d'utiliser DORZOLAMIDE VIATRIS 2 %, collyre en solution comme vous l'a prescrit votre médecin.
Si vous avez oublié d'instiller une dose, instillez-la le plus tôt possible après l'oubli. Cependant, s'il est presque l'heure de l'instillation suivante, ne prenez pas la dose oubliée mais reprenez votre schéma d'administration normal.
Ne prenez pas de dose double pour compenser la dose que vous avez oublié de prendre.
Si vous arrêtez d’utiliser DORZOLAMIDE VIATRIS 2%, collyre en solution :
DORZOLAMIDE VIATRIS 2 %, collyre en solution doit être pris chaque jour pour agir correctement. Si vous devez arrêter le traitement, contactez immédiatement votre médecin.
Si vous avez d’autres questions sur l’utilisation de ce médicament, demandez plus d’informations à votre médecin ou à votre pharmacien.

Arrêtez d’utiliser DORZOLAMIDE VIATRIS 2 %, collyre en solution immédiatement et allez directement à l’hôpital ou demandez conseil à votre médecin si vous avez l’un des effets indésirables suivants :
Fréquent (peut affecter jusqu’à 1 patient sur 10)
· Lésion de la couche supérieure de l’œil, pouvant causer douleur oculaire, rougeur de l’œil (des yeux) et vision trouble, avec possibilité de sensibilité à la lumière, ou sensation d’avoir quelque chose dans l’œil (kératite ponctuée superficielle).
Peu fréquent (peut affecter jusqu’à 1 patient sur 100)
· Gonflement de l’iris (la partie colorée de l’œil), pouvant causer vision trouble et vision de points noirs semblant flotter à travers l’œil, ou possibilité de flashs lumineux (irido-cyclite).
Rare (peut affecter jusqu’à 1 patient sur 1000)
· Des réactions allergiques telles qu’une éruption soudaine ou avec de fortes démangeaisons, un gonflement soudain de l’œil, de la paupière,des lèvres, de la langue, du visage, des mains ou de la gorge pouvant causer des difficultés à respirer ou une respiration sifflante.
· Une rougeur excessive et douloureuse de la peau, de larges ampoules, décollement de la peau en lambeaux, saignements des lèvres, des yeux, des parties génitales ou de la bouche accompagnés de fièvre (ceci pouvant indiquer un syndrome de Stevens-Johnson ou une nécrolyse épidermique toxique).
· Perte soudaine de la vision, accompagnée par une douleur et parfois de malaises, pouvant survenir après une chirurgie oculaire (détachement choroïdal).
· Forte diminution de la pression oculaire, pouvant conduire à des problèmes oculaires tels qu’une perte de la vision ou une vision déformée.
Les autres effets indésirables incluent :
Très fréquents (peut affecter plus de 1 patient sur 10)
· Sensations de brûlure ou de picotements au niveau des yeux
Fréquents (peut affecter jusqu’à 1 patient sur 10)
· Maux de tête
· Augmentation de la sécrétion de larmes
· Inflammation ou infection des yeux
· Inflammation ou croûtes au niveau de la paupière
· Démangeaisons oculaires
· Irritation de la paupière
· Vision trouble (sans autres effets indésirables)
· Malaise
· Impression de saveur amère
· Faiblesse ou sensation de fatigue
Rare (peut affecter jusqu’à 1 patient sur 1000)
· Sensations vertigineuses
· Fourmillements dans les mains et/ou les pieds
· Irritation oculaire pouvant entrainer rougeur et douleur oculaire
· Difficulté d’accommodation sur les objets lointains (myopie), normalement réversible après l’arrêt du traitement
· Gonflement de la couche supérieure de l’œil que vous pourriez remarquer par la possibilité de vision trouble éventuellement avec apparition de halos autour des objets (œdème cornéen)
· Saignements du nez
· Irritation de la gorge
· Sécheresse buccale
· Démangeaisons cutanées et peau écailleuse, parfois accompagnées de sensations de brûlure, pouvant aussi apparaitre sur la peau entourant l’œil et pouvant être le signe d’une réaction allergique cutanée
· Calculs rénaux
Fréquence indéterminée (ne peut être estimée sur la base des données disponibles)
· Essoufflement
· Sensation de corps étranger (sentiment d’avoir quelque chose dans votre œil)
· Battements du cœur puissants pouvant être rapides ou irréguliers (palpitations)
· Augmentation de la fréquence cardiaque
· Augmentation de la pression artérielle
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin, à votre pharmacien ou à votre infirmier/ère. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (Ansm) et réseau des Centres Régionaux de Pharmacovigilance – Site internet : https://signalement.social-sante.gouv.fr.
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.

Tenir hors de la vue et de la portée des enfants.
N’utilisez pas ce médicament après la date de péremption indiquée sur l’étiquette, l’emballage après « EXP ». La date de péremption fait référence au dernier jour de ce mois.
Conservez le flacon dans l'emballage d'origine à l'abri de la lumière.
A conserver à une température ne dépassant pas 30°C.
DORZOLAMIDE VIATRIS 2 %, collyre en solution doit être utilisé dans les 28 jours qui suivent l'ouverture du flacon. Vous devez donc jeter le flacon 4 semaines après l'avoir ouvert même s'il reste un peu de solution. Pour vous aider à vous en rappeler, inscrivez la date à laquelle vous avez ouvert le flacon dans le cadre prévu à cet effet sur la boîte.
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.

Ce que contient DORZOLAMIDE VIATRIS 2%, collyre en solution 
· La substance active est le dorzolamide. Chaque ml contient 20 mg de dorzolamide (sous forme de chlorhydrate de dorzolamide)
· Les autres composants sont : chlorure de benzalkonium (comme conservateur) (voir rubrique 2.), mannitol, hydroxyéthylcellulose, citrate de sodium, hydroxyde de sodium pour l'ajustement du pH et eau pour préparations injectables.
Qu’est-ce que DORZOLAMIDE VIATRIS 2%, collyre en solution et contenu de l’emballage extérieur 
DORZOLAMIDE VIATRIS 2 %, collyre en solution est une solution stérile, au pH tamponné, incolore, légèrement visqueuse, contenue dans un flacon en plastique blanc muni d'un embout compte-goutte scellé et d'un bouchon en deux parties assurant l’inviolabilité. Chaque flacon contient 5 mL de collyre.
Boîte de 1, 3 ou 6 flacons.
Toutes les présentations peuvent ne pas être commercialisées.
Titulaire de l’autorisation de mise sur le marché 
1 RUE DE TURIN
69007 LYON
Exploitant de l’autorisation de mise sur le marché 
1 RUE DE TURIN
69007 LYON
DERVENAKION 6
PALLINI 15331
ATTIKI
GRECE
ou
FAMAR SA
63 AGIOU DIMITRIOU STREET
ALIMOS, ATHENES, 174-56
GRECE
ou
MC DERMOTT LABORATORIES LIMITED T/A GERARD LABORATORIES
35 BALDOYLE INDUSTRIAL ESTATE, GRANGE ROAD
DUBLIN 13
IRLANDE
Noms du médicament dans les Etats membres de l'Espace Economique Européen 
Ce médicament est autorisé dans les Etats membres de l'Espace Economique Européen sous les noms suivants : Conformément à la réglementation en vigueur.
[À compléter ultérieurement par le titulaire]
La dernière date à laquelle cette notice a été révisée est : 
[à compléter ultérieurement par le titulaire]
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).
[1] Indiquer le libellé détaillé qui figure dans l’application form avec le code de la modification selon les lignes directrices https://ec.europa.eu/health//sites/health/files/files/eudralex/vol-2/c_2013_2008/c_2013_2008_pdf/c_2013_2804_fr.pdf
|
| Plan du site | Accessibilité | Contact | Téléchargement | Declaration de confidentialité | Service-Public.fr | Legifrance | Gouvernement.fr |