Dernière mise à jour le 02/02/2026
HALDOL DECANOAS 50 mg/ml, solution injectable
Indications thérapeutiques
Le nom de votre médicament est HALDOL DECANOAS 50 mg/ml, solution injectable.
HALDOL DECANOAS contient une substance active appelée halopéridol (sous forme de décanoate d’halopéridol). Il appartient à un groupe de médicaments appelés « antipsychotiques ».
HALDOL DECANOAS est utilisé chez les adultes dont la maladie a été traitée précédemment par de l’halopéridol pris par voie orale. Il est utilisé pour traiter des maladies affectant les pensées, les sensations ou le comportement. Cela comprend des problèmes de santé mentale (tels que la schizophrénie). Ces maladies peuvent provoquer chez vous :
· un état de confusion (délire)
· voir, entendre, ressentir ou sentir des choses qui ne sont pas réelles (hallucinations)
· croire des choses qui ne sont pas réelles (idées délirantes)
· une suspicion anormale (paranoïa)
· un fort sentiment d’excitation, d’agitation, d’enthousiasme, de l’impulsivité ou de l’hyperactivité
· un comportement très agressif, hostile ou violent.
Présentations
> 5 ampoule(s) en verre de 1 ml
Code CIP : 326 351-0 ou 34009 326 351 0 8
Déclaration de commercialisation : 19/10/1984
Cette présentation est agréée aux collectivités
- Prix hors honoraire de dispensation : 14,49 €
- Honoraire de dispensation : 1,02 €
- Prix honoraire compris : 15,51 €
- Taux de remboursement :65%
> 1 ampoule(s) en verre de 1 ml
Code CIP : 326 993-2 ou 34009 326 993 2 2
Déclaration de commercialisation : 19/10/1984
Cette présentation est agréée aux collectivités
- Prix hors honoraire de dispensation : 3,37 €
- Honoraire de dispensation : 1,02 €
- Prix honoraire compris : 4,39 €
- Taux de remboursement :65%
Service médical rendu (SMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprès de la HAS (plus d'informations dans l'aide). Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Important | Avis du 25/01/2017 | Renouvellement d'inscription (CT) | Le service médical rendu par HALDOL 5 mg comprimé et HALDOL 2 mg/ml solution buvable reste important dans le traitement des états psychotiques aigus et chroniques chez l’adulte. Le service médical rendu par HALDOL 2 mg/ml solution buvable et HALDOL 5 mg/ml solution injectable reste important dans le traitement des vomissements lors de traitements antimitotiques post-radiothérapiques chez l’adulte. Le service médical rendu par HALDOL 2 mg/ml solution buvable reste important dans le traitement des chorées (mouvements anormaux), maladie des tics de Gilles de la Tourette chez l’adulte et l’enfant de plus de 3 ans. Le service médical rendu par HALDOL solution injectable reste important dans le traitement de courte durée des états d'agitation et d'agressivité au cours des états psychotiques aigus et chroniques. Le service médical rendu par HALDOL DECANOAS reste important dans le traitement au long cours des états psychotiques chroniques. |
| Modéré | Avis du 25/01/2017 | Renouvellement d'inscription (CT) | Le service médical rendu par HALDOL 1 mg comprimé et HALDOL 2 mg/ml solution buvable reste modéré dans le traitement symptomatique de courte durée de l'anxiété de l'adulte en cas d'échec des thérapeutiques habituelles. Le service médical rendu par HALDOL 2 mg/ml solution buvable reste modéré dans la prise en charge des troubles graves du comportement de l’enfant. La Commission de la transparence a tenu compte du caractère très limité des données cliniques disponibles dans cette indication et d’une place mal définie des antipsychotiques dans la prise en charge des troubles graves du comportement avec agitation et agressivité de l’enfant. |
Amélioration du service médical rendu (ASMR)
Pas d'ASMR disponible pour ce médicament (plus d'informations dans l\'aide)
ANSM - Mis à jour le : 26/04/2023
HALDOL DECANOAS 50 mg/ml, solution injectable
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Décanoate d’halopéridol.................................................................................................... 70,52 mg
(Correspondant à halopéridol................................................................................................. 50 mg)
Pour une ampoule de 1 ml
Excipient à effet notoire :
Chaque ml de solution contient 15 mg d’alcool benzylique et jusqu’à 1 ml d’huile de sésame.
Pour la liste complète des excipients, voir rubrique 6.1.
Solution injectable.
Solution légèrement ambrée, légèrement visqueuse, exempte de particules visibles.
4.1. Indications thérapeutiques
HALDOL DECANOAS est indiqué dans le traitement d’entretien de la schizophrénie et du trouble schizo-affectif chez les patients adultes actuellement stabilisés par l’halopéridol oral (voir rubrique 5.1).
4.2. Posologie et mode d'administration
L’instauration du traitement et l’ajustement de la dose doivent être réalisés sous étroite surveillance clinique.
Posologie
La dose prescrite à chaque patient dépendra à la fois de la sévérité des symptômes et de la dose d’halopéridol oral actuellement utilisée. Les patients doivent toujours recevoir la plus faible dose efficace.
La dose initiale de décanoate d’halopéridol correspond à un multiple de la dose quotidienne d’halopéridol oral, il n’est pas possible de fournir des recommandations spécifiques concernant le changement de traitement après utilisation d’autres antipsychotiques (voir rubrique 5.1).
Adultes âgés de 18 ans et plus
Tableau 1 : doses de décanoate d’halopéridol recommandées chez les adultes âgés de 18 ans et plus
|
Transition après le traitement oral par l’halopéridol · Il est recommandé d’utiliser une dose de décanoate d’halopéridol correspondant à 10 à 15 fois la dose quotidienne antérieure d’halopéridol oral. · Sur la base de ce rapport de conversion, la dose de décanoate d’halopéridol sera de 25 à 150 mg chez la plupart des patients. |
|
Poursuite du traitement · Il est recommandé d’ajuster la dose de décanoate d’halopéridol par paliers de 50 mg maximum toutes les 4 semaines (selon la réponse de chaque patient au traitement) jusqu’à obtenir un effet thérapeutique optimal. · La dose la plus efficace devrait être comprise dans un intervalle de 50 à 200 mg. · Il est recommandé d’évaluer le rapport bénéfice/risque au cas par cas lorsque des doses supérieures à 200 mg toutes les 4 semaines sont envisagées. · La dose maximale de 300 mg toutes les 4 semaines ne doit pas être dépassée car, au-delà, les risques en termes de sécurité sont supérieurs aux bénéfices cliniques apportés par le traitement.
|
|
Fréquence d’administration · Les injections seront habituellement espacées de 4 semaines. · Un ajustement de la fréquence d’administration peut être nécessaire (selon la réponse de chaque patient au traitement). |
|
Traitement complémentaire par l’halopéridol non-décanoate · Un traitement complémentaire par une forme d’halopéridol non-décanoate peut être envisagé pendant la transition vers le traitement par HALDOL DECANOAS, l’ajustement de la dose ou les épisodes d’exacerbation des symptômes psychotiques (selon la réponse de chaque patient au traitement). · La dose totale d’halopéridol résultant de l’association des deux formulations ne doit pas dépasser la dose orale maximale correspondante d’halopéridol, à savoir 20 mg/jour. |
Populations particulières
Personnes âgées
Tableau 2 : doses de décanoate d’halopéridol recommandées chez les patients âgés
|
Transition après le traitement oral par l’halopéridol · Il est recommandé d’utiliser une faible dose de décanoate d’halopéridol, comprise entre 12,5 et 25 mg. |
|
Poursuite du traitement · Il est recommandé d’ajuster la dose de décanoate d’halopéridol uniquement si nécessaire (selon la réponse de chaque patient au traitement) jusqu’à obtenir un effet thérapeutique optimal. · La dose la plus efficace devrait être comprise dans un intervalle de 25 à 75 mg. · Des doses supérieures à 75 mg toutes les 4 semaines ne doivent être envisagées que chez les patients qui ont préalablement toléré des doses supérieures et après réévaluation du rapport bénéfice/risque pour chaque patient. |
|
Fréquence d’administration · Les injections seront habituellement espacées de 4 semaines. · Un ajustement de la fréquence d’administration peut être nécessaire (selon la réponse de chaque patient au traitement). |
|
Traitement complémentaire par l’halopéridol non-décanoate · Un traitement complémentaire par une forme d’halopéridol non-décanoate peut être envisagé pendant la transition vers le traitement par HALDOL DECANOAS, l’ajustement de la dose ou les épisodes d’exacerbation des symptômes psychotiques (selon la réponse de chaque patient au traitement). · La dose totale d’halopéridol résultant de l’association des deux formulations ne doit pas dépasser la dose maximale correspondante d’halopéridol oral de 5 mg/jour, ou la dose précédente d’halopéridol oral chez les patients traités au long cours par l’halopéridol oral. |
Insuffisance rénale
L’influence de l’insuffisance rénale sur la pharmacocinétique de l’halopéridol n’a pas été évaluée. Aucun ajustement de la dose n’est recommandé, néanmoins il est conseillé de procéder avec prudence lors de l’utilisation du traitement chez des patients atteints d’insuffisance rénale. Cependant, en cas d’insuffisance rénale sévère, il peut être nécessaire d’utiliser une dose initiale plus faible et d’ajuster ensuite la dose par paliers plus petits et plus espacés que chez les patients ne présentant pas d’insuffisance rénale (voir rubrique 5.2).
Insuffisance hépatique
L’influence de l’insuffisance hépatique sur la pharmacocinétique de l’halopéridol n’a pas été évaluée. L’halopéridol étant très largement métabolisé dans le foie, il est recommandé de réduire la dose initiale de moitié et d’ajuster la dose par paliers plus petits et plus espacés que chez les patients ne présentant pas d’insuffisance hépatique (voir rubriques 4.4 et 5.2).
Population pédiatrique
La sécurité et l’efficacité d’HALDOL DECANOAS chez les enfants et les adolescents âgés de moins de 18 ans n’ont pas été établies. Aucune donnée n’est disponible.
Mode d’administration
HALDOL DECANOAS est destiné à être utilisé par voie intramusculaire uniquement et ne doit pas être administré par voie intraveineuse. Il est administré en injection intramusculaire profonde dans la région glutéale. Il est recommandé d’effectuer les injections en alternance dans l’un et l’autre des deux muscles fessiers. L’administration de volumes supérieurs à 3 mL n’est pas recommandée car elle est inconfortable pour le patient. Pour les instructions concernant la manipulation d’HALDOL DECANOAS, voir rubrique 6.6.
· Hypersensibilité à la substance active ou à l’un des excipients mentionnés à la rubrique 6.1.
· État comateux.
· Dépression du système nerveux central (SNC).
· Maladie de Parkinson.
· Démence à corps de Lewy.
· Paralysie supranucléaire progressive.
· Allongement connu de l’intervalle QTc ou syndrome du QT long congénital.
· Infarctus du myocarde aigu récent.
· Insuffisance cardiaque non compensée.
· Antécédents d’arythmies ventriculaires ou de torsades de pointes.
· Hypokaliémie non corrigée.
· Traitement concomitant par des médicaments allongeant l’intervalle QT (voir rubrique 4.5).
4.4. Mises en garde spéciales et précautions d'emploi
Mortalité accrue chez les personnes âgées atteintes de démence
De rares cas de mort subite ont été signalés chez des patients atteints de troubles psychiatriques traités par des antipsychotiques, notamment par l’halopéridol (voir rubrique 4.8).
Les patients âgés atteints de psychose liée à une démence et traités par des antipsychotiques sont exposés à un risque accru de mortalité. L’analyse de 17 études contrôlées contre placebo (d’une durée modale de 10 semaines), portant essentiellement sur des patients traités par des antipsychotiques atypiques, a révélé un risque de mortalité compris, chez les patients traités, entre 1,6 et 1,7 fois le risque correspondant chez les patients sous placebo. Sur la durée d’une étude contrôlée typique de 10 semaines, le taux de mortalité a été d’environ 4,5 % chez les patients traités par des antipsychotiques, contre 2,6 % environ dans le groupe placebo. Bien que les causes de mortalité aient été diverses, la plupart des décès sont apparus être d’origine cardiovasculaire (insuffisance cardiaque, mort subite, par exemple) ou infectieuse (pneumonie, par exemple). Les études observationnelles semblent indiquer que le traitement par l’halopéridol chez les patients âgés est également associé à une mortalité accrue. Cette association pourrait être plus importante avec l’halopéridol qu’avec les antipsychotiques atypiques ; elle est plus marquée pendant les 30 premiers jours suivant le début du traitement et persiste pendant au moins 6 mois. Il n’a pas été clairement établi dans quelle mesure cette association est imputable au médicament ou plutôt liée aux conditions du patient.
HALDOL DECANOAS n’est pas indiqué pour le traitement des troubles du comportement liés à la démence.
Effets cardiovasculaires
Outre les cas de mort subite, des allongements de l’intervalle QTc et/ou des arythmies ventriculaires ont été signalés avec l’halopéridol (voir rubriques 4.3 et 4.8). Le risque de survenue de ces événements semble être plus élevé à forte dose, à forte concentration plasmatique, chez les patients prédisposés ou en cas d’administration par voie parentérale, en particulier intraveineuse.
HALDOL DECANOAS ne doit pas être administré par voie intraveineuse.
La prudence est conseillée chez les patients présentant une bradycardie, une maladie cardiaque, des antécédents familiaux d’allongement du QTc ou des antécédents de consommation importante d’alcool. La prudence est également requise chez les patients susceptibles de présenter des concentrations plasmatiques élevées (voir rubrique 4.4, Métaboliseurs lents du CYP2D6).
Il est recommandé de réaliser un ECG à l’initiation du traitement. La nécessité d’effectuer des ECG de contrôle pendant le traitement pour surveiller l’allongement de l’intervalle QTc et les arythmies ventriculaires doit être évaluée chez tous les patients. En cas d’allongement du QTc en cours de traitement, il est recommandé de réduire la dose, mais la prise d’halopéridol doit être interrompue si le QTc dépasse 500 ms.
Les déséquilibres électrolytiques tels que l’hypokaliémie et l’hypomagnésémie augmentent le risque d’arythmies ventriculaires et doivent donc être corrigés avant de commencer le traitement par l’halopéridol. Par conséquent, un bilan initial des électrolytes suivi de contrôles réguliers est recommandé.
Des cas de tachycardie et d’hypotension (notamment d’hypotension orthostatique) ont également été signalés (voir rubrique 4.8). La prudence est recommandée lors de l’administration d’halopéridol chez des patients enclins à l’hypotension ou à l’hypotension orthostatique.
Événements vasculaires cérébraux
Lors des études cliniques randomisées, contrôlées contre placebo, menées chez des patients atteints de démence, une augmentation d’un facteur 3 environ du risque d’événements vasculaires cérébraux indésirables a été observée avec certains antipsychotiques atypiques. Les études observationnelles qui ont comparé le taux d’Accident Vasculaire Cérébral (AVC) chez les patients âgés exposés à des antipsychotiques, tous types confondus, au taux d’AVC chez ceux non exposés à des médicaments de ce type ont constaté que le taux d’AVC était plus élevé parmi les patients exposés. Cette majoration pourrait être plus importante avec l’ensemble des butyrophénones, y compris l’halopéridol. Le mécanisme à l’origine de cette augmentation du risque n’est pas connu. Une augmentation du risque ne peut être exclue chez les autres populations de patients. HALDOL DECANOAS doit être utilisé avec prudence chez les patients présentant des facteurs de risque d’AVC.
Syndrome malin des neuroleptiques
L’halopéridol a été associé à des cas de syndrome malin des neuroleptiques : une réaction idiosyncrasique rare caractérisée par une hyperthermie, une rigidité musculaire généralisée, une instabilité du système nerveux autonome, des troubles de la conscience et une augmentation des taux sériques de créatine phosphokinase. L’hyperthermie est souvent un signe précoce de ce syndrome. Le traitement antipsychotique doit être immédiatement interrompu et un traitement symptomatique approprié doit être mis en place, ainsi qu’une surveillance rapprochée.
Dyskinésie tardive
Une dyskinésie tardive peut apparaître chez certains patients traités au long cours ou après l’arrêt du médicament. Le syndrome est principalement caractérisé par des mouvements répétitifs involontaires de la langue, du visage, de la bouche ou de la mâchoire. Les manifestations peuvent être permanentes chez certains patients. Le syndrome peut être occulté par la réinstauration du traitement, l’augmentation de la dose ou le passage à un antipsychotique différent. Si des signes et symptômes de dyskinésie tardive apparaissent, l’arrêt de tous les antipsychotiques, y compris d’HALDOL DECANOAS, doit être envisagé.
Symptômes extrapyramidaux
Des symptômes extrapyramidaux peuvent survenir (par exemple, tremblement, rigidité, hypersalivation, bradykinésie, akathisie, dystonie aiguë). L’utilisation d’halopéridol a été associée à l’apparition d’une akathisie, caractérisée par une sensation subjective d’agitation désagréable ou éprouvante et un besoin de bouger, souvent accompagnés d’une incapacité à rester assis ou debout sans bouger. Cet effet survient le plus souvent pendant les premières semaines du traitement. Chez les patients développant ces symptômes, une augmentation de la dose peut être délétère.
Une dystonie aiguë peut survenir pendant les premiers jours du traitement par l’halopéridol, mais son apparition a également été signalée plus tardivement et à la suite d’augmentations de la dose. Les symptômes dystoniques peuvent comprendre le torticolis, les grimaces faciales, le trismus, la protrusion linguale et les mouvements oculaires anormaux, notamment la crise oculogyre (liste non exhaustive). Le risque de survenue de ces réactions est plus important chez les patients de sexe masculin et les plus jeunes. En cas de dystonie aiguë, il peut être nécessaire d’arrêter la prise du médicament.
Si nécessaire, il est possible de prescrire des médicaments antiparkinsoniens de type anticholinergique pour corriger les symptômes extrapyramidaux, mais il est recommandé de ne pas les prescrire de façon systématique à titre préventif. Lorsqu’un traitement concomitant par un antiparkinsonien est requis, il peut être nécessaire de le poursuivre après l’arrêt d’HALDOL DECANOAS, s’il est excrété plus rapidement que l’halopéridol, afin d’éviter l’apparition ou l’aggravation de symptômes extrapyramidaux. Le risque d’augmentation de la pression intra-oculaire doit être pris en compte lorsque des médicaments anticholinergiques, y compris des médicaments antiparkinsoniens, sont administrés en concomitance avec HALDOL DECANOAS.
Crises épileptiques/convulsions
La survenue de crises épileptiques déclenchées par l’halopéridol a été signalée. La prudence est requise chez les patients atteints d’épilepsie ou présentant des prédispositions aux crises épileptiques (sevrage alcoolique et lésions cérébrales, par exemple).
Sécurité hépatobiliaire
L’halopéridol étant métabolisé par le foie, il est conseillé d’ajuster la dose et de procéder avec prudence chez les patients atteints d’insuffisance hépatique (voir rubriques 4.2 et 5.2). Des cas isolés d’anomalies de la fonction hépatique ou d’hépatite, le plus souvent cholestatique, ont été signalés (voir rubrique 4.8).
Sécurité endocrinienne
La thyroxine peut favoriser l’apparition d’effets toxiques de l’halopéridol. Chez les patients atteints d’hyperthyroïdie, le traitement antipsychotique ne devra être utilisé qu’avec précaution et devra toujours être accompagné d’un traitement visant à rétablir l’euthyroïdie.
Les effets hormonaux des antipsychotiques comprennent l’hyperprolactinémie, laquelle peut entraîner une galactorrhée, une gynécomastie et une oligoménorrhée ou une aménorrhée (voir rubrique 4.8). Les études de cultures tissulaires semblent indiquer que le développement des cellules au sein des tumeurs mammaires humaines pourrait être stimulé par la prolactine. Bien qu’aucune association claire n’ait été démontrée entre l’administration d’antipsychotiques et les tumeurs mammaires humaines lors des études cliniques et épidémiologiques, la prudence est recommandée en présence d’antécédents médicaux pertinents. HALDOL DECANOAS doit être utilisé avec précaution chez les patients présentant une hyperprolactinémie préexistante ou de possibles tumeurs prolactino-dépendantes (voir rubrique 5.3).
Des cas d’hypoglycémie et de syndrome de sécrétion inappropriée d’hormone antidiurétique ont été signalés avec l’halopéridol (voir rubrique 4.8).
Thromboembolie veineuse
Des cas de thromboembolie veineuse (TEV) ont été signalés avec les antipsychotiques. Étant donné que les patients traités par des antipsychotiques présentent souvent des facteurs de risque acquis de TEV, tous les facteurs de risque éventuels de TEV doivent être identifiés avant et pendant le traitement par HALDOL DECANOAS et des mesures préventives doivent être prises.
Instauration du traitement
Lorsqu’un traitement par HALDOL DECANOAS est envisagé, le patient doit être traité initialement avec de l’halopéridol oral afin de réduire le risque de réaction indésirable inattendue à l’halopéridol.
Patients atteints de dépression
Il est recommandé de ne pas utiliser HALDOL DECANOAS seul lorsque la dépression est l’affection prédominante chez un patient. Le médicament peut être associé à des antidépresseurs pour traiter les patients chez lesquels coexistent une dépression et une psychose (voir rubrique 4.5).
Métaboliseurs lents du CYP2D6
HALDOL DECANOAS doit être utilisé avec précaution chez les patients connus pour être des métaboliseurs lents du cytochrome P450 (CYP) 2D6 et recevant en parallèle un inhibiteur du CYP3A4.
Excipients d’HALDOL DECANOAS
HALDOL DECANOAS contient de l’alcool benzylique, qui peut provoquer des réactions allergiques. HALDOL DECANOAS doit être utilisé avec précaution chez les patients atteints d’insuffisance rénale ou hépatique, ainsi que chez les patientes enceintes ou qui allaitent, en raison du risque d’accumulation et de toxicité (acidose métabolique).
HALDOL DECANOAS contient de l'huile de sésame, qui peut dans de rares cas provoquer des réactions allergiques sévères.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Les études d’interaction n’ont été réalisées que chez l’adulte.
Effets cardiovasculaires
L’utilisation d’HALDOL DECANOAS est contre-indiquée en association avec les médicaments connus pour allonger l’intervalle QTc (voir rubrique 4.3), par exemple :
· les anti-arythmiques de classe IA (p. ex., disopyramide, quinidine).
· les anti-arythmiques de classe III (p. ex., amiodarone, dofétilide, dronédarone, ibutilide, sotalol).
· certains antidépresseurs (p. ex., citalopram, escitalopram).
· certains antibiotiques (p. ex., azithromycine, clarithromycine, érythromycine, lévofloxacine, moxifloxacine, télithromycine).
· d’autres antipsychotiques (p. ex., dérivés de la phénothiazine, sertindole, pimozide, ziprasidone).
· certains antifongiques (p. ex., pentamidine).
· certains antipaludéens (p. ex., halofantrine).
· certains traitements gastro-intestinaux (p. ex., dolasétron).
· certains médicaments utilisés pour le traitement du cancer (p. ex., torémifène, vandétanib).
· certains autres médicaments (p. ex., bépridil, méthadone).
Cette liste n’est pas exhaustive.
La prudence est conseillée lorsque HALDOL DECANOAS est utilisé en association avec des médicaments connus pour provoquer un déséquilibre électrolytique (voir rubrique 4.4).
Médicaments pouvant augmenter les concentrations plasmatiques de l’halopéridol
L’halopéridol est métabolisé par plusieurs voies (voir rubrique 5.2). Les principales voies sont la glucurono-conjugaison et la réduction cétonique. Le système enzymatique du cytochrome P450 est également impliqué, en particulier le CYP3A4 et, dans une moindre mesure, le CYP2D6. L’inhibition de ces voies de métabolisation par un autre médicament ou la réduction de l’activité enzymatique du CYP2D6 peuvent conduire à une augmentation des concentrations de l’halopéridol. Les effets de l’inhibition du CYP3A4 et de la réduction de l’activité enzymatique du CYP2D6 peuvent être cumulatifs (voir rubrique 5.2). D’après les informations limitées et parfois contradictoires qui sont disponibles, l’augmentation potentielle des concentrations plasmatiques de l’halopéridol, lors de l’administration concomitante d’un inhibiteur du CYP3A4 et/ou du CYP2D6, peut être comprise entre 20 % et 40 % bien que, dans certains cas, des augmentations allant jusqu’à 100 % aient été rapportées. Les médicaments susceptibles de provoquer une augmentation des concentrations plasmatiques de l’halopéridol (d’après l’expérience clinique ou le mécanisme d’interaction médicamenteuse) comprennent, par exemple :
· les inhibiteurs du CYP3A4 : alprazolam, fluvoxamine, indinavir, itraconazole, kétoconazole, néfazodone, posaconazole, saquinavir, vérapamil, voriconazole.
· les inhibiteurs du CYP2D6 : bupropion, chlorpromazine, duloxétine, paroxétine, prométhazine, sertraline, venlafaxine.
· les inhibiteurs combinés du CYP3A4 et du CYP2D6 : fluoxétine, ritonavir.
· des médicaments dont le mécanisme est incertain : buspirone.
Cette liste n’est pas exhaustive.
L’augmentation des concentrations plasmatiques de l’halopéridol peut entraîner une majoration du risque d’effets indésirables, notamment d’allongement du QTc (voir rubrique 4.4). Des allongements du QTc ont été observés lorsque l’halopéridol a été administré avec une association des inhibiteurs métaboliques que sont le kétoconazole (400 mg/jour) et la paroxétine (20 mg/jour).
Chez les patients prenant de l’halopéridol en concomitance avec des médicaments de ce type, il est recommandé de surveiller les signes ou symptômes d’une majoration ou d’une prolongation des effets pharmacologiques de l’halopéridol et de réduire la dose d’HALDOL DECANOAS si nécessaire.
Médicaments pouvant réduire les concentrations plasmatiques de l’halopéridol
L’administration concomitante d’halopéridol et d’inducteurs enzymatiques puissants du CYP3A4 peut entraîner une diminution progressive des concentrations plasmatiques de l’halopéridol au point d’en réduire potentiellement l’efficacité, par exemple :
· Carbamazépine, phénobarbital, phénytoïne, rifampicine, millepertuis (Hypericum perforatum).
Cette liste n’est pas exhaustive.
Une induction enzymatique peut être observée au bout de quelques jours de traitement. L’induction enzymatique atteint généralement son niveau maximal en l’espace de 2 semaines environ et peut ensuite persister pendant une durée similaire après l’arrêt du traitement par le médicament. En cas de traitement concomitant par des inducteurs du CYP3A4, il est recommandé de maintenir les patients sous surveillance et d’augmenter la dose d’HALDOL DECANOAS si nécessaire. Après l’arrêt de l’inducteur du CYP3A4, la concentration de l’halopéridol peut augmenter progressivement et il peut donc être nécessaire de réduire la dose d’HALDOL DECANOAS.
Le valproate de sodium est connu pour inhiber la glucurono-conjugaison mais n’altère pas les concentrations plasmatiques de l’halopéridol.
Effets de l’halopéridol sur les autres médicaments
L’halopéridol peut amplifier la dépression du SNC induite par l’alcool ou par les médicaments dépresseurs du SNC, notamment les hypnotiques, les sédatifs ou les analgésiques puissants. Une majoration de l’effet sur le SNC a également été rapportée en association avec la méthyldopa.
L’halopéridol peut antagoniser l’action de l’adrénaline et des autres médicaments sympathomimétiques (stimulants tels que les amphétamines, par exemple) et inverser les effets hypotenseurs des antagonistes adrénergiques tels que la guanéthidine.
L’halopéridol peut antagoniser les effets de la lévodopa et des autres agonistes de la dopamine.
L’halopéridol est un inhibiteur du CYP2D6. L’halopéridol inhibe le métabolisme des antidépresseurs tricycliques (imipramine, désipramine, par exemple), ce qui conduit à une augmentation des concentrations plasmatiques de ces médicaments.
Autres formes d’interactions
Dans de rares cas, les symptômes suivants ont été signalés lors de l’utilisation concomitante de lithium et d’halopéridol : encéphalopathie, symptômes extrapyramidaux, dyskinésie tardive, syndrome malin des neuroleptiques, syndrome cérébelleux aigu et coma. La plupart de ces symptômes ont été réversibles. Il n’a pas été clairement établi s’il s’agit là d’une entité clinique distincte.
En cas de traitement concomitant par le lithium et par HALDOL DECANOAS, il est néanmoins conseillé d’arrêter immédiatement le traitement si des symptômes de ce type apparaissent.
Un antagonisme des effets de la phénindione, un anticoagulant, a été rapporté.
4.6. Fertilité, grossesse et allaitement
Grossesse
Un nombre limité de données chez la femme enceinte (plus de 400 grossesses) n’a mis en évidence aucun effet de malformation, ni toxique pour le fœtus ou le nouveau-né de l’halopéridol. Cependant, des cas isolés d’anomalies congénitales ont été signalés après une exposition fœtale à l’halopéridol en association avec d’autres médicaments. Les études effectuées chez l’animal ont mis en évidence une toxicité sur la reproduction (voir rubrique 5.3). Par mesure de précaution, il est préférable d’éviter l’utilisation d’HALDOL DECANOAS pendant la grossesse.
Les nouveau-nés exposés aux antipsychotiques (y compris l’halopéridol) pendant le troisième trimestre de la grossesse courent un risque de réactions indésirables, notamment des symptômes extrapyramidaux et/ou des symptômes de sevrage, dont la sévérité et la durée peuvent varier, après l’accouchement. Des cas d’agitation, d’hypertonie, d’hypotonie, de tremblement, de somnolences, de détresse respiratoire et de troubles alimentaires ont été signalés. Par conséquent, il est recommandé de surveiller étroitement les nouveau-nés.
Allaitement
L’halopéridol est excrété dans le lait maternel. De faibles quantités d’halopéridol ont été détectées dans le plasma et l’urine de nouveau-nés allaités par des mères traitées par l’halopéridol. Il n’existe pas de données suffisantes concernant les effets de l’halopéridol chez les nouveau-nés allaités. Une décision doit être prise soit d’interrompre l’allaitement soit d’interrompre le traitement avec HALDOL DECANOAS en prenant en compte le bénéfice de l’allaitement pour l’enfant au regard du bénéfice du traitement pour la femme.
Fertilité
L’halopéridol augmente le taux de prolactine. L’hyperprolactinémie peut inhiber la GnRH hypothalamique, entraînant une réduction de la sécrétion de gonadotrophine par l’hypophyse. Ceci peut inhiber la fonction de reproduction en altérant la stéroïdogenèse gonadique chez les femmes comme chez les hommes (voir rubrique 4.4).
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
HALDOL DECANOAS a une influence modérée sur l’aptitude à conduire des véhicules et à utiliser des machines. Un certain niveau de sédation ou de perte de vigilance est possible, en particulier à forte dose et en début de traitement, et cet effet peut être potentialisé par l’alcool. Il est recommandé de conseiller aux patients de ne pas conduire de véhicules ou utiliser de machines pendant le traitement, jusqu’à ce que leur sensibilité au médicament soit connue.
La sécurité du décanoate d’halopéridol a été évaluée chez 410 patients dans le cadre de 3 études comparatives (1 comparant le décanoate d’halopéridol à la fluphénazine et 2 comparant la forme décanoate à l’halopéridol oral), de 9 études en ouvert et d’une étude dose-réponse.
D’après les données de sécurité compilées issues de ces études cliniques, les effets indésirables les plus fréquemment signalés ont été : syndrome extrapyramidal (14 %), tremblement (8%), parkinsonisme (7 %), rigidité musculaire (6 %) et somnolences (5 %).
Par ailleurs, la sécurité de l’halopéridol a été évaluée chez 284 patients traités par l’halopéridol dans le cadre de 3 études cliniques contrôlées contre placebo et chez 1 295 patients traités par l’halopéridol dans le cadre de 16 études cliniques en double aveugle contrôlées contre comparateur actif.
Le tableau 3 présente les effets indésirables qui ont été :
· signalés au cours des études cliniques avec le décanoate d’halopéridol ;
· signalés au cours des études cliniques avec l’halopéridol (formulations non-décanoate) en lien avec la fraction active ;
· identifiés dans le cadre de la surveillance post-commercialisation avec le décanoate d’halopéridol et l’halopéridol.
La fréquence des effets indésirables repose sur (ou est estimée d’après) les essais cliniques ou les études épidémiologiques concernant le décanoate d’halopéridol et classée suivant la convention ci-dessous :
Très fréquent : ≥ 1/10
Fréquent : ≥ 1/100, < 1/10
Peu fréquent : ≥ 1/1 000, < 1/100
Rare : ≥ 1/10 000, < 1/1 000
Très rare : < 1/10 000
Fréquence indéterminée : ne peut être estimée sur la base des données disponibles.
Les effets indésirables sont présentés par classe de système d’organes et par ordre décroissant de gravité au sein de chaque catégorie de fréquence.
Tableau 3 : Effets indésirables
|
Classe de système d’organes |
Effet indésirable |
||||
|
|
Fréquence |
||||
|
|
Très fréquent |
Fréquent
|
Peu fréquent
|
Rare
|
Fréquence indéterminée |
|
Affections hématologiques et du système lymphatique |
|
|
|
|
Pancytopénie Agranulocytose Thrombopénie Leucopénie Neutropénie |
|
Affections du système immunitaire |
|
|
|
|
Réaction anaphylactique Hypersensibilité |
|
Affections endocriniennes |
|
|
|
|
Sécrétion inappropriée d’hormone antidiurétique Hyperprolactinémie |
|
Troubles du métabolisme et de la nutrition |
|
|
|
|
Hypoglycémie |
|
Affections psychiatriques |
|
Dépression Insomnies |
|
|
Trouble psychotique Agitation État de confusion Perte de la libido Diminution de la libido Nervosité |
|
Affections du système nerveux |
Syndrome extrapyramidal
|
Akathisie Parkinsonisme Faciès figé Tremblement Somnolences Sédation |
Akinésie Dyskinésie Dystonie Signe de la roue dentée Hypertonie Céphalées |
|
Syndrome malin des neuroleptiques Dyskinésie tardive Convulsion Bradykinésie Hyperkinésie Hypokinésie Sensations vertigineuses Contractions musculaires involontaires Dysfonction motrice Nystagmus |
|
Affections oculaires |
|
|
Crise oculogyre Troubles de la vision |
|
|
|
Affections cardiaques |
|
|
Tachycardie |
|
Fibrillation ventriculaire Torsades de pointes Tachycardie ventriculaire Extrasystoles |
|
Affections vasculaires |
|
|
|
|
Hypotension Hypotension orthostatique |
|
Affections respiratoires, thoraciques et médiastinales |
|
|
|
|
Œdème laryngé Bronchospasme Laryngospasme Dyspnée |
|
Affections gastro-intestinales |
|
Constipation Sécheresse buccale Hypersécrétion salivaire |
|
|
Vomissements Nausées
|
|
Affections hépatobiliaires |
|
|
|
|
Insuffisance hépatique aiguë Hépatite Cholestase Ictère Anomalies du bilan hépatique |
|
Affections de la peau et du tissu sous-cutané |
|
|
|
|
Angio-œdème Dermatite exfoliative Vascularite leucocytoclasique Réaction de photosensibilité Urticaire Prurit Éruption cutanée Hyperhidrose |
|
Affections musculo-squelettiques et systémiques |
|
Rigidité musculaire |
|
|
Rhabdomyolyse Trismus Spasmes musculaires Fasciculations Raideur musculo-squelettique |
|
Affections du rein et des voies urinaires |
|
|
|
|
Rétention urinaire |
|
Affections gravidiques, puerpérales et périnatales |
|
|
|
|
Syndrome de sevrage médicamenteux chez le nouveau-né (voir rubrique 4.6) |
|
Affections des organes de reproduction et du sein |
|
Dysfonction sexuelle
|
|
|
Priapisme Aménorrhée Galactorrhée Ménorragie Dysfonction érectile Gynécomastie Troubles menstruels Douleur mammaire Gêne mammaire |
|
Troubles généraux et anomalies au site d’administration |
|
Réaction au site d’injection |
|
|
Mort subite Œdème de la face Œdème Hyperthermie Hypothermie Troubles de la démarche Abcès au site d’injection |
|
Investigations |
|
Prise de poids |
|
|
Allongement du QT à l’électrocardiogramme Perte de poids |
Des allongements de l’intervalle QT à l’électrocardiogramme, des arythmies ventriculaires (fibrillation ventriculaire, tachycardie ventriculaire), des torsades de pointes et des morts subites ont été signalés avec l’halopéridol.
Effets de classe des antipsychotiques
Des arrêts cardiaques ont été signalés avec les antipsychotiques.
Des cas de thromboembolie veineuse, y compris des cas d’embolie pulmonaire et de thrombose veineuse profonde, ont été signalés avec les antipsychotiques. La fréquence de ces événements n’est pas connue.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr.
Le risque de surdosage étant plus faible lors d’une administration parentérale qu’avec un traitement oral, les indications suivantes correspondent à l’halopéridol utilisé par voie orale mais tiennent également compte de la durée d’action plus longue d’HALDOL DECANOAS.
Signes et symptômes
Le surdosage de l’halopéridol se manifeste par une exagération des effets pharmacologiques et indésirables connus du médicament. Les symptômes prédominants sont des réactions extrapyramidales sévères, une hypotension et une sédation. Les réactions extrapyramidales se présentent sous la forme d’une rigidité musculaire et d’un tremblement généralisé ou localisé. Il est également possible qu’une hypertension survienne au lieu d’une hypotension.
Dans les cas extrêmes, le patient paraîtra comateux, avec une dépression respiratoire et une hypotension suffisamment sévères pour entraîner un état comparable à l’état de choc. Le risque d’arythmies ventriculaires, potentiellement associées à un allongement du QTc, doit être envisagé.
Traitement
Il n’existe aucun antidote spécifique. Le traitement sera symptomatique. La dialyse ne permettant d’éliminer que de très faibles quantités d’halopéridol, son utilisation n’est pas recommandée pour le traitement du surdosage (voir rubrique 5.2).
Si le patient est comateux, ses voies aériennes doivent être maintenues dégagées au moyen d’une canule oropharyngée ou d’une sonde endotrachéale. Une ventilation artificielle peut être nécessaire en cas de dépression respiratoire.
Il est recommandé de surveiller l’ECG et les signes vitaux et de poursuivre la surveillance jusqu’à ce que l’ECG soit normal. Il est également recommandé de traiter les arythmies sévères en prenant les mesures anti-arythmiques appropriées.
L’hypotension et le collapsus cardiovasculaire peuvent être contrebalancés au moyen d’un remplissage vasculaire, de plasma ou d’albumine concentrée et d’agents vasopresseurs tels que la dopamine ou la noradrénaline. L’adrénaline ne doit pas être utilisée car elle pourrait provoquer une hypotension profonde en présence d’halopéridol.
En cas de réaction extrapyramidale sévère, il est recommandé d’administrer un médicament antiparkinsonien et de poursuivre ce traitement pendant plusieurs semaines. L’arrêt des antiparkinsoniens doit se faire avec une extrême prudence car il peut donner lieu à l’apparition de symptômes extrapyramidaux.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Classe pharmacothérapeutique : psycholeptiques ; antipsychotiques ; dérivés de la butyrophénone, code ATC : N05AD01.
Mécanisme d’action
Le décanoate d’halopéridol est un ester d’halopéridol et d’acide décanoïque et constitue à ce titre un antipsychotique retard appartenant à la famille des butyrophénones. Après injection intramusculaire, le décanoate d’halopéridol est progressivement libéré par le tissu musculaire et lentement hydrolysé pour former de l’halopéridol libre, lequel rejoint la circulation générale.
L’halopéridol est un puissant antagoniste central des récepteurs dopaminergiques de type 2 qui, aux doses recommandées, exerce une faible activité alpha-1 anti-adrénergique et n’a aucune activité anti-histaminergique ou anticholinergique.
Effets pharmacodynamiques
L’halopéridol inhibe les idées délirantes et les hallucinations en conséquence directe du blocage de la signalisation dopaminergique au sein de la voie mésolimbique. L’effet de blocage central de la dopamine exerce une activité sur les noyaux gris centraux (faisceaux nigro-striés). L’halopéridol provoque une sédation psychomotrice efficace, ce qui explique son effet positif sur la manie et les autres syndromes d’agitation.
L’action sur les noyaux gris centraux est probablement à l’origine des effets indésirables moteurs extrapyramidaux (dystonie, akathisie et parkinsonisme).
Les effets anti-dopaminergiques de l’halopéridol sur les cellules lactotropes de l’anté-hypophyse expliquent l’hyperprolactinémie due à l’inhibition tonique de la sécrétion de prolactine médiée par la dopamine.
Etudes cliniques
Au cours des études cliniques, la plupart des patients avaient été traités précédemment par de l’halopéridol administré par voie orale avant de passer sous décanoate d’halopéridol. Dans quelques cas, les patients avaient reçu auparavant un traitement oral par un autre antipsychotique.
5.2. Propriétés pharmacocinétiques
Absorption
L’administration de décanoate d’halopéridol sous forme d’injection retard par voie intramusculaire conduit à une libération lente et prolongée d’halopéridol libre. Les concentrations plasmatiques augmentent progressivement et atteignent généralement leur valeur maximale 3 à 9 jours après l’injection.
L’état d’équilibre des concentrations plasmatiques est atteint en 2 à 4 mois chez les patients recevant des injections mensuelles.
Distribution
Le taux de liaison moyen de l’halopéridol avec les protéines plasmatiques est d’environ 88 % à 92 % chez l’adulte. Le taux de liaison avec les protéines plasmatiques est soumis à une forte variabilité interindividuelle. L’halopéridol est rapidement distribué dans les divers tissus et organes, comme indiqué par son large volume de distribution (moyennes de 8 à 21 L/kg après administration intraveineuse). L’halopéridol traverse facilement la barrière hémato-encéphalique. Il traverse également la barrière placentaire et est excrété dans le lait maternel.
Biotransformation
L’halopéridol est très largement métabolisé dans le foie. Les principales voies métaboliques de l’halopéridol chez l’être humain comprennent la glucurono-conjugaison, la réduction cétonique, la N-désalkylation oxydative et la formation de métabolites pyridinium. Les métabolites de l’halopéridol ne sont pas considérés comme contribuant de façon significative à son activité ; cependant, la voie de réduction représente environ 23 % de la biotransformation et une rétroconversion du métabolite réduit de l’halopéridol en halopéridol ne peut être totalement exclue. Les enzymes CYP3A4 et CYP2D6 du cytochrome P450 sont impliquées dans le métabolisme de l’halopéridol. L’inhibition ou l’induction du CYP3A4, ou l’inhibition du CYP2D6, peuvent altérer le métabolisme de l’halopéridol. La réduction de l’activité enzymatique du CYP2D6 peut entraîner une augmentation des concentrations de l’halopéridol.
Élimination
La demi-vie d’élimination finale de l’halopéridol, après injection intramusculaire de décanoate d’halopéridol, est en moyenne de 3 semaines. Elle est plus longue que pour les formulations d’halopéridol non-décanoate, dont la demi-vie d’élimination terminale est en moyenne de 24 heures après administration orale et de 21 heures après administration intramusculaire.
La clairance apparente de l’halopéridol après administration extravasculaire est comprise entre 0,9 et 1,5 L/h/kg et elle est réduite chez les métaboliseurs lents du CYP2D6. La réduction de l’activité enzymatique du CYP2D6 peut entraîner une augmentation des concentrations de l’halopéridol. La variabilité interindividuelle (coefficient de variation, %) de la clairance de l’halopéridol a été estimée à 44 % lors d’une analyse pharmacocinétique de population chez des patients atteints de schizophrénie. Après administration intraveineuse de l’halopéridol, 21 % de la dose ont été éliminés dans les selles et 33 % dans les urines. Moins de 3 % de la dose sont excrétés sous forme inchangée dans les urines.
Linéarité/non-linéarité
La pharmacocinétique de l’halopéridol, après injection intramusculaire sous forme de décanoate d’halopéridol, est liée à la dose. La relation entre la dose et la concentration plasmatique de l’halopéridol est à peu près linéaire pour les doses inférieures à 450 mg.
Populations particulières
Personnes âgées
Les concentrations plasmatiques de l’halopéridol ont été plus élevées chez les patients âgés que chez les adultes plus jeunes après administration de la même dose. Les résultats issus d’études cliniques de taille limitée semblent indiquer une clairance plus faible et une demi-vie d’élimination plus longue de l’halopéridol chez les patients âgés. Les résultats se situent dans les limites de la variabilité observée au niveau de la pharmacocinétique de l’halopéridol. Un ajustement de la dose est recommandé chez les patients âgés (voir rubrique 4.2).
Insuffisance rénale
L’influence de l’insuffisance rénale sur la pharmacocinétique de l’halopéridol n’a pas été évaluée. Un tiers environ de la dose d’halopéridol est excrété dans les urines, principalement sous forme de métabolites. Moins de 3 % de l’halopéridol administré sont éliminés sous forme inchangée dans les urines. Les métabolites de l’halopéridol ne sont pas considérés comme contribuant de façon significative à son activité, bien qu’une rétroconversion en halopéridol ne puisse être exclue dans le cas du métabolite réduit de l’halopéridol. Même si l’altération de la fonction rénale ne semble pas devoir affecter l’élimination de l’halopéridol de façon cliniquement significative, il est conseillé de procéder avec prudence en présence d’une insuffisance rénale, en particulier en cas d’insuffisance sévère, en raison de la longue demi-vie de l’halopéridol et de son métabolite réduit, ainsi que de l’éventualité d’une accumulation (voir rubrique 4.2).
Étant donnés le volume de distribution important de l’halopéridol et son fort taux de liaison avec les protéines plasmatiques, la dialyse ne permet de l’éliminer qu’en très faible quantité.
Insuffisance hépatique
L’influence de l’insuffisance hépatique sur la pharmacocinétique de l’halopéridol n’a pas été évaluée. Cependant, l’insuffisance hépatique peut avoir des effets significatifs sur la pharmacocinétique de l’halopéridol dans la mesure où le médicament est très largement métabolisé dans le foie. Par conséquent, il est conseillé d’ajuster la dose et de procéder avec prudence chez les patients atteints d’insuffisance hépatique (voir rubriques 4.2 et 4.4).
Relations pharmacocinétique/pharmacodynamique
Concentrations thérapeutiques
D’après les données publiées à la suite de multiples études cliniques, une réponse thérapeutique est obtenue chez la plupart des patients atteints de schizophrénie aiguë ou chronique à des concentrations plasmatiques de 1 à 10 ng/mL. Des concentrations plus élevées peuvent être nécessaires chez une partie des patients en raison de la forte variabilité pharmacocinétique interindividuelle de l’halopéridol.
Chez les patients connaissant un premier épisode de schizophrénie et traités par des formulations d’halopéridol à courte durée d’action, une réponse au traitement peut être obtenue à des concentrations de seulement 0,6 à 3,2 ng/mL, comme estimé d’après la mesure du taux d’occupation des récepteurs D2 et en partant de l’hypothèse qu’un taux d’occupation des récepteurs D2 de 60 % à 80 % est le plus adapté pour obtenir une réponse au traitement et limiter les symptômes extrapyramidaux. En moyenne, ces concentrations devraient pouvoir être atteintes avec des doses de 1 à 4 mg par jour.
En raison de la forte variabilité interindividuelle de la pharmacocinétique de l’halopéridol et de la relation concentration-effet, il est recommandé d’ajuster la dose de décanoate d’halopéridol au cas par cas selon la réponse au traitement chez le patient. Il convient alors de tenir compte du délai nécessaire pour obtenir une nouvelle concentration plasmatique à l’état d’équilibre après la modification de la dose et du temps supplémentaire requis pour l’obtention d’une réponse au traitement. Une mesure des concentrations plasmatiques de l’halopéridol peut être envisagée dans certains cas.
Effets cardiovasculaires
Le risque d’allongement du QTc augmente avec la dose et les concentrations plasmatiques de l’halopéridol.
Symptômes extrapyramidaux
Des symptômes extrapyramidaux peuvent survenir dans l’intervalle thérapeutique, mais leur fréquence est généralement plus élevée aux doses conduisant à des concentrations supérieures aux concentrations thérapeutiques.
5.3. Données de sécurité préclinique
Les données non cliniques issues des études conventionnelles de tolérance locale, de toxicologie en administration répétée et de génotoxicité n’ont pas révélé de risque particulier pour l’homme. Chez les rongeurs, l’administration d’halopéridol a entraîné une réduction de la fertilité, une tératogénicité limitée ainsi que des effets embryotoxiques.
Lors d’une étude sur la cancérogénicité de l’halopéridol, des augmentations doses-dépendantes des adénomes hypophysaires et des carcinomes mammaires ont été observées chez les souris femelles. Ces tumeurs pourraient avoir été causées par l’antagonisation prolongée des récepteurs dopaminergiques D2 et l’hyperprolactinémie. La pertinence clinique de ces tumeurs constatées chez les rongeurs n’est pas connue chez l’homme.
Plusieurs études in vitro publiées ont montré que l’halopéridol bloque le canal hERG des cellules cardiaques. Dans un certain nombre d’études in vivo, l’administration intraveineuse d’halopéridol chez certains modèles animaux a provoqué un allongement significatif du QTc à des doses d’environ 0,3 mg/kg, conduisant à une Cmax plasmatique au moins 7 à 14 fois supérieure aux concentrations plasmatiques thérapeutiques de 1 à 10 ng/mL qui ont été efficaces chez la majorité des patients au cours des études cliniques. Ces doses intraveineuses, qui ont entraîné un allongement du QTc, n’ont pas provoqué d’arythmies. Lors de certaines études effectuées chez l’animal, des doses intraveineuses d’halopéridol plus élevées, de 1 mg/kg ou plus, ont entraîné un allongement du QTc et/ou des arythmies ventriculaires à une Cmax au moins 38 à 137 fois supérieure aux concentrations plasmatiques thérapeutiques qui ont été efficaces chez la majorité des patients au cours des études cliniques.
Alcool benzylique, huile de sésame.
Sans objet.
3 ans.
6.4. Précautions particulières de conservation
A conserver dans l’emballage d’origine à l’abri de la lumière. Ce médicament ne nécessite pas de précautions particulières de conservation concernant la température.
6.5. Nature et contenu de l'emballage extérieur
1 ml ou 3 ml de solution en ampoule de verre ambré.
Ampoules de 1 ml: boîte de 1, 3 ou 5 ampoules.
Ampoules de 3 ml: boîte de 1 ou 5 ampoules ; multipacks contenant 50 (10 boîtes de 5) ampoules.
Toutes les présentations peuvent ne pas être commercialisées.
6.6. Précautions particulières d’élimination et de manipulation
|
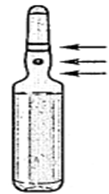
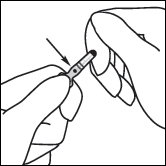
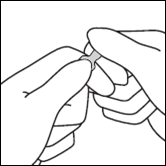
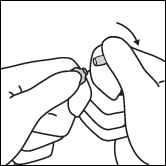
· Avant d’utiliser l’ampoule, la faire rouler brièvement entre les paumes des mains afin de réchauffer le produit. · Tenir l’ampoule entre le pouce et l’index, en laissant le haut de l’ampoule libre. · De l’autre main, tenir le haut de l’ampoule en posant l’index sur le col de l’ampoule et le pouce sur le point coloré, parallèlement à l’anneau de couleur. · En maintenant le pouce sur le point, casser le haut de l’ampoule d’un mouvement sec tout en tenant fermement le corps de l’ampoule dans la main.
|
|
Anneau de couleur Point coloré Zone de cassure |
|
|
|
|||
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
Vision Exchange Building
Triq it-Territorjals, Zone 1,
Central Business District,
Birkirkara, CBD 1070,
MALTE
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 326 993 2 2 : 1 ml en ampoule (verre) : Boîte de 1.
· 34009 326 351 0 8 : 1 ml en ampoule (verre) : Boîte de 5.
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Sans objet.
Liste I.
ANSM - Mis à jour le : 26/04/2023
HALDOL DECANOAS 50 mg/ml, solution injectable
Halopéridol
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin, votre pharmacien ou votre infirmier/ère.
· Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d’autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin, votre pharmacien ou votre infirmier/ère. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
1. Qu'est-ce que HALDOL DECANOAS 50 mg/ml, solution injectable et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant de recevoir HALDOL DECANOAS 50 mg/ml, solution injectable ?
3. Comment utiliser HALDOL DECANOAS 50 mg/ml, solution injectable ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver HALDOL DECANOAS 50 mg/ml, solution injectable ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE HALDOL DECANOAS 50 mg/ml, solution injectable ET DANS QUELS CAS EST-IL UTILISE ?
Le nom de votre médicament est HALDOL DECANOAS 50 mg/ml, solution injectable.
HALDOL DECANOAS contient une substance active appelée halopéridol (sous forme de décanoate d’halopéridol). Il appartient à un groupe de médicaments appelés « antipsychotiques ».
HALDOL DECANOAS est utilisé chez les adultes dont la maladie a été traitée précédemment par de l’halopéridol pris par voie orale. Il est utilisé pour traiter des maladies affectant les pensées, les sensations ou le comportement. Cela comprend des problèmes de santé mentale (tels que la schizophrénie). Ces maladies peuvent provoquer chez vous :
· un état de confusion (délire)
· voir, entendre, ressentir ou sentir des choses qui ne sont pas réelles (hallucinations)
· croire des choses qui ne sont pas réelles (idées délirantes)
· une suspicion anormale (paranoïa)
· un fort sentiment d’excitation, d’agitation, d’enthousiasme, de l’impulsivité ou de l’hyperactivité
· un comportement très agressif, hostile ou violent.
N’utilisez jamais HALDOL DECANOAS 50 mg/ml, solution injectable si :
· vous êtes allergique à l’halopéridol ou à l’un des autres composants contenus dans ce médicament (mentionnés dans la rubrique 6)
· votre niveau de conscience est altéré ou si vos réactions deviennent anormalement lentes
· vous avez une maladie de Parkinson
· vous avez un type de démence appelé « démence à corps de Lewy »
· vous avez une paralysie supranucléaire progressive (PSP)
· vous avez une maladie cardiaque appelée « allongement de l’intervalle QT » ou tout autre trouble du rythme cardiaque mis en évidence par un tracé anormal sur l’électrocardiogramme (ECG)
· vous avez une insuffisance cardiaque ou avez récemment eu une crise cardiaque
· le taux de potassium dans votre sang est faible et que vous n’avez pas reçu de traitement pour cela
· vous prenez l’un des médicaments mentionnés dans la rubrique « Autres médicaments et HALDOL DECANOAS 50 mg/ml, solution injectable - N’utilisez pas HALDOL DECANOAS 50 mg/ml, solution injectable si vous prenez d’autres médicaments pour traiter ».
Ce médicament ne doit pas être utilisé si vous vous trouvez dans l’une des situations décrites ci-dessus. En cas de doute, adressez-vous à votre médecin, pharmacien ou infirmier/ère avant de recevoir HALDOL DECANOAS.
Avertissements et précautions
Effets indésirables graves
HALDOL DECANOAS peut provoquer des problèmes cardiaques, des difficultés à contrôler les mouvements du corps ou des membres et un effet indésirable grave appelé « syndrome malin des neuroleptiques ». Il peut également entraîner des réactions allergiques sévères et des caillots sanguins. Vous devez avoir connaissance des effets indésirables graves possibles pendant le traitement par HALDOL DECANOAS car vous pourriez avoir besoin d’un traitement médical en urgence, le cas échéant. Voir « Soyez attentif aux effets indésirables graves » dans la rubrique 4.
Personnes âgées et personnes atteintes de démence
Une légère augmentation de la mortalité et des accidents vasculaires cérébraux a été signalée chez les personnes âgées atteintes de démence prenant des antipsychotiques. Adressez-vous à votre médecin avant de recevoir HALDOL DECANOAS si vous êtes âgé(e), en particulier si vous souffrez de démence.
Adressez-vous à votre médecin si vous présentez :
· un rythme cardiaque lent, une maladie cardiaque, ou si quelqu’un de votre famille proche est décédé subitement à cause de problèmes cardiaques
· une tension artérielle basse ou des vertiges lorsque vous vous levez ou vous asseyez
· un faible taux de potassium ou de magnésium (ou d’un autre électrolyte) dans votre sang. Votre médecin déterminera comment traiter ce problème
· des antécédents de saignement dans le cerveau, ou si votre médecin vous a indiqué que vous risquiez plus que les autres d’avoir un AVC
· une épilepsie ou avez déjà fait des crises épileptiques (convulsions)
· des problèmes de reins, de foie ou de thyroïde
· un taux élevé de l’hormone appelée « prolactine » dans votre sang, ou un cancer pouvant être provoqué par des taux élevés de prolactine (comme le cancer du sein)
· des antécédents de caillots sanguins, ou si un membre de votre famille a des antécédents de caillots sanguins
· une dépression.
Vous pourriez avoir besoin d’une surveillance plus étroite et il pourrait être nécessaire de modifier la quantité d’HALDOL DECANOAS que vous recevez.
Si vous n’êtes pas sûr(e) de savoir si vous êtes concerné(e) par l’une des situations ci-dessus, adressez-vous à votre médecin ou infirmier/ère avant de recevoir HALDOL DECANOAS.
Contrôles médicaux
Votre médecin pourra décider de réaliser un électrocardiogramme (ECG) avant ou pendant votre traitement par HALDOL DECANOAS. L’ECG mesure l’activité électrique de votre cœur.
Analyses sanguines
Votre médecin pourra décider de contrôler les taux de potassium ou de magnésium (ou d’un autre électrolyte) dans votre sang avant ou pendant votre traitement par HALDOL DECANOAS.
Enfants et adolescents
HALDOL DECANOAS ne doit pas être utilisé chez les enfants et les adolescents âgés de moins de 18 ans car il n’a pas été étudié chez ces classes d’âge.
Autres médicaments et HALDOL DECANOAS 50 mg/ml, solution injectable
Informez votre médecin, pharmacien ou infirmier/ère si vous prenez, avez récemment pris ou pourriez prendre tout autre médicament.
N’utilisez pas HALDOL DECANOAS si vous prenez d’autres médicaments pour traiter :
· des problèmes cardiaques (comme l’amiodarone, le dofétilide, le disopyramide, la dronédarone, l’ibutilide, la quinidine et le sotalol)
· une dépression (comme le citalopram et l’escitalopram)
· une psychose (comme la fluphénazine, la lévomépromazine, la perphénazine, le pimozide, la prochlorpérazine, la promazine, le sertindole, la thiorizadine, la trifluopérazine, la triflupromazine et la ziprasidone)
· une infection bactérienne (comme l’azithromycine, la clarithromycine, l’érythromycine, la lévofloxacine, la moxifloxacine et la télithromycine)
· une infection fongique (comme la pentamidine)
· le paludisme (comme l’halofantrine)
· les nausées et vomissements (comme le dolasétron)
· un cancer (comme le torémifène et le vandétanib).
Prévenez également votre médecin si vous prenez du bépridil (pour des douleurs thoraciques ou pour faire baisser votre tension artérielle) ou de la méthadone (comme antidouleur ou pour traiter une toxicomanie).
Ces médicaments pourraient augmenter le risque de problèmes cardiaques ; par conséquent, si vous prenez l’un de ces médicaments, parlez-en à votre médecin et n’utilisez pas HALDOL DECANOAS (voir « N’utilisez jamais HALDOL DECANOAS 50 mg/ml, solution injectable si »).
Une surveillance particulière pourrait être nécessaire si vous utilisez du lithium en même temps qu’HALDOL DECANOAS. Prévenez immédiatement votre médecin et arrêtez de prendre les deux médicaments si vous présentez :
· une fièvre inexplicable ou des mouvements incontrôlables ;
· une confusion, une désorientation, des maux de tête, des problèmes d’équilibre et des somnolences.
Ces signes indiquent une maladie grave.
Certains médicaments pourraient altérer le fonctionnement d’HALDOL DECANOAS ou augmenter le risque de problèmes cardiaques
Informez votre médecin si vous prenez :
· de l’alprazolam ou de la buspirone (pour l’anxiété)
· de la duloxétine, de la fluoxétine, de la fluvoxamine, de la néfazodone, de la paroxétine, de la sertraline, du millepertuis (Hypericum perforatum) ou de la venlafaxine (pour la dépression)
· du bupropion (pour la dépression ou l’aide à l’arrêt du tabac)
· de la carbamazépine, du phénobarbital ou de la phénytoïne (pour l’épilepsie)
· de la rifampicine (pour une infection bactérienne)
· de l’itraconazole, du posaconazole ou du voriconazole (pour une infection fongique)
· du kétoconazole en comprimés (pour traiter le syndrome de Cushing)
· de l’indinavir, du ritonavir ou du saquinavir (pour une infection par le virus de l’immunodéficience humaine, le VIH)
· de la chlorpromazine ou de la prométhazine (pour des nausées et vomissements)
· du vérapamil (pour la pression artérielle ou les problèmes cardiaques).
Prévenez également votre médecin si vous prenez un autre médicament pour faire baisser votre tension artérielle, tel qu’un diurétique.
Si vous prenez l’un de ces médicaments, votre médecin devra peut-être modifier votre dose d’HALDOL DECANOAS.
HALDOL DECANOAS peut altérer le fonctionnement des types de médicaments suivants
Informez votre médecin si vous prenez des médicaments pour :
· vous calmer ou vous aider à dormir (tranquillisants)
· la douleur (antalgiques puissants)
· la dépression (« antidépresseurs tricycliques »)
· faire baisser votre tension artérielle (comme la guanéthidine et la méthyldopa)
· des réactions allergiques sévères (adrénaline)
· un trouble de déficit de l’attention avec ou sans hyperactivité (TDAH) ou une narcolepsie (médicaments appelés « stimulants »)
· une maladie de Parkinson (comme la lévodopa)
· fluidifier le sang (phénindione).
Adressez-vous à votre médecin ou infirmier/ère avant de recevoir HALDOL DECANOAS si vous prenez l’un de ces médicaments.
HALDOL DECANOAS 50 mg/ml, solution injectable avec de l’alcool
La consommation d’alcool pendant le traitement par HALDOL DECANOAS peut entraîner des somnolences et une perte de vigilance. Vous devez donc faire attention à la quantité d’alcool que vous consommez. Parlez avec votre médecin de la consommation d’alcool pendant le traitement par HALDOL DECANOAS et indiquez-lui en quelle quantité vous en consommez.
Grossesse, allaitement et fertilité
Grossesse : si vous êtes enceinte, si vous pensez être enceinte ou planifiez une grossesse, demandez conseil à votre médecin. Votre médecin pourra vous conseiller de ne pas utiliser HALDOL DECANOAS pendant votre grossesse.
Chez les nouveau-nés dont les mères ont utilisé HALDOL DECANOAS pendant les 3 derniers mois de la grossesse (dernier trimestre), les problèmes suivants pourraient survenir :
· tremblements musculaires, raideur ou faiblesse des muscles ;
· somnolences ou agitation ;
· difficultés à respirer ou à s’alimenter.
La fréquence exacte de ces problèmes n’est pas connue. Si vous avez utilisé HALDOL DECANOAS pendant votre grossesse et que l’un de ces effets indésirables apparaît chez votre enfant, contactez votre médecin.
Allaitement : si vous allaitez ou prévoyez d’allaiter, parlez-en à votre médecin. En effet, de petites quantités du médicament pourraient passer dans le lait maternel et être absorbées par l’enfant. Votre médecin vous expliquera quels sont les risques et les bénéfices liés à l’allaitement pendant le traitement par HALDOL DECANOAS.
Fertilité : HALDOL DECANOAS pourrait augmenter le taux d’une hormone appelée « prolactine », ce qui pourrait altérer la fertilité masculine et féminine. Si vous avez des questions à ce sujet, adressez-vous à votre médecin.
Conduite de véhicules et utilisation de machines
HALDOL DECANOAS peut altérer votre aptitude à conduire des véhicules ou à utiliser des machines. Des effets indésirables, tels que la somnolence, peuvent altérer votre vigilance, en particulier lors de la première utilisation ou après administration d’une dose élevée. Ne conduisez pas de véhicules et n’utilisez pas d’outils ou de machines sans en avoir discuté au préalable avec votre médecin.
HALDOL DECANOAS 50 mg/ml, solution injectable contient de l’alcool benzylique et de l’huile de sésame
Ce médicament contient 15 mg d’alcool benzylique dans chaque ml de solution. L’alcool benzylique peut provoquer des réactions allergiques. Demandez conseil à votre médecin ou à votre pharmacien si vous avez une maladie hépatique ou rénale, ou si vous êtes enceinte ou allaitez. En effet, de grandes quantités d’alcool benzylique peuvent s’accumuler dans votre corps et provoquer des effets indésirables (appelé « acidose métabolique »).
Ce médicament contient aussi de l’huile de sésame, qui peut dans de rares cas induire des réactions allergiques sévères.
3. COMMENT UTILISER HALDOL DECANOAS 50 mg/ml, solution injectable ?
Quelle quantité de médicament recevrez-vous ?
Votre médecin déterminera la quantité d’HALDOL DECANOAS dont vous avez besoin et la durée du traitement. Votre médecin ajustera la dose selon vos besoins et pourra également vous prescrire une forme d’halopéridol à prendre par voie orale. La dose de décanoate d’halopéridol que vous recevrez dépendra :
· de votre âge
· de l’état de vos reins ou votre foie
· de la façon dont vous avez réagi précédemment à l’halopéridol
· des autres médicaments que vous prenez.
Adultes
· La dose initiale sera normalement comprise entre 25 mg et 150 mg.
· Votre médecin pourra ajuster la dose par paliers de 50 mg toutes les 4 semaines de façon à trouver la dose qui vous convient le mieux (habituellement comprise entre 50 mg et 200 mg toutes les 4 semaines).
· Vous ne recevrez pas plus de 300 mg toutes les 4 semaines.
Personnes âgées
· Chez les personnes âgées, le traitement sera normalement commencé à une dose plus faible, habituellement comprise entre 12,5 mg et 25 mg toutes les 4 semaines.
· La dose pourra être ajustée jusqu’à ce que le médecin trouve celle qui vous convient le mieux (habituellement comprise entre 25 mg et 75 mg toutes les 4 semaines).
· Vous recevrez une dose supérieure à 75 mg toutes les 4 semaines dans le seul cas ou votre médecin estime que cela est sans danger.
Comment HALDOL DECANOAS 50 mg/ml, solution injectable est-il administré ?
HALDOL DECANOAS vous sera administré par un médecin ou un(e) infirmier/ère. Il doit être administré par voie intramusculaire, c’est-à-dire injecté en profondeur dans un muscle. Une dose unique d’HALDOL DECANOAS fera normalement effet pendant 4 semaines. HALDOL DECANOAS ne doit pas être injecté dans une veine.
Si vous avez reçu plus d’HALDOL DECANOAS 50 mg/ml, solution injectable que vous n’auriez dû
Ce médicament vous sera administré par un médecin ou un(e) infirmier/ère ; il est donc peu probable que vous receviez plus de médicament que vous n’auriez dû. En cas d’inquiétude, parlez-en avec le médecin ou l’infirmier/ère.
Si vous oubliez une dose ou si vous arrêtez d’utiliser HALDOL DECANOAS 50 mg/ml, solution injectable
Vous ne devez pas arrêter ce médicament sans que votre médecin ne vous ai dit de le faire car vos symptômes peuvent réapparaitre. Si vous manquez un rendez-vous, contactez immédiatement votre médecin pour fixer un nouveau rendez-vous.
Si vous avez d’autres questions sur l’utilisation de ce médicament, demandez plus d’informations à votre médecin ou pharmacien.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Soyez attentif aux effets indésirables graves
Informez immédiatement votre médecin ou votre infirmier/ère si vous remarquez ou suspectez l’un des effets indésirables suivants. Vous pourriez avoir besoin d’un traitement médical en urgence.
Problèmes cardiaques :
· Rythme cardiaque anormal, empêchant le cœur de fonctionner normalement et pouvant provoquer une perte de conscience
· Rythme cardiaque anormalement rapide
· Battements de cœur supplémentaires
Les problèmes cardiaques sont peu fréquents chez les personnes utilisant HALDOL DECANOAS (peuvent affecter jusqu’à 1 personne sur 100). Des cas de mort subite se sont produits chez des patients utilisant ce médicament, mais la fréquence exacte de ces décès n’est pas connue. Des arrêts cardiaques (cœur qui s’arrête de battre) se sont également produits chez des personnes prenant des antipsychotiques.
Problème grave appelé « syndrome malin des neuroleptiques », qui provoque une forte fièvre, une raideur musculaire sévère, une confusion et une perte de conscience. La fréquence exacte de cet effet indésirable chez les personnes traitées par HALDOL DECANOAS n'est pas connue.
Problèmes de contrôle des mouvements du corps ou des membres (syndrome extrapyramidal), notamment :
· des mouvements de la bouche, de la langue, de la mâchoire et parfois des membres (dyskinésie tardive)
· une agitation ou des difficultés à rester assis sans bouger, une amplification des mouvements du corps
· des mouvements du corps ralentis ou réduits, des mouvements saccadés ou erratiques
· un tremblement ou une raideur musculaire, un pas traînant
· une incapacité à bouger
· une expression figée du visage pouvant faire penser à un masque.
Ces problèmes sont très fréquents chez les personnes utilisant HALDOL DECANOAS (peuvent toucher plus d’une personne sur 10). Si vous présentez l’un de ces effets, un médicament supplémentaire pourra vous être prescrit.
Réaction allergique sévère, avec notamment :
· un gonflement du visage, des lèvres, de la bouche, de la langue ou de la gorge
· des difficultés à avaler ou à respirer
· une éruption cutanée avec démangeaisons (urticaire).
La fréquence exacte des réactions allergiques chez les personnes traitées par HALDOL DECANOAS n'est pas connue.
Caillots sanguins dans les veines, généralement dans les jambes (thrombose veineuse profonde, TVP). Ce problème a été signalé chez des personnes prenant des antipsychotiques. Les signes d’une TVP dans la jambe comprennent un gonflement, une douleur et une rougeur au niveau de la jambe, mais le caillot peut également se déplacer vers les poumons et provoquer une douleur thoracique et des difficultés à respirer. Les caillots sanguins peuvent être très graves ; vous devez donc prévenir immédiatement votre médecin si vous remarquez l’un de ces problèmes.
Informez immédiatement votre médecin si vous remarquez l’un des effets indésirables graves mentionnés ci-dessus.
Autres effets indésirables
Informez votre médecin si vous remarquez ou suspectez l’un des effets indésirables suivants.
Fréquent (pouvant affecter jusqu’à 1 personne sur 10) :
· Dépression
· Troubles du sommeil ou somnolences
· Constipation
· Bouche sèche ou augmentation de la production de salive
· Problèmes lors des rapports sexuels
· Irritation, douleur ou accumulation de pus (abcès) au site d’injection
· Prise de poids.
Peu fréquent (pouvant affecter jusqu’à 1 personne sur 100) :
· Tension musculaire anormale
· Maux de tête
· Mouvement des yeux vers le haut ou mouvements des yeux rapides impossibles à contrôler
· Problèmes de vision, tels qu’une vision floue
Les effets indésirables suivants ont également été signalés, mais leur fréquence exacte n’est pas connue :
· Graves problèmes de santé mentale, comme croire des choses qui ne sont pas vraies (illusions) ou voir, ressentir, entendre ou sentir des choses qui ne sont pas réelles (hallucinations)
· Sensation d'agitation ou de confusion
· Crises épileptiques (convulsions)
· Sensations de vertiges, y compris en s'asseyant ou en se levant
· Tension artérielle basse
· Problèmes pouvant provoquer des difficultés à respirer, tels que :
o Gonflement autour du larynx ou bref spasme des cordes vocales altérant la capacité à parler
o Rétrécissement des voies aériennes dans les poumons
o Essoufflement
· Nausées, vomissements
· Modifications sanguines, telles que :
o Effets sur les cellules sanguines – diminution de tous les types de cellules sanguines, y compris des réductions sévères des globules blancs et une diminution des plaquettes (les cellules qui aident le sang à coaguler)
o Taux élevé de certaines hormones dans le sang - la prolactine et l’hormone antidiurétique (syndrome de sécrétion inappropriée d’hormone antidiurétique)
o Faible taux de sucre dans le sang
· Modifications mises en évidence par les analyses sanguines visant à contrôler le fonctionnement du foie et autres problèmes de foie, tels que :
o Jaunissement de la peau ou du blanc des yeux (jaunisse)
o Inflammation du foie
o Défaillance soudaine du foie
· Diminution du flux de bile dans les canaux biliaires
· Problèmes de peau, tels que :
o Éruption cutanée ou démangeaisons
o Sensibilité accrue à la lumière du soleil
o Peau qui s’écaille ou qui pèle
o Inflammation des petits vaisseaux sanguins, entraînant une éruption cutanée accompagnée de petits boutons rouges ou violets
· Transpiration excessive
· Destruction du tissu musculaire (rhabdomyolyse)
· Spasmes, secousses ou contractions musculaires impossibles à contrôler, y compris un spasme de la nuque faisant pencher la tête d’un côté
· Difficultés ou incapacité à ouvrir la bouche
· Raideur des muscles et des articulations
· Incapacité à uriner ou à vider complètement la vessie
· Érection persistante et douloureuse du pénis
· Difficultés à obtenir et maintenir une érection (impuissance)
· Perte ou diminution du désir sexuel
· Modifications du cycle menstruel (règles), telles qu’une absence de règles ou des règles prolongées, abondantes, douloureuses
· Problèmes au niveau des seins, tels que :
o Douleur ou gêne
o Production inattendue de lait maternel
o Augmentation du volume des seins chez les hommes
· Gonflement dû à l’accumulation de liquide dans le corps
· Température corporelle élevée ou basse
· Troubles de la marche
· Perte de poids
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin, votre pharmacien ou à votre infirmier/ère. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr.
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER HALDOL DECANOAS 50 mg/ml, solution injectable ?
Tenir ce médicament hors de la vue et de la portée des enfants.
HALDOL DECANOAS ne doit pas être utilisé après la date de péremption indiquée sur l’étiquette et sur la boîte après EXP. La date de péremption fait référence au dernier jour de ce mois.
A conserver dans l’emballage d’origine à l’abri de la lumière.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient HALDOL DECANOAS 50 mg/ml, solution injectable
· La substance active est :
Décanoate d’halopéridol.............................................................................................. 70,52 mg
(Correspondant à halopéridol........................................................................................... 50 mg)
Pour une ampoule de 1 ml.
· Les autres composants sont :
Alcool benzylique, huile de sésame.
Qu’est-ce que HALDOL DECANOAS 50 mg/ml, solution injectable et contenu de l’emballage extérieur
Toutes les présentations peuvent ne pas être commercialisées.
Titulaire de l’autorisation de mise sur le marché
Vision Exchange Building
Triq it-Territorjals, Zone 1,
Central Business District,
Birkirkara, CBD 1070,
MALTE
Exploitant de l’autorisation de mise sur le marché
Vision Exchange Building
Triq it-Territorjals, Zone 1,
Central Business District,
Birkirkara, CBD 1070,
MALTE
GLAXOSMITHKLINE MANUFACTURING S.P.A
STRADA PROVINCIALE ASOLANA N. 90 (LOC. SAN POLO)
43056 TORRILE (PR)
Italie
ou
JANSSEN PHARMACEUTICA NV
TURNHOUTSEWEG 30
2340 BEERSE
BELGIQUE
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Ce médicament est autorisé dans les Etats membres de l'Espace Economique Européen sous les noms suivants : Conformément à la réglementation en vigueur.
[À compléter ultérieurement par le titulaire]
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).