Dernière mise à jour le 02/02/2026
DONEPEZIL TEVA 10 mg, comprimé orodispersible
Ce médicament n'est ou ne sera bientôt plus disponible sur le marché.
Si vous prenez actuellement ce médicament, il vous est recommandé d'en parler avec votre médecin
ou avec votre pharmacien qui pourra vous orienter vers un autre traitement.
Indications thérapeutiques
DONEPEZIL TEVA appartient à un groupe de médicaments appelés médicaments inhibiteurs de l'acétylcholinestérase. Le donépézil augmente les concentrations dans le cerveau d’une substance (acétylcholine) impliquée dans le processus de la mémoire en diminuant la destruction de l’acétylcholine.
Il est utilisé pour le traitement des symptômes de la maladie d'Alzheimer légère à modérément sévère. Les symptômes de la maladie d'Alzheimer incluent une perte progressive de la mémoire, une confusion et des modifications du comportement. Il devient de ce fait de plus en plus difficile de réaliser les activités de la vie quotidienne. Il est réservé aux patients adultes.
Documents de bon usage du médicament
- Maladie d’Alzheimer et maladies apparentées : diagnostic et prise en charge
Auteur : Haute autorité de santé
Type : Recommandation de bonne pratique
Date de mise à jour :Décembre 2011
Service médical rendu (SMR)
Pas de SMR disponible pour ce médicament ( plus d'informations dans l'aide )
Amélioration du service médical rendu (ASMR)
Pas d'ASMR disponible pour ce médicament (plus d'informations dans l'aide )
ANSM - Mis à jour le : 14/03/2024
DONEPEZIL TEVA 10 mg, comprimé orodispersible
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Chlorhydrate de donépézil...................................................................................................... 10 mg
Equivalant à 9,12 mg de donépézil
Pour un comprimé orodispersible.
Excipients à effet notoire : un comprimé orodispersible de 10 mg contient 183,82 mg de lactose (monohydraté) et 0,14 mg d'aspartam.
Pour la liste complète des excipients, voir rubrique 6.1.
Comprimé jaune, rond et plat aux bords biseautés, comportant la mention « L 10 » gravée sur une face, l'autre face étant lisse.
4.1. Indications thérapeutiques
4.2. Posologie et mode d'administration
Adultes/Sujets âgés
Le traitement doit être instauré à la dose de 5 mg par jour (en prise unique).
La posologie de 5 mg/jour sera maintenue pendant au moins 1 mois, durée nécessaire à l'évaluation des premières réponses cliniques au traitement et à l'atteinte de l'état d'équilibre des concentrations plasmatiques. En fonction des résultats cliniques observés après 1 mois de traitement à la dose de 5 mg/jour, la dose pourra être augmentée à 10 mg/jour (en une prise par jour). La posologie quotidienne maximale recommandée est de 10 mg. Les posologies supérieures à 10 mg/jour n'ont pas été étudiées dans les études cliniques.
Le traitement doit être instauré et supervisé par un médecin ayant l'expérience du diagnostic et du traitement des patients atteints de la maladie d'Alzheimer. Le diagnostic sera porté en accord avec les critères en vigueur (par exemple DSM IV, ICD 10). Le traitement par le chlorhydrate de donépézil ne doit être entrepris qu'en présence d'un proche pouvant s'assurer régulièrement de la prise du médicament par le patient. Le traitement d'entretien peut être poursuivi tant que le bénéfice existe pour le patient. En conséquence, le bénéfice clinique doit être réévalué de façon régulière. L'arrêt du traitement doit être envisagé lorsque l'effet thérapeutique n'est plus démontré. La réponse individuelle au traitement n'est pas prévisible.
A l'arrêt du traitement, il a été observé une réduction progressive des effets bénéfiques produits par le chlorhydrate de donépézil. Il n'existe pas de preuve d'un effet rebond après l'arrêt brutal du traitement.
Insuffisance rénale et hépatique
Chez les patients présentant une insuffisance rénale, la clairance du chlorhydrate de donépézil n'étant pas modifiée, il n'est pas nécessaire d'adapter la posologie.
En cas d'insuffisance hépatique légère à modérée, en raison d'une possible augmentation de l'exposition au donépézil (voir rubrique 5.2), l'augmentation posologique devra être adaptée en fonction de la tolérance individuelle au produit. Il n'existe pas de données chez les patients souffrant d'insuffisance hépatique sévère.
Population pédiatrique
L'utilisation de DONEPEZIL TEVA n'est pas recommandée chez les enfants et les adolescents âgés de moins de 18 ans.
Mode d’administration
DONEPEZIL TEVA doit être administré par voie orale, le soir, avant le coucher.
En cas de troubles du sommeil, y compris rêves anormaux, cauchemars ou insomnie (voir rubrique 4.8), la prise de DONEPEZIL TEVA le matin peut être envisagée.
Placer le comprimé orodispersible sur la langue et le laisser fondre avant de l’avaler avec ou sans eau, selon la préférence du patient.
Pour les doses non réalisables/praticables avec ce dosage, d'autres dosages de ce médicament sont disponibles.
4.4. Mises en garde spéciales et précautions d'emploi
Anesthésie
Le chlorhydrate de donépézil, comme tout inhibiteur de la cholinestérase, peut majorer la relaxation musculaire induite par les traitements du type succinylcholine lors d'anesthésies.
Troubles cardio-vasculaires
En raison de leur activité pharmacologique, les inhibiteurs de la cholinestérase peuvent avoir des effets vagotoniques sur le rythme cardiaque (par exemple, bradycardie). Leur incidence peut être particulièrement élevée chez les patients présentant une maladie du sinus ou d'autres anomalies de la conduction supra-ventriculaire telles qu'un bloc sino-auriculaire ou auriculo-ventriculaire.
Il a été rapporté des cas de syncope et de convulsions. Lors de l'examen de ces patients la possibilité de bloc cardiaque ou de pauses sinusales prolongées doit être envisagée.
Des cas d’allongement de l’intervalle QTc et de torsade de pointes ont été rapportés après la mise sur le marché (voir rubriques 4.5 et 4.8). La prudence est recommandée chez les patients ayant des antécédents familiaux ou préexistants d’allongement de l’intervalle QTc, chez les patients traités par des médicaments modifiant l’intervalle QTc, ou chez les patients présentant une pathologie cardiaque préexistante pertinente (par exemple, insuffisance cardiaque non compensée, infarctus récent du myocarde, bradyarythmies) ou des troubles électrolytiques (hypokaliémie, hypomagnésémie). Une surveillance clinique (ECG) peut être nécessaire.
Troubles gastro-intestinaux
Les patients présentant un risque particulier d'ulcère, comme par exemple ceux ayant des antécédents de maladie ulcéreuse ou recevant un traitement concomitant par des anti-inflammatoires non stéroïdiens (AINS), doivent faire l'objet d'une surveillance symptomatique attentive. Cependant, les études cliniques conduites avec le chlorhydrate de donépézil n'ont pas montré d'augmentation de l'incidence des ulcères gastroduodénaux ou des saignements gastro-intestinaux comparativement au placebo.
Troubles génito-urinaires
Bien que non observée lors des études conduites avec le chlorhydrate de donépézil, les cholinomimétiques peuvent induire une rétention urinaire.
Troubles neurologiques
Convulsions
Les cholinomimétiques sont décrits comme potentiellement responsables de crises convulsives généralisées. Toutefois, les convulsions peuvent aussi être une manifestation de la maladie d'Alzheimer.
Les cholinomimétiques peuvent avoir le potentiel d'exacerber ou d'induire des symptômes extra-pyramidaux.
Syndrome malin des neuroleptiques (SMN)
Le SMN, une affection pouvant engager le pronostic vital et caractérisée par une hyperthermie, une rigidité musculaire, une instabilité du système nerveux autonome, une altération de la conscience et une élévation des taux sériques de créatine phosphokinase, a été rapporté, dans de très rares cas, en association avec le donépézil, en particulier chez des patients recevant également des antipsychotiques de façon concomitante.
D’autres signes peuvent inclure une myoglobinurie (rhabdomyolyse) et une insuffisance rénale aiguë. Si un patient développe des signes ou des symptômes évocateurs d’un SMN ou présente une forte fièvre inexpliquée sans autres manifestations cliniques de SMN, le traitement doit être interrompu.
Troubles broncho-pulmonaires
Du fait de leur activité cholinomimétique, les inhibiteurs de la cholinestérase doivent être prescrits avec précaution chez les malades présentant des antécédents d'asthme ou de maladie broncho-pulmonaire obstructive.
L'administration concomitante de DONEPEZIL TEVA et d'autres inhibiteurs de l'acétylcholinestérase, d'agonistes ou d'antagonistes du système cholinergique est à éviter.
Insuffisance hépatique sévère
Il n'existe pas de données chez les patients souffrant d'insuffisance hépatique sévère.
Mortalité au cours des études menées dans la démence vasculaire
Trois études cliniques d'une durée de six mois ont été menées chez des patients répondant aux critères NINDS-AIREN de démence vasculaire (DVa) probable ou possible. Les critères NINDS-AIREN sont conçus pour identifier les patients dont la démence serait uniquement liée à des causes vasculaires et exclure les patients souffrant d'une maladie d'Alzheimer.
Dans la première étude, le taux de mortalité était de 2/198 (1,0 %) sous chlorhydrate de donépézil 5 mg, 5/206 (2,4 %) sous chlorhydrate de donépézil 10 mg et 7/199 (3,5 %) sous placebo.
Dans la deuxième étude, les taux de mortalité étaient de 4/208 (1,9 %) sous chlorhydrate de donépézil 5 mg, 3/215 (1,4 %) sous chlorhydrate de donépézil 10 mg et 1/193 (0,5 %) sous placebo.
Dans la troisième étude, les taux de mortalité étaient de 11/648 (1,7 %) sous chlorhydrate de donépézil 5 mg et 0/326 (0 %) sous placebo.
Le taux de mortalité dans les trois études réunies était plus élevé dans le groupe chlorhydrate de donépézil (1,7 %) que dans le groupe placebo (1,1 %) ; cette différence n'était toutefois pas statistiquement significative. Il apparaît que la majorité des décès chez les patients recevant soit le chlorhydrate de donépézil soit le placebo résultaient de causes vasculaires diverses, ce qui était prévisible dans cette population âgée souffrant de pathologies vasculaires préexistantes. Une analyse de tous les événements vasculaires graves ayant ou non entraîné un décès n'a pas montré de différence sur leur taux de survenue entre le groupe chlorhydrate de donépézil et le groupe placebo.
Dans des études menées avec le chlorhydrate de donépézil dans la maladie d'Alzheimer d'une part (n = 4 146) et dans l'ensemble des démences, y compris les démences vasculaires d'autre part (n total = 6 888), le taux de mortalité dans les groupes placebo était plus élevé que dans les groupes chlorhydrate de donépézil.
Excipients
Lactose
Les patients présentant une intolérance au fructose ou un syndrome de malabsorption du glucose ou du galactose (maladies héréditaires rares) ne doivent pas prendre ce médicament.
Aspartam
L’aspartam est hydrolysé dans le tube gastro-digestif lorsqu’il est ingéré par voie orale. L’un des principaux produits de l’hydrolyse est la phénylalanine. Peut être dangereux pour les personnes atteintes de phénylcétonurie (PCU)
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Les études in vitro ont montré que le système du cytochrome P450 (isoenzyme 3A4 et dans une moindre mesure 2D6) est impliqué dans le métabolisme du chlorhydrate de donépézil. Les études d'interactions médicamenteuses in vitro ont montré que le kétoconazole et la quinidine, inhibiteurs du CYP3A4 et 2D6 respectivement, inhibent le métabolisme du chlorhydrate de donépézil. En conséquence, ceux-ci et les autres inhibiteurs du CYP3A4, comme l'itraconazole et l'érythromycine, et les inhibiteurs du CYP2D6, comme la fluoxétine, pourraient inhiber le métabolisme du chlorhydrate de donépézil. Dans une étude chez le volontaire sain, les concentrations moyennes en chlorhydrate de donépézil ont été augmentées de 30 % environ par le kétoconazole.
Les inducteurs enzymatiques comme la rifampicine, la phénytoïne, la carbamazépine et l'alcool peuvent diminuer les concentrations de chlorhydrate de donépézil. En l'absence de données quant à l'amplitude de ces effets inducteurs ou inhibiteurs, de telles associations médicamenteuses sont à utiliser avec précaution.
Le chlorhydrate de donépézil peut modifier l'activité d'autres médicaments anticholinergiques. Il peut également se produire une potentialisation de l'activité cholinergique lors de la prise concomitante de médicaments tels que la succinylcholine, d'autres agents bloquant le système neuro-musculaire ou d'agonistes cholinergiques ou de bêta-bloquants ayant une action sur la conduction cardiaque.
Des cas d’allongement de l’intervalle QTc et de torsade de pointes ont été rapportés pour le donépézil. La prudence est recommandée lorsque le donépézil est utilisé en association avec d’autres médicaments connus pour allonger l’intervalle QTc et une surveillance clinique (ECG) peut être nécessaire. Exemples :
Antiarythmiques de classe IA (par exemple, la quinidine)
Antiarythmiques de classe III (par exemple, l’amiodarone, le sotalol)
Certains antidépresseurs (par exemple, le citalopram, l’escitalopram, l’amitriptyline)
D’autres antipsychotiques (par exemple, les dérivés de la phénothiazine, le sertindole, le pimozide, la ziprasidone)
Certains antibiotiques (par exemple, la clarithromycine, l’érythromycine, la lévofloxacine, la moxifloxacine)
4.6. Fertilité, grossesse et allaitement
Grossesse
On ne dispose pas de données sur l’utilisation du chlorhydrate de donépézil chez la femme enceinte.
Les études réalisées chez l'animal n'ont pas montré d'effet tératogène mais ont mis en évidence une toxicité pré et post-natale (voir rubrique 5.3). Le risque potentiel chez l'Homme est inconnu.
DONEPEZIL TEVA ne doit pas être utilisé pendant la grossesse, sauf en cas de nécessité absolue.
Allaitement
Le chlorhydrate de donépézil est excrété dans le lait maternel chez le rat. Le passage du chlorhydrate de donépézil dans le lait maternel n'est pas documenté et il n'y a pas d'étude chez la femme allaitante. En conséquence, les femmes qui reçoivent du chlorhydrate de donépézil ne doivent pas allaiter.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
La maladie d'Alzheimer peut être à l'origine d'une altération de l'aptitude à conduire des véhicules ou à utiliser des machines. De plus le chlorhydrate de donépézil peut induire une fatigue, des sensations vertigineuses et des crampes musculaires, notamment lors de l'instauration ou de l'augmentation posologique. L'aptitude à poursuivre la conduite automobile ou l'utilisation de machines complexes des patients atteints de la maladie d'Alzheimer traités par chlorhydrate de donépézil doit être régulièrement évaluée par le médecin traitant.
Les événements indésirables les plus fréquents ont été : diarrhées, crampes musculaires, fatigue, nausées, vomissements et insomnie.
Les effets indésirables qui ont été rapportés plus d'une fois sont répertoriés ci-dessous par classe de systèmes d’organes et par fréquence. Les fréquences sont définies selon la convention suivante : très fréquent (≥ 1/10), fréquent (≥ 1/100, < 1/10), peu fréquent (≥ 1/1 000, < 1/100), rare (≥ 1/10 000, < 1/1 000), très rare (< 1/10 000) et fréquence indéterminée (ne peut être estimée sur la base des données disponibles).
|
Classe de systèmes d’organes |
Très fréquent |
Fréquent |
Peu fréquent |
Rare |
Très rare |
Fréquence indéterminée |
|
Infections et infestations |
|
Rhume |
|
|
|
|
|
Troubles du métabolisme et de la nutrition |
|
Anorexie |
|
|
|
|
|
Affections psychiatriques |
|
Hallucinations** Agitation** Agressivité** Rêves anormaux et cauchemars** |
|
|
|
Augmentation de la libido Hypersexualité |
|
Affections du système nerveux |
|
Syncope* Vertiges Insomnie |
Convulsions* |
Symptômes extra-pyramidaux |
Syndrome Malin des Neuroleptiques |
Pleurothotonus (syndrome de la tour de Pise) |
|
Affections cardiaques |
|
|
Bradycardie |
Bloc sino-auriculaire Bloc auriculo-ventriculaire |
|
Tachycardie ventriculaire polymorphe incluant torsade de pointes ; Allongement de l’intervalle QT à l’électrocardiogramme |
|
Affections gastro-intestinales |
Diarrhée Nausées |
Vomissements Troubles abdominaux
|
Hémorragies gastro-intestinales Ulcère gastrique et duodénal Ptyalisme |
|
|
|
|
Affections hépatobiliaires |
|
|
|
Atteinte hépatique incluant hépatites*** |
|
|
|
Affections de la peau et du tissu sous-cutané |
|
Rash Prurit |
|
|
|
|
|
Affections musculo-squelettiques et systémiques |
|
Crampes musculaires |
|
|
Rhabdomyolyse**** |
|
|
Affections du rein et des voies urinaires |
|
Incontinence urinaire |
|
|
|
|
|
Troubles généraux et anomalies au site d’administration |
Céphalées |
Fatigue Douleurs |
|
|
|
|
|
Investigations |
|
|
Légère augmentation des concentrations sériques en créatinine kinase musculaire |
|
|
|
|
Lésions et intoxications |
|
Accidents, y compris chutes |
|
|
|
|
* Lors de l'examen des patients ayant présenté syncope ou convulsions, la possibilité de bloc cardiaque ou de pause sinusale prolongée doit être envisagée (voir rubrique 4.4).
** Les cas rapportés d'hallucinations, de rêves anormaux et cauchemars, d'agitation et d'agressivité ont régressé lors de la réduction de la dose ou de l'arrêt du traitement.
*** En cas d'hépatite d'étiologie inconnue, l'arrêt de DONEPEZIL TEVA doit être envisagé.
**** Il a été établi qu'une rhabdomyolyse se produit indépendamment du syndrome malin des neuroleptiques, et en étroite association temporelle avec le début du traitement par donépézil ou une augmentation de la dose.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/.
Symptômes
La dose létale médiane de chlorhydrate de donépézil après administration unique par voie orale chez la souris et chez le rat est estimée, respectivement, à 45 et 32 mg/kg, soit environ 225 et 160 fois la posologie maximale recommandée chez l'Homme (10 mg/jour). Des signes dose-dépendants de stimulation cholinergique ont été observés chez l'animal dont une réduction de la motricité spontanée, une prostration, une démarche chancelante, un larmoiement, des convulsions cloniques, une dépression respiratoire, une salivation, un myosis, une fasciculation et une baisse de la température corporelle.
Le surdosage par les inhibiteurs de la cholinestérase peut donner lieu à des crises cholinergiques caractérisées par des nausées sévères, des vomissements, une salivation, une transpiration, une bradycardie, une hypotension, une dépression respiratoire, un collapsus et des convulsions. Une faiblesse musculaire croissante est possible et peut conduire au décès si les muscles respiratoires sont atteints.
Prise en charge
En cas de surdosage, le traitement doit être symptomatique. Des anticholinergiques tertiaires tels que l'atropine peuvent être utilisés comme antidote lors d'un surdosage par le chlorhydrate de donépézil. L'administration intraveineuse de sulfate d'atropine est recommandée à la dose initiale de 1,0 à 2,0 mg IV, à renouveler si nécessaire en adaptant la dose en fonction de la réponse clinique. Des réponses atypiques au niveau de la pression artérielle et du rythme cardiaque ont pu être observées avec d'autres cholinomimétiques lors d'administration concomitante avec des anticholinergiques quaternaires comme le glycopyrrolate. L'élimination par dialyse (hémodialyse, dialyse péritonéale ou hémofiltration) du chlorhydrate de donépézil et/ou de ses métabolites n'est pas documentée.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Mécanisme d’action
Le chlorhydrate de donépézil est un inhibiteur spécifique et réversible de l'acétylcholinestérase, cholinestérase prédominante dans le cerveau. Il présente, in vitro, une activité inhibitrice sur l'acétylcholinestérase 1 000 fois supérieure à celle qu'il a sur la butyrylcholinestérase, cholinestérase prédominante hors du système nerveux central.
Efficacité clinique
Maladie d'Alzheimer
Chez les patients présentant une maladie d'Alzheimer qui ont été inclus dans les études cliniques, l'administration d'une dose unique quotidienne de 5 ou 10 mg de chlorhydrate de donépézil a produit une inhibition de l'activité de l'acétylcholinestérase (mesurée dans les membranes des hématies) respectivement de 63,6 % et de 77,3 %, mesurées à l'état d'équilibre juste après la prise. Il a été montré que l'inhibition de l'acétylcholinestérase (AChE) dans les globules rouges par le chlorhydrate de donépézil est corrélée au changement sur l'ADAS-cog, échelle sensible de mesure de certains paramètres de la cognition. La possibilité que le chlorhydrate de donépézil modifie le cours de l'affection neuropathologique sous-jacente n'a pas été étudiée. En conséquence, le chlorhydrate de donépézil ne peut être considéré comme ayant un effet sur la progression de la maladie.
L'efficacité du traitement par chlorhydrate de donépézil a été étudiée lors de 4 essais cliniques contrôlés contre placebo, 2 essais d'une durée de 6 mois et 2 essais d'une durée de 1 an.
Une analyse a été conduite au terme de 6 mois d'essai clinique de traitement par le chlorhydrate de donépézil sur une combinaison de trois critères d'efficacité : l’ADAS-Cog (échelle de mesure de la performance cognitive), l'impression clinique globale de changement évalué par un clinicien et l'entourage (CIBIC - échelle de mesure de la fonction globale) et la sous-échelle des activités de vie quotidienne de la CDR (échelle de mesure des activités du patient liées à la vie en société, aux activités domestiques, à ses passe-temps et son hygiène personnelle).
Les patients qui ont satisfait aux critères suivants ont été considérés comme répondeurs au traitement :
Répondeurs :
· Amélioration d'au moins 4 points sur l'échelle ADAS-Cog,
· Pas de détérioration sur l'échelle CIBIC,
· Pas de détérioration sur la sous-échelle d'activités de la vie quotidienne de la CDR.
|
|
Pourcentage de répondeurs |
|
|
|
|
Population en « Intention de Traiter » n = 365 |
Population évaluable n = 352 |
|
|
|
|||
|
Groupe placebo |
10 % |
10 % |
|
|
Groupe chlorhydrate de donépézil 5 mg |
18 %* |
18 %* |
|
|
Groupe chlorhydrate de donépézil 10 mg |
21 %* |
22 %** |
|
* p < 0,05, **p < 0,01
Le chlorhydrate de donépézil conduit à une augmentation dose-dépendante et statistiquement significative du pourcentage des patients considérés comme répondeurs au traitement.
5.2. Propriétés pharmacocinétiques
Les concentrations plasmatiques maximales sont atteintes en 3 à 4 heures environ après administration orale. Les concentrations plasmatiques et l'aire sous la courbe augmentent proportionnellement à la dose. La demi-vie d'élimination terminale (t1/2) est d'environ 70 heures et l'état d'équilibre est donc atteint graduellement par l'administration répétée de prises uniques quotidiennes. L'état d'équilibre est atteint en 3 semaines environ après l'instauration du traitement. A l'état d'équilibre, les concentrations plasmatiques de chlorhydrate de donépézil et l'activité pharmacologique qui lui est associée présentent une faible variabilité au cours de la journée.
L'alimentation n'a pas d'influence sur l'absorption du chlorhydrate de donépézil.
Distribution
Le chlorhydrate de donépézil est lié aux protéines plasmatiques humaines à environ 95 %. Le taux de liaison aux protéines plasmatiques du métabolite 6-O-déméthyldonépézil n'est pas connu. La distribution du chlorhydrate de donépézil dans les différents tissus de l'organisme n'est pas complètement documentée. Cependant, au cours d'une étude chez le volontaire sain de sexe masculin, environ 28 % d'une dose unique de 5 mg de chlorhydrate de donépézil marqué au 14C, n'est pas retrouvé 240 heures après administration unique, ce qui suggère la persistance, au-delà de 10 jours, du chlorhydrate de donépézil et/ou de ses métabolites dans l'organisme.
Biotransformation/Elimination
Le chlorhydrate de donépézil est excrété dans les urines, à la fois sous forme inchangée et sous forme de métabolites issus de l'action du cytochrome P450 qui n'ont pas tous été identifiés. Après administration d'une dose unique de 5 mg de chlorhydrate de donépézil marqué au 14C, la radioactivité plasmatique, exprimée en pourcentage de la dose administrée, a été principalement présente sous forme de chlorhydrate de donépézil inchangé (30 %), de 6-O-déméthyldonépézil (11 %, seul métabolite présentant une activité similaire à celle du chlorhydrate de donépézil), de dérivé oxyde-N-cis-donépézil (9 %), de dérivé 5-O-déméthyl-donépézil (7 %) et de forme glucuronoconjugée du dérivé 5-O-déméthyl-donépézil (3 %). Environ 57 % de la radioactivité totale a été retrouvée dans les urines (17 % sous forme inchangée) et 14,5 % dans les fèces, ce qui suggère que la voie d'élimination principale se fonde sur la biotransformation et l'excrétion urinaire. Il n'y a pas d'arguments en faveur d'un second cycle entéro-hépatique du chlorhydrate de donépézil et/ou d'un de ses métabolites.
Le chlorhydrate de donépézil a une demi-vie plasmatique de 70 heures environ.
Populations particulières
Le sexe, la race et le tabagisme n'ont pas d'influence clinique significative sur les concentrations plasmatiques du chlorhydrate de donépézil. La pharmacocinétique du chlorhydrate de donépézil n'a pas été formellement étudiée chez le volontaire sain âgé ou chez les patients souffrant de la maladie d'Alzheimer ou de démence vasculaire. Toutefois les taux plasmatiques moyens chez ces patients concordent étroitement à ceux observés chez le volontaire sain jeune.
Chez l'insuffisant hépatique léger à modéré, l'aire sous la courbe (ASC) moyenne et la concentration maximale (Cmax) moyenne à l'état d'équilibre peuvent être augmentées de 48 % et 39 % respectivement (voir rubrique 4.2).
5.3. Données de sécurité préclinique
Les nombreuses études effectuées chez l'animal ont démontré que ce composant provoque peu d'effets autres que les effets pharmacologiques attendus, compatibles avec son activité de stimulation cholinergique (voir rubrique 4.9).
Le chlorhydrate de donépézil n'est pas mutagène sur les tests sur bactérie et sur cellule de mammifère. Des effets clastogènes ont été observés in vitro à des concentrations très fortement toxiques pour la cellule elle-même et plus de 3 000 fois supérieures à la concentration plasmatique à l'état d'équilibre. Le chlorhydrate de donépézil n'a pas montré d'effet clastogène ou d'autres effets génotoxiques dans le test du micronoyau in vivo chez la souris. Les études de carcinogenèse à long terme n'ont pas révélé de potentiel carcinogène chez le rat ou la souris.
Le chlorhydrate de donépézil n'a pas d'effet sur la fertilité chez le rat et ne présente pas d'effet tératogène chez le rat et le lapin, mais a un léger effet sur le nombre d'embryons mort-nés et le taux de survie des nouveau-nés lorsqu'il est administré à des rates gravides à une dose 50 fois supérieure à la posologie chez l'Homme (voir rubrique 4.6).
2 ans.
6.4. Précautions particulières de conservation
Pas de précautions particulières de conservation.
6.5. Nature et contenu de l'emballage extérieur
Plaquettes ordinaires ou plaquettes calendrier (en OPA/Alu/PVC – Aluminium (avec feuillet détachable))
Boîtes de 1, 7, 28, 30, 50, 56, 60, 98, 100 ou 120 comprimés orodispersibles.
Toutes les présentations peuvent ne pas être commercialisées
6.6. Précautions particulières d’élimination et de manipulation
Pas d’exigences particulières.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
100-110, ESPLANADE DU GENERAL DE GAULLE
92931 PARIS LA DEFENSE CEDEX
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 381 859 2 8 : 1 comprimé sous plaquette (OPA/Aluminium/PVC).
· 34009 381 860 0 0 : 7 comprimés sous plaquettes (OPA/Aluminium/PVC).
· 34009 381 861 7 8 : 28 comprimés sous plaquettes (OPA/Aluminium/PVC).
· 34009 381 922 6 1 : 30 comprimés sous plaquettes (OPA/Aluminium/PVC).
· 34009 381 923 2 2 : 1 comprimé sous plaquette calendrier (OPA/ Aluminium/PVC).
· 34009 381 969 2 4 : 7 comprimés sous plaquettes calendrier (OPA/ Aluminium/PVC).
· 34009 382 000 5 8 : 28 comprimés sous plaquettes calendrier (OPA/ Aluminium/PVC).
· 34009 382 057 7 0 : 30 comprimés sous plaquettes calendrier (OPA/ Aluminium/PVC).
· 34009 577 186 0 2 : 50 comprimés sous plaquettes (OPA/Aluminium/PVC).
· 34009 577 187 7 0 : 56 comprimés sous plaquettes (OPA/Aluminium/PVC).
· 34009 577 188 3 1 : 60 comprimés sous plaquettes (OPA/Aluminium/PVC).
· 34009 577 190 8 1 : 98 comprimés sous plaquettes (OPA/Aluminium/PVC).
· 34009 577 191 4 2 : 100 comprimés sous plaquettes (OPA/Aluminium/PVC).
· 34009 577 192 0 3 : 120 comprimés sous plaquettes (OPA/Aluminium/PVC).
· 34009 577 193 7 1 : 50 comprimés sous plaquettes calendrier (OPA/ Aluminium/PVC).
· 34009 577 194 3 2 : 56 comprimés sous plaquettes calendrier (OPA/Aluminium/PVC).
· 34009 577 196 6 1 : 60 comprimés sous plaquettes calendrier (OPA/ Aluminium/PVC).
· 34009 577 197 2 2 : 98 comprimés sous plaquettes calendrier (OPA/Aluminium/PVC).
· 34009 577 198 9 0 : 100 comprimés sous plaquettes calendrier (OPA/ Aluminium/PVC).
· 34009 577 199 5 1 : 120 comprimés sous plaquettes calendrier (OPA/ Aluminium/PVC).
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Liste I.
Surveillance particulière nécessaire pendant le traitement.
Prescription initiale annuelle réservée aux médecins spécialistes en neurologie, en psychiatrie, aux médecins spécialistes titulaires du diplôme d'études spécialisées complémentaires de gériatrie et aux médecins spécialistes ou qualifiés en médecine générale titulaires de la capacité de gérontologie.
Ce médicament n'est ou ne sera bientôt plus disponible sur le marché.
Si vous prenez actuellement ce médicament, il vous est recommandé d'en parler avec votre médecin
ou avec votre pharmacien qui pourra vous orienter vers un autre traitement.
ANSM - Mis à jour le : 14/03/2024
DONEPEZIL TEVA 10 mg, comprimé orodispersible
Chlorhydrate de donépézil
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin ou votre pharmacien.
· Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d’autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s'applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
1. Qu'est-ce que DONEPEZIL TEVA 10 mg, comprimé orodispersible et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant de prendre DONEPEZIL TEVA 10 mg, comprimé orodispersible ?
3. Comment prendre DONEPEZIL TEVA 10 mg, comprimé orodispersible ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver DONEPEZIL TEVA 10 mg, comprimé orodispersible ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE DONEPEZIL TEVA 10 mg, comprimé orodispersible ET DANS QUELS CAS EST-IL UTILISE ?
DONEPEZIL TEVA appartient à un groupe de médicaments appelés médicaments inhibiteurs de l'acétylcholinestérase. Le donépézil augmente les concentrations dans le cerveau d’une substance (acétylcholine) impliquée dans le processus de la mémoire en diminuant la destruction de l’acétylcholine.
Il est utilisé pour le traitement des symptômes de la maladie d'Alzheimer légère à modérément sévère. Les symptômes de la maladie d'Alzheimer incluent une perte progressive de la mémoire, une confusion et des modifications du comportement. Il devient de ce fait de plus en plus difficile de réaliser les activités de la vie quotidienne. Il est réservé aux patients adultes.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT DE PRENDRE DONEPEZIL TEVA 10 mg, comprimé orodispersible ?
Indiquez à votre médecin ou à votre pharmacien le nom de votre soignant. Celui-ci vous aidera à prendre votre médicament conformément à la prescription.
Ne prenez jamais DONEPEZIL TEVA 10 mg, comprimé orodispersible :
· si vous êtes allergique au chlorhydrate de donépézil, aux dérivés de la pipéridine ou à l'un des autres composants contenus dans ce médicament, mentionnés dans la rubrique 6.
Avertissements et précautions
Adressez-vous à votre médecin ou pharmacien avant de prendre DONEPEZIL TEVA si vous avez ou avez eu l’une des affections ci-dessous :
· ulcères de l'estomac ou du duodénum,
· crises d’épilepsie ou convulsions,
· maladie cardiaque (telle que rythme cardiaque irrégulier ou très lent, insuffisance cardiaque, infarctus du myocarde),
· affection cardiaque appelée « intervalle QT prolongé » ou antécédents de certains rythmes cardiaques anormaux appelés torsade de pointes ou une personne de votre famille est atteinte d’un « intervalle QT prolongé »,
· faibles taux de magnésium ou de potassium dans votre sang,
· asthme ou autre maladie pulmonaire chronique,
· problèmes de foie ou hépatite,
· difficultés à uriner ou maladie rénale légère.
Prévenez aussi votre médecin si vous êtes enceinte ou si vous pensez l'être.
DONEPEZIL TEVA peut être utilisé chez les patients avec une maladie des reins ou une maladie légère à modérée du foie. Prévenez votre médecin si vous présentez une maladie des reins ou du foie. Les patients atteints d'une maladie grave du foie ne doivent pas prendre DONEPEZIL TEVA.
Enfants et adolescents
DONEPEZIL TEVA n’est pas recommandé chez les enfants et les adolescents âgés de moins de 18 ans.
Autres médicaments et DONEPEZIL TEVA 10 mg, comprimé orodispersible
Informez votre médecin ou pharmacien si vous prenez, avez récemment pris ou pourriez prendre tout autre médicament.
Cela inclut les médicaments que votre médecin ne vous a pas prescrits mais que vous avez achetés vous-même dans une pharmacie. Cela s'applique également aux médicaments que vous pourriez prendre à l'avenir si vous continuez à prendre DONEPEZIL TEVA. En effet, ces médicaments peuvent affaiblir ou renforcer les effets de DONEPEZIL TEVA.
En particulier, il est important d'informer votre médecin si vous prenez l'un des types de médicaments suivants :
· médicaments pour les problèmes de rythme cardiaque ; par exemple amiodarone, sotalol,
· médicaments contre la dépression ; par exemple citalopram, escitalopram, amitriptyline, fluoxétine,
· médicaments contre la psychose ; par exemple pimozide, sertindole, ziprasidone,
· médicaments contre les infections bactériennes ; par exemple clarithromycine, érythromycine, lévofloxacine, moxifloxacine, rifampicine,
· médicaments antifongiques ; par exemple kétoconazole,
· autres médicaments contre la maladie d'Alzheimer ; par exemple galantamine,
· traitements anti-douleur ou anti-arthrose ; par exemple aspirine, anti-inflammatoires non stéroïdiens (AINS) comme l'ibuprofène ou le diclofénac sodique,
· traitement anticholinergique ; par exemple toltérodine,
· antiépileptiques ; par exemple phénytoïne, carbamazépine,
· médicaments pour traiter une maladie cardiaque ; par exemple quinidine, bêta-bloquants (propanolol et aténolol),
· traitement relaxant musculaire ; par exemple diazépam, succinylcholine,
· anesthésiques par voie générale,
· médicaments obtenus sans ordonnance ; par exemple phytothérapie.
Si vous devez subir une intervention nécessitant une anesthésie générale, vous devez prévenir votre médecin et l'anesthésiste que vous prenez DONEPEZIL TEVA. En effet, votre médicament peut avoir une influence sur la dose d'anesthésiques nécessaire.
DONEPEZIL TEVA 10 mg, comprimé orodispersible avec des aliments, boissons et de l’alcool
La prise de nourriture ne modifie pas l'effet de DONEPEZIL TEVA.
DONEPEZIL TEVA ne doit pas être pris avec de l’alcool car l’alcool peut modifier son effet.
Si vous êtes enceinte ou que vous allaitez, si vous pensez être enceinte ou planifiez une grossesse, demandez conseil à votre médecin ou pharmacien avant de prendre ce médicament.
DONEPEZIL TEVA ne doit pas être utilisé pendant l’allaitement.
Conduite de véhicules et utilisation de machines
La maladie d'Alzheimer peut affecter votre capacité à conduire des véhicules ou à utiliser des machines. Ne conduisez pas et n'utilisez ni outils ni machines sauf avis contraire de votre médecin. Votre traitement peut occasionner fatigue, vertiges et crampes musculaires. Si vous présentez l’un de ces effets, vous ne devez pas conduire de véhicule ou utiliser de machines.
DONEPEZIL TEVA 10 mg, comprimé orodispersible contient du lactose
Si votre médecin vous a informé(e) d'une intolérance à certains sucres, contactez-le avant de prendre ce médicament.
DONEPEZIL TEVA 10 mg, comprimé orodispersible contient de l’aspartam
Ce médicament contient 0,14 mg d'aspartam dans chaque comprimé orodispersible. L’aspartam contient une source de phénylalanine. Peut être dangereux pour les personnes atteintes de phénylcétonurie (PCU), une maladie génétique rare caractérisée par l’accumulation de phénylalanine ne pouvant être éliminée correctement.
3. COMMENT PRENDRE DONEPEZIL TEVA 10 mg, comprimé orodispersible ?
Quelle quantité de DONEPEZIL TEVA devez-vous prendre ?
En général, vous commencerez par prendre 5 mg (un comprimé blanc) tous les soirs avant de vous coucher. Après un mois, votre médecin pourra vous demander de prendre 10 mg (un comprimé jaune) tous les soirs avant de vous coucher.
En cas de rêves anormaux, de cauchemars ou de difficultés à dormir (voir rubrique 4), votre médecin pourra vous conseiller de prendre DONEPEZIL TEVA le matin.
Si vous présentez une insuffisance hépatique (maladie affectant le foie) ou une insuffisance rénale (maladie affectant les reins) légère ou modérée, vous pouvez prendre DONEPEZIL TEVA. Si vous avez des problèmes hépatiques ou rénaux, informez-en votre médecin avant de commencer le traitement. Les patients présentant une insuffisance hépatique sévère (maladie affectant le foie) ne doivent pas prendre DONEPEZIL TEVA.
La dose indiquée peut varier selon la durée du traitement et les recommandations de votre médecin. La dose maximale recommandée est de 10 mg chaque soir.
Pour des doses non réalisables/faisables avec ce dosage, d'autres dosages sont disponibles pour ce médicament.
Suivez toujours les conseils de votre médecin ou de votre pharmacien sur la manière et le moment de prendre votre médicament.
Ne modifiez pas vous-même la dose sans l’avis de votre médecin.
Il est important que vous et vos soignants ayez bien compris les recommandations du médecin.
Mode d’administration
§ Ne pas appuyer sur le comprimé pour le faire sortir de l'emballage, il pourrait se casser.
§ Chaque film thermosoudé contient des comprimés dans des alvéoles séparées par des perforations permettant de les détacher. Découper le long des lignes de perforations (figure 1).
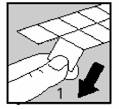
§ Retirer soigneusement la feuille d'aluminium en soulevant l'angle indiqué par la flèche (figures 2 et 3).
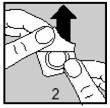
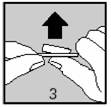
Vos mains doivent être sèches lorsque vous retirez le comprimé de la plaquette.
§ Le comprimé doit être placé sur la langue pour permettre sa désintégration avant de l'avaler, avec ou sans eau, selon la préférence du patient.
Durée du traitement
Votre médecin ou votre pharmacien vous indiquera la durée du traitement. Vous devrez voir votre médecin de façon régulière pour ajuster votre traitement et évaluer vos symptômes.
Si vous avez pris plus de DONEPEZIL TEVA 10 mg, comprimé orodispersible que vous n’auriez dû :
Contactez immédiatement votre médecin ou le service d'urgences de l'hôpital le plus proche si vous avez pris plus de médicaments que vous n’auriez dû. Emportez cette notice, les comprimés restants et la boîte à l'hôpital pour que le médecin sache ce qui a été pris.
Les symptômes d'un surdosage sont les suivants : nausées et vomissements, augmentation de la sécrétion de salive, transpiration, ralentissement du rythme cardiaque, pression artérielle basse (sensation de tête vide ou sensations vertigineuses lors du passage en position débout), problèmes respiratoires, perte de conscience et crises d'épilepsie ou convulsions.
Si vous oubliez de prendre DONEPEZIL TEVA 10 mg, comprimé orodispersible :
Si vous avez oublié de prendre votre médicament, prenez la dose suivante à l'heure habituelle. Ne prenez pas une double dose pour compenser un comprimé oublié.
En cas d'oubli de prise pendant plus de 1 semaine, consulter votre médecin avant toute reprise du traitement.
Si vous arrêtez de prendre DONEPEZIL TEVA 10 mg, comprimé orodispersible :
N’arrêtez pas de prendre les comprimés, sauf avis contraire de votre médecin. Si vous arrêtez de prendre DONEPEZIL TEVA, les effets bénéfiques de votre traitement vont disparaître progressivement.
Si vous avez d'autres questions sur l'utilisation de ce médicament, demandez plus d'informations à votre médecin ou à votre pharmacien.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Les effets indésirables suivants ont été rapportés chez des personnes prenant du donépézil.
Informez votre médecin si vous présentez l'un de ces effets pendant la prise de DONEPEZIL TEVA.
Effets indésirables graves
Si vous ressentez les effets indésirables graves suivants, veuillez en informer votre médecin. Vous pourriez avoir besoin d'un traitement médical d'urgence.
· Atteinte du foie, par exemple hépatite. Les symptômes de l'hépatite sont les suivants : nausées ou vomissements, perte d'appétit, sensation générale de malaise, fièvre, démangeaisons, jaunissement de la peau et des yeux, et urines de couleur foncée (pouvant affecter jusqu'à 1 personne sur 1 000).
· Ulcères de l'estomac ou du duodénum. Les symptômes des ulcères sont des douleurs ou une gêne à l'estomac (indigestion) entre le nombril et le sternum (pouvant affecter jusqu'à 1 personne sur 100).
· Saignements dans l'estomac ou les intestins. Cela peut entraîner des selles noires d’aspect goudronneux ou la présence de sang dans les selles (pouvant affecter jusqu'à 1 personne sur 100).
· Crises d'épilepsie ou convulsions (pouvant affecter jusqu'à 1 personne sur 100).
· Fièvre avec raideur musculaire, transpiration ou altération de la conscience (trouble appelé « syndrome malin des neuroleptiques ») (pouvant affecter jusqu'à 1 personne sur 10 000).
· Faiblesse, sensibilité ou douleur musculaire, surtout si, en même temps, vous ne vous sentez pas bien, si vous avez de la fièvre ou si vos urines sont foncées. Cela pourrait être provoqué par une dégradation musculaire anormale potentiellement mortelle et pourrait entraîner des problèmes rénaux (affection appelée rhabdomyolyse) (pouvant affecter jusqu’à 1 personne sur 10 000).
· Battements cardiaques rapides et irréguliers, et évanouissements qui pourraient être des symptômes d'une maladie potentiellement mortelle connue sous le nom de torsades de pointes (la fréquence ne peut être estimée sur la base des données disponibles).
Autres effets indésirables
Très fréquent (pouvant affecter plus de 1 personne sur 10)
· diarrhée,
· maux de tête.
Fréquent (pouvant affecter jusqu’à 1 personne sur 10)
· crampes musculaires,
· fatigue,
· difficultés à dormir (insomnie),
· rhume,
· hallucinations (voir ou entendre des choses qui ne sont pas réellement présentes),
· rêves anormaux, y compris cauchemars,
· agitation,
· agressivité,
· évanouissement,
· sensations vertigineuses,
· sensation de gêne au niveau de l’estomac,
· éruption cutanée,
· uriner de manière incontrôlée,
· douleurs,
· accidents (les patients sont plus susceptibles de tomber et de se faire mal).
Peu fréquent (pouvant affecter jusqu’à 1 personne sur 100)
· ralentissement du rythme cardiaque,
· hypersalivation.
Rare (pouvant affecter jusqu’à 1 personne sur 1 000)
· tremblements, rigidité ou mouvements involontaires, en particulier du visage, de la langue et des membres.
Fréquence indéterminée (ne peut être estimée sur la base des données disponibles)
· Modifications de l’activité cardiaque susceptibles d’être observées sur un électrocardiogramme (ECG), appelées « intervalle QT prolongé », augmentation de la libido, hypersexualité, syndrome de la tour de Pise (affection impliquant des contractions musculaires involontaires associées à une flexion latérale anormale du corps et de la tête).
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER DONEPEZIL TEVA 10 mg, comprimé orodispersible ?
Tenir ce médicament hors de la vue et de la portée des enfants.
N’utilisez pas ce médicament après la date de péremption indiquée sur la plaquette et la boîte après EXP. La date de péremption fait référence au dernier jour de ce mois.
Pas de conditions particulières de conservation.
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient DONEPEZIL TEVA 10 mg, comprimé orodispersible
· La substance active est : chlorhydrate de donépézil
Chlorhydrate de donépézil...................................................................................................... 10 mg
Equivalant à 9,12 mg de donépézil
Pour un comprimé orodispersible.
· Les autres composants sont :
Mannitol (E421), hypromellose, silice colloïdale anhydre, crospovidone, lactose monohydraté, amidon de maïs, aspartam (E951), stéarate de magnésium, oxyde de fer jaune (E172).
Qu’est-ce que DONEPEZIL TEVA 10 mg, comprimé orodispersible et contenu de l’emballage extérieur
Comprimé orodispersible.
Comprimé jaune, rond et plat aux bords biseautés, comportant la mention « L 10 » gravée sur une face, l'autre face étant lisse, disponible en boîtes de 1, 7, 28, 30, 50, 56, 60, 98, 100 ou 120 comprimés orodispersibles.
Toutes les présentations peuvent ne pas être commercialisées.
Titulaire de l’autorisation de mise sur le marché
100-110, ESPLANADE DU GENERAL DE GAULLE
92931 PARIS LA DEFENSE CEDEX
Exploitant de l’autorisation de mise sur le marché
100-110, ESPLANADE DU GENERAL DE GAULLE
92931 PARIS LA DEFENSE CEDEX
SWENSWEG 5
2031 GA HAARLEM
PAYS-BAS
OU
TEVA PHARMACEUTICALS WORKS PRIVATE LIMITED COMPANY
PALLAGI ÚT 13
4042 DEBRECEN
HONGRIE
OU
MERCKLE GMBH
LUDWIG-MERCKLE-STR. 3
89143 BLAUBEUREN
ALLEMAGNE
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Ce médicament est autorisé dans les Etats membres de l'Espace Economique Européen sous les noms suivants : Conformément à la réglementation en vigueur.
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
{mois AAAA}.
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).