Dernière mise à jour le 01/12/2025
OCTIM 150 microgrammes/dose, solution pour pulvérisation nasale
Indications thérapeutiques
Classe pharmacothérapeutique - code ATC : H01BA02
La desmopressine agit en augmentant la production de certains facteurs de coagulation afin d’assurer une coagulation du sang normale et d’empêcher des saignements.
Ce médicament est utilisé afin de prévenir et/ou de traiter les saignements et en cas d’opération chirurgicale dans les cas suivants :
· Si vous souffrez de la maladie de Willebrand (à l’exception des formes sévères de type 3 ou de type 2B). La maladie de Willebrand est une maladie héréditaire caractérisée par un manque en une protéine appelée facteur Willebrand. Ce manque entraîne des problèmes de coagulation, responsables de saignements anormalement abondants.
· Si vous souffrez d’hémophilie A. L’hémophilie A est une maladie héréditaire caractérisée par un manque en une protéine appelée facteur VIII de la coagulation. Ce manque entraîne des troubles de la coagulation, responsables de saignements anormalement abondants.
· Chez les femmes portant le gène de l’hémophilie A et qui ont des risques de saignement.
Présentations
> 1 flacon(s) pressurisé(s) en verre brun de 2,5 ml
Code CIP : 354 733-1 ou 34009 354 733 1 8
Déclaration de commercialisation : 16/03/1998
Cette présentation est agréée aux collectivités
- Prix hors honoraire de dispensation : 262,49 €
- Honoraire de dispensation : 1,02 €
- Prix honoraire compris : 263,51 €
- Taux de remboursement :65%
Service médical rendu (SMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprès de la HAS (plus d'informations dans l'aide). Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Important | Avis du 29/06/2016 | Renouvellement d'inscription (CT) | Le service médical rendu reste important pour : • MINIRIN, comprimé et MINIRINMELT, lyophilisat dans les indications : • « Traitement du diabète insipide d’origine centrale pitresso-sensible », • « Traitement symptomatique de l’énurésie nocturne chez le sujet âgé de plus de 6 ans et après élimination d’une pathologie organique sous-jacente». • MINIRIN SPRAY et MINIRIN 0,1mg/ml, formes endonasales, dans l’indication : « Traitement du diabète insipide d'origine centrale pitresso-sensible ». • OCTIM, dans l’ensemble des indications de l’AMM. |
| Insuffisant | Avis du 29/06/2016 | Renouvellement d'inscription (CT) | Le service médical rendu reste insuffisant pour MINIRIN comprimé et MINIRINMELT dans l’indication « Traitement symptomatique de la nycturie chez l’adulte âgé de moins de 65 ans, lorsqu’elle est associée à une polyurie nocturne ». |
Amélioration du service médical rendu (ASMR)
Pas d'ASMR disponible pour ce médicament (plus d'informations dans l'aide )
Autres informations
- Titulaire de l'autorisation : FERRING SAS
- Conditions de prescription et de délivrance :
- liste I
- prescription initiale hospitalière annuelle
- Statut de l'autorisation : Valide
- Type de procédure : Procédure nationale
- Code CIS : 6 139 636 1
ANSM - Mis à jour le : 21/10/2025
OCTIM 150 microgrammes/dose, solution pour pulvérisation nasale
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Acétate de desmopressine trihydraté.................................................................... 150 microgrammes
quantité correspondant à desmopressine...................................................................134 microgrammes
pour une dose.
Excipient à effet notoire : chlorure de benzalkonium
Pour la liste complète des excipients, voir rubrique 6.1.
Solution pour pulvérisation nasale
4.1. Indications thérapeutiques
Prévention et traitement des accidents hémorragiques survenant au cours de :
· l'hémophilie A mineure (taux de facteur VIII supérieur à 5 %),
· la maladie de Willebrand à l'exception des formes sévères (type 3 ou type 2B),
· et chez les conductrices d'hémophilie A à risque hémorragique.
4.2. Posologie et mode d'administration
Le traitement doit être pris en charge et surveillé par un médecin ayant l'expérience du traitement de l'hémophilie et de la maladie de Willebrand.
Il est nécessaire d'effectuer un test de réponse thérapeutique avant la mise en route du traitement avec dosage du facteur VIII, du facteur Willebrand (activité et antigène), mesure du temps de saignement, numération plaquettaire et dosage de la natrémie. Ces dosages devront être renouvelés après 1 à 2 heures, puis entre 4 et 6 heures, après une pulvérisation de desmopressine. Les taux plasmatiques de facteur VIII:C et de l'activité cofacteur de la Ristocétine du facteur Willebrand (vWFR:Co) doivent augmenter significativement dans l'heure ou les 2 heures qui suivent l'administration de desmopressine.
Les doses indiquées sont de :
150 μg (une seule pulvérisation nasale) pour un poids inférieur à 50 kg, ou 300 μg (soit une pulvérisation dans chaque narine) pour un poids supérieur ou égal à 50 kg, dès le début du saignement en cas d'accident hémorragique ou une heure avant le geste en cas d'intervention chirurgicale.
Un intervalle de 3 à 4 jours doit être respecté entre les traitements de 2 épisodes hémorragiques pour garantir une réponse thérapeutique satisfaisante.
OCTIM ne doit être utilisé en traitement à domicile que pour prévenir et traiter les accidents hémorragiques modérés suivants :
épistaxis antérieure, gingivorragies, ménorragies non compliquées, contusions simples avec ou sans hématomes mineurs, extractions dentaires simples, gestes chirurgicaux mineurs (ongles incarnés, pose d'un drain tympanique...).
L'administration devra être précoce.
L'administration peut être réitérée toutes les 12 heures et ne devra pas se prolonger au-delà de 48 heures.
Si le traitement d'un épisode hémorragique doit se prolonger au-delà de 48 heures, celui-ci devra être effectué à l'hôpital sous surveillance d'un médecin ayant l'expérience du traitement de l'hémophilie et de la maladie de Willebrand.
Lorsque le traitement est pris en charge à l'hôpital :
Pour le traitement d'un épisode hémorragique, l'administration peut être réitérée toutes les 12 heures pendant au maximum 2 à 3 jours (l'efficacité devenant extrêmement faible du fait du phénomène de tachyphylaxie).
Surveillance du traitement
Si le traitement est poursuivi plus de 48 heures, un contrôle de l'efficacité et de la tolérance est nécessaire, avec dosage des facteurs de coagulation (facteur VIII:C et facteur Willebrand), dosage de la natrémie et mesure si besoin du temps de saignement, avant, 1 à 2 heures puis 4 à 6 heures après la pulvérisation de desmopressine.
Les taux plasmatiques de facteur VIII:C et de facteur Willebrand (vWFR:Co) doivent augmenter significativement dans l'heure ou les 2 heures qui suivent l'administration de desmopressine.
En cas de non-réponse, l'administration de préparation de facteur VIII peut être nécessaire.
La mesure du temps de saignement doit être standardisée.
Les dosages plasmatiques des facteurs de coagulation doivent être effectués par un laboratoire d'hématologie.
Mode d’administration
Pulvérisation nasale (voir les instructions d’utilisation mentionnées à la rubrique 6.6).
En cas de doute sur la dose administrée, le spray ne doit plus être utilisé avant la prochaine dose prévue.
Chez l'enfant, l'administration doit être réalisée sous la surveillance d'un adulte.
· Hypersensibilité à la substance active ou à l’un des excipients mentionnés à la rubrique 6.1.
· Enfants de moins de 2 ans.
· Chez les patients atteints de maladie de Willebrand de type 2B : le facteur von Willebrand est de structure anormale et la desmopressine peut entraîner une agrégation plaquettaire responsable de thrombocytopénie.
· Chez les patients atteints de maladie de Willebrand de type 3.
· Polydipsie (avec production d'urine excédant 40 ml/kg/24h).
· Insuffisance cardiaque connue ou suspectée.
· Etat pathologique nécessitant un traitement par les diurétiques.
· Hyponatrémie connue.
· Syndrome de sécrétion inappropriée d'hormone anti-diurétique.
4.4. Mises en garde spéciales et précautions d'emploi
Avant la première prescription d'OCTIM, le test de réponse thérapeutique à la desmopressine doit être pratiqué dans un centre spécialisé dans le traitement de l'hémophilie et de la maladie de Willebrand.
OCTIM ne doit être utilisé en traitement à domicile que pour prévenir et traiter des accidents hémorragiques modérés.
Le produit doit être utilisé avec précaution chez les patients ayant des antécédents cardiovasculaires, d'hypertension artérielle ou chez qui il existe une inaptitude au respect de la restriction hydrique en particulier chez les enfants ou les personnes âgées.
Un traitement par desmopressine sans diminution parallèle de la prise liquidienne peut entraîner une intoxication par l'eau avec hyponatrémie, avec ou sans survenue de symptômes d'alarme tels que céphalées, nausées, vomissements, diminution de la natrémie, prise de poids rapide, état confusionnel, crises convulsives voire un état de mal comitial.
Il existe un risque de rétention hydrique lors de l'administration de doses élevées : l'apport hydrique doit être réduit au minimum nécessaire (750 mL par 24 heures chez l'adulte et 20 mL/kg et par 24 heures chez l'enfant). Le poids corporel doit être régulièrement contrôlé.
L’administration d’Octim doit être interrompue et la prise de liquide fortement réduite en cas d’augmentation rapide du poids corporel, de diminution de la natrémie en dessous de 130 mmol/L ou de diminution de l’osmolalité en dessous de 270 mOsm/kg de poids corporel.
Les enfants, les sujets âgés et les patients dont la natrémie se situe à la limite inférieure de la normale présentent un risque accru d’hyponatrémie. Le traitement par desmopressine doit être ajusté avec une surveillance stricte lors d'affections aiguës intercurrentes caractérisées par un déséquilibre hydrique et/ou électrolytique telles que : épisode infectieux, fièvre, gastroentérite. L’équilibre hydrique et/ou électrolytique doit être particulièrement surveillé en cas de saignements excessifs.
Le traitement doit être utilisé avec précaution chez les patients présentant une insuffisance rénale modérée ou sévère (clairance de la créatinine £ 50 ml/min).
Le traitement doit être utilisé avec précaution chez les patients à risque d’hypertension intracrânienne.
En cas d'insuffisance corticotrope, celle-ci doit être corrigée avant le début du traitement et pendant toute sa durée, afin d'éviter la rétention hydrique.
Une attention particulière sera apportée aux patients prenant en association un médicament pouvant induire un syndrome de sécrétion inappropriée d’hormone anti-diurétique. Chez ces patients, la restriction hydrique devra être particulièrement respectée et une surveillance de la natrémie (ionogramme sanguin) sera instaurée (voir rubrique 4.5).
En raison de la présence de chlorure de benzalkonium, il existe un risque d’eczéma de contact, d’irritation et de bronchospasme.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Une interaction de la desmopressine avec les médicaments agissant sur le métabolisme hépatique est peu probable, car les études réalisées in vitro avec des microsomes humains ont démontré que la desmopressine ne subit pas de métabolisation significative dans le foie. Néanmoins, aucune étude in vivo formelle n’a été réalisée.
Associations faisant l'objet de précautions d’emploi
Carbamazépine
Augmentation de l'activité antidiurétique (hyponatrémie sous carbamazépine).
La surveillance biologique de la natrémie et de l'osmolalité plasmatique doit être régulière et la posologie adaptée si nécessaire.
Associations à prendre en compte
Clofibrate
Potentialisation de l'activité antidiurétique.
Chlorpropamide
Potentialisation de l'activité antidiurétique.
Indométacine
Potentialisation de l'activité antidiurétique.
Glibenclamide
Diminution de l'activité antidiurétique.
4.6. Fertilité, grossesse et allaitement
Grossesse
Les études effectuées chez l'animal n'ont pas mis en évidence d'effet tératogène.
En l'absence d'effet tératogène chez l'animal, un effet malformatif dans l'espèce humaine n'est pas attendu. En effet, à ce jour, les substances responsables de malformations dans l'espèce humaine se sont révélées tératogènes chez l'animal au cours d'études bien conduites sur deux espèces.
En clinique, l'utilisation de la desmopressine sur des effectifs limités n'a apparemment révélé aucun effet malformatif ou fœtotoxique particulier à ce jour. Toutefois, des études complémentaires sont nécessaires pour évaluer les conséquences d'une exposition en cours de grossesse.
En conséquence, l'utilisation de la desmopressine ne doit être envisagée au cours de la grossesse que si nécessaire.
Les études sur la reproduction animale n’ont pas révélé d’effets cliniquement significatifs sur les parents et leurs descendances. Il n’a pas été observé de passage transplacentaire de la desmopressine à dose thérapeutique dans les études in vitro sur les tissus placentaires humains.
La desmopressine passe dans le lait maternel ; cependant les quantités de desmopressine retrouvées dans le lait maternel de femmes recevant des doses élevées de desmopressine (300 µg par voie nasale) sont très inférieures à celles pouvant avoir un effet sur la diurèse et l'absorption gastro-intestinale de la desmopressine chez l'enfant est très peu probable. En conséquence, l'allaitement est vraisemblablement dénué de risque pour l'enfant.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Résumé du profil de sécurité
L’effet indésirable le plus grave avec la desmopressine est l’hyponatrémie rapportée très rarement. Il faut y penser devant la survenue de symptômes d'alarme tels que céphalées, nausées, vomissements, diminution de la natrémie, prise de poids, évanouissements, douleurs abdominales, crampes musculaires, sensations vertigineuses, état confusionnel, diminution de la conscience et, dans les cas sévères, convulsions voire coma. Elle peut être observée en l'absence de restriction hydrique et entraîner la survenue de crises comitiales.
Les effets indésirables, généralement transitoires, les plus fréquemment rapportés ont été majoritairement non graves : céphalées, rougeur du visage et des yeux, tachycardie de durée brève, rhinite.
Des cas de réactions cutanées allergiques et des réactions allergiques générales ont été rapportés.
Les effets indésirables rapportés uniquement après commercialisation ou pour les autres formes de desmopressine sont listés dans la colonne «fréquence indéterminée».
|
MedDRA Système Classe Organe |
Fréquent (≥1/100, <1/10) |
Très rare (<1/10000) |
Indeterminée |
|
Affections du système immunitaire |
|
|
Réaction allergique |
|
Troubles du métabolisme et nutritionnels |
|
Hyponatrémie |
Prise de poids* |
|
Affections psychiatriques |
|
Etat confusionnel* |
|
|
Affections du système nerveux |
Céphalées* |
|
Convulsions* Coma* Sensation vertigineuse* |
|
Affections oculaires |
Rougeur des yeux |
|
|
|
Affections cardiaques |
Tachycardie |
|
|
|
Affections vasculaires |
Rougeur |
|
|
|
Affections respiratoires, thoraciques et mediastinales |
Congestion nasale, Rhinite Epistaxis |
|
|
|
Affections gastro-intestinales |
Nausées* Douleurs abdominales* |
|
Vomissements* |
|
Affections de la peau et du tissu sous-cutané |
|
|
Prurit Eruption cutanée Urticaire |
|
Affections musculo-squelettiques et systémiques |
|
|
Spasmes musculaires* |
|
Troubles généraux et anomalies au site d’administration |
|
|
Fatigue*, Œdèmes périphériques*,
|
Population pédiatrique
Une attention particulière doit être apportée aux mises en garde spéciales et précautions d’emploi (voir rubrique 4.4).
Autres populations
Les enfants, les sujets âgés et les patients dont la natrémie se situe à la limite inférieure de la normale présentent un risque accru d’hyponatrémie (voir rubrique 4.4).
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr.
Il existe un risque de rétention hydrique lors de l'administration de doses élevées : l'apport hydrique doit être réduit au minimum nécessaire et le poids corporel doit être régulièrement contrôlé.
En cas d'augmentation importante du poids corporel, de survenue d'une natrémie inférieure à 130 mmol/L, ou d'une osmolalité plasmatique inférieure à 270 mOsmol/kg, l'absorption de liquide doit être sévèrement réduite et le traitement doit être interrompu.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Classe pharmacothérapeutique : VASOPRESSINE ET ANALOGUES, code ATC : H01BA02
La desmopressine est un analogue structural de l'arginine-vasopressine humaine (hormone antidiurétique ou ADH provenant du lobe postérieur de l'hypophyse). Elle diffère de l'hormone humaine par la désamination de la cystéine terminale et par le remplacement de la L-arginine par la D-arginine.
La desmopressine entraîne une augmentation de l'activité du facteur VIII:C par une action sur la libération du facteur VIII intracellulaire. Une augmentation plus modérée du facteur Willebrand (vWFR:Co) est également observée, ainsi qu'une libération de l'activateur tissulaire du plasminogène. La libération de l'activateur tissulaire du plasminogène qui suit la prise de desmopressine ne nécessite pas une compensation par les anti-fibrinolytiques.
Il n'a pas été possible d'établir une corrélation entre le taux plasmatique de ces facteurs et le temps de saignement, que ce soit avant ou après l'administration de desmopressine.
L'effet de l'administration de 300 μg de desmopressine par administration endonasale unique chez un patient dont le poids est supérieur ou égal à 50 kg, sur le profil de coagulation est comparable à celui observé après une administration intraveineuse de 0,2 μg/kg de desmopressine.
Chez le volontaire sain, la reproductibilité de la réponse en facteur VIII:C varie de 21% pour un même individu ; la variation interindividuelle est de 27 %.
5.2. Propriétés pharmacocinétiques
La biodisponibilité de la desmopressine après administration endonasale de desmopressine est d'environ 6%.
Pour une dose de 300 microgrammes, la concentration maximale plasmatique qui est en moyenne de 500 pg/mL est atteinte après environ 60 minutes.
La demi-vie plasmatique de la desmopressine est d'environ 3 heures.
5.3. Données de sécurité préclinique
Les données précliniques ne laissent supposer aucun effet mutagène d'OCTIM.
3 ans
6.4. Précautions particulières de conservation
A conserver à une température ne dépassant pas +25°C.
A conserver en position verticale.
Ce médicament est sensible à la lumière, conservez le conditionnement primaire dans l'emballage extérieur.
Ne pas congeler.
6.5. Nature et contenu de l'emballage extérieur
2,5 mL (25 doses) en flacon pulvérisateur (verre brun) avec embout nasal muni d'un capuchon de protection (Polypropylène).
6.6. Précautions particulières d’élimination et de manipulation
Avant la première utilisation d’OCTIM, amorcer la pompe en appuyant 6 fois vers le bas ou jusqu'à l'obtention d'une pulvérisation homogène. Si le spray n'a pas été utilisé pendant 3 jours, il est nécessaire d'amorcer à nouveau la pompe en appuyant deux fois vers le bas ou jusqu'à l'obtention d'une pulvérisation homogène.
Instructions d’utilisation :
Avant toute pulvérisation, il est nécessaire de se moucher pour éviter une perte du produit.
|
|
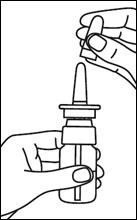
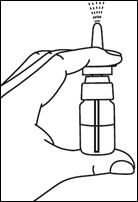
1. Enlever le capuchon protecteur |
|
2. Contrôler que l’extrémité du tube à l’intérieur du flacon plonge dans le liquide. |
|
|
|
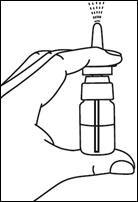
3. Réamorcer la pompe si le spray n'a pas été utilisé au cours des 3 derniers jours. |
|
4. Dès qu'elle est amorcée, la pompe délivre une quantité de 150 μg, chaque fois qu'une pression est exercée. |
|
|
|
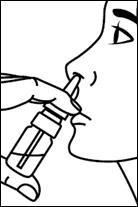
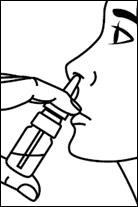
5. Insérer l’embout nasal dans la narine et presser une fois. Respirez normalement par le nez sans inspirer fortement.
|
|
6. Lorsque 2 pulvérisations sont nécessaires, exercer une pression alternativement dans chaque narine. |
|
|
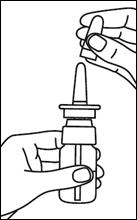
7. Replacer le capuchon protecteur après chaque utilisation et conserver le flacon en position verticale. |
|
Le flacon pulvérisateur doit toujours être conservé en position verticale.
En cas de doute sur la dose administrée, le spray ne doit plus être utilisé avant la prochaine dose prévue.
Chez l'enfant, l'administration doit être réalisée sous la surveillance d'un adulte.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
7, RUE JEAN-BAPTISTE CLEMENT
94250 GENTILLY
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
CIP34009 354 733 1 8 : 2,5 mL (25 doses) en flacon pulvérisateur (verre brun).
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
OCTIM 150 microgrammes/dose, solution pour pulvérisation nasale
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
{JJ mois AAAA}
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Liste I
Médicament soumis à prescription initiale hospitalière annuelle.
ANSM - Mis à jour le : 21/10/2025
OCTIM 150 microgrammes/dose, solution pour pulvérisation nasale
acétate de desmopressine
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin ou votre pharmacien.
· Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d’autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien ou votre infirmier/ère. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
1. Qu'est-ce que OCTIM 150 microgrammes/dose, solution pour pulvérisation nasale et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant d'utiliser OCTIM 150 microgrammes/dose, solution pour pulvérisation nasale ?
3. Comment utiliser OCTIM 150 microgrammes/dose, solution pour pulvérisation nasale ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver OCTIM 150 microgrammes/dose, solution pour pulvérisation nasale ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE OCTIM 150 microgrammes/dose, solution pour pulvérisation nasale ET DANS QUELS CAS EST-IL UTILISE ?
Classe pharmacothérapeutique - code ATC : H01BA02
La desmopressine agit en augmentant la production de certains facteurs de coagulation afin d’assurer une coagulation du sang normale et d’empêcher des saignements.
Ce médicament est utilisé afin de prévenir et/ou de traiter les saignements et en cas d’opération chirurgicale dans les cas suivants :
· Si vous souffrez de la maladie de Willebrand (à l’exception des formes sévères de type 3 ou de type 2B). La maladie de Willebrand est une maladie héréditaire caractérisée par un manque en une protéine appelée facteur Willebrand. Ce manque entraîne des problèmes de coagulation, responsables de saignements anormalement abondants.
· Si vous souffrez d’hémophilie A. L’hémophilie A est une maladie héréditaire caractérisée par un manque en une protéine appelée facteur VIII de la coagulation. Ce manque entraîne des troubles de la coagulation, responsables de saignements anormalement abondants.
· Chez les femmes portant le gène de l’hémophilie A et qui ont des risques de saignement.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D’UTILISER OCTIM 150 microgrammes/dose, solution pour pulvérisation nasale ?
· si vous êtes allergique à la desmopressine ou à l’un des autres composants contenus dans ce médicament, mentionnés dans la rubrique 6.
· chez les enfants de moins de 2 ans ;
· si vous souffrez de la maladie de Willebrand de type 2B (forme sévère de la maladie de Willebrand). Dans ce cas, OCTIM peut entraîner l’adhésion des plaquettes entre elles (cellules du sang jouant un rôle dans la coagulation) et donc une diminution de leur nombre dans le sang ;
· si vous souffrez de la maladie de Willebrand de type 3 (forme sévère de la maladie de Willebrand) ;
· si vous avez une soif excessive (polydipsie) avec une production d'urine excessive. Si votre cœur fonctionne mal (insuffisance cardiaque) ;
· si vous avez une maladie qui nécessite un traitement augmentant la quantité d’urine émise (médicaments diurétiques) ;
· si vous avez un taux de sodium dans le sang trop bas (hyponatrémie) ;
· si vous avez un taux d’hormone antidiurétique dans le sang trop élevé (syndrome de sécrétion inappropriée d'hormone antidiurétique).
Avertissements et précautions
Adressez-vous à votre médecin ou pharmacien avant d’utiliser OCTIM.
Ce médicament contient du chlorure de benzalkonium qui peut provoquer, une gêne respiratoire.
Prévenez votre médecin si vous êtes dans l’un des cas suivants :
· si vous avez ou si vous avez eu une maladie du cœur ou des vaisseaux,
· si vous avez ou si vous avez eu une tension artérielle élevée (hypertension artérielle),
· si vous avez ou si vous avez eu une baisse du taux de sodium dans le sang. En effet, un taux faible de sodium dans le sang peut entraîner des convulsions (épilepsie), pouvant être graves (état de mal épileptique),
· si vous ne pouvez pas respecter une diminution de la quantité de boissons quotidiennes (restriction hydrique), en particulier chez les enfants et chez les personnes âgées de plus de 65 ans,
· si votre glande surrénale (située au-dessus du rein) ne produit pas assez de certaines hormones (insuffisance corticotrope). L’insuffisance corticotrope doit être corrigée avant le début du traitement et pendant toute sa durée afin d’éviter la rétention hydrique (augmentation de la quantité d’eau dans le corps),
· si durant le traitement vous avez une maladie responsable de fièvre, de vomissements, de diarrhées.
Enfants
Sans objet.
Autres médicaments et OCTIM
Informez votre médecin ou pharmacien si vous utilisez, avez récemment utilisé ou pourriez utiliser tout autre médicament.
Prévenez votre médecin ou votre pharmacien si vous prenez l’un des médicaments suivants :
Médicament anti dépresseur
Médicament utilisé pour traiter l’épilepsie (la carbamazépine)
Médicament utilisé pour diminuer le taux de graisses dans le sang (le clofibrate),
Médicament utilisé pour diminuer l’inflammation et contre la douleur (anti-inflammatoire non stéroïdien : l’indométacine)
Médicaments utilisés pour traiter le diabète (le glibenclamide et le chlorpropamide).
OCTIM avec des boissons
Si vous prenez des doses élevées de ce médicament, il existe un risque d’augmentation de la quantité d’eau dans le corps (rétention hydrique). Par conséquent, l’apport hydrique (apport en eau de boissons et autres) doit être réduit au minimum nécessaire pendant le traitement (750 ml par 24 heures chez l’adulte et 20 ml/kg et par 24 heures chez l’enfant).
Votre poids doit être contrôlé régulièrement.
Si vous êtes enceinte ou que vous allaitez, si vous pensez être enceinte ou planifiez une grossesse, demandez conseil à votre médecin ou pharmacien avant de prendre ce médicament.
Au cours de la grossesse et de l’allaitement, vous ne devez utiliser ce médicament que sur les conseils de votre médecin.
Si vous découvrez que vous êtes enceinte pendant le traitement, consultez votre médecin.
Demandez conseil à votre médecin ou à votre pharmacien avant de prendre tout médicament.
Conduite de véhicules et utilisation de machines
Aucun élément ne permet de penser qu’OCTIM altère la capacité des patients à conduire des véhicules ou à utiliser des machines.
OCTIM contient chlorure de benzalkonium
3. COMMENT UTILISER OCTIM 150 microgrammes/dose, solution pour pulvérisation nasale ?
|
IMPORTANT : Le traitement par OCTIM 150 microgrammes/dose, solution pour pulvérisation nasale doit respecter : · la dose à utiliser : la dose 150 μg soit une pulvérisation nasale pour un patient qui pèse moins de 50 kg et 300 μg soit une pulvérisation dans chaque narine pour un patient qui pèse plus de 50 kg, · la restriction hydrique : l'absorption de liquide ne doit pas dépasser 750 mL/24 h pour un adulte et 20 mL par kg et par 24 h chez l'enfant, · la durée du traitement : à domicile, la durée du traitement ne doit pas dépasser 48 heures. |
Le traitement sera instauré et surveillé par un médecin expérimenté dans le traitement de l'hémophilie et de la maladie de Willebrand.
Avant la première prescription d’OCTIM, vous recevrez une injection test d’OCTIM dans un centre spécialisé dans le traitement de l’hémophilie et de la maladie de Willebrand afin de vérifier que vous répondez bien au traitement.
Ce test comprend notamment :
· un dosage de certains facteurs de coagulation (facteur VIII, facteur Willebrand), la mesure du temps de saignement,
· un dosage de la quantité de plaquettes (éléments du sang jouant un rôle important dans la coagulation sanguine) dans votre sang,
· un dosage de la quantité de sodium dans votre sang.
Ces dosages seront renouvelés après 1 à 2 heures, puis entre 4 et 6 heures après une pulvérisation nasale d’OCTIM.
Posologie
La dose habituelle est de :
Chez les personnes pesant moins de 50 kg : 150 microgrammes (une seule pulvérisation nasale).
Chez les personnes ayant un poids supérieur ou égal à 50 kg : 300 microgrammes (soit une pulvérisation dans chaque narine).
Traitement à domicile
En général, ce médicament doit être utilisé à l’hôpital. Cependant, vous pouvez être amené à utiliser ce médicament chez vous si vous êtes dans l’une des situations suivantes :
· si vous avez des saignements du nez,
· si vous avez des saignements des gencives,
· si vous avez des règles abondantes,
· si vous avez eu un petit choc (contusion simple) avec ou sans bleu,
· si vous devez aller chez le dentiste pour vous faire retirer une dent,
· si vous devez subir un geste chirurgical mineur (ongles incarnés, pose d’un drain dans le tympan...).
Demandez à votre médecin à quel moment vous devez vous administrer ce médicament si vous êtes dans une de ces situations.
L’administration peut être répétée toutes les 12 heures et ne devra pas se prolonger au-delà de 48 heures.
Si le traitement doit se prolonger au-delà de 48 heures, celui-ci devra être effectué à l’hôpital sous surveillance d’un médecin ayant l’expérience du traitement de l’hémophilie et de la maladie de Willebrand.
Traitement à l’hôpital
L’administration peut être renouvelée toutes les 12 heures pendant au maximum 2 à 3 jours.
Mode et voie d'administration
Ce médicament est à utiliser par voie nasale.
Avant la première utilisation d’OCTIM, amorcer la pompe en appuyant 6 fois vers le bas ou jusqu'à l'obtention d'une pulvérisation homogène. Si le spray n'a pas été utilisé pendant 3 jours, il est nécessaire d'amorcer à nouveau la pompe en appuyant deux fois vers le bas ou jusqu'à l'obtention d'une pulvérisation homogène.
Instructions d’utilisation :
Avant chaque pulvérisation nasale, vous devez vous moucher pour dégager les narines et éviter une perte du produit.
|
|
1. Enlever le capuchon protecteur |
|
2. Contrôler que l’extrémité du tube à l’intérieur du flacon plonge dans le liquide. |
|
|
|
3. Réamorcer la pompe si le spray n'a pas été utilisé au cours des 3 derniers jours. |
|
4. Dès qu'elle est amorcée, la pompe délivre une quantité de 150 microgrammes, chaque fois qu'une pression est exercée. |
|
|
|
5. Insérer l’embout nasal dans la narine et presser une fois. Respirez normalement par le nez sans inspirer fortement.
|
|
6. Lorsque 2 pulvérisations sont nécessaires, exercer une pression alternativement dans chaque narine. |
|
|
7. Replacer le capuchon protecteur après chaque utilisation et conserver le flacon en position verticale. |
|
Le flacon pulvérisateur doit toujours être conservé en position verticale.
En cas de doute sur la dose administrée, le spray ne doit plus être utilisé avant la prochaine dose prévue.
Chez l'enfant, l'administration doit être réalisée sous la surveillance d'un adulte.
.
Fréquence d’administration
· Si vous prenez ce médicament pour traiter des saignements : vous devez utiliser OCTIM dès le début du saignement. Vous devrez attendre au minimum 3 à 4 jours entre le traitement de 2 saignements.
· Si vous prenez ce médicament avant une opération chirurgicale : vous devez utiliser OCTIM une heure avant l’opération.
Si vous avez utilisé plus d’OCTIM que vous n’auriez dû
Consultez immédiatement votre médecin ou votre pharmacien.
Les effets indésirables suivants peuvent survenir :
· une augmentation importante de votre poids due à une rétention d’eau dans le corps,
· une diminution du taux de sodium dans le sang.
Si l’un de ces effets survient, vous devez arrêter le traitement, réduire l’absorption de liquides au minimum nécessaire et votre poids doit être régulièrement contrôlé.
Si vous oubliez d’utiliser OCTIM
Ne prenez pas de dose double pour compenser la dose que vous avez oublié de prendre.
Si vous arrêtez d’utiliser OCTIM
Sans objet
Si vous avez d’autres questions sur l’utilisation de ce médicament, demandez plus d’informations à votre médecin ou à votre pharmacien.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Description des effets indésirables
L’effet indésirable le plus grave avec la desmopressine est un taux de sodium dans le sang trop bas (hyponatrémie) survenant très rarement.
Pensez-y si les signes d’alarme suivants surviennent : maux de tête, nausées, vomissements, prise de poids, évanouissements, douleurs au niveau du ventre, crampes musculaires, sensations de vertige, confusion (paroles qui ne veulent rien dire, difficulté d’attention ) et dans les cas sévères des convulsions (contractions violentes et involontaires d’un ou plusieurs membres) voire un coma.
Ces signes peuvent traduire une rétention d’eau plus ou moins importante. Ils apparaissent en général avec des doses élevées d’Octim.
Si vous ressentez l’un de ces signes, réduisez votre consommation d’eau, arrêtez votre traitement et prévenez immédiatement votre médecin.
Effets indésirables fréquents (affecte jusqu’à un patient sur 10) : maux de tête, rougeur des yeux, accélération des battements du cœur (tachycardie), rougeur, nez bouché, inflammation du nez (rhinite), saignement du nez, nausées et douleurs au niveau du ventre.
Effets indésirables très rares (affecte moins d’un patient sur 10000) : taux de sodium dans le sang trop bas (hyponatrémie).
Effets indésirables dont la fréquence est indéterminée : réaction allergique, prise de poids, confusion (paroles qui ne veulent rien dire, difficulté d’attention ), convulsions (contractions violentes et involontaires d’un ou plusieurs membres), coma, sensation de vertiges, vomissements, démangeaisons (prurit), éruption au niveau de la peau (rash, urticaire), spasmes musculaires, fatigue, gonflements des membres (œdèmes périphériques).
Si vous remarquez des effets indésirables non mentionnés dans cette notice, ou si certains effets indésirables deviennent graves, veuillez en informer votre médecin ou votre pharmacien.
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet: https://signalement.social-sante.gouv.fr.
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER OCTIM 150 microgrammes/dose, solution pour pulvérisation nasale ?
Tenir ce médicament hors de la vue et de la portée des enfants.
N’utilisez pas ce médicament après la date de péremption indiquée sur l’emballage après EXP. La date de péremption fait référence au dernier jour de ce mois.
Ce médicament doit être conservé à une température ne dépassant pas + 25°C.
A conserver en position verticale.
Afin de conserver ce médicament contre la lumière, conserver le conditionnement primaire dans l'emballage extérieur.
Ne pas congeler.
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient OCTIM 150 microgrammes/dose, solution pour pulvérisation nasale
· La substance active est :
la desmopressine (134 microgrammes par flacon) sous forme d’acétate de desmopressine trihydraté.
· Les autres composants sont : le chlorure de sodium, l'acide citrique monohydraté, l'hydrogénophosphate de sodium dihydraté, la solution de chlorure de benzalkonium à 50 pour cent et l'eau purifiée.
Ce médicament se présente sous forme de solution pour pulvérisation nasale. Boîte de 1 flacon pulvérisateur de 2,5 mL (25 doses).
Titulaire de l’autorisation de mise sur le marché
7, RUE JEAN-BAPTISTE CLEMENT
94250 GENTILLY
Exploitant de l’autorisation de mise sur le marché
7, RUE JEAN-BAPTISTE CLEMENT
94250 GENTILLY
WITTLAND 11
24109 KIEL
Allemagne
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Sans objet.
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
mois AAAA
Sans objet.
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).
Les informations suivantes sont destinées exclusivement aux professionnels de santé :
Surveillance du traitement
Si le traitement est poursuivi plus de 48 heures, un contrôle de l’efficacité et de la tolérance est nécessaire, avec dosage des facteurs de coagulation (facteur VIII:C et facteur Willebrand), dosage de la natrémie (taux de sodium dans le sang) et mesure si besoin du temps de saignement, avant et 1 à 2 heures, puis 4 à 6 heures après la pulvérisation de desmopressine. Les taux plasmatiques de facteur VIII:C et de facteur Willebrand (vWFR:Co) doivent augmenter significativement dans l’heure ou les 2 heures qui suivent l’administration de desmopressine. Il n’a pas été possible d’établir une corrélation entre le taux plasmatique de ces facteurs et le temps de saignement, que ce soit avant ou après l’administration de desmopressine. En cas de non-réponse, l’administration de préparation de facteur VIII peut être nécessaire. La mesure du temps de saignement doit être standardisée. Les dosages plasmatiques des facteurs de coagulation doivent être effectués par un laboratoire d’hématologie.
Informations importantes
Les informations importantes disponibles pour ce médicament sont les suivantes :
- Rappel de tous les lots de OCTIM 150 microgrammes/dose (desmopressine) : conduite à tenir par les patients et les professionnels de santé - Point d'information
- Indisponibilité du médicament OCTIM (desmopressine) : mise à disposition des patients d'un guide pratique pour l'utilisation de l'alternative OCTOSTIM - Point d'Information