Dernière mise à jour le 30/06/2025
REFRESH, collyre en récipient unidose
Indications thérapeutiques
Classe pharmacothérapeutique : Substitut lacrymal - code ATC : S01XA20
Ce médicament est utilisé pour soulager les signes d'irritation liés à la sécheresse de l'œil (quand il existe une insuffisance de larmes).
Vous devez vous adresser à votre médecin si vous ne ressentez aucune amélioration ou si vous vous sentez moins bien.
Présentations
> 30 récipient(s) unidose(s) polyéthylène de 0,4 ml
Code CIP : 337 960-3 ou 34009 337 960 3 7
Déclaration de commercialisation : 01/09/1998
Cette présentation est agréée aux collectivités
- Prix hors honoraire de dispensation : 2,92 €
- Honoraire de dispensation : 1,02 €
- Prix honoraire compris : 3,94 €
- Taux de remboursement :65%
> 90 récipient(s) unidose(s) polyéthylène de 0,4 ml
Code CIP : 337 962-6 ou 34009 337 962 6 6
Déclaration de commercialisation : 15/01/2010
Cette présentation est agréée aux collectivités
- Prix hors honoraire de dispensation : 7,82 €
- Honoraire de dispensation : 1,02 €
- Prix honoraire compris : 8,84 €
- Taux de remboursement :65%
Service médical rendu (SMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprès de la HAS (plus d'informations dans l'aide). Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Important | Avis du 17/02/2016 | Renouvellement d'inscription (CT) | Le service médical rendu par REFRESH reste important dans l’indication de l’AMM. |
Amélioration du service médical rendu (ASMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprés de la HAS (plus d'informations dans l'aide). Les avis et synthéses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur de l'ASMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| V (Inexistant) | Avis du 22/07/2009 | Inscription (CT) | Absence d’amélioration du service médical rendu. |
ANSM - Mis à jour le : 08/07/2022
REFRESH, collyre en récipient unidose
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Alcool polyvinylique............................................................................................................ 5,60 mg
Povidone............................................................................................................................ 2,40 mg
Pour un récipient unidose de 0,4 ml.
Pour la liste complète des excipients, voir rubrique 6.1.
Collyre en solution en récipient unidose.
Solution limpide et incolore.
4.1. Indications thérapeutiques
Traitement symptomatique du syndrome d'œil sec dans ses manifestations modérées.
4.2. Posologie et mode d'administration
En instillation oculaire.
La posologie recommandée est de 1 goutte dans l'œil ou les yeux à traiter, 3 à 4 fois par jour et jusqu'à 8 fois si les troubles oculaires liés à l'hypolacrymie le nécessitent.
Population pédiatrique
La sécurité et l’efficacité de REFRESH chez les enfants n’ont pas été établies.
Mode d’administration
Tourner le capuchon pour ouvrir l'unidose et instiller le collyre.
Instiller dans le cul de sac conjonctival en tirant légèrement la paupière inférieure vers le bas et en regardant vers le haut.
Utiliser l'unidose immédiatement après ouverture et jeter après usage.
4.4. Mises en garde spéciales et précautions d'emploi
En cas d'apparition ou d'aggravation d'irritation, de douleur, de rougeur ou de troubles de la vision, le traitement doit être arrêté et réévalué.
Ce collyre est présenté en récipients unidoses (à usage unique) et ne contient pas de conservateur : il existe donc un risque de rapide contamination bactérienne. Pour éviter une contamination du collyre ou une éventuelle lésion de l’œil, ne pas mettre l'embout de l'unidose en contact avec l'œil ou toute autre surface. L'unidose doit être jetée immédiatement après usage et ne doit pas être conservée en vue d'une utilisation ultérieure.
En cas de traitement concomitant par un autre collyre, attendre 15 minutes entre les deux instillations et terminer par le produit le plus visqueux.
REFRESH pouvant retarder la pénétration d'autres médicaments, doit être instillé en dernier s'il est le plus visqueux.
Ne pas utiliser si la solution change de couleur ou devient trouble.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Aucune étude d’interaction n’a été réalisée.
4.6. Fertilité, grossesse et allaitement
Il n’existe pas d’étude spécifique sur l’utilisation de REFRESH pendant la grossesse ou l’allaitement dans l’espèce humaine.
En conséquence, l'utilisation de REFRESH se fera avec prudence chez la femme enceinte ou allaitante.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Dans ce cas, il doit être recommandé au patient de ne pas conduire ni utiliser de machines jusqu'à ce que la vision normale soit rétablie.
Les effets indésirables rapportés après utilisation de REFRESH sont classés par classes de systèmes d'organes et listés ci-dessous comme suit : Très fréquent (≥1/10) ; Fréquent (≥1/100, <1/10) ; Peu fréquent (≥1/1 000, <1/100) ; Rare (≥1/10 000, <1/1 000) ; Très rare (<1/10 000) et fréquence indéterminée (ne peut être estimée sur la base des données disponibles).
Des cas de picotements, de douleurs oculaires ou d'irritations transitoires ont été rapportés à l'instillation de REFRESH.
Affections oculaires
Fréquence indéterminée (ne peut être estimée sur la base des données disponibles) :
· Irritation oculaire,
· Douleur oculaire
· Hyperémie conjonctivale
· Vision trouble,
· Prurit oculaire,
· Sensation de corps étranger,
· Sécrétions oculaires,
· Hyperémie oculaire,
· Larmoiements,
· Hypersensibilité.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : www.signalement-sante.gouv.fr
Aucun effet systémique n’est attendu à la suite d’un surdosage après administration topique de REFRESH.
De plus, aucun effet toxique n’est attendu suite à un surdosage systémique accidentel.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Mécanisme d’action
Ce collyre est un humidificateur de la cornée.
Il ne possède pas d'activité pharmacologique mais agit par un effet mécanique (lubrification, hydratation).
Il supplée à l'insuffisance de sécrétion des larmes, en reconstituant temporairement la phase aqueuse des larmes.
L'agent améliorant la viscosité est l'alcool polyvinylique et l'agent lubrifiant est la povidone.
5.2. Propriétés pharmacocinétiques
Il n'existe pas d'étude pharmacocinétique contrôlée chez l'animal ou chez l'Homme. Une absorption ou une accumulation dans les tissus oculaires peut être vraisemblablement exclue en raison du haut poids moléculaire des principes actifs.
5.3. Données de sécurité préclinique
Chlorure de sodium, hydroxyde de sodium ou acide chlorhydrique (pour ajuster le pH), eau purifiée.
18 mois.
Utiliser l'unidose immédiatement après ouverture et jeter après usage.
6.4. Précautions particulières de conservation
A conserver à une température ne dépassant pas 25°C.
Pour les conditions de conservation du médicament après première ouverture, voir la rubrique 6.3.
6.5. Nature et contenu de l'emballage extérieur
A conserver à une température ne dépassant pas 25°C.
Pour les conditions de conservation du médicament après première ouverture, voir la rubrique 6.3.
6.6. Précautions particulières d’élimination et de manipulation
Récipient unidose en polyéthylène contenant 0,4 ml.
Boîte de 5, 10, 30 ou 90 unidoses.
Toutes les présentations peuvent ne pas être commercialisées.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
10 RUE D’ARCUEIL
94528 RUNGIS CEDEX
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 337 958-9 ou 34009 337 958 9 4 : 0,4 ml en récipient unidose (PE). Boîte de 5.
· 337 959-5 ou 34009 337 959 5 5: 0,4 ml en récipient unidose (PE). Boîte de 10.
· 337 960-3 ou 34009 337 960 3 7: 0,4 ml en récipient unidose (PE). Boîte de 30.
· 337 962-6 ou 34009 337 962 6 6: 0,4 ml en récipient unidose (PE). Boîte de 90.
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
<{JJ mois AAAA}>
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Médicament non soumis à prescription médicale.
ANSM - Mis à jour le : 08/07/2022
REFRESH, collyre en récipient unidose
Alcool polyninylique/Povidone
Vous devez toujours utiliser ce médicament en suivant scrupuleusement les informations fournies dans cette notice ou par votre médecin ou votre pharmacien.
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Adressez-vous à votre pharmacien pour tout conseil ou information.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
· Vous devez vous adresser à votre médecin si vous ne ressentez aucune amélioration ou si vous vous sentez moins bien.
1. Qu'est-ce que REFRESH, collyre en récipient unidose et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant d'utiliser REFRESH, collyre en récipient unidose ?
3. Comment utiliser REFRESH, collyre en récipient unidose ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver REFRESH, collyre en récipient unidose ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE REFRESH, collyre en récipient unidose ET DANS QUELS CAS EST-IL UTILISE ?
Classe pharmacothérapeutique : Substitut lacrymal - code ATC : S01XA20
Ce médicament est utilisé pour soulager les signes d'irritation liés à la sécheresse de l'œil (quand il existe une insuffisance de larmes).
Vous devez vous adresser à votre médecin si vous ne ressentez aucune amélioration ou si vous vous sentez moins bien.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D’UTILISER REFRESH, collyre en récipient unidose ?
N’utilisez jamais REFRESH, collyre en récipient unidose :
· si vous êtes allergique à l’alcool polyvinylique et à la povidone ou à l’un des autres composants contenus dans ce médicament, mentionnés dans la rubrique 6.
Avertissements et précautions
Adressez-vous à votre médecin avant d’utiliser REFRESH.
Arrêtez d’utiliser REFRESH et consultez votre médecin si vous ressentez une douleur de l’œil, des changements dans votre vision, une rougeur ou une irritation continue de l’œil ou si les symptômes de la sécheresse oculaire s’aggravent.
Ce collyre est présenté en unidose à usage unique et ne contient pas de conservateur. Il existe donc un risque de rapide contamination bactérienne. Pour éviter une contamination du collyre ou une éventuelle lésion de l’œil, ne pas mettre l’embout de l’unidose en contact avec l’œil ou toute autre surface.
L'unidose doit être jetée immédiatement après usage et ne doit pas être conservée en vue d'une utilisation ultérieure.
Ne pas utiliser si la solution change de couleur ou devient trouble.
Enfants
Sans objet.
Autres médicaments et REFRESH, collyre en récipient unidose
En cas de traitement concomitant par un autre collyre, attendre 15 minutes entre les deux instillations et terminer par le produit le plus visqueux.
REFRESH pouvant retarder la pénétration d'autres médicaments, doit être instillé en dernier s'il est le plus visqueux.
Informez votre médecin ou pharmacien si vous prenez, avez récemment pris ou pourriez prendre tout autre médicament.
REFRESH, collyre en récipient unidose avec des aliments, boissons et de l’alcool
Sans objet.
Si vous êtes enceinte ou que vous allaitez, si vous pensez être enceinte ou planifiez une grossesse, demandez conseil à votre médecin ou pharmacien avant de prendre ce médicament.
Conduite de véhicules et utilisation de machines
La vision peut être brouillée après l'instillation ce qui peut altérer la capacité à conduire ou à utiliser des machines. Dans ce cas, il doit être recommandé au patient de ne pas conduire ni utiliser de machines jusqu'à ce que la vision normale soit rétablie.
3. COMMENT UTILISER REFRESH, collyre en récipient unidose ?
La dose recommandée est de 1 goutte dans l'œil ou les yeux à traiter 3 à 4 fois par jour et jusqu'à 8 fois par jour si la sécheresse de l'œil persiste.
Mode d’administration
Voie locale.
EN INSTILLATION OCULAIRE.
Une unidose permet de traiter les deux yeux.
Utiliser une nouvelle unidose à chaque application de la journée.
Pour une bonne utilisation du collyre, certaines précautions doivent être prises :
· Se laver soigneusement les mains avant.
· Ne pas toucher l'œil ou toute autre surface avec l'embout de l'unidose.
· Ne pas utiliser l'unidose si le capuchon semble cassé avant usage.
Pour utiliser une unidose, procéder de la façon suivante :
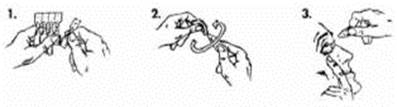
1. Détacher une unidose de la plaquette
2. Tenir l'unidose à la verticale (capuchon tête en haut). Pour ouvrir l'unidose, tourner complètement la partie plate afin de rompre la soudure.
3. Tirer doucement la paupière inférieure vers le bas en regardant vers le haut. Renverser l'unidose et la presser légèrement pour faire tomber 1 goutte dans l'œil ou les yeux à traiter. Cligner des yeux plusieurs fois.
Lorsque l'unidose est utilisée, la jeter immédiatement. Ne pas la conserver, ne pas la réutiliser.
Fréquence d’administration
Répartir les instillations au cours de la journée, en fonction des besoins.
Durée du traitement
Si les troubles persistent ou s'aggravent, consulter un ophtalmologiste afin qu'il adapte votre traitement.
Si vous avez utilisé plus de REFRESH, collyre en récipient unidose que vous n’auriez dû
Consultez immédiatement votre médecin ou votre pharmacien.
Si vous oubliez d’utiliser REFRESH, collyre en récipient unidose
Ne prenez pas de dose double pour compenser la dose simple que vous avez oublié de prendre mais poursuivez simplement votre traitement.
Si vous arrêtez d’utiliser REFRESH, collyre en récipient unidose
Sans objet.
Si vous avez d’autres questions sur l’utilisation de ce médicament, demandez plus d’informations à votre médecin ou à votre pharmacien.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Des cas de picotements ou d'irritation passagers peuvent apparaître lors de l'administration de REFRESH.
Pour les effets indésirables suivants, le nombre de personnes concernées n'est pas connu :
Réactions au niveau de l'œil :
· Irritation oculaire,
· Douleur oculaire,
· Rougeur de la conjonctive (membrane transparente de l’œil),
· Vision trouble,
· Démangeaison oculaire,
· Sensation de corps étranger,
· Œil collé,
· Rougeur oculaire,
· Larmoiements,
· Hypersensibilité.
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet: www.signalement-sante.gouv.fr
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER REFRESH, collyre en récipient unidose ?
Tenir ce médicament hors de la vue et de la portée des enfants.
N’utilisez pas ce médicament après la date de péremption indiquée sur le flacon après EXP. La date de péremption fait référence au dernier jour de ce mois.
A conserver à une température ne dépassant pas 25°C.
Ne pas conserver l'unidose après ouverture.
N’utilisez pas ce médicament si vous remarquez une unidose endommagée.
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient REFRESH, collyre en récipient unidose
· Les substances actives sont :
Alcool polyvinylique..................................................................................................... 5,60 mg
Povidone..................................................................................................................... 2,40 mg
pour un récipient unidose de 0,4 ml.
· Les autres composants sont : chlorure de sodium, hydroxyde de sodium ou acide chlorhydrique (pour ajuster le pH), eau purifiée.
Qu’est-ce que REFRESH, collyre en récipient unidose et contenu de l’emballage extérieur
REFRESH est présenté en récipient unidose en plastique contenant 0,4 ml de collyre.
Chaque boîte contient 5, 10, 30 ou 90 unidoses.
Toutes les présentations peuvent ne pas être commercialisées.
Titulaire de l’autorisation de mise sur le marché
10 RUE D’ARCUEIL
94528 RUNGIS CEDEX
Exploitant de l’autorisation de mise sur le marché
10 RUE D’ARCUEIL
94528 RUNGIS CEDEX
ALLERGAN PHARMACEUTICALS IRELAND
WESTPORT
CO. MAYO
IRLANDE
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Sans objet.
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
< {MM/AAAA}>< {mois AAAA}.>
Sans objet.
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).