
ANSM - Mis à jour le : 20/07/2020
LIDBREE 42 mg/mL, gel intra-utérin
2. COMPOSITION QUALITATIVE ET QUANTITATIVE 
Pour un mL.
Excipients à effet notoire :
Chaque mL de gel contient 284 mg de ricinoléate de macrogolglycérol (huile de ricin polyoxyéthylénée) et jusqu’à 28 microgrammes de butylhydroxytoluène (E 321).
Pour la liste complète des excipients, voir rubrique 6.1.
Liquide visqueux stérile, limpide à presque limpide, légèrement brun-jaune, qui forme un gel à température corporelle.
4.1. Indications thérapeutiques 
4.2. Posologie et mode d'administration 
Procédures cervicales
Appliquer une couche épaisse 2 à 3 mL de gel sur l’orifice cervicale et 3 mL à l’intérieur ducanal cervical en utilisant l’applicateur stérile, 5 minutes avant le début de la procédure.
Procédures intra-utérines
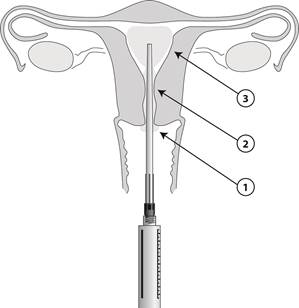
À l’aide de l’applicateur stérile, appliquer 1 à 2 mL sur la lèvre antérieure du col et 2 à 3 mL dans le canal cervical. Attendre 2 minutes pour l’apparition de l’effet anesthésique au niveau du méat interne. Insérer ensuite l’applicateur dans la cavité utérine et injecter 3 à 5 mL, 5 minutes avant la procédure. L’applicateur est gradué en centimètres. Un volume plus petit peut être administré, p. ex. chez les patientes nullipares, si la patiente présente une gêne avant l’administration de la totalité du volume. La dose intra-utérine à appliquer au cours d’une seule administration ne doit pas dépasser un volume total de 10 mL.
Population pédiatrique âgée de 15 ans et plus
Chez les adolescentes de faible poids corporel, inférieur à 30 kg, la dose doit être proportionnellement réduite et une dose unique ne doit pas dépasser la dose maximale recommandée par voie parentérale (6 mg/kg de chlorhydrate de lidocaïne, correspondant à 5,2 mg/kg de lidocaïne base dans Lidbree, c’est-à-dire 1,2 mL pour 10 kg de poids corporel). Chez les adolescentes ayant un poids de 30 kg, la dose maximale totale de Lidbree est de 3,6 mL.
La sécurité et l’efficacité de Lidbree chez les jeunes filles âgées de moins de 15 ans n’ont pas été établies. Lidbree ne doit pas être utilisé chez les enfants âgés de moins de 15 ans en raison de problèmes de sécurité (voir rubriques 4.4 et 5.1).
Patientes âgées
Aucune réduction de dose n’est nécessaire les patientes âgées (voir rubrique 5.2).
Insuffisance hépatique
En cas d’administration unique, il n’est pas nécessaire de réduire la dose chez les patientes ayant une altération de la fonction hépatique (voir rubrique 5.2).
Insuffisance rénale
Une réduction de dose n’est pas nécessaire chez les patientes ayant une insuffisance rénale.
Mode d’administration
Utilisation par voies cervicale et intra-utérine strictes.
Au moment de l’administration, Lidbree doit être liquide. S’il s’est transformé en gel, il faut le mettre au réfrigérateur jusqu’à ce qu’il redevienne liquide. La bulle d’air visible dans la seringue se déplacera si l’on incline la seringue.
Préparer le produit par étapes et appliquer le liquide visqueux en utilisant l’applicateur stérile fourni dans l’emballage :
1) Incliner la seringue et vérifier son aspect. Si le produit est sous forme liquide et prêt à l’emploi, la bulle d’air dans la seringue se déplacera lors de l’inclinaison de la seringue. Si la bulle d’air ne bouge pas, cela signifie que le produit s’est transformé en gel – dans ce cas, mettre la seringue au réfrigérateur jusqu’à ce que le produit redevienne liquide.
2) Connecter le piston et l’applicateur à la seringue et s’assurer qu’ils sont solidement attachés.
![]()
3) Expulser la bulle d’air et remplir l’applicateur de gel en enfonçant prudemment le piston de la seringue.
4) Utiliser la graduation en centimètres de l’applicateur pour préparer l’administration du gel Lidbree.
Lorsque l’applicateur est en place, 8,5 mL de gel peuvent être délivrés par la seringue. Un mL contient 42 mg de lidocaïne. Appliquer le gel par étapes (1 à 3) comme illustré sur le dessin.
Hypersensibilité à la substance active ou à l’un des excipients mentionnés à la rubrique 6.1.
4.4. Mises en garde spéciales et précautions d'emploi 
En cas de difficultés d’insertion de contraceptifs intra-utérins et/ou de saignement ou douleur inhabituels survenant pendant ou après l’insertion, un examen clinique et une échographie doivent être immédiatement réalisés afin d’exclure une perforation du col ou du corps de l’utérus, car en présence d’anesthésiques topiques efficaces, la patiente pourrait ne pas réagir à la douleur en cas de perforation.
Certaines patientes nécessitent une attention particulière :
· Patientes ayant un bloc auriculo-ventriculaire partiel ou complet – car les anesthésiques locaux peuvent inhiber la conduction myocardique.
· Les patientes traitées par des antiarythmiques de classe III (p. ex. amiodarone) doivent faire l’objet d’une surveillance étroite et une surveillance ECG doit être envisagée chez ces patientes car les effets cardiaques peuvent être additifs.
· Patientes atteintes de porphyrie aiguë. La lidocaïne est probablement porphyrinogénique et elle doit être prescrite aux patientes atteintes de porphyrie aiguë uniquement en cas d’indications urgentes ou impérieuses. Des précautions appropriées doivent être prises pour toutes les patientes atteintes de porphyrie.
· Patientes en mauvais état général.
Population pédiatrique
Lidbree ne doit pas être administré sur les muqueuses des enfants âgés de moins de 15 ans, car les concentrations plasmatiques de lidocaïne pourraient dépasser le seuil de toxicité (voir rubrique 5.1).
Excipients
Ce médicament contient du ricinoléate de macrogolglycérol (huile de ricin polyoxyéthylénée) et du butylhydroxytoluène (E 321).
Le ricinoléate de macrogolglycérol peut provoquer de graves réactions allergiques.
Le butylhydroxytoluène (E 321) peut provoquer une irritation des muqueuses.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions 
4.6. Fertilité, grossesse et allaitement 
Grossesse
Aucune étude de toxicité sur la reproduction et le développement n’a été réalisée avec Lidbree. La lidocaïne traverse la barrière placentaire. Il est raisonnable de considérer que la lidocaïne a été utilisée chez un nombre important de femmes enceintes et de femmes en âge de procréer. Aucune donnée n’indique que la lidocaïne induise des troubles du process de reproduction tels qu’une incidence plus élevée de malformations. Le risque pour l’être humain n’a néanmoins pas fait l’objet d’investigations complètes. La toxicité de la lidocaïne sur la reproduction a été évaluée dans des modèles non cliniques qui n’ont indiqué aucun effet délétère pour le fœtus.
La lidocaïne peut être excrétée dans le lait maternel, mais en quantités si faibles qu’elle n’induit généralement aucun risque pour le nouveau-né. L’allaitement peut donc être poursuivi en cas de traitement par Lidbree.
Fertilité
Il n’existe aucune donnée satisfaisant sur les effets de Lidbree sur la fertilité. On ne connait aucun effet de la lidocaïne sur la fertilité ou le développement embryonnaire précoce.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines 
Résumé du profil de sécurité
Le type et la fréquence des effets indésirables signalés au cours des études cliniques ont été similaires chez les femmes traitées par Lidbree et les femmes recevant un gel placebo et ces effets correspondaient aux effets indésirables transitoires qui sont associés à la mise en place de dispositifs intra-utérins contraceptifs. Aucun effet indésirable grave n’a été signalé.
Tableau des effets indésirables
Les effets indésirables sont classés par fréquence et classe de systèmes d’organes. Les catégories de fréquence sont définies selon la convention suivante : Très fréquent (≥ 1/10) ; Fréquent (≥ 1/100, < 1/10) ; Peu fréquent (≥ 1/1 000, < 1/100) ; Rare (≥ 1/10 000, < 1/1 000) ; Très rare (< 1/10 000) ; Fréquence indéterminée (ne peut être estimée sur la base des données disponibles). Les effets indésirables suivants ont été signalés à une fréquence d’au moins 2 % après l’administration de Lidbree.
|
Classe de système d’organe |
Fréquence |
Effets indésirables |
|
Affections du système nerveux |
Fréquent |
Étourdissements, céphalées |
|
Affections gastro-intestinales |
Très fréquent |
Nausées |
|
Fréquent |
Autres troubles gastro-intestinaux |
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : www.signalement-sante.gouv.fr.
En cas d’utilisation selon les recommandations, il est peu probable que l’administration de Lidbree induise des concentrations plasmatiques toxiques de lidocaïne. Néanmoins, si d’autres anesthésiques locaux sont administrés simultanément, les effets sont additifs et cela peut entraîner un surdosage, comme pourrait le faire une injection intravasculaire accidentelle (voir rubrique 4.4), et provoquer la survenue de réactions toxiques systémiques.
Symptômes
Les réactions toxiques systémiques impliquent principalement le système nerveux central (SNC) et le système cardiovasculaire (SCV), et deviennent de plus en plus marquées à mesure que les concentrations plasmatiques augmentent de 5 000 à 10 000 ng/mL. Les signes de toxicité du SNC précèdent généralement les effets toxiques cardiovasculaires.
La toxicité du SNC est une réponse progressive avec des signes et des symptômes de sévérité croissante. Les premiers symptômes sont généralement : paresthésies péribuccales, engourdissement de la langue, sensation ébrieuse, hyperacousie, acouphènes et troubles visuels. La dysarthrie, les spasmes musculaires ou les tremblements sont des symptômes plus graves, qui précèdent l’apparition de convulsions généralisées. Une perte de connaissance et des convulsions de type grand mal peuvent ensuite survenir et durer de quelques secondes à plusieurs minutes. Une hypoxie et une hypercapnie apparaissent rapidement après les convulsions en raison de l’augmentation de l’activité musculaire et elles sont associées à des troubles respiratoires et à une éventuelle perte fonctionnelle respiratoire. Dans les cas sévères, une apnée peut survenir. L’acidose, l’hyperkaliémie, l’hypocalcémie et l’hypoxie augmentent et prolongent les effets toxiques des anesthésiques locaux.
La récupération résulte de la redistribution de l’anesthésique local à partir du système nerveux central suivie de la transformation métabolique et de l’excrétion de la substance.
Une toxicité au niveau du système cardiovasculaire peut s’observer dans les cas sévères et elle est généralement précédée de signes de toxicité au niveau du système nerveux central. Une hypotension, une bradycardie, des arythmies et même un arrêt cardiaque peuvent survenir en raison des concentrations systémiques élevées de l’anesthésique local, mais dans de rares cas, l’arrêt cardiaque survient sans signes prodromiques au niveau du SNC.
Traitement
Les symptômes sévères au niveau du SNC (convulsions, dépression du SNC) doivent être rapidement traités par une assistance respiratoire appropriée et l’administration d’anticonvulsivants.
En cas de dépression cardiovasculaire (hypotension, bradycardie), un traitement approprié par des agents vasopresseurs, chronotropes et/ou inotropes doit être envisagé.
En cas d’arrêt cardiocirculatoire, une réanimation cardiopulmonaire immédiate doit être instaurée. Une oxygénation et une assistance respiratoire et circulatoire optimales ainsi que le traitement de l’acidose sont d’une importance vitale.
5. PROPRIETES PHARMACOLOGIQUES 
5.1. Propriétés pharmacodynamiques 
Classe pharmacothérapeutique : Anesthésiques ; Anesthésiques locaux, Code ATC : N01BB02.
Mécanisme d’action
La lidocaïne est un anesthésique local de type amide. La lidocaïne stabilise la membrane neuronale de manière réversible et empêche l’induction et la conduction des influx nerveux, produisant ainsi une anesthésie locale. À des concentrations plasmatiques élevées, la lidocaïne peut également diminuer la conduction dans les membranes des neurones excitateurs situés dans le cerveau et le muscle cardiaque.
Effets pharmacodynamiques
Lidbree est un anesthésique local se présentant sous la forme d’un liquide visqueux thermogélifiant sans conservateur. La formulation se transforme en gel lorsque la température atteint la température corporelle, ce qui permet son adhérence aux muqueuses du canal cervical et de l’utérus (et minimise ainsi l’écoulement qui pourrait survenir avec une formulation liquide). La formulation thermogélifiante limite sa dilution avec les sécrétions muqueuses et l’anesthésique local agit comme un système tampon.
Après l’application topique de Lidbree sur les muqueuses cervicales, le délai d’apparition de l’effet anesthésique est de 2 minutes. Au cours des procédures intra-utérines, l’anesthésie locale du corps utérin s’obtient en 5 minutes après l’administration dans la cavité utérine. La durée de l’effet est d’au moins 30 minutes, alors qu'aucun effet sur la douleur post-procédurale par rapport au gel placebo ne persiste après 60 minutes.
La visibilité n’est pas altérée pendant l’hystéroscopie.
Efficacité et sécurité clinique
L’efficacité et la sécurité de Lidbree en tant qu’anesthésique topique pour les procédures cervicales et intra-utérines ont été démontrées dans un modèle de douleur : une étude multicentrique contrôlée par placebo a été réalisée chez 218 femmes nullipares demandant la mise en place d’un dispositif intra-utérin (DIU) contraceptif. Ce modèle de douleur est représentatif de la douleur ressentie au cours de procédures intra-utérines telles qu’une hystéroscopie diagnostique et des biopsies cervicales et endométriales, qui impliquent les mêmes stimuli douloureux (saisie du col avec une pince, manipulation cervicale et distension utérine). Au cours de l’étude contrôlée par placebo, le gel a été appliqué sur le col, dans le canal cervical et dans le corps utérin, 5 minutes avant la mise en place du DIU. Le volume total de 8,5 mL n’a pas pu être administré chez 72 femmes sur 218, les femmes nullipares ayant souvent un utérus plus petit. L’intensité maximale de la douleur ressentie pendant et dans les 10 minutes suivant le début de la mise en place du DIU, évaluée au moyen d’une échelle visuelle analogique (EVA) de 100 mm, était significativement plus faible chez les femmes traitées par Lidbree (p < 0,0001), avec une taille d’effet estimée à 16 mm (différence significative), correspondant à une réduction moyenne de 36 % du score de douleur à l’EVA, par rapport aux femmes ayant reçu le gel placebo. La proportion de patientes des groupes Lidbree et placebo présentant un score proche des scores traduisant une absence de douleur (0-10) et la proportion de femmes présentant des scores élevés indicateurs d’une douleur modérée ou sévère (51-100) ont été de respectivement de 31 % contre 9,7 % et de 18 % contre 40 %. La proportion de patientes dont le score de douleur indique une douleur sévère (71-100) a été de 9,4 % contre 19.4 %. Le besoin en analgésiques pendant la première heure suivant la fin du placement du DIU a été de 15,4 % et 30,5 % dans les groupes respectivement Lidbree et placebo. La proportion de patientes des groupes Lidbree et placebo présentant un score proche des scores traduisant une absence de douleur (EVA 0-10) a été respectivement de 34,5 % et 16,1 % (p < 0,01) après 30 minutes et de 38,7 % et 32,4 % après 60 minutes.
Aucun cas de perforation utérine n’a été observé à l’examen échographique. Aucun effet indésirable grave n’est survenu.
Population pédiatrique
Lidbree n’a fait l’objet d’aucune étude chez les patientes pédiatriques de moins de 18 ans. La lidocaïne est connue comme étant un anesthésique local efficace chez les enfants, les adolescents et les adultes. La posologie pour les adolescentes est déterminée sur la base de l’étude d’efficacité réalisée chez les adultes (voir rubrique 4.2). L’administration de Lidbree sur les muqueuses des enfants de moins de 15 ans n’est pas indiquée (voir rubrique 4.2) et peut induire une toxicité systémique de l’anesthésique local chez les sujets ayant un poids corporel inférieur à 30 kg si la dose appliquée de lidocaïne est supérieure à la dose parentérale maximale recommandée (6 mg/kg de poids corporel de chlorhydrate de lidocaïne, correspondant à 5,2 mg/kg de lidocaïne base dans Lidbree, c.-à-d. 1,2 mL de Lidbree pour 10 kg).
5.2. Propriétés pharmacocinétiques 
L’absorption systémique de la lidocaïne à partir de Lidbree dépend de la dose appliquée. Dans les études non cliniques, l’augmentation des concentrations plasmatiques maximales après une administration intra-utérine a été inférieure à une augmentation proportionnelle à la dose.
Les concentrations élevées de lidocaïne peuvent induire une augmentation temporaire du pH dans les sécrétions muqueuses au site d’application, ce qui augmentera le taux d’absorption de l’anesthésique local.
L’absorption de la lidocaïne a été étudiée après une administration cervicale et intra-utérine de 8,5 mL de Lidbree chez quinze femmes âgées de 20 à 36 ans, dont plusieurs étaient aux jours 1 à 6 de leur cycle menstruel avant la mise en place du DIU. Chez toutes les patientes, la lidocaïne a été détectée dans le plasma dans les 5 à 10 minutes suivant l’administration intra-utérine du gel. Les concentrations plasmatiques maximales ont été observées entre 30 et 180 minutes après l’administration, avec un délai d’apparition moyen de 68 minutes. Les concentrations plasmatiques maximales (Cmax) moyennes (ET) ont été de 351 (205) ng/mL, comprises entre 65 et 725 ng/mL. Les symptômes de toxicité de l’anesthésique local deviennent de plus en plus marqués à mesure que les concentrations plasmatiques augmentent de 5 000 à 10 000 ng/mL et la Cmax moyenne observée est inférieure à 10 % de la valeur seuil pour l’apparition des signes initiaux de toxicité au niveau du SNC. Après 3 heures, les concentrations étaient revenues à 30-50 % de leurs valeurs maximales chez la plupart des patientes.
Biotransformation, élimination
La principale voie d’élimination de la lidocaïne est un métabolisme hépatique impliquant les CYP 1A2 et 3A4, conduisant à la formation de monoéthylglycine-xylidide (MEGX) qui présente une activité pharmacologique similaire à celle de la lidocaïne. Le MEGX est ensuite métabolisé par le CYP2A6 et les métabolites ainsi formés sont excrétés par voie rénale. Après une administration IV, la clairance systémique de la lidocaïne est comprise entre 10 et 20 mL/min/kg et sa demi-vie d’élimination est comprise entre 1,5 et 2 heures. Néanmoins, après l’application topique de Lidbree, les taux de transformation métabolique et d’élimination de l’anesthésique local dépendent de son taux d’absorption. Une réduction de la clairance, comme c’est le cas chez les patientes ayant une altération sévère de la fonction hépatique, a donc des effets limités sur les concentrations plasmatiques systémiques après l’administration d’une dose unique.
Populations particulières
Patientes âgées
Après une administration épidurale, la clairance de la lidocaïne diminue d’environ 40 % chez les femmes ayant un âge moyen de 77 ans, par rapport aux femmes ayant un âge moyen de 42 ans, alors qu’aucune différence significative n’est observée au niveau des concentrations plasmatiques de lidocaïne. Étant donné qu’après l’application topique de Lidbree, les taux de transformation métabolique et d’élimination de l’anesthésique local dépendent de son taux d’absorption, une réduction de la clairance a des effets limités sur les concentrations plasmatiques après l’administration d’une dose unique.
Aucune donnée pharmacocinétique n’est disponible concernant l’utilisation intra-utérine et cervicale de la lidocaïne chez les femmes ménopausées. Les données de sécurité n’ont indiqué aucun risque accru après l’administration cervicale et intra-utérine d’une dose unique de lidocaïne chez des femmes ménopausées.
5.3. Données de sécurité préclinique 
Toxicité sur la reproduction
Aucune étude non clinique de la fertilité, du développement embryo-fœtal ou de la toxicité pré- et postnatale n’a été conduite avec Lidbree. Au cours d’études réalisées chez le rat avec la lidocaïne, aucune altération de la fertilité des mâles ou des femelles n’a été observée.
La lidocaïne traverse la barrière placentaire par simple diffusion. Une toxicité embryonnaire ou fœtale a été observée chez le lapin, mais seulement en cas d’administration de doses maternelles toxiques qui étaient supérieures à la dose clinique.
Génotoxicité et carcinogénicité
Aucune étude de génotoxicité ou de carcinogénicité n’a été réalisée avec Lidbree.
Des tests de génotoxicité réalisés avec la lidocaïne n’ont pas mis en évidence de potentiel mutagène. Un métabolite de la lidocaïne, la 2,6 diméthylaniline, a présenté une faible activité lors de certains tests de génotoxicité. Des études toxicologiques précliniques évaluant une exposition chronique ont indiqué que le métabolite 2,6 diméthylaniline avait un potentiel carcinogène. Des évaluations du risque comparant l’exposition maximale calculée chez l’être humain résultant de l’utilisation intermittente de lidocaïne avec l’exposition utilisée au cours des études précliniques indiquent une large marge de sécurité pour l’utilisation clinique. Aucune étude dans le cancer n’a été réalisée avec la lidocaïne, compte tenu de l’étendue et de la durée de l’utilisation thérapeutique de ce médicament.
Ricinoléate de macrogolglycérol (huile de ricin polyoxyéthylénée), poloxamère (contenant du butylhydroxytoluène (E321)), ascorbate de sodium (E301), acide chlorhydrique pour ajustement du pH, hydroxyde de sodium pour ajustement du pH, eau pour préparations injectables.
2 ans
6.4. Précautions particulières de conservation 
Ce médicament ne nécessite pas de précautions particulières de conservation.
6.5. Nature et contenu de l'emballage extérieur 
LIDBREE 42 mg/mL, gel intra-utérin est fourni dans une seringue préremplie stérile de 10 mL (copolymère d’oléfine cyclique), munie d’un bouchon et d’un capuchon en caoutchouc bromobutyle, conditionnée sous plaquette avec le piston. La seringue est graduée en mL. Un applicateur stérile (polypropylène), muni d’un embout Luer-Lock compatible avec la seringue préremplie, est fourni dans une poche séparée à l’intérieur de la boîte. Un volume de 8,5 mL peut être délivré de l’applicateur de la seringue.
Présentation : 1 × 10 mL de gel intra-utérin en seringue préremplie.
6.6. Précautions particulières d’élimination et de manipulation 
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE 
GYÖMRŐI ÚT 19-21
1103 BUDAPEST
HONGRIE
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE 
· 34009 302 121 2 7 : 10 mL en seringue préremplie. Boîte de 1.
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION 
[à compléter ultérieurement par le titulaire]
Date de première autorisation : {JJ mois AAAA}
10. DATE DE MISE A JOUR DU TEXTE 
[à compléter ultérieurement par le titulaire]
{JJ mois AAAA}
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES 
Liste II
|
| Plan du site | Accessibilité | Contact | Téléchargement | Declaration de confidentialité | Service-Public.fr | Legifrance | Gouvernement.fr |