Dernière mise à jour le 08/01/2026
BREAKYL 200 microgrammes, film orodispersible
Indications thérapeutiques
Classe pharmacothérapeutique – code ATC : N02AB03
La substance active contenue dans le film orodispersible de BREAKYL est le fentanyl, un puissant antalgique opioïde. BREAKYL est indiqué pour le traitement des accès douloureux paroxystiques dus à un cancer chez les patients adultes. L’accès douloureux paroxystique est une douleur supplémentaire qui survient brutalement en dépit de la prise de votre antalgique opioïde habituel.
Vous ne devez prendre BREAKYL que si vous prenez déjà régulièrement un traitement de type opioïde (par exemple morphine, oxycodone ou fentanyl transdermique) depuis au moins une semaine pour traiter vos douleurs chroniques d’origine cancéreuse.
Présentations
> 28 sachet(s) polyacrylonitrile aluminium polytéréphtalate (PET) papier avec fermeture de sécurité enfant de 1 film
Code CIP : 218 565-3 ou 34009 218 565 3 8
Déclaration de commercialisation : 11/04/2013
Cette présentation est agréée aux collectivités
- Prix hors honoraire de dispensation : 145,05 €
- Honoraire de dispensation : 1,02 €
- Prix honoraire compris : 146,07 €
- Taux de remboursement :65%
Documents de bon usage du médicament
- Prévenir le risque de surdose d’opioïdes
Auteur : Haute autorité de santé
Type : Fiche Bon Usage du Médicament
Date de mise à jour :Avril 2023
- Les médicaments des accès douloureux paroxystiques du cancer
Auteur : Haute autorité de santé
Type : Fiche Bon Usage du Médicament
Date de mise à jour :Juin 2014
Service médical rendu (SMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprès de la HAS (plus d'informations dans l'aide). Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Important | Avis du 30/05/2018 | Renouvellement d'inscription (CT) | Le service médical rendu par les spécialités BREAKYL reste important dans l’indication de l’AMM. |
Amélioration du service médical rendu (ASMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprés de la HAS (plus d'informations dans l'aide). Les avis et synthéses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur de l'ASMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| V (Inexistant) | Avis du 05/09/2012 | Inscription (CT) | BREAKYL n'apporte pas d'amélioration de service médical rendu (ASMR V) par rapport aux morphiniques transmuqueux d'action rapide indiqués dans la prise en charge des accès douloureux paroxystiques chez les patients adultes utilisant des morphiniques pour traiter des douleurs chroniques d'origine cancéreuse. |
Autres informations
- Titulaire de l'autorisation : VIATRIS MEDICAL
- Conditions de prescription et de délivrance :
- délivrance fractionnée de 7 jours
- prescription en toutes lettres sur ordonnance sécurisée
- prescription limitée à 4 semaines
- stupéfiants
- Statut de l'autorisation : Valide
- Type de procédure : Procédure décentralisée
- Code CIS : 6 130 000 5
ANSM - Mis à jour le : 09/05/2025
BREAKYL 200 microgrammes, film orodispersible
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Un film orodispersible contient :
200 microgrammes de fentanyl (sous forme de citrate)
Excipients à effet notoire :
Propylèneglycol (E1520)...................................................................................................... 0,17 mg
Benzoate de sodium (E211)................................................................................................. 0,11 mg
Parahydroxybenzoate de méthyle (E218).............................................................................. 0,12 mg
Parahydroxybenzoate de propyle (E216)............................................................................... 0,03 mg
Pour la liste complète des excipients, voir rubrique 6.1.
BREAKYL est un film orodispersible soluble, rectangulaire, plat et souple à deux faces, l’une rose et l’autre blanche, conçu pour permettre un passage direct de fentanyl dans la circulation sanguine. La face rose contient la substance active (fentanyl). La face blanche permet de minimiser la libération du fentanyl dans la salive afin d’éviter la déglutition de la substance active.
Les schémas suivants montrent les tailles des dosages disponibles de BREAKYL :
|
0,78 cm² 1,56 cm² 2,34 cm² 3,11 cm² 4,67 cm² |
Chaque film orodispersible est scellé individuellement dans un sachet avec sécurité enfant.
4.1. Indications thérapeutiques
Un accès douloureux paroxystique est une exacerbation passagère d’une douleur chronique par ailleurs contrôlée par un traitement de fond.
Les patients sous traitement de fond opioïde sont ceux prenant au moins 60 mg de morphine orale par jour, au moins 25 microgrammes de fentanyl transdermique par heure, au moins 30 mg d’oxycodone par jour, au moins 8 mg d’hydromorphone par voie orale par jour ou une dose équi-analgésique d’un autre opioïde pendant une durée d’au moins une semaine.
4.2. Posologie et mode d'administration
La dose efficace de BREAKYL pour le traitement d’accès douloureux paroxystiques d’origine cancéreuse doit être déterminée par titration de dose, car elle ne peut pas être prédite à partir de la dose quotidienne du traitement de fond opioïde ou d’un autre médicament destiné au traitement de ces accès.
Titration de la dose
Les douleurs chroniques des patients doivent être contrôlées par un traitement de fond opioïde avant le début de la phase de titration avec BREAKYL. Chez les patients présentant plus de quatre épisodes d’accès douloureux paroxystiques par jour, l’augmentation de la dose du traitement de fond opioïde doit être envisagée avant de commencer la titration de BREAKYL.
Titration chez des patients passant d’un autre médicament contenant du fentanyl à BREAKYL
Compte tenu du fait que ces produits possèdent des profils d’absorption différents, la substitution ne doit pas se faire selon un rapport de 1 :1. Chez les patients passant d’une autre forme orale de citrate de fentanyl à BREAKYL, la titration de la dose de BREAKYL doit être réalisée indépendamment étant donné que la biodisponibilité entre les produits diffère significativement (voir le graphique à la rubrique 5.2).
Dose initiale :
La dose initiale de BREAKYL doit être de 200 microgrammes, avec augmentation progressive de la posologie si nécessaire conformément à la gamme de dosages disponibles (200, 400, 600, 800 et 1200 microgrammes). Le processus de titration doit être attentivement surveillé jusqu’à l’obtention d’une dose produisant l’effet analgésique adéquat avec des effets indésirables acceptables après la prise d’une seule dose par accès douloureux paroxystique. Cette dose est alors définie comme la dose efficace. Les prises de BREAKYL doivent être espacées d'au moins quatre heures.
Avec BREAKYL 200 microgrammes, des doses plus élevées peuvent être obtenues en appliquant simultanément plusieurs unités de BREAKYL 200 microgrammes, film orodispersible :
· 1 film orodispersible de BREAKYL 200 est égal à une dose de 200 microgrammes
· 2 films orodispersibles de BREAKYL 200 sont égaux à une dose de 400 microgrammes
· 3 films orodispersibles de BREAKYL 200 sont égaux à une dose de 600 microgrammes
· 4 films orodispersibles de BREAKYL 200 sont égaux à une dose de 800 microgrammes
Si l'application simultanée de 4 films orodispersibles de BREAKYL 200 microgrammes (soit 800 microgrammes) ne soulage pas suffisamment les douleurs, BREAKYL 1200 microgrammes peut être indiqué. Il s’agit du dosage le plus élevé disponible de BREAKYL.
Si le soulagement des douleurs est adéquat après la prise d'un dosage particulier, les accès douloureux paroxystiques suivants doivent être traités en utilisant la dose de BREAKYL qui a été identifiée.
Si le soulagement des douleurs n’est pas adéquat dans les 30 minutes suivant l’application d'une dose particulière de BREAKYL, et si cette dose a bien tolérée par le patient, il devra prendre la dose supérieure suivante de BREAKYL afin de traiter le prochain accès douloureux paroxystique.
Si le soulagement des douleurs n’est pas adéquat dans les 30 minutes suivant l’application de BREAKYL 1 200 microgrammes film orodispersible (dosage le plus élevé disponible), le patient devra discuter des autres options thérapeutiques avec son médecin. L’utilisation d’une combinaison de plusieurs films orodispersibles à dose faible pour atteindre la dose supérieure suivante est possible au cours de la phase de titration. L’utilisation d’une dose combinée totale excédant 1200 microgrammes n’a pas été évaluée dans des conditions contrôlées.
Au cours d’une période d’accès douloureux paroxystiques, si un soulagement adéquat n’est pas obtenu dans les 30 minutes suivant l’application d’un film orodispersible de BREAKYL, le patient pourra utiliser des médicaments de secours pour les accès douloureux paroxystiques, s’ils ont été prescrits par son médecin. Le patient ne devra cependant pas prendre les médicaments opioïdes de secours lorsque des effets indésirables non acceptables de BREAKYL ou des signes de toxicité des opioïdes ont été notés.
|
||||||||||||||||||||||||||||||||||||
Quand la dose efficace est déterminée, l’utilisation de BREAKYL doit être limitée à quatre périodes d’accès douloureux paroxystiques ou moins par jour, et les doses doivent être séparées d’au moins quatre heures. BREAKYL ne doit être utilisé qu’une seule fois par épisode.
Ajustement de la dose
L’ajustement de la dose de BREAKYL ou de celle du traitement de fond de l'analgésique opioïde (sur 24 heures) peut être nécessaire chez certains patients afin de continuer à procurer un soulagement adéquat des accès douloureux paroxystiques. Une augmentation de la dose de l’opioïde administré sur 24 heures pour le traitement des douleurs persistantes doit être envisagée chez les patients ayant quotidiennement plus de quatre périodes d’accès douloureux paroxystiques sur une période de plus de quatre jours consécutifs. En cas d’augmentation de la dose d’opioïde d’action prolongée, il peut être nécessaire de réévaluer la dose de BREAKYL utilisée pour traiter les accès douloureux paroxystiques.
Toute nouvelle titration de la dose d’un analgésique doit être impérativement suivie par un médecin.
Durée et objectifs du traitement
Avant l’instauration du traitement par BREAKYL, une stratégie thérapeutique comprenant la durée et les objectifs du traitement, doivent être convenus avec le patient, conformément aux lignes directrices relatives à la prise en charge de la douleur. Pendant le traitement, des contacts fréquents doivent avoir lieu entre le médecin et le patient afin d’évaluer la nécessité de poursuivre le traitement, d’envisager l’arrêt du traitement et d’ajuster les doses si nécessaire. En l’absence d’un contrôle adéquat de la douleur, la possibilité d’hyperalgésie, de tolérance et de progression de la maladie sous-jacente doit être envisagée (voir rubrique 4.4). BREAKYL ne doit pas être utilisé plus longtemps que nécessaire.
Arrêt du traitement
Le traitement par BREAKYL doit être immédiatement arrêté si le patient ne présente plus d’accès douloureux paroxystiques. Le traitement de la douleur chronique de fond doit être maintenu comme prescrit.
Si l’arrêt de tous les traitements opioïdes est nécessaire, le patient doit être étroitement surveillé par le médecin afin de gérer le risque d’apparition de symptômes liés à un sevrage brutal.
Mode d’administration
Le patient doit :
· ouvrir le sachet de BREAKYL immédiatement avant emploi selon les instructions indiquées sur le sachet ;
· utiliser sa langue pour humidifier l’intérieur de sa joue ou se rincer la bouche à l'eau afin d'humecter la zone d'application de BREAKYL ;
· avec les mains sèches, prendre le film orodispersible de BREAKYL entre l’index et le pouce avec la face rose du côté du pouce ;
· placer le film orodispersible de BREAKYL dans la bouche, de telle façon que la face rose soit en contact uniforme avec la muqueuse interne de sa joue ;
· appuyer et le maintenir en place pendant au moins 5 secondes jusqu’à ce qu’il adhère fermement ; la face blanche doit être ensuite visible.
Le film orodispersible de BREAKYL doit rester en place de lui-même après cette période. Le patient peut boire au bout de 5 minutes.
La dissolution d’un film orodispersible de BREAKYL est habituellement complète dans les 15 à 30 minutes suivant l’application. Dans certains cas, la dissolution complète du produit peut prendre plus de 30 minutes, mais cela n’affecte pas l’absorption du fentanyl. Il faudra demander au patient d’éviter de toucher le film orodispersible avec sa langue ou ses doigts et d’éviter de manger jusqu’à ce que le film orodispersible soit dissout.
Si un film orodispersible de BREAKYL est mâché et dégluti, les concentrations maximales et la biodisponibilité pourraient être inférieures à celles obtenues lors d’une utilisation conforme aux instructions (voir rubrique 5.2).
Quand le patient applique plus d’un film orodispersible de BREAKYL en même temps, il doit s’assurer que chacun des films adhère directement à sa muqueuse buccale. Afin d’éviter que les films orodispersibles ne se chevauchent, il est possible de les appliquer à la fois sur les muqueuses droite et gauche des joues.
Population pédiatrique
La sécurité et l’efficacité de BREAKYL chez les enfants âgés de 0 à 18 ans n’ont pas été établies. Aucune donnée n’est disponible.
Utilisation chez le sujet âgé
Les patients âgés sont plus sensibles aux effets du fentanyl par voie intraveineuse que des sujets plus jeunes. Chez le sujet âgé, le fentanyl est plus lentement éliminé et sa demi-vie terminale d’élimination est plus longue, ce qui peut entraîner une accumulation de la substance active et accroître le risque d'effets indésirables. La titration de la dose doit donc être effectuée de façon particulièrement prudente. Les études cliniques n’ont cependant pas montré de différence de la dose moyenne de BREAKYL obtenue après titration entre des patients âgés de ≥ 65 ans et des patients de moins de 65 ans.
Populations particulières
La titration doit être effectuée avec prudence chez les patients présentant des troubles de la fonction rénale ou hépatique.
Les patients présentant une mucite de grade 1 doivent être étroitement surveillés ; une adaptation de la dose peut être envisagée. L’efficacité et la sécurité de BREAKYL n’ont pas été étudiées chez des patients présentant une mucite de sévérité supérieure au grade 1.
Le film orodispersible ne doit pas être utilisé si le sachet a été endommagé avant son ouverture.
· Hypersensibilité au fentanyl ou à l’un des excipients mentionnés à la rubrique 6.1.
· Administration conjointe d’un inhibiteur de la monoamine oxydase (IMAO), ou dans les deux semaines suivant l’arrêt d’utilisation d’un IMAO (voir également rubrique 4.5).
· Patients traités par un traitement contenant de l’oxybate de sodium.
· Dépression respiratoire sévère ou obstruction sévère des voies aériennes.
· Patients non traités par un traitement de fond opioïde (voir rubrique 4.1) en raison d’un risque accru de dépression respiratoire.
· Traitement de la douleur aiguë autre que les accès douloureux paroxystiques.
4.4. Mises en garde spéciales et précautions d'emploi
En raison des risques, associés à l’exposition accidentelle, au mésusage et à l’abus, pouvant avoir une issue fatale, les patients et leurs aidants doivent être informés qu’ils doivent conserver BREAKYL dans un endroit sûr et sécurisé, inaccessible à d’autres personnes.
Il est impératif d’informer les patients et leurs soignants que BREAKYL contient une substance active à une dose qui peut être mortelle pour un enfant et qu’ils doivent par conséquent toujours tenir BREAKYL hors de la vue et de la portée des enfants et des personnes non concernées par le traitement.
Afin de réduire au minimum les risques d’effets indésirables liés aux opioïdes et de déterminer la dose efficace, il est indispensable que les patients soient étroitement surveillés par un médecin durant la phase de titration.
Il est important de s’assurer que le traitement de fond opioïde utilisé pour traiter les douleurs chroniques du patient a été stabilisé avant d’amorcer un traitement par BREAKYL.
Dépression respiratoire
L’utilisation du fentanyl est associée à un risque de dépression respiratoire cliniquement significative. La prudence est de rigueur lors de la titration de BREAKYL chez des patients présentant une bronchopneumopathie chronique obstructive non sévère ou toute autre pathologie les prédisposant à une dépression respiratoire, car même administré aux doses thérapeutiques normales, BREAKYL peut aggraver les troubles respiratoires jusqu'à entraîner une insuffisance respiratoire.
Troubles respiratoires liés au sommeil
Les opioïdes peuvent provoquer des troubles respiratoires liés au sommeil, notamment une apnée centrale du sommeil (ACS) et une hypoxémie liée au sommeil. L’utilisation d’opioïdes majore le risque d’ACS de façon dose-dépendante. Chez les patients souffrant d’ACS, une réduction de la dose totale d’opioïdes doit être envisagée.
Augmentation de la pression intracrânienne
BREAKYL ne doit être administré qu’avec une extrême prudence chez les patients qui pourraient être particulièrement sensibles aux effets cérébraux de l'hypercapnie, par exemple chez les patients présentant des signes d'hypertension intracrânienne ou des troubles de la conscience. Les opioïdes pouvant masquer l’évolution clinique en cas de traumatisme crânien, ils ne doivent être utilisés dans ce cadre qu'en cas de nécessité clinique.
Pathologie cardiaque
Le fentanyl peut provoquer une bradycardie. Il doit être utilisé avec prudence chez les patients présentant des antécédents de bradyarythmie ou une bradyarythmie préexistante.
Le traitement par BREAKYL doit être envisagé avec prudence en cas d’hypovolémie ou d’hypotension.
Insuffisance hépatique ou rénale
En outre, BREAKYL doit être administré avec prudence chez les patients présentant une insuffisance hépatique ou rénale. L'influence d'une insuffisance hépatique ou rénale sur la pharmacocinétique du fentanyl n’a pas été étudiée. Cependant, lors de l’administration intraveineuse, la clairance du fentanyl est modifiée par l’insuffisance hépatique ou rénale en raison d'une altération de la clairance métabolique et de la liaison aux protéines plasmatiques.
Après administration de BREAKYL, l’insuffisance hépatique ou rénale peut d’une part augmenter la biodisponibilité du fentanyl et d’autre part diminuer sa clairance systémique, ce qui pourrait entraîner des effets opioïde accrus et prolongés. Une prudence particulière est donc de rigueur lors de la phase de titration chez les patients présentant une insuffisance hépatique ou rénale modérée à sévère.
Syndrome sérotoninergique
Il est conseillé de faire preuve de prudence lorsque BREAKYL est administré en association avec des médicaments qui affectent les systèmes de neurotransmission sérotoninergique.
Un syndrome sérotoninergique, susceptible de mettre en jeu le pronostic vital, peut se développer lors de l’utilisation concomitante de médicaments sérotoninergiques tels que des inhibiteurs sélectifs de la recapture de la sérotonine (ISRS) et des inhibiteurs de la recapture de la sérotonine et de la noradrénaline (IRSN), ainsi qu’avec des médicaments qui altèrent le métabolisme de la sérotonine (y compris les inhibiteurs de la monoamine oxydase [IMAO]). Cela peut se produire aux doses recommandées.
Le syndrome sérotoninergique peut s’accompagner d’altérations de l’état mental (par exemple agitation, hallucinations, coma), d’une instabilité du système nerveux autonome (par exemple tachycardie, pression artérielle labile, hyperthermie), de troubles neuromusculaires (par exemple hyperréflexie, incoordination, rigidité) et/ou de symptômes gastro-intestinaux (par exemple nausées, vomissements, diarrhée).
En cas de suspicion de syndrome sérotoninergique, il convient d’arrêter le traitement par BREAKYL.
Risque lié à l’utilisation concomitante de médicaments sédatifs tels que les benzodiazépines ou autres médicaments apparentés
L’utilisation concomitante de BREAKYL et de sédatifs tels que les benzodiazépines ou autres médicaments apparentés peut entraîner une sédation, une détresse respiratoire, un coma et la mort. En raison de ces risques, la prescription concomitante avec ces médicaments sédatifs doit être réservée aux patients pour lesquels d’autres options thérapeutiques ne sont pas possibles. Si la décision de prescrire BREAKYL en même temps que des médicaments sédatifs est prise, la dose efficace la plus faible doit être utilisée et la durée de traitement doit être aussi courte que possible.
Les patients doivent être suivis de près pour surveiller la survenue de signes et symptômes de dépression respiratoire et de sédation.
À cet égard, il est fortement recommandé d'informer les patients et leurs soignants afin qu’ils connaissent ces symptômes (voir rubrique 4.5).
Tolérance et troubles liés à l’usage d’opioïdes (abus et dépendance)
Une accoutumance et une dépendance physique et/ou psychologique sont susceptibles d’apparaître lors de l’administration répétée d’opioïdes tels que le fentanyl..
L’utilisation répétée de BREAKYL peut induire un trouble lié à l’usage d’opioïdes (TUO). Une dose plus élevée et une durée plus longue du traitement par opioïdes peuvent augmenter le risque de développer un TUO. L’abus ou le mésusage intentionnel de BREAKYL peut entrainer un surdosage et/ou le décès du patient. Le risque de développer un TUO est accru chez les patients ayant des antécédents personnels ou familiaux (parents ou frères et sœurs) de troubles liés à la consommation de substances (y compris ceux liés à la consommation abusive d’alcool), chez les fumeurs actifs ou chez les patients ayant des antécédents personnels de troubles de la santé mentale (par ex. dépression majeure, anxiété et troubles de la personnalité).
Avant l’instauration du traitement par BREAKYL et pendant le traitement, les objectifs du traitement et un plan d’arrêt doivent être convenus en accord avec le patient (voir rubrique 4.2). Avant et pendant le traitement, le patient doit également être informé des risques et des signes de TUO. En cas d’apparition de ces signes, les patients doivent être invités à contacter leur médecin.
Les patients devront être surveillés pour détecter tout signe d’abus ou d’addiction (par exemple une demande de renouvellement prématurée). Cela inclut la revue de la prise concomitante d’opioïdes et de psychotropes (comme les benzodiazépines). Pour les patients présentant des signes et des symptômes de TUO, il convient d’envisager une consultation chez un spécialiste en toxicomanie.
Hyperalgésie
Comme avec les autres opioïdes, en cas de contrôle insuffisant de la douleur en réponse à une dose plus élevée de fentanyl, la possibilité d’hyperalgésie induite par les opioïdes doit être envisagée. Une réduction de la dose de fentanyl, l’arrêt du traitement par le fentanyl ou une réévaluation du traitement peuvent être indiqués.
Les athlètes doivent être informés que le traitement par le fentanyl peut induire des résultats positifs lors des contrôles antidopage.
BREAKYL contient du benzoate de sodium, du parahydroxybenzoate de méthyle, du parahydroxybenzoate de propyle et du propylèneglycol. Le benzoate de sodium est légèrement irritant pour la peau, les yeux et les muqueuses. Le parahydroxybenzoate de méthyle et le parahydroxybenzoate de propyle peuvent provoquer des réactions allergiques (pouvant être retardées). Le propylèneglycol peut provoquer une irritation cutanée.
Les patients présentant une mucite de grade 1 doivent être étroitement surveillés, une adaptation de la dose peut être envisagée. L’efficacité et la sécurité de BREAKYL n’ont pas été étudiées chez les patients présentant une mucite de sévérité supérieure au grade 1 (voir également rubriques 4.2 et 5.2).
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Compte tenu qu’une potentialisation sévère et imprévisible des effets opioïdes a été rapportée lors de l’administration concomitante d’inhibiteurs de la monoamine oxydase (IMAO) et d’analgésiques opioïdes, BREAKYL ne doit pas être administré aux patients recevant ou ayant reçu des inhibiteurs de la monoamine oxydase (IMAO) dans les 14 jours précédant la prise de BREAKYL (voir rubrique 4.3).
L’administration concomitante de traitements contenant de l’oxybate de sodium et du fentanyl est contre-indiquée (voir rubrique 4.3). Le traitement contenant de l’oxybate de sodium doit être interrompu avant le début du traitement par BREAKYL.
Médicaments sérotoninergiques
L’administration concomitante de fentanyl et d’un agent sérotoninergique, tel qu’un inhibiteur sélectif de la recapture de la sérotonine (ISRS), un inhibiteur de la recapture de la sérotonine et de la noradrénaline (IRSN) ou un inhibiteur de la monoamine oxydase (IMAO) (voir rubrique 4.3), peut augmenter le risque de syndrome sérotoninergique, une pathologie pouvant mettre en jeu le pronostic vital.
Le fentanyl est métabolisé par l’isoenzyme CYP3A4 dans le foie et la muqueuse intestinale (voir également rubrique 5.2).
Les inhibiteurs de l’isoenzyme CYP3A4 tels que :
· antibiotiques macrolides (par exemple érythromycine, clarithromycine, télithromycine),
· antifongiques azolés (par exemple kétoconazole, itraconazole et fluconazole),
· certaines antiprotéases (par exemple ritonavir, indinavir, nelfinavir, saquinavir),
· antagonistes calciques (par exemple diltiazem ou vérapamil),
· antiémétiques (par exemple aprepitant ou dronabinol),
· antidépresseurs (par exemple fluoxétine),
· antiacides (par exemple cimétidine),
peuvent augmenter la biodisponibilité du fentanyl dégluti et également diminuer sa clairance systémique, ce qui peut augmenter ou prolonger les effets opioïdes et induire une dépression respiratoire potentiellement fatale. Des effets similaires pourraient être observés après prise concomitante de jus de pamplemousse, inhibiteur connu du CYP3A4. La prudence est donc de rigueur quand le fentanyl est administré de façon concomitante avec les inhibiteurs du CYP 3A4. Les patients recevant BREAKYL et débutant un traitement par un inhibiteur du CYP3A4 ou chez qui la dose d’inhibiteur du CYP3A4 est augmentée doivent faire l’objet d’une surveillance étroite en vue de suivre l’apparition de signes de toxicité des opioïdes pendant une période prolongée.
L’administration concomitante de BREAKYL et d’inducteurs puissants du CYP3A4 tels que :
· barbituriques et autres sédatifs (par exemple phénobarbital),
· antiépileptiques (par exemple carbamazépine, phénytoïne, oxcarbazépine),
· certains antiviraux (par exemple éfavirenz, névirapine),
· anti-inflammatoires ou immunosuppresseurs (par exemple glucocorticoïdes),
· antidiabétiques (par exemple pioglitazone),
· antibiotiques antituberculeux (par exemple rifabutine, rifampicine),
· psychotropes (par exemple modafinil),
· antidépresseurs (par exemple millepertuis),
peut entraîner une diminution des concentrations plasmatiques du fentanyl, ce qui pourrait diminuer l'efficacité de BREAKYL. Les patients recevant BREAKYL chez qui un traitement par un inducteur de la CYP3A4 est arrêté ou poursuivi à plus basse posologie doivent être suivis à la recherche d'une augmentation de l’activité ou d’une toxicité de BREAKYL, dont la dose doit alors être adaptée en conséquence.
Médicaments sédatifs tels que les benzodiazépines ou les médicaments apparentés :
L’utilisation concomitante d’opioïdes avec des médicaments sédatifs tels que les benzodiazépines ou les médicaments apparentés augmente le risque de sédation, de dépression respiratoire, de coma et de décès en raison d’un effet dépresseur additif sur le système nerveux central. La dose et la durée de l’utilisation concomitante doivent être limitées (voir rubrique 4.4).
L’administration concomitante de BREAKYL et d’autres dépresseurs du SNC (incluant autres opioïdes sédatifs ou hypnotiques, anesthésiques généraux, phénothiazines, tranquillisants, myorelaxants, antihistaminiques sédatifs ou alcool) peut potentialiser les effets dépresseurs de chaque produit.
L’utilisation concomitante d’antalgiques morphiniques agonistes/antagonistes partiels (exemples : buprénorphine, nalbuphine, pentazocine) n’est pas recommandée. En effet, ils possèdent une forte affinité pour les récepteurs opioïdes avec une activité intrinsèque relativement faible et donc antagonisent partiellement l’effet analgésique du fentanyl pouvant ainsi induire un syndrome de sevrage chez les patients dépendants aux opioïdes.
4.6. Fertilité, grossesse et allaitement
Grossesse
Il n’existe pas de données suffisamment pertinentes concernant l'utilisation de fentanyl chez la femme enceinte. Les études effectuées chez l’animal ont mis en évidence une toxicité sur la reproduction (voir rubrique 5.3). Le risque potentiel chez l’homme n'est pas connu. Le fentanyl ne doit pas être utilisé pendant la grossesse à moins d'une nécessité absolue.
Un traitement prolongé au cours de la grossesse est associé à un risque de symptômes de sevrage chez le nouveau-né.
Il est recommandé de ne pas utiliser le fentanyl pendant le travail et l'accouchement (y compris en cas de césarienne), car le fentanyl franchit la barrière placentaire et peut entraîner une dépression respiratoire chez le fœtus. En cas d’administration de BREAKYL, un antidote pour l’enfant doit être immédiatement disponible.
Allaitement
Le fentanyl est excrété dans le lait maternel et peut entraîner une sédation et une dépression respiratoire chez le nourrisson. Le fentanyl ne doit pas être utilisé pendant l'allaitement et celui-ci ne doit pas reprendre moins de 5 jours après la dernière administration du fentanyl.
Fertilité
Aucune donnée concernant la fertilité chez l’être humain n’est disponible. Dans les études chez l’animal, la fertilité des mâles et des femelles était altérée aux doses sédatives (voir rubrique 5.3)
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Les effets sur l’aptitude à conduire des véhicules et à utiliser des machines n’ont pas été étudiés.
Toutefois les analgésiques opioïdes sont susceptibles d’altérer les capacités mentales et/ou physiques nécessaires à la réalisation de tâches potentiellement dangereuses (come la conduite d’un véhicule ou l’utilisation de machines). Il est recommandé aux patients de ne pas conduire un véhicule ou utiliser de machines s’ils éprouvent de la somnolence, des étourdissements ou une vision trouble ou double pendant le traitement par BREAKYL.
Résumé du profil de sécurité
Les effets indésirables attendus avec BREAKYL sont les effets indésirables typiques des opioïdes. Le plus souvent, ces effets cesseront ou diminueront d’intensité avec la poursuite du traitement une fois la titration effectuée de façon à définir la dose appropriée. Cependant, les effets indésirables les plus graves associés à tous les opioïdes, dont BREAKYL, sont la dépression respiratoire (pouvant entraîner un arrêt respiratoire), la dépression circulatoire, l’hypotension et l’état de choc ; l’apparition éventuelle de ces effets indésirables doit être étroitement surveillée chez tous les patients.
Les études cliniques menées avec BREAKYL ayant pour but d’évaluer l’efficacité et la sécurité de ce médicament dans le traitement des accès douloureux paroxystiques d’origine cancéreuse, les patients inclus recevaient en même temps d’autres opioïdes (morphine à libération prolongée, oxycodone à libération prolongée ou fentanyl par voie transdermique) pour traiter leurs douleurs chroniques. Par conséquent, il n’est pas possible d’isoler avec certitude les effets indésirables dus au seul traitement par BREAKYL.
Les données sur les effets indésirables présentées ici ont été observées d’une part lors de l'expérience acquise avec BREAKYL dans le traitement des accès douloureux paroxystiques, avec administration conjointe d’un opioïde pour le traitement des douleurs chroniques. D’autre part, les événements indésirables mentionnés comme très rares ont été précédemment associés au fentanyl, mais n’ont pas été observés à ce jour lors des études cliniques avec BREAKYL. Aucune tentative de correction en fonction de l'administration conjointe d’un autre opioïde, de la durée du traitement par BREAKYL ou des troubles liés au cancer n’a été effectuée.
Les effets indésirables les plus fréquemment observés ont été les nausées, la somnolence et des vertiges.
Liste tabulée des effets indésirables
La fréquence des effets indésirables est évaluée de la façon suivante : très fréquent (≥ 1/10), fréquent (≥1/100 à < 1/10), peu fréquent (≥ 1/1000 à < 1/100), rare (≥ 1/10 000 à < 1/1 000), très rare (< 1/10 000), inconnue (ne peut être estimée sur la base des données disponibles).
Les événements indésirables considérés comme liés de façon au moins possible au traitement ont été les suivants :
|
Classes de systèmes d’organes |
Fréquent |
Peu fréquent |
Très rare, ou fréquence indéterminée# |
|
Troubles du métabolisme et de la nutrition |
|
Anorexie |
|
|
Affections psychiatriques |
Syndrome confusionnel |
Anxiété, hallucinations, délires, rêves inhabituels, nervosité, insomnie, agitation |
Troubles de la pensée, dépersonnalisation, dépression, labilité émotionnelle, euphorie, pharmacodépendance (addiction), utilisation abusive, délire |
|
Affections du système nerveux |
Somnolence, vertiges, céphalées, sédation |
Dysgueusie, léthargie, amnésie, troubles cognitifs |
Myoclonies, paresthésies (dont hyperesthésies/paresthésies péribuccales), anomalie de la démarche/incoordination, convulsion |
|
Affections oculaires |
Vision anormale (vision floue, diplopie) |
|
|
|
Affections vasculaires |
|
Bouffée de chaleur, rougeur |
Vasodilatation |
|
Affections respiratoires, thoraciques et médiastinales |
|
Dépression respiratoire, congestion sinusale |
Dyspnée |
|
Affections gastro-intestinales |
Nausée, constipation, vomissements, sécheresse buccale |
Diarrhée, stomatite, gingivorragie, dyspepsie, ulcération buccale, douleur buccale, dysphagie |
Douleurs abdominales, flatulences, augmentation du volume de l’abdomen |
|
Affections de la peau et du tissu sous-cutané |
Prurit |
Hyperhidrose, augmentation d’une tendance aux ecchymoses |
Eruption |
|
Affections musculo-squelettiques et systémiques |
|
Contractions musculaires, arthralgie, faiblesse musculaire, douleurs musculo-squelettiques, douleurs des membres, douleurs maxillaires |
|
|
Affections du rein et des voies urinaires |
|
Incontinence urinaire |
Rétention urinaire |
|
Affections gravidiques, puerpérales et périnatales |
|
|
Syndrome de sevrage néonatal |
|
Troubles généraux et anomalies au site d’administration |
Fatigue |
Asthénie, frissons, pyrexie, soif |
Malaise, œdème périphérique, syndrome de sevrage*, tolérance au médicament |
|
Investigations |
|
Augmentation de la pression artérielle |
|
|
Lésions, intoxications et complications liées aux procédures |
|
Blessure accidentelle (par exemple chutes) |
|
# fréquence indéterminée : uniquement pour le syndrome de sevrage*, tolérance au médicament
* des symptômes de sevrage des opioïdes tels que nausées, vomissements, diarrhée, anxiété, frissons, tremblements, et sudation ont été observés avec le fentanyl administré par voie transmuqueuse.
Description de certains effets indésirables
Tolérance
La tolérance peut se développer lors d’une utilisation répétée.
Pharmacodépendance
L’utilisation répétée de BREAKYL peut entraîner une dépendance aux médicaments (pharmacodépendance), même à des doses thérapeutiques. Le risque de pharmacodépendance peut varier selon les facteurs de risque propres au patient, de la posologie et de la durée du traitement par opioïdes (voir rubrique 4.4).
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr.
Les symptômes attendus en cas de surdosage en BREAKYL ou les signes de toxicité sont de même nature que ceux observés après l'administration intraveineuse de fentanyl ou d'autres opioïdes, et résultent de son action pharmacologique. L'effet indésirable le plus grave est la dépression respiratoire. D’autres symptômes d’un surdosage peuvent être une sédation profonde, un coma, une bradycardie, une hypotonie, une hypothermie, une diminution du tonus musculaire, une ataxie, des convulsions et un myosis. Une leucoencéphalopathie toxique a également été observée lors d’un surdosage en fentanyl.
Des cas de respiration de Cheynes-Stokes ont été constatés en cas de surdosage en fentanyl, en particulier chez les patients ayant des antécédents d’insuffisance cardiaque.
Traitement
Pour le traitement de la dépression respiratoire, des mesures doivent être prises immédiatement. Ces mesures consistent à retirer tout film orodispersible de BREAKYL de la bouche du patient s’il s'y trouve encore, effectuer des stimulations physiques et verbales du patient et déterminer son niveau de conscience ainsi que son état ventilatoire et circulatoire. Si la situation clinique l’exige, les voies respiratoires doivent être dégagées (éventuellement par intubation oropharyngée ou endotrachéale), de l’oxygène doit être administré et la respiration doit être assistée ou contrôlée, selon les besoins.
Mettre en place une voie d'abord veineuse. Selon l'état clinique, il est possible d’administrer de la naloxone ou un autre antagoniste des opioïdes. La durée de la dépression respiratoire due au surdosage peut être plus longue que les effets de l'antagoniste opioïde (par exemple, la demi-vie de la naloxone est comprise entre 30 et 81 minutes) et il peut donc être nécessaire de répéter l'administration ou d’administrer une perfusion continue de naloxone ou d’un autre antagoniste opioïde si nécessaire. L’inversion de l’effet narcotique peut entraîner une manifestation aiguë de la douleur et la libération de catécholamines. Chez des patients recevant un traitement opioïde de fond, l’utilisation de naloxone ou d’un autre antagoniste opioïde est associée avec le risque de survenue d’un syndrome de sevrage aigu.
Il conviendra également de maintenir une température corporelle et un apport de liquides adéquats. En cas d’hypotension sévère ou persistante, une hypovolémie doit être envisagée et prise en charge par un traitement approprié par administration de liquides par voie parentérale. Si une rigidité musculaire apparaît, il faudra aussi administrer, en dernier recours, un curarisant.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Le fentanyl, agoniste morphinomimétique pur, agit essentiellement sur les récepteurs opioïdes μ du cerveau, de la moelle épinière et des muscles lisses. L’effet thérapeutique s’exerce essentiellement au niveau du système nerveux central (SNC). L’analgésie représente l’effet pharmacologique clinique le plus utile résultant de l’interaction du fentanyl avec les récepteurs μ.
Chez des patients atteints de cancer dont les douleurs chroniques étaient contrôlées par des administrations régulières de doses stables d’opioïdes, BREAKYL a significativement diminué l’intensité des douleurs (évaluée par la somme des différences de l’intensité des douleurs) comparativement à un placebo pendant 15, 30, 45 et 60 minutes après l’administration du traitement.
Les effets analgésiques du fentanyl sont corrélés à sa concentration sanguine, en tenant compte du délai de la pénétration dans le SNC et de la sortie de celui-ci (phénomène dont la demi-vie est de 3 à 5 minutes).
Chez les sujets n’ayant jamais reçu un traitement opioïde, l’analgésie apparaît à une concentration sanguine de 1 à 2 ng/ml, alors que l’anesthésie chirurgicale et une profonde dépression respiratoire se produiraient à des concentrations de 10 à 20 ng/ml.
Les actions secondaires des opioïdes sont le myosis et l’augmentation du tonus des muscles lisses gastro-intestinaux et une diminution de leurs contractions, ce qui prolonge la durée du transit intestinal et peut être responsable de la constipation liée aux opioïdes.
Les opioïdes augmentent généralement le tonus des muscles lisses des voies urinaires, mais l’effet global est variable, induisant dans certains cas une miction impérieuse et dans d’autres une dysurie.
Tous les agonistes des récepteurs opioïdes μ, y compris le fentanyl, induisent une dépression respiratoire dose-dépendante. Le risque de dépression respiratoire est moindre chez les patients qui reçoivent un traitement opioïde de fond, car ces patients développent une tolérance à la dépression respiratoire et aux autres effets opioïdes.
5.2. Propriétés pharmacocinétiques
Le fentanyl est une substance très lipophile et peut être absorbé très rapidement par la muqueuse buccale et plus lentement par la voie gastro-intestinale conventionnelle. Il subit un métabolisme par effet de premier passage hépatique et intestinal, mais ses métabolites ne contribuent pas à ses effets thérapeutiques.
Absorption
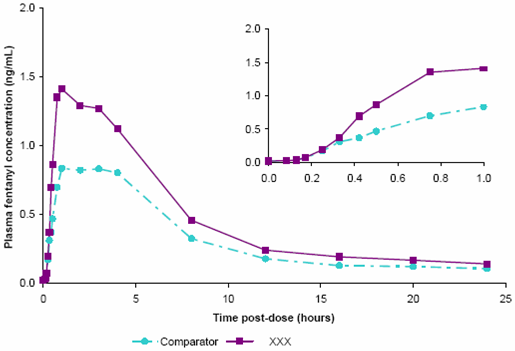
Une étude pharmacocinétique a montré que le fentanyl était rapidement absorbé après une application buccale de BREAKYL et que sa biodisponibilité absolue était de 71%. Cette étude de biodisponibilité absolue a également montré des paramètres pharmacocinétiques similaires entre des sous-groupes de six hommes et six femmes volontaires adultes en bonne santé.
La pharmacocinétique de l’absorption du fentanyl à partir de BREAKYL associe une absorption initiale rapide par la muqueuse buccale et une absorption plus prolongée du fentanyl dégluti par le tractus gastro-intestinal. Les résultats de l'étude de biodisponibilité absolue ont montré qu’environ 51% de la dose totale de BREAKYL étaient rapidement absorbés par la muqueuse buccale et devenaient disponibles sur le plan systémique. Les 49% restants de la dose totale ont été déglutis avec la salive puis lentement absorbés à partir du tractus gastro-intestinal. Environ un tiers de cette quantité (20% de la dose totale) a échappé à l’élimination lors du premier passage hépatique et intestinale, et devient disponible sur le plan systémique. De ce fait, la biodisponibilité absolue observée de 71% de BREAKYL est répartie entre une absorption transmuqueuse rapide et une absorption digestive plus lente. Si un film orodispersible de BREAKYL est mâché et dégluti, les concentrations maximales et la biodisponibilité seront probablement inférieures à celles obtenues lors d’une utilisation conforme aux instructions.
Une proportionnalité à la dose a été démontrée sur la totalité de l’étendue des dosages disponibles de BREAKYL (200 à 1200 microgrammes). Après l’administration d'un seul film orodispersible de BREAKYL (200 à 1200 microgrammes), la Cmax moyenne était de 0,38 à 2,19 ng/ml (en fonction de la dose) et la Tmax de 45 à 240 minutes (médiane : 60 min). L’application de BREAKYL sur un site actif de mucite (grade 1) dans un groupe de patients atteints de cancer a été associée à des diminutions de la Cmax et l’ASCinf.. Il est recommandé de surveiller étroitement les patients présentant une mucite de grade 1 ; une adaptation de la dose peut être envisagée. L’efficacité et la sécurité de BREAKYL n’ont pas été étudiées chez des patients présentant une mucite de sévérité supérieure au grade 1.
|
|
Concentrations plasmatiques moyennes en fentanyl en fonction du temps (24 heures et première heure uniquement [graphe en haut et à droite]) après des doses uniques de 800 microgrammes de BREAKYL ou de 800 microgrammes d’un produit de comparaison (fentanyl comprimé avec applicateur buccal) chez des volontaires sains.
Distribution
Le fentanyl est très lipophile. Des études menées chez l’animal ont montré qu’après avoir été absorbé, le fentanyl est distribué rapidement au niveau du cerveau, du cœur, des poumons, des reins et de la rate, puis est redistribué plus lentement vers les muscles et les tissus adipeux. Le taux de liaison du fentanyl aux protéines plasmatiques est de 80 à 85%. La principale protéine de liaison est l'alpha-1 glycoprotéine acide, mais l’albumine et les lipoprotéines sont également impliquées, dans une certaine mesure. La fraction libre du fentanyl augmente en cas d’acidose. Le volume moyen de distribution à l’état d’équilibre (VEE) est de 4 l/kg.
Biotransformation
Le fentanyl est métabolisé en norfentanyl dans le foie et la muqueuse intestinale sous l'effet de l'isoenzyme 3A4 du cytochrome P450. Lors des expérimentations animales, le norfentanyl n’a pas montré d’effet pharmacologique. Le fentanyl est principalement éliminé (plus de 90% de la dose) par biotransformation en métabolites N-désalkylés et hydroxylés inactifs
Élimination
Moins de 7% de la dose sont excrétés sous forme inchangée dans les urines et environ 1% est excrété sous forme inchangée dans les fèces. Les métabolites sont essentiellement excrétés par voie urinaire, l'excrétion fécale étant moins importante. La clairance plasmatique totale du fentanyl est de 0,5 l/h/kg (valeurs: 0,3 à 0,7 l/h/kg). La demi-vie cliniquement pertinente du fentanyl après administration de BREAKYL est d’environ sept heures et la demi-vie terminale d'élimination d'environ 14 heures.
5.3. Données de sécurité préclinique
Les études de toxicité sur le développement embryo-fœtal conduites chez le rat et le lapin n’ont révélé aucune malformation ou modification du développement lorsque le fentanyl était administré pendant la période d’organogenèse. Dans une étude de fertilité et de développement embryonnaire précoce chez le rat, un effet médié par les mâles a été observé à forte dose (300 mcg/kg/jour, voie sous-cutanée), concordant avec les effets sédatifs du fentanyl dans les études animales.
Dans les études de développement pré et post-natal chez le rat, le taux de survie de la descendance était significativement réduit à des doses entraînant une toxicité maternelle sévère. Les autres effets sur les petits de première génération observés à des doses toxiques maternelles sont : un retard du développement physique, des fonctions sensorielles, des réflexes et du comportement. Ces effets peuvent être des effets indirects de négligence maternelle et/ou de diminution de l’allaitement, ou un effet direct du fentanyl sur les petits.
Les études de cancérogénicité (test alternatif par voie cutanée chez la souris transgénique Tg.AC durant 26 semaines, étude de cancérogénèse par voie sous-cutanée chez le rat durant deux ans) ne montrent pas de résultats suggérant un potentiel oncogène. L’analyse des coupes de cerveau provenant de l’étude de cancérogenèse réalisée chez le rat a montré des lésions cérébrales chez les animaux ayant reçu des doses élevées de citrate de fentanyl. La pertinence clinique de ces résultats n’est pas connue.
Propylèneglycol (E1520), benzoate de sodium (E211), parahydroxybenzoate de méthyle (E218), parahydroxybenzoate de propyle (E216), oxyde de fer rouge (E172), acide citrique anhydre, acétate de tout-rac-alpha-tocophérol,phosphate monosodique anhydre, hydroxyde de sodium, phosphate trisodique anhydre, polycarbophile, hydroxypropylcellulose, hydroxyéthylcellulose, carmellose sodique.
Revêtement :
Benzoate de sodium (E211), parahydroxybenzoate de méthyle (E218), parahydroxybenzoate de propyle (E216), acide citrique anhydre, acétate de tout-rac-alpha-tocophérol, hydroxypropylcellulose, hydroxyéthylcellulose, dioxyde de titane (E171), saccharine sodique, huile essentielle de menthe poivrée.
2 ans
6.4. Précautions particulières de conservation
A conserver à une température ne dépassant pas 30ºC.
Ne pas mettre au réfrigérateur.
A conserver dans l’emballage extérieur d’origine, à l’abri de l’humidité.
6.5. Nature et contenu de l'emballage extérieur
Chaque film orodispersible est individuellement emballé dans un sachet avec sécurité enfant constitué d’un laminé COC Coex/aluminium/polytéréphtalate d’éthylène/papier.
Boîtes de 4, 10 ou 28 sachets contenant chacun un film orodispersible.
Toutes les présentations peuvent ne pas être commercialisées.
6.6. Précautions particulières d’élimination et de manipulation
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
1 BIS PLACE DE LA DEFENSE – TOUR TRINITY
92400 COURBEVOIE
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 498 121 3 4 : film orodispersible en sachet (Polyacrylonitrile/Aluminium/ Polytéréphtalate d’éthylène/Papier) ; boîte de 10.
· 34009 218 565 3 8 : film orodispersible en sachet (Polyacrylonitrile/Aluminium/ Polytéréphtalate d’éthylène/Papier) ; boîte de 28.
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Stupéfiant
Prescription sur ordonnances sécurisées.
Prescription limitée à 28 jours.
Délivrance fractionnée par périodes de 7 jours.
ANSM - Mis à jour le : 09/05/2025
BREAKYL 200 microgrammes, film orodispersible
Fentanyl
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin ou votre pharmacien.
· Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d’autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
1. Qu'est-ce que BREAKYL 200 microgrammes, film orodispersible et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant de prendre BREAKYL 200 microgrammes, film orodispersible ?
3. Comment prendre BREAKYL 200 microgrammes, film orodispersible ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver BREAKYL 200 microgrammes, film orodispersible ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE BREAKYL 200 microgrammes, film orodispersible ET DANS QUELS CAS EST-IL UTILISE ?
Classe pharmacothérapeutique – code ATC : N02AB03
La substance active contenue dans le film orodispersible de BREAKYL est le fentanyl, un puissant antalgique opioïde. BREAKYL est indiqué pour le traitement des accès douloureux paroxystiques dus à un cancer chez les patients adultes. L’accès douloureux paroxystique est une douleur supplémentaire qui survient brutalement en dépit de la prise de votre antalgique opioïde habituel.
Vous ne devez prendre BREAKYL que si vous prenez déjà régulièrement un traitement de type opioïde (par exemple morphine, oxycodone ou fentanyl transdermique) depuis au moins une semaine pour traiter vos douleurs chroniques d’origine cancéreuse.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT DE PRENDRE BREAKYL 200 microgrammes, film orodispersible ?
Ne prenez jamais BREAKYL 200 microgrammes, film orodispersible :
· Si vous êtes allergique (hypersensible) au fentanyl, ou à l’un des autres composants contenus dans BREAKYL, mentionnés à la rubrique 6.
· Si vous prenez actuellement ou avez pris au cours des 2 dernières semaines des médicaments appelés inhibiteurs de la monoamine oxydase (IMAO) (utilisés dans la dépression sévère).
· Si vous prenez actuellement un traitement contenant de l’oxybate de sodium.
· Si vous souffrez de graves problèmes respiratoires ou d’un syndrome respiratoire obstructif sévère (par exemple un asthme sévère).
· Si vous ne prenez pas régulièrement des médicaments de type opioïde sous ordonnance (par exemple codéine, fentanyl, hydromorphone, morphine, oxycodone, péthidine) tous les jours à intervalles réguliers depuis au moins une semaine pour contrôler votre douleur persistante. Si vous ne prenez pas ces médicaments, vous ne devez pas utiliser BREAKYL, car cela peut augmenter le risque que votre respiration devienne dangereusement lente et/ou superficielle, ou même qu’elle s’arrête.
· Si vous souffrez de douleurs de courte durée autres que des accès douloureux paroxystiques.
Conservez ce médicament dans un endroit sûr et sécurisé, où d’autres personnes n’y ont pas accès (voir la rubrique 5. « Comment conserver BREAKYL » pour plus d’informations).
Adressez-vous à votre médecin avant de commencer à prendre BREAKYL si vous êtes dans l’un des cas suivants, car votre médecin devra en tenir compte pour la prescription de votre dose :
· La posologie de votre autre antalgique de type opioïde pris pour traiter vos douleurs chroniques d’origine cancéreuse n’est pas encore stabilisée.
· Vous êtes atteint d’une affection ayant un effet sur votre respiration.
· Vous présentez un traumatisme crânien ou votre médecin a diagnostiqué une augmentation de votre pression intracrânienne.
· Vous avez des problèmes cardiaques, notamment une fréquence cardiaque lente, ou vous présentez d’autres problèmes cardiaques.
· Vous avez une tension artérielle basse, particulièrement en raison d’un faible volume sanguin.
· Vous avez des problèmes au foie ou aux reins, car ces organes ont un effet sur la manière dont votre organisme élimine le médicament.
· Vous souffrez d’une mucite buccale.
· Vous prenez des antidépresseurs ou des neuroleptiques, veuillez consulter la rubrique « Autres médicaments et BREAKYL ».
Pour plus d’informations, voir la rubrique 3.
Troubles respiratoires liés au sommeil
BREAKYL peut provoquer des troubles respiratoires liés au sommeil, tels qu’une apnée du sommeil (pauses respiratoires pendant le sommeil) et une hypoxémie liée au sommeil (faible taux d’oxygène dans le sang). Les symptômes associés peuvent inclure des arrêts de la respiration pendant le sommeil, des réveils nocturnes dus à un essoufflement, des difficultés à rester endormi ou une somnolence excessive pendant la journée. Si vous ou une personne de votre entourage remarquez ces symptômes, contactez votre médecin. Une réduction de la dose pourra être envisagée par votre médecin.
Consultez votre médecin pendant l’utilisation de BREAKYL si :
· Vous présentez une douleur ou une sensibilité accrue à la douleur (hyperalgésie) qui ne répond pas à la dose plus élevée de votre médicament prescrite par votre médecin ;
· Vous présentez une association des symptômes suivants : nausées, vomissements, anorexie, fatigue, faiblesse, sensations vertigineuses et pression artérielle basse. Ensemble, ces symptômes peuvent être le signe d’une maladie pouvant engager le pronostic vital appelée insuffisance surrénalienne, dans laquelle les glandes surrénales ne produisent pas suffisamment d’hormones ;
· Vous avez présenté dans le passé une insuffisance surrénalienne ou un manque d’hormones sexuelles (hypoandrogénie, ou déficit androgénique) lors de l’utilisation de médicaments opioïdes.
Utilisation au long cours et tolérance
Ce médicament contient du fentanyl, qui est un médicament opioïde. L’utilisation répétée d’analgésiques opioïdes peut entraîner une diminution de l’efficacité du médicament (vous vous y habituez, ce que l’on appelle la tolérance aux médicaments). Vous pouvez également devenir plus sensible à la douleur lors de l’utilisation de BREAKYL. C’est ce que l’on appelle l’hyperalgésie. L’augmentation de la dose de BREAKYL peut vous aider à réduire davantage vos douleurs pendant un certain temps, mais elle peut également être nocive. Si vous remarquez que votre médicament devient moins efficace, parlez-en à votre médecin. Votre médecin décidera s’il est préférable pour vous d’augmenter la dose ou de diminuer progressivement votre utilisation de BREAKYL.
Dépendance et addiction
Ce médicament contient du fentanyl, qui est un médicament opioïde. Il peut entraîner une dépendance et/ou une addiction.
L’utilisation répétée de BREAKYL peut également entraîner une dépendance, un abus et une addiction, qui peuvent aboutir à un surdosage mettant la vie en danger. Le risque de ces effets indésirables peut augmenter avec une dose plus élevée et une durée d’utilisation plus longue. La dépendance ou l’addiction peut vous donner l’impression que vous ne contrôlez plus la quantité de médicament que vous devez utiliser ou la fréquence à laquelle vous devez l’utiliser. Vous pouvez avoir l’impression que vous devez continuer à prendre votre médicament, même s’il ne vous aide pas à soulager votre douleur.
Le risque de développer une dépendance ou une addiction varie d’une personne à l’autre. Vous pouvez présenter un risque plus élevé de développer une dépendance ou une addiction à BREAKYL si :
· vous ou un membre de votre famille avez déjà consommé de façon abusive ou été dépendant(e) de l’alcool, à des médicaments prescrits sur ordonnance ou à des substances illicites (« addiction ») ;
· vous fumez ;
· vous avez déjà présenté des troubles de l’humeur (dépression, anxiété ou trouble de la personnalité) ou avez été traité(e) par un psychiatre pour d’autres maladies mentales.
Si vous remarquez l’un des signes suivants lors de l’utilisation de BREAKYL, il pourrait s’agir d’un signe que vous avez développé une dépendance ou une addiction.
· vous avez besoin d’utiliser le médicament pendant une durée plus longue que celle indiquée par votre médecin ;
· vous avez besoin d’utiliser une dose supérieure à la dose recommandée ;
· vous utilisez le médicament pour des raisons autres que celles qui vous ont été prescrites, par exemple « pour rester calme » ou « pour vous aider à dormir » ;
· vous avez tenté à plusieurs reprises et sans succès d’arrêter d’utiliser le médicament ou de contrôler son utilisation ;
· lorsque vous arrêtez de prendre le médicament, vous vous sentez mal (par exemple, nausées, vomissements, diarrhées, anxiété, frissons, tremblements et transpiration), et vous vous sentez mieux lorsque vous reprenez le médicament (« effets de sevrage »).
Si vous remarquez l’un de ces signes, parlez-en à votre médecin pour discuter de la meilleure voie de traitement pour vous, y compris le moment opportun pour arrêter et la façon d’arrêter en toute sécurité.
Enfants et adolescents
Ne donnez pas ce médicament aux enfants âgés de 0 à 18 ans.
BREAKYL contient une quantité de fentanyl qui peut être mortelle pour un enfant. BREAKYL doit donc être constamment tenu hors de la vue et de la portée des enfants.
Si vous pratiquez un sport, sachez que ce produit peut entraîner la positivité d’un contrôle antidopage.
Autres médicaments et BREAKYL 200 microgrammes, film orodispersible
Informez votre médecin ou pharmacien si vous prenez, avez récemment pris ou pourriez prendre tout autre médicament.
Ne prenez pas BREAKYL si vous prenez actuellement des médicaments appelés inhibiteurs de la monoamine oxydase (IMAO) (utilisés dans la dépression sévère) ou si vous en avez pris au cours des 2 dernières semaines.
Si vous prenez l’un des médicaments suivants, parlez-en à votre médecin ou à votre pharmacien avant de commencer votre traitement par BREAKYL :
Tout médicament qui pourrait normalement induire une fatigue ou une somnolence, par exemple :
· somnifères,
· médicaments pour traiter l’anxiété, la nervosité, la dépression,
· médicament pour traiter la tension ou la raideur musculaire (médicaments myorelaxants),
· médicaments pour traiter les allergies (antihistaminiques).
Les médicaments qui pourraient diminuer la façon dont votre organisme dégrade BREAKYL (grâce à l’isoenzyme CYP3A4). En effet, cela pourrait augmenter la concentration de fentanyl dans le sang et accroître ou prolonger ainsi les effets de BREAKYL et provoquer des troubles respiratoires potentiellement fatals. Ces médicaments sont notamment les suivants :
· médicaments pour le traitement d’infections bactériennes (tels que l’érythromycine, la clarithromycine, la télithromycine),
· médicaments pour le traitement des infections fongiques (tels que le kétoconazole, l’itraconazole, le fluconazole),
· médicaments pour le traitement des infections virales, par exemple infections au VIH (tels que le ritonavir, l’indinavir, le nelfinavir, le saquinavir),
· médicaments pour le traitement de maladies cardiovasculaires (tels que le diltiazem, le vérapamil),
· médicaments contre les nausées sévères (tels que l’aprepitant, le dronabinol),
· médicaments pour le traitement des dépressions (tels que la fluoxétine),
· médicaments qui inhibent la production d’acide gastrique (tels que la cimétidine).
Le risque d’effets indésirables augmente si vous prenez des médicaments tels que certains antidépresseurs ou neuroleptiques. BREAKYL peut interagir avec ces médicaments et il est possible que vous développiez des altérations de votre état mental (par exemple agitation, hallucinations, coma) et d’autres effets tels qu’une température corporelle supérieure à 38°C, une augmentation de la fréquence cardiaque, une instabilité de la pression artérielle, une exagération des réflexes, une rigidité musculaire, un manque de coordination et/ou des symptômes gastro-intestinaux (par exemple nausées, vomissements, diarrhée). Votre médecin vous dira si BREAKYL est approprié pour vous.
Médicaments qui pourraient augmenter la façon dont votre organisme dégrade le fentanyl (grâce à l’isoenzyme CYP3A4). En effet, cela peut diminuer l’efficacité de BREAKYL, notamment :
· somnifères ou sédatifs (tel que le phénobarbital),
· médicaments pour contrôler les convulsions/crises épileptiques (tels que la carbamazépine, la phénytoïne, l’oxcarbazépine),
· médicaments pour bloquer la prolifération virale (tels que l’éfavirenz, la névirapine),
· médicaments anti-inflammatoires ou immunosuppresseurs (tels que les glucocorticoïdes),
· médicaments pour le traitement du diabète (tels que la pioglitazone),
· antibiotiques pour le traitement de la tuberculose (tels que la rifabutine, la rifampicine),
· médicaments psychostimulants (tels que le modafinil),
· médicaments pour le traitement de la dépression (tels que le millepertuis).
Si vous arrêtez un traitement par l’un de ces médicaments ou en diminuez la dose lors du traitement par BREAKYL, parlez-en à votre médecin. Ce dernier vous surveillera étroitement afin de déceler tout signe éventuel de toxicité des opioïdes, et pourra ajuster la dose de BREAKYL en conséquence.
L'utilisation concomitante de BREAKYL et de médicaments sédatifs comme les benzodiazépines ou les médicaments apparentés augmente le risque de somnolence, de difficultés respiratoires (dépression respiratoire), de coma et peut être mortelle. Pour cette raison, l’utilisation concomitante ne doit être envisagée que lorsque d’autres options de traitement ne sont pas possibles.
Toutefois, si votre médecin vous prescrit BREAKYL en association avec des médicaments sédatifs, la posologie et la durée du traitement concomitant doivent être limitées par votre médecin.
Veuillez informer votre médecin de tous les médicaments sédatifs que vous prenez et respectez strictement les doses recommandées par votre médecin. Il pourrait être utile d'informer des amis ou des proches afin qu’ils aient connaissance des signes et des symptômes mentionnés ci-dessus. Contactez votre médecin si vous ressentez de tels symptômes.
Si vous prenez en même temps un traitement avec certains types d’antalgiques puissants, appelés opioïdes agonistes/antagonistes partiels, par exemple buprénorphine, nalbuphine et pentazocine (médicaments du traitement de la douleur), vous pouvez ressentir des symptômes du syndrome de sevrage (nausées, vomissements, diarrhée, anxiété, frissons, tremblements, et transpiration excessive) quand vous prenez ces médicaments.
BREAKYL 200 microgrammes, film orodispersible avec des aliments, boissons et de l’alcool
Ne consommez pas d’alcool, car il peut provoquer une sédation supplémentaire et déprimer davantage votre respiration. Vous ne devez pas boire de jus de pamplemousse, car cela pourrait ralentir la dégradation du fentanyl par votre organisme, ce qui pourrait entraîner une augmentation ou une prolongation des effets de BREAKYL et provoquer des troubles respiratoires potentiellement fatals.
Grossesse, allaitement et fertilité
Si vous êtes enceinte ou que vous allaitez, si vous pensez être enceinte ou planifiez une grossesse, demandez conseil à votre médecin ou pharmacien avant de prendre ce médicament.
BREAKYL ne doit pas être utilisé pendant la grossesse à moins d’en avoir parlé avec votre médecin. Vous ne devez pas utiliser BREAKYL lors de l’accouchement, car le fentanyl peut entraîner une dépression respiratoire chez le nouveau-né.
Le fentanyl peut passer dans le lait maternel et entraîner des effets indésirables chez le nourrisson. N’utilisez pas BREAKYL si vous allaitez. Vous ne devriez pas commencer l’allaitement à moins de 5 jours après la dernière dose de BREAKYL.
Conduite de véhicules et utilisation de machines
Demandez à votre médecin si vous pouvez conduire un véhicule ou utiliser une machine sans risque au cours des heures suivant la prise de BREAKYL.
Les antalgiques de type opioïde comme le fentanyl peuvent altérer les aptitudes mentales et/ou physiques nécessaires à la réalisation de tâches potentiellement dangereuses. Vous ne devez pas conduire ni utiliser une machine si vous ressentez une somnolence ou des étourdissements, si votre vision est trouble ou double, ou si vous éprouvez des difficultés de concentration lorsque vous prenez BREAKYL.
BREAKYL 200 microgrammes, film orodispersible contient du propylèneglycol (E1520), du benzoate de sodium (E211), du parahydroxybenzoate de méthyle (E218) et du parahydroxybenzoate de propyle (E216).
Le benzoate de sodium est légèrement irritant pour la peau, les yeux et les muqueuses. Le parahydroxybenzoate de méthyle et le parahydroxybenzoate de propyle peuvent provoquer des réactions allergiques (pouvant être retardées). Le propylèneglycol peut provoquer une irritation cutanée.
3. COMMENT PRENDRE BREAKYL 200 microgrammes, film orodispersible ?
Avant de commencer le traitement et régulièrement pendant le traitement, votre médecin discutera également avec vous de ce que vous pouvez attendre de l’utilisation de BREAKYL, quand vous devez l’utiliser et pendant combien de temps, quand vous devez contacter votre médecin et quand vous devez l’arrêter (voir également rubrique 2).
Veillez à toujours prendre ce médicament en suivant exactement les indications de votre médecin ou pharmacien. Vérifiez auprès de votre médecin ou pharmacien en cas de doute.
Posologie
Lorsque vous commencerez à prendre BREAKYL, votre médecin s’emploiera à trouver avec vous la dose qui soulagera vos accès douloureux paroxystiques (titration de dose). Cela est nécessaire, car votre dose individuelle efficace de BREAKYL ne peut être prédite à partir de la dose quotidienne des opioïdes que vous prenez pour le traitement de vos douleurs chroniques d’origine cancéreuse ni de celle des autres médicaments que vous pourriez avoir pris pour le traitement des accès douloureux paroxystiques d’origine cancéreuse.
Pour la titration de dose, votre dose sera progressivement augmentée. Quand vous aurez atteint une dose qui soulagera de façon adéquate vos douleurs dans les 30 minutes, et si les effets indésirables éventuels sont acceptables pour vous, la dose efficace aura alors été déterminée. Il est important que vous suiviez strictement les recommandations de votre médecin.
La méthode suivante sera habituellement utilisée pour la titration de dose.
Titration de la dose
Votre dose initiale de BREAKYL doit être de 200 microgrammes.
Contactez votre médecin si vos accès douloureux paroxystiques ne sont pas soulagés dans les 30 minutes suivant l’application de cette dose de BREAKYL. Si vous avez toléré cette dose, votre médecin vous recommandera de prendre la dose supérieure suivante de BREAKYL pour traiter le prochain accès douloureux paroxystique. Votre médecin pourra progressivement augmenter la dose de 200 à 400 et 600 microgrammes, jusqu’à 800 microgrammes.
En appliquant simultanément une combinaison de films orodispersibles de BREAKYL dosés à 200 microgrammes, il est possible d’atteindre ces doses plus élevées :
· 1 film orodispersible de BREAKYL 200 est égal à une dose de 200 microgrammes
· 2 films orodispersibles de BREAKYL 200 sont égaux à une dose de 400 microgrammes
· 3 films orodispersibles de BREAKYL 200 sont égaux à une dose de 600 microgrammes
· 4 films orodispersibles de BREAKYL 200 sont égaux à une dose de 800 microgrammes
Si l'application simultanée de 4 films orodispersibles à 200 microgrammes (soit 800 microgrammes) ne soulage pas suffisamment les douleurs, votre médecin pourra vous prescrire BREAKYL 1200 microgrammes. Il s’agit du dosage le plus élevé disponible de BREAKYL.
Quand vous aurez déterminé la dose efficace, votre médecin vous la prescrira pour traiter les accès douloureux paroxystiques suivants.
Vous ne devrez prendre BREAKYL qu’une seule fois par accès douloureux paroxystique, et vous devrez attendre au moins quatre heures avant de prendre une autre dose.
Si vos douleurs ne sont pas correctement soulagées dans les 30 minutes suivant l’application d’une dose de BREAKYL, vous pourrez prendre un médicament de secours pour les accès douloureux paroxystiques, si votre médecin vous l’a prescrit.
Fréquence d’administration
Vous ne devez pas prendre plus de quatre doses de BREAKYL par jour.
Ajustement de dose
Vous devez informer votre médecin immédiatement si vous avez plus de quatre accès douloureux paroxystiques par jour. Votre médecin pourra augmenter la dose de l’autre médicament de type opioïde que vous prenez pour le traitement de vos douleurs persistantes d’origine cancéreuse. Une fois que vos douleurs persistantes seront contrôlées à nouveau, votre médecin pourra ajuster votre dose de BREAKYL si besoin. Pour avoir les meilleurs résultats, parlez à votre médecin de vos douleurs et des effets de BREAKYL afin que la dose puisse être ajustée si besoin.
Vous ne devez pas changer les doses de BREAKYL ou celle de votre traitement opioïde habituel par vous-même. Les modifications de dose doivent être prescrites et suivies par votre médecin.
Mode d’administration
BREAKYL film orodispersible est conçu pour une utilisation buccale. Lorsque vous appliquez un film orodispersible de BREAKYL à l’intérieur de votre joue, le fentanyl est directement absorbé par la muqueuse de votre bouche et atteint la circulation sanguine.
· Ouvrez le sachet de BREAKYL immédiatement avant emploi, selon les instructions indiquées sur le sachet ;
· Humidifiez l’intérieur de votre joue avec votre langue ou rincez-vous la bouche à l'eau afin d'humecter la zone d'application de BREAKYL ;
· Avec les mains sèches, prenez le film orodispersible de BREAKYL entre votre index et votre pouce, la face rose du côté de votre pouce (figure 1) ;
· Placez le film orodispersible de BREAKYL dans votre bouche de telle façon que la face rose soit en contact uniforme avec la muqueuse interne de votre joue (figure 2) ;
· Appuyez et maintenez-le en place pendant au moins 5 secondes jusqu’à ce qu’il adhère fermement. La face blanche doit être maintenant visible (figure 3).
· Si vous appliquez plus d’un film orodispersible de BREAKYL en même temps, vérifiez que chaque film orodispersible adhère directement à votre muqueuse buccale. Afin d’éviter que les films orodispersibles ne se recouvrent pas, il est possible de les appliquer sur les muqueuses droite et gauche des joues.
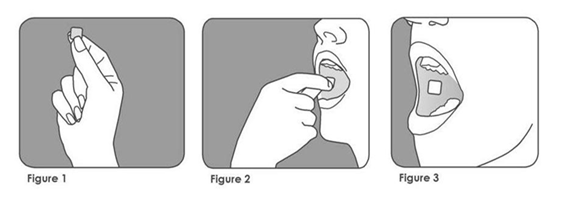
Le film orodispersible de BREAKYL doit rester en place de lui-même après cette étape. Vous pouvez boire au bout de cinq minutes.
La dissolution d’un film orodispersible de BREAKYL est habituellement complète dans les 15 à 30 minutes suivant l’application. Dans certains cas, la dissolution totale peut prendre plus de 30 minutes, mais cela n’affecte par l’absorption du fentanyl.
Vous devez éviter de manipuler le film orodispersible avec votre langue ou vos doigts. Vous ne devez pas manger tant que le film orodispersible n’est pas complètement dissout.
Ne pas mâcher ou avaler BREAKYL. Si vous le faites, le soulagement de l’accès douloureux paroxystique serait moindre.
Si vous avez pris plus de BREAKYL 200 microgrammes, film orodispersible que vous n’auriez dû :
Si vous commencez à ressentir une forte sensation de somnolence après l’utilisation de BREAKYL, retirez le film orodispersible ou même des fragments de votre bouche aussi rapidement que possible et demandez de l’aide.
Vous ou votre soignant devez contacter votre médecin, l’hôpital ou un service d’urgence afin d’évaluer le risque encouru et de demander conseil si vous avez utilisé plus de BREAKYL que vous n’auriez dû.
Les symptômes d’un surdosage peuvent être :
· forte somnolence
· étourdissements
· nausées ou vomissements
· respiration très lente et/ou superficielle
· ou réduction de la température corporelle, ralentissement des battements du cœur, difficultés à coordonner les bras et les jambes
La personne ayant accidentellement pris BREAKYL peut présenter les mêmes symptômes que ceux qui sont décrits ci-dessus lors d’un surdosage.
Au début du traitement ces symptômes peuvent survenir si votre dose de BREAKYL est trop élevée ou si vous prenez trop de BREAKYL. Vous-même et votre soignant devez vous entretenir avec votre médecin afin de savoir quelle action immédiate entreprendre si ces troubles apparaissent.
Note aux soignants :
Si vous constatez que la respiration du patient prenant BREAKYL ou d’une personne ayant accidentellement pris BREAKYL alors qu’il ne lui a pas été prescrit, est lente et/ou superficielle, ou si vous avez d’importantes difficultés à le réveiller, effectuez immédiatement les actions suivantes :
· Si le film orodispersible ou même des fragments de BREAKYL sont encore collés à l’intérieur de la joue de l’individu, enlevez-les de la bouche aussi rapidement que possible.
· Appelez un service d’aide médicale urgente.
· Dans l’attente du service d’aide médicale urgente :
o Si la personne est endormie, réveillez-la en l’appelant par son nom et en secouant son bras ou son épaule
o Si la personne semble respirer lentement, stimulez-la afin qu’elle respire toutes les 5 à 10 secondes
o Si la personne ne respire plus, faites-la respirer en pratiquant un bouche-à-bouche jusqu'à l’arrivée des secours
Si vous oubliez de prendre BREAKYL 200 microgrammes, film orodispersible :
Si vous arrêtez de prendre BREAKYL 200 microgrammes, film orodispersible :
Vous devez arrêter la prise de BREAKYL lorsque vous n’avez plus d’accès douloureux paroxystique. Cependant, vous devez continuer à prendre le reste de votre traitement antidouleur habituel pour traiter votre douleur cancéreuse de fond comme conseillé par votre médecin.
À l’arrêt de BREAKYL, vous pouvez ressentir des symptômes de sevrage, comparables aux effets indésirables potentiels de BREAKYL. Si vous ressentez des symptômes de sevrage ou si vous êtes inquiet concernant le soulagement de votre douleur, contactez votre médecin. Votre médecin évaluera si vous avez besoin d’un traitement pour réduire ou éliminer les symptômes de sevrage.
Si vous avez d’autres questions sur l’utilisation de ce médicament, demandez plus d’informations à votre médecin ou à votre pharmacien.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Les effets indésirables les plus graves sont la respiration superficielle, la pression artérielle basse et un état de choc. Si vous devenez très somnolent(e) ou si votre respiration est lente et/ou superficielle, vous-même ou votre soignant devez contacter immédiatement votre médecin et appeler un service d'aide médicale urgente. Si le film orodispersible est encore en place à l’intérieur de votre joue, enlevez-le ou même des fragments de votre bouche aussi vite que possible.
Les effets indésirables les plus fréquemment observés sont des nausées, une somnolence et des étourdissements.
Comme les patients qui utilisent BREAKYL prennent également régulièrement un autre traitement opioïde (tels que la morphine, l’oxycodone ou le fentanyl transdermique) pour leurs douleurs chroniques, les effets indésirables des opioïdes peuvent donc être dus à l'un ou l'autre des médicaments. Il n’est donc pas possible de distinguer avec certitude les effets indésirables dus au seul traitement par BREAKYL de ceux dus aux autres opioïdes.
Les événements indésirables considérés comme liés de façon au moins possible au traitement ont été les suivants :
Fréquent (pouvant toucher jusqu’à 1 personne sur 10) :
· fatigue/somnolence excessive, étourdissements, maux de tête, sédation,
· troubles de la vue (par exemple vision trouble ou double),
· nausée, constipation, vomissement, sécheresse buccale,
· démangeaison de la peau,
· fatigue,
· confusion.
Peu fréquent (pouvant toucher jusqu’à 1 personne sur 100) :
· augmentation de la pression artérielle,
· modification du goût, inactivité, troubles de la mémoire, troubles de la pensée,
· respiration lente ou superficielle, congestion des sinus,
· diarrhée, inflammation de la muqueuse buccale, saignement des gencives, indigestion, ulcères dans la bouche, douleur buccale, déglutition douloureuse,
· perte non intentionnelle d’urine,
· augmentation de la sudation, tendance aux ecchymoses (« bleus »),
· contractions musculaires, faiblesse musculaire, douleurs dans les articulations, douleurs dans les muscles, douleurs dans les membres, douleurs dans la mâchoire,
· diminution de l’appétit,
· blessure accidentelle (par exemple chutes),
· rougeurs/bouffées de chaleur,
· faiblesse, frisson, fièvre, soif,
· anxiété ou nervosité, hallucinations, délire, rêves inhabituels, somnolence (insomnie), agitation.
Très rare (pouvant toucher jusqu’à 1 personne sur 10 000) :
· soubresauts musculaires, convulsion, sensations anormales, comme des fourmillements, engourdissement, augmentation de la sensibilité au toucher, également autour de la bouche, des difficultés à coordonner ses mouvements,
· problèmes respiratoires graves,
· maux de ventre, gaz, ballonnement abdominal,
· difficultés à uriner,
· éruption cutanée,
· vasodilatation,
· sensation de malaise général,
· gonflement des bras ou des jambes,
· pensées inhabituelles, sentiment de détachement, dépression, sautes d’humeur, sensation excessive de bien-être.
Fréquence indéterminée (la fréquence ne peut être estimée à partir des données disponibles) :
· délire (les symptômes peuvent inclure une combinaison d’agitation, d’impatience, de désorientation, de confusion, de peur, de troubles du sommeil et de cauchemars, ou le fait d’avoir des visions ou d’entendre des choses qui ne sont pas réellement présentes),
· syndrome de sevrage (peut se manifester par l’apparition des effets indésirables suivants : nausées, vomissements, diarrhée, anxiété, frissons, tremblements, et transpiration excessive),
· tolérance au médicament, pharmacodépendance (addiction), utilisation abusive (voir rubrique 2).
Il existe un risque d’abus ou d’addiction avec BREAKYL. Le risque est plus élevé en cas d’antécédents d'addiction à d'autres médicaments ou d'abus de ceux-ci et de consommation de substances illicites ou d'abus d'alcool.
Si vous remarquez des effets indésirables non mentionnés dans cette notice, ou si certains effets indésirables deviennent graves, veuillez en informer votre médecin ou votre pharmacien.
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin, à votre pharmacien ou à votre infirmier/ère. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence national de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance – Site internet : https://signalement.social-sante.gouv.fr.
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER BREAKYL 200 microgrammes, film orodispersible ?
Tenir ce médicament hors de la vue et de la portée des enfants.
La quantité de fentanyl contenue dans BREAKYL peut être mortelle pour un enfant ou pour une personne qui ne prend pas régulièrement un traitement de type opioïde. Conservez ce médicament dans un endroit sûr et sécurisé, où d’autres personnes ne peuvent pas y accéder. Il peut causer des dommages graves et être fatal pour les personnes qui peuvent prendre ce médicament par accident, ou intentionnellement alors qu’il ne leur a pas été prescrit.
N’utilisez pas ce médicament après la date de péremption indiquée sur la boîte et sur le sachet après {MM.AAAA}. La date de péremption fait référence au dernier jour de ce mois.
A conserver à une température ne dépassant pas 30ºC.
Ne pas mettre au réfrigérateur.
A conserver dans l’emballage extérieur d’origine, à l’abri de l’humidité.
N’utilisez pas ce médicament si vous remarquez que le sachet a été endommagé avant ouverture. Si un film orodispersible a été abîmé ou coupé lors de l’ouverture, il ne doit pas être utilisé.
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement et à éviter qu’un médicament non utilisé ne soit pris par des enfants et/ou des personnes à qui il n’a pas été prescrit.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient BREAKYL 200 microgrammes, film orodispersible
· La substance active est : le fentanyl.
Un film orodispersible contient 200 microgrammes de fentanyl (sous forme de citrate de fentanyl).
· Les autres composants sont :
Couche active :
Propylèneglycol (E1520), benzoate de sodium (E211), parahydroxybenzoate de méthyle (E218), parahydroxybenzoate de propyle (E216), oxyde de fer rouge (E172), acide citrique anhydre, acétate de tout-rac-alpha-tocophérol, phosphate monosodique anhydre, hydroxyde de sodium, phosphate trisodique anhydre, polycarbophile, hydroxypropylcellulose, hydroxyéthylcellulose, carmellose sodique.
Revêtement :
Benzoate de sodium (E211), parahydroxybenzoate de méthyle (E218), parahydroxybenzoate de propyle (E216), acide citrique anhydre, acétate de tout-rac-alpha-tocophérol, hydroxypropylcellulose, hydroxyéthylcellulose, dioxyde de titane (E171), saccharine sodique, huile essentielle de menthe poivrée.
Ce médicament contient moins de 1 mmol (23 mg) de sodium par film orodispersible, c.-à-d. qu’il est essentiellement « sans sodium ».
Un film orodispersible contient 0,11 mg de benzoate de sodium.
Qu’est-ce que BREAKYL 200 microgrammes, film orodispersible et contenu de l’emballage extérieur
BREAKYL est un film orodispersible soluble, rectangulaire, plat et souple à deux faces, l’une rose et l’autre blanche, conçu pour permettre un passage direct de fentanyl dans la circulation sanguine. La face rose contient la substance active (fentanyl). La face blanche minimise la libération du fentanyl dans la salive afin d’éviter que la substance active ne soit avalée.
Les schémas suivants montrent les tailles des dosages disponibles de BREAKYL :

Chaque film orodispersible est scellé dans un sachet avec sécurité enfant.
Les présentations suivantes de BREAKYL 200 microgrammes sont disponibles :
boîtes de 4, 10 ou 28 sachets contenant chacun un film orodispersible.
Toutes les présentations peuvent ne pas être commercialisées.
Titulaire de l’autorisation de mise sur le marché
1 BIS PLACE DE LA DEFENSE – TOUR TRINITY
92400 COURBEVOIE
Exploitant de l’autorisation de mise sur le marché
1 BIS PLACE DE LA DEFENSE – TOUR TRINITY
92400 COURBEVOIE
BENZSTR. 1
61352 BAD HOMBURG
ALLEMAGNE
ou
LTS LOHMANN THERAPIE SYSTEME AG
Lohmannstrasse 2
56626 Andernach
ALLEMAGNE
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Ce médicament est autorisé dans les Etats membres de l'Espace Economique Européen sous les noms suivants : Conformément à la réglementation en vigueur.
[À compléter ultérieurement par le titulaire]
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).