Dernière mise à jour le 02/02/2026
POTASSIUM OLIGOSOL, solution buvable en ampoule
Présentations
> 14 ampoule(s) en verre de 2 ml
Code CIP : 307 521-1 ou 34009 307 521 1 1
Déclaration de commercialisation : 19/01/1956
Cette présentation n'est pas agréée aux collectivités
> 28 ampoule(s) en verre de 2 ml
Code CIP : 34009 301 426 5 3
Déclaration de commercialisation : 14/02/2019
Cette présentation n'est pas agréée aux collectivités
Service médical rendu (SMR)
Pas de SMR disponible pour ce médicament ( plus d'informations dans l'aide )
Amélioration du service médical rendu (ASMR)
Pas d'ASMR disponible pour ce médicament (plus d'informations dans l'aide )
ANSM - Mis à jour le : 01/08/2023
POTASSIUM OLIGOSOL, solution buvable en ampoule
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Gluconate de potassium.................................................................................................... 0,240 mg
(Quantité correspondante en potassium ............................................................................ 0,040 mg)
Pour une ampoule de 2 ml.
Excipient à effet notoire : glucose (100 mg dans une ampoule de 2 ml).
Pour la liste complète des excipients, voir rubrique 6.1.
4.1. Indications thérapeutiques
4.2. Posologie et mode d'administration
RÉSERVÉ A L'ADULTE.
1 à 3 ampoules par jour.
Les ampoules sont à prendre :
· de préférence le matin à jeun,
· éventuellement 15 minutes avant un repas ou le soir au coucher.
Mode d’administration
Voie orale.
L'administration par voie sublinguale est recommandée : garder le contenu de l'ampoule 1 à 2 minutes sous la langue avant d'avaler.
Hypersensibilité à la substance active ou à l’un des excipients mentionnés à la rubrique 6.1.
4.4. Mises en garde spéciales et précautions d'emploi
Ce médicament contient du glucose. Son utilisation est déconseillée chez les patients présentant un syndrome de malabsorption du glucose et du galactose (maladie héréditaire rare).
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Les données disponibles à ce jour ne laissent pas supposer l'existence d'interactions cliniquement significatives.
4.6. Fertilité, grossesse et allaitement
En l'absence de données expérimentales et cliniques et par mesure de précaution, l'utilisation de ce médicament est à éviter pendant la grossesse et l'allaitement.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : www.signalement-sante.gouv.fr
Aucun cas de surdosage n'a été rapporté.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Classe pharmacothérapeutique : OLIGOTHÉRAPIE (V : divers).
Elément minéral trace.
5.2. Propriétés pharmacocinétiques
5.3. Données de sécurité préclinique
Glucose anhydre, eau purifiée.
5 ans.
6.4. Précautions particulières de conservation
A conserver à une température ne dépassant pas 25 °C.
6.5. Nature et contenu de l'emballage extérieur
Ampoule à deux pointes autocassables en verre incolore de type I de 2 ml. Boîte de 14 ou 28 ampoules.
6.6. Précautions particulières d’élimination et de manipulation
Pas d’exigences particulières.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
1198 AVENUE DU DOCTEUR MAURICE DONAT
ZAC DU FONT DE L’ORME
06250 MOUGINS
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 307 521 1 1 : 2 ml en ampoule (verre incolore), boîte de 14.
· 34009 301 426 5 3 : 2 ml en ampoule (verre incolore), boîte de 28.
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Médicament non soumis à prescription médicale.
ANSM - Mis à jour le : 01/08/2023
POTASSIUM OLIGOSOL, solution buvable en ampoule
Gluconate de potassium
Vous devez toujours prendre ce médicament en suivant scrupuleusement les informations fournies dans cette notice ou par votre médecin, ou votre pharmacien.
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Adressez-vous à votre pharmacien pour tout conseil ou information.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin, ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
· Vous devez vous adresser à votre médecin si vous ne ressentez aucune amélioration ou si vous vous sentez moins bien.
1. Qu'est-ce que POTASSIUM OLIGOSOL, solution buvable en ampoule et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant de prendre POTASSIUM OLIGOSOL, solution buvable en ampoule ?
3. Comment prendre POTASSIUM OLIGOSOL, solution buvable en ampoule ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver POTASSIUM OLIGOSOL, solution buvable en ampoule ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE POTASSIUM OLIGOSOL, solution buvable en ampoule ET DANS QUELS CAS EST-IL UTILISE ?
Classe pharmacothérapeutique : OLIGOTHÉRAPIE (V : divers).
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT DE PRENDRE POTASSIUM OLIGOSOL, solution buvable en ampoule ?
Ne prenez jamais POTASSIUM OLIGOSOL, solution buvable en ampoule :
· Si vous êtes allergique (hypersensible) au gluconate de potassium ou à l’un des autres composants contenus dans ce médicament, mentionnés dans la rubrique 6.
Avertissements et précautions
Lorsqu’une supplémentation en potassium est indiquée (hypokaliémie ou risque d’hypokaliémie), le potassium sous forme d’oligo-élément n’est pas adapté.
Adressez-vous à votre médecin ou votre pharmacien avant de prendre POTASSIUM OLIGOSOL, solution buvable en ampoule.
Enfants
Sans objet.
Autres médicaments et POTASSIUM OLIGOSOL, solution buvable en ampoule
Informez votre médecin ou pharmacien si vous prenez, avez récemment pris ou pourriez prendre tout autre médicament.
POTASSIUM OLIGOSOL, solution buvable en ampoule avec des aliments et boissons
Sans objet.
Par mesure de précaution, l’utilisation de ce médicament est à éviter pendant la grossesse et l’allaitement.
Si vous êtes enceinte ou que vous allaitez, si vous pensez être enceinte ou planifiez une grossesse, demandez conseil à votre médecin ou votre pharmacien avant de prendre ce médicament.
Conduite de véhicules et utilisation de machines
Sans objet.
POTASSIUM OLIGOSOL, solution buvable en ampoule contient du glucose
Si votre médecin vous a informé(e) d’une intolérance à certains sucres, contactez-le avant de prendre ce médicament.
3. COMMENT prendre POTASSIUM OLIGOSOL, solution buvable en ampoule ?
La dose recommandée est de 1 à 3 ampoules par jour.
Voie orale.
L'administration par voie sublinguale est recommandée : garder le contenu de l'ampoule 1 à 2 minutes sous la langue avant d'avaler.
Les ampoules sont à prendre :
· de préférence le matin à jeun,
· éventuellement 15 minutes avant un repas ou le soir au coucher.
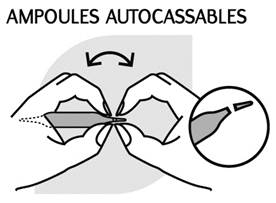
|
|
Instructions pour ouvrir l'ampoule: Casser les 2 pointes au niveau de l'anneau de couleur. |
Si vous avez pris plus de POTASSIUM OLIGOSOL, solution buvable en ampoule que vous n’auriez dû :
Aucun cas de surdosage n’a été rapporté.
Si vous oubliez de prendre POTASSIUM OLIGOSOL, solution buvable en ampoule
Sans objet.
Si vous arrêtez de prendre POTASSIUM OLIGOSOL, solution buvable en ampoule
Sans objet.
Si vous avez d’autres questions sur l’utilisation de ce médicament, demandez plus d’informations à votre médecin ou à votre pharmacien.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : www.signalement-sante.gouv.fr
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER POTASSIUM OLIGOSOL, solution buvable en ampoule ?
Tenir ce médicament hors de la vue et de la portée des enfants.
N’utilisez pas ce médicament après la date de péremption indiquée sur l’emballage après EXP. La date de péremption fait référence au dernier jour de ce mois.
A conserver à une température ne dépassant pas 25 °C.
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient POTASSIUM OLIGOSOL, solution buvable en ampoule
· La substance active est :
Gluconate de potassium.................................................................................................... 0,240 mg
(Quantité correspondante en potassium............................................................................. 0,040 mg)
Pour une ampoule de 2 ml.
· Les autres composants sont : glucose anhydre, eau purifiée.
Qu’est-ce que POTASSIUM OLIGOSOL, solution buvable en ampoule et contenu de l’emballage extérieur
Ce médicament se présente sous la forme d’une solution buvable en ampoule de 2 ml ; boîte de 14 ou 28 ampoules.
Titulaire de l’autorisation de mise sur le marché
1198 AVENUE DU DOCTEUR MAURICE DONAT
ZAC DU FONT DE L’ORME
06250 MOUGINS
Exploitant de l’autorisation de mise sur le marché
LE PARADOR II
5 ALLEE CROVETTO FRERES
98000 MONACO
ZONE INDUSTRIELLE DU MONT-BLANC
1, RUE DE L’INDUSTRIE
74106 ANNEMASSE
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Sans objet.
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).