
ANSM - Mis à jour le : 24/09/2024
RIASTAP 1g, poudre pour solution injectable/perfusion
2. COMPOSITION QUALITATIVE ET QUANTITATIVE 
RIASTAP se présente sous la forme d’une poudre pour solution injectable ou pour perfusion contenant 1 g de fibrinogène humain par flacon.
Le produit reconstitué avec 50 ml d’eau pour préparations injectables contient approximativement 20 mg/ml de fibrinogène humain.
Le contenu de fibrinogène est déterminé conformément à la monographie de la Pharmacopée Européenne pour fibrinogène humain.
Excipient(s) à effet notoire : Sodium jusqu’à 164 mg (7,1 mmol) par flacon.
Pour la liste complète des excipients, voir rubrique 6.1.
Poudre pour solution injectable/ perfusion.
Poudre blanche.
4.1. Indications thérapeutiques 
4.2. Posologie et mode d'administration 
Posologie
La posologie et la durée du traitement de substitution dépendent de la sévérité des troubles, de l’importance et du lieu de l’hémorragie, et de l’état clinique du patient.
La concentration en fibrinogène (fonctionnel) doit être déterminée afin de calculer la posologie individuelle. La posologie et la fréquence de l'administration doivent être adaptées de façon individuelle grâce à des dosages plasmatiques réguliers en fibrinogène et au contrôle continu de l'état clinique du patient et des autres traitements de substitution utilisés.
Les concentrations plasmatiques normales en fibrinogène sont comprises entre 1,5 à 4,5 g/l. Le seuil critique de fibrinogène plasmatique au-dessous duquel les hémorragies peuvent survenir est approximativement de 0,5 à 1,0 g/l. En cas d'intervention chirurgicale majeure, la surveillance étroite du traitement de substitution par des tests de coagulation est essentielle.
Dose initiale :
Si la concentration en fibrinogène du patient n'est pas connue, la dose recommandée est de 70 mg par kilogramme de poids corporel administrée par voie intraveineuse.
Dose suivante :
La concentration cible (1 g/l) pour des événements mineurs (par exemple épistaxis, saignement intramusculaire ou ménorragie) doit être maintenue pendant au moins trois jours. La concentration cible (1,5 g/l) pour des événements majeurs (par exemple traumatisme crânien ou hémorragie intracrânienne) doit être maintenue pendant sept jours.
|
Dose de fibrinogène = |
[Concentration cible (g/l) – Concentration mesurée (g/l)] |
|
(mg/kg de poids corporel) |
0,017 (g/l par mg/kg de poids corporel)
|
Posologie pour les nouveau-nés, les enfants en bas âge et les enfants :
Les données disponibles obtenues lors des études cliniques concernant les posologies de Riastap chez l’enfant sont limitées. Compte tenu de ces études et de la longue expérience clinique avec les spécialités contenant du fibrinogène, la posologie recommandée dans le traitement chez l’enfant est la même que celle chez l’adulte.
Mode d’administration
Injection ou perfusion intraveineuse.
RIASTAP doit être reconstitué selon les modalités décrites dans la rubrique 6.6. Avant administration, la solution reconstituée doit être amenée à la température ambiante ou corporelle, puis être injectée ou perfusée lentement à un débit confortable pour le patient. Le débit d'injection ou de perfusion ne doit pas dépasser approximativement 5 ml par minute.
Hypersensibilité à la substance active ou à l’un des excipients mentionnés à la rubrique 6.1.
4.4. Mises en garde spéciales et précautions d'emploi 
Chez les patients présentant des antécédents de maladie coronarienne ou d'infarctus du myocarde, les patients présentant une affection hépatique, les patients en situation péri- ou post opératoires, chez les nouveau-nés, les patients à risque thromboembolique ou de coagulation intravasculaire disséminée (CIVD), le bénéfice potentiel d’un traitement par un concentré de fibrinogène humain devra être évalué par rapport au risque de complications thromboemboliques. Une étroite surveillance devra également être mise en place.
En cas d’allergie ou de réaction anaphylactique, l’administration devra être immédiatement interrompue. En cas de choc anaphylactique, le traitement médical standard du choc devra être instauré.
Dans le cas de traitement de substitution avec des facteurs de coagulation dans d'autres insuffisances congénitales, la formation d'anticorps neutralisant a été observée, mais il n'existe actuellement aucune donnée dans le cas du fibrinogène.
RIASTAP contient jusqu’à 164 mg (7,1 mmol) de sodium par flacon, soit 11,5 mg (0,5 mmol) de sodium par kg de poids corporel chez un patient recevant la posologie initiale recommandée de 70 mg/kg de poids corporel. Ceci est à prendre en considération chez les patients suivant un régime hyposodé.
Sécurité virale
Les mesures habituelles de prévention du risque de transmission d’agents infectieux par les médicaments préparés à partir de sang ou de plasma humain comprennent la sélection clinique des donneurs, la recherche des marqueurs spécifiques d’infection sur chaque don et sur les mélanges de plasma ainsi que la mise en œuvre dans le procédé de fabrication d’étapes efficaces pour l’inactivation/élimination virale. Cependant, lorsque des médicaments préparés à partir de sang ou de plasma humain sont administrés, le risque de transmission d’agents infectieux ne peut pas être totalement exclu. Ceci s’applique également aux virus inconnus ou émergents ou d’autres types d’agents infectieux.
Les mesures prises sont considérées comme efficaces vis-à-vis des virus enveloppés tels que le VIH, le VHB et VHC ainsi que contre les virus non enveloppés comme le VHA et le parvovirus B19.
Une vaccination appropriée (hépatite A et B) doit être envisagée chez les patients recevant régulièrement ou de façon réitérée des produits dérivés du plasma humain.
Il est fortement recommandé que chaque fois que Riastap est administré à un patient, le nom et le numéro de lot du produit soient enregistrés afin de maintenir la traçabilité entre le patient et le lot du médicament.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions 
4.6. Fertilité, grossesse et allaitement 
Grossesse
Aucune étude de reproduction animale n’a été menée avec RIASTAP (voir rubrique 5.3). Compte tenu de l’origine humaine de la substance active, celle-ci est métabolisée de la même manière que les protéines propres au patient. S’agissant de constituants physiologiques du sang humain, aucun effet secondaire sur la reproduction ou le fœtus n’est attendu.
L’innocuité de RIASTAP au cours de la grossesse n’a pas été évaluée par des essais cliniques contrôlés.
L’expérience clinique acquise avec le concentré de fibrinogène dans le traitement des complications obstétricales indique qu’aucun effet nocif sur l’évolution de la grossesse, le développement du fœtus ou du nouveau-né n’est attendu.
On ne sait pas si RIASTAP est excrété dans le lait humain. L’utilisation de RIASTAP chez la femme allaitante n’a pas été évaluée par des essais cliniques.
Le risque de transmission à l’enfant allaité n’est pas exclu. La décision d’arrêter l’allaitement, ou d’arrêter ou de suspendre momentanément le traitement par RIASTAP doit prendre en compte le bénéfice de l’allaitement pour l’enfant et le bénéfice du traitement pour la mère.
Fertilité
Aucune donnée n’est disponible.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines 
Tableau résumant les effets indésirables
Ce tableau combine les effets indésirables observés dans les essais cliniques et l'expérience post-commercialisation. Les fréquences présentées dans le tableau ont été fondées sur des analyses regroupées de deux essais cliniques, promus par la firme et contrôlés par un placebo, réalisés en chirurgie aortique avec ou sans autres interventions chirurgicales [BI3023-2002 (n=61) et BI3023_3002 (n=152)], selon la convention suivante : très fréquent (≥1/10) ; fréquent (≥1/100 à <1/10) ; peu fréquent (≥1/1.000 à <1/100) ; rare (≥1/10.000 à <1/1.000) ; très rare (<1/10.000). Pour les effets indésirables spontanés post-commercialisation, la fréquence des rapports est classée comme indéterminée.
Compte tenu du fait que ces essais ont été réalisés uniquement sur la population étroite de la chirurgie aortique, les taux d’effets indésirables observés dans ces essais peuvent ne pas refléter les taux observés en pratique clinique et sont inconnus pour les paramètres cliniques en dehors de l’indication étudiée.
|
Classe des systèmes d’organe (SOC, MedDRA) |
Effets indésirables |
Fréquence (en chirurgie aortique avec ou sans d'autres interventions chirurgicales) |
|
Troubles généraux et au site d'administration |
Fièvre |
Très fréquent |
|
Troubles du système immunitaire |
Réaction anaphylactique (incluant le choc anaphylactique) |
Peu fréquent |
|
|
Réactions allergiques (y compris urticaire généralisée, éruption cutanée, dyspnée, tachycardie, nausées, vomissements, frissons, fièvre, douleurs à la poitrine, toux, diminution de la pression artérielle) |
Indéterminée |
|
Troubles vasculaires |
Evènements thromboemboliques* (voir la rubrique 4.4) |
Fréquent** |
* Des cas isolés ont été mortels.
** Basé sur les résultats de deux essais cliniques (chirurgie aortique avec ou sans autres procédures chirurgicales), le taux d'incidence globale des évènements thromboemboliques était plus faible chez les sujets traités par fibrinogène (n=8, 7,4%) par rapport au placebo (n=11, 10,4%).
Pour la sécurité relative aux agents transmissibles, voir la rubrique 4.4.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr.
En cas de surdosage, le risque de développer des complications thromboemboliques est augmenté.
5. PROPRIETES PHARMACOLOGIQUES 
5.1. Propriétés pharmacodynamiques 
Classe pharmacothérapeutique : Antihémorragique, fibrinogène humain, code ATC : B02BB01.
Le fibrinogène humain (facteur I de coagulation), en présence de thrombine, de facteur XIII activé et d’ions calcium, forme un caillot hémostatique de fibrine tridimensionnel, stable et élastique.
L'administration d’un concentré de fibrinogène humain génère une augmentation de la concentration en fibrinogène plasmatique circulant et peut temporairement corriger le défaut de coagulation des patients déficients en fibrinogène.
L’étude pivot de phase II a évalué la pharmacocinétique en dose unique (voir rubrique 5.2 Propriétés Pharmacocinétiques) et a également fourni des données d'efficacité par l’intermédiaire du critère de fermeté maximale du caillot (FMC) et des données de sécurité.
Pour chaque sujet, le FMC a été déterminé avant (valeur de référence) et une heure après l’administration d’une dose unique de 70 mg/kg de poids corporel de RIASTAP. RIASTAP s’est révélé efficace dans l’augmentation de la stabilité du caillot mesurée par thromboélastométrie chez des patients ayant un déficit congénital en fibrinogène (afibrinogénémie). L'efficacité hémostatique dans les épisodes de saignements aigus et sa corrélation avec le FMC sont en cours de vérification dans une étude post-marketing.
5.2. Propriétés pharmacocinétiques 
Le produit est administré par voie intraveineuse et est immédiatement disponible dans le plasma à une concentration correspondante à la posologie administrée.
Une étude pharmacocinétique a évalué la pharmacocinétique à dose unique avant et après l'administration de concentré humain de fibrinogène chez les sujets avec afibrinogénémie. Cette étude prospective, en ouvert, non contrôlée et multicentrique a inclus 5 femmes et 10 hommes âgés de 8 à 61 ans (2 enfants, 3 adolescents, 10 adultes). La dose médiane était de 77,0 mg/kg de poids corporel (intervalle compris entre 76,6 – 77,4 mg/kg).
Du sang a été prélevé chez 15 sujets (14 mesurables) pour déterminer l'activité de fibrinogène de base et jusqu'à 14 jours après la fin de la perfusion. En outre, la récupération incrémentale in vivo (RIV), définie comme l’augmentation maximale des concentrations plasmatiques en fibrinogène mesurée par mg/kg de poids corporel a été déterminée par paliers jusqu'à 4 heures après la perfusion. La récupération incrémentale in vivo médiane était de 1,7 (intervalle compris entre 1,30-2,73) mg/dl par mg/kg de poids corporel. Le tableau suivant fournit les résultats pharmacocinétiques.
Résultats pharmacocinétiques pour l’activité du fibrinogène
|
Paramètre (n=14) |
Moyenne ± SD |
Médiane (intervalle) |
|
t1/2 [h] |
78,7 ± 18,13 |
77,1 (55,73-117,26) |
|
Cmax [g/l] |
1,4 ± 0,27 |
1,3 (1,00-2,10) |
|
ASC par dose de 70 mg/kg [h•mg/ml] |
124,3 ± 24,16 |
126,8 (81,73-156,40) |
|
Partie extrapolée d’ASC [%] |
8,4 ± 1,72 |
7,8 (6,13-12,14) |
|
Cl [ml/h/kg] |
0,59 ± 0,13 |
0,55 (0,45-0,86) |
|
TMR [h] |
92,8 ± 20,11 |
85,9 (66,14-126,44) |
|
Vss [ml/kg] |
52,7 ± 7,48 |
52,7 (36,22-67,67) |
|
RIV [mg/dl par mg/kg de poids corporel] |
1,8 ± 0,35 |
1,7 (1,30-2,73) |
t1/2 = demi-vie terminale d'élimination
h = heure
Cmax = concentration maximale dans un délai de 4 heures
ASC = aire sous la courbe
Cl = clairance
TMR = temps moyen résiduel
Vss = volume de distribution à l’état d’équilibre
SD = Ecart type
RIV = récupération in vivo
5.3. Données de sécurité préclinique 
Des études précliniques par administrations répétées (toxicité chronique, cancérogénicité et mutagénicité) ne peuvent pas être convenablement réalisées dans les modèles animaux conventionnels du fait du développement d’anticorps lors de l'administration des protéines humaines hétérologues.
La stabilité physico-chimique du produit reconstitué a été démontrée pendant 8 heures à température ambiante (max. + 25 °C). D’un point de vue microbiologique, le produit doit être utilisé immédiatement après reconstitution. Cependant, si le produit n’est pas administré immédiatement, la durée de conservation ne doit pas dépasser 8 heures à température ambiante (max. + 25 °C). La solution reconstituée ne doit pas être conservée au réfrigérateur.
6.4. Précautions particulières de conservation 
À conserver à une température ne dépassant pas 25°C.
Ne pas congeler.
Conserver le flacon dans l'emballage extérieur à l'abri de la lumière.
Pour les conditions de conservation du médicament après reconstitution, voir la rubrique 6.3.
6.5. Nature et contenu de l'emballage extérieur 
Flacon (verre type II, incolore) muni d’un bouchon sans latex (caoutchouc bromobutyle), serti d’une capsule en aluminium surmontée d’un disque en plastique.
Boîte de 1 g (Figure 1)
1. Un flacon contenant 1 g de fibrinogène humain
2. Filtre : Filtre seringue Pall®
3. Dispositif de prélèvement : dispositif de prélèvement Mini-Spike®
 Figure 1
Figure 1
6.6. Précautions particulières d’élimination et de manipulation 
Instructions générales
· La reconstitution et le prélèvement doivent être effectués en conditions aseptiques.
· Les produits reconstitués doivent être inspectés visuellement avant administration pour mettre en évidence la présence éventuelle de particules ou un changement de coloration.
· La solution est incolore à jaunâtre, claire à légèrement opalescente et de pH neutre. N’utilisez pas de solution trouble ou contenant des dépôts.
Reconstitution
· Amener le flacon de solvant et celui de poudre non ouverts à la température de la pièce ou à la température corporelle (ne pas dépasser +37°C).
· RIASTAP doit être reconstitué avec de l’eau pour préparations injectables (50 ml, non fourni).
· Se laver les mains ou mettre des gants avant de reconstituer le produit.
· Retirer la capsule protectrice du flacon de RIASTAP pour découvrir la partie centrale du bouchon de perfusion.
· Nettoyer la surface du bouchon de perfusion avec une solution antiseptique et laisser sécher.
· Transférer le solvant dans le flacon à l’aide d’un dispositif de transfert approprié. S’assurer de l'imprégnation complète de la poudre.
· Remuer le flacon avec un léger mouvement de rotation jusqu'à dissolution complète de la poudre et obtention de la solution prête à administrer. Eviter de secouer le flacon car cela pourrait générer l’apparition de mousse. Généralement, la poudre se dissout en 5 minutes environ. Cela ne devrait pas prendre plus de 15 minutes pour se dissoudre complétement.
· Ouvrir le blister en plastique contenant le dispositif de prélèvement (dispositif de prélèvement Mini-Spike®) fourni avec RIASTAP (Figure 2).
 Figure 2
Figure 2
· Prendre le dispositif de prélèvement fourni et l’insérer dans le bouchon du flacon contenant le produit reconstitué (Figure 3).
 Figure 3
Figure 3
· Après avoir inséré le dispositif de prélèvement, retirer le capuchon. Après avoir retiré le capuchon, ne pas toucher la surface exposée.
· Ouvrir le blister du filtre (Filtre seringue Pall®) fourni avec RIASTAP (Figure 4).
 Figure 4
Figure 4
· Visser la seringue sur le filtre (Figure 5).
 Figure 5
Figure 5
· Visser la seringue avec le filtre sur le dispositif de prélèvement (Figure 6).
 Figure 6
Figure 6
· Aspirer le produit reconstitué dans la seringue (Figure 7).
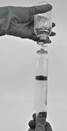 Figure 7
Figure 7
· Une fois terminé, retirer le filtre, le dispositif de prélèvement et le flacon vide de la seringue, les jeter selon la réglementation en vigueur et procéder à l’administration comme d’habitude.
· Le produit reconstitué doit être administré immédiatement par une ligne séparée d’injection / de perfusion.
· Eviter que du sang ne pénètre dans les seringues remplies de produit.
Tout produit non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE 
EMIL-VON-BEHRING-STRASSE 76
35041 MARBURG
ALLEMAGNE
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE 
· 34009 494 884 2 1 : Flacon (verre type II, incolore) muni d’un bouchon sans latex (caoutchouc bromobutyle), serti d’une capsule en aluminium surmontée d’un disque en plastique. Boîte contenant 1 flacon, 1 filtre et 1 dispositif de prélèvement.
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION 
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE 
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES 
Liste I
Médicament soumis à prescription hospitalière.
|
| Plan du site | Accessibilité | Contact | Téléchargement | Declaration de confidentialité | Service-Public.fr | Legifrance | Gouvernement.fr |