Dernière mise à jour le 01/12/2025
FENTANYL TEVA SANTE 75 microgrammes/heure, dispositif transdermique
Indications thérapeutiques
Le nom de votre médicament est FENTANYL TEVA SANTE.
Les dispositifs transdermiques aident à soulager les douleurs très fortes et de longue durée :
· chez les adultes qui ont besoin d’un traitement continu de la douleur
· chez les enfants à partir de l’âge de 2 ans qui ont déjà reçu des médicaments opioïdes et qui ont besoin d’un traitement continu de la douleur.
FENTANYL TEVA SANTE contient un médicament appelé fentanyl. Il appartient à la classe des opioïdes, des anti-douleurs puissants.
Présentations
> 5 sachet(s) papier adhésif, polyéthylène, polymère, aluminium, ionomère avec fermeture de sécurité enfant de 1 dispositif(s)
Code CIP : 275 611-0 ou 34009 275 611 0 8
Déclaration de commercialisation : 22/07/2014
Cette présentation est agréée aux collectivités
- Prix hors honoraire de dispensation : 27,02 €
- Honoraire de dispensation : 1,02 €
- Prix honoraire compris : 28,04 €
- Taux de remboursement :65%
Documents de bon usage du médicament
- Prévenir le risque de surdose d’opioïdes
Auteur : Haute autorité de santé
Type : Fiche Bon Usage du Médicament
Date de mise à jour :Avril 2023
- Les médicaments des accès douloureux paroxystiques du cancer
Auteur : Haute autorité de santé
Type : Fiche Bon Usage du Médicament
Date de mise à jour :Juin 2014
Service médical rendu (SMR)
Amélioration du service médical rendu (ASMR)
Ce médicament étant un générique, l'ASMR n'a pas été évalué par la commission de la transparence (CT), il est possible de se référer à la /aux spécialité(s) de référence du groupe générique auquel appartient ce médicament (cliquez ici pour aller à la rubrique des groupes génériques)
Autres informations
- Titulaire de l'autorisation : TEVA SANTE
- Conditions de prescription et de délivrance :
- délivrance fractionnée de 14 jours
- médicament soumis à prescription médicale restreinte
- prescription en toutes lettres sur ordonnance sécurisée
- prescription limitée à 4 semaines
- stupéfiants
- Statut de l'autorisation : Valide
- Type de procédure : Procédure de reconnaissance mutuelle
- Code CIS : 6 117 082 5
ANSM - Mis à jour le : 24/10/2025
Fentanyl Teva Sante 75 microgrammes/heure, dispositif transdermique
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Fentanyl.......................................................................................................................... 12,375 mg
Pour un dispositif de 22,5 cm2 libérant 75 microgrammes de fentanyl par heure.
Pour la liste complète des excipients, voir rubrique 6.1.
Dispositif transdermique.
Dispositif transparent et incolore avec la mention « fentanyl 75 µg/h » en bleu sur le support protecteur.
4.1. Indications thérapeutiques
Adultes
FENTANYL TEVA SANTE est indiqué dans le traitement des douleurs chroniques sévères qui nécessitent une administration continue au long cours d’opioïdes.
Enfants
Traitement au long cours des douleurs chroniques sévères chez les enfants à partir de 2 ans recevant un traitement par opioïdes.
4.2. Posologie et mode d'administration
Posologie
La dose de FENTANYL TEVA SANTE est à ajuster individuellement selon l’état du patient et doit être évaluée à intervalles réguliers après l’application. La dose efficace minimale doit être utilisée. Les dispositifs sont destinés à délivrer approximativement 12, 25, 50, 75 ou 100 microgrammes de fentanyl par heure dans la circulation systémique, ce qui représente respectivement environ 0,3 ; 0,6 ; 1,2 ; 1,8 et 2,4 mg de fentanyl par jour.
Détermination de la posologie initiale
Le choix de la dose initiale optimale de FENTANYL TEVA SANTE doit être basé sur le traitement opioïde actuel du patient. Il est recommandé que FENTANYL TEVA SANTE soit utilisé chez les patients ayant démontré une tolérance aux opioïdes.
D’autres facteurs sont à prendre en compte, tels que l’état général actuel et l’état de santé du patient, incluant la corpulence, l’âge, le degré de sévérité de la maladie ainsi que le degré de tolérance aux opioïdes.
Chez l’adulte
Patients tolérants aux opioïdes
Pour remplacer un traitement par opioïdes oraux ou parentéraux par un traitement par FENTANYL TEVA SANTE chez les patients tolérants aux opioïdes, se référer à la conversion des doses équi-analgésiques ci-dessous. Si nécessaire, la posologie peut par la suite être augmentée ou diminuée par paliers de 12 ou 25 microgrammes/heure afin d’atteindre la posologie minimale optimale de FENTANYL TEVA SANTE en tenant compte de la réponse au traitement et des besoins en analgésiques supplémentaires.
Patients naïfs d’opioïdes
En général, la voie transdermique n’est pas recommandée chez les patients naïfs d’opioïdes. D’autres voies d’administration (orale, parentérale) doivent être envisagées. Afin d’éviter un surdosage, il est recommandé que les patients naïfs d’opioïdes reçoivent de faibles doses d’opioïdes à libération immédiate (tels que la morphine, l’hydromorphone, l’oxycodone, le tramadol et la codéine) à ajuster jusqu’à atteindre une dose analgésique équivalente à une dose de FENTANYL TEVA SANTE de 12 ou 25 microgrammes/heure. Après quoi les patients peuvent changer de traitement pour FENTANYL TEVA SANTE.
Dans le cas où il n’est pas possible de débuter par des opioïdes par voie orale et où FENTANYL TEVA SANTE représente la seule option de traitement appropriée chez les patients naïfs d’opioïdes, seule l’utilisation de la dose initiale la plus faible (12 microgrammes/heure) est envisageable. Dans ce cas, le patient doit être étroitement surveillé. Il existe un risque d’hypoventilation grave ou potentiellement fatal même si la plus faible dose de FENTANYL TEVA SANTE est utilisée pour l’initiation du traitement chez les patients naïfs d’opioïdes (voir rubriques 4.4 et 4.9).
Conversion des doses équi-analgésiques
Chez les patients actuellement traités par des analgésiques opioïdes, la dose initiale de FENTANYL TEVA SANTE doit être fonction de la dose journalière du précédent opioïde. Pour calculer la dose initiale optimale de FENTANYL TEVA SANTE, il convient de suivre les étapes ci-dessous.
1. Calculer la dose par 24 heures (mg/jour) de l’opioïde actuellement administré.
2. Convertir la quantité ainsi obtenue en dose équi-analgésique de morphine orale par 24 heures à l’aide des facteurs de multiplication du tableau 1 pour la voie d’administration appropriée.
3. Afin d’obtenir le dosage de FENTANYL TEVA SANTE correspondant à la dose équi-analgésique calculée de morphine par 24 heures, utiliser les tableaux 2 ou 3 de conversion des doses comme suit :
a. le tableau 2 est destiné aux patients adultes nécessitant une rotation des opioïdes ou cliniquement moins stables (le rapport de conversion de la morphine orale au fentanyl transdermique est d’environ 150:1)
b. le tableau 3 est destiné aux patients adultes dont le traitement par opioïde est stable et bien toléré (le rapport de conversion de la morphine orale au fentanyl transdermique est d’environ 100:1)
Tableau 1 : Tableau de conversion – Facteurs de multiplication pour la conversion de la dose journalière des opioïdes précédents en dose équi-analgésique de morphine orale par 24 heures (mg/jour de l’opioïde précédent x Facteur = dose équi-analgésique de morphine orale par 24 heures)
|
Voie d’administration |
Facteur de multiplication |
|
|
morphine |
orale |
1a |
|
parentérale |
3 |
|
|
buprénorphine |
sublinguale |
75 |
|
parentérale |
100 |
|
|
codéine |
orale |
0,15 |
|
parentérale |
0,23b |
|
|
diamorphine |
orale |
0,5 |
|
parentérale |
6b |
|
|
fentanyl |
orale |
- |
|
parentérale |
300 |
|
|
hydromorphone |
orale |
4 |
|
parentérale |
20b |
|
|
kétobémidone |
orale |
1 |
|
parentérale |
3 |
|
|
lévorphanol |
orale |
7,5 |
|
parentérale |
15b |
|
|
méthadone |
orale |
1,5 |
|
parentérale |
3b |
|
|
oxycodone |
orale |
1,5 |
|
parentérale |
3 |
|
|
oxymorphone |
rectale |
3 |
|
parentérale |
30b |
|
|
péthidine |
orale |
- |
|
parentérale |
0,4b |
|
|
tapentadol |
orale |
0,4 |
|
parentérale |
- |
|
|
tramadol |
orale |
0,25 |
|
parentérale |
0,3 |
a La puissance de la morphine par voie orale/IM est basée sur l’expérience clinique chez les patients présentant une douleur chronique.
b Basé sur des études à dose unique dans lesquelles une dose en IM de chaque substance active listée a été comparée à la morphine pour établir la puissance relative. Les doses orales sont celles recommandées lors du passage d’une voie parentérale à une voie orale.
Référence : Adapté de 1) Foley KM. The treatment of cancer pain. NEJM 1985; 313 (2): 84-95 et 2) McPherson ML. Introduction to opioid conversion calculations. Dans : Demystifying Opioid Conversion Calculations: A Guide for Effective Dosing. Bethesda, MD: American Society of Health-System Pharmacists; 2010:1-15.
|
Tableau 2 : Dose initiale recommandée de FENTANYL TEVA SANTE en fonction de la dose orale journalière de morphine (pour des patients nécessitant une rotation des opioïdes ou cliniquement moins stables : rapport de conversion de la morphine orale au fentanyl transdermique d’environ 150:1)1 |
||
|
Dose orale de morphine par 24 heures (mg/jour) |
Dosage de FENTANYL TEVA SANTE (mcg/h) |
|
|
< 90 |
12 |
|
|
90-134 |
25 |
|
|
135-224 |
50 |
|
|
225-314 |
75 |
|
|
315-404 |
100 |
|
|
405-494 |
125 |
|
|
495-584 |
150 |
|
|
585-674 |
175 |
|
|
675-764 |
200 |
|
|
765-854 |
225 |
|
|
855-944 |
250 |
|
|
945-1034 |
275 |
|
|
1035-1124 |
300 |
|
|
1 Dans les études cliniques, ces intervalles de doses orales de morphine étaient utilisés comme base pour la conversion en FENTANYL TEVA SANTE.
|
||
|
Tableau 3 : Dose initiale recommandée de FENTANYL TEVA SANTE en fonction de la dose orale journalière de morphine (pour des patients dont le traitement par opioïde est stable et bien toléré : rapport de conversion de la morphine orale au fentanyl transdermique d’environ 100:1) |
||
|
Dose orale de morphine par 24 heures (mg/jour) |
Dosage de FENTANYL TEVA SANTE (mcg/h) |
|
|
≤ 44 |
12 |
|
|
45-89 |
25 |
|
|
90-149 |
50 |
|
|
150-209 |
75 |
|
|
210-269 |
100 |
|
|
270-329 |
125 |
|
|
330-389 |
150 |
|
|
390-449 |
175 |
|
|
450-509 |
200 |
|
|
510-569 |
225 |
|
|
570-629 |
250 |
|
|
630-689 |
275 |
|
|
690-749 |
300 |
|
L’évaluation initiale de l’effet analgésique maximal de FENTANYL TEVA SANTE doit être réalisée avant 24 heures de pose du dispositif. En effet, les concentrations sériques de fentanyl augmentent progressivement pendant les 24 premières heures suivant la pose du premier dispositif.
Par conséquent, le traitement analgésique précédent doit être progressivement arrêté après l’administration de la première dose, jusqu’à ce que l’efficacité analgésique de FENTANYL TEVA SANTE soit atteinte.
Ajustement de la dose et traitement d’entretien
Le dispositif de FENTANYL TEVA SANTE doit être remplacé toutes les 72 heures.
La dose doit être ajustée au cas par cas en fonction de l’utilisation moyenne quotidienne d’analgésiques supplémentaires jusqu’à ce qu’un équilibre entre efficacité analgésique et tolérance soit atteint. Normalement, les adaptations posologiques doivent être effectuées par paliers de 12 ou de 25 microgrammes/heure, bien qu’il faille tenir compte des besoins en analgésiques supplémentaires (morphine orale 45 ou 90 mg/jour équivalant à FENTANYL TEVA SANTE 12 ou 25 microgrammes/heure) et de l’intensité de la douleur du patient. Après une augmentation de la dose, il peut s’écouler jusqu’à 6 jours pour que le patient atteigne l’équilibre à la nouvelle dose. Par conséquent, après une augmentation de la dose, les patients doivent porter le dispositif à la dose augmentée pendant deux périodes de 72 heures avant d’effectuer une autre augmentation de dose.
Il est possible d’utiliser plus d’un dispositif de FENTANYL TEVA SANTE pour des doses supérieures à 100 microgrammes/heure. Les patients peuvent avoir périodiquement besoin de doses supplémentaires d’un analgésique à courte durée d’action, en cas de douleur paroxystique. Certains patients peuvent avoir besoin de méthodes d’administration d’opioïdes supplémentaires ou différentes quand la dose de FENTANYL TEVA SANTE dépasse 300 microgrammes/heure.
Uniquement lors de la première application, si l’effet analgésique est insuffisant, le dispositif de FENTANYL TEVA SANTE peut être remplacé au bout de 48 heures par un dispositif de la même dose, ou la dose peut être augmentée après 72 heures.
Si le dispositif doit être remplacé (notamment si le dispositif se décolle) avant les 72 heures, un dispositif du même dosage doit être appliqué sur une zone différente de la peau. Une telle situation peut entraîner une augmentation des concentrations sériques (voir rubrique 5.2) et le patient doit être étroitement surveillé.
Durée et objectifs du traitement
Avant l’instauration du traitement par FENTANYL TEVA SANTE, une stratégie thérapeutique comprenant la durée et les objectifs du traitement, ainsi qu'un plan de fin de traitement, doivent être convenus avec le patient, conformément aux directives relatives à la prise en charge de la douleur. Au cours du traitement, le médecin et le patient doivent se contacter fréquemment afin d'évaluer la nécessité de poursuivre le traitement, d'envisager son arrêt et d’adapter les doses si nécessaire. En l’absence de contrôle adéquat de la douleur, la possibilité d'une hyperalgésie, d'une tolérance et d'une progression de la maladie sous-jacente doit être envisagée (voir rubrique 4.4).
Arrêt de FENTANYL TEVA SANTE
S’il s’avère nécessaire d’arrêter le traitement par FENTANYL TEVA SANTE, le remplacement par d’autres opioïdes doit être progressif, en commençant par une dose faible puis en augmentant progressivement les doses. En effet, les concentrations de fentanyl diminuent progressivement après le retrait du dispositif de FENTANYL TEVA SANTE. Il faut au moins 20 heures pour que les concentrations sériques de fentanyl diminuent de 50 %. En règle générale, il faut arrêter progressivement le traitement analgésique opioïde afin d’éviter des symptômes de sevrage (voir rubriques 4.4 et 4.8). Il a été rapporté qu’un arrêt brutal des analgésiques opioïdes chez des patients physiquement dépendants aux opioïdes a conduit à des symptômes de sevrage significatifs et à une douleur non contrôlée. La diminution de la dose doit se baser sur la dose individuelle, sur la durée du traitement et sur la réponse du patient en matière de douleur et de symptômes de sevrage. Chez les patients sous traitement à long terme, une diminution plus progressive peut être nécessaire. Chez les patients dont le traitement a été de courte durée, une diminution plus rapide peut être envisagée.
Les symptômes de sevrage des opioïdes sont possibles chez certains patients après une conversion ou une adaptation de dose.
Les tableaux 1, 2 et 3 doivent seulement être utilisés pour le passage d’autres opioïdes à FENTANYL TEVA SANTE et non pour le passage de FENTANYL TEVA SANTE à d’autres traitements afin d’éviter de surestimer la nouvelle dose analgésique et d’entraîner un risque de surdosage.
Populations particulières
Patients âgés
Les patients âgés doivent être étroitement surveillés et la dose doit être ajustée individuellement en fonction de l’état du patient (voir rubriques 4.4 et 5.2).
Chez les patients âgés naïfs d’opioïdes, le traitement doit seulement être envisagé lorsque les bénéfices sont supérieurs aux risques. Dans ces cas, seul FENTANYL TEVA SANTE 12 microgrammes/heure doit être utilisé pour initier le traitement.
Insuffisance rénale et hépatique
En cas d’insuffisance hépatique ou rénale, une surveillance étroite est nécessaire et la dose doit être ajustée individuellement en fonction de l’état du patient (voir rubriques 4.4 et 5.2).
Chez les patients naïfs d’opioïdes atteints d’une insuffisance rénale ou hépatique, le traitement doit seulement être envisagé lorsque les bénéfices sont supérieurs aux risques. Dans ces cas, seul FENTANYL TEVA SANTE 12 microgrammes/heure doit être utilisé pour initier le traitement.
Population pédiatrique
Enfants âgés de 16 ans et plus
Se reporter à la posologie chez l’adulte.
Enfants âgés de 2 à 16 ans
FENTANYL TEVA SANTE doit être administré uniquement aux enfants (âgés de 2 à 16 ans) tolérants aux opioïdes et recevant une dose équivalente à au moins 30 mg de morphine orale par jour. Pour calculer la dose de FENTANYL TEVA SANTE à administrer chez les enfants à partir d’opioïdes par voie orale ou parentérale, se référer à la conversion des doses équi-analgésiques (Tableau 1) et à la dose de FENTANYL TEVA SANTE recommandée en fonction de la dose journalière de morphine orale (Tableau 4).
|
Tableau 4 : Dose de FENTANYL TEVA SANTE recommandée chez les enfants1 en fonction de la dose journalière de morphine orale2 |
|
|
Dose de morphine orale par 24 heures (mg/jour) |
Dosage de FENTANYL TEVA SANTE (mcg/h) |
|
30-44 |
12 |
|
45-134 |
25 |
1 La conversion à des dosages de FENTANYL TEVA SANTE supérieurs à 25 microgrammes/heure est la même pour les enfants et les adultes (voir Tableau 2).
2 Dans les études cliniques, ces intervalles de dose journalière de morphine orale ont été utilisés comme base de conversion à FENTANYL TEVA SANTE.
Dans deux études pédiatriques, la dose nécessaire de fentanyl par voie transdermique a été calculée de façon prudente : 30 mg à 44 mg de morphine orale par jour ou une dose équivalente d’opioïde ont été remplacés par un dispositif transdermique de FENTANYL TEVA SANTE 12 microgrammes/heure. Cette table de conversion chez l’enfant s’applique qu’au passage de la morphine orale (ou son équivalent) à FENTANYL TEVA SANTE, dispositif transdermique. La table de conversion ne doit pas être utilisée pour le passage d'un traitement par FENTANYL TEVA SANTE à d’autres opioïdes en raison d’un risque de surdosage.
L'effet analgésique de la première dose de FENTANYL TEVA SANTE n'est pas optimal pendant les 24 premières heures. C’est pourquoi il est recommandé de poursuivre à doses régulières les analgésiques antérieurement utilisés pendant les 12 heures suivant le remplacement par FENTANYL TEVA SANTE. Pendant les 12 heures suivantes, ces analgésiques pourront être utilisés en fonction du besoin clinique.
Une surveillance des effets indésirables du patient, pouvant inclure une hypoventilation, est recommandée pendant au moins 48 heures après l’initiation du traitement par FENTANYL TEVA SANTE ou après une augmentation de la dose (voir rubrique 4.4).
FENTANYL TEVA SANTE ne doit pas être utilisé chez les enfants âgés de moins de 2 ans car la sécurité et l’efficacité n’ont pas été établies.
Ajustement de la dose et traitement d’entretien chez les enfants
Le dispositif de FENTANYL TEVA SANTE doit être remplacé toutes les 72 heures. La dose doit être ajustée au cas par cas jusqu’à ce qu’un équilibre entre efficacité analgésique et tolérance soit atteint. La posologie ne doit pas être augmentée par paliers de moins de 72 heures. En cas d’effet analgésique insuffisant de FENTANYL TEVA SANTE, il peut être nécessaire d’administrer des doses supplémentaires de morphine ou d’un autre opioïde à courte durée d’action. En fonction des besoins analgésiques supplémentaires et de l’état douloureux de l’enfant, il peut être nécessaire d’augmenter la dose. Les adaptations posologiques doivent être réalisées par paliers de 12 microgrammes/heure.
Mode d’administration
FENTANYL TEVA SANTE est à usage transdermique.
FENTANYL TEVA SANTE doit être appliqué sur une peau non irritée et non irradiée, sur une partie plane du haut du corps ou sur la partie supérieure du bras.
Chez les jeunes enfants, la partie supérieure du dos est l’emplacement privilégié afin d’éviter que l’enfant retire le dispositif.
Les poils sur le site d’application doivent être coupés (et non rasés) avant l’application (une région glabre de la peau est préférable). Si le site d’application de FENTANYL TEVA SANTE nécessite un nettoyage préalable à l’application du dispositif, il convient de le faire avec de l’eau propre. Les savons, huiles, lotions ou tout autre agent susceptible d’irriter la peau ou d’en altérer ses caractéristiques ne doivent pas être utilisés. La peau doit être parfaitement sèche avant d’appliquer le dispositif. Les dispositifs doivent être examinés avec attention avant utilisation. Tout dispositif découpé ou endommagé de quelque façon que ce soit ne doit pas être utilisé.
< Sachets sans sécurité enfant >
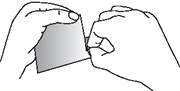
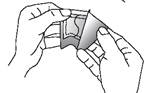
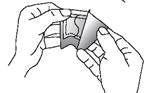
FENTANYL TEVA SANTE doit être appliqué immédiatement après avoir extrait le dispositif de l’emballage scellé. Pour enlever le dispositif de son sachet protecteur, repérer l’encoche pré-découpée située au bord du scellage. Plier le sachet au niveau de l’encoche puis déchirer soigneusement le sachet. Puis ouvrir le sachet sur deux côtés en le dépliant comme un livre. La pellicule protectrice du dispositif est découpée. Plier le dispositif au centre et retirer séparément chaque moitié de la pellicule. Eviter de toucher le côté adhésif du dispositif.
Appliquer le dispositif sur la peau en appuyant légèrement avec la paume de la main pendant environ 30 secondes. S’assurer que les bordures du dispositif adhèrent correctement. Se laver ensuite les mains à l’eau propre.
< Sachets avec sécurité enfant >
FENTANYL TEVA SANTE doit être appliqué immédiatement après avoir extrait le dispositif de l’emballage scellé. Pour enlever le dispositif de son sachet protecteur, repérer les marques situées au bord du scellage. Découper soigneusement le sachet avec des ciseaux au niveau des marques. Puis ouvrir le sachet sur deux côtés en le dépliant comme un livre. La pellicule protectrice du dispositif est découpée. Plier le dispositif au centre et retirer séparément chaque moitié de la pellicule. Eviter de toucher le côté adhésif du dispositif. Appliquer le dispositif sur la peau en appuyant légèrement avec la paume de la main pendant environ 30 secondes. S’assurer que les bordures du dispositif adhèrent correctement. Se laver ensuite les mains à l’eau propre.
FENTANYL TEVA SANTE peut être porté pendant 72 heures consécutives. Après le retrait du précédent dispositif transdermique le nouveau dispositif doit être appliqué à un endroit différent. Attendre plusieurs jours avant d’appliquer un nouveau dispositif sur la même zone de la peau.
Hypersensibilité à la substance active ou à l’un des excipients mentionnés à la rubrique 6.1.
Douleur aiguë ou post-opératoire puisqu’il n’y a aucune possibilité de titration de la dose lors d’une utilisation de courte durée et qu’une hypoventilation grave ou potentiellement fatale pourrait en résulter.
Dépression respiratoire sévère.
4.4. Mises en garde spéciales et précautions d'emploi
Les patients ayant présenté des évènements indésirables graves doivent être surveillés pendant au moins 24 heures après le retrait de FENTANYL TEVA SANTE, ou plus, si les symptômes cliniques l’imposent du fait de la diminution progressive des concentrations sériques de fentanyl qui, 20 à 27 heures plus tard, sont réduites d’environ 50 %.
Les patients et leur personnel soignant doivent être informés que FENTANYL TEVA SANTE contient une quantité de substance active pouvant être fatale, notamment chez l’enfant. En conséquence, ils doivent conserver tous les dispositifs hors de la vue et de la portée des enfants, avant et après utilisation.
Ne pas découper les dispositifs de fentanyl. Tout dispositif découpé ou endommagé de quelque façon que ce soit ne doit pas être utilisé.
En raison des risques, notamment mortels, associés à une utilisation ou une ingestion accidentelle, un mésusage et à un usage abusif, les patients et leur personnel soignant doivent être informés de conserver FENTANYL TEVA SANTE dans un endroit sûr et sécurisé, inaccessible à d’autres personnes.
Patients naïfs d’opioïdes et intolérants aux opioïdes
L’utilisation de FENTANYL TEVA SANTE en initiation d’un traitement opioïde chez le patient naïf d’opioïdes a été associée à de très rares cas de dépression respiratoire importante et/ou fatale, particulièrement chez les patients présentant une douleur d’origine non cancéreuse. Le risque d’une hypoventilation grave ou fatale existe même si la plus faible dose de FENTANYL TEVA SANTE est utilisée en initiation du traitement chez les patients naïfs d’opioïdes, particulièrement chez les personnes âgées et les patients présentant une insuffisance hépatique ou rénale. La tendance à développer une tolérance varie de façon importante selon les individus. Il est recommandé d’utiliser FENTANYL TEVA SANTE chez des patients ayant démontré une tolérance aux opioïdes (voir rubrique 4.2).
Dépression respiratoire
Certains patients peuvent présenter une dépression respiratoire significative avec FENTANYL TEVA SANTE ; les patients doivent être surveillés à la recherche de cet effet. La dépression respiratoire peut persister après le retrait du dispositif de FENTANYL TEVA SANTE. L’incidence de la dépression respiratoire augmente avec l’augmentation de la dose de FENTANYL TEVA SANTE (voir rubrique 4.9).
Risque associé à l’utilisation concomitante de dépresseurs du système nerveux central (SNC), incluant les sédatifs tels que les benzodiazépines ou les médicaments apparentés, l’alcool et les médicaments narcotiques dépresseurs du SNC
L’utilisation concomitante de FENTANYL TEVA SANTE et de sédatifs tels que les benzodiazépines ou les médicaments apparentés, d’alcool ou de médicaments narcotiques dépresseurs du SNC, peut entraîner une sédation, une dépression respiratoire, un coma ou le décès. En raison de ces risques, la prescription concomitante de médicaments sédatifs doit être réservée aux patients ne disposant pas d’autres options thérapeutiques. Si la décision est prise de prescrire FENTANYL TEVA SANTE de façon concomitante avec des sédatifs, il convient d’utiliser la dose efficace la plus faible et la durée du traitement doit être aussi courte que possible.
Les patients doivent être suivis étroitement pour détecter des signes et symptômes éventuels de dépression respiratoire et de sédation. À ce sujet, il est fortement recommandé d’informer les patients et leurs soignants de faire attention à ces symptômes (voir rubrique 4.5).
Maladie pulmonaire chronique
FENTANYL TEVA SANTE peut entraîner des effets indésirables plus sévères chez les patients atteints d’une maladie pulmonaire chronique obstructive ou autre. Chez ces patients, les opioïdes peuvent diminuer l’activité respiratoire et augmenter la résistance des voies aériennes.
Effets du traitement à long terme et tolérance
Chez tous les patients, une tolérance aux effets des analgésiques, une hyperalgésie ainsi qu’une dépendance physique et psychique peuvent apparaître après l’administration répétée d’opioïdes, alors qu'une tolérance incomplète est développée pour certains effets indésirables comme la constipation induite par les opioïdes. Chez les patients présentant une douleur chronique d’origine non cancéreuse, en particulier, il a été rapporté qu’ils pouvaient ne pas ressentir une amélioration significative de l’intensité de la douleur lors d’un traitement opioïde continu au long cours. Au cours du traitement, le médecin et le patient doivent se contacter fréquemment afin d'évaluer la nécessité de poursuivre le traitement (voir rubrique 4.2). Lorsqu'il est décidé qu'il n'y a pas d'avantage à poursuivre le traitement, il convient de procéder à une réduction progressive pour remédier aux symptômes de sevrage.
Il a été rapporté qu’une diminution rapide de la dose de FENTANYL TEVA SANTE chez un patient physiquement dépendant aux opioïdes pouvait conduire à des symptômes de sevrage significatifs et à une douleur non contrôlée (voir rubrique 4.2 et rubrique 4.8). Lorsqu’un patient n’a plus besoin de traitement, il est recommandé de diminuer la dose progressivement afin de minimiser les risques de symptômes de sevrage. Une diminution à partir d’une dose élevée peut prendre des semaines, voire des mois.
Le syndrome de sevrage des opioïdes est caractérisé par une partie ou l’ensemble des symptômes suivants : impatiences, larmoiement, rhinorrhée, bâillements, transpiration, frissons, myalgie, mydriase et palpitations. D’autres symptômes pourraient également se développer, comme de l’irritabilité, de l’agitation, de l’anxiété, de l’hyperkinésie, des tremblements, une faiblesse, de l’insomnie, de l’anorexie, des crampes abdominales, des nausées, des vomissements, de la diarrhée ainsi qu’une pression artérielle augmentée, une fréquence respiratoire augmentée ou une fréquence cardiaque augmentée.
Trouble lié à l'utilisation d'opioïdes (abus et dépendance)
L'utilisation répétée de FENTANYL TEVA SANTE peut induire un trouble lié à l'utilisation des opioïdes (TUO). Une dose plus élevée et une durée plus longue d’un traitement par opioïdes peuvent augmenter le risque de développer un TUO. Un abus ou un mésusage intentionnel de FENTANYL TEVA SANTE peut entraîner un surdosage et/ou un décès. Le risque de développer un TUO est accru chez les patients ayant des antécédents personnels ou familiaux (parents ou frères et sœurs) de troubles liés à la consommation de substances (y compris ceux liés à la consommation abusive d'alcool), chez les fumeurs actifs ou chez les patients ayant des antécédents personnels d'autres troubles de la santé mentale (par exemple, dépression majeure, anxiété et troubles de la personnalité).
Avant l’instauration du traitement par FENTANYL TEVA SANTE et au cours du traitement, les objectifs du traitement et un plan d'arrêt doivent être convenus avec le patient (voir rubrique 4.2). Avant et pendant le traitement, le patient doit également être informé des risques et des signes de TUO. En cas d'apparition de ces signes, les patients doivent être invités à contacter leur médecin.
Les patients traités avec des opioïdes doivent être surveillés pour détecter des signes de TUO, tels que les comportements de recherche de médicaments (par exemple, demandes de renouvellement prématurées), en particulier chez les patients à risque accru. Cela inclut l'examen de la prise concomitante d’opioïdes et de psychotropes (comme les benzodiazépines). Pour les patients présentant des signes et des symptômes de TUO, il convient d'envisager une consultation chez un spécialiste en toxicomanie. En cas d'arrêt du traitement aux opioïdes, voir rubrique 4.4.
Troubles du Système Nerveux Central incluant l’augmentation de la pression intracrânienne
FENTANYL TEVA SANTE doit être utilisé avec prudence chez les patients qui peuvent être particulièrement sensibles aux effets intracrâniens de la rétention de CO2, par exemple les patients présentant des signes d’augmentation de la pression intracrânienne, une altération de la conscience ou les patients dans le coma. FENTANYL TEVA SANTE doit être utilisé avec prudence chez les patients présentant des tumeurs cérébrales.
Maladies cardiaques
Le fentanyl peut induire une bradycardie et doit donc être utilisé avec prudence chez les patients présentant des bradyarythmies.
Hypotension
Les opioïdes peuvent provoquer une hypotension, en particulier chez les patients présentant une hypovolémie sévère. Une hypotension et/ou une hypovolémie symptomatique sous-jacente doivent être corrigées avant l’initiation d’un traitement par fentanyl sous forme de dispositif transdermique.
Insuffisance hépatique
Le fentanyl est métabolisé en métabolites inactifs dans le foie, l’insuffisance hépatique peut retarder son élimination. Les patients présentant une insuffisance hépatique qui reçoivent FENTANYL TEVA SANTE doivent être surveillés attentivement pour détecter des signes de toxicité du fentanyl et la dose de FENTANYL TEVA SANTE doit être réduite si nécessaire (voir rubrique 5.2).
Insuffisance rénale
Bien qu’il ne soit pas attendu que l’insuffisance rénale modifie l’élimination du fentanyl de façon cliniquement significative, la prudence est recommandée car la pharmacocinétique du fentanyl n’a pas été évaluée chez cette population de patients (voir rubrique 5.2). Le traitement ne doit être envisagé que si les avantages l'emportent sur les risques. Les patients présentant une insuffisance rénale qui reçoivent FENTANYL TEVA SANTE doivent être surveillés attentivement pour détecter des signes de toxicité du fentanyl et la dose de FENTANYL TEVA SANTE doit être réduite si nécessaire. Des restrictions supplémentaires s’appliquent aux patients naïfs d’opioïdes présentant une insuffisance rénale (voir rubrique 4.2).
Fièvre/Exposition à la chaleur extérieure
Les concentrations du fentanyl peuvent augmenter si la température cutanée augmente (voir rubrique 5.2). En conséquence, les patients fébriles doivent être surveillés à la recherche d’effets indésirables des opioïdes et la dose de FENTANYL TEVA SANTE doit être adaptée si nécessaire. Il est possible que la libération du fentanyl à partir du dispositif soit augmentée par la température pouvant possiblement entraîner un surdosage et un décès.
Tous les patients doivent être informés d’éviter d’exposer le site d’application de FENTANYL TEVA SANTE à des sources de chaleur extérieures telles que les coussins chauffants, couvertures chauffantes, matelas d’eau chauffée, lampes solaires ou lampes bronzantes, bains de soleil, bouillotes, bains chauds prolongés, saunas et bains chauds à remous.
Syndrome sérotoninergique
La prudence est conseillée lorsque FENTANYL TEVA SANTE est co-administré avec des médicaments affectant les systèmes de neurotransmission sérotoninergique.
Le développement d’un syndrome sérotoninergique pouvant mettre en jeu le pronostic vital peut survenir lors de l’utilisation concomitante de substances actives sérotoninergiques telles que les Inhibiteurs Sélectifs de la Recapture de la Sérotonine (ISRS), les Inhibiteurs de la Recapture de la Sérotonine et de la Noradrénaline (IRSN), et avec les substances actives altérant le métabolisme de la sérotonine (incluant les Inhibiteurs de la Monoamine Oxydase [IMAO]). Cela peut se produire à la posologie recommandée (voir rubrique 4.5).
Le syndrome sérotoninergique peut inclure des modifications de l’état mental (par exemple : agitation, hallucinations, coma), une instabilité du système nerveux autonome (par exemple : tachycardie, pression artérielle instable, hyperthermie), des anomalies neuromusculaires (par exemple : hyperréflexie, incoordination, rigidité) et/ou des symptômes gastro-intestinaux (par exemple : nausées, vomissements, diarrhée).
Si un syndrome sérotoninergique est suspecté, le traitement par FENTANYL TEVA SANTE doit être arrêté.
Interactions avec d’autres médicaments
Inhibiteurs du CYP3A4
L’utilisation concomitante de FENTANYL TEVA SANTE avec des inhibiteurs du cytochrome P450 3A4 (CYP3A4) peut entraîner une augmentation des concentrations plasmatiques du fentanyl, ce qui peut augmenter ou prolonger à la fois les effets thérapeutiques et les effets indésirables, et provoquer une dépression respiratoire grave.
Par conséquent, l’utilisation concomitante de FENTANYL TEVA SANTE avec des inhibiteurs du CYP3A4 n’est pas recommandée à moins que les bénéfices soient supérieurs au risque accru d’effets indésirables. En général, un patient doit attendre 2 jours après l’arrêt d’un traitement par un inhibiteur du CYP3A4 avant d’appliquer le premier dispositif de FENTANYL TEVA SANTE. Cependant, la durée de l’inhibition varie et pour certains inhibiteurs du CYP3A4 avec une longue demi-vie d’élimination, tels que l’amiodarone, ou pour les inhibiteurs temps-dépendants tels que l’érythromycine, l’idélalisib, la nicardipine et le ritonavir, il peut être nécessaire d’attendre plus longtemps. Par conséquent, il est nécessaire de consulter l’information produit de l’inhibiteur du CYP3A4 concernant la demi-vie de la substance active et la durée de l’effet inhibiteur avant d’appliquer le premier dispositif de FENTANYL TEVA SANTE. Un patient traité par FENTANYL TEVA SANTE doit attendre au moins 1 semaine après le retrait du dernier dispositif avant d’initier un traitement par un inhibiteur du CYP3A4. Si l’utilisation concomitante de FENTANYL TEVA SANTE avec un inhibiteur du CYP3A4 ne peut être évitée, il est conseillé de surveiller attentivement l’apparition des signes ou symptômes d’une augmentation ou d’une prolongation des effets thérapeutiques et des effets indésirables du fentanyl (notamment une dépression respiratoire), et si nécessaire la dose de FENTANYL TEVA SANTE doit être réduite ou le traitement interrompu (voir rubrique 4.5).
Exposition accidentelle par transfert du dispositif transdermique
Un transfert accidentel du dispositif sur la peau d’une tierce personne non traitée (plus particulièrement un enfant) au cours du sommeil, ou lors de contacts physiques rapprochés avec une personne traitée peut entraîner un surdosage en opioïde chez cette personne non-traitée. Les patients doivent être informés qu’en cas d’exposition accidentelle, il est nécessaire de retirer immédiatement le dispositif transféré de la peau de la personne non traitée (voir rubrique 4.9).
Utilisation chez les personnes âgées
Les résultats des études menées après l’administration intraveineuse du fentanyl suggèrent que la clairance du produit peut être réduite et sa demi-vie prolongée chez les personnes âgées. En outre, les patients âgés risquent d’être plus sensibles à la substance active que les patients plus jeunes. Les patients âgés qui reçoivent FENTANYL TEVA SANTE doivent être surveillés attentivement pour détecter des signes de toxicité du fentanyl et la dose de FENTANYL TEVA SANTE doit être réduite, si nécessaire (voir rubrique 5.2).
Tractus gastro-intestinal
Les opioïdes augmentent le tonus et diminuent les contractions propulsives du muscle lisse du tractus gastro-intestinal. L’augmentation du temps du transit gastro-intestinal qui en résulte peut être responsable de l’effet de constipation du fentanyl. Les patients doivent être informés des mesures permettant de prévenir la constipation et un traitement laxatif prophylactique doit être envisagé. La plus grande prudence s’impose chez les patients souffrant de constipation chronique. Si un iléus paralytique est présent ou suspecté, le traitement par FENTANYL TEVA SANTE doit être arrêté.
Patients présentant une myasthénie grave
Des réactions (myo)cloniques non épileptiques peuvent survenir. La prudence s’impose lors du traitement des patients présentant une myasthénie grave.
Utilisation concomitante d’un mélange d’agonistes/antagonistes des opioïdes
L’utilisation concomitante de buprénorphine, nalbuphine ou pentazocine n’est pas recommandée (voir rubrique 4.5).
Population pédiatrique
FENTANYL TEVA SANTE ne doit pas être administré chez des enfants naïfs de traitement opioïde (voir rubrique 4.2). Il existe un risque d’hypoventilation grave ou potentiellement fatale quelle que soit la dose de FENTANYL TEVA SANTE dispositif transdermique administrée.
FENTANYL TEVA SANTE n’a pas été étudié chez l’enfant de moins de 2 ans. FENTANYL TEVA SANTE doit être administré uniquement aux enfants de 2 ans ou plus tolérants aux opioïdes (voir rubrique 4.2).
Afin de prévenir une utilisation ou une ingestion accidentelle par l’enfant, choisir avec prudence le site d’application de FENTANYL TEVA SANTE (voir rubriques 4.2 et 6.6) et vérifier attentivement la bonne adhésion du dispositif.
Hyperalgésie induite par les opioïdes
L’hyperalgésie induite par les opioïdes (HIO) est une réponse paradoxale à un opioïde, dans laquelle la perception de la douleur est accrue, malgré une exposition stable ou croissante à l’opioïde.
Elle se distingue de la tolérance, pour laquelle des doses plus importantes d’opioïdes sont nécessaires pour atteindre un effet analgésique identique ou pour traiter une douleur récurrente. L’HIO peut se manifester sous la forme d’une augmentation de la douleur, d’une douleur plus généralisée (c.-à-d. moins topique) ou d’une douleur provoquée par des stimuli ordinaires (c.-à-d. non douloureux ; allodynie) sans signe d’une progression de la maladie. En cas de suspicion d’HIO, la dose d’opioïde devra être réduite ou progressivement diminuée, si possible.
Dopage
L'utilisation des dispositifs transdermiques de fentanyl peut mener à un contrôle anti-dopage positif. L'utilisation des dispositifs transdermiques de fentanyl comme agent dopant peut être dangereuse pour la santé.
Effets endocriniens
Les opioïdes tels que le fentanyl peuvent avoir un effet sur les axes hypothalamo-hypophyso-surrénalien ou gonadique, en particulier après une utilisation à long terme. Les changements observés incluent notamment une augmentation de la prolactine sérique et une diminution des taux plasmatiques de cortisol et de testostérone. Ces changements hormonaux peuvent entraîner des signes et symptômes cliniques. Si un effet endocrinien tel qu'une hyperprolactinémie ou une insuffisance surrénalienne est suspecté, des tests de laboratoire appropriés sont recommandés et l'arrêt du traitement par FENTANYL TEVA SANTE doit être envisagé.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Interactions liées à la pharmacodynamique
Médicaments à action centrale/dépresseurs du système nerveux central (SNC), incluant l’alcool et les médicaments narcotiques dépresseurs du SNC
L'utilisation concomitante de FENTANYL TEVA SANTE avec d'autres dépresseurs du système nerveux central (incluant benzodiazépines et autres sédatifs/hypnotiques, opioïdes, anesthésiques généraux, phénothiazines, tranquillisants, antihistaminiques sédatifs, alcool et médicaments narcotiques dépresseurs du SNC), des relaxants musculo-squelettiques et des gabapentinoïdes (gabapentine et prégabaline) peut entraîner une dépression respiratoire, une hypotension, une sédation profonde, un coma ou un décès. La prescription concomitante de dépresseurs du SNC et de FENTANYL TEVA SANTE doit être réservée aux patients pour lesquels d'autres options de traitement ne sont pas possibles. L’utilisation d’un de ces médicaments avec FENTANYL TEVA SANTE nécessite une surveillance et une observation étroite du patient.
Inhibiteurs de la Monoamine Oxydase (IMAO)
L’utilisation de FENTANYL TEVA SANTE n’est pas recommandée chez les patients nécessitant une administration concomitante d’un IMAO. Des interactions sévères et imprévisibles avec les IMAO, comportant une potentialisation des effets opiacés ou des effets sérotoninergiques, ont été rapportées. Ainsi, FENTANYL TEVA SANTE ne doit pas être utilisé dans les 14 jours suivant l’arrêt d’un traitement par IMAO.
Médicaments sérotoninergiques
La co-administration de fentanyl avec un médicament sérotoninergique, tel qu’un Inhibiteur Sélectif de la Recapture de la Sérotonine (ISRS), un Inhibiteur de la Recapture de la Sérotonine et de la Noradrénaline (IRSN) ou un Inhibiteur de la Monoamine Oxydase (IMAO) peut augmenter le risque de syndrome sérotoninergique, pouvant mettre en jeu le pronostic vital. A utiliser avec prudence de manière concomitante. Garder le patient sous étroite surveillance, en particulier lors de l'instauration du traitement et de l'ajustement de la dose (voir rubrique 4.4).
Utilisation concomitante d’un mélange d’agonistes/antagonistes opioïdes
L’utilisation concomitante de buprénorphine, nalbuphine ou pentazocine n’est pas recommandée. Ces derniers présentent une forte affinité pour les récepteurs aux opioïdes avec une activité intrinsèque relativement faible. Par conséquent, ils antagonisent partiellement l’effet analgésique du fentanyl et peuvent induire des symptômes de sevrage chez les patients dépendants des opioïdes (voir rubrique 4.4).
Interactions liées à la pharmacocinétique
Inhibiteurs du cytochrome P450 3A4 (CYP3A4)
Le fentanyl, substance active ayant une clairance élevée, est rapidement et largement métabolisé, essentiellement par le CYP3A4.
L’utilisation concomitante de FENTANYL TEVA SANTE avec des inhibiteurs du cytochrome P450 3A4 (CYP3A4) peut entraîner une augmentation des concentrations plasmatiques du fentanyl, ce qui peut augmenter ou prolonger à la fois ses effets thérapeutiques et ses effets indésirables et provoquer une dépression respiratoire grave. Il est attendu que l’interaction avec les inhibiteurs puissants du CYP3A4 soit supérieure à l’interaction avec les inhibiteurs faibles ou modérés du CYP3A4. Des cas de dépression respiratoire grave après co-administration d’inhibiteurs du CYP3A4 avec du fentanyl transdermique ont été rapportés, incluant un cas mortel après une co-administration avec un inhibiteur modéré du CYP3A4.
L’utilisation concomitante de FENTANYL TEVA SANTE avec des inhibiteurs du CYP3A4 n’est pas recommandée à moins que le patient soit étroitement surveillé (voir rubrique 4.4). Des exemples de substances actives pouvant augmenter les concentrations de fentanyl incluent : amiodarone, cimétidine, clarithromycine, diltiazem, érythromycine, fluconazole, itraconazole, kétoconazole, néfazodone, ritonavir, vérapamil et voriconazole (cette liste n’est pas exhaustive). Après la co-administration d’inhibiteurs faibles, modérés ou sévères du CYP3A4 avec du fentanyl par voie intraveineuse administré sur une courte durée, les diminutions de la clairance du fentanyl étaient généralement ≤ 25 %. Cependant, avec le ritonavir (inhibiteur puissant du CYP3A4), la clairance du fentanyl a diminué en moyenne de 67 %. L’importance des interactions des inhibeurs du CYP3A4 en cas d’administration à long terme du fentanyl transdermique est inconnue, mais elle peut être supérieure à celle d’une administration intraveineuse de courte durée.
Inducteurs du cytochrome P450 3A4 (CYP3A4)
L’utilisation concomitante du fentanyl transdermique avec des inducteurs du CYP3A4 peut entraîner une diminution des concentrations plasmatiques du fentanyl et une diminution de l’effet thérapeutique. La prudence est conseillée lors d’une utilisation concomitante d’inducteurs du CYP3A4 et de FENTANYL TEVA SANTE. Il peut être nécessaire d’augmenter la dose de FENTANYL TEVA SANTE ou de changer pour une autre substance active analgésique. Une diminution de la dose de fentanyl et une surveillance particulière sont nécessaires en prévision de l’arrêt du traitement concomitant par un inducteur du CYP3A4. Les effets de l’inducteur diminuent progressivement et peuvent entraîner une augmentation des concentrations plasmatiques du fentanyl, ce qui peut augmenter ou prolonger à la fois ses effets thérapeutiques et ses effets indésirables, et provoquer une dépression respiratoire grave. Une surveillance étroite doit être maintenue jusqu’à ce que les effets du médicament soient stabilisés. Parmi les exemples de substances actives pouvant diminuer les concentrations plasmatiques du fentanyl : carbamazépine, phénobarbital, phénytoïne et rifampicine (cette liste n’est pas exhaustive).
Population pédiatrique
Les études d’interaction n’ont été réalisées que chez l’adulte.
4.6. Fertilité, grossesse et allaitement
Grossesse
Il n’existe pas de données suffisantes sur l’utilisation de FENTANYL TEVA SANTE chez la femme enceinte. Les études effectuées chez l’animal ont mis en évidence une toxicité sur la reproduction (voir rubrique 5.3). Le risque potentiel chez l’Homme n’est pas connu, bien qu’il ait été constaté que le fentanyl utilisé en tant qu’anesthésique par voie intraveineuse franchit la barrière placentaire chez les femmes enceintes. Un syndrome de sevrage néonatal a été rapporté chez des nouveau-nés dont les mères avaient reçu un traitement prolongé par FENTANYL TEVA SANTE durant la grossesse. FENTANYL TEVA SANTE ne doit pas être utilisé pendant la grossesse sauf en cas de nécessité absolue.
L’utilisation du FENTANYL TEVA SANTE pendant l’accouchement n’est pas recommandée car il ne doit pas être utilisé dans le traitement de la douleur aiguë ou postopératoire (voir rubrique 4.3). De plus, comme le fentanyl franchit la barrière placentaire, l’utilisation de FENTANYL TEVA SANTE pendant l’accouchement pourrait provoquer une dépression respiratoire chez le nouveau-né.
Allaitement
Le fentanyl est excrété dans le lait maternel et peut provoquer une sédation/dépression respiratoire chez le nourrisson allaité. L’allaitement doit donc être interrompu au cours du traitement par FENTANYL TEVA SANTE et pendant au moins 72 heures après le retrait du dispositif.
Fertilité
Il n’existe pas de données cliniques concernant les effets du fentanyl sur la fertilité. Des études chez le rat ont révélé une diminution de la fertilité et une augmentation de la mortalité embryonnaire à des doses toxiques pour la mère (voir rubrique 5.3).
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
FENTANYL TEVA SANTE peut altérer les capacités mentales et/ou physiques nécessaires à l’exécution de tâches potentiellement dangereuses telles que la conduite et l’utilisation des machines.
La sécurité d’emploi de FENTANYL TEVA SANTE a été évaluée chez 1 565 sujets adultes et 289 enfants ayant participé à 11 études cliniques (1 en double aveugle, contrôlée versus placebo ; 7 en ouvert, contrôlées par un médicament actif ; 3 en ouvert, non contrôlées) relatives au traitement de la douleur chronique d’origine cancéreuse ou non-cancéreuse. Ces sujets ont reçu au moins une dose de FENTANYL TEVA SANTE et ont permis de fournir des données de sécurité. Sur la base des données de sécurité combinées à partir de ces études cliniques, les effets indésirables les plus fréquemment rapportés (fréquence ≥ 10 %) étaient : nausées (35,7 %), vomissements (23,2 %), constipation (23,1 %), somnolence (15,0 %), sensations vertigineuses (13,1 %) et céphalées (11,8 %).
Les effets indésirables rapportés lors de l’utilisation du fentanyl transdermique à partir de ces études cliniques, incluant les effets indésirables mentionnés ci-dessus et ceux signalés après la commercialisation sont présentés dans le tableau 5.
Les catégories de fréquence sont définies de la manière suivante : très fréquent (≥ 1/10), fréquent (≥ 1/100, < 1/10), peu fréquent (≥ 1/1 000, < 1/100), rare (≥ 1/10 000, < 1/1 000), très rare (< 1/10 000), fréquence indéterminée (ne peut être estimée sur la base des données disponibles). Les effets indésirables sont listés par classe de systèmes d’organes suivant un ordre décroissant de gravité dans chaque catégorie de fréquence.
Tableau 5 : Effets indésirables chez les patients adultes et enfants
|
Classe de systèmes d’organes |
Catégorie de fréquence |
|||||
|
Très fréquent |
Fréquent |
|
Peu fréquent |
Rare |
Fréquence indéterminée |
|
|
Affections du système immunitaire |
|
Hypersensibilité |
|
|
|
Choc anaphylactique, réaction anaphylactique, réaction anaphylactoïde |
|
Affections endocriniennes |
|
|
|
|
|
Déficience androgénique |
|
Troubles du métabolisme et de la nutrition |
|
Anorexie |
|
|
|
|
|
Affections psychiatriques |
|
Insomnie, dépression, anxiété, état confusionnel, hallucinations |
Agitation, désorientation, humeur euphorique |
|
Dépendance, délire |
|
|
Affections du système nerveux |
Somnolence, sensations vertigineuses, céphalées |
Tremblements, paresthésie |
Hypoesthésie, convulsions (y compris crises cloniques et crises de grand mal), amnésie, diminution du niveau de conscience, perte de conscience |
|
|
|
|
Affections oculaires |
|
|
Vision floue |
Myosis |
|
|
|
Affections de l’oreille et du labyrinthe |
|
Vertiges |
|
|
|
|
|
Affections cardiaques |
|
Palpitations, tachycardie |
Bradycardie, cyanose |
|
|
|
|
Affections vasculaires |
|
Hypertension |
Hypotension |
|
|
|
|
Affections respiratoires, thoraciques et médiastinales |
|
Dyspnée |
Dépression respiratoire, détresse respiratoire |
Apnée, hypoventilation |
Bradypnée |
|
|
Affections gastro-intestinales |
Nausées, vomissements, constipation |
Diarrhées, sécheresse buccale, douleurs abdominales, douleurs abdominales hautes, dyspepsie |
Iléus, dysphagie |
Subiléus |
|
|
|
Affections de la peau et du tissu sous-cutané |
|
Hyperhidrose, prurit, éruption cutanée, érythème |
Eczéma, dermatite allergique, troubles cutanés, dermatite, dermatite de contact |
|
|
|
|
Affections musculo-squelettiques et systémiques |
|
Contractures musculaires |
Contractions musculaires |
|
|
|
|
Affections du rein et des voies urinaires |
|
Rétention urinaire |
|
|
|
|
|
Affections des organes de reproduction et du sein |
|
|
Dysfonctionnement érectile, dysfonctionnement sexuel |
|
|
|
|
Troubles généraux et anomalies au site d’administration |
|
Fatigue, œdème périphérique, asthénie, malaise, sensation de froid |
Réaction au site d’application, syndrome grippal, sensation de modification de température corporelle, hypersensibilité au site d’application, syndrome de sevrage, fièvre* |
Dermatite au site d’application, eczéma au site d’application |
Tolérance médicamenteuse |
|
* la fréquence assignée (peu fréquent) est fonction des analyses de fréquence incluant seulement les sujets adultes et enfants des études cliniques présentant une douleur d’origine non-cancéreuse.
Population pédiatrique
La sécurité d’emploi du fentanyl transdermique a été évaluée chez 289 enfants (< 18 ans) ayant participé à 3 études cliniques relatives au traitement de la douleur chronique ou continue d’origine cancéreuse ou non-cancéreuse. Ces sujets ont reçu au moins une dose de fentanyl transdermique et ont permis de fournir des données de sécurité (voir rubrique 5.1).
Le profil de sécurité d’emploi chez les enfants et les adolescents traités par du fentanyl transdermique était similaire à celui observé chez les adultes. Chez l’enfant, il n’a pas été identifié de risque supérieur à celui attendu lors de l’utilisation des opioïdes dans le traitement des douleurs associées à une maladie grave et il ne semble pas qu’il y ait de risque pédiatrique spécifique associé à l’utilisation de fentanyl transdermique chez l’enfant à partir de l’âge de 2 ans dès lors qu’il est utilisé selon les recommandations définies.
Sur la base des données de sécurité combinées à partir de ces 3 essais cliniques chez les enfants, les effets indésirables les plus fréquemment rapportés (fréquence ≥ 10 %) étaient : vomissements (33,9 %), nausées (23,5 %), céphalées (16,3 %), constipation (13,5 %), diarrhées (12,8 %), et prurit (12,8 %).
Tolérance
Une tolérance peut se développer en cas d'utilisation répétée.
Pharmacodépendance
L'utilisation répétée de FENTANYL TEVA SANTE peut entraîner une pharmacodépendance, même à des doses thérapeutiques. Le risque de pharmacodépendance peut varier en fonction des facteurs de risque individuels du patient, de la posologie et de la durée du traitement par opioïdes (voir rubrique 4.4).
Symptômes de sevrage aux opioïdes
Après le relais d’autres analgésiques opioïdes par FENTANYL TEVA SANTE ou après l’arrêt brutal du traitement, certains patients peuvent présenter des symptômes de sevrage aux opioïdes (tels que nausées, vomissements, diarrhée, anxiété et frissons) (voir rubriques 4.2 et 4.4).
Syndrome de sevrage néonatal
Il y a eu de très rares cas de syndrome de sevrage néonatal chez des nouveau-nés dont les mères avaient reçu un traitement prolongé par fentanyl transdermique durant la grossesse (voir rubrique 4.6).
Syndrome sérotoninergique
Des cas de syndrome sérotoninergique ont été rapportés avec le fentanyl administré de façon concomitante avec des médicaments sérotoninergiques puissants (voir rubriques 4.4 et 4.5).
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/.
Signes et symptômes
Les manifestations d’un surdosage en fentanyl consistent en une accentuation de ses effets pharmacologiques, l’effet le plus grave étant la dépression respiratoire. Une leucoencéphalopathie toxique a également été observée lors d'un surdosage en fentanyl.
Traitement
Pour la prise en charge de la dépression respiratoire, les mesures immédiates à prendre comprennent le retrait du dispositif de FENTANYL TEVA SANTE et la stimulation physique ou verbale du patient. Ces mesures peuvent être suivies par l’administration d’un antagoniste spécifique des opioïdes tel que la naloxone.
La dépression respiratoire consécutive à un surdosage peut persister plus longtemps que l’effet de l’antagoniste des opioïdes. L’intervalle entre les doses d’antagoniste par voie IV doit être soigneusement choisi en raison de la possibilité de re-narcotisation après le retrait du dispositif ; une administration répétée ou une perfusion continue de naloxone peuvent être nécessaires. La neutralisation de l’effet narcotique peut provoquer l’apparition d’une douleur aiguë et une libération de catécholamines.
Si la situation clinique le justifie, la perméabilité des voies respiratoires doit être assurée et maintenue, éventuellement à l’aide d’une canule oropharyngée ou d’une sonde endotrachéale, de l'oxygène doit être administré et si besoin, la ventilation doit être assistée ou contrôlée. Une température corporelle adéquate et un apport hydrique doivent être maintenus.
En cas de survenue d’une hypotension sévère ou persistante, une hypovolémie doit être envisagée et l’état doit être géré par l’administration appropriée de liquides par voie parentérale.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Classe pharmacothérapeutique : Analgésiques, Opioïdes, Dérivés de la phénylpipéridine, code ATC : N02AB03.
Mécanisme d’action
Le fentanyl est un analgésique opioïde qui interagit principalement sur les récepteurs aux opioïdes μ. Ses principaux effets thérapeutiques sont une analgésie et une sédation.
Population pédiatrique
La sécurité d’emploi du fentanyl transdermique a été évaluée au cours de 3 études en ouvert chez 289 enfants âgés de 2 ans à 17 ans inclus, présentant des douleurs chroniques, parmi lesquels 80 enfants étaient âgés de 2 à 6 ans inclus. Sur les 289 patients inclus dans ces 3 études, 110 ont débuté un traitement par fentanyl transdermique à la dose de 12 microgrammes/heure.
Sur ces 110 patients, 23 (20,9 %) avaient précédemment reçu une dose équivalente à < 30 mg de morphine orale par jour, 66 (60,0 %) avaient reçu une dose équivalente à 30 à 44 mg de morphine orale par jour et 12 (10,9 %) avaient reçu une dose équivalente à au moins 45 mg de morphine orale par jour (données non disponibles pour 9 [8,2 %] sujets). Des doses d’initiation de 25 microgrammes/heure et plus ont été utilisées chez les 179 sujets restants dont 174 (97,2 %) qui ont reçu des doses d’opioïdes équivalentes à au moins 45 mg de morphine orale par jour. Parmi les 5 patients restants ayant reçu une dose d’initiation d’au moins 25 microgrammes/heure avec des doses d’opioïdes précédentes équivalentes à < 45 mg de morphine orale par jour, 1 (0,6 %) avait précédemment reçu une dose équivalente à < 30 mg de morphine orale par jour et 4 (2,2 %) avaient reçu une dose équivalente à 30 à 44 mg de morphine orale par jour (voir rubrique 4.8).
5.2. Propriétés pharmacocinétiques
Absorption
Le fentanyl transdermique permet une libération systémique continue de fentanyl pendant l’application de 72 heures. Après l’application du dispositif de fentanyl, le fentanyl est absorbé par la peau située sous le dispositif et un dépôt de fentanyl se concentre dans les couches supérieures de la peau. Le fentanyl devient ensuite accessible à la circulation systémique. Grâce à la matrice de polymère et à la diffusion du fentanyl au travers des couches cutanées, la vitesse de libération reste relativement constante. Le gradient de concentration qui existe entre le dispositif et la concentration la plus basse dans la peau entraîne la libération du médicament. La biodisponibilité moyenne du fentanyl après l’application du dispositif transdermique est de 92 %.
Après la première application du dispositif de fentanyl, les concentrations sériques de fentanyl augmentent progressivement et atteignent généralement un plateau au bout de 12 à 24 heures, après quoi elles restent relativement stables pendant le reste des 72 heures d’application. La concentration sérique d’équilibre est atteinte avant la fin de la deuxième application de 72 heures et se maintient pendant les applications ultérieures d’un dispositif de même taille. Du fait de l’accumulation, les valeurs de l’ASC et de la Cmax entre deux doses sont, à l’équilibre, environ 40 % plus élevées qu’après une application unique. Les patients atteignent et maintiennent une concentration sérique d’équilibre qui est déterminée par les variations individuelles de la perméabilité de la peau et la clairance corporelle du fentanyl. Une importante variabilité inter-individuelle dans les concentrations plasmatiques a été observée.
Un modèle pharmacocinétique a indiqué que les concentrations sériques de fentanyl pouvaient augmenter de 14 % (intervalle de 0 à 26 %) si un nouveau dispositif était appliqué après un délai de 24 heures plutôt qu’après le délai d’application recommandé de 72 heures.
Une augmentation de la température cutanée peut accroître l’absorption du fentanyl appliqué par voie transdermique (voir rubrique 4.4). L’élévation de la température cutanée par l’application d’un coussin chauffant réglé à basse température sur le dispositif de fentanyl pendant les 10 premières heures lors d’une application unique a multiplié la valeur moyenne de l’ASC du fentanyl par 2,2 et a augmenté de 61 % la concentration moyenne à la fin de l’exposition à la chaleur.
Distribution
Le fentanyl est rapidement distribué dans divers tissus et organes comme l’indique l’important volume de distribution (3 à 10 L/kg après administration intraveineuse chez des patients). Le fentanyl s’accumule dans le muscle squelettique et les graisses et est lentement libéré dans le sang.
Dans une étude chez des patients atteints d’un cancer et traités par du fentanyl transdermique, le taux moyen de liaison aux protéines plasmatiques était de 95 % (intervalle de 77 à 100 %). Le fentanyl traverse facilement la barrière hémato-encéphalique. Le fentanyl traverse également le placenta et est excrété dans le lait maternel.
Biotransformation
Le fentanyl est une substance active avec une clairance élevée et est rapidement et largement métabolisé, principalement par le CYP3A4, dans le foie. Le métabolite principal, le norfentanyl, et les autres métabolites sont inactifs. Le fentanyl délivré par voie transdermique ne semble pas être métabolisé au niveau de la peau. Cette observation a été établie par un test sur des kératinocytes humains et par des études cliniques dans lesquelles 92 % de la dose libérée par le dispositif l’était sous forme de fentanyl inchangé, retrouvé dans la circulation systémique.
Elimination
Après une application du dispositif pendant 72 heures, la demi-vie moyenne du fentanyl varie de 20 à 27 heures. En raison de l’absorption continue du fentanyl à partir du dépôt cutané après le retrait du dispositif, la demi-vie du fentanyl après administration transdermique est d’environ 2 à 3 fois plus longue qu’après administration intraveineuse.
Après administration intraveineuse, la clairance totale moyenne du fentanyl dans les études varie généralement entre 34 et 66 L/h.
Dans les 72 heures suivant une administration intraveineuse de fentanyl, environ 75 % de la dose est excrété dans les urines et environ 9 % de la dose est retrouvé dans les selles. L’excrétion a principalement lieu sous la forme de métabolites, avec moins de 10 % de la dose excrété sous la forme active inchangée.
Linéarité/non-linéarité
Les concentrations sériques de fentanyl atteintes sont proportionnelles à la taille du dispositif de fentanyl transdermique. La pharmacocinétique du fentanyl transdermique n’est pas modifiée par des applications répétées.
Relations pharmacocinétique/pharmacodynamique
Il existe une importante variabilité inter-individuelle dans la pharmacocinétique du fentanyl, dans les relations entre les concentrations de fentanyl, les effets thérapeutiques et les effets indésirables, et dans la tolérance aux opioïdes. La concentration minimale efficace du fentanyl dépend de l’intensité de la douleur et de l’utilisation antérieure de traitement opioïde. La concentration minimale efficace et la concentration toxique augmentent avec la tolérance. Il n’est donc pas possible d’établir un intervalle de concentration thérapeutique optimale en fentanyl. L’adaptation de la dose individuelle en fentanyl doit se baser sur la réponse du patient et le niveau de tolérance. Après l’application du premier dispositif et après une augmentation de la dose, un délai de 12 à 24 heures doit être pris en compte.
Populations particulières
Personnes âgées
Les données des études avec le fentanyl administré par voie intraveineuse suggèrent que la clairance peut être réduite et la demi-vie prolongée chez les personnes âgées. En outre, les patients âgés risquent d’être plus sensibles au médicament que les patients plus jeunes. Dans une étude conduite avec le fentanyl transdermique chez des sujets âgés sains la pharmacocinétique du fentanyl ne différait pas de façon significative de celle observée chez les sujets jeunes sains bien que le pic des concentrations sériques tendait à être inférieur et que les valeurs moyennes de demi-vie étaient augmentées jusqu’à environ 34 heures. Les patients âgés doivent être étroitement surveillés à la recherche de signes de toxicité du fentanyl et la dose doit être réduite si nécessaire (voir rubrique 4.4).
Insuffisance rénale
L’effet d’une insuffisance rénale sur la pharmacocinétique du fentanyl devrait être limité car l’excrétion urinaire du fentanyl sous forme inchangée est inférieure à 10 % et il n’existe pas de métabolites actifs connus éliminés par le rein. Cependant, comme l’effet de l’insuffisance rénale sur la pharmacocinétique du fentanyl n’a pas été évalué, la prudence est de rigueur (voir rubriques 4.2 et 4.4).
Insuffisance hépatique
Les patients présentant une insuffisance hépatique doivent être étroitement surveillés à la recherche de signes de toxicité du fentanyl et la dose de FENTANYL TEVA SANTE doit être réduite si nécessaire (voir rubrique 4.4). Des données chez des patients cirrhotiques et des données de simulation chez des patients présentant différents grades d’insuffisance hépatique traités par du fentanyl transdermique indiquent que les concentrations de fentanyl peuvent être augmentées et que la clairance du fentanyl peut être diminuée en comparaison avec les sujets présentant une fonction hépatique normale. Les simulations indiquent que l’ASC à l’équilibre des patients atteints d’une insuffisance hépatique de grade B selon le score de Child-Pugh (score de Child-Pugh = 8) serait 1,36 fois plus importante que chez des patients présentant une fonction hépatique normale (grade A ; score de Child-Pugh = 5,5). Pour les patients présentant une insuffisance hépatique de grade C (score de Child-Pugh = 12,5), les résultats indiquent que la concentration du fentanyl s’accumule à chaque administration, conduisant chez ces patients à une ASC à l’équilibre 3,72 fois plus grande.
Population pédiatrique
Les concentrations de fentanyl ont été mesurées chez plus de 250 enfants âgés de 2 à 17 ans ayant reçu du fentanyl par voie transdermique à une dose allant de 12,5 à 300 microgrammes/heure. La clairance ajustée au poids corporel (L/h/kg) s’avère être plus élevée d’environ 80 % chez les enfants âgés de 2 à 5 ans, et d’environ 25 % chez les enfants de 6 à 10 ans, comparativement à celle observée chez les enfants de 11 à 16 ans dont la clairance devrait être similaire à celle des adultes. Ces résultats ont été pris en compte pour déterminer les recommandations posologiques chez les enfants (voir rubriques 4.2 et 4.4).
5.3. Données de sécurité préclinique
Les données non cliniques issues des études conventionnelles de toxicologie en administration répétée n’ont pas révélé de risque particulier pour l’Homme.
Des études de toxicité standards sur la reproduction et le développement ont été conduites avec le fentanyl administré par voie parentérale. Dans une étude chez le rat, le fentanyl n’a pas eu d’effet sur la fertilité chez le mâle. Des études chez les rats femelles ont montré une réduction de la fertilité et une augmentation de la mortalité embryonnaire.
Les effets sur l’embryon étaient dus à la toxicité maternelle et non aux effets directs de la substance sur le développement embryonnaire. Il n’a pas été noté d’effet tératogène dans les études effectuées chez deux espèces (rat et lapin). Dans une étude sur le développement pré- et post-natal, le taux de survie de la progéniture a été significativement réduit aux doses qui entraînaient une légère diminution du poids des mères. Cet effet pourrait être dû soit à une modification des soins maternels, soit à un effet direct du fentanyl sur les petits. Il n’a pas été observé d’effets sur le développement somatique et sur le comportement de la progéniture.
Les tests de mutagénicité sur bactéries et chez les rongeurs ont donné des résultats négatifs. In vitro, le fentanyl a induit des effets mutagènes dans des cellules de mammifères comparables à ceux des autres analgésiques opioïdes. Un risque mutagène en cas d’utilisation à des doses thérapeutiques semble peu probable puisque ces effets ne sont apparus qu’à des concentrations élevées.
Une étude de cancérogenèse (injections sous-cutanées quotidiennes de chlorhydate de fentanyl hydrochloride pendant deux ans chez des rats Sprague Dawley) n’a donné aucun résultat indiquant un potentiel oncogène.
Matrice adhésive : en polyacrylate.
Support protecteur : feuille de polypropylène, encre d’impression bleue.
Feuille protectrice détachable : film de téréphtalate de polyéthylène siliconé.
Sans objet.
3 ans.
6.4. Précautions particulières de conservation
A conserver à une température ne dépassant pas 30°C.
6.5. Nature et contenu de l'emballage extérieur
Boîtes de 3, 5, 10 ou 20 dispositifs transdermiques sous sachets individuels composés de papier Kraft enrobé, feuille de polyéthylène de basse densité, feuille d’aluminium et Surlyn (copolymère thermoplastique d’éthylène/acide méthacrylique).
Boîtes de 3, 5, 10 ou 20 dispositifs transdermiques sous sachets sécurité enfant individuels composés de feuille de polyéthylène, adhésif, feuille d’aluminium, adhésif et Surlyn (copolymère thermoplastique d’éthylène/acide méthacrylique).
Boîtes de 3, 5, 10 ou 20 dispositifs transdermiques sous sachets sécurité enfant individuels composés de papier, adhésif, polyéthylène, polymère, aluminium, ionomère.
Toutes les présentations peuvent ne pas être commercialisées.
6.6. Précautions particulières d’élimination et de manipulation
Instructions pour l’élimination :
Les dispositifs usagés doivent être pliés de telle façon que la face adhésive du dispositif soit repliée sur elle-même, puis placés à l’intérieur du système de récupération fourni dans l’emballage. Le système sera ensuite refermé par la bande adhésive, et placé hors de portée. La pochette ainsi fermée, contenant les dispositifs utilisés, ainsi que les dispositifs non utilisés doit être retournée à la pharmacie.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
TEVA SANTE
100-110, ESPLANADE DU GENERAL DE GAULLE
92931 PARIS LA DEFENSE CEDEX
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 385 086 8 0 : dispositif transdermique en sachet sécurité enfant; boîte de 3 dispositifs avec un système de récupération.
· 34009 385 087 4 1 : dispositif transdermique en sachet sécurité enfant; boîte de 5 dispositifs avec un système de récupération.
· 34009 572 646 3 5 : dispositif transdermique en sachet sécurité enfant; boîte de 10 dispositifs avec un système de récupération.
· 34009 572 648 6 4 : dispositif transdermique en sachet sécurité enfant; boîte de 20 dispositifs avec un système de récupération.
· 34009 275 610 4 7 : dispositif transdermique en sachet sécurité enfant composé de papier, adhésif, polyéthylène, polymère, aluminium, ionomère : boîte de 3 avec un système de récupération.
· 34009 275 611 0 8 : dispositif transdermique en sachet sécurité enfant composé de papier, adhésif, polyéthylène, polymère, aluminium, ionomère : boîte de 5 avec un système de récupération.
· 34009 585 598 2 2 : dispositif transdermique en sachet sécurité enfant composé de papier, adhésif, polyéthylène, polymère, aluminium, ionomère : boîte de 10 avec un système de récupération.
· 34009 585 599 9 0 : dispositif transdermique en sachet sécurité enfant composé de papier, adhésif, polyéthylène, polymère, aluminium, ionomère : boîte de 20 avec un système de récupération.
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Sans objet.
Médicament soumis à prescription médicale restreinte
Stupéfiant : prescription limitée à 28 jours.
Délivrance fractionnée de 14 jours.
Prescription sur ordonnance répondant aux spécifications fixées par l’arrêté du 31 mars 1999.
ANSM - Mis à jour le : 24/10/2025
FENTANYL TEVA SANTE 75 microgrammes/heure, dispositif transdermique
Fentanyl
Veuillez lire attentivement cette notice avant d’utiliser ce médicament car elle contient des informations importantes pour vous.
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin, votre pharmacien ou votre infirmier/ère.
· Ce médicament vous a été personnellement prescrit (ou à votre enfant). Ne le donnez pas à d’autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin, votre pharmacien ou votre infirmier/ère. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
1. Qu'est-ce que FENTANYL TEVA SANTE 75 microgrammes/heure, dispositif transdermique et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant d'utiliser FENTANYL TEVA SANTE 75 microgrammes/heure, dispositif transdermique ?
3. Comment utiliser FENTANYL TEVA SANTE 75 microgrammes/heure, dispositif transdermique ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver FENTANYL TEVA SANTE 75 microgrammes/heure, dispositif transdermique ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE FENTANYL TEVA SANTE 75 microgrammes/heure, dispositif transdermique ET DANS QUELS CAS EST-IL UTILISE ?
Le nom de votre médicament est FENTANYL TEVA SANTE.
Les dispositifs transdermiques aident à soulager les douleurs très fortes et de longue durée :
· chez les adultes qui ont besoin d’un traitement continu de la douleur
· chez les enfants à partir de l’âge de 2 ans qui ont déjà reçu des médicaments opioïdes et qui ont besoin d’un traitement continu de la douleur.
FENTANYL TEVA SANTE contient un médicament appelé fentanyl. Il appartient à la classe des opioïdes, des anti-douleurs puissants.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D’UTILISER FENTANYL TEVA SANTE 75 microgrammes/heure, dispositif transdermique ?
N’utilisez jamais FENTANYL TEVA SANTE 75 microgrammes/heure, dispositif transdermique :
· Si vous êtes allergique au fentanyl ou à l’un des autres composants contenus dans ce médicament (mentionnés dans la rubrique 6).
· Si vous souffrez d’une douleur de courte durée, telle qu’une douleur soudaine ou une douleur survenant après une intervention chirurgicale.
· Si vous avez des difficultés à respirer, avec une respiration lente ou peu profonde.
N’utilisez pas ce médicament si l’une des situations ci-dessus s’applique à vous ou à votre enfant. En cas de doute, parlez-en avec votre médecin ou votre pharmacien avant d’utiliser Fentanyl Teva Sante.
Avertissements et précautions
· Fentanyl Teva Sante peut avoir des effets indésirables pouvant mettre la vie en danger chez les personnes qui n’utilisent pas déjà régulièrement des médicaments opioïdes sur ordonnance.
· Fentanyl Teva Sante est un médicament qui peut mettre la vie des enfants en danger, même si les dispositifs transdermiques ont déjà servi. Gardez à l’esprit qu'un dispositif transdermique adhésif (utilisé ou non) peut être attractif pour un enfant ; si le dispositif se colle sur sa peau ou si l’enfant le porte à la bouche, cela peut être fatal.
· Conserver ce médicament dans un endroit sûr et sécurisé, non accessible à d’autres personnes – voir rubrique 5 pour de plus amples informations.
Transfert de dispositif transdermique sur la peau d’une tierce personne
Le dispositif doit être appliqué exclusivement sur la peau de la personne pour laquelle il a été prescrit. Des cas ont été rapportés de transfert accidentel de dispositif sur la peau d’un membre de la famille du patient traité, lors de contacts physiques rapprochés ou en cas de partage du même lit. Le transfert accidentel du dispositif sur la peau d’une tierce personne (notamment un enfant) peut entraîner le passage du médicament contenu dans le dispositif à travers sa peau et provoquer des effets indésirables graves qui peuvent être fatals, telles que des difficultés respiratoires, avec une respiration lente ou peu profonde. Dans le cas où le dispositif se serait collé à la peau d’une autre personne, retirez-le immédiatement et consultez un médecin.
Soyez extrêmement prudent(e) avec Fentanyl Teva Sante
Adressez-vous à votre médecin ou votre pharmacien avant d'utiliser ce médicament si l'un des cas suivants vous concerne, votre médecin devra peut-être vous surveiller plus étroitement si :
· Vous avez déjà eu des problèmes aux poumons ou de respiration.
· Vous avez déjà eu des problèmes au coeur, au foie, aux reins, ou de basse pression artérielle.
· Vous avez déjà eu une tumeur cérébrale.
· Vous avez déjà eu des maux de tête persistants ou un traumatisme crânien.
· Vous êtes âgé : vous pouvez être plus sensible aux effets de ce médicament.
· Vous souffrez d’une maladie appelée « myasthénie grave », qui provoque une faiblesse musculaire et une fatigue.
Si l'une des situations décrites ci-dessus vous concerne (ou en cas de doute), parlez-en à votre médecin ou votre pharmacien avant d'utiliser Fentanyl Teva Sante.
· pauses respiratoires pendant le sommeil ;
· réveil nocturne en raison d’un essoufflement ;
· difficultés à rester endormi(e) ;
· endormissement excessif pendant la journée.
Votre médecin pourrait décider de modifier votre dose.
Pendant que vous portez le dispositif, prévenez votre médecin si vous remarquez un changement dans la douleur que vous ressentez. Si vous sentez :
· que votre douleur n’est plus soulagée par le dispositif ;
· une augmentation de la douleur ;
· une modification de la manière dont vous ressentez la douleur (par exemple, vous ressentez la douleur dans une autre partie du corps) ;
· une douleur lorsque vous touchez quelque chose qui ne devrait pas entraîner de douleur.
Ne modifiez pas la posologie vous-même. Votre médecin décidera lui-même s’il faut changer votre dose ou votre traitement.
Effets indésirables et Fentanyl Teva Sante
· Fentanyl Teva Sante peut provoquer une somnolence inhabituelle et être à l'origine d'une respiration plus lente ou peu profonde. Très rarement, ces problèmes respiratoires peuvent mettre la vie en danger, voire être mortels, en particulier chez les personnes n'ayant pas utilisé auparavant des anti-douleurs opioïdes puissants (comme Fentanyl Teva Sante ou la morphine). Si vous, votre partenaire ou votre personnel soignant remarquez que la personne portant le dispositif est inhabituellement somnolente et a une respiration lente ou peu profonde :
o Retirez le dispositif
o Appelez un médecin ou rendez-vous immédiatement à l'hôpital le plus proche
o Maintenez la personne animée et faites-la parler autant que possible
· Si vous avez de la fièvre pendant l'utilisation de Fentanyl Teva Sante, parlez-en à votre médecin ; cela peut augmenter la quantité de médicament qui passe à travers votre peau.
· Fentanyl Teva Sante peut provoquer une constipation, demandez conseil auprès de votre médecin ou de votre pharmacien sur les moyens de prévenir ou de soulager la constipation.
Veuillez-vous reporter à la rubrique 4 pour la liste complète des effets indésirables éventuels.
Fentanyl Teva Sante, comme d'autres opioïdes, peut affecter la production normale d'hormones dans l’organisme, telles que le cortisol, la prolactine ou les hormones sexuelles, en particulier si vous avez pris Fentanyl Teva Sante sur une longue période. Les effets de ces changements hormonaux peuvent inclure des nausées ou des vomissements, une perte d'appétit, de la fatigue, une faiblesse, des sensations vertigineuses, une pression artérielle basse, une infertilité ou une baisse de la libido. En outre, les femmes peuvent connaître des modifications de leur cycle menstruel, tandis que les hommes peuvent présenter une impuissance ou une augmentation du volume des seins. Si vous remarquez l'un de ces signes, parlez-en à votre médecin.
Lorsque vous portez le dispositif vous devez éviter de l’exposer à des sources directes de chaleur, comme des coussins chauffants, couvertures électriques, bouillottes, lits chauffants, lampes chauffantes ou lampes à bronzer. Ne prenez pas de bains de soleil, ni de bains chauds prolongés, de saunas ou de bains bouillonnants chauds, car vous risqueriez d'augmenter la quantité de médicament libérée par le dispositif.
Il ne faut pas découper les dispositifs en petits fragments car ni la qualité, ni l’efficacité, ni la tolérance de ces fragments de dispositif ne sont démontrées.
L'utilisation des dispositifs transdermiques de fentanyl peut mener à un contrôle anti-dopage positif. L'utilisation des dispositifs transdermiques de fentanyl comme agent dopant peut être dangereuse pour la santé.
Utilisation à long terme et tolérance
Ce médicament contient du fentanyl, un médicament opioïde. L'utilisation répétée d'analgésiques opioïdes peut réduire l'efficacité du médicament (vous vous y habituez, c'est ce que l'on appelle la tolérance médicamenteuse). Vous pouvez également devenir plus sensible à la douleur lorsque vous utilisez FENTANYL TEVA SANTE. Ce phénomène est connu sous le nom d'hyperalgésie. L'augmentation de la dose de vos dispositifs peut contribuer à réduire davantage votre douleur pendant un certain temps, mais elle peut également être nocive. Si vous remarquez que votre médicament devient moins efficace, parlez-en à votre médecin. Celui-ci décidera s'il est préférable pour vous d'augmenter la dose ou de diminuer progressivement votre utilisation de FENTANYL TEVA SANTE.
Dépendance et accoutumance
Ce médicament contient du fentanyl, qui est un médicament opioïde. Il peut entraîner une dépendance et/ou une addiction
L'utilisation répétée de FENTANYL TEVA SANTE peut également entraîner une dépendance, un abus et une accoutumance pouvant entraîner un surdosage susceptible d’engager le pronostic vital. Le risque de ces effets indésirables peut augmenter avec une dose plus élevée et une durée d'utilisation plus longue. La dépendance ou l'accoutumance peut vous donner l'impression que vous ne contrôlez plus la quantité de médicament que vous devez utiliser ou la fréquence à laquelle vous devez l'utiliser. Vous pouvez avoir l'impression de devoir poursuivre l’utilisation de votre médicament, même s'il n’atténue pas vos douleurs.
Le risque de devenir dépendant varie d'une personne à l'autre. Le risque de dépendance ou d'accoutumance à FENTANYL TEVA SANTE est plus élevé dans les cas suivants :
· Vous ou un membre de votre famille avez déjà consommé de façon abusive de l’alcool ou vous avez été dépendant à l’alcool, à des médicaments sur ordonnance ou à des substances illicites (« addiction »).
· Vous êtes fumeur.
· Vous avez déjà eu des troubles de l’humeur (dépression, anxiété ou trouble de la personnalité) ou avez été suivi(e) par un psychiatre pour toute autre maladie mentale.
Si vous remarquez l'un des signes suivants lors de l'utilisation de FENTANYL TEVA SANTE, il peut s'agir d'un signe de dépendance ou d'accoutumance :
· Vous ressentez le besoin d’utiliser le médicament plus longtemps que ce que vous a conseillé votre médecin.
· Vous ressentez le besoin de dépasser la dose recommandée.
· Vous utilisez le médicament pour des raisons autres que celles prescrites, par exemple « pour rester calme » ou « pour vous aider à dormir ».
· Vous avez fait des tentatives répétées et infructueuses pour arrêter ou contrôler l'utilisation du médicament.
· Lorsque vous arrêtez d'utiliser le médicament, vous vous sentez mal et vous vous sentez mieux lorsque vous utilisez à nouveau le médicament (« effets de sevrage »).
Si vous remarquez l'un de ces signes, parlez-en à votre médecin pour discuter du meilleur traitement possible dans votre cas, y compris du moment approprié pour arrêter et de la manière d'arrêter en toute sécurité.
Symptômes de sevrage à l’arrêt de Fentanyl Teva Sante 75 microgrammes/heure, dispositif transdermique
N’arrêtez pas brusquement d’utiliser ce médicament. Des symptômes de sevrage comme de l’impatience, des difficultés à dormir, de l’irritabilité, de l’agitation, de l’anxiété, le fait de sentir les battements du cœur (palpitations), une pression artérielle élevée, des nausées ou des vomissements, de la diarrhée, une perte d’appétit, des tremblements, des frissonnements ou de la transpiration pourraient se manifester. Si vous souhaitez arrêter d’utiliser ce médicament, parlez-en d’abord avec votre médecin. Il vous expliquera comme procéder, habituellement en réduisant progressivement la dose de manière à maintenir au minimum tout effet désagréable de sevrage.
Autres médicaments et FENTANYL TEVA SANTE 75 microgrammes/heure, dispositif transdermique
Informez votre médecin ou votre pharmacien si vous prenez/utilisez, avez récemment pris/utilisé ou pourriez prendre/utiliser tout autre médicament. Ceci inclut les médicaments achetés sans ordonnance ou les médicaments à base de plantes. Vous devez également signaler à votre pharmacien que vous utilisez FENTANYL TEVA SANTE si vous achetez un médicament à la pharmacie.
Votre médecin vous indiquera les médicaments que vous pouvez prendre/utiliser en toute sécurité avec FENTANYL TEVA SANTE. Vous pouvez avoir besoin d’une surveillance étroite si vous prenez/utilisez ou arrêtez de prendre/utiliser certains types de médicaments énumérés ci-dessous ; en effet, ils sont susceptibles de modifier la dose de FENTANYL TEVA SANTE qui vous est nécessaire.
Vous devez en particulier informer votre médecin ou votre pharmacien si vous prenez/utilisez :
· D’autres médicaments contre la douleur, par exemple d'autres anti-douleurs opioïdes (tels que buprénorphine, nalbuphine ou pentazocine) et certains anti-douleurs pour traiter les douleurs neuropathiques (gabapentine et prégabaline).
· Des médicaments utilisés pour traiter les troubles du sommeil (tels que témazépam, zaleplon ou zolpidem).
· Des médicaments utilisés pour traiter l’anxiété (tranquillisants, tels que alprazolam, clonazépam, diazépam, hydroxyzine ou lorazépam) et des médicaments utilisés pour traiter les troubles psychiques (anti-psychotiques, tels que aripiprazole, halopéridol, olanzapine, rispéridone ou phénothiazines).
· Des médicaments utilisés pour détendre les muscles (tels que cyclobenzaprine ou diazépam).
· Certains médicaments utilisés pour traiter la dépression, appelés ISRS ou IRSN (tels que citalopram, duloxétine, escitalopram, fluoxétine, fluvoxamine, paroxétine, sertraline ou venlafaxine) – voir ci-dessous pour plus d'informations.
· Certains médicaments utilisés pour traiter la dépression ou la maladie de Parkinson appelés IMAO (par exemple isocarboxazide, phénelzine, sélégiline ou tranylcypromine). Vous ne devez pas utiliser FENTANYL TEVA SANTE au cours des 14 jours suivant l'arrêt de ces médicaments – voir ci-dessous pour plus d'informations.
· Certains antihistaminiques, en particulier ceux qui font dormir (tels que chlorphéniramine, clémastine, cyproheptadine, diphénhydramine ou hydroxyzine).
· Certains antibiotiques utilisés pour traiter les infections (tels que érythromycine ou clarithromycine).
· Des médicaments utilisés pour traiter les infections fongiques (tels que itraconazole, kétoconazole, fluconazole ou voriconazole).
· Des médicaments utilisés pour traiter l'infection à VIH (tels que ritonavir).
· Des médicaments utilisés pour traiter des troubles du rythme cardiaque (tels que amiodarone, diltiazem ou vérapamil).
· Des médicaments contre la tuberculose (tels que rifampicine).
· Certains médicaments antiépileptiques (tels que carbamazépine, phénobarbital ou phénytoïne).
· Certains médicaments utilisés pour traiter les nausées ou le mal des transports (tels que phénothiazines).
· Certains médicaments utilisés pour traiter les brûlures d'estomac ou les ulcères (tels que cimétidine).
· Certains médicaments utilisés pour traiter l’angine de poitrine (douleur à la poitrine) ou une pression sanguine élevée (tels que la nicardipine).
· Certains médicaments utilisés pour traiter le cancer du sang (tels que idélalisib).
FENTANYL TEVA SANTE 75 microgrammes/heure, dispositif transdermique avec les antidépresseurs
Le risque d'effets indésirables augmente si vous prenez ou utilisez des médicaments tels que certains antidépresseurs. FENTANYL TEVA SANTE est susceptible d'interagir avec ces médicaments, et vous pourriez présenter des modifications de votre état mental se manifestant par une agitation, la perception d'informations visuelles, tactiles, auditives ou olfactives qui ne sont pas réelles (hallucinations), ainsi que d'autres effets comme des modifications de la pression artérielle, des battements cardiaques rapides, une augmentation de la température corporelle, des réflexes hyperactifs, un manque de coordination, une raideur musculaire, des nausées, des vomissements et une diarrhée (il pourrait s'agir de signes du syndrome sérotoninergique). En cas d'utilisation conjointe, votre médecin peut vouloir vous surveiller étroitement pour détecter ces effets secondaires, en particulier au début du traitement ou lors d'une modification de la dose de votre médicament.
Utilisation avec les dépresseurs du système nerveux central, incluant l'alcool et certains médicaments narcotiques
L’utilisation concomitante de FENTANYL TEVA SANTE et de sédatifs tels que les benzodiazépines ou les médicaments apparentés augmente le risque de sensations vertigineuses, difficultés respiratoires (dépression respiratoire), coma, et peut mettre en jeu le pronostic vital. Pour cette raison, l’utilisation concomitante doit être envisagée uniquement en l’absence d’autres options thérapeutiques.
Cependant, si votre médecin vous prescrit FENTANYL TEVA SANTE avec des sédatifs, il doit s’assurer de limiter la dose et la durée du traitement concomitant.
Veuillez informer votre médecin de tous les sédatifs que vous prenez ou utilisez et suivre attentivement ses recommandations concernant la dose. Il peut être utile de demander à vos amis ou parents de faire attention aux signes et symptômes décrits ci-dessus. Contactez votre médecin si vous présentez ce type de symptômes.
Ne buvez pas d'alcool pendant l'utilisation de FENTANYL TEVA SANTE sans en avoir préalablement discuté avec votre médecin.
Interventions chirurgicales
Si vous pensez que vous allez recevoir une anesthésie, prévenez le médecin ou le dentiste que vous utilisez FENTANYL TEVA SANTE.
Grossesse et allaitement
Si vous êtes enceinte ou que vous allaitez, si vous pensez être enceinte ou planifiez une grossesse, demandez conseil à votre médecin ou votre pharmacien avant d’utiliser ce médicament.
FENTANYL TEVA SANTE ne doit pas être utilisé pendant la grossesse sans en avoir discuté avec votre médecin. FENTANYL TEVA SANTE ne doit pas être utilisé pendant l'accouchement car le médicament peut perturber la respiration du nouveau-né.
Un usage prolongé de FENTANYL TEVA SANTE pendant la grossesse peut entraîner des symptômes de sevrage (comme un cri aigu, un énervement, des crises, une mauvaise alimentation et une diarrhée) chez votre nouveau-né, qui pourraient engager le pronostic vital s’ils sont non reconnus et non traités. Adressez-vous immédiatement à votre médecin si vous pensez que votre bébé peut présenter des symptômes de sevrage.
Vous ne devez pas utiliser FENTANYL TEVA SANTE si vous allaitez. Vous ne devez pas allaiter pendant les 3 jours qui suivent le retrait du dispositif de FENTANYL TEVA SANTE. Ces précautions sont nécessaires car le médicament peut passer dans le lait maternel.
Conduite de véhicules et utilisation de machines
FENTANYL TEVA SANTE peut interférer sur l'aptitude à conduire et à utiliser des machines car il peut provoquer une somnolence ou un étourdissement. Dans ce cas, vous ne devez pas conduire de véhicules ou utiliser d'outils ou de machines. Vous ne devez pas conduire pendant l'utilisation de ce médicament tant que vous ne connaissez pas ses effets sur vous.
Discutez avec votre médecin ou votre pharmacien si vous n’êtes pas sûr(e) de pouvoir conduire en toute sécurité pendant l’utilisation de ce médicament.
FENTANYL TEVA SANTE 75 microgrammes/heure, dispositif transdermique contient
Sans objet.
3. COMMENT UTILISER FENTANYL TEVA SANTE 75 microgrammes/heure, dispositif transdermique ?
Veillez à toujours utiliser ce médicament en suivant exactement les indications de votre médecin. Vérifiez auprès de votre médecin ou pharmacien en cas de doute.
Votre médecin déterminera le dosage de FENTANYL TEVA SANTE le mieux adapté pour vous, en tenant compte de l’intensité de votre douleur, de votre état général et du type de traitement anti-douleur que vous avez reçu jusque-là.
Avant de commencer le traitement et régulièrement au cours du traitement, votre médecin discutera également avec vous de ce que vous pouvez attendre de l'utilisation de FENTANYL TEVA SANTE, quand et combien de temps vous devez l'utiliser, quand contacter votre médecin et quand vous devez l'arrêter (voir également rubrique 2, « Symptômes de sevrage à l’arrêt de FENTANYL TEVA SANTE 75 microgrammes/heure, dispositif transdermique »).
Application et changement de dispositif transdermique
· La quantité de médicament dans chaque dispositif est suffisante pour une durée de 3 jours (72 heures).
· Vous devez donc changer de dispositif tous les 3 jours, sauf indication contraire du médecin.
· Veillez à toujours retirer l'ancien dispositif avant d'appliquer le nouveau.
· Effectuez toujours le changement de dispositif à la même heure tous les 3 jours (72 heures).
· Si vous utilisez plusieurs dispositifs, changez-les tous en même temps.
· Notez le jour, la date et l'heure de l'application du dispositif, pour vous rappeler quand vous aurez besoin de remplacer le dispositif.
· Le tableau suivant est fourni à titre indicatif comme aide pour les changements de dispositif :
|
Application du dispositif le |
Changement de dispositif le |
|
Lundi → |
Jeudi |
|
Mardi → |
Vendredi |
|
Mercredi → |
Samedi |
|
Jeudi → |
Dimanche |
|
Vendredi → |
Lundi |
|
Samedi → |
Mardi |
|
Dimanche → |
Mercredi |
Où appliquer le dispositif transdermique ?
Adultes
· Appliquez le dispositif sur une partie plane du haut du corps ou des bras (pas sur les articulations).
Enfants
· Appliquez toujours le dispositif en haut du dos pour que votre enfant ne puisse pas l'atteindre et l'enlever.
· Même dans ce cas, vérifiez régulièrement que le dispositif est bien resté en place sur la peau.
· Il est primordial que votre enfant ne retire pas le dispositif pour le mettre dans sa bouche ; cela pourrait mettre sa vie en danger, voire lui être fatal.
· Vous devez surveiller très attentivement votre enfant pendant 48 heures après :
o l'application du premier dispositif ;
o l'application d'un dispositif à plus fort dosage.
· L'effet maximal du premier dispositif peut être un peu long à obtenir. Votre enfant aura donc peut-être besoin d'autres anti-douleurs en attendant que le dispositif devienne efficace. Votre médecin en discutera avec vous.
Adultes et enfants :
Ne pas appliquer le dispositif transdermique sur
· Le même endroit deux fois de suite.
· Les régions du corps qui bougent beaucoup (articulations), des zones de peau irritée ou coupée.
· Une zone de peau très poilue. Si la peau est poilue, ne la rasez pas (le rasage irrite la peau). Coupez plutôt les poils le plus près possible de la peau.
Application du dispositif transdermique
Etape 1 : préparation de la peau
· Vérifiez que la peau est complètement sèche, propre et fraîche avant l’application du dispositif.
· Si la peau a besoin d’être lavée, lavez-la uniquement à l’eau froide.
· N’utilisez pas de savons ou autres détergents, crèmes, crèmes hydratantes, huiles ou talc avant l'application du dispositif.
· Évitez d'appliquer le dispositif juste après un bain ou une douche chaude.
< Sachets sans sécurité enfant >
Etape 2 : ouverture du sachet
· Chaque dispositif est scellé dans son propre sachet.
· Déchirez le sachet au niveau de l'encoche.
· Déchirez doucement le bord du sachet en entier.
|
|
|
· Prenez les deux côtés de l'ouverture du sachet et écartez-les.
· Sortez le dispositif de l'emballage et utilisez-le immédiatement.
· Gardez le sachet vide pour y jeter ultérieurement le dispositif usagé.
· Chaque dispositif ne doit être utilisé qu'une seule fois.
· Ne sortez pas le dispositif de son sachet avant d'être prêt(e) à l'utiliser.
· Vérifiez visuellement que le dispositif n'a pas été endommagé.
· N’utilisez pas le dispositif s'il a été divisé, coupé ou s'il semble endommagé.
· Ne divisez pas ou ne coupez pas le dispositif.
< Sachets avec sécurité enfant >
Etape 2 : ouverture du sachet avec sécurité enfant
· Chaque dispositif est scellé dans son propre sachet.
· Découpez soigneusement le bord du sachet en entier avec des ciseaux au niveau des marques le long du bord scellé du sachet pour éviter d'endommager le dispositif.
|
|
|
· Prenez les deux côtés de l'ouverture du sachet et écartez-les.
· Sortez le dispositif de l'emballage et utilisez-le immédiatement.
· Chaque dispositif ne doit être utilisé qu'une seule fois.
· Ne sortez pas le dispositif de son sachet avant d'être prêt(e) à l'utiliser.
· Vérifiez visuellement que le dispositif n'a pas été endommagé.
· N’utilisez pas le dispositif s'il a été divisé, coupé ou s'il semble endommagé.
· Ne divisez pas ou ne coupez pas le dispositif.
Etape 3 : retrait de la pellicule de protection et application
· Assurez-vous que le dispositif sera recouvert de vêtements amples et ne le recouvrez pas d’une bande serrée ou élastique.
· Enlevez doucement la moitié de la pellicule de plastique brillante à partir du centre du dispositif. Essayez de ne pas toucher la partie adhésive du dispositif.
· Appliquez la partie adhésive du dispositif sur la peau.
· Retirez l'autre moitié de la pellicule de protection et appliquez la totalité du dispositif sur la peau en appuyant avec la paume de la main.
· Maintenez pendant au moins 30 secondes. Assurez-vous que le dispositif colle bien, notamment sur les bords.
Etape 4 : élimination du dispositif transdermique
· Dès que vous retirez un dispositif, pliez-le fermement en deux de telle façon que la face adhésive se replie sur elle-même.
· Replacez les dispositifs utilisés dans le système de récupération fourni dans l'emballage et fermez-le par la bande adhésive. Rapportez la pochette ainsi fermée à la pharmacie.
· Veillez à tenir les dispositifs usagés hors de la vue et de la portée des enfants ; en effet, même usagés, les dispositifs contiennent une quantité de médicament qui peut être nocive, voire fatale, pour les enfants.
Etape 5 : lavage des mains
· Après avoir manipulé le dispositif, lavez-vous toujours les mains à l'eau propre uniquement.
Informations supplémentaires sur l'utilisation de FENTANYL TEVA SANTE
Activités quotidiennes pendant l'utilisation des dispositifs transdermiques
· Les dispositifs sont imperméables.
· Vous pouvez donc vous doucher ou prendre un bain pendant que vous portez un dispositif, mais vous ne devez pas frotter le dispositif lui-même.
· Si votre médecin l'accepte, vous pouvez faire de l'exercice ou du sport pendant le port du dispositif.
· Vous pouvez également pratiquer la natation pendant le port du dispositif mais :
o vous ne devez pas utiliser de bains bouillonnants chauds ;
o vous ne devez pas mettre de bande serrée ou élastique au-dessus du dispositif.
· Pendant le port du dispositif, vous devez éviter d’exposer le dispositif à des sources directes de chaleur, comme des coussins chauffants, couvertures électriques, bouillottes, lits chauffants, lampes chauffantes ou lampes à bronzer. Ne prenez pas de bains de soleil, ni de bains chauds prolongés ou de saunas car vous risqueriez d'augmenter la quantité de médicament libérée par le dispositif.
En combien de temps le dispositif transdermique agit-il ?
· L'effet maximal du premier dispositif peut être un peu long à obtenir.
· Votre médecin pourra aussi vous donner d'autres anti-douleurs pour le premier jour et les autres jours si besoin.
· Ensuite, le dispositif doit permettre de soulager la douleur de façon continue, si bien que vous pourrez arrêter de prendre ou d’utiliser les autres anti-douleurs. Toutefois, votre médecin pourra encore vous prescrire des anti-douleurs supplémentaires de temps en temps.
Quelle sera la durée d’utilisation des dispositifs transdermiques ?
· Les dispositifs de FENTANYL TEVA SANTE sont indiqués pour les douleurs de longue durée. Votre médecin vous indiquera la durée prévue d'utilisation des dispositifs.
Si votre douleur devient plus intense
· Si votre douleur devient plus intense soudainement après l’application de votre dernier dispositif transdermique, il est nécessaire de vérifier votre dispositif transdermique. S’il n’adhère plus correctement ou s’il est décollé, remplacez-le (voir également la rubrique Si un dispositif transdermique se détache).
· Si votre douleur devient plus intense au fil du temps pendant l'utilisation de ces dispositifs, votre médecin pourra essayer un dispositif à plus fort dosage ou vous prescrire des anti-douleurs supplémentaires (ou les deux).
· Si l'augmentation du dosage du dispositif ne vous aide pas, votre médecin pourra décider d'arrêter l'utilisation des dispositifs.
Si vous utilisez trop de dispositifs transdermiques ou un dispositif avec un dosage erroné
Si vous avez appliqué trop de dispositifs ou un dispositif avec un mauvais dosage, retirez les dispositifs et contactez immédiatement un médecin.
Les signes de surdosage se manifestent notamment par des troubles respiratoires ou une respiration peu profonde, une fatigue, une somnolence extrême, une incapacité à penser clairement, à marcher ou à parler normalement et une sensation d'étourdissement, de vertige ou de confusion. Un surdosage peut également entraîner un trouble cérébral connu sous le nom de leucoencéphalopathie toxique.
Si vous avez oublié de changer de dispositif transdermique
· Si vous avez oublié de changer votre dispositif, remplacez-le dès que vous constatez l'oubli et notez le jour et l'heure du remplacement de dispositif. Changez à nouveau le dispositif au bout de 3 jours (72 heures) comme d'habitude.
· Si vous avez beaucoup de retard pour changer votre dispositif, vous devez en discuter avec votre médecin car vous aurez peut-être besoin d'anti-douleurs supplémentaires mais n'appliquez pas de dispositif supplémentaire.
Si un dispositif transdermique se détache
· Si un dispositif se détache avant son changement prévu, appliquez immédiatement un nouveau dispositif et notez le jour et l'heure. Appliquez le dispositif sur une nouvelle zone de peau située sur :
o la partie supérieure du corps ou du bras ;
o la partie supérieure du dos de votre enfant.
· Signalez à votre médecin que le dispositif s'est détaché et laissez le nouveau dispositif en place pendant 3 jours (72 heures) ou en fonction des instructions de votre médecin, avant de le remplacer comme d'habitude.
· Si vos dispositifs continuent de se détacher, parlez-en à votre médecin, votre pharmacien ou à votre infirmier/ère.
Si vous souhaitez arrêter d'utiliser les dispositifs transdermiques
· N’arrêtez pas brusquement d’utiliser ce médicament. Si vous souhaitez arrêter d’utiliser ce médicament, parlez-en d’abord à votre médecin. Il vous indiquera comment procéder, habituellement en diminuant progressivement la dose, de sorte que les effets déplaisants du sevrage soient réduits au minimum. Voir également la rubrique 2 « Symptômes de sevrage à l’arrêt de FENTANYL TEVA SANTE 75 microgrammes/heure, dispositif transdermique ».
· Si vous arrêtez l'utilisation des dispositifs, ne recommencez pas le traitement sans en discuter au préalable avec votre médecin. En effet, la reprise du traitement peut nécessiter un autre dosage de dispositif.
Si vous avez d’autres questions sur l’utilisation de ce médicament, demandez plus d’informations à votre médecin ou à votre pharmacien.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Comme tous les médicaments, ce médicament peut provoquer des effets indésirables, mais ils ne surviennent pas systématiquement chez tout le monde.
Si vous, ou votre partenaire ou votre personnel soignant remarquez que la personne portant le dispositif transdermique présente les symptômes suivants, retirez le dispositif et contactez un médecin ou rendez-vous immédiatement à l'hôpital le plus proche. Un traitement médical d'urgence peut être nécessaire.
· Sensation de somnolence inhabituelle, respiration plus lente ou superficielle que d'habitude.
Suivez les conseils ci-dessus et maintenez la personne portant le dispositif animée et faites-la parler autant que possible. Très rarement, ces difficultés respiratoires peuvent mettre la vie en danger, voire être fatales, notamment chez les personnes n'ayant pas utilisé auparavant des anti-douleurs opioïdes forts (comme FENTANYL TEVA SANTE ou la morphine). (Peu fréquent, pouvant affecter jusqu'à 1 personne sur 100)
· Gonflement soudain du visage ou de la gorge, irritation sévère, rougeur de la peau ou formation de cloques sur la peau. Il peut s'agir des signes d'une réaction allergique sévère. (La fréquence ne peut être estimée sur la base des données disponibles).
· Convulsions (crises épileptiques). (Peu fréquent, pouvant affecter jusqu'à 1 personne sur 100)
· Diminution de la conscience ou perte de conscience. (Peu fréquent, pouvant affecter jusqu'à 1 personne sur 100)
Les effets secondaires suivants ont également été signalés
Très fréquent (pouvant affecter plus de 1 personne sur 10)
· Nausées, vomissements, constipation.
· Envie de dormir (somnolence).
· Sensations vertigineuses.
· Maux de tête.
Fréquent (pouvant affecter jusqu'à 1 personne sur 10)
· Réaction allergique.
· Perte d'appétit.
· Difficultés pour dormir.
· Dépression.
· Sensation d'anxiété ou de confusion.
· Perception d'informations visuelles, tactiles, auditives ou olfactives qui ne sont pas réelles (hallucinations).
· Tremblements ou spasmes musculaires.
· Sensation inhabituelle au niveau de la peau, comme des picotements ou des fourmillements (paresthésies).
· Sensation de tournis (vertige).
· Battements cardiaques rapides ou irréguliers (palpitations, tachycardie).
· Pression artérielle élevée.
· Essoufflement (dyspnée).
· Diarrhée.
· Sécheresse buccale.
· Douleur au niveau de l'estomac ou troubles de la digestion.
· Transpiration excessive.
· Démangeaisons, éruption cutanée ou rougeur de la peau.
· Incapacité à uriner ou à vider complètement la vessie.
· Sensation de fatigue extrême, de faiblesse ou de mal-être général.
· Sensation de froid.
· Gonflement des mains, des chevilles ou des pieds (œdèmes périphériques).
Peu fréquent (pouvant affecter jusqu'à 1 personne sur 100)
· Sensation d'agitation ou de désorientation.
· Sensation de bonheur extrême (euphorie).
· Diminution de la sensibilité, notamment au niveau de la peau (hypoesthésie).
· Perte de mémoire.
· Vision trouble.
· Battements cardiaques lents (bradycardie) ou pression artérielle basse.
· Coloration bleue de la peau due à un faible taux d'oxygène dans le sang (cyanose).
· Perte des contractions intestinales (iléus).
· Eruption cutanée associée à des démangeaisons (eczéma), réaction allergique ou autres troubles cutanés sur le site d'application du dispositif.
· Syndrome pseudo-grippal.
· Sensation de modification de la température corporelle.
· Fièvre.
· Contractions musculaires.
· Troubles à obtenir et maintenir une érection (impuissance) ou problèmes lors des rapports sexuels.
Rare (pouvant affecter jusqu'à 1 personne sur 1 000)
· Constriction des pupilles (myosis).
· Interruptions ponctuelles de la respiration (apnée).
Fréquence indéterminée (ne peut être estimée sur la base des données disponibles)
· Manque d’hormones sexuelles masculines (déficience androgénique).
· Délire (les symptômes peuvent inclure une combinaison d’agitation, d’impatience, de désorientation, de confusion, de peur, de troubles du sommeil et de cauchemars, ou le fait d’avoir des visions ou d’entendre des choses qui ne sont pas réellement présentes).
· Vous pouvez développer une dépendance à FENTANYL TEVA SANTE (voir rubrique 2).
Une éruption cutanée, une rougeur ou de légères démangeaisons peuvent apparaître sur le site d'application du dispositif. Ces effets sont généralement bénins et disparaissent après le retrait du dispositif. Dans le cas contraire, ou si le dispositif irrite trop votre peau, signalez-le à votre médecin.
L'utilisation répétée des dispositifs peut diminuer l'efficacité du médicament (vous vous y habituez ou vous pouvez devenir plus sensible à la douleur) ou provoquer une dépendance.
Si vous passez d'un autre anti-douleur à FENTANYL TEVA SANTE ou si vous arrêtez brutalement le traitement par FENTANYL TEVA SANTE, des symptômes de sevrage pourront apparaître ; tels que des nausées, des vomissements, une diarrhée, une anxiété et des frissons. Si vous présentez l'un de ces effets, quel qu'il soit, signalez-le à votre médecin.
Des cas de symptômes de sevrage chez le nouveau-né ont également été rapportés lorsque les mères avaient utilisé FENTANYL TEVA SANTE de façon prolongée pendant la grossesse.
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin, à votre pharmacien, ou à votre infirmier/ère. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER FENTANYL TEVA SANTE 75 microgrammes/heure, dispositif transdermique ?
Lieu de conservation des dispositifs transdermiques
Tenir les dispositifs (usagés et non utilisés) hors de la vue et de la portée des enfants.
Durée de conservation de FENTANYL TEVA SANTE
N’utilisez pas ce médicament après la date de péremption indiquée sur l’emballage et le sachet après EXP. La date de péremption fait référence au dernier jour de ce mois. Si les dispositifs sont périmés, les rapporter à la pharmacie.
A conserver à une température ne dépassant pas 30°C.
Comment éliminer les dispositifs transdermiques usagés ou les dispositifs qui ne sont plus utilisés ?
Une exposition accidentelle à des dispositifs usagés ou non utilisés, en particulier chez les enfants, peut entraîner la mort.
Les dispositifs usagés doivent être fermement pliés en deux de façon à ce que la face adhésive colle sur elle-même. Ils doivent ensuite être éliminés de façon sécurisée en les remettant dans le système de récupération fourni dans l’emballage et doivent être rangés hors de la vue et de la portée d’autres personnes, particulièrement des enfants, jusqu’à leur élimination sécurisée. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus.
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient FENTANYL TEVA SANTE 75 microgrammes/heure, dispositif transdermique
· La substance active est :
Fentanyl.................................................................................................................... 12,375 mg
Pour un dispositif de 22,5 cm2 libérant 75 microgrammes de fentanyl par heure.
· Les autres composants sont :
Matrice adhésive : en polyacrylate.
Support protecteur : feuille de polypropylène, encre d’impression bleue.
Feuille protectrice détachable : film de téréphtalate de polyéthylène siliconé.
FENTANYL TEVA SANTE 75 microgrammes/heure, dispositif transdermique est un dispositif transdermique transparent dont la face postérieure est adhésive, ce qui permet de le coller sur la peau. Les dispositifs transdermiques portent une mention imprimée en bleu, qui indique le dosage.
Boîtes de 3, 5, 10 ou 20.
Toutes les présentations peuvent ne pas être commercialisées.
Titulaire de l’autorisation de mise sur le marché
TEVA SANTE
100-110, ESPLANADE DU GENERAL DE GAULLE
92931 PARIS LA DEFENSE CEDEX
Exploitant de l’autorisation de mise sur le marché
TEVA SANTE
100-110, ESPLANADE DU GENERAL DE GAULLE
92931 PARIS LA DEFENSE CEDEX
MERCKLE GMBH
GRAF-ARCO-STRASSE 3
89079 ULM
ALLEMAGNE
Ou
LUYE PHARMA AG
AM WINDFELD 35
83714 MIESBACH
ALLEMAGNE
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Ce médicament est autorisé dans les Etats membres de l'Espace Economique Européen et au Royaume-Uni (Irlande du Nord) sous les noms suivants : Conformément à la réglementation en vigueur.
[à compléter ultérieurement par le titulaire]
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
< {MM/AAAA}>< {mois AAAA}.>
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).