Dernière mise à jour le 01/12/2025
GANIRELIX EG 0,25 mg/0,5 mL, solution injectable en seringue préremplie
Indications thérapeutiques
GANIRELIX EG contient la substance active ganirélix et appartient au groupe des médicaments appelés « antagonistes de l’hormone de libération des gonadotrophines » bloquant les effets de l’hormone naturelle de libération des gonadotrophines (GnRH). La GnRH régule la libération des gonadotrophines (hormone lutéinisante [LH] et hormone folliculo-stimulante [FSH]). Les gonadotrophines jouent un rôle important dans la fertilité humaine et la reproduction. Chez les femmes, la FSH est nécessaire pour la croissance et le développement des follicules dans les ovaires. Les follicules sont de petits sacs ronds qui contiennent les ovocytes. La LH est nécessaire pour libérer les ovocytes matures hors des follicules et des ovaires (c’est-à-dire l’ovulation). GANIRELIX EG inhibe l'action de la GnRH, entraînant une suppression de la libération de LH en particulier.
Utilisation de GANIRELIX EG
Chez les femmes ayant recours à des techniques médicales d’assistance à la procréation, telles que la fécondation in vitro (FIV) et d’autres méthodes, l’ovulation peut parfois avoir lieu trop tôt et entraîner une diminution significative des chances de devenir enceinte. GANIRELIX EG est utilisé pour prévenir le pic prématuré de LH qui est susceptible d’entraîner une libération prématurée des ovocytes.
Dans les études cliniques, le ganirélix a été utilisé en association avec l’hormone folliculo-stimulante recombinante (FSH) ou la corifollitropine alfa, un stimulant folliculaire à longue durée d’action.
Présentations
> 1 seringue préremplie en verre avec aiguille de 0,5 mL
Code CIP : 34009 302 689 8 8
Déclaration de commercialisation : 08/05/2024
Cette présentation est agréée aux collectivités
- Prix hors honoraire de dispensation : 22,89 €
- Honoraire de dispensation : 1,02 €
- Prix honoraire compris : 23,91 €
- Taux de remboursement :100 %
> 5 seringues préremplies en verre avec aiguilles de 0,5 mL
Code CIP : 34009 302 689 9 5
Déclaration de commercialisation : 29/05/2024
Cette présentation est agréée aux collectivités
- Prix hors honoraire de dispensation : 113,12 €
- Honoraire de dispensation : 1,02 €
- Prix honoraire compris : 114,14 €
- Taux de remboursement :100 %
Service médical rendu (SMR)
Amélioration du service médical rendu (ASMR)
Ce médicament étant un générique, l'ASMR n'a pas été évalué par la commission de la transparence (CT), il est possible de se référer à la /aux spécialité(s) de référence du groupe générique auquel appartient ce médicament (cliquez ici pour aller à la rubrique des groupes génériques)
Autres informations
- Titulaire de l'autorisation : EG LABO - Laboratoires EuroGenerics
- Conditions de prescription et de délivrance :
- liste I
- médicament nécessitant une surveillance particulière pendant le traitement
- prescription réservée aux spécialistes et services ENDOCRINOLOGIE
- prescription réservée aux spécialistes et services GYNECOLOGIE
- prescription réservée aux spécialistes et services MALADIES METABOLIQUES
- prescription réservée aux spécialistes et services OBSTETRIQUE
- Statut de l'autorisation : Valide
- Type de procédure : Procédure décentralisée
- Code CIS : 6 112 595 8
ANSM - Mis à jour le : 15/09/2025
GANIRELIX EG 0,25 mg/0,5 mL, solution injectable en seringue préremplie
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Chaque seringue pré-remplie contient de l’acétate de ganirélix équivalent à 0,25 mg de ganirélix dans 0,5 mL de solution aqueuse.
La substance active, le ganirélix (sous forme d’acétate) (DCI), est un décapeptide synthétique doté d’une haute activité antagoniste de l’hormone naturelle de libération des gonadotrophines (GnRH). Les acides aminés en position 1, 2, 3, 6, 8 et 10 du décapeptide naturel GnRH ont été substitués, pour donner le [N-Ac-D-Nal (2)1, D-pClPhe2, D-Pal(3)3, D-hArg(Et2)6, L-hArg(Et2)8, D-Ala10]-GnRH d’un poids moléculaire de 1570,3.
Pour la liste complète des excipients, voir rubrique 6.1.
Solution injectable en seringue préremplie.
Solution aqueuse limpide et incolore avec un pH compris entre 4,5 et 5,5.
4.1. Indications thérapeutiques
Le ganirélix est indiqué dans la prévention des pics prématurés d’hormone lutéinisante (LH) chez les femmes en cours d’hyperstimulation ovarienne contrôlée (HOC) dans le cadre des techniques d’assistance médicale à la procréation (AMP).
Dans les études cliniques, le ganirélix a été utilisé en association avec une hormone folliculo-stimulante humaine recombinante (FSH) ou la corifollitropine alfa, un stimulant folliculaire à action prolongée.
4.2. Posologie et mode d'administration
Le ganirélix ne doit être prescrit que par un spécialiste ayant de l’expérience dans le traitement de l’infertilité.
Posologie
Le ganirélix est utilisé pour prévenir les pics prématurés de LH chez les femmes en cours d’HOC. L’hyperstimulation ovarienne contrôlée par la FSH ou la corifollitropine alfa peut commencer au 2e ou au 3e jour des règles. Le ganirélix (0,25 mg) doit être injecté par voie sous-cutanée une fois par jour, en commençant le 5e ou le 6e jour de l’administration de FSH ou le 5e ou le 6e jour suivant l’administration de la corifollitropine alfa. Le jour de l’instauration du traitement par ganirélix est déterminé en fonction de la réponse ovarienne, c’est-à-dire du nombre et de la taille des follicules en voie de maturation et/ou du taux d’estradiol circulant. Le début du traitement par ganirélix peut être retardé en l’absence de croissance folliculaire, bien que l’expérience clinique soit basée sur un début de traitement par ganirélix au 5e ou au 6e jour de la stimulation.
Le ganirélix et la FSH doivent être administrés approximativement au même moment. Cependant, les préparations ne doivent pas être mélangées et des sites d’injection différents doivent être utilisés.
Les ajustements de dose de FSH doivent être basés sur le nombre et la taille des follicules en voie de maturation, plutôt que sur le taux d’estradiol circulant (voir rubrique 5.1).
Le traitement quotidien par ganirélix doit être poursuivi jusqu’au jour d’obtention d’un nombre suffisant de follicules de taille adéquate. La maturation finale des follicules peut être induite par l’administration de gonadotrophine chorionique humaine (hCG).
Moment de la dernière injection
En raison de la demi-vie du ganirélix, le délai entre deux injections de ganirélix, ainsi que celui entre la dernière injection de ganirélix et l’injection d’hCG ne doivent pas dépasser 30 heures. Dans le cas contraire, un pic prématuré de LH risque de survenir. Par conséquent, lorsque le ganirélix est injecté au cours de la matinée, le traitement par ganirélix doit être poursuivi pendant toute la période du traitement par gonadotrophine, y compris le jour de déclenchement de l’ovulation. Lorsque le ganirélix est injecté au cours de l’après-midi, la dernière injection de ganirélix doit être effectuée dans l’après-midi, la veille du jour de déclenchement de l’ovulation.
Le ganirélix s’est avéré sûr et efficace chez les femmes ayant eu plusieurs cycles de traitement.
La nécessité d’un soutien de la phase lutéale pendant les cycles sous ganirélix n’a pas été étudiée. Dans les études cliniques, le soutien de la phase lutéale a été réalisé selon les pratiques habituelles du centre d’étude ou selon le protocole clinique.
Populations particulières
Insuffisance rénale
Les sujets présentant une insuffisance rénale n’étant pas inclus dans les études cliniques, il n’existe pas de données sur l’utilisation du ganirélix chez ces sujets. Par conséquent, l’utilisation du ganirélix est contre indiquée chez les patientes présentant une insuffisance rénale modérée ou sévère (voir rubrique 4.3).
Insuffisance hépatique
Les sujets présentant une insuffisance hépatique n’étant pas inclus dans les études cliniques, il n’existe pas de données sur l’utilisation du ganirélix chez ces sujets. Par conséquent, l’utilisation du ganirélix est contre indiquée chez les patientes présentant une insuffisance hépatique modérée ou sévère (voir rubrique 4.3).
Population pédiatrique
Il n’existe pas d’utilisation justifiée du ganirélix dans la population pédiatrique.
Mode d’administration
Le ganirélix doit être administré par voie sous-cutanée, de préférence dans la cuisse. Pour éviter une lipodystrophie, le site d’injection doit changer d’une injection à l’autre. La patiente ou son partenaire, peuvent réaliser eux-mêmes les injections de ganirélix, à condition qu’ils aient été convenablement formés et qu’ils aient accès à un avis compétent.
Une/des bulle(s) d'air peuvent apparaître dans la seringue préremplie. Ceci est attendu, et l'élimination de la/des bulle(s) d'air n'est pas nécessaire.
· Hypersensibilité à la substance active ou à l’un des excipients mentionnés à la rubrique 6.1.
· Hypersensibilité à l’hormone de libération des gonadotrophines (GnRH) ou à tout autre analogue de la GnRH.
· Insuffisance rénale ou hépatique modérée ou sévère.
· Grossesse ou allaitement.
4.4. Mises en garde spéciales et précautions d'emploi
Réaction d’hypersensibilité
Des précautions particulières doivent être prises chez les femmes présentant des signes et des symptômes de prédisposition allergique. Depuis la commercialisation, des cas de réactions d’hypersensibilité (à la fois généralisées et locales) ont été rapportés avec le ganirélix, dès la première dose. Ces événements ont inclus anaphylaxie (y compris choc anaphylactique), angio-œdème et urticaire (voir rubrique 4.8). Si une réaction d’hypersensibilité est suspectée, le ganirélix doit être arrêté et un traitement approprié doit être administré. En l’absence de données cliniques, un traitement par ganirélix n’est pas recommandé chez les femmes présentant des risques importants d’allergie.
Syndrome d'hyperstimulation ovarienne (SHSO)
Le syndrome d’hyperstimulation ovarienne (SHSO) peut survenir pendant ou à la suite d'une stimulation ovarienne. Le SHSO doit être considéré comme un risque intrinsèque de la stimulation par une gonadotrophine. Le SHSO doit être traité de façon symptomatique, par exemple par du repos, une perfusion par voie intraveineuse d’une solution d’électrolytes ou de colloïdes et de l’héparine.
Grossesse extra-utérine
Etant donné que les femmes infertiles suivant des techniques d’assistance à la procréation, notamment des fécondations in vitro (FIV), présentent souvent des anomalies tubaires, l’incidence des grossesses extra-utérines peut être augmentée. Il est important de confirmer par une échographie précoce que la grossesse est intra-utérine.
Malformations congénitales
L'incidence des malformations congénitales après des techniques d’assistance médicale à la procréation (AMP) peut être plus élevée qu'après des conceptions spontanées. Ceci semble dû à des différences au niveau des caractéristiques des parents (par exemple, âge de la mère, qualité du sperme) et à une augmentation de l'incidence des grossesses multiples. Dans des études cliniques portant sur plus de 1 000 nouveau-nés, il a été démontré que l’incidence des malformations congénitales chez les enfants nés suite à une HOC utilisant le ganirélix était comparable à celle rapportée après HOC utilisant un agoniste de la GnRH.
Femmes pesant moins de 50 kg ou plus de 90 kg
La sécurité et l’efficacité du ganirélix n’ont pas été établies chez les femmes pesant moins de 50 kg ou plus de 90 kg (voir également rubriques 5.1 et 5.2).
Sodium
Ce médicament contient moins de 1 mmol (23 mg) de sodium par injection, c’est-à-dire qu’il est essentiellement « sans sodium ».
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Aucune étude d’interaction n’a été réalisée.
La possibilité d’interactions avec des médicaments fréquemment utilisés, y compris les médicaments libérant de l’histamine, ne peut être exclue.
4.6. Fertilité, grossesse et allaitement
Grossesse
Il n'existe pas de données pertinentes concernant l'utilisation du ganirélix chez la femme enceinte.
Chez les animaux, une exposition au ganirélix au moment de l’implantation a abouti à une résorption de la portée (voir rubrique 5.3). On ignore la pertinence de ces données chez l’être humain.
Allaitement
On ignore si le ganirélix est excrété dans le lait maternel.
L’utilisation de ganirélix est contre-indiquée pendant la grossesse et l’allaitement (voir rubrique 4.3).
Fertilité
Le ganirélix est utilisé pour traiter les femmes sous hyperstimulation ovarienne contrôlée dans le cadre des programmes de procréation médicalement assistée. Le ganirélix est utilisé pour prévenir les pics prématurés de LH qui pourraient autrement survenir chez ces femmes pendant la stimulation ovarienne.
Pour la posologie et la méthode d'administration, voir rubrique 4.2.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Les effets sur l’aptitude à conduire des véhicules et à utiliser des machines n’ont pas été étudiés.
Résumé du profil de sécurité
Le tableau ci-dessous présente tous les effets indésirables rapportés dans les études cliniques chez les femmes traitées par ganirélix en association avec la FSHrec pour la stimulation ovarienne. Des effets indésirables similaires sont attendus avec le ganirélix utilisé en association avec la corifollitropine alfa pour la stimulation ovarienne.
Tableau listant les effets indésirables
Les effets indésirables sont classés conformément à la classe de systèmes d’organes MedDRA et à la fréquence : très fréquent (≥ 1/10), fréquent (≥ 1/100, < 1/10), peu fréquent (≥ 1/1 000, < 1/100). La fréquence des réactions d’hypersensibilité (très rare, < 1/10 000) est issue de l’expérience post-commercialisation.
|
Classe de systèmes d’organes |
Fréquence |
Effet indésirable |
|
Affections du système immunitaire |
Très rare |
Réactions d’hypersensibilité (incluant rash, gonflement du visage, dyspnée, anaphylaxie [y compris choc anaphylactique], angio-œdème et urticaire)1 Aggravation d'un eczéma préexistant2 |
|
Affections du système nerveux |
Peu fréquent |
Céphalées |
|
Affections gastro-intestinales |
Peu fréquent |
Nausées |
|
Troubles généraux et anomalies au site d’administration |
Très fréquent |
Réaction cutanée locale au site d’injection (principalement rougeur, avec ou sans gonflement)3 |
|
Peu fréquent |
Malaise |
1 Des cas ont été rapportés, dès la première dose, chez des patients recevant le ganirélix.
2 Rapporté chez un sujet après la première dose de ganirélix.
3 Dans les études cliniques, une heure après l'injection, 12 % des patientes traitées par ganirélix et 25 % des patientes traitées par un agoniste de la GnRH par voie sous cutanée ont rapporté une réaction cutanée locale modérée ou sévère survenue au moins une fois par cycle de traitement. Les réactions locales disparaissent en général dans les 4 heures suivant l’administration.
Description d’effets indésirables sélectionnés
Les autres effets indésirables rapportés sont liés à l’hyperstimulation ovarienne contrôlée dans le cadre des techniques d’AMP, notamment douleur pelvienne, distension abdominale, SHSO (voir rubrique 4.4), grossesse extra-utérine et avortement spontané.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr.
Un surdosage peut aboutir à une durée d’action prolongée.
Aucune donnée sur la toxicité aiguë du ganirélix chez l’être humain n’est disponible. Les études cliniques portant sur l’administration sous-cutanée de ganirélix à des doses uniques allant jusqu’à 12 mg n’ont pas révélé d'effet indésirable systémique. Au cours des études de toxicité aiguë chez le rat et le singe, seuls des symptômes de toxicité non spécifique, tels que hypotension et bradycardie, ont été observés après administration intraveineuse de ganirélix à plus de 1 et 3 mg/kg, respectivement.
En cas de surdosage, le traitement par ganirélix doit être (temporairement) arrêté.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Classe pharmacothérapeutique : Hormones hypophysaires, hypothalamiques et analogues, anti-hormones entraînant la libération de gonadotrophine, code ATC : H01CC01.
Mécanisme d’action
Le ganirélix est un antagoniste de la GnRH, qui module l’axe hypothalamo-hypophyso-gonadique en se liant de façon compétitive aux récepteurs de la GnRH dans l’hypophyse. De ce fait, une suppression rapide, profonde et réversible des gonadotrophines endogènes survient, sans la stimulation initiale que l’on constate avec les agonistes de la GnRH. A la suite de l’administration de multiples doses de 0,25 mg de ganirélix à des femmes volontaires, les concentrations sériques en LH diminuaient au maximum de 74 %, 4 heures après l’injection et celles en FSH et E2 respectivement de 32 % et de 25 %, 16 heures après l’injection. Les taux hormonaux sériques revenaient aux valeurs de pré-traitement dans les deux jours suivant la dernière injection.
Effets pharmacodynamiques
Chez les patientes en cours de stimulation ovarienne contrôlée, la durée médiane du traitement par ganirélix était de 5 jours. Pendant le traitement par ganirélix, l’incidence moyenne des élévations de LH (> 10 UI/L) avec une élévation concomitante de la progestérone (> 1 ng/mL) a été de 0,3– 1,2 % par rapport à 0,8 % pendant le traitement par agoniste de la GnRH. Une tendance à l’augmentation de l’incidence des élévations de LH et de la progestérone a été observée chez les femmes présentant un poids corporel élevé (> 80 kg), mais aucun effet sur les résultats cliniques n’a été observé. Cependant, étant donné le faible nombre de patientes traitées à ce jour, un effet ne peut être exclu.
En cas de réponse ovarienne importante, résultant soit d’une forte exposition aux gonadotrophines au début de la phase folliculaire soit d’une haute réactivité ovarienne, des pics prématurés de LH peuvent survenir plus tôt que le 6e jour de stimulation. L’instauration du traitement par ganirélix au 5e jour de la stimulation peut empêcher ces pics prématurés de LH sans compromettre les résultats cliniques.
Efficacité et sécurité clinique
Dans les études contrôlées portant sur le ganirélix associé à la FSH, utilisant un protocole long avec un agoniste de la GnRH comme référence, le traitement par ganirélix a permis une croissance folliculaire plus rapide pendant les premiers jours de stimulation, mais la cohorte de follicules en voie de maturation finale était légèrement plus réduite et a sécrété en moyenne des taux moindres d’estradiol. Ce profil différent de la croissance folliculaire nécessite que les ajustements des doses de FSH soient basés sur le nombre et la taille des follicules en voie de maturation, plutôt que sur le taux d’estradiol circulant. Des études cliniques comparatives similaires avec la corifollitropine alfa utilisant soit un antagoniste de la GnRH soit un protocole agoniste long n’ont pas été réalisées.
5.2. Propriétés pharmacocinétiques
Les paramètres pharmacocinétiques après administrations sous-cutanées répétées de ganirélix (injection quotidienne) sont comparables à ceux observés après une dose unique sous-cutanée. Des taux plasmatiques à l’équilibre d’environ 0,6 ng/mL sont atteints en 2 à 3 jours, après administration répétée de 0,25 mg/jour.
L'analyse pharmacocinétique indique une relation inverse entre le poids corporel et les concentrations sériques de ganirélix.
Absorption
Après une administration unique sous-cutanée de 0,25 mg, les taux sériques de ganirélix augmentent rapidement et atteignent un pic (Cmax) d’environ 15 ng/mL en 1 à 2 heures (tmax). La biodisponibilité du ganirélix après administration sous-cutanée est d'environ 91 %.
Biotransformation
Le composant principal circulant dans le plasma est le ganirélix. Le ganirélix est aussi le composant principal retrouvé dans l’urine. Les fèces ne contiennent que des métabolites. Les métabolites sont des petits fragments peptidiques formés par hydrolyse enzymatique du ganirélix survenant en des sites limités. Le profil métabolique du ganirélix chez l’être humain est similaire à celui observé chez l’animal.
Elimination
La demi-vie d'élimination (t½) est d'environ 13 heures et la clairance est d'environ 2,4 L/h. L'excrétion se fait par les fèces (environ 75 %) et l'urine (environ 22 %).
5.3. Données de sécurité préclinique
Des études de reproduction réalisées avec le ganirélix chez le rat à des doses allant de 0,1 à 10 µg/kg/jour par voie sous-cutanée et chez le lapin à des doses allant de 0,1 à 50 µg/kg/jour par voie sous-cutanée ont révélé une augmentation du taux de résorption des portées dans les groupes de dose les plus élevées. Aucun effet tératogène n’a été observé.
5 ans
6.4. Précautions particulières de conservation
Ce médicament ne nécessite pas de précautions particulières de conservation.
6.5. Nature et contenu de l'emballage extérieur
Seringues préremplies en verre incolore de type I contenant 0,5 mL de solution aqueuse stérile, prête à l’emploi, fermée par un bouchon-piston et une tige de piston en caoutchouc chlorobutyle ou bromobutyle. Chaque seringue préremplie est munie d’une aiguille d’injection (27G) recouverte d’un capuchon d’aiguille en caoutchouc synthétique qui entre en contact avec l’aiguille. Le capuchon de l’aiguille est protégé par un protège-aiguille rigide en plastique.
Fournies en boîtes contenant 1 ou 5 seringues préremplies comme spécifié ci-dessous :
· 1 seringue préremplie
· 5 seringues préremplies
Toutes les présentations peuvent ne pas être commercialisées.
6.6. Précautions particulières d’élimination et de manipulation
Examiner la seringue avant utilisation. Utiliser la seringue uniquement si la solution est limpide, exempte de particules et si son conditionnement n’a pas été endommagé.
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
EG LABO – LABORATOIRES EUROGENERICS
Central Park
9-15 rue Maurice Mallet
92130 Issy les Moulineaux
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 302 689 8 8 : 0,5 mL en seringue préremplie (verre). Boîte de 1.
· 34009 302 689 9 5 : 0,5 mL en seringue préremplie (verre). Boîte de 5.
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Liste I
Médicament soumis à une prescription réservée aux spécialistes en gynécologie et/ou en gynécologie-obstétrique et/ou en endocrinologie et métabolisme.
Médicament nécessitant une surveillance particulière pendant le traitement.
ANSM - Mis à jour le : 15/09/2025
GANIRELIX EG 0,25 mg/0,5 mL, solution injectable en seringue préremplie
Ganirélix
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin, votre pharmacien ou votre infirmier/ère.
· Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d’autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin, votre pharmacien ou votre infirmier/ère. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
1. Qu'est-ce que GANIRELIX EG 0,25 mg/0,5 mL, solution injectable en seringue préremplie et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant d'utiliser GANIRELIX EG 0,25 mg/0,5 mL, solution injectable en seringue préremplie ?
3. Comment utiliser GANIRELIX EG 0,25 mg/0,5 mL, solution injectable en seringue préremplie ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver GANIRELIX EG 0,25 mg/0,5 mL, solution injectable en seringue préremplie ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE GANIRELIX EG 0,25 mg/0,5 mL, solution injectable en seringue préremplie ET DANS QUELS CAS EST-IL UTILISE ?
GANIRELIX EG contient la substance active ganirélix et appartient au groupe des médicaments appelés « antagonistes de l’hormone de libération des gonadotrophines » bloquant les effets de l’hormone naturelle de libération des gonadotrophines (GnRH). La GnRH régule la libération des gonadotrophines (hormone lutéinisante [LH] et hormone folliculo-stimulante [FSH]). Les gonadotrophines jouent un rôle important dans la fertilité humaine et la reproduction. Chez les femmes, la FSH est nécessaire pour la croissance et le développement des follicules dans les ovaires. Les follicules sont de petits sacs ronds qui contiennent les ovocytes. La LH est nécessaire pour libérer les ovocytes matures hors des follicules et des ovaires (c’est-à-dire l’ovulation). GANIRELIX EG inhibe l'action de la GnRH, entraînant une suppression de la libération de LH en particulier.
Utilisation de GANIRELIX EG
Chez les femmes ayant recours à des techniques médicales d’assistance à la procréation, telles que la fécondation in vitro (FIV) et d’autres méthodes, l’ovulation peut parfois avoir lieu trop tôt et entraîner une diminution significative des chances de devenir enceinte. GANIRELIX EG est utilisé pour prévenir le pic prématuré de LH qui est susceptible d’entraîner une libération prématurée des ovocytes.
Dans les études cliniques, le ganirélix a été utilisé en association avec l’hormone folliculo-stimulante recombinante (FSH) ou la corifollitropine alfa, un stimulant folliculaire à longue durée d’action.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D’UTILISER GANIRELIX EG 0,25 mg/0,5 mL, solution injectable en seringue préremplie ?
N’utilisez jamais GANIRELIX EG 0,25 mg/0,5 mL, solution injectable en seringue préremplie
· si vous êtes allergique au ganirélix ou à l’un des autres composants contenus dans ce médicament, mentionnés dans la rubrique 6 ;
· si vous êtes allergique à l’hormone de libération des gonadotrophines (GnRH) ou à un analogue de la GnRH ;
· si vous présentez une maladie rénale ou hépatique modérée ou sévère ;
· si vous êtes enceinte ou si vous allaitez.
Avertissements et précautions
Adressez-vous à votre médecin, pharmacien ou infirmier/ère avant d’utiliser GANIRELIX EG.
· Si vous avez des prédispositions allergiques, veuillez-en parler à votre médecin. Votre médecin décidera en fonction de leur sévérité si une surveillance supplémentaire est nécessaire pendant le traitement. Des cas de réactions allergiques ont été rapportés, dès la première dose.
· Des réactions allergiques, à la fois généralisées et locales, incluant urticaire, gonflement du visage, des lèvres, de la langue et/ou de la gorge pouvant provoquer des difficultés à respirer et/ou à avaler (angio-œdème et/ou anaphylaxie) ont été rapportées (voir également rubrique 4). Si vous développez une réaction allergique, arrêtez de prendre GANIRELIX EG et consultez immédiatement un médecin.
· Pendant ou à la suite d’une stimulation hormonale des ovaires, un syndrome d’hyperstimulation ovarienne peut se développer. Ce syndrome est lié au traitement de stimulation par les gonadotrophines. Veuillez-vous rapporter à la notice du médicament contenant de la gonadotrophine qui vous a été prescrit.
· L’incidence des malformations congénitales après des techniques d’assistance médicale à la procréation peut être légèrement plus élevée qu’après des conceptions spontanées. Cette incidence légèrement plus élevée semble être liée aux caractéristiques des patientes suivant un traitement pour la fertilité (par exemple, âge de la femme, caractéristiques du sperme) et à une augmentation de l’incidence des grossesses multiples après des techniques d’assistance médicale à la procréation. L’incidence des malformations congénitales après des techniques d’assistance médicale à la procréation utilisant GANIRELIX EG est comparable à celle rapportée après utilisation d’autres analogues de la GnRH au cours des techniques d’assistance médicale à la procréation.
· Il y a une légère augmentation du risque de grossesse hors de l’utérus (grossesse extra-utérine) chez les femmes présentant une anomalie des trompes de Fallope.
· L’efficacité et la sécurité de GANIRELIX EG n’ont été établies que chez les femmes pesant moins de 50 kg ou plus de 90 kg. Pour plus d’informations, adressez-vous à votre médecin.
Enfants et adolescents
GANIRELIX EG n’est pas utilisé chez les enfants ou les adolescents.
Autres médicaments et GANIRELIX EG 0,25 mg/0,5 mL, solution injectable en seringue préremplie
Informez votre médecin ou pharmacien si vous prenez, avez récemment pris ou pourriez prendre tout autre médicament.
GANIRELIX EG 0,25 mg/0,5 mL, solution injectable en seringue préremplie avec des aliments et boissons
Sans objet.
Grossesse, allaitement et fertilité
Si vous êtes enceinte ou que vous allaitez, si vous pensez être enceinte ou planifiez une grossesse, demandez conseil à votre médecin ou pharmacien avant d’utiliser ce médicament.
GANIRELIX EG doit être utilisé au cours d’une stimulation ovarienne contrôlée dans le cadre d’une assistance médicale à la procréation (AMP).
N’utilisez pas GANIRELIX EG pendant la grossesse et l’allaitement.
Conduite de véhicules et utilisation de machines
Les effets de GANIRELIX EG sur l’aptitude à conduire des véhicules et à utiliser des machines n’ont pas été étudiés.
GANIRELIX EG 0,25 mg/0,5 mL, solution injectable en seringue préremplie contient du sodium
Ce médicament contient moins de 1 mmol (23 mg) de sodium par injection, c’est-à-dire qu’il est essentiellement « sans sodium ».
3. COMMENT UTILISER GANIRELIX EG 0,25 mg/0,5 mL, solution injectable en seringue préremplie ?
Vous effectuerez vous-même les injections et votre médecin vous expliquera comment vous devez procéder. Veillez à toujours utiliser ce médicament en suivant exactement les indications de votre médecin ou pharmacien. Vérifiez auprès de votre médecin ou pharmacien si vous n'avez pas compris les instructions.
Etape 1
La stimulation ovarienne par l’hormone folliculo-stimulante (FSH) ou la corifollitropine peut commencer au 2e ou au 3e jour de vos règles.
Etape 2
Le contenu de la seringue GANIRELIX EG (0,25 mg) doit être injecté juste sous la peau une fois par jour, en commençant le 5e ou le 6e jour de la stimulation. En fonction de votre réponse ovarienne, votre médecin pourra décider de commencer le traitement un autre jour.
GANIRELIX EG et la FSH doivent être administrés approximativement au même moment. Toutefois, les préparations ne doivent pas être mélangées et des sites d’injection différents doivent être utilisés.
Le traitement quotidien par GANIRELIX EG doit être poursuivi jusqu'au jour où un nombre suffisant de follicules de taille adéquate sont présents.
Etape 3
La maturation finale des ovocytes contenus dans les follicules peut être induite par administration de gonadotrophine chorionique humaine (hCG). Le délai entre deux injections de GANIRELIX EG, ainsi que celui entre la dernière injection de GANIRELIX EG et l'injection d'hCG ne doit pas dépasser 30 heures car, dans le cas contraire, une ovulation prématurée (c.-à-d. libération des ovocytes) peut survenir. Par conséquent, si vous avez injecté GANIRELIX EG au cours de la matinée, vous devez également recevoir GANIRELIX EG le jour où vous recevrez le traitement par hCG pour déclencher l’ovulation. Si vous avez injecté GANIRELIX EG au cours de l'après-midi, la dernière injection de GANIRELIX EG doit être effectuée dans l’après-midi, la veille du jour de déclenchement de l’ovulation.
Instructions pour l’utilisation
· Zone d’injection
GANIRELIX EG est fourni en seringues préremplies contenant une dose. Le contenu doit être injecté lentement, juste sous la peau, de préférence dans la cuisse. Examinez la solution avant utilisation. Ne pas l’utiliser si elle contient des particules ou si elle n’est pas limpide. Vous pouvez remarquer une ou plusieurs bulles d'air dans la seringue préremplie. Ceci est attendu, et l'élimination de la ou des bulles d'air n'est pas nécessaire. Si vous pratiquez vous-même les injections ou si elles sont effectuées par votre partenaire, suivez attentivement les instructions ci-dessous. Ne mélangez GANIRELIX EG avec aucun autre médicament.
· Préparation du site d'injection
Lavez-vous minutieusement les mains à l'eau et au savon. Nettoyez le site d'injection avec un désinfectant (par exemple, alcool) afin d'éliminer toutes les bactéries cutanées. Désinfectez sur une zone d’environ 5 cm (2 pouces) autour du site d'injection et laissez sécher le désinfectant pendant au moins une minute avant de pratiquer l’injection.
· Introduction de l'aiguille
Prendre 1 seringue du blister en saisissant la seringue par son corps. Ne pas prendre la seringue par la tige du piston.
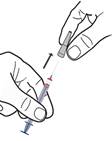
1. Tenez la seringue verticalement et retirez le capuchon de l'aiguille sans mouvement de pression ou de rotation.
2. Pincez délicatement la zone propre de la peau pour faire un pli cutané.
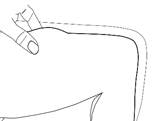
3. Introduisez l'aiguille à la base de la peau pincée, selon un angle de 45° par rapport à la surface de la peau.
|
|
|
|
||
|
|
|
||
Changez de site d'injection à chaque injection.
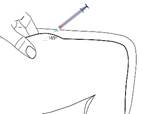
· Vérification de la position correcte de l'aiguille
Tirez doucement sur le piston de la seringue pour vérifier que l’aiguille est correctement placée. Toute présence de sang dans la seringue signifie que l’extrémité de l'aiguille a pénétré un vaisseau sanguin. Dans ce cas, ne poursuivez pas l’injection de GANIRELIX EG. Retirez la seringue, couvrez le site d'injection d'un coton imbibé de désinfectant et exercez une pression ; le saignement doit cesser en une ou deux minutes. N’utilisez plus cette seringue, et jetez-la soigneusement. Recommencez avec une nouvelle seringue.
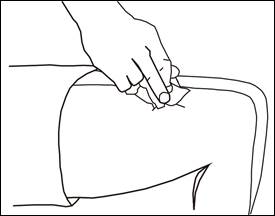
· Injection de la solution
Une fois l'aiguille correctement positionnée, poussez le piston lentement et régulièrement, la solution sera ainsi correctement injectée et les tissus cutanés ne seront pas abimés.
· Retrait de la seringue
Retirez rapidement la seringue.
Exercez une pression sur le site d’injection à l’aide d’un coton imbibé de désinfectant. N’utilisez la seringue préremplie qu’une seule fois.
|
|
Si vous avez utilisé plus de GANIRELIX EG 0,25 mg/0,5 mL, solution injectable en seringue préremplie que vous n’auriez dû
Contactez votre médecin.
Si vous oubliez d’utiliser GANIRELIX EG 0,25 mg/0,5 mL, solution injectable en seringue préremplie
Si vous vous rendez compte que vous avez oublié une dose, effectuez l’injection dès que possible.
N’injectez pas de dose double pour compenser la dose que vous avez oublié d’injecter.
Si le retard est supérieur à 6 heures (de sorte que l'intervalle entre deux injections dépasse les 30 heures), injectez la dose dès que possible, et contactez votre médecin pour obtenir des conseils supplémentaires.
Si vous arrêtez d’utiliser GANIRELIX EG 0,25 mg/0,5 mL, solution injectable en seringue préremplie
N’arrêtez pas d’utiliser GANIRELIX EG à moins que cela ne soit conseillé par votre médecin, car cela peut affecter l’issue de votre traitement.
Si vous avez d’autres questions sur l’utilisation de ce médicament, demandez plus d’informations à votre médecin, à votre pharmacien ou à votre infirmier/ère.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Très fréquent (pouvant affecter plus de 1 femme sur 10)
· Réaction cutanée locale au site d'injection (essentiellement rougeur, avec ou sans gonflement). La réaction locale disparaît normalement dans les 4 heures suivant l’administration.
Peu fréquent (pouvant affecter jusqu’à 1 femme sur 100)
· Maux de tête
· Nausées
· Malaise.
Très rare (pouvant affecter jusqu’à 1 femme sur 10 000)
· Des réactions allergiques ont été observées, dès la première dose.
· Eruption cutanée
· Gonflement du visage
· Difficulté à respirer (dyspnée)
· Gonflement du visage, des lèvres, de la langue et/ou de la gorge pouvant provoquer des difficultés à respirer et/ou à avaler (angio-œdème et/ou anaphylaxie)
· Urticaire.
De plus, des effets indésirables connus pour survenir pendant un traitement par hyperstimulation ovarienne contrôlée ont été rapportés, tels que :
· Douleurs abdominales
· Syndrome d'hyperstimulation ovarienne (SHSO). (Le SHSO se produit lorsque vos ovaires réagissent de manière excessive aux médicaments de fertilité que vous prenez)
· Grossesse extra-utérine (lorsque l’embryon se développe en dehors de l’utérus)
· Fausse couche (voir la notice patient de la préparation contenant de la FSH avec laquelle vous êtes traitée).
Une aggravation d'une éruption de la peau pré-existante (eczéma) a été rapportée chez un sujet après la première dose de ganirélix.
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin, à votre pharmacien ou à votre infirmier/ère. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr.
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER GANIRELIX EG 0,25 mg/0,5 mL, solution injectable en seringue préremplie ?
Tenir ce médicament hors de la vue et de la portée des enfants.
N’utilisez pas ce médicament après la date de péremption indiquée sur la boîte et sur l'étiquette après EXP. La date de péremption fait référence au dernier jour de ce mois.
Ce médicament ne nécessite pas de précautions particulières de conservation.
Examinez la seringue avant utilisation. Utilisez la seringue uniquement si la solution est limpide, exempte de particules et si son conditionnement n’a pas été endommagé.
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient GANIRELIX EG 0,25 mg/0,5 mL, solution injectable en seringue préremplie
· La substance active est le ganirélix.
Chaque seringue pré-remplie contient 0,25 mg de ganirélix (sous forme d’acétate) dans 0,5 mL de solution aqueuse.
· Les autres composants sont : acide acétique glacial, mannitol et eau pour préparations njectables. Le pH (un indicateur de l’acidité) peut avoir été ajusté avec de l'hydroxyde de sodium et de l’acide acétique glacial.
GANIRELIX EG est une solution injectable, aqueuse, limpide et incolore. La solution est prête à l’emploi et destinée à une administration sous-cutanée.
GANIRELIX EG est disponible en boîtes de 1 ou 5 seringues préremplies avec aiguilles d'injection (27 G), comme spécifié ci-dessous :
· 1 seringue préremplie
· 5 seringues préremplies.
Toutes les présentations peuvent ne pas être commercialisées.
Titulaire de l’autorisation de mise sur le marché
EG LABO – LABORATOIRES EUROGENERICS
Central Park
9-15 rue Maurice Mallet
92130 Issy les Moulineaux
Exploitant de l’autorisation de mise sur le marché
EG LABO – LABORATOIRES EUROGENERICS
Central Park
9-15 rue Maurice Mallet
92130 Issy les Moulineaux
Poligono Industrial Els Vinyets-Els Fogars 2
Ctra. C-244 Km. 22 Sant Quinti de Mediona
08777 BarcelonE
espagne
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Ce médicament est autorisé dans les Etats membres de l'Espace Economique Européen sous les noms suivants : Conformément à la réglementation en vigueur.
[À compléter ultérieurement par le titulaire]
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
{mois AAAA}.
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).