Dernière mise à jour le 08/01/2026
CONDYLINE 0,5 %, solution pour application cutanée
Indications thérapeutiques
Classe pharmacothérapeutique : ANTIVIRAUX - code ATC : D06BB04 (D : Dermatologie)
Ce médicament est destiné au traitement des verrues génitales et péri-anales (végétations des organes génitaux externes ou zones atteintes autour de l'anus, provoquées par un virus).
Le mécanisme d'action de ce médicament conduit à la destruction des verrues génitales et péri-anales dans un délai de 2 à 5 semaines.
Au cours du traitement la verrue génitale devient sèche et crouteuse, puis disparaît.
Présentations
> 1 flacon(s) en verre brun de 3,5 ml avec 30 applicateur(s) polypropylène
Code CIP : 331 261-6 ou 34009 331 261 6 2
Déclaration de commercialisation : 10/05/1989
Cette présentation est agréée aux collectivités
- Prix hors honoraire de dispensation : 17,09 €
- Honoraire de dispensation : 1,02 €
- Prix honoraire compris : 18,11 €
- Taux de remboursement :65%
Service médical rendu (SMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprès de la HAS (plus d'informations dans l'aide). Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Important | Avis du 03/10/2018 | Renouvellement d'inscription (CT) | le service médical rendu par CONDYLINE 0,5% reste important dans l’indication de l’AMM. |
Amélioration du service médical rendu (ASMR)
Pas d'ASMR disponible pour ce médicament (plus d'informations dans l'aide )
ANSM - Mis à jour le : 24/11/2022
CONDYLINE 0,5%, solution pour application cutanée
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Pour 100 ml de solution.
(1) : principe actif de la résine de podophylline extraite à l'alcool à partir de rhizomes séchés et des racines de la podophylline (P. peltatum, P. emodi).
Pour la liste complète des excipients, voir rubrique 6.1.
Solution pour application cutanée.
4.1. Indications thérapeutiques
4.2. Posologie et mode d'administration
CONDYLINE doit être appliquée deux fois par jour pendant 3 jours consécutifs. Le traitement peut être répété chaque semaine pendant un maximum de 5 semaines successives.
Mode d’administration
Appliquer CONDYLINE avec précaution sur le condylome avec l'applicateur contenu dans le conditionnement et laisser sécher. Jeter l'applicateur usagé. Prendre soin que la préparation ne soit pas mise en contact avec la peau saine. Changer d'applicateur après chaque utilisation.
Hypersensibilité à la substance active ou à l’un des excipients mentionnés à la rubrique 6.1.
CONDYLINE est contre-indiquée pendant la grossesse en raison de ses effets antimitotiques.
Pour les mêmes raisons, elle ne doit pas être utilisée pendant l'allaitement ni chez l'enfant.
CONDYLINE ne doit pas être utilisée en association avec d'autres préparations à base de podophylline, de façon à éviter les risques de surdosage.
4.4. Mises en garde spéciales et précautions d'emploi
Chez toute femme en âge de procréer, s'assurer de l'absence de grossesse avant le début du traitement et prescrire une méthode efficace de contraception avant le début du traitement et pendant toute sa durée.
L'application de CONDYLINE sur des zones de surface relativement étendue (muqueuses) peut donner lieu à des effets secondaires systémiques et devra par conséquent être évitée. Durant l'application, on doit éviter tout contact du principe actif avec la peau saine ou les muqueuses avoisinantes.
Précautions d’emploi
Il est recommandé de laisser sécher avec précaution CONDYLINE après son application, de façon à éviter toute dissémination intempestive. Ceci s’applique plus particulièrement aux condylomes localisés dans la région du prépuce.
CONDYLINE ne doit pas être mis en contact avec les yeux sous peine d’irritation sévère. En cas de projection au niveau des yeux, rincer immédiatement et avec insistance avec de l’eau.
Une irritation cutanée et/ou ulcération des muqueuses saines de la peau à proximité ou à la base du condylome par CONDYLINE peut être évitée en appliquant une couche protectrice de crème neutre avant le traitement (vaseline ou pommade à base de zinc).
Ce médicament contient 732 mg d'alcool (éthanol) par ml. Cela peut provoquer une sensation de brûlure sur une peau endommagée.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Aucune étude d’interaction n’a été réalisée.
4.6. Fertilité, grossesse et allaitement
Grossesse et allaitement
CONDYLINE est contre-indiqué pendant la grossesse et l’allaitement en raison de ses effets antimitotiques.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Des effets secondaires locaux se produisent, indiquant principalement un effet thérapeutique maximal, habituellement le 2ème ou le 3ème jour du traitement, lorsque la nécrose du condylome débute. Ces effets secondaires sont en règle générale peu sévères et consistent en des rougeurs accompagnées de légères douleurs et/ou une ulcération superficielle de l'épithélium de la zone traitée. L'application de CONDYLINE peut en conséquence être douloureuse. Un œdème et une balanoposthite ont été observés chez quelques patients portant de larges lésions dans la cavité préputiale. De tels effets locaux s'estompent après quelques jours d'application d'un corticostéroïde topique.
En raison de la présence d’alcool, les applications fréquentes sur la peau peuvent provoquer des irritations et une sécheresse de la peau.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : www.signalement-sante.gouv.fr.
Le traitement consiste à inhiber l’absorption (vomissements provoqués et lavage gastrique rapidement après l’ingestion, utilisation de charbon activé et laxatifs). Les autres traitements sont symptomatiques.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Classe pharmacothérapeutique : ANTIVIRAUX, code ATC : D06BB04 (D : Dermatologie)
La podophyllotoxine est le principal composant actif de la podophylline qui est préparée à partir d'extraits de plante. La podophyllotoxine a une action antimitotique et cytolytique marquée conduisant à une nécrose des condylomes acuminés. Etant donné que CONDYLINE peut être dosée très précisément, un certain nombre d'effets secondaires sévères peuvent être réduits et le traitement ambulatoire devient possible. Des taux élevés de rémission sont obtenus.
5.2. Propriétés pharmacocinétiques
L'application pendant 3 jours de 0,01 à 0,05 ml de podophyllotoxine à 0,5% n'entraîne aucun passage détectable dans le sérum 1/2 heure à 1 heure après le traitement.
Une dose de 0,1 ml (condylome ayant une surface totale supérieure à 4 cm2) produit un taux sérique ≤ à 5 ng par ml après 1 à 2 heures, ce taux décroissant à un niveau ≤ à 3 ng par ml après 4 heures. Avec une dose de 0,15 ml, des valeurs à peu près comparables sont obtenues : un niveau ≤ à 1 ng par ml rémanent est mesuré 12 heures après l'application (chez 5 patients). Chez 7 patients ayant des lésions très importantes, chez lesquels a été appliquée une dose de 0,1 à 1,5 ml, les pics obtenus atteignent de 1 à 17 ng par ml après 1 à 2 heures. Des essais effectués chez 52 patients ont montré que des concentrations supérieures à 0,1 ml sont rarement nécessaires pour traiter les condylomes.
Distribution, métabolisme et excrétion
L'absorption de la podophyllotoxine semble fonction de la dose appliquée, de la taille, du siège, et de l'ancienneté des condylomes traités.
D'après les résultats obtenus après les tests d'absorption, on peut évaluer la demi-vie sérique de la podophyllotoxine de 1 à 4,5 heures. On n'observe pas d'accumulation du produit. Les résultats suggèrent que la cinétique obéit à un modèle bicompartimental.
5.3. Données de sécurité préclinique
Acide lactique, lactate de sodium, éthanol à 96% (v/v).
6.4. Précautions particulières de conservation
A conserver à une température ne dépassant pas 25°C.
6.5. Nature et contenu de l'emballage extérieur
3,5 ml en flacon (verre brun) avec 30 applicateurs (polypropylène).
6.6. Précautions particulières d’élimination et de manipulation
Pas d’exigences particulières.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
BOX 16184
103 24 STOCKHOLM
SUÈDE
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 331 262 6 2 : 3,5 ml en flacon (verre brun) et 30 applicateurs (polypropylène).
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
10. DATE DE MISE A JOUR DU TEXTE
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Liste I
ANSM - Mis à jour le : 24/11/2022
CONDYLINE 0,5%, solution pour application cutanée
Podophyllotoxine
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin ou votre pharmacien.
· Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d’autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
1. Qu'est-ce que CONDYLINE 0,5%, solution pour application cutanée et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant d'utiliser CONDYLINE 0,5%, solution pour application cutanée ?
3. Comment utiliser CONDYLINE 0,5%, solution pour application cutanée ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver CONDYLINE 0,5%, solution pour application cutanée ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE CONDYLINE 0,5%, solution pour application cutanée ET DANS QUELS CAS EST-IL UTILISE ?
Classe pharmacothérapeutique : ANTIVIRAUX - code ATC : D06BB04 (D : Dermatologie)
Ce médicament est destiné au traitement des verrues génitales et péri-anales (végétations des organes génitaux externes ou zones atteintes autour de l'anus, provoquées par un virus).
Le mécanisme d'action de ce médicament conduit à la destruction des verrues génitales et péri-anales dans un délai de 2 à 5 semaines.
Au cours du traitement la verrue génitale devient sèche et crouteuse, puis disparaît.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D’UTILISER CONDYLINE 0,5%, solution pour application cutanée ?
N’utilisez jamais CONDYLINE 0,5%, solution pour application locale :
· si vous êtes allergique à la podophyllotoxine ou à l’un des autres composants contenus dans ce médicament, mentionnés dans la rubrique 6 ;
· si vous utilisez déjà une autre préparation contenant la même substance active que CONDYLINE 0,5%, solution pour application cutanée (la podophyllotoxine) ;
· si vous êtes une femme enceinte ;
· si vous êtes une femme qui allaite ;
· chez un enfant.
Avertissements et précautions
Faites attention avec CONDYLINE 0,5%, solution pour application cutanée :
· Evitez d'appliquer CONDYLINE 0,5%, solution pour application cutanée sur des zones de peau relativement étendues.
· Evitez de mettre en contact la solution avec les yeux sous peine d'irritation sévère. Si la solution est entrée en contact avec vos yeux, rincez immédiatement et abondamment avec de l'eau.
· Si vous appliquez CONDYLINE 0,5%, solution pour application cutanée par accident sur une peau saine ou sur les muqueuses avoisinantes à la verrue, une irritation cutanée et/ou ulcération peuvent apparaître. Ces effets peuvent être évités en appliquant avant le traitement une couche protectrice de crème neutre (vaseline ou pommade à base de zinc) autour de la verrue génitale ou péri-anale.
· Au cours du traitement la verrue génitale ou péri-anale devient sèche et crouteuse, puis disparaît. Comme elle est d'origine virale, il faut détruire la totalité des lésions pour éviter les récidives.
Adressez-vous à votre médecin ou pharmacien avant d’utiliser CONDYLINE 0,5%, solution pour application locale.
Sans objet.
Autres médicaments et CONDYLINE 0,5%, solution pour application cutanée
Informez votre médecin ou pharmacien si vous utilisez, avez récemment utilisé ou pourriez utiliser tout autre médicament.
CONDYLINE 0,5%, solution pour application cutanée avec des aliments et boissons
Sans objet.
Grossesse et allaitement
Vous ne devez jamais utiliser CONDYLINE 0,5%, solution pour application cutanée si vous êtes une femme enceinte ou si vous allaitez.
Avant d'être traitée par CONDYLINE 0,5%, solution pour application cutanée, informez votre médecin si vous êtes enceinte, pensez l'être ou si vous allaitez. Les femmes en âge de procréer doivent utiliser des méthodes appropriées de contraception. Si vous envisagez une grossesse, parlez-en d'abord à votre médecin.
En cas de début d'une grossesse sous CONDYLINE 0,5%, solution pour application cutanée, arrêter le traitement et contactez immédiatement votre médecin. Votre médecin décidera avec vous, si vous continuerez votre traitement ou non.
Demandez conseil à votre médecin ou à votre pharmacien avant de prendre tout médicament.
Conduite de véhicules et utilisation de machines
Les effets sur l’aptitude à conduire des véhicules et à utiliser des machines n’ont pas été étudiés. Cependant, compte-tenu de son usage local, à la posologie recommandée, il semble peu probable que Condyline ait un effet sur l’aptitude à conduire des véhicules et à utiliser des machines.
CONDYLINE 0,5%, solution pour application cutanée contient de l’alcool (Ethanol à 96%)
Ce médicament contient 732 mg d'alcool (éthanol) par ml. Cela peut provoquer une sensation de brûlure sur une peau endommagée.
3. COMMENT UTILISER CONDYLINE 0,5%, solution pour application cutanée ?
Quelques conseils avant d'utiliser CONDYLINE 0,5%, solution pour application cutanée
· CONDYLINE 0,5%, solution pour application cutanée est utilisé en usage externe uniquement.
· L'efficacité de CONDYLINE 0,5%, solution pour application cutanée peut entraîner vers le 2ème ou le 3ème jour du traitement une inflammation modérée de la zone traitée (rougeur, douleur légère, irritation). Si la douleur ou la gêne vous semble importante, n'hésitez pas à contacter votre médecin.
Comment faire pour éviter de contaminer votre entourage ?
· Les verrues génitales et péri-anales sont contagieuses. Un flacon ne doit servir qu'au traitement d'une seule personne.
· Les verrues génitales et péri-anales sont contagieuses ; utilisez systématiquement un préservatif tant que votre médecin ne vous aura pas confirmé la guérison complète des lésions.
· Afin d'éviter tout risque de contamination de votre entourage, réservez un linge de toilette uniquement à votre usage personnel.
Où appliquer CONDYLINE 0,5%, solution pour application cutanée ?
· Utilisez uniquement CONDYLINE 0,5%, solution pour application cutanée sur les lésions indiquées par votre médecin.
· N'appliquez pas CONDYLINE 0,5%, solution pour application cutanée sur la peau saine ou les muqueuses avoisinantes (voir également « Faites attention avec CONDYLINE 0,5%, solution pour application cutanée »).
Comment utiliser CONDYLINE 0,5 %, solution pour application cutanée ?
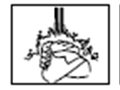
1. Lavez-vous les mains.
|
|
2. Lavez la zone à traiter à l’eau et au savon, rincez et séchez délicatement.
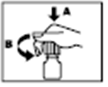
3. Le flacon est muni d’un bouchon de sécurité. Pour l’ouvrir, placez-le sur un support rigide en le maintenant d’une main.
4. Appuyez fortement sur le bouchon vers le bas (A) et dévissez-le dans le sens inverse des aiguilles d’une montre (B).
|
|
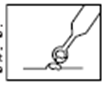
5. Au moyen d’un des applicateurs fournis dans la boîte, déposez avec précaution le produit sur la verrue génitale ou péri-anale. Évitez d’en mettre sur la peau saine, ce qui pourrait provoquer une irritation.
|
|
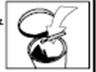
6. Laissez sécher avant de remettre vos vêtements pour éviter que la solution touche accidentellement la peau saine. Ceci est particulièrement important pour les verrues génitales localisées sur le prépuce.
7. Si la verrue génitale ou péri-anale est dans un repli, écartez la peau avec les doigts et laissez sécher avant que la peau ne reprenne sa position normale. Si elle est difficile à atteindre, utilisez un miroir ou demandez l’aide d’une tierce personne.
|
|
8. Après utilisation, jetez l’applicateur.
|
|
9. Lavez-vous les mains.
|
|
10. Refermez le flacon normalement, sans manipulation particulière.
Respectez toujours la posologie indiquée par votre médecin. En cas de doute, consultez votre médecin ou votre pharmacien.
Fréquence des applications
· Utilisez CONDYLINE 0,5%, solution pour application cutanée seulement deux fois par jour. Il ne faut pas l'appliquer plus souvent.
· Si vous avez l'impression que l'efficacité n'est pas suffisante, n'augmentez pas le nombre ou la durée des applications. Prévenez votre médecin.
Durée de traitement
· N'utilisez pas CONDYLINE 0,5%, solution pour application cutanée plus de trois jours de suite.
· Trois jours de traitement doivent être suivis de quatre jours d'arrêt.
· Ce traitement peut être répété chaque semaine jusqu'à un maximum de cinq semaines si votre médecin l'indique.
Si vous avez utilisé plus de CONDYLINE 0,5%, solution pour application cutanée que vous n’auriez dû
Utilisez toujours CONDYLINE 0,5%, solution pour application cutanée comme votre médecin vous l'a indiqué.
Si vous avez accidentellement avalé ou si vous avez pris plus de CONDYLINE 0,5%, solution pour application cutanée qu’il ne le fallait, consultez immédiatement votre médecin ou votre pharmacien.
Si vous oubliez d’utiliser CONDYLINE 0,5%, solution pour application cutanée
Ne prenez pas de dose double pour compenser la dose que vous avez oublié de prendre.
Si vous arrêtez d’utiliser CONDYLINE 0,5%, solution pour application cutanée
N’interrompez en aucun cas le traitement sans avoir consulté un médecin.
Si vous avez d’autres questions sur l’utilisation de ce médicament, demandez plus d’informations à votre médecin ou à votre pharmacien.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
· Inflammation (rougeur, légères douleurs, œdème) au niveau de la zone traitée. Ces effets secondaires sont en général peu sévères et ne nécessitent pas l'arrêt du traitement.
· Irritation cutanée avec douleur ou rougeur et ulcération de la peau si la solution entre en contact avec la peau saine. Ces effets secondaires peuvent être évités (voir la rubrique « Faites attention avec CONDYLINE 0,5%, solution pour application cutanée »).
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : www.signalement-sante.gouv.fr.
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER CONDYLINE 0,5%, solution pour application cutanée ?
Tenir ce médicament hors de la vue et de la portée des enfants.
N’utilisez pas ce médicament après la date de péremption indiquée sur la boite après EXP. La date de péremption fait référence au dernier jour de ce mois.
A conserver à une température ne dépassant pas 25°C.
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient CONDYLINE 0,5%, solution pour application cutanée
· La substance active est :
Podophyllotoxine . 0,50 g
Pour 100 ml de solution.
· Les autres composants sont :
Acide lactique, lactate de sodium, éthanol à 96% (v/v).
Qu’est-ce que CONDYLINE 0,5%, solution pour application cutanée et contenu de l’emballage extérieur
Ce médicament se présente sous forme de solution pour application cutanée.
Flacon de 3,5 ml.
Titulaire de l’autorisation de mise sur le marché
BOX 16184
103 24 STOCKHOLM
SUÈDE
Exploitant de l’autorisation de mise sur le marché
ZAC DE CHAPOTIN SUD
69970 CHAPONNAY
DELPHARM BLADEL B.V.
INDUSTRIEWEG 1
BLADEL
5531AD
PAYS BAS
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Sans objet.
La dernière date à laquelle cette notice a été révisée est :
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).