Dernière mise à jour le 02/02/2026
ADRENALINE AGUETTANT 1 mg/ml, solution injectable en ampoule
Indications thérapeutiques
Classe pharmacothérapeutique - STIMULANTS CARDIAQUES, GLUCOSIDES CARDIOTONIQUES EXCLUS – code ATC : C01CA24
Ce médicament est indiqué :
- dans le traitement de l’arrêt cardio-vasculaire ;
- dans le traitement du choc anaphylactique (chute importante de la tension artérielle de cause allergique) ;
- dans le traitement des détresses cardio-circulatoires.
Présentations
> 10 ampoule(s) en verre de 1 ml
Code CIP : 319 531-7 ou 34009 319 531 7 3
Déclaration de commercialisation : 31/01/1967
Cette présentation est agréée aux collectivités
Service médical rendu (SMR)
Pas de SMR disponible pour ce médicament ( plus d'informations dans l'aide )
Amélioration du service médical rendu (ASMR)
Pas d'ASMR disponible pour ce médicament (plus d'informations dans l'aide )
ANSM - Mis à jour le : 18/10/2022
Adrénaline Aguettant 1 mg/mL, solution injectable en ampoule
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Adrénaline .1 mg
Pour une ampoule de 1 mL.
Excipients à effet notoire :
Chaque ampoule de 1 mL de solution injectable contient 3,32 mg sodium équivalent à 0,14 mmol de sodium.
Chaque ampoule de 1 mL de solution injectable contient 0,70 mg de métabisulfite de sodium équivalent à 0,0037 mmol de métabisulfite de sodium.
Pour la liste complète des excipients, voir rubrique 6.1.
4.1. Indications thérapeutiques
· Traitement de l’arrêt cardiovasculaire.
· Traitement du choc anaphylactique.
· Traitement des détresses cardio-circulatoires avec états de choc anaphylactique, hémorragique, traumatique, infectieux ou secondaire à la chirurgie cardiaque.
Dans les situations où le pronostic vital est en jeu l’adrénaline peut être utilisée, même chez les patients sensibles aux sulfites.
4.2. Posologie et mode d'administration
Traitement de l’arrêt cardiaque :
Adultes :
Voie I.V. : en bolus de 1 mg d’adrénaline (1 mL) toutes les 3 à 5 minutes jusqu’au rétablissement de l’état hémodynamique.
Nourrissons et enfants :
Voie I.V. : en bolus de 0,01 mg/kg d’adrénaline, puis si nécessaire, une dose supplémentaire de 0,01 mg/kg toutes les 3 à 5 minutes jusqu’au rétablissement de l’état hémodynamique.
Traitement du choc anaphylactique établi :
Adultes :
Voie I.M. : 0,5-1 mg d’adrénaline (0,5-1 mL), répété toutes les 5 minutes si nécessaire.
Voie I.V. : 0,1 mg d’adrénaline après dilution, soit 1 mg (1 mL) dans 9 mL de chlorure de sodium à 0,9% puis administration intraveineuse en bolus de 1 mL de la solution diluée. Les bolus seront répétés jusqu’au rétablissement de l’état hémodynamique. Une surveillance étroite sera instaurée.
Voie S.C. : 0,3 mg d’adrénaline (0,3 mL de la solution non diluée). L’amélioration apparaît généralement dans les 3 à 5 minutes suivant l’injection sous-cutanée. Une seconde injection de 0,3 mg (0,3 mL de la solution non diluée) peut être faite 10 à 15 minutes plus tard si nécessaire.
Nourrissons et enfants :
Les doses recommandées sont les suivantes :
|
Age |
Dose d'adrénaline 1 mg/mL (solution à 1:1000) |
|
Au-dessus de 12 ans |
0,5 mg en IM (0,5 mL de la solution à 1:1000) |
|
6-12 ans |
0,3 mg en IM (0,3 mL de la solution à 1:1000) |
|
6 mois-6 ans |
0,15 mg en IM (0,15 mL de la solution à 1:1000) |
|
En-dessous de 6 mois |
0,01 mg/kg en IM (0,01 mL/kg de la solution à 1:1000) |
Si nécessaire, ces doses peuvent être répétées plusieurs fois à intervalles de 5-15 minutes, en fonction de la pression artérielle, de la fréquence cardiaque et de la fonction respiratoire. Une seringue de petit volume doit être utilisée.
Traitement des détresses cardio-circulatoires avec états de choc :
Administration à la seringue électrique en continu d’une dose comprise entre 0,01 microgramme/kg/minute et 0,5 voir 1 microgramme/kg/minute, la posologie moyenne étant à titrer en fonction de l’effet thérapeutique recherché.
Ce médicament ne doit jamais être utilisé en cas de :
· Troubles du rythme (surtout ventriculaire).
· Myocardiopathie obstructive sévère.
· Insuffisance coronarienne.
· Hypersensibilité à l’adrénaline, aux sulfites ou à l’un des excipients mentionnés à la rubrique 6.1.
Ce médicament étant indiqué en situation d’urgence, ces contre-indications sont relatives.
4.4. Mises en garde spéciales et précautions d'emploi
Mises en garde spéciales :
ADRENALINE AGUETTANT 1 mg/mL est uniquement indiqué comme traitement d’urgence. Un suivi médical est indispensable après administration.
|
L’administration d’adrénaline impose une surveillance cardiovasculaire étroite et si possible un monitorage électrocardiographique. Toute administration par voie intraveineuse d'adrénaline peut entraîner des troubles du rythme ventriculaire avec risque de fibrillation ventriculaire parfois létale, ainsi que des élévations tensionnelles. L’adrénaline doit être administrée par voie I.M. ou S.C., en cas de survenue de prodromes d’une réaction anaphylactique tels que : · prurit généralisé des muqueuses ou érythème, œdème labial ou oropharyngé, · oppression thoracique, · sueurs profuses, · hypotension. |
En cas de choc hypovolémique, n’administrer l’adrénaline qu’après rétablissement de la volémie.
L’attention des sportifs sera attirée sur le fait que cette spécialité contient un principe actif pouvant induire une réaction positive des tests pratiqués lors des contrôles antidopage.
La prise concomitante de ce médicament par voie intraveineuse ou intramusculaire est déconseillée en association avec les anesthésiques volatils halogénés, les antidépresseurs imipraminiques ou les médicaments mixtes adrénergiques-sérotoninergiques (voir rubrique 4.5).
Précautions d’emploi
Après administration d’adrénaline, des effets indésirables peuvent survenir chez des patients souffrant d’insuffisance rénale sévère, d’hypercalcémie, d’hypokaliémie, chez les diabétiques, les femmes enceintes.
Des injections locales répétées peuvent provoquer une nécrose au niveau des points d’injection par vasoconstriction.
Population pédiatrique
La voie intramusculaire est généralement privilégiée dans la prise en charge initiale du choc anaphylactique, la voie intraveineuse étant plus appropriée dans les unités de soins intensifs (USI) ou dans les services d'urgence. L’injection d'adrénaline à 1 mg / mL (1:1000) ne convient pas pour une administration intraveineuse. Si la solution injectable d’adrénaline à 0,1 mg / mL (1:10 000) n’est pas disponible, une solution d'adrénaline à 1:1000 doit être diluée à 1:10 000 avant toute administration par voie intraveineuse. L’administration par voie intraveineuse d'adrénaline doit être utilisée avec une extrême prudence et est généralement réservée aux spécialistes familiers avec l’administration intraveineuse de l'adrénaline.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Interactions avec l’adrénaline utilisée par voie IV ou IM
Associations déconseillées (Voir rubrique 4.4 Mises en gardes spéciales)
+ Anesthésiques volatils halogénés (desflurane, enflurane, halothane, isoflurane, methoxyflurane, sevoflurane)
Troubles du rythme ventriculaire graves par augmentation de l’excitabilité cardiaque.
+ Antidépresseurs imipraminiques (amitriptyline, amoxapine, clomipramine, desipramine, dosulepine, doxepine, imipramine, maprotiline, nortriptyline, opipramol, trimipramine)
Hypertension paroxystique avec possibilité de troubles du rythme (inhibition de l’entrée des sympathomimétiques dans la fibre sympathique).
+ Médicaments mixtes adrénergiques-sérotoninergiques (amitriptyline, clomipramine, imipramine, milnacipran, oxtitriptan, sibutramine, venlafaxine)
Hypertension paroxystique avec possibilité de troubles du rythme (inhibition de l’entrée du sympathomimétique dans la fibre sympathique).
Associations faisant l’objet de précautions d’emploi
+ IMAO non sélectifs (iproniazide, nialamide)
Augmentation de l’action pressive du sympathomimétique, le plus souvent modérée. A n’utiliser que sous contrôle médical strict.
+ IMAO A sélectifs (moclobémide, toloxatone)
Par extrapolation à partir des IMAO non sélectifs : risque d’augmentation de l’action pressive. A n’utiliser que sous contrôle médical strict.
+ Linézolide
Par extrapolation à partir des IMAO non sélectifs : risque d’augmentation de l’action pressive. A n’utiliser que sous contrôle médical strict.
Interactions avec l’adrénaline utilisée par voie sous-cutanée
Associations faisant l’objet de précautions d’emploi
+ Anesthésiques volatils halogénés (desflurane, enflurane, halothane, isoflurane, methoxyflurane, sevoflurane)
Troubles du rythme ventriculaire graves par augmentation de l’excitabilité cardiaque. Limiter l’apport, par exemple : moins de 0,1 mg d’adrénaline en 10 minutes ou 0,3 mg en 1 heure chez l’adulte.
+ Antidépresseurs imipraminiques (amitriptyline, amoxapine, clomipramine, desipramine, dosulepine, doxepine, imipramine, maprotiline, nortriptyline, opipramol, trimipramine)
Troubles du rythme ventriculaire graves par augmentation de l’excitabilité cardiaque. Limiter l’apport, par exemple : moins de 0,1 mg d’adrénaline en 10 minutes ou 0,3 mg en 1 heure chez l’adulte.
+ Médicaments mixtes adrénergiques-sérotoninergiques (amitriptyline, clomipramine, imipramine, milnacipran, oxtitriptan, sibutramine, venlafaxine)
Troubles du rythme ventriculaire graves par augmentation de l’excitabilité cardiaque. Limiter l’apport, par exemple : moins de 0,1 mg d’adrénaline en 10 minutes ou 0,3 mg en 1 heure chez l’adulte.
+ IMAO non sélectifs (iproniazide, nialamide)
Troubles du rythme ventriculaire graves par augmentation de l’excitabilité cardiaque. Limiter l’apport, par exemple : moins de 0,1 mg d’adrénaline en 10 minutes ou 0,3 mg en 1 heure chez l’adulte.
4.6. Fertilité, grossesse et allaitement
Grossesse
Les études effectuées chez l’animal ont mis en évidence un effet tératogène.
En clinique, l’utilisation de l’adrénaline au cours d’un nombre limité de grossesses n’a révélé aucun effet malformatif ou foetotoxique particulier à ce jour. Toutefois, des études complémentaires sont nécessaires pour évaluer les conséquences d’une exposition en cours de grossesse.
Compte tenu des indications en situation d’urgence, l’adrénaline peut être utilisée, si besoin, au cours de la grossesse.
Le passage de l’adrénaline dans le lait maternel n’est pas connu. Compte tenu des effets indésirables potentiels pour le nouveau-né allaité, l’allaitement est déconseillé au cours d’un traitement par l’adrénaline.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Les effets indésirables dépendent de la sensibilité individuelle du patient et de la dose administrée.
A faible dose, les effets indésirables fréquents sont : palpitations, tachycardie, sueurs, nausées, vomissements, dyspnée, pâleur, étourdissements, faiblesse, tremblements, céphalées, inquiétude, nervosité, anxiété, refroidissement des extrémités.
Les effets indésirables moins fréquents sont : hallucinations, syncopes, hyperglycémie, hypokaliémie, acidose métabolique, mydriase, difficulté mictionnelle avec rétention urinaire, tremblements musculaires.
A forte dose ou chez les patients sensibles à l’adrénaline, les effets indésirables sont : arythmie cardiaque notamment ventriculaire (avec risque de fibrillation ventriculaire/arrêt cardiaque), accès d’hypertension artérielle (provoquant parfois une hémorragie cérébrale), vasoconstriction (par exemple cutanée, des muqueuses et des reins), crises angineuses, voire risque d’infarctus aigu du myocarde.
Des cas de syndrome de takotsubo (cardiomyopathie de stress) ont également été rapportés.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet :www.signalement-sante.gouv.fr.
Un surdosage ou une injection intra-vasculaire accidentelle d’adrénaline peut provoquer une hypertension artérielle sévère responsable d’accidents cérébraux, cardiaques et vasculaires potentiellement mortels (hémorragie cérébrale, troubles du rythme tels que bradycardie transitoire suivie d’une tachycardie pouvant conduire à une arythmie, nécrose myocardique, œdème aigu pulmonaire, insuffisance rénale). La demi-vie de l’adrénaline étant très brève, il n’est pas toujours nécessaire d’avoir recours à des médicaments spécifiques.
Les effets de l’adrénaline peuvent être antagonisés, en fonction de l’état du patient, par l’administration de vasodilatateurs à action rapide de type dihydropyridine, de médicaments alpha-bloquants adrénergiques, voire de bêta-bloquants adrénergiques.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
L’adrénaline est une amine sympathomimétique à action directe ayant des effets aussi bien sur les récepteurs alpha que bêta-adrénergiques (bêta 1 et bêta 2), mais dont l’effet est plus marqué aux doses thérapeutiques faibles tandis que l’effet alpha est plus marqué aux doses thérapeutiques élevées.
L’emploi d’adrénaline repose essentiellement sur les propriétés suivantes :
- vasoconstriction périphérique,
- action cardiaque bathmotrope positive et inotrope positive,
- action relaxante de la musculature bronchique et inhibition de la libération des médiateurs de l’inflammation et de l’allergie.
5.2. Propriétés pharmacocinétiques
L’adrénaline est rapidement inactivée dans l’organisme principalement par les enzymes hépatiques COMT et MAO (chez les adultes comme chez les enfants).
La majorité d’une dose d’adrénaline est excrétée sous forme urinaire.
Après administration intraveineuse, la demi-vie plasmatique est d’environ 2 à 3 minutes.
5.3. Données de sécurité préclinique
Elle s’est révélée mutagène dans le test sur cellules L5178Y du lymphome de souris à partir de 100 µg/mL (plus petite dose avec effet).
Les études sur la reproduction chez le rat ont montré qu’à la dose de 0,72 mg/kg/jour administrée par perfusion IV continue les jours 13 à 19 de la gestation, l’adrénaline entraîne une diminution du débit sanguin de l’utérus et du placenta sans effet sur le poids de la mère et du fœtus et sans effet létal sur le fœtus.
Chlorure de sodium, métabisulfite de sodium, acide chlorhydrique, eau pour préparations injectables.
Ne jamais diluer dans des solutions alcalines.
Sont incompatibles : alcalins, cuivre, fer, argent, zinc et autres métaux, gommes, agents antioxydants et tanins.
18 mois.
Après ouverture : le produit doit être utilisé immédiatement.
Après dilution dans une solution de chlorure de sodium à 0,9 %, le produit doit être utilisé immédiatement.
6.4. Précautions particulières de conservation
Pour les conditions de conservation du médicament après dilution, première ouverture, voir la rubrique 6.3.
6.5. Nature et contenu de l'emballage extérieur
1 mL en ampoule bouteille (verre incolore de type I). Boîte de 10 ou de 100.
Toutes les présentations peuvent ne pas être commercialisées.
6.6. Précautions particulières d’élimination et de manipulation
Pas d’exigences particulières pour l’élimination.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
1 rue Alexander Fleming
69007 Lyon
FRANCE
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009-319 531 7 3: 1 mL en ampoule (verre), boîte de 10.
· 34009-319 532 3 4: 1 mL en ampoule (verre), boîte de 100.
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
10. DATE DE MISE A JOUR DU TEXTE
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Liste I
ANSM - Mis à jour le : 18/10/2022
ADRENALINE AGUETTANT 1 mg/mL, solution injectable en ampoule
Adrénaline
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin ou votre pharmacien.
· Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d’autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
1. Qu'est-ce que ADRENALINE AGUETTANT 1 mg/mL, solution injectable et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant d'utiliser ADRENALINE AGUETTANT 1 mg/mL, solution injectable ?
3. Comment utiliser ADRENALINE AGUETTANT 1 mg/mL, solution injectable ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver ADRENALINE AGUETTANT 1 mg/mL, solution injectable ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE ADRENALINE AGUETTANT 1 mg/mL, solution injectable ET DANS QUELS CAS EST-IL UTILISE ?
Classe pharmacothérapeutique - STIMULANTS CARDIAQUES, GLUCOSIDES CARDIOTONIQUES EXCLUS – code ATC : C01CA24
Ce médicament est indiqué :
- dans le traitement de l’arrêt cardio-vasculaire ;
- dans le traitement du choc anaphylactique (chute importante de la tension artérielle de cause allergique) ;
- dans le traitement des détresses cardio-circulatoires.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D’UTILISER ADRENALINE AGUETTANT 1 mg/mL, solution injectable ?
N’utilisez jamais ADRENALINE AGUETTANT 1 mg/mL, solution injectable dans les cas suivants :
· Si vous êtes allergique à l’adrénaline ou à l’un des autres composants contenus dans ce médicament, mentionnés dans la rubrique 6,
· Troubles du rythme (surtout ventriculaire),
· Myocardiopathie obstructive sévère (maladie sévère du muscle cardiaque),
· Angine de poitrine.
Ce médicament étant indiqué en situation d’urgence, ces contre-indications sont relatives.
Avertissements et précautions
L’ADRENALINE AGUETTANT 1 mg/mL, solution injectable est uniquement indiqué comme traitement d’urgence. Un suivi médical est indispensable après administration.
L’administration intraveineuse d’adrénaline peut entraîner des troubles du rythme cardiaque graves.
Elle impose une surveillance cardiologique étroite et si possible un enregistrement électrocardiographique continu.
L’administration se fera par voie intra-musculaire ou sous-cutanée en cas de signes annonciateurs d’une réaction allergique sévère tels que :
· prurit (démangeaisons) généralisé des muqueuses ou érythème (rougeur de la peau),
· œdème labial ou oropharyngé (gonflement du visage et du cou),
· oppression thoracique,
· sueurs profuses,
· hypotension.
Utiliser ce médicament AVEC PRECAUTION en cas de : choc hypovolémique (état de choc).
N'administrer qu'après rétablissement de la volémie.
La prise concomitante de médicament lors de son utilisation par voie intraveineuse ou intramusculaire est à éviter en association avec certains médicaments utilisés en anesthésie, avec certains antidépresseurs, avec les médicaments mixtes adrénergiques-sérotoninergique (voir Prise ou utilisation d'autres médicaments).
Après administration d’adrénaline, des effets indésirables peuvent survenir si vous souffrez d’insuffisance rénale sévère, d’hypercalcémie, d’hypokaliémie, de diabète ou si vous êtes enceinte.
Des injections locales répétées peuvent provoquer une nécrose (destruction de la peau) au niveau des points d’injection.
Enfants et adolescents
La voie intramusculaire est généralement privilégiée dans la prise en charge initiale du choc allergique, la voie intraveineuse étant plus appropriée dans les unités de soins intensifs (USI) ou dans les services d'urgence. L’injection d'adrénaline à 1 mg / mL (1: 1000) ne convient pas pour une administration intraveineuse. Si la solution injectable d’adrénaline à 0,1 mg / mL (1:10 000) n’est pas disponible, une solution d'adrénaline à 1: 1000 doit être diluée à 1:10 000 avant toute administration par voie intraveineuse. L’administration par voie intraveineuse d'adrénaline doit être utilisée avec une extrême prudence et est généralement réservée aux spécialistes familiers avec l’administration intraveineuse de l'adrénaline.
Autres médicaments et ADRENALINE AGUETTANT 1 mg/mL, solution injectable
Dans le cas d’une administration intraveineuse ou intramusculaire, ce médicament DOIT ETRE EVITÉ avec certains médicaments utilisés en anesthésie, avec certains antidépresseurs et les médicaments mixtes adrénergiques-sérotoninergiques (voir Mises en garde spéciales).
Si vous prenez les médicaments suivants, parlez-en à votre médecin :
- les IMAO sélectifs et non sélectifs,
- le linézolide.
Veuillez indiquer à votre médecin ou à votre pharmacien si vous prenez ou avez pris récemment un autre médicament, même s’il s’agit d’un médicament obtenu sans ordonnance.
Grossesse
Ce médicament est un traitement d’urgence, il peut être utilisé au cours de la grossesse lorsque votre médecin le juge nécessaire.
Demandez conseil à votre médecin ou à votre pharmacien avant de prendre tout médicament.
Allaitement
Le passage de l’adrénaline dans le lait maternel n’est pas connu. Mais du fait d’effets indésirables qui pourraient toucher votre enfant, vous ne devez pas allaiter au cours d’un traitement par ce médicament.
Demandez conseil à votre médecin ou à votre pharmacien avant de prendre tout médicament.
Ce médicament contient du sodium.
Ce médicament contient moins de 1 mmol (23 mg) de sodium par ampoule, c.-à-d. qu’il est essentiellement « sans sodium ».
Ce médicament contient du métabisulfite de sodium et peut provoquer, dans de rares cas, des réactions d’hypersensibilité sévères et des bronchospasmes.
3. COMMENT UTILISER ADRENALINE AGUETTANT 1 mg/mL, solution injectable ?
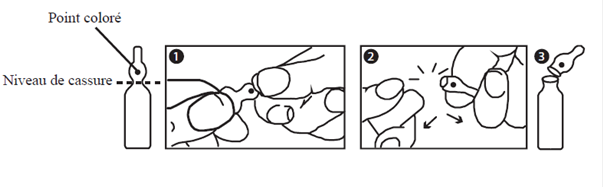
Mode d’emploi pour l’ouverture des ampoules :
Une ampoule bouteille de type OPC (One Point Cut) est caractérisée par une zone de fragilité au niveau du col de l'ampoule, repérée par un point coloré. Pour ouvrir correctement l'ampoule, il est indispensable d'exercer une pression au niveau de cette zone selon la procédure suivante :
1 - D'une main, tenir fermement le corps de l'ampoule en laissant dépasser la tête de l'ampoule, point coloré face à vous.
2 - De l'autre main, saisir la partie supérieure de l'ampoule, index posé derrière le col de l'ampoule et le pouce sur le point coloré comme indiqué par le schéma (les deux pouces sont ainsi perpendiculaires).
3 - En tenant fermement chaque partie de l'ampoule, casser d'un coup sec en exerçant une pression vers le bas.
|
|
Traitement de l'arrêt cardiaque Adultes :
Voie I.V. : en bolus de 1 mg d’adrénaline (1 mL) toutes les 3 à 5 minutes jusqu'à rétablissement de l'état hémodynamique.
Nourrissons et enfants :
Voie I.V. : en bolus de 0,01 mg/kg d’adrénaline, puis si nécessaire, une dose supplémentaire de 0,01mg/kg toutes les 3 à 5 minutes jusqu’au rétablissement de l’état hémodynamique.
Traitement du choc anaphylactique établi :
Adultes :
Voie I.M. : 0,5-1 mg d’adrénaline (0,5-1 mL), répété toutes les 5 minutes si nécessaire.
Voie I.V. : 0,1 mg d’adrénaline après dilution, soit 1mg (1 mL) dans 9 mL de solution de chlorure de sodium à 0,9 % puis administration intraveineuse en bolus de 1 mL de la solution diluée, soit 0,1 mg d'adrénaline. Les bolus seront répétés jusqu'au rétablissement de l'état hémodynamique. Une surveillance étroite sera instaurée.
Voie S.C. : 0,3 mg d’adrénaline (0,3 mL de la solution non diluée). L'amélioration apparaît généralement dans les 3 à 5 minutes suivant l'injection sous-cutanée. Une seconde injection de 0,3 mg (0,3 mL de la solution non diluée) peut être faite 10 à 15 minutes plus tard si nécessaire.
Nourrissons et enfants :
Les doses recommandées sont les suivantes :
|
Age |
Dose d'adrénaline 1 mg/mL (solution à 1:1000) |
|
Au-dessus de 12 ans |
0,5 mg en IM (0,5 mL de la solution à 1:1000) |
|
6-12 ans |
0,3 mg en IM (0,3 mL de la solution à 1:1000) |
|
6 mois-6 ans |
0,15 mg en IM (0,15 mL de la solution à 1:1000) |
|
En-dessous de 6 mois |
0,01 mg/kg en IM (0,01 mL/kg de la solution à 1:1000) |
Si nécessaire, ces doses peuvent être répétées plusieurs fois à intervalles de 5-15 minutes, en fonction de la pression artérielle, de la fréquence cardiaque et de la respiration. Une seringue de petit volume doit être utilisée.
Traitement des détresses cardio-circulatoires avec états de choc :
Administration à la seringue électrique en continu d'une dose comprise entre 0,01microgramme/kg/minute et 0,5 voire 1 microgramme/kg/minute, la posologie moyenne étant à titrer en fonction de l’effet thérapeutique recherché.
Mode d’administration
Voie I.V, IM, ou S.C.
LE MODE D’ADMINISTRATION EST DETERMINE PAR LE MEDECIN.
Fréquence d’administration
L’administration d’adrénaline impose une surveillance cardiologique étroite et si possible en enregistrement ECG continu.
Si vous avez pris plus de ADRENALINE AGUETTANT 1 mg/mL, solution injectable que vous n’auriez dû :
En cas de surdosage, on peut observer : hypertension artérielle sévère responsable d’accidents cérébraux, cardiaques et vasculaires potentiellement mortels.
Consultez immédiatement votre médecin ou votre pharmacien.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Ils dépendent de la sensibilité individuelle du patient et de la dose administrée.
A faible dose, les effets indésirables fréquents sont : palpitations, tachycardie (accélération du rythme cardiaque), sueurs, nausées, vomissements, difficultés respiratoires, pâleur, étourdissements, faiblesse, tremblements, maux de tête, inquiétude, nervosité, anxiété, refroidissement des extrémités.
Les effets indésirables moins fréquents sont : hallucinations, syncopes, hyperglycémie (excès de sucre dans le sang), hypokaliémie (baisse du potassium dans le sang), acidose métabolique (acidité élevée du sang), mydriase (dilatation de la pupille), difficulté mictionnelle (à uriner) avec rétention urinaire, tremblements musculaires.
A forte dose ou chez les patients sensibles à l’adrénaline, les effets indésirables sont : arythmie cardiaque (troubles du rythme cardiaque/arrêt cardiaque), accès d’hypertension artérielle (provoquant parfois une hémorragie cérébrale), voire une vasoconstriction (diminution du diamètre des vaisseaux sanguins par exemple cutanés, des muqueuses et des reins).
Si vous remarquez des effets indésirables non mentionnés dans cette notice, ou si certains effets indésirables deviennent graves, veuillez en informer votre médecin ou votre pharmacien.
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet: www.signalement-sante.gouv.fr.
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER ADRENALINE AGUETTANT 1 mg/mL, solution injectable ?
Tenir ce médicament hors de la vue et de la portée des enfants.
N’utilisez pas ce médicament après la date de péremption indiquée sur l’ampoule ou l’étui carton. La date de péremption fait référence au dernier jour de ce mois.
A conserver à une température ne dépassant pas + 25 °C.
Conserver les ampoules dans l’emballage extérieur, à l’abri de la lumière.
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient ADRENALINE AGUETTANT 1 mg/mL, solution injectable
· La substance active est
Adrénaline............................................................................................................................... 1 mg
Pour une ampoule de 1 mL.
· Les autres composants sont :
Chlorure de sodium, métabisulfite de sodium, acide chlorhydrique, eau pour préparations injectables.
Qu’est-ce que ADRENALINE AGUETTANT 1 mg/mL, solution injectable et contenu de l’emballage extérieur
Titulaire de l’autorisation de mise sur le marché
1 rue Alexander Fleming
69007 LYON
France
Exploitant de l’autorisation de mise sur le marché
1 rue Alexander Fleming
69007 LYON
France
1 rue Alexander Fleming
69007 LYON
France
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Sans objet.
La dernière date à laquelle cette notice a été révisée est :
{MM/AAAA}
Sans objet.