Dernière mise à jour le 06/11/2025
BCG-MEDAC, poudre et solvant pour suspension intravésicale
Indications thérapeutiques
BCG‑MEDAC contient des bactéries Mycobacterium bovis affaiblies (atténuées) à faible potentiel infectieux.
BCG‑MEDAC stimule le système immunitaire et il est utilisé pour traiter plusieurs types de cancer de la vessie. Il est efficace si le cancer est limité aux cellules qui tapissent la paroi interne de la vessie (urothélium) et n’a pas envahi les tissus internes de la vessie.
BCG‑MEDAC est administré directement dans la vessie par instillation.
Dans la forme de cancer de la vessie de type « lésion plane » (carcinome in situ), BCG‑MEDAC est utilisé pour traiter la maladie confinée à la muqueuse vésicale. Les cancers touchant la muqueuse de la vessie et la couche de cellules qui bordent la muqueuse (lamina propria) peuvent être de différents grades.
BCG‑MEDAC est également utilisé pour prévenir une réapparition du cancer (traitement prophylactique).
Présentations
> 1 flacon(s) en verre - 1 poche(s) PVC de 50 ml avec connecteur avec adaptateur pour cathéter avec cathéter ( abrogée le 23/10/2024)
Code CIP : 353 956-7 ou 34009 353 956 7 2
Déclaration de commercialisation : 03/08/2012
Abrogée le : 2024-10-23
Cette présentation est agréée aux collectivités
- Prix hors honoraire de dispensation : 157,15 €
- Honoraire de dispensation : 1,02 €
- Prix honoraire compris : 158,17 €
- Taux de remboursement :100%
> 1 flacon(s) en verre - 1 poche(s) APP : advanced polypropylène de 50 ml avec connecteur(s) pour flacon avec connecteur(s) Luer-Lock pour cathéter avec cathéter(s)
Code CIP : 34009 300 186 4 4
Déclaration de commercialisation : 15/02/2016
Cette présentation est agréée aux collectivités
- Prix hors honoraire de dispensation : 157,15 €
- Honoraire de dispensation : 1,02 €
- Prix honoraire compris : 158,17 €
- Taux de remboursement :100%
Service médical rendu (SMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprès de la HAS (plus d'informations dans l'aide). Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Important | Avis du 23/09/2015 | Inscription (CT) | Le service médical rendu par BCG-MEDAC, poudre et solvant pour suspension pour administration intravésicale est important dans les indications de l’AMM. |
| Important | Avis du 09/05/2012 | Inscription (CT) | Le service médical rendu par cette spécialité est important dans les indications de l’AMM. |
Amélioration du service médical rendu (ASMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprés de la HAS (plus d'informations dans l'aide). Les avis et synthéses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur de l'ASMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| V (Inexistant) | Avis du 23/09/2015 | Inscription (CT) | Cette spécialité est un complément de gamme qui n’apporte pas d’amélioration du service médical rendu (ASMR V) par rapport à la présentation déjà inscrite. |
| V (Inexistant) | Avis du 09/05/2012 | Inscription (CT) | La spécialité BCG-MEDAC n'apporte pas d'amélioration du service médical rendu (ASMR V) par rapport à IMMUCYST 81 mg, poudre pour suspension intravésicale. |
Autres informations
- Titulaire de l'autorisation : MEDAC GESELLSCHAFT FUR KLINISCHE SPEZIALPRAPARATE MBH
- Conditions de prescription et de délivrance :
- liste I
- prescription initiale hospitalière semestrielle
- renouvellement de la prescription réservé aux spécialistes en ONCOLOGIE MEDICALE
- renouvellement de la prescription réservé aux spécialistes en UROLOGIE
- Statut de l'autorisation : Valide
- Type de procédure : Procédure de reconnaissance mutuelle
- Code CIS : 6 097 389 9
ANSM - Mis à jour le : 20/03/2025
BCG‑MEDAC, poudre et solvant pour suspension intravésicale
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Après reconstitution, un flacon de BCG‑MEDAC contient :
bactéries BCG (Bacille de Calmette-Guérin) provenant de Mycobacterium bovis, germe RIVM dérivé du germe 1173‑ ‑P2
2 x 108 à 3 x 109 unités viables
Pour la liste complète des excipients, voir rubrique 6.1.
Poudre et solvant pour suspension intravésicale.
Poudre :
Poudre blanche ou presque blanche ou lyophilisat poreux avec des teintes jaunes et grises
Solvant :
Solution incolore et limpide
4.1. Indications thérapeutiques
Traitement du carcinome urothélial non-invasif de la vessie :
· Traitement curatif du carcinome in situ.
· Traitement prophylactique de la récidive du :
o carcinome urothélial limitée à la muqueuse :
§ pTa G1‑G2 s’il s’agit d’une tumeur multifocale et/ou récidivante.
§ pTa G3.
o carcinome urothélial envahissant la lamina propria mais non dans la musculeuse de la vessie (pT1).
o carcinome in situ.
4.2. Posologie et mode d'administration
BCG‑MEDAC est destiné à une utilisation intravésicale après reconstitution.
Pour les instructions concernant la préparation de la suspension de BCG‑MEDAC avant administration, voir la rubrique 6.6.
Posologie
Adultes et personnes âgées
Le contenu d’un flacon, remis en suspension comme indiqué, est requis pour une instillation vésicale.
Traitement d’induction
Le traitement par BCG doit être instauré environ 2 à 3 semaines après la résection transurétrale (RTU) ou après la biopsie vésicale sans cathétérisme traumatique et doit être répété chaque semaine pendant 6 semaines. Cette thérapie doit être suivie d’un traitement d’entretien pour les tumeurs à risque intermédiaire et élevé. Les schémas de traitement d’entretien sont décrits ci-dessous.
Traitement d’entretien
Sur la base d’études cliniques, un traitement d’entretien est fortement recommandé à la suite d’un traitement d’induction. Le schéma thérapeutique d’entretien recommandé consiste en 1 instillation par semaine pendant 3 semaines administrées sur un minimum d’1 an et jusqu’à 3 ans aux 3ème, 6ème, 12ème, 18ème, 24ème, 30ème et 36ème mois. Dans le cadre de ce schéma, 27 instillations au maximum sont administrées pendant une période de trois ans.
Bien que le traitement d’entretien réduise les récidives et puisse réduire la progression de la maladie, les effets indésirables et l’inconfort liés au traitement peuvent l’emporter sur les bénéfices chez certains patients. Par conséquent, il est important d’évaluer le rapport bénéfice/risque et de prendre en compte les préférences du patient avant de débuter ou de poursuivre le traitement d’entretien. Le besoin de poursuivre un traitement d’entretien tous les 6 mois au-delà de la première année de traitement doit être évalué sur la base de la classification de la tumeur et de la réponse clinique.
Population pédiatrique
La sécurité et l’efficacité de BCG‑MEDAC chez les enfants n’ont pas été établies. Aucune donnée n’est disponible.
Mode d’administration
Le patient ne doit pas boire au cours des 4 heures qui précèdent l’instillation et pendant 2 heures après l’instillation.
Un cathéter uréthral est inséré dans la vessie dans des conditions d’asepsie. Une quantité suffisante de lubrifiant doit être utilisée pour réduire le risque de traumatiser la muqueuse urinaire et par conséquent le risque de complications graves, ainsi que pour réduire l’inconfort lié à la procédure pour le patient. La vessie doit être vidée avant l’instillation du BCG. Un drainage complet de la vessie après la pose du cathéter réduit la quantité de lubrifiant résiduel qui pourrait avoir atteint la vessie avant l’instillation de BCG‑MEDAC.
BCG‑MEDAC est introduit dans la vessie au moyen d’un cathéter et à basse pression. La suspension de BCG‑MEDAC instillée devrait rester dans la vessie pendant une période de 2 heures. Pendant ce temps, la suspension doit rester en contact suffisant avec toute la surface de la muqueuse vésicale. Par conséquent, le patient doit être mobilisé autant que possible ou, s’il est alité, il doit être retourné d’une position sur le dos à une position sur l’abdomen et vice versa toutes les 15 minutes. Deux heures plus tard, le patient doit éliminer la suspension instillée en position assise.
S’il n’existe pas de contre-indication médicale spécifique, une hyperhydratation du patient est conseillée pendant les 48 heures qui suivent chaque instillation.
Les patients traités par BCG‑MEDAC doivent recevoir la notice et la Carte de surveillance patient.
· Hypersensibilité à la substance active ou à l’un des excipients mentionnés à la rubrique 6.1.
· BCG‑MEDAC ne doit pas être utilisé chez les immunodéprimés ou les personnes présentant un déficit immunitaire congénital ou acquis causé par la pathologie concomitante (par ex. un sérodiagnostic du VIH positif, une leucémie ou un lymphome), un traitement anticancéreux (par ex. par des médicaments cytostatiques, une radiothérapie) ou un traitement immunosuppresseur (par ex. par des corticostéroïdes).
· BCG‑MEDAC ne doit pas être administré à des personnes atteintes d’une tuberculose évolutive. La présence d’une tuberculose évolutive doit être exclue au moyen d’une anamnèse appropriée et, si cela est indiqué, par les tests diagnostiques pratiqués conformément aux recommandations locales.
· Antécédents de radiothérapie de la vessie.
· Le traitement par BCG‑MEDAC est contre-indiqué pendant l’allaitement (voir rubrique 4.6).
· BCG‑MEDAC ne doit pas être instillé avant 2 à 3 semaines suite à une RTU, une biopsie vésicale ou un cathétérisme traumatique.
· Perforation de la vessie susceptible d’entraîner un risque accru d’infections systémiques sévères (voir rubrique 4.4).
· Infection urinaire aiguë (voir rubrique 4.4). Une leucocyturie asymptomatique isolée et une bactériurie asymptomatique ne sont pas des contre-indications pour le traitement intravésical par BCG‑MEDAC, et une prophylaxie antibiotique n’est pas nécessaire.
4.4. Mises en garde spéciales et précautions d'emploi
Traitement des symptômes, signes ou syndromes
Voir rubrique 4.8.
Précautions relatives à la manipulation
BCG‑MEDAC ne doit pas être manipulé dans la même pièce et par le même personnel que celui qui prépare des médicaments cytotoxiques pour administration intraveineuse. BCG‑MEDAC ne doit pas être manipulé par une personne atteinte d’un déficit immunitaire connu. Le contact de BCG‑MEDAC avec la peau ou les muqueuses doit être évité. Une contamination peut entraîner une réaction d’hypersensibilité ou une infection de la région concernée.
Renversement accidentel de BCG‑MEDAC
En cas de renversement accidentel d’une suspension de BCG‑MEDAC, traiter avec un désinfectant possédant une activité démontrée contre les mycobactéries. Les éclaboussures sur la peau doivent être traitées avec un désinfectant approprié.
Recommandations d’hygiène générale pour le patient
Il est recommandé de se laver les mains et la région génitale après les mictions. Ceci est particulièrement important lors des premières mictions après l’instillation de BCG. En cas de contamination de lésions cutanées, il est recommandé d’utiliser un désinfectant approprié.
Intradermoréactions
Le traitement intravésical par BCG‑MEDAC peut induire une sensibilité à la tuberculine et compliquer l’interprétation ultérieure des tests intradermiques à la tuberculine réalisés pour diagnostiquer une infection mycobactérienne. Dans ce cas, la réactivité du patient à la tuberculine devrait être réalisée avant l’administration de BCG‑MEDAC.
Détection du bacille de Calmette-Guérin
Les médecins doivent garder à l’esprit que des résultats négatifs pour la présence du germe d’une culture de biopsie et des résultats d’analyse négatifs n’excluent pas une infection systémique au BCG. Dans plusieurs cas, les germes n’ont pas été détectés même si le patient présentait une infection systémique au BCG. Les méthodes disponibles (microscopie, PCR et/ou cultures et/ou une détection histologique compatible avec la tuberculose) ne sont pas fiables.
Infections/réactions systémiques sévères au BCG
Une instillation traumatique peut provoquer une septicémie due au BCG accompagnée éventuellement d’un choc septique et d’une situation engageant le pronostic vital. Pour les options de traitement, voir la rubrique 4.8.
L’infection urinaire doit être exclue avant chaque instillation vésicale de BCG (une inflammation de la muqueuse vésicale peut augmenter le risque de dissémination hématogène du BCG). Si une infection urinaire est diagnostiquée pendant le traitement par BCG, le traitement doit être interrompu jusqu’à la normalisation des résultats d’analyse d’urine et la fin du traitement par antibiotique.
Le risque d’infections systémiques sévères dues au BCG ainsi que la nécessité du traitement antituberculeux doit être envisagée avant l’instauration du traitement par BCG, en particulier chez les patients âgés (voir Patients âgés) et les patients atteints d’insuffisance hépatique.
Des infections/réactions systémiques sévères au BCG ont été signalées dans moins de 5 % de la population étudiée. Pour les signes et symptômes, voir rubrique 4.8.
En cas de suspicion d’une infection systémique, un spécialiste des maladies infectieuses doit être consulté. Une infection au BCG peut être potentiellement fatale. Veuillez consulter la rubrique 4.8.
Contrairement aux infections systémiques, le syndrome de Reiter se présente comme une réaction à médiation principalement immunitaire qui n’est pas nécessairement provoquée par la dissémination du BCG, mais qui peut être également déclenchée par le BCG localisé uniquement dans les voies urinaires.
Fièvre ou hématurie macroscopique
Le traitement doit être reporté jusqu’à la disparition de la fièvre concomitante ou de l’hématurie macroscopique.
Faible capacité vésicale
Les patients dont la capacité vésicale est faible courent un risque accru de contracture de la vessie.
HLA‑B27
Chez les patients qui sont HLA‑B27 positifs, la survenue d’une arthrite réactionnelle ou syndrome de Reiter est plus fréquente.
Réactivation d’une infection latente au BCG (y compris le retard de diagnostic)
Des cas isolés de persistance du BCG dans le corps pendant plusieurs années ont été rapportés. Ces infections latentes au BCG peuvent resurgir des années après l’infection initiale et peuvent notamment donner lieu à une pneumopathie granulomateuse, des abcès, des anévrismes infectés, une infection d’un implant, d’un greffon ou du tissu environnant.
Le patient doit être averti de la possibilité de réactivation tardive d’une infection latente par le BCG et informé de la conduite à tenir en cas d’apparition de symptômes tels que fièvre et perte de poids de cause inconnue.
En cas de suspicion de réactivation d’une infection latente au BCG, un médecin spécialiste des maladies infectieuses doit être consulté.
Patients âgés
L’administration du BCG chez les patients âgés n’est pas contre-indiquée. Toutefois, le risque d’une infection/réaction systémique au BCG doit être envisagé avant de réaliser l’administration initiale. Les patients âgés peuvent souffrir d’insuffisance rénale ou hépatique, ce qui peut avoir une influence sur le traitement par des médicaments antituberculeux en cas d’infection/réaction systémique sévère au BCG. La prudence s’impose également pour les patients âgés présentant un état de santé affaibli.
Grossesse
BCG‑MEDAC n’est pas recommandé pendant la grossesse (voir rubrique 4.6).
Patients en contact avec des personnes immunodéprimées
Les patients traités par BCG‑MEDAC doivent prendre des mesures hygiéniques adaptées s’ils sont en contact avec des patients immunodéprimés. M. bovis est moins pathogène que M. tuberculosis et aucune transmission de personne à personne n’a encore été signalée à ce jour, mais elle ne peut pas être exclue, en particulier chez les patients immunodéprimés.
Transmission sexuelle
Jusqu’à présent, une transmission sexuelle du BCG n’a pas été rapportée mais il est recommandé d’utiliser un préservatif pendant les rapports sexuels pendant une semaine après le traitement par BCG.
Traçabilité
Afin d'améliorer la traçabilité des médicaments biologiques, le nom et le numéro de lot du produit administré doivent être clairement enregistrés.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Les bactéries BCG sont sensibles aux médicaments antituberculeux (par ex. l’éthambutol, la streptomycine, l’acide p‑aminosalicylique [PAS], l’isoniazide [INH] et la rifampicine), aux antibiotiques et aux antiseptiques. Une résistance au pyrazinamide et à la cyclosérine a été décrite.
L’administration concomitante d’antituberculeux et d’antibiotiques comme les fluoroquinolones, la doxycycline ou la gentamicine doit être évitée pendant le traitement par instillation intravésicale de BCG en raison de la sensibilité du BCG à ces médicaments.
4.6. Fertilité, grossesse et allaitement
Grossesse
Allaitement
Il n’existe pas de données suffisantes sur l’excrétion du BCG/métabolites dans le lait maternel. BCG‑MEDAC est contre-indiqué pendant l’allaitement (voir rubrique 4.3).
Fertilité
Il a été observé que le traitement intravésical par BCG avait des effets nocifs sur la spermatogenèse et pouvait entraîner une oligospermie ou une azoospermie.
Les études effectuées chez l’animal suggèrent que ces effets pourraient être transitoires et réversibles. Cependant, il est souhaitable que les hommes se fassent conseiller sur les possibilités de conservation du sperme avant de débuter le traitement.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Les effets indésirables sont répertoriés ci-dessous par classe de systèmes d’organes et par fréquence. La fréquence est définie comme : très fréquent (³ 1/10), fréquent (³ 1/100, < 1/10), peu fréquent (³ 1/1 000 à < 1/100), rare (³ 1/10 000 à < 1/1 000), très rare (< 1/10 000) et fréquence indéterminée (ne peut être estimée sur la base des données disponibles).
Au sein de chaque fréquence de groupe, les effets indésirables doivent être présentés suivant un ordre décroissant de gravité.
|
Classe de système d’organes |
Fréquence et effets indésirables |
|
Infections et infestations |
Très fréquent Cystite et réactions inflammatoires (granulomes) de la vessie, prostatite granulomateuse asymptomatique Peu fréquent Infection urinaire, orchite, épididymite, prostatite granulomateuse symptomatique, infection/réaction systémique sévère au BCG, septicémie à BCG, miliaire pulmonaire, abcès cutané, syndrome de Reiter (conjonctivite, oligoarthrite asymétrique et cystite) Rare Infection vasculaire (par ex. anévrisme infecté), abcès rénal Très rare Infection par le BCG des implants et tissus environnants (par ex. infection d’un greffon aortique, d’un défibrillateur cardiaque, d’une prothèse de hanche ou de genou), infection des ganglions lymphatiques locaux, ostéomyélite, infection de la moelle osseuse, péritonite, abcès du psoas, infection du gland du pénis, orchite ou épididymite résistant à un traitement antituberculeux |
|
Affections hématologiques et du système lymphatique |
Peu fréquent Cytopénie, anémie Très rare Lymphadénite cervicale Fréquence indéterminée Syndrome hémophagocytaire |
|
Affections du système immunitaire |
Très fréquent Réaction systémique au BCG transitoire (fièvre < 38,5 °C, syndrome pseudo‑grippal incluant malaise, fièvre, frissons, inconfort général, myalgies) Très rare Réaction d’hypersensibilité (par ex. œdème des paupières, toux) |
|
Affections oculaires |
Très rare Choriorétinite, conjonctivite, uvéite |
|
Affections vasculaires |
Peu fréquent Hypotension Très rare Fistule vasculaire Fréquence indéterminée Vasculite (y compris vasculite du système nerveux central) |
|
Affections respiratoires, thoraciques et médiastinales |
Peu fréquent Granulome pulmonaire |
|
Affections gastro-intestinales |
Très fréquent Nausées Fréquent Diarrhée, douleurs abdominales Très rare Vomissements, fistule intestinale |
|
Affections hépatobiliaires |
Peu fréquent Hépatite |
|
Affections de la peau et du tissu sous-cutané |
Peu fréquent Eruption cutanée |
|
Affections musculo-squelettiques et systémiques |
Fréquent Myalgie Peu fréquent Arthrite, arthralgies |
|
Affections du rein et des voies urinaires |
Très fréquent Mictions fréquentes avec gêne et douleur Fréquent Incontinence urinaire Peu fréquent Hématurie macroscopique, rétention vésicale, obstruction des voies urinaires, vessie contractée Fréquence indéterminée Insuffisance rénale, pyélonéphrite, néphrite (dont néphrite tubulo-interstitielle, néphrite interstitielle et glomérulonéphrite) |
|
Affections des organes de reproduction et du sein |
Fréquence indéterminée Troubles génitaux (par ex. douleur vaginale, dyspareunie), oligospermie, azoospermie |
|
Troubles généraux et anomalies au site d’administration |
Très fréquent Fatigue Fréquent Fièvre > 38,5°C Très rare Œdème périphérique |
|
Investigations |
Peu fréquent Enzymes hépatiques augmentées Fréquence indéterminée Antigène spécifique prostatique (PSA) augmenté |
Les effets indésirables d’un traitement par BCG sont fréquents mais généralement bénins et transitoires. Les effets indésirables augmentent généralement avec le nombre d’instillations de BCG.
Fréquemment une myalgie et peu fréquemment une arthrite/arthralgie et un rash cutané peuvent survenir. Dans la majorité des cas d’arthrite, d’arthralgie et de rash cutané, ils peuvent être attribués à des réactions d’hypersensibilité au BCG. Dans certain cas, il peut être nécessaire d’arrêter l’administration du BCG‑MEDAC.
Effets indésirables locaux
Une gêne et des douleurs à la miction ainsi qu’une fréquence mictionnelle excessive surviennent chez près de 90 % des patients. La cystite et une réaction inflammatoire (granulomes) peuvent constituer une part essentielle de l’activité anti-tumorale. Autres effets indésirables locaux peu fréquemment observés : hématurie macroscopique, infection urinaire, rétraction vésicale, obstruction urinaire, contracture vésicale, prostatite granulomateuse symptomatique, orchite et épididymite. Des abcès rénaux sont rarement observés. En outre, des troubles génitaux (par exemple douleur vaginale, dyspareunie) peuvent survenir à une fréquence indéterminée.
Réaction systémique au BCG transitoire
Un état subfébrile, un syndrome pseudo‑grippal et une sensation d’inconfort général peuvent survenir. Ces symptômes disparaissent dans les 24 à 48 heures et doivent faire l’objet d’un traitement symptomatique standard. Ces réactions sont les signes du début d’une réaction immunitaire. Tous les patients recevant le médicament doivent être surveillés étroitement et il convient de leur conseiller de signaler toute apparition de fièvre et de manifestations autres qu’urinaires.
Infections/effets indésirables systémiques sévères
Il est difficile de distinguer une infection au BCG d’une réaction immunitaire au BCG, car les symptômes sont très similaires au début. En revanche, une réaction systémique transitoire au BCG est un effet indésirable très fréquent qui doit être différencié.
Les signes et symptômes cliniques d’une infection/réaction au BCG sont au début une fièvre de plus de 39,5 °C pendant au moins 12 heures, une fièvre de plus de 38,5 °C pendant au moins 48 heures et une aggravation de l’état général. Les signes caractéristiques d’une infection sont le développement d’une miliaire pulmonaire, une hépatite granulomateuse, des anomalies du bilan biologique hépatique (en particulier une élévation de la phosphatase alcaline), un dysfonctionnement organique (en dehors de l’appareil génito-urinaire) avec inflammation granulomateuse à la biopsie avec le temps. En cas de suspicion d’infection systémique, un médecin spécialiste des maladies infectieuses doit être consulté. Une infection au BCG peut être potentiellement fatale.
Bien que les symptômes d’une infection systémique par le BCG ne soient pas différents de ceux de la tuberculose, le patient n’a pas besoin d’être isolé, parce que M. bovis est moins pathogène pour les humains que M. tuberculosis.
En cas de réactivation d’une infection latente, les patients présentant une fièvre et une perte de poids de cause inconnue. Plusieurs rapports de cas montrent que le diagnostic est difficile, car les symptômes varient et le lien de causalité avec l’infection par le BCG n’est pas évident pour les médecins.
Un diagnostic correct et précoce, et de ce fait un traitement approprié, est important pour l’issue, en particulier chez les patients âgés ou affaiblis, pour éviter des conséquences fatales. Veuillez noter qu’il existe une carte de surveillance patient dédiée sur ce sujet qui doit être remise au patient (voir également rubrique 4.4).
En cas de suspicion d’une réactivation d’une infection par le BCG latente, un spécialiste des maladies infectieuses doit être consulté.
L’utilisation additionnelle de corticoïdes pourrait être recommandée en cas de septicémie, de réactions granulomateuses (poumons ou foie par ex.) et d’autres réactions d’origine immunitaires.
Recommandations thérapeutiques, voir le tableau ci‑dessous.
|
Traitement des symptômes, signes et syndromes |
|
|
Symptômes, signes ou syndrome |
Traitement |
|
1) Symptômes d’une irritation vésicale durant moins de 48 heures |
Traitement symptomatique. |
|
2) Symptômes d’irritation vésicale durant au moins 48 heures |
Arrêter le traitement par BCG‑MEDAC et instaurer un traitement par des quinolones. S’il n’y a pas disparition complète des symptômes après 10 jours, administrer de l’isoniazide (INH)* pendant 3 mois. En cas de traitement antituberculeux, le traitement par BCG‑MEDAC doit être définitivement interrompu. |
|
3) Infection bactérienne concomitante des voies urinaires |
Différer le traitement par BCG‑MEDAC jusqu’à l’obtention d’une culture urinaire négative et jusqu’à la fin de l’antibiothérapie. |
|
4) Autres effets indésirables génito-urinaires : prostatite granulomateuse symptomatique, épididymite et orchite, obstruction urétrale et abcès rénal |
Arrêter le traitement par BCG‑MEDAC. Administrer de l’isoniazide (INH)* et de la rifampicine*, pendant 3 à 6 mois en fonction de la sévérité des symptômes. En cas de traitement antituberculeux, le traitement par BCG‑MEDAC doit être définitivement interrompu. |
|
5) Fièvre de moins de 38,5 °C durant moins de 48 heures |
Traitement symptomatique par le paracétamol. |
|
6) Eruption cutanée, arthralgies ou arthrite ou syndrome de Reiter. |
Arrêter le traitement par BCG‑MEDAC. Envisager une consultation chez un spécialiste des maladies infectieuses. Administrer un antihistaminique ou des anti-inflammatoires non stéroïdiens. Un traitement à base de cortisone doit être envisagé en cas de réaction d’origine immunitaire. En l’absence de réponse, administrer de l’isoniazide* pendant 3 mois. En cas de traitement antituberculeux, le traitement par BCG‑MEDAC doit être définitivement interrompu. |
|
7) Infection/réaction systémique au BCG** sans signes de choc septique |
Interrompre définitivement le traitement par BCG‑MEDAC. Prévoir une consultation chez un spécialiste des maladies infectieuses. Administrer une trithérapie antituberculeuse* pendant 6 mois, ainsi que des corticoïdes à faible dose. |
|
8) Infection/réaction systémique au BCG avec signes de choc septique |
Interrompre définitivement le traitement par BCG‑MEDAC. Administrer immédiatement une trithérapie antituberculeuse* associée à des corticoïdes d’action rapide à dose élevée. Demander l’avis d’un spécialiste des maladies infectieuses. |
* Attention : les bactéries BCG sont sensibles à tous les médicaments antituberculeux actuellement utilisés sauf le pyrazinamide. Si une trithérapie antituberculeuse est nécessaire, l’association normalement recommandée est l’isoniazide (INH), la rifampicine et l’éthambutol.
** voir la définition ci-dessus
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr.
Le surdosage est peu probable car un flacon de BCG‑MEDAC correspond à une dose.
Il n’existe pas de données indiquant qu’un surdosage peut provoquer d’autres symptômes que les effets indésirables décrits.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Classe pharmacothérapeutique : IMMUNOSTIMULANTS, AUTRES IMMUNOSTIMULANTS, code ATC : L03AX03.
BCG‑MEDAC est une suspension lyophilisée de la souche bacillaire vivante de Calmette-Guérin à faible potentiel infectieux provenant de Mycobacterium bovis, souche RIVM.
Mécanisme d’action
BCG‑MEDAC stimule le système immunitaire et a une activité antitumorale. Les résultats d’études indiquent que le BCG agit comme un immunostimulant non-spécifique, que son action n’est pas unique mais qu’il a plusieurs actions impliquant les cellules du système immunitaire. Le BCG a un effet stimulateur sur la rate, il majore la fonction des macrophages dans la rate et active les cellules NK (cellules tueuses naturelles). L’instillation du BCG stimule le taux des granulocytes, monocytes/macrophages et de lymphocytes T, ce qui indique une activation locale du système immunitaire. Les cytokines IL1, IL2, IL6 et TNFa sont également augmentées.
5.2. Propriétés pharmacocinétiques
5.3. Données de sécurité préclinique
Aucune étude sur la mutagenèse, la carcinogenèse et la reproduction n’a été faite.
Poudre : polygéline, glucose anhydre et polysorbate 80.
Solvant : chlorure de sodium et eau pour préparations injectables.
BCG‑MEDAC ne doit pas être mélangé avec les solutions hypotoniques et hypertoniques.
2 ans ou 3 ans si le nombre des unités vivantes lors de la libération est plus grand que 5 x 108 CFU/flacon, en tous cas pas au-delà de 4 ans à partir de la date de récolte.
La stabilité physico-chimique du produit reconstitué a été démontrée pendant 24 heures lorsque le produit est conservé à l’abri de la lumière à température ambiante (entre 20 °C et 25 °C) ou au réfrigérateur (entre 2 °C et 8 °C).
D’un point de vue microbiologique, le médicament doit être utilisé immédiatement.
S’il n’est pas utilisé immédiatement, les durées et conditions de conservation du produit avant utilisation relèvent de la responsabilité de l’utilisateur mais ne devront normalement pas dépasser 24 heures entre 2 °C et 8 °C, sauf si la reconstitution a eu lieu dans des conditions aseptiques contrôlées et validées.
6.4. Précautions particulières de conservation
A conserver au réfrigérateur (entre 2°C et 8°C).
Ne pas congeler.
A conserver dans l’emballage d’origine à l’abri de la lumière.
Pour les conditions de conservation du médicament après reconstitution, voir la rubrique 6.3.
6.5. Nature et contenu de l'emballage extérieur
Poudre en flacon (verre de type I) avec un bouchon en caoutchouc + 50 ml de solvant dans une poche (advanced polypropylène, APP) avec connecteur pour flacon et connecteur pour cathéter, avec ou sans cathéter et adaptateur Luer‑Lock pour embout conique.
Présentations :
· 1, 3, 5 ou 6 flacon(s), poche(s) de solvant, adaptateur(s) Luer‑Lock pour embout conique, avec ou sans cathéter(s).
· 1 ou 3 flacon(s), poche(s) de solvant, avec ou sans cathéter(s).
Toutes les présentations peuvent ne pas être commercialisées.
6.6. Précautions particulières d’élimination et de manipulation
Informations importantes concernant l’utilisation de BCG‑MEDAC
BCG‑MEDAC ne doit être utilisé que par des professionnels de santé expérimentés.
S’assurer que les conditions de conservation sont adaptées (voir rubrique 6.4) et vérifier l’intégrité du conditionnement.
BCG‑MEDAC doit être administré dans les conditions requises pour l’endoscopie intravésicale.
BCG‑MEDAC ne doit pas être administré par voie sous‑cutanée, intradermique, intramusculaire, intraveineuse ni pour la vaccination contre la tuberculose.
Le connecteur pour cathéter Luer‑Lock de la poche de solvant ne doit être utilisé que dans le cadre d’une instillation intravésicale !
Principes de base et mesures de protection pour l’utilisation de BCG‑MEDAC
En général, il convient d’éviter tout contact direct avec BCG‑MEDAC. BCG-MEDAC est un médicament qui peut entraîner une infection chez l’être humain et présenter un risque pour les professionnels de santé. Un danger peut exister si le médicament pénètre dans l’organisme via une peau lésée, si des aérosols sont inhalés, si des gouttelettes pénètrent dans les yeux ou entrent en contact avec les muqueuses, ou s’il est ingéré. Ne pas manger, boire ou fumer dans les zones de travail et ne pas conserver de nourriture, de boissons ou de produits contenant du tabac dans ces zones. BCG‑MEDAC ne doit pas être manipulé dans une pièce où des médicaments cytotoxiques sont préparés pour une utilisation par voie intraveineuse ni être manipulé par le personnel qui prépare des médicaments cytotoxiques destinés à une utilisation par voie intraveineuse.
Le médicament ne doit pas être manipulé par des personnes présentant une immunodéficience connue.
Durant la manipulation, il est recommandé de porter un équipement de protection individuelle constitué d’une blouse de protection fermée résistante aux éclaboussures, de gants jetables, d’un masque de protection respiratoire FFP2 et de lunettes de protection avec écrans latéraux. BCG‑MEDAC ne doit être transporté que dans des contenants fermés (pour connaître les conditions de conservation après reconstitution, voir rubrique 6.3).
Une fois le travail terminé, essuyer les surfaces de travail avec une solution désinfectante adaptée. Après le travail et en cas de contact avec la peau, se désinfecter les mains à l’aide d’un désinfectant pour les mains, les laisser sécher, les laver et utiliser des produits de soin pour la peau.
Tests à la tuberculine intradermiques
Le traitement intravésical par BCG‑MEDAC peut induire une sensibilité à la tuberculine et compliquer l’interprétation ultérieure des tests à la tuberculine intradermiques réalisés pour diagnostiquer une infection mycobactérienne. Dans ce cas, la réactivité du patient à la tuberculine devrait être réalisée avant l’administration de BCG‑MEDAC.
Préparation de la suspension intravésicale reconstituée
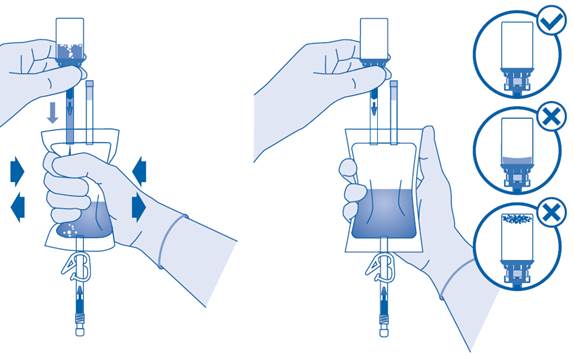
Avant utilisation, le médicament doit être remis en suspension dans des conditions aseptiques à l’aide d’une solution de chlorure de sodium stérile à 0,9 % (9 mg/mL) (voir les instructions d’utilisation, étape 7). Le cathéter doit être mis en place avec une attention toute particulière pour éviter les lésions de l’épithélium urétral et vésical, qui pourraient entraîner une infection systémique par le BCG. Il est recommandé d’utiliser un lubrifiant pour limiter le risque de cathétérisme traumatique et pour que la procédure soit plus confortable. Il est possible que les femmes aient besoin de moins de lubrifiant que les hommes. Aucune influence sur l’efficacité du produit liée à l’éventuel effet antiseptique du lubrifiant n’a été observée. Vider la vessie après le cathétérisme pour réduire la quantité de lubrifiant potentiellement introduit avant d’administrer BCG‑MEDAC. La suspension est mélangée en la remuant délicatement avant utilisation. Les particules visibles au niveau macroscopique n’ont aucune influence sur l’efficacité et la sécurité du médicament.
Le contenu du flacon est destiné à une utilisation unique/une dose unique exclusivement. Toute solution restante doit être éliminée.
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
Comportement en cas d’urgence et de renversement de BCG‑MEDAC
Porter des vêtements de protection et limiter la propagation des particules.
Couvrir de cellulose la suspension de BCG‑MEDAC renversée et l’humidifier avec un désinfectant dont l’efficacité a été prouvée contre les mycobactéries. Après avoir essuyé la suspension de BCG‑MEDAC renversée, nettoyer à nouveau la surface avec une solution désinfectante et laisser sécher. En cas de renversement sur la peau, traiter à l’aide d’un désinfectant adapté.
Premiers secours
Toujours consulter un médecin en cas de contamination.
En cas de contact avec la peau : retirer les vêtements contaminés. Désinfecter et nettoyer la peau et vérifier si des plaies ont pu être contaminées.
En cas de contact avec les yeux : laver l’œil concerné avec une solution de lavage oculaire en quantité suffisante ou, à défaut, avec de l’eau. Retirer les lentilles de contact, le cas échéant.
En cas d’ingestion : rincer la bouche avec de l’eau en abondance.
En cas d’inhalation : s’assurer que l’apport d’air frais est suffisant.
Pour de plus amples informations sur le cathéter, veuillez consulter le mode d’emploi correspondant.
Instructions destinées aux utilisateurs de BCG‑MEDAC
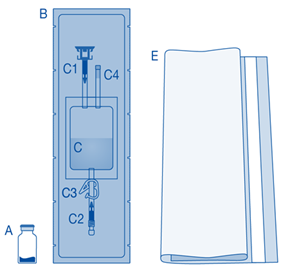
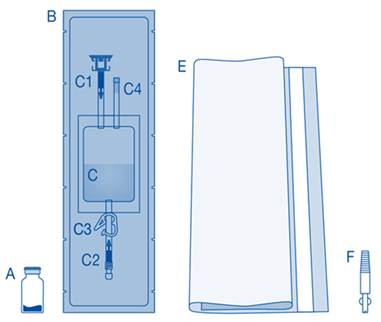
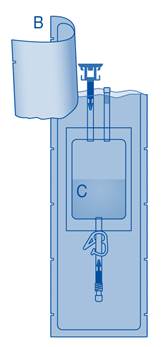
Composants et application du système d’instillation |
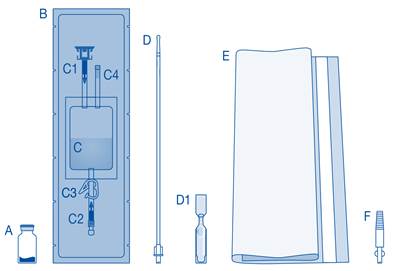
Principaux composants du système d’instillation
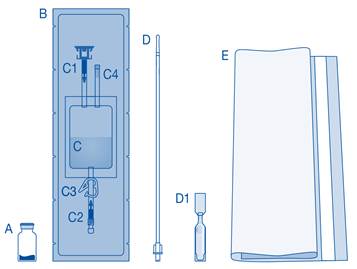
|
Principaux composants |
Description |
|
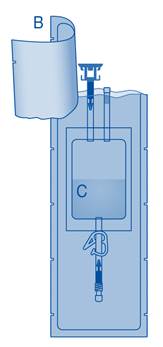
A |
Flacon de poudre |
|
B |
Enveloppe de protection |
|
C |
Poche de solvant contenant une solution de chlorure de sodium à 0,9 % (9 mg/mL) |
|
C1 |
Connecteur pour flacon avec capuchon de protection et système de scellement à briser |
|
C2 |
Connecteur pour cathéter Luer-Lock avec capuchon de protection et système de scellement à briser |
|
C3 |
Pince de pression |
|
C4 |
Port de remplissage sans fonction d’application |
|
D |
Cathéter Luer‑Lock |
|
D1 |
Lubrifiant |
|
E |
Sac à déchets de soins |
Connexion du flacon à la poche de solvant
1. Posez le sac à déchets de soins (E) pour qu’il soit prêt pour l’élimination directe du système après instillation afin d’éviter toute contamination.
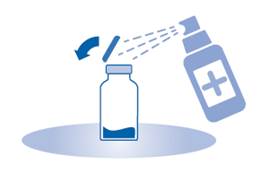
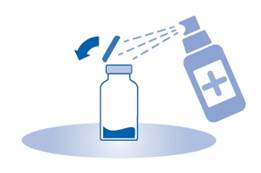
2. Retirez le capuchon amovible du flacon (A) et désinfectez le bouchon conformément aux réglementations locales.
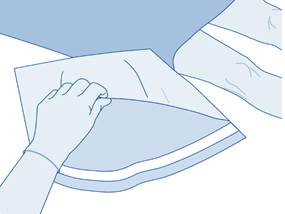
3. Déchirez l’enveloppe de protection (B) de la poche de solvant (C) et retirez complètement l’enveloppe de protection.
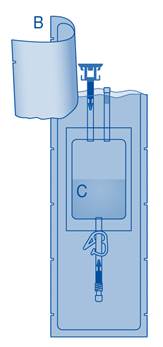
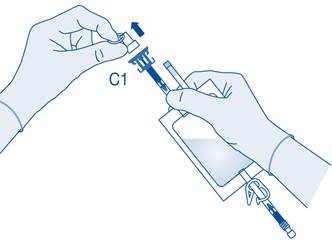
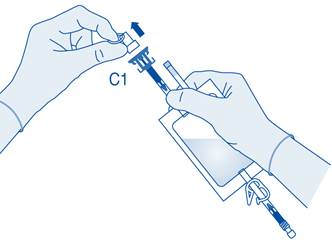
4. Retirez le capuchon de protection du connecteur pour flacon (C1).
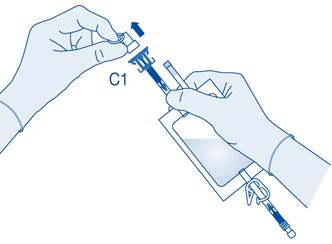
5. Poussez le connecteur sur le flacon jusqu’à la butée.
Mélange de la poudre avec le solvant
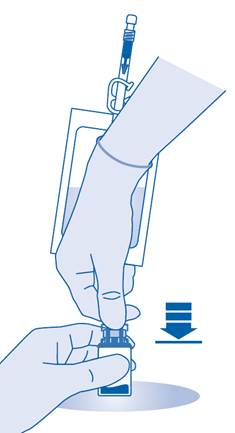
6. Pliez le sceau à briser dans le tube du connecteur pour flacon (C1) dans un sens puis dans l’autre plusieurs fois afin de briser le sceau.
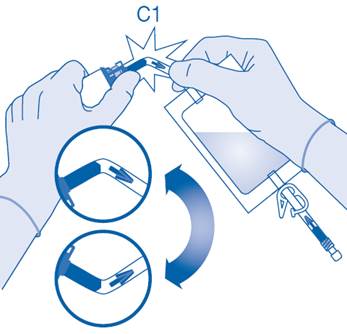
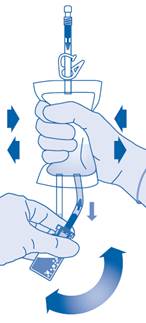
7. Maintenez la poche de solvant afin que le flacon se trouve en dessous.
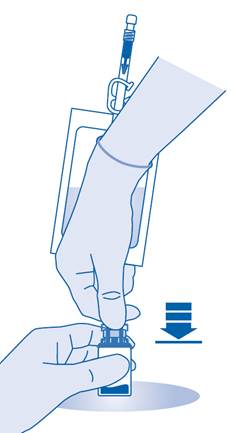
Pressez plusieurs fois la poche de solvant pour transférer suffisamment de solvant dans le flacon.
Veillez à ne pas remplir complètement le flacon afin de permettre le transfert ultérieur de la suspension dans la poche de solvant. Il est possible qu’il reste un peu de solvant dans la poche.
Remuez lentement le flacon afin de limiter la formation excessive de mousse, tout en mélangeant le médicament au solvant. S’il y a beaucoup de mousse, laissez le flacon reposer brièvement (quelques minutes).
Le contenu du flacon doit former une suspension homogène, ce qui peut prendre quelques minutes.
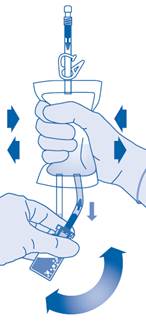
8. Retournez la poche de solvant et maintenez-la de sorte que le flacon se trouve au‑dessus.
Maintenez le flacon.
Pressez plusieurs fois la poche de solvant jusqu’à ce que le flacon soit complètement vide.
S’il reste de la poudre dans le flacon, répétez les étapes 7 et 8.
D’un point de vue microbiologique, le médicament doit être utilisé immédiatement. Si le médicament n’est pas utilisé immédiatement, consultez la rubrique 6.3 « Durée de conservation ».
La suspension ne doit pas être instillée à la température du réfrigérateur afin d’éviter que le patient n’ait envie d’uriner, ce qui entraînerait une durée d’exposition raccourcie.
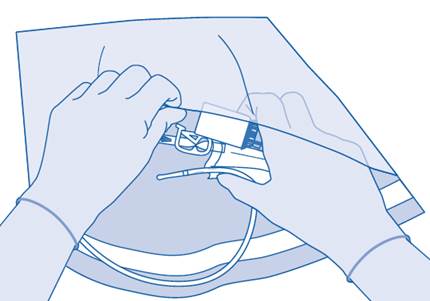
Cathétérisme
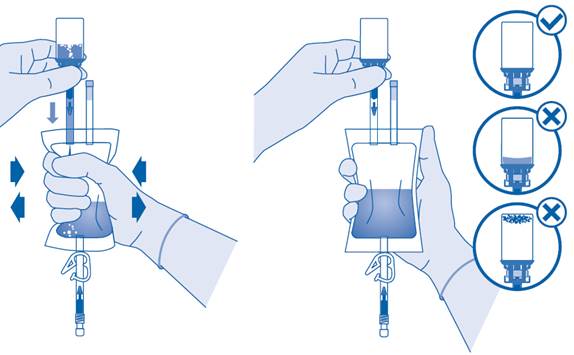
9. Cathétérisez le patient conformément aux réglementations locales et aux instructions d’utilisation à l’aide du cathéter Luer‑Lock (D) et du lubrifiant (D1) fournis ou d’un autre cathéter et/ou lubrifiant adaptés.
Videz la vessie à l’aide du cathéter.
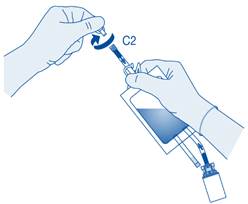
Connexion du cathéter à la poche de solvant
10. Afin de mélanger les sédiments, renversez et faites tourner la poche avant de la connecter.
N’administrez pas la suspension à la température du réfrigérateur.
Retirez le capuchon de protection du connecteur pour cathéter (C2).
Connectez le cathéter Luer‑Lock du patient (D) au connecteur pour cathéter (C2) de la poche de solvant.
Instillation
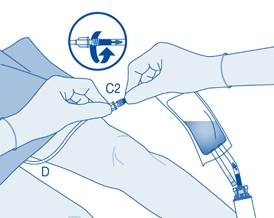
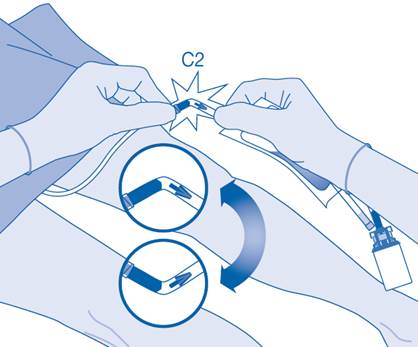
11. Pliez le sceau à briser dans le tube du connecteur pour cathéter (C2) dans un sens puis dans l’autre plusieurs fois afin de briser le sceau.
Maintenez fermement le cathéter du patient lors de cette manipulation.
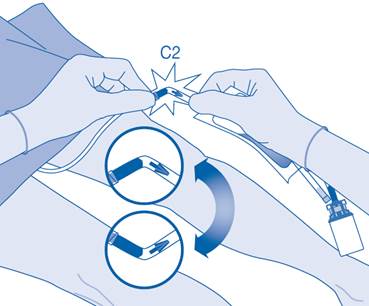
12. Maintenez la poche de solvant avec le flacon à l’envers au‑dessus de la poche.
Pressez délicatement la poche de solvant avec l’autre main afin que le médicament soit instillé lentement dans la vessie du patient.
Continuez de la presser jusqu’à ce que la poche de solvant et le flacon soient vides.
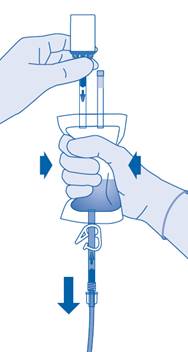
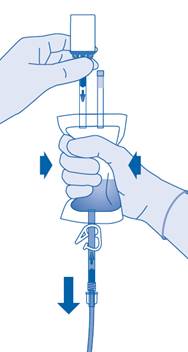
13. Expulsez l’air restant de la poche de solvant pour vider au maximum le cathéter.
Après l’instillation
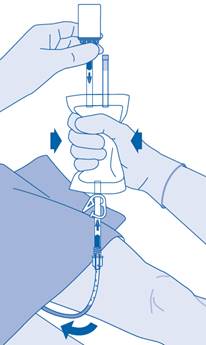
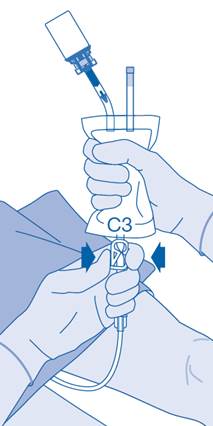
14. La fermeture de la pince de pression (C3) permet d’éviter un reflux du liquide dans le cathéter et réduit le risque de contamination. Autrement, vous pouvez garder la poche de solvant compressée tout en effectuant les étapes 15 et 16.
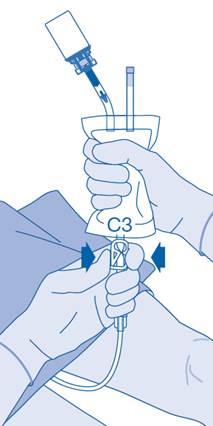
15. Avec précaution, retirez le cathéter de la vessie sans déconnecter la poche de solvant du cathéter. Évitez toute contamination provenant de gouttelettes d’éclaboussure.
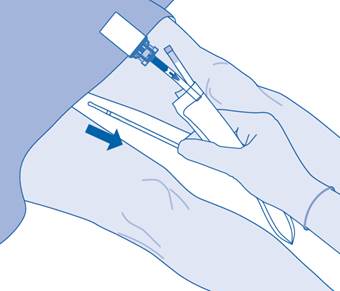
16. Éliminez le produit conformément aux réglementations nationales à l’aide du sac à déchets de soins.
Le contenu du flacon est destiné à une utilisation unique/une dose unique exclusivement. Toute suspension restante doit être éliminée.
Instructions destinées aux utilisateurs de BCG‑MEDAC
Composants et application du système d’instillation
Principaux composants du système d’instillation
|
Principaux composants |
Description |
|
A |
Flacon de poudre |
|
B |
Enveloppe de protection |
|
C |
Poche de solvant contenant une solution de chlorure de sodium à 0,9 % (9 mg/mL) |
|
C1 |
Connecteur pour flacon avec capuchon de protection et système de scellement à briser |
|
C2 |
Connecteur pour cathéter Luer-Lock avec capuchon de protection et système de scellement à briser |
|
C3 |
Pince de pression |
|
C4 |
Port de remplissage sans fonction d’application |
|
D |
Cathéter Luer‑Lock |
|
D1 |
Lubrifiant |
|
E |
Sac à déchets de soins |
|
F |
Adaptateur Luer‑Lock pour embout conique |
Connexion du flacon à la poche de solvant
1. Posez le sac à déchets de soins (E) pour qu’il soit prêt pour l’élimination directe du système après instillation afin d’éviter toute contamination.
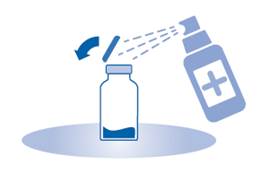
2. Retirez le capuchon amovible du flacon (A) et désinfectez le bouchon conformément aux réglementations locales.
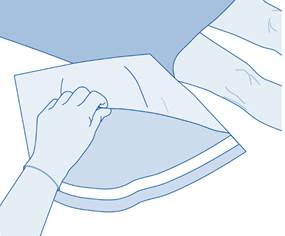
3. Déchirez l’enveloppe de protection (B) de la poche de solvant (C) et retirez complètement l’enveloppe de protection.
4. Retirez le capuchon de protection du connecteur pour flacon (C1).
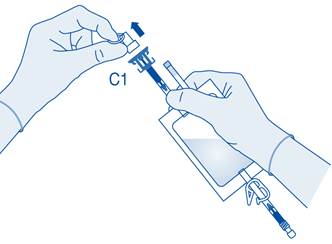
5. Poussez le connecteur sur le flacon jusqu’à la butée.
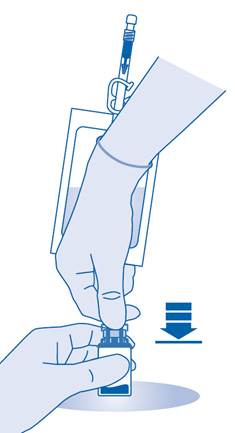
Mélange de la poudre avec le solvant
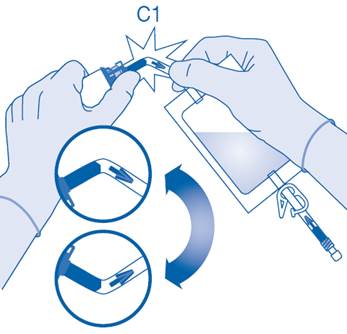
6. Pliez le sceau à briser dans le tube du connecteur pour flacon (C1) dans un sens puis dans l’autre plusieurs fois afin de briser le sceau.
7. Maintenez la poche de solvant afin que le flacon se trouve en dessous.
Pressez plusieurs fois la poche de solvant pour transférer suffisamment de solvant dans le flacon.
Veillez à ne pas remplir complètement le flacon afin de permettre le transfert ultérieur de la suspension dans la poche de solvant. Il est possible qu’il reste un peu de solvant dans la poche.
Remuez lentement le flacon afin de limiter la formation excessive de mousse, tout en mélangeant le médicament au solvant. S’il y a beaucoup de mousse, laissez le flacon reposer brièvement (quelques minutes).
Le contenu du flacon doit former une suspension homogène, ce qui peut prendre quelques minutes.
8. Retournez la poche de solvant et maintenez-la de sorte que le flacon se trouve au‑dessus.
Maintenez le flacon.
Pressez plusieurs fois la poche de solvant jusqu’à ce que le flacon soit complètement vide.
S’il reste de la poudre dans le flacon, répétez les étapes 7 et 8.
D’un point de vue microbiologique, le médicament doit être utilisé immédiatement.
Si le médicament n’est pas utilisé immédiatement, consultez la rubrique 6.3 « Durée de conservation ».
La suspension ne doit pas être instillée à la température du réfrigérateur afin d’éviter que le patient n’ait envie d’uriner, ce qui entraînerait une durée d’exposition raccourcie.
Cathétérisme
9. Cathétérisez le patient conformément aux réglementations locales et aux instructions d’utilisation à l’aide du cathéter Luer‑Lock (D) et du lubrifiant (D1) fournis ou d’un autre cathéter et/ou lubrifiant adaptés.
Videz la vessie à l’aide du cathéter.
Remarque concernant l’utilisation avec un cathéter auto-sélectionné avec embout conique :
L’adaptateur Luer‑Lock pour embout conique fourni (F) doit être utilisé pour connecter la poche au cathéter auto-sélectionné (non illustré).
Pour cela, les étapes supplémentaires suivantes doivent être effectuées :
· Retirez le capuchon de protection du connecteur pour cathéter (C2, voir étape 10).
· Renversez et faites tourner la poche avant de la connecter afin de remélanger les sédiments.
· Connectez l’adaptateur Luer‑Lock pour embout conique (F) au connecteur pour cathéter (C2) de la poche.
· Connectez soigneusement la poche avec l’adaptateur (F) au cathéter du patient.
· Passez ensuite à l’étape 11.
Connexion du cathéter à la poche de solvant
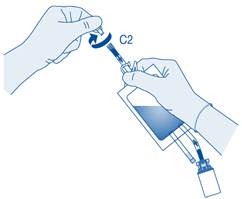
10. Afin de mélanger les sédiments, renversez et faites tourner la poche avant de la connecter.
N’administrez pas la suspension à la température du réfrigérateur.
Retirez le capuchon de protection du connecteur pour cathéter (C2).
Connectez le cathéter Luer‑Lock du patient (D) au connecteur pour cathéter (C2) de la poche de solvant.
Instillation
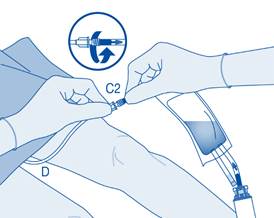
11. Pliez le sceau à briser dans le tube du connecteur pour cathéter (C2) dans un sens puis dans l’autre plusieurs fois afin de briser le sceau.
Maintenez fermement le cathéter du patient lors de cette manipulation.
12. Maintenez la poche de solvant avec le flacon à l’envers au‑dessus de la poche.
Pressez délicatement la poche de solvant avec l’autre main afin que le médicament soit instillé lentement dans la vessie du patient.
Continuez de la presser jusqu’à ce que la poche de solvant et le flacon soient vides.
13. Expulsez l’air restant de la poche de solvant pour vider au maximum le cathéter.

Après l’instillation
14. La fermeture de la pince de pression (C3) permet d’éviter un reflux du liquide dans le cathéter et réduit le risque de contamination. Autrement, vous pouvez garder la poche de solvant compressée tout en effectuant les étapes 15 et 16.
15. Avec précaution, retirez le cathéter de la vessie sans déconnecter la poche de solvant du cathéter. Évitez toute contamination provenant de gouttelettes d’éclaboussure.

16. Éliminez le produit conformément aux réglementations nationales à l’aide du sac à déchets de soins.
Le contenu du flacon est destiné à une utilisation unique/une dose unique exclusivement. Toute suspension restante doit être éliminée.
Instructions destinées aux utilisateurs de BCG‑MEDAC
Composants et application du système d’instillation
Principaux composants du système d’instillation
|
Principaux composants |
Description |
|
A |
Flacon de poudre |
|
B |
Enveloppe de protection |
|
C |
Poche de solvant contenant une solution de chlorure de sodium à 0,9 % (9 mg/mL) |
|
C1 |
Connecteur pour flacon avec capuchon de protection et système de scellement à briser |
|
C2 |
Connecteur pour cathéter Luer-Lock avec capuchon de protection et système de scellement à briser |
|
C3 |
Pince de pression |
|
C4 |
Port de remplissage sans fonction d’application |
|
E |
Sac à déchets de soins |
Connexion du flacon à la poche de solvant
1. Posez le sac à déchets de soins (E) pour qu’il soit prêt pour l’élimination directe du système après instillation afin d’éviter toute contamination.

2. Retirez le capuchon amovible du flacon (A) et désinfectez le bouchon conformément aux réglementations locales.
3. Déchirez l’enveloppe de protection (B) de la poche de solvant (C) et retirez complètement l’enveloppe de protection.

4. Retirez le capuchon de protection du connecteur pour flacon (C1).
5. Poussez le connecteur sur le flacon jusqu’à la butée.
Mélange de la poudre avec le solvant
6. Pliez le sceau à briser dans le tube du connecteur pour flacon (C1) dans un sens puis dans l’autre plusieurs fois afin de briser le sceau.

7. Maintenez la poche de solvant afin que le flacon se trouve en dessous.
Pressez plusieurs fois la poche de solvant pour transférer suffisamment de solvant dans le flacon.
Veillez à ne pas remplir complètement le flacon afin de permettre le transfert ultérieur de la suspension dans la poche de solvant. Il est possible qu’il reste un peu de solvant dans la poche.
Remuez lentement le flacon afin de limiter la formation excessive de mousse, tout en mélangeant le médicament au solvant. S’il y a beaucoup de mousse, laissez le flacon reposer brièvement (quelques minutes).
Le contenu du flacon doit former une suspension homogène, ce qui peut prendre quelques minutes.
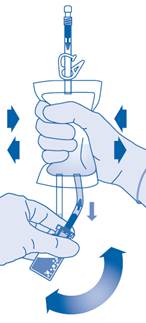
8. Retournez la poche de solvant et maintenez-la de sorte que le flacon se trouve au‑dessus.
Maintenez le flacon.
Pressez plusieurs fois la poche de solvant jusqu’à ce que le flacon soit complètement vide.
S’il reste de la poudre dans le flacon, répétez les étapes 7 et 8.
D’un point de vue microbiologique, le médicament doit être utilisé immédiatement.
Si le médicament n’est pas utilisé immédiatement, consultez la rubrique 6.3 « Durée de conservation ».
La suspension ne doit pas être instillée à la température du réfrigérateur afin d’éviter que le patient n’ait envie d’uriner, ce qui entraînerait une durée d’exposition raccourcie.

Cathétérisme
9. Cathétérisez le patient conformément aux réglementations locales et aux instructions d’utilisation à l’aide d’un cathéter et d’un lubrifiant adaptés.
Videz la vessie à l’aide du cathéter.
Connexion du cathéter à la poche de solvant
10. Afin de mélanger les sédiments, renversez et faites tourner la poche avant de la connecter.
N’administrez pas la suspension à la température du réfrigérateur.
Retirez le capuchon de protection du connecteur pour cathéter (C2).
Connectez le cathéter du patient au connecteur pour cathéter (C2) de la poche de solvant.
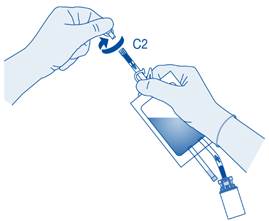

Instillation
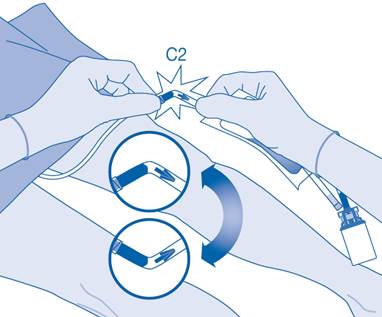
11. Pliez le sceau à briser dans le tube du connecteur pour cathéter (C2) dans un sens puis dans l’autre plusieurs fois afin de briser le sceau.
Maintenez fermement le cathéter du patient lors de cette manipulation.
12. Maintenez la poche de solvant avec le flacon à l’envers au‑dessus de la poche.
Pressez délicatement la poche de solvant avec l’autre main afin que le médicament soit instillé lentement dans la vessie du patient.
Continuez de la presser jusqu’à ce que la poche de solvant et le flacon soient vides.

13. Expulsez l’air restant de la poche de solvant pour vider au maximum le cathéter.

Après l’instillation
14. La fermeture de la pince de pression (C3) permet d’éviter un reflux du liquide dans le cathéter et réduit le risque de contamination. Autrement, vous pouvez garder la poche de solvant compressée tout en effectuant les étapes 15 et 16.

15. Avec précaution, retirez le cathéter de la vessie sans déconnecter la poche de solvant du cathéter. Évitez toute contamination provenant de gouttelettes d’éclaboussure.

16. Éliminez le produit conformément aux réglementations nationales à l’aide du sac à déchets de soins.
Le contenu du flacon est destiné à une utilisation unique/une dose unique exclusivement. Toute suspension restante doit être éliminée.

Instructions destinées aux utilisateurs de BCG‑MEDAC
Composants et application du système d’instillation
Principaux composants du système d’instillation
|
Principaux composants |
Description |
|
A |
Flacon de poudre |
|
B |
Enveloppe de protection |
|
C |
Poche de solvant contenant une solution de chlorure de sodium à 0,9 % (9 mg/mL) |
|
C1 |
Connecteur pour flacon avec capuchon de protection et système de scellement à briser |
|
C2 |
Connecteur pour cathéter Luer-Lock avec capuchon de protection et système de scellement à briser |
|
C3 |
Pince de pression |
|
C4 |
Port de remplissage sans fonction d’application |
|
E |
Sac à déchets de soins |
|
F |
Adaptateur Luer‑Lock pour embout conique |
Connexion du flacon à la poche de solvant
1. Posez le sac à déchets de soins (E) pour qu’il soit prêt pour l’élimination directe du système après instillation afin d’éviter toute contamination.
2. Retirez le capuchon amovible du flacon (A) et désinfectez le bouchon conformément aux réglementations locales.
3. Déchirez l’enveloppe de protection (B) de la poche de solvant (C) et retirez complètement l’enveloppe de protection.
4. Retirez le capuchon de protection du connecteur pour flacon (C1).
5. Poussez le connecteur sur le flacon jusqu’à la butée.
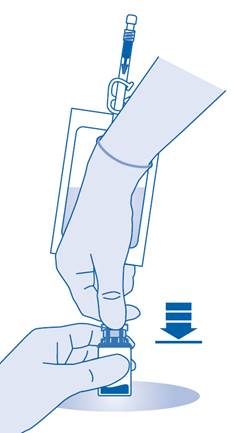
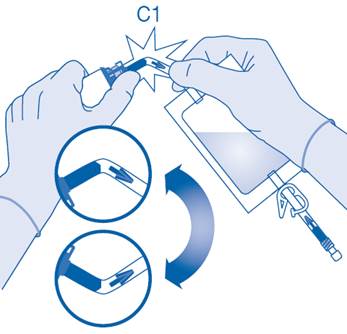
Mélange de la poudre avec le solvant
6. Pliez le sceau à briser dans le tube du le connecteur pour flacon (C1) dans un sens puis dans l’autre plusieurs fois afin de briser le sceau.
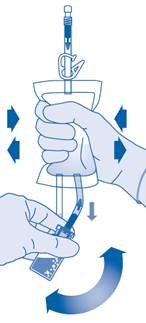
7. Maintenez la poche de solvant afin que le flacon se trouve en dessous.
Pressez plusieurs fois la poche de solvant pour transférer suffisamment de solvant dans le flacon.
Veillez à ne pas remplir complètement le flacon afin de permettre le transfert ultérieur de la suspension dans la poche de solvant. Il est possible qu’il reste un peu de solvant dans la poche.
Remuez lentement le flacon afin de limiter la formation excessive de mousse, tout en mélangeant le médicament au solvant. S’il y a beaucoup de mousse, laissez le flacon reposer brièvement (quelques minutes).
Le contenu du flacon doit former une suspension homogène, ce qui peut prendre quelques minutes.
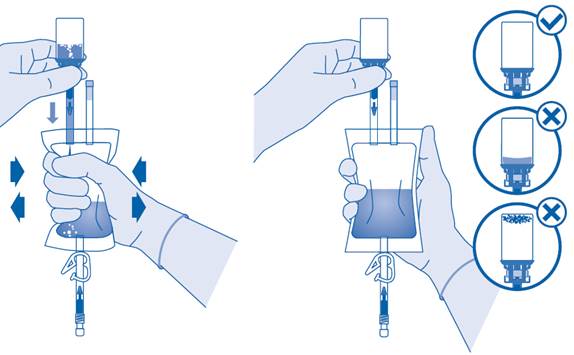
8. Retournez la poche de solvant et maintenez-la de sorte que le flacon se trouve au‑dessus.
Maintenez le flacon.
Pressez plusieurs fois la poche de solvant jusqu’à ce que le flacon soit complètement vide.
S’il reste de la poudre dans le flacon, répétez les étapes 7 et 8.
D’un point de vue microbiologique, le médicament doit être utilisé immédiatement.
Si le médicament n’est pas utilisé immédiatement, consultez la rubrique 6.3 « Durée de conservation ».
La suspension ne doit pas être instillée à la température du réfrigérateur afin d’éviter que le patient n’ait envie d’uriner, ce qui entraînerait une durée d’exposition raccourcie.
Cathétérisme
9. Cathétérisez le patient conformément aux réglementations locales et aux instructions d’utilisation à l’aide d’un cathéter et d’un lubrifiant adaptés.
Videz la vessie à l’aide du cathéter.
Ce pack ne contient pas de cathéter. Utilisez le connecteur fourni (F) pour connecter la poche au cathéter du patient avec embout conique (non illustré).
Pour cela, les étapes supplémentaires suivantes doivent être effectuées :
· Retirez le capuchon de protection du connecteur pour cathéter (C2, voir étape 10).
· Connectez l’adaptateur (F) au connecteur pour cathéter (C2) de la poche.
· Connectez soigneusement la poche avec l’adaptateur (F) au cathéter du patient.
· Passez ensuite à l’étape 11.
Connexion du cathéter à la poche de solvant
10. Afin de mélanger les sédiments, renversez et faites tourner la poche avant de la connecter.
N’administrez pas la suspension à la température du réfrigérateur.
Retirez le capuchon de protection du connecteur pour cathéter (C2).
Connectez le cathéter du patient au connecteur pour cathéter (C2) de la poche de solvant.
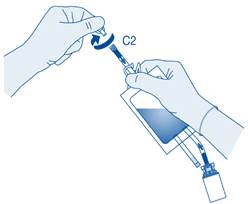
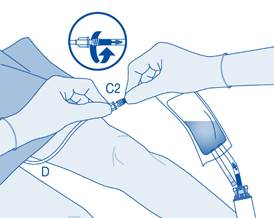
Instillation
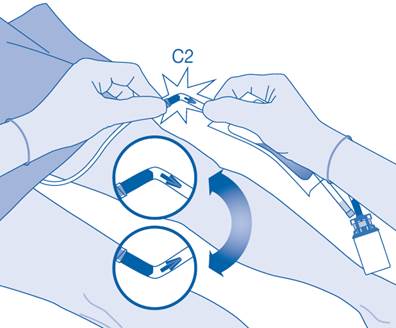
11. Pliez le sceau à briser dans le tube du connecteur pour cathéter (C2) dans un sens puis dans l’autre plusieurs fois afin de briser le sceau.
Maintenez fermement le cathéter du patient lors de cette manipulation.
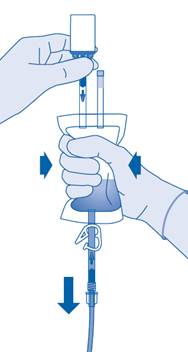
12. Maintenez la poche de solvant avec le flacon à l’envers au‑dessus de la poche.
Pressez délicatement la poche de solvant avec l’autre main afin que le médicament soit instillé lentement dans la vessie du patient.
Continuez de la presser jusqu’à ce que la poche de solvant et le flacon soient vides.
13. Expulsez l’air restant de la poche de solvant pour vider au maximum le cathéter.
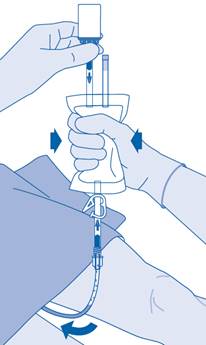
Après l’instillation
14. La fermeture de la pince de pression (C3) permet d’éviter un reflux du liquide dans le cathéter et réduit le risque de contamination. Autrement, vous pouvez garder la poche de solvant compressée tout en effectuant les étapes 15 et 16.
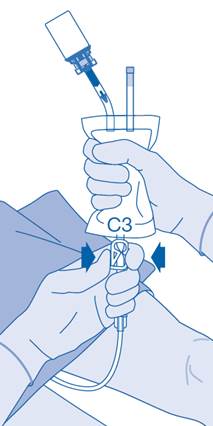
15. Avec précaution, retirez le cathéter de la vessie sans déconnecter la poche de solvant du cathéter. Évitez toute contamination provenant de gouttelettes d’éclaboussure.
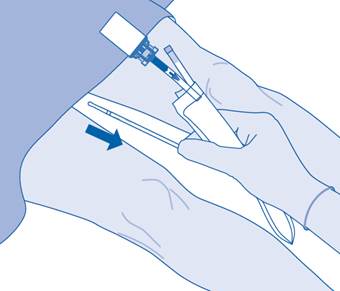
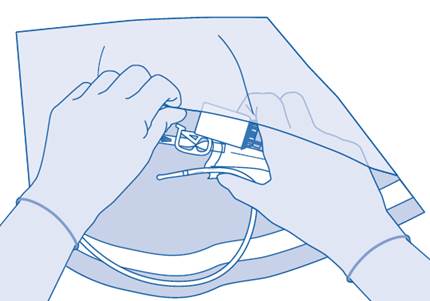
16. Éliminez le produit conformément aux réglementations nationales à l’aide du sac à déchets de soins.
Le contenu du flacon est destiné à une utilisation unique/une dose unique exclusivement. Toute suspension restante doit être éliminée.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
medac Gesellschaft für klinische Spezialpräparate mbH
Theaterstr. 6
22880 Wedel
Allemagne
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 362 774 5 8 : poudre en flacon (verre de type I) avec bouchon en caoutchouc et 50 ml de solvant dans une poche (Advanced Polypropylène) avec connecteur pour flacon et connecteur Luer-Lock pour cathéter. Boîte de 3 sans cathéter.
· 34009 300 186 4 4 : poudre en flacon (verre de type I) avec bouchon en caoutchouc et 50 ml de solvant dans une poche (Advanced Polypropylène) avec connecteur pour flacon et connecteur Luer-Lock pour cathéter. Boîte de 1 avec cathéter.
· 34009 300 186 5 1 : poudre en flacon (verre de type I) avec bouchon en caoutchouc et 50 ml de solvant dans une poche (Advanced Polypropylène) avec connecteur pour flacon et connecteur Luer-Lock pour cathéter. Boîte de 3 avec cathéter.
· 34009 303 044 9 5 : poudre en flacon (verre de type I) avec bouchon en caoutchouc et 50 ml de solvant dans une poche ((Advanced Polypropylène) avec connecteur pour flacon et connecteur Luer-Lock pour cathéter, avec adaptateur Luer Lock pour embout conique. Boîte de 1 avec cathéter.
· 34009 303 045 1 8 : poudre en flacon (verre de type I) avec bouchon en caoutchouc et 50 ml de solvant dans une poche (Advanced Polypropylène) avec connecteur pour flacon et connecteur Luer-Lock pour cathéter, avec adaptateur Luer Lock pour embout conique. Boîte de 3 avec cathéter.
· 34009 303 045 2 5 : poudre en flacon (verre de type I) avec bouchon en caoutchouc et 50 ml de solvant dans une poche (Advanced Polypropylène) avec connecteur pour flacon et connecteur Luer-Lock pour cathéter, avec adaptateur Luer Lock pour embout conique. Boîte de 5 avec cathéter.
· 34009 303 045 3 2 : poudre en flacon (verre de type I) avec bouchon en caoutchouc et 50 ml de solvant dans une poche (Advanced Polypropylène) avec connecteur pour flacon et connecteur Luer-Lock pour cathéter, avec adaptateur Luer Lock pour embout conique. Boîte de 6 avec cathéter.
· 34009 303 045 4 9 : poudre en flacon (verre de type I) avec bouchon en caoutchouc et 50 ml de solvant dans une poche (Advanced Polypropylène) avec connecteur pour flacon et connecteur Luer-Lock pour cathéter, avec adaptateur Luer Lock pour embout conique. Boîte de 1 sans cathéter.
· 34009 303 045 5 6 : poudre en flacon (verre de type I) avec bouchon en caoutchouc et 50 ml de solvant dans une poche (Advanced Polypropylène) avec connecteur pour flacon et connecteur Luer-Lock pour cathéter, avec adaptateur Luer Lock pour embout conique. Boîte de 3 sans cathéter.
· 34009 303 045 6 3 : poudre en flacon (verre de type I) avec bouchon en caoutchouc et 50 ml de solvant dans une poche (Advanced Polypropylène) avec connecteur pour flacon et connecteur Luer-Lock pour cathéter, avec adaptateur Luer Lock pour embout conique. Boîte de 5 sans cathéter.
· 34009 303 045 7 0 : poudre en flacon (verre de type I) avec bouchon en caoutchouc et 50 ml de solvant dans une poche (Advanced Polypropylène) avec connecteur pour flacon et connecteur Luer-Lock pour cathéter, avec adaptateur Luer Lock pour embout conique. Boîte de 6 sans cathéter.
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Liste I
Prescription initiale hospitalière 6 mois et renouvellement réservés aux spécialistes en urologie ou en oncologie médicale.
ANSM - Mis à jour le : 20/03/2025
BCG‑MEDAC, poudre et solvant pour suspension intravésicale
Bacille de Calmette et Guérin
Veuillez lire attentivement cette notice avant d’utiliser ce médicament car elle contient des informations importantes pour vous.
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin ou votre pharmacien.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
1. Qu'est-ce que BCG‑MEDAC, poudre et solvant pour suspension intravésicale et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant d'utiliser BCG‑MEDAC, poudre et solvant pour suspension intravésicale ?
3. Comment utiliser BCG‑MEDAC, poudre et solvant pour suspension intravésicale ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver BCG‑MEDAC, poudre et solvant pour suspension intravésicale ?
6. Contenu de l’emballage et autres informations
1. QU’EST-CE QUE BCG‑MEDAC, poudre et solvant pour suspension intravésicale ET DANS QUELS CAS EST-IL UTILISE ?
BCG‑MEDAC contient des bactéries Mycobacterium bovis affaiblies (atténuées) à faible potentiel infectieux.
BCG‑MEDAC stimule le système immunitaire et il est utilisé pour traiter plusieurs types de cancer de la vessie. Il est efficace si le cancer est limité aux cellules qui tapissent la paroi interne de la vessie (urothélium) et n’a pas envahi les tissus internes de la vessie.
BCG‑MEDAC est administré directement dans la vessie par instillation.
Dans la forme de cancer de la vessie de type « lésion plane » (carcinome in situ), BCG‑MEDAC est utilisé pour traiter la maladie confinée à la muqueuse vésicale. Les cancers touchant la muqueuse de la vessie et la couche de cellules qui bordent la muqueuse (lamina propria) peuvent être de différents grades.
BCG‑MEDAC est également utilisé pour prévenir une réapparition du cancer (traitement prophylactique).
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D’UTILISER BCG‑MEDAC, poudre et solvant pour suspension intravésicale ?
N’utilisez jamais BCG‑MEDAC, poudre et solvant pour suspension intravésicale
· si vous êtes allergique aux bactéries BCG (Bacillus Calmette-Guérin) viables ou à l’un des autres composants contenus dans ce médicament, mentionnés dans la rubrique 6.
· si l’activité de votre système immunitaire est diminuée ou si vous souffrez d’un déficit immunitaire, qu’il soit causé par une maladie coexistante (par exemple infection par le VIH, leucémie, lymphome), un traitement anticancéreux (par exemple médicaments cytostatiques, radiothérapie) ou un traitement immunosuppresseur (par exemple corticoïdes).
· si vous souffrez de tuberculose active.
· si votre vessie ou une région avoisinante de votre corps a été traitée par radiothérapie auparavant.
· si vous allaitez.
· si vous avez subi une intervention chirurgicale réalisée via l’urètre (RTU, résection transurétrale), un prélèvement d’échantillon de tissu vésical (biopsie de la vessie) ou une lésion causée par un cathéter (cathétérisme traumatique) au cours des 2 à 3 semaines précédentes.
· si vous souffrez de perforation de la vessie.
· si du sang est visible dans vos urines (hématurie macroscopique).
· si vous souffrez d’une infection urinaire aiguë.
BCG‑MEDAC ne doit pas être administré sous ou dans la peau, dans un muscle ou une veine ou pour la vaccination. Il doit être administré directement dans la vessie par instillation.
Avertissements et précautions
Votre médecin vous remettra une Carte de surveillance patient que vous devriez avoir sur vous en permanence (voir également rubrique 4).
Adressez-vous à votre médecin ou pharmacien avant d’utiliser BCG‑MEDAC
· si vous avez de la fièvre ou en cas de présence de sang dans les urines. Le traitement par BCG‑MEDAC devra alors être différé.
· si vous avez une capacité vésicale faible, car elle pourrait diminuer encore davantage après le traitement.
· si vous êtes porteur/porteuse de l’antigène HLA‑B27 (human leukocyte antigen B27), car le risque de survenue d’une inflammation des articulations (arthrite réactionnelle) peut être plus élevé.
· si vous souffrez d’une arthrite accompagnée d’une inflammation de la peau, des yeux et des voies urinaires (syndrome de Reiter ou syndrome oculo‑urétro‑synovial).
· si vous présentez une dilatation localisée d’un vaisseau sanguin (anévrisme) ou si vous portez une prothèse. Vous pourriez développer une infection de l’implant ou du greffon.
· si vous avez des problèmes de foie ou si vous prenez des médicaments qui peuvent affecter le foie. Ceci est particulièrement important si une trithérapie antibiotique avec des médicaments antituberculeux est envisagée.
Hygiène générale
Après l’instillation, asseyez-vous avant d’uriner pour empêcher les éclaboussures d’urine et éviter la contamination de la zone par les bactéries BCG.
Il est recommandé de se laver les mains et la région génitale après avoir uriné. Cela s’applique en particulier à la première miction (action d’uriner) suivant l’instillation du BCG. En cas de contamination de lésions cutanées, un désinfectant approprié doit être utilisé (demandez conseil à votre médecin ou à votre pharmacien).
Détection du bacille de Calmette-Guérin
La détection des bactéries BCG est en général difficile. Un résultat négatif du test n’exclut pas une infection par le BCG à l’extérieur de la vessie.
Infection urinaire
Votre médecin devra s’assurer de l’absence d’infection urinaire aiguë avant chaque instillation du BCG dans la vessie. Si une infection urinaire aiguë est diagnostiquée pendant le traitement par le BCG, le traitement devra être interrompu jusqu’à ce que l’analyse d’urine soit normale et que le traitement antibiotique soit terminé.
Patients en contact avec des personnes immunodéprimées
Si vous recevez un traitement par BCG‑MEDAC, vous devez respecter des normes d’hygiène générale comme indiqué ci-dessus. Cela est de la plus haute importance si vous êtes en contact avec des personnes immunodéprimées, car les bactéries BCG peuvent être dangereuses pour des patients ayant un système immunitaire affaibli. Toutefois, aucun cas de transmission de la bactérie de personne à personne n’a encore été signalé à ce jour.
Transmission sexuelle
Vous devez utiliser des préservatifs pendant les rapports sexuels pendant une semaine après le traitement par le BCG pour éviter la transmission sexuelle des bactéries BCG.
Enfants et adolescents
Sans objet.
Autres médicaments et BCG‑MEDAC, poudre et solvant pour suspension intravésicale
Informez votre médecin ou pharmacien si vous utilisez, avez récemment utilisé ou pourriez utiliser tout autre médicament.
Cela est particulièrement important avec les médicaments ci‑dessous, auxquels les bactéries BCG sont sensibles :
· médicaments antituberculeux (par exemple éthambutol, streptomycine, acide para‑aminosalicylique (PAS), isoniazide (INH) et rifampicine) ;
· antibiotiques (fluoroquinolones, doxycycline ou gentamicine) ;
· antiseptiques ;
· agents lubrifiants.
Les bactéries BCG sont résistantes à la pyrazinamide et à la cyclosérine.
BCG‑MEDAC, poudre et solvant pour suspension intravésicale avec des aliments et boissons
Grossesse, allaitement et fertilité
Grossesse
Vous ne devez pas recevoir BCG‑MEDAC si vous êtes enceinte ou si vous pensez l’être.
Allaitement
Vous ne devez pas recevoir BCG‑MEDAC si vous allaitez.
Fertilité
Il a été observé que le BCG avait des effets nocifs sur la production du sperme et pouvait entraîner une diminution de la concentration des spermatozoïdes dans le sperme, voire leur absence totale. Cet effet a été réversible chez les animaux. Cependant, il est souhaitable que les hommes se fassent conseiller sur les possibilités de conservation du sperme avant de débuter le traitement.
Conduite de véhicules et utilisation de machines
Ce médicament peut avoir une influence sur votre aptitude à conduire des véhicules et à utiliser des machines. Vous ne devez pas conduire ou utiliser des machines avant de savoir quel effet BCG‑MEDAC a sur vous.
En cas de doute, adressez-vous à votre médecin, infirmier/ère ou pharmacien.
BCG‑MEDAC, poudre et solvant pour suspension intravésicale contient
Sans objet.
3. COMMENT UTILISER BCG MEDAC, poudre et solvant pour suspension intravésicale ?
BCG‑MEDAC ne doit être préparé et administré que par des professionnels de santé expérimentés. Le contenu d’un flacon est nécessaire pour une instillation intravésicale.
Administration
BCG‑MEDAC est introduit dans la vessie au moyen d’un cathéter sous faible pression.
Le médicament devrait rester dans la vessie pendant une période de 2 heures. Pour cela, vous ne devez pas boire pendant 4 heures avant et 2 heures après l’instillation.
Pendant que la suspension est dans la vessie, il est important qu’elle entre suffisamment en contact avec toute la surface de la muqueuse, et le fait de bouger le plus possible facilite ce contact. Au bout de 2 heures, vous devez uriner en position assise pour éviter un débordement accidentel.
Si vous ne suivez pas un régime restreint en liquides, il est recommandé de boire abondamment pendant 48 heures après chaque instillation.
Utilisation chez les enfants
La sécurité et l’efficacité de BCG‑MEDAC chez les enfants n’ont pas été établies.
Utilisation chez les personnes âgées
Il n’y a pas de recommandations particulières concernant l’utilisation du médicament chez les personnes âgées. Cependant, la fonction hépatique doit être prise en compte avant l’administration du BCG.
Durée du traitement
Le schéma thérapeutique conventionnel (traitement d’induction) consiste en une instillation intravésicale de BCG‑MEDAC par semaine pendant 6 semaines consécutives. Après une période de 4 semaines sans traitement, vous pourrez recevoir des instillations intravésicales supplémentaires, appelées « traitement d’entretien », pendant au moins un an comme il est décrit ci‑dessous. Votre médecin vous en parlera.
Traitement d’induction
· Le traitement par le BCG doit débuter 2 à 3 semaines environ après l’intervention chirurgicale réalisée via l’urètre (RTU, résection transurétrale) ou le prélèvement d’un échantillon de tissu vésical (biopsie de la vessie) et en l’absence de lésion causée par un cathéter (cathétérisme traumatique). Il sera répété à intervalles d’une semaine pendant 6 semaines.
· Après ce traitement d’induction, de nombreuses personnes suivent un traitement d’entretien, au cours duquel vous recevrez d’autres doses.
Traitement d’entretien
· Le schéma d’entretien consiste en 3 instillations à intervalles d’une semaine administrées sur un minimum d’1 an et jusqu’à 3 ans les 3, 6, 12, 18, 24, 30 et 36èmes mois. Avec ce schéma, vous recevrez au total 15 à 27 instillations sur une période de 1 an à 3 ans.
Votre médecin discutera avec vous de la nécessité du traitement d’entretien tous les 6 mois après la première année de traitement, si nécessaire.
Bien que le traitement d’entretien réduise le risque de réapparition du cancer et puisse réduire sa capacité à progresser, les effets indésirables et l’inconfort liés au traitement peuvent l’emporter sur les bénéfices chez certains patients. Par conséquent, il est important que votre médecin discute avec vous des inconvénients du traitement et de vos propres préférences avant de débuter ou de poursuivre le traitement d’entretien.
Si vous avez utilisé plus de BCG‑MEDAC, poudre et solvant pour suspension intravésicale que vous n’auriez dû
Un surdosage est peu susceptible de survenir car un flacon de BCG‑MEDAC correspond à une dose instillée dans la vessie. Il n’existe pas de données indiquant qu’un surdosage peut entraîner des symptômes autres que les effets indésirables décrits (voir rubrique 4).
Si vous oubliez d’utiliser BCG‑MEDAC, poudre et solvant pour suspension intravésicale
Si vous arrêtez d’utiliser BCG‑MEDAC, poudre et solvant pour suspension intravésicale
Sans objet.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Les effets indésirables du traitement par le BCG sont fréquents mais généralement légers et temporaires. En général, les effets indésirables augmentent avec le nombre d’instillations du BCG.
Toutefois, l’effet secondaire le plus grave est une infection systémique (généralisée) sévère. Informez immédiatement votre médecin si vous présentez les symptômes suivants qui peuvent se produire à tout moment et sont parfois retardés, pouvant apparaître des semaines, des mois, ou même des années après votre dernière dose.
Montrez votre Carte de surveillance patient aux médecins qui vous traitent.
· Une fièvre de plus de 39,5 °C pendant au moins 12 heures ou une fièvre de plus de 38 °C pouvant durer plusieurs semaines, des sueurs nocturnes
· Perte de poids d’origine inconnue
· Une sensation grandissante de malaise
· Les signes d’une inflammation sont variés et peuvent se présenter sous la forme
o de difficultés à respirer ou d’une toux qui ne ressemble pas à une toux normale de rhume (pneumonie miliaire),
o de problèmes de foie : une sensation de pression dans la partie supérieure droite de l’abdomen ou d’anomalies du bilan biologique hépatique (en particulier une enzyme appelée phosphatase alcaline), ou
o d’une douleur et d’une rougeur dans l’œil, de problèmes de vue ou d’une vision floue, d’une conjonctivite.
· Une inflammation granulomateuse qui a été observée sur une biopsie.
Infection/réaction systémique au BCG
Si la vessie est blessée accidentellement pendant le traitement par BCG‑MEDAC ou si BCG‑MEDAC est administré dans un muscle ou une veine, une infection systémique (généralisée) sévère par le BCG peut survenir. Une infection systémique sévère par le BCG peut entraîner une septicémie à BCG. La septicémie à BCG est une situation pouvant engager le pronostic vital. Si vous présentez un symptôme ou un signe qui vous inquiète, parlez-en immédiatement à votre médecin ou contactez un spécialiste des maladies infectieuses ! Cependant, l’infection n’est pas virulente. Votre médecin vous prescrira un médicament pour traiter les effets indésirables et le traitement par BCG‑MEDAC pourra être interrompu.
Contrairement à une infection par le BCG, une réaction au BCG entraîne souvent une légère fièvre, des symptômes pseudo-grippaux et un inconfort général pendant 24 à 48 heures au début de la réaction immunitaire. Votre médecin peut vous prescrire certains médicaments pour traiter les symptômes. Si les symptômes s’aggravent, parlez-en à votre médecin.
Infection par le BCG retardée
Dans des cas isolés, les bactéries BCG peuvent rester dans l’organisme pendant des années. Cette infection peut survenir à tout moment et les signes et symptômes d’une infection apparaissent parfois de façon retardée, même des années après l’administration de la dernière dose de BCG‑MEDAC. Les signes d’une inflammation peuvent être similaires aux signes d’une infection/réaction sévère au BCG mentionnés ci‑dessus. Des problèmes avec un implant ou un greffon peuvent également être un effet indésirable du traitement par le BCG et peuvent nécessiter un traitement en urgence.
Il est donc de la plus haute importance d’avoir sur vous votre Carte de surveillance patient et de la montrer à tous les médecins qui vous traitent pour assurer un traitement approprié en cas de survenue d’une infection par le BCG retardée. Le médecin pourra également évaluer si les symptômes sont ou non un effet indésirable de votre traitement par le BCG.
Vous trouverez ci-après une liste complète des effets secondaires qui peuvent se produire :
Très fréquent : pouvant affecter plus de 1 personne sur 10
· Sensation de mal au cœur (nausées)
· Inflammation de la vessie (cystite), réactions inflammatoires (granulomes) de la vessie. Ces effets indésirables peuvent être une part essentielle de l’activité antitumorale.
· Mictions fréquentes avec gêne et douleur. Cet effet indésirable peut affecter jusqu’à 90 % des patients.
· Réactions inflammatoires de la prostate (prostatite granulomateuse asymptomatique)
· Réactions systémiques temporaires au BCG telles que fièvre inférieure à 38,5 °C, symptômes pseudo‑grippaux (malaise, fièvre, frissons) et inconfort général
· Fatigue
Fréquent : pouvant affecter jusqu’à 1 personne sur 10
· Fièvre supérieure à 38,5 °C
· Douleur musculaire (myalgie)
· Diarrhée
· Douleurs abdominales
Peu fréquent : pouvant affecter jusqu’à 1 personne sur 100
· Infection/réaction systémique au BCG sévère, septicémie à BCG (voir ci‑dessous pour des informations plus détaillées)
· Taux insuffisant (déficit) de cellules du sang (cytopénie)
· Anémie (diminution du taux d’hémoglobine dans le sang)
· Syndrome de Reiter (arthrite accompagnée d’une inflammation de la peau, des yeux et des voies urinaires)
· Inflammation des poumons (pneumopathie avec atteinte miliaire)
· Réactions inflammatoires des poumons (granulome pulmonaire)
· Inflammation du foie (hépatite)
· Abcès cutané
· Eruption cutanée, inflammation des articulations (arthrite), douleurs articulaires (arthralgies). Dans la plupart des cas, ces effets indésirables sont des signes de réaction allergique (hypersensibilité) au BCG. Dans certains cas, il peut être nécessaire d’arrêter le traitement.
· Infection urinaire, présence de sang dans les urines (hématurie macroscopique)
· Vessie anormalement petite (rétraction vésicale), débit urinaire anormalement faible (obstruction des voies urinaires), contracture vésicale
· Inflammation des testicules (orchite)
· Inflammation de l’épididyme (épididymite)
· Réaction inflammatoire de la prostate (prostatite granulomateuse symptomatique)
· Tension artérielle basse (hypotension)
· Tests hépatiques anormaux
Rare : pouvant affecter jusqu’à 1 personne sur 1 000
· Infection vasculaire (par exemple dilatation localisée infectée d’un vaisseau sanguin)
· Abcès rénal
Très rare : pouvant affecter jusqu’à 1 personne sur 10 000
· Infection par le BCG des implants et tissus environnants (par exemple greffon aortique, défibrillateur cardiaque, prothèse de hanche ou de genou)
· Inflammation des ganglions lymphatiques du cou (lymphadénite cervicale), infection des ganglions lymphatiques régionaux
· Réaction allergique (hypersensibilité) (par exemple œdème des paupières, toux)
· Inflammation de la partie interne de l’œil (choriorétinite)
· Conjonctivite, uvéite (inflammation de l’uvée de l’œil)
· Fistule vasculaire
· Vomissements, fistule intestinale, inflammation du péritoine (péritonite)
· Infection des os et de la moelle osseuse par des bactéries (ostéomyélite)
· Infection de la moelle osseuse
· Abcès du psoas (abcès au niveau du muscle de l’aine)
· Inflammation des testicules (orchite) ou de l’épididyme (épididymite) résistant à un traitement antituberculeux
· Infection du gland du pénis
· Gonflement dans les bras ou les jambes
Fréquence indéterminée : ne peut être estimée sur la base des données disponibles
· Inflammation des vaisseaux sanguins (éventuellement dans le cerveau)
· Troubles génitaux (par exemple douleur vaginale)
· Rapports sexuels douloureux (dyspareunie)
· Réaction immunitaire sévère avec fièvre, augmentation de volume du foie, de la rate et des ganglions lymphatiques, jaunisse et éruption cutanée (syndrome hémophagocytaire)
· Insuffisance rénale, inflammation du tissu rénal, des cavités rénales, du bassin (pyélonéphrite, néphrite [dont néphrite tubulo-interstitielle, néphrite interstitielle et glomérulonéphrite])
· Taux de spermatozoïdes nul ou faible dans le sperme (azoospermie, oligospermie)
· Augmentation de l’antigène spécifique de la prostate (PSA, analyse de laboratoire concernant la prostate)
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet: https://signalement.social-sante.gouv.fr.
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER BCG‑MEDAC, poudre et solvant pour suspension intravésicale ?
Tenir ce médicament hors de la vue et de la portée des enfants.
N’utilisez pas ce médicament après la date de péremption indiquée sur l’étiquette et l’emballage après EXP.
A conserver au réfrigérateur (entre 2 °C et 8 °C).
Ne pas congeler.
A conserver dans l’emballage d’origine à l’abri de la lumière.
La stabilité physico-chimique du produit reconstitué a été démontrée pendant 24 heures lorsque le produit est conservé à l’abri de la lumière à température ambiante (entre 20 °C et 25 °C) ou au réfrigérateur (entre 2 °C et 8 °C).
D’un point de vue microbiologique, le médicament doit être utilisé immédiatement.
S’il n’est pas utilisé immédiatement, les durées et conditions de conservation du produit avant utilisation relèvent de la responsabilité de l’utilisateur mais ne devront normalement pas dépasser 24 heures entre 2 °C et 8 °C, sauf si la reconstitution a eu lieu dans des conditions aseptiques contrôlées et validées.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient BCG‑MEDAC, poudre et solvant pour suspension intravésicale
· La substance active est : la bactérie BCG viable (bacille de Calmette et Guérin) (souche RIVM dérivée de la souche 1173‑ P2).
Après reconstitution, un flacon contient :
Souche RIVM du BCG dérivée de la souche 1173‑ P2
2 x 108 à 3 x 109 unités viables
· Les autres composants sont :
Poudre : polygéline, glucose anhydre et polysorbate 80.
Solvant : chlorure de sodium et eau pour préparations injectables.
BCG‑MEDAC se présente sous forme d’une poudre blanche ou presque blanche ou d’un lyophilisat poreux avec des teintes jaunes et grises et d’une solution incolore limpide utilisée comme solvant.
Boîtes de 1, 3, 5 ou 6 flacons avec ou sans cathéter/s et adaptateur/s Luer‑Lock pour embout conique.
Toutes les présentations peuvent ne pas être commercialisées.
Titulaire de l’autorisation de mise sur le marché
medac Gesellschaft für klinische Spezialpräparate mbH
Theaterstr. 6
22880 Wedel
Allemagne
Exploitant de l’autorisation de mise sur le marché
medac s.a.s.
1 RUE CROIX BARRET
69007 Lyon
medac Gesellschaft für klinische Spezialpräparate mbH
Theaterstr. 6
22880 Wedel
Allemagne
Noms du médicament dans les Etats membres de l'Espace Economique Européen
[À compléter ultérieurement par le titulaire]
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).
---------------------------------------------------------------------------------------------------------------------------
Les informations suivantes sont destinées exclusivement aux professionnels de santé:
Traitement des symptômes, signes et syndromes
|
Symptômes, signes ou syndrome |
Traitement |
|
1) Symptômes d’une irritation vésicale durant moins de 48 heures |
Traitement symptomatique |
|
2) Symptômes d’irritation vésicale durant au moins 48 heures |
Arrêter le traitement par BCG‑MEDAC et instaurer un traitement par des quinolones. S’il n’y a pas disparition complète des symptômes après 10 jours, administrer de l’isoniazide (INH)* pendant 3 mois. En cas de traitement antituberculeux, le traitement par BCG‑MEDAC doit être définitivement interrompu. |
|
3) Infection bactérienne concomitante des voies urinaires |
Différer le traitement par BCG‑MEDAC jusqu’à l’obtention d’une culture urinaire négative et jusqu’à la fin de l’antibiothérapie. |
|
4) Autres effets indésirables génito-urinaires : prostatite granulomateuse symptomatique, épididymite et orchite, obstruction urétrale et abcès rénal |
Arrêter le traitement par BCG‑MEDAC. Envisager une consultation chez un spécialiste des maladies infectieuses. Administrer de l’isoniazide (INH)* et de la rifampicine*, pendant 3 à 6 mois en fonction de la sévérité des symptômes. En cas de traitement antituberculeux, le traitement par BCG‑MEDAC doit être définitivement interrompu. |
|
5) Fièvre de moins de 38,5 °C durant moins de 48 heures |
Traitement symptomatique par le paracétamol. |
|
6) Eruption cutanée, arthralgies ou arthrite ou syndrome de Reiter |
Arrêter le traitement par BCG‑MEDAC. Envisager une consultation chez un spécialiste des maladies infectieuses. Administrer un antihistaminique ou des anti-inflammatoires non stéroïdiens. Un traitement à base de cortisone doit être envisagé en cas de réaction d’origine immunitaire. En l’absence de réponse, administrer de l’isoniazide* pendant 3 mois. En cas de traitement antituberculeux, le traitement par BCG‑MEDAC doit être définitivement interrompu. |
|
7) Infection/réaction systémique au BCG** sans signes de choc septique |
Interrompre définitivement le traitement par BCG‑MEDAC. Envisager une consultation chez un spécialiste des maladies infectieuses. Administrer une trithérapie antituberculeuse* pendant 6 mois ainsi que des corticoïdes à faible dose. |
|
8) Infection/réaction systémique au BCG avec signes de choc septique |
Interrompre définitivement le traitement par BCG‑MEDAC. Administrer immédiatement une trithérapie antituberculeuse* associée à des corticoïdes d’action rapide à dose élevée. Demander l’avis d’un spécialiste des maladies infectieuses. |
* Attention: les bactéries BCG sont sensibles à tous les médicaments antituberculeux actuellement utilisés sauf le pyrazinamide. Si une trithérapie antituberculeuse est nécessaire, l’association normalement recommandée est l’isoniazide (INH), la rifampicine et l’éthambutol.
** voir la définition ci-dessus
Informations importantes concernant l’utilisation de BCG‑MEDAC
BCG‑MEDAC ne doit être utilisé que par des professionnels de santé expérimentés.
S’assurer que les conditions de conservation sont adaptées (voir rubrique 5) et vérifier l’intégrité du conditionnement.
BCG‑MEDAC doit être administré dans les conditions requises pour l’endoscopie intravésicale.
BCG‑MEDAC ne doit pas être administré par voie sous‑cutanée, intradermique, intramusculaire, intraveineuse ni pour la vaccination contre la tuberculose.
Le connecteur pour cathéter Luer‑Lock de la poche de solvant ne doit être utilisé que dans le cadre d’une instillation intravésicale !
Principes de base et mesures de protection pour l’utilisation de BCG‑MEDAC
En général, il convient d’éviter tout contact direct avec BCG‑MEDAC. BCG-MEDAC est un médicament qui peut entraîner une infection chez l’être humain et présenter un risque pour les professionnels de santé. Un danger peut exister si le médicament pénètre dans l’organisme via une peau lésée, si des aérosols sont inhalés, si des gouttelettes pénètrent dans les yeux ou entrent en contact avec les muqueuses, ou s’il est ingéré. Ne pas manger, boire ou fumer dans les zones de travail et ne pas conserver de nourriture, de boissons ou de produits contenant du tabac dans ces zones. BCG‑MEDAC ne doit pas être manipulé dans une pièce où des médicaments cytotoxiques sont préparés pour une utilisation par voie intraveineuse ni être manipulé par le personnel qui prépare des médicaments cytotoxiques destinés à une utilisation par voie intraveineuse.
Le médicament ne doit pas être manipulé par des personnes présentant une immunodéficience connue.
Durant la manipulation, il est recommandé de porter un équipement de protection individuelle constitué d’une blouse de protection fermée résistante aux éclaboussures, de gants jetables, d’un masque de protection respiratoire FFP2 et de lunettes de protection avec écrans latéraux. BCG‑MEDAC ne doit être transporté que dans des contenants fermés (pour connaître les conditions de conservation après reconstitution, voir rubrique 5).
Une fois le travail terminé, essuyer les surfaces de travail avec une solution désinfectante adaptée. Après le travail et en cas de contact avec la peau, se désinfecter les mains à l’aide d’un désinfectant pour les mains, les laisser sécher, les laver et utiliser des produits de soin pour la peau.
Tests à la tuberculine intradermiques
Le traitement intravésical par BCG‑MEDAC peut induire une sensibilité à la tuberculine et compliquer l’interprétation ultérieure des tests à la tuberculine intradermiques réalisés pour diagnostiquer une infection mycobactérienne. Dans ce cas, la réactivité du patient à la tuberculine devrait être réalisée avant l’administration de BCG‑MEDAC.
Préparation de la suspension intravésicale reconstituée
Avant utilisation, le médicament doit être remis en suspension dans des conditions aseptiques à l’aide d’une solution de chlorure de sodium stérile à 0,9 % (9 mg/mL) (voir les instructions d’utilisation, étape 7). Le cathéter doit être mis en place avec une attention toute particulière pour éviter les lésions de l’épithélium urétral et vésical, qui pourraient entraîner une infection systémique par le BCG. Il est recommandé d’utiliser un lubrifiant pour limiter le risque de cathétérisme traumatique et pour que la procédure soit plus confortable. Il est possible que les femmes aient besoin de moins de lubrifiant que les hommes. Aucune influence sur l’efficacité du produit liée à l’éventuel effet antiseptique du lubrifiant n’a été observée. Vider la vessie après le cathétérisme pour réduire la quantité de lubrifiant potentiellement introduit avant d’administrer BCG‑MEDAC. La suspension est mélangée en la remuant délicatement avant utilisation. Les particules visibles au niveau macroscopique n’ont aucune influence sur l’efficacité et la sécurité du médicament.
Le contenu du flacon est destiné à une utilisation unique/une dose unique exclusivement. Toute solution restante doit être éliminée.
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
Comportement en cas d’urgence et de renversement de BCG‑MEDAC
Porter des vêtements de protection et limiter la propagation des particules.
Couvrir de cellulose la suspension de BCG‑MEDAC renversée et l’humidifier avec un désinfectant dont l’efficacité a été prouvée contre les mycobactéries. Après avoir essuyé la suspension de BCG‑MEDAC renversée, nettoyer à nouveau la surface avec une solution désinfectante et laisser sécher. En cas de renversement sur la peau, traiter à l’aide d’un désinfectant adapté.
Premiers secours
Toujours consulter un médecin en cas de contamination.
En cas de contact avec la peau : retirer les vêtements contaminés. Désinfecter et nettoyer la peau et vérifier si des plaies ont pu être contaminées.
En cas de contact avec les yeux : laver l’œil concerné avec une solution de lavage oculaire en quantité suffisante ou, à défaut, avec de l’eau. Retirer les lentilles de contact, le cas échéant.
En cas d’ingestion : rincer la bouche avec de l’eau en abondance.
En cas d’inhalation : s’assurer que l’apport d’air frais est suffisant.
Pour de plus amples informations sur le cathéter, veuillez consulter le mode d’emploi correspondant.
Instructions destinées aux utilisateurs de BCG‑MEDAC
Composants et application du système d’instillation |
Principaux composants du système d’instillation
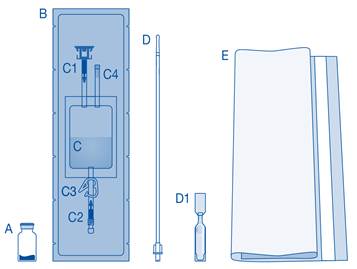
|
Principaux composants |
Description |
|
A |
Flacon de poudre |
|
B |
Enveloppe de protection |
|
C |
Poche de solvant contenant une solution de chlorure de sodium à 0,9 % (9 mg/mL) |
|
C1 |
Connecteur pour flacon avec capuchon de protection et système de scellement à briser |
|
C2 |
Connecteur pour cathéter Luer-Lock avec capuchon de protection et système de scellement à briser |
|
C3 |
Pince de pression |
|
C4 |
Port de remplissage sans fonction d’application |
|
D |
Cathéter Luer‑Lock |
|
D1 |
Lubrifiant |
|
E |
Sac à déchets de soins |
Connexion du flacon à la poche de solvant
1. Posez le sac à déchets de soins (E) pour qu’il soit prêt pour l’élimination directe du système après instillation afin d’éviter toute contamination.
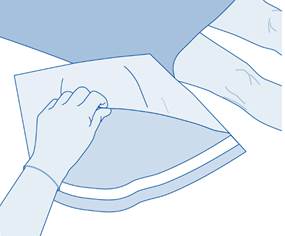
2. Retirez le capuchon amovible du flacon (A) et désinfectez le bouchon conformément aux réglementations locales.
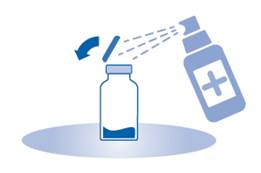
3. Déchirez l’enveloppe de protection (B) de la poche de solvant (C) et retirez complètement l’enveloppe de protection.
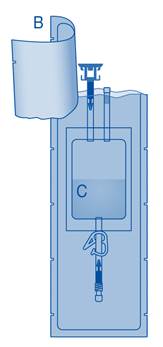
4. Retirez le capuchon de protection du connecteur pour flacon (C1).
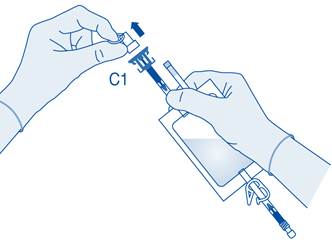
5. Poussez le connecteur sur le flacon jusqu’à la butée.
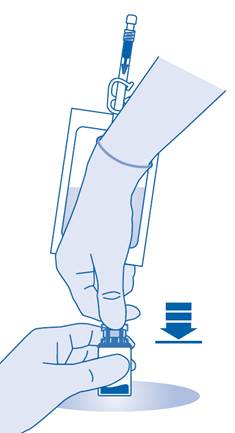
Mélange de la poudre avec le solvant
6. Pliez le sceau à briser dans le tube du connecteur pour flacon (C1) dans un sens puis dans l’autre plusieurs fois afin de briser le sceau.
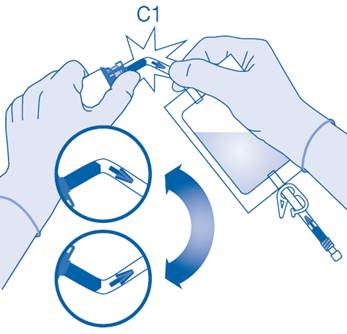
7. Maintenez la poche de solvant afin que le flacon se trouve en dessous.
Pressez plusieurs fois la poche de solvant pour transférer suffisamment de solvant dans le flacon.
Veillez à ne pas remplir complètement le flacon afin de permettre le transfert ultérieur de la suspension dans la poche de solvant. Il est possible qu’il reste un peu de solvant dans la poche.
Remuez lentement le flacon afin de limiter la formation excessive de mousse, tout en mélangeant le médicament au solvant. S’il y a beaucoup de mousse, laissez le flacon reposer brièvement (quelques minutes).
Le contenu du flacon doit former une suspension homogène, ce qui peut prendre quelques minutes.
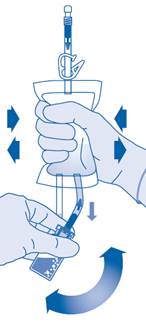
8. Retournez la poche de solvant et maintenez-la de sorte que le flacon se trouve au‑dessus.
Maintenez le flacon.
Pressez plusieurs fois la poche de solvant jusqu’à ce que le flacon soit complètement vide.
S’il reste de la poudre dans le flacon, répétez les étapes 7 et 8.
D’un point de vue microbiologique, le médicament doit être utilisé immédiatement. Si le médicament n’est pas utilisé immédiatement, consultez la rubrique 5 « Comment conserver BCG‑MEDAC ».
La suspension ne doit pas être instillée à la température du réfrigérateur afin d’éviter que le patient n’ait envie d’uriner, ce qui entraînerait une durée d’exposition raccourcie.
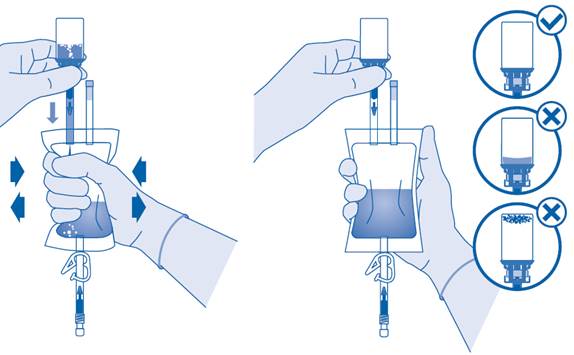
Cathétérisme
9. Cathétérisez le patient conformément aux réglementations locales et aux instructions d’utilisation à l’aide du cathéter Luer‑Lock (D) et du lubrifiant (D1) fournis ou d’un autre cathéter et/ou lubrifiant adaptés.
Videz la vessie à l’aide du cathéter.
Connexion du cathéter à la poche de solvant
10. Afin de mélanger les sédiments, renversez et faites tourner la poche avant de la connecter.
N’administrez pas la suspension à la température du réfrigérateur.
Retirez le capuchon de protection du connecteur pour cathéter (C2).
Connectez le cathéter Luer‑Lock du patient (D) au connecteur pour cathéter (C2) de la poche de solvant.
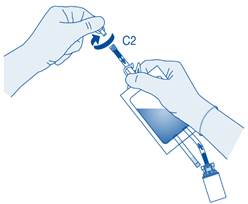
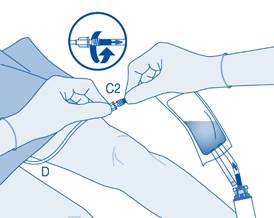
Instillation
11. Pliez le sceau à briser dans le tube du connecteur pour cathéter (C2) dans un sens puis dans l’autre plusieurs fois afin de briser le sceau.
Maintenez fermement le cathéter du patient lors de cette manipulation.
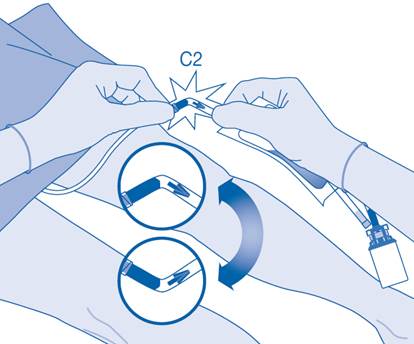
12. Maintenez la poche de solvant avec le flacon à l’envers au‑dessus de la poche.
Pressez délicatement la poche de solvant avec l’autre main afin que le médicament soit instillé lentement dans la vessie du patient.
Continuez de la presser jusqu’à ce que la poche de solvant et le flacon soient vides.
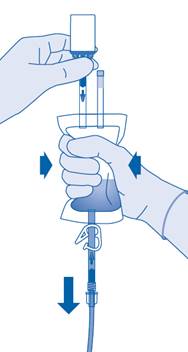
13. Expulsez l’air restant de la poche de solvant pour vider au maximum le cathéter.
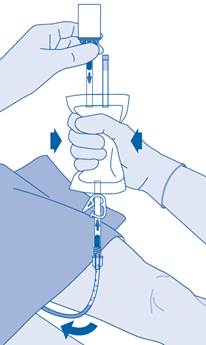
Après l’instillation
14. La fermeture de la pince de pression (C3) permet d’éviter un reflux du liquide dans le cathéter et réduit le risque de contamination. Autrement, vous pouvez garder la poche de solvant compressée tout en effectuant les étapes 15 et 16.
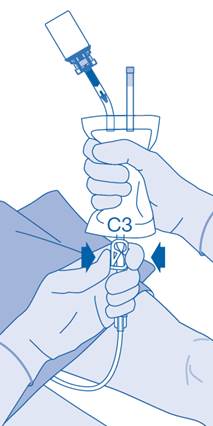
15. Avec précaution, retirez le cathéter de la vessie sans déconnecter la poche de solvant du cathéter. Évitez toute contamination provenant de gouttelettes d’éclaboussure.
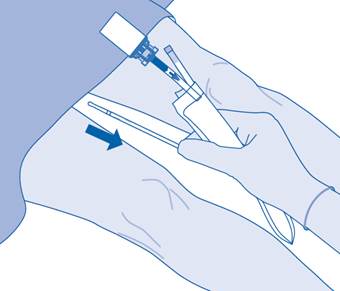
16. Éliminez le produit conformément aux réglementations nationales à l’aide du sac à déchets de soins.
Le contenu du flacon est destiné à une utilisation unique/une dose unique exclusivement. Toute suspension restante doit être éliminée.
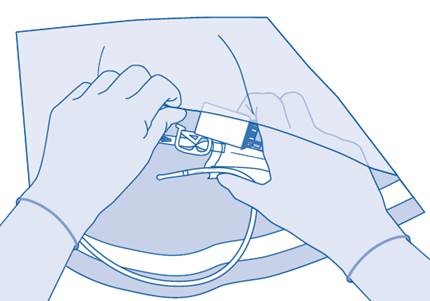
Instructions destinées aux utilisateurs de BCG‑MEDAC
Composants et application du système d’instillation
Principaux composants du système d’instillation
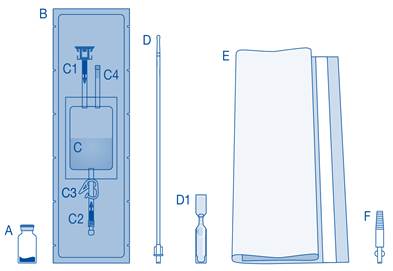
|
Principaux composants |
Description |
|
A |
Flacon de poudre |
|
B |
Enveloppe de protection |
|
C |
Poche de solvant contenant une solution de chlorure de sodium à 0,9 % (9 mg/mL) |
|
C1 |
Connecteur pour flacon avec capuchon de protection et système de scellement à briser |
|
C2 |
Connecteur pour cathéter Luer-Lock avec capuchon de protection et système de scellement à briser |
|
C3 |
Pince de pression |
|
C4 |
Port de remplissage sans fonction d’application |
|
D |
Cathéter Luer‑Lock |
|
D1 |
Lubrifiant |
|
E |
Sac à déchets de soins |
|
F |
Adaptateur Luer‑Lock pour embout conique |
Connexion du flacon à la poche de solvant
1. Posez le sac à déchets de soins (E) pour qu’il soit prêt pour l’élimination directe du système après instillation afin d’éviter toute contamination.

2. Retirez le capuchon amovible du flacon (A) et désinfectez le bouchon conformément aux réglementations locales.

3. Déchirez l’enveloppe de protection (B) de la poche de solvant (C) et retirez complètement l’enveloppe de protection.
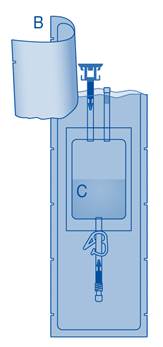
4. Retirez le capuchon de protection du connecteur pour flacon (C1).

5. Poussez le connecteur sur le flacon jusqu’à la butée.

Mélange de la poudre avec le solvant
6. Pliez le sceau à briser dans le tube du connecteur pour flacon (C1) dans un sens puis dans l’autre plusieurs fois afin de briser le sceau.
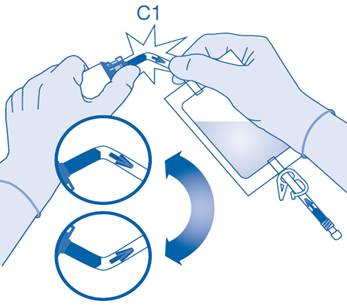
7. Maintenez la poche de solvant afin que le flacon se trouve en dessous.
Pressez plusieurs fois la poche de solvant pour transférer suffisamment de solvant dans le flacon.
Veillez à ne pas remplir complètement le flacon afin de permettre le transfert ultérieur de la suspension dans la poche de solvant. Il est possible qu’il reste un peu de solvant dans la poche.
Remuez lentement le flacon afin de limiter la formation excessive de mousse, tout en mélangeant le médicament au solvant. S’il y a beaucoup de mousse, laissez le flacon reposer brièvement (quelques minutes).
Le contenu du flacon doit former une suspension homogène, ce qui peut prendre quelques minutes.

8. Retournez la poche de solvant et maintenez-la de sorte que le flacon se trouve au‑dessus.
Maintenez le flacon.
Pressez plusieurs fois la poche de solvant jusqu’à ce que le flacon soit complètement vide.
S’il reste de la poudre dans le flacon, répétez les étapes 7 et 8.
D’un point de vue microbiologique, le médicament doit être utilisé immédiatement.
Si le médicament n’est pas utilisé immédiatement, consultez la rubrique 5 « Comment conserver BCG‑MEDAC ».
La suspension ne doit pas être instillée à la température du réfrigérateur afin d’éviter que le patient n’ait envie d’uriner, ce qui entraînerait une durée d’exposition raccourcie.

Cathétérisme
9. Cathétérisez le patient conformément aux réglementations locales et aux instructions d’utilisation à l’aide du cathéter Luer‑Lock (D) et du lubrifiant (D1) fournis ou d’un autre cathéter et/ou lubrifiant adaptés.
Videz la vessie à l’aide du cathéter.
Remarque concernant l’utilisation avec un cathéter auto-sélectionné avec embout conique :
L’adaptateur Luer‑Lock pour embout conique fourni (F) doit être utilisé pour connecter la poche au cathéter auto-sélectionné (non illustré).
Pour cela, les étapes supplémentaires suivantes doivent être effectuées :
· Retirez le capuchon de protection du connecteur pour cathéter (C2, voir étape 10).
· Renversez et faites tourner la poche avant de la connecter afin de remélanger les sédiments.
· Connectez l’adaptateur Luer‑Lock pour embout conique (F) au connecteur pour cathéter (C2) de la poche.
· Connectez soigneusement la poche avec l’adaptateur (F) au cathéter du patient.
· Passez ensuite à l’étape 11.
Connexion du cathéter à la poche de solvant
10. Afin de mélanger les sédiments, renversez et faites tourner la poche avant de la connecter.
N’administrez pas la suspension à la température du réfrigérateur.
Retirez le capuchon de protection du connecteur pour cathéter (C2).
Connectez le cathéter Luer‑Lock du patient (D) au connecteur pour cathéter (C2) de la poche de solvant.
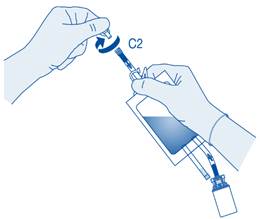

Instillation
11. Pliez le sceau à briser dans le tube du connecteur pour cathéter (C2) dans un sens puis dans l’autre plusieurs fois afin de briser le sceau.
Maintenez fermement le cathéter du patient lors de cette manipulation.
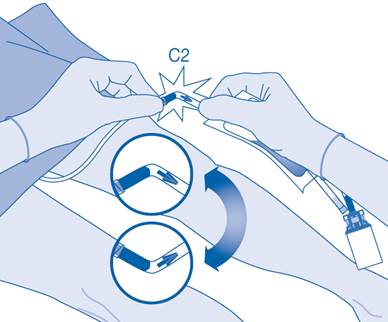
12. Maintenez la poche de solvant avec le flacon à l’envers au‑dessus de la poche.
Pressez délicatement la poche de solvant avec l’autre main afin que le médicament soit instillé lentement dans la vessie du patient.
Continuez de la presser jusqu’à ce que la poche de solvant et le flacon soient vides.

13. Expulsez l’air restant de la poche de solvant pour vider au maximum le cathéter.
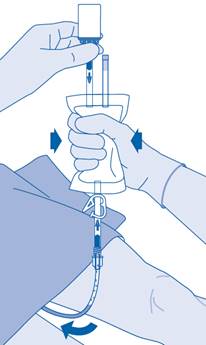
Après l’instillation
14. La fermeture de la pince de pression (C3) permet d’éviter un reflux du liquide dans le cathéter et réduit le risque de contamination. Autrement, vous pouvez garder la poche de solvant compressée tout en effectuant les étapes 15 et 16.
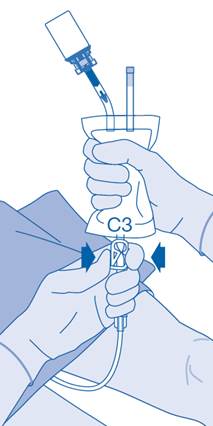
15. Avec précaution, retirez le cathéter de la vessie sans déconnecter la poche de solvant du cathéter. Évitez toute contamination provenant de gouttelettes d’éclaboussure.
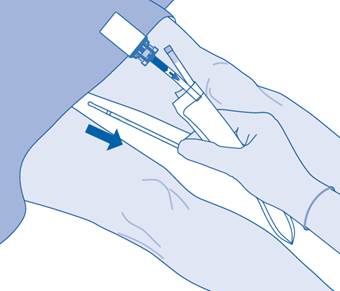
16. Éliminez le produit conformément aux réglementations nationales à l’aide du sac à déchets de soins.
Le contenu du flacon est destiné à une utilisation unique/une dose unique exclusivement. Toute suspension restante doit être éliminée.
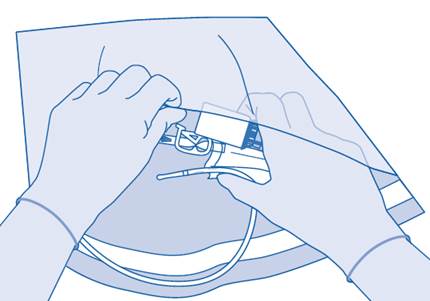
Instructions destinées aux utilisateurs de BCG‑MEDAC
Composants et application du système d’instillation
Principaux composants du système d’instillation
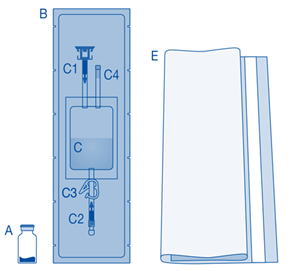
|
Principaux composants |
Description |
|
A |
Flacon de poudre |
|
B |
Enveloppe de protection |
|
C |
Poche de solvant contenant une solution de chlorure de sodium à 0,9 % (9 mg/mL) |
|
C1 |
Connecteur pour flacon avec capuchon de protection et système de scellement à briser |
|
C2 |
Connecteur pour cathéter Luer-Lock avec capuchon de protection et système de scellement à briser |
|
C3 |
Pince de pression |
|
C4 |
Port de remplissage sans fonction d’application |
|
E |
Sac à déchets de soins |
Connexion du flacon à la poche de solvant
1. Posez le sac à déchets de soins (E) pour qu’il soit prêt pour l’élimination directe du système après instillation afin d’éviter toute contamination.
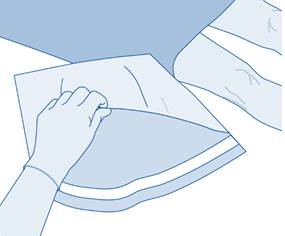
2. Retirez le capuchon amovible du flacon (A) et désinfectez le bouchon conformément aux réglementations locales.
3. Déchirez l’enveloppe de protection (B) de la poche de solvant (C) et retirez complètement l’enveloppe de protection.
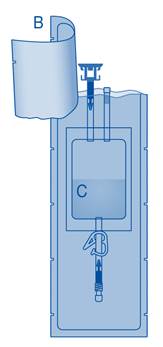
4. Retirez le capuchon de protection du connecteur pour flacon (C1).
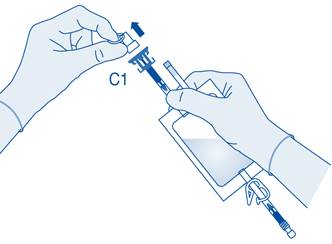
5. Poussez le connecteur sur le flacon jusqu’à la butée.
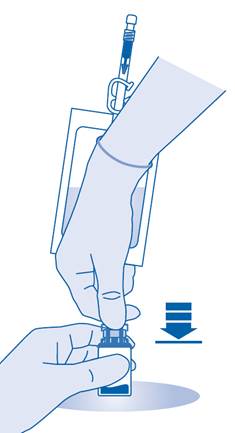
Mélange de la poudre avec le solvant
6. Pliez le sceau à briser dans le tube du connecteur pour flacon (C1) dans un sens puis dans l’autre plusieurs fois afin de briser le sceau.
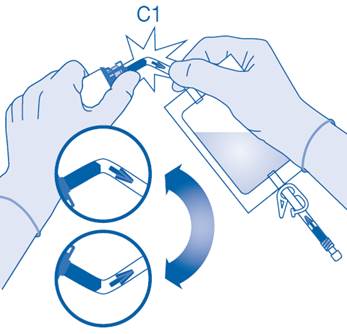
7. Maintenez la poche de solvant afin que le flacon se trouve en dessous.
Pressez plusieurs fois la poche de solvant pour transférer suffisamment de solvant dans le flacon.
Veillez à ne pas remplir complètement le flacon afin de permettre le transfert ultérieur de la suspension dans la poche de solvant. Il est possible qu’il reste un peu de solvant dans la poche.
Remuez lentement le flacon afin de limiter la formation excessive de mousse, tout en mélangeant le médicament au solvant. S’il y a beaucoup de mousse, laissez le flacon reposer brièvement (quelques minutes).
Le contenu du flacon doit former une suspension homogène, ce qui peut prendre quelques minutes.
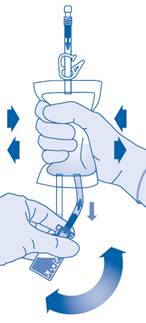
8. Retournez la poche de solvant et maintenez-la de sorte que le flacon se trouve au‑dessus.
Maintenez le flacon.
Pressez plusieurs fois la poche de solvant jusqu’à ce que le flacon soit complètement vide.
S’il reste de la poudre dans le flacon, répétez les étapes 7 et 8.
D’un point de vue microbiologique, le médicament doit être utilisé immédiatement.
Si le médicament n’est pas utilisé immédiatement, consultez la rubrique 5 « Comment conserver BCG‑MEDAC ».
La suspension ne doit pas être instillée à la température du réfrigérateur afin d’éviter que le patient n’ait envie d’uriner, ce qui entraînerait une durée d’exposition raccourcie.
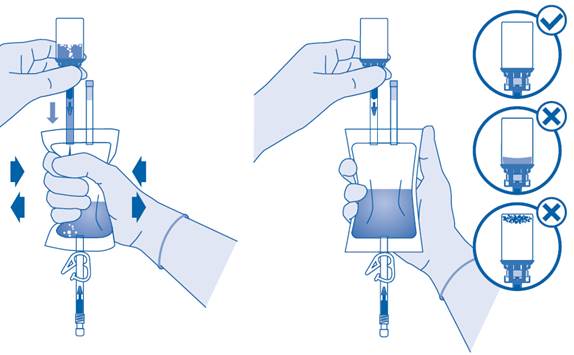
Cathétérisme
9. Cathétérisez le patient conformément aux réglementations locales et aux instructions d’utilisation à l’aide d’un cathéter et d’un lubrifiant adaptés.
Videz la vessie à l’aide du cathéter.
Connexion du cathéter à la poche de solvant
10. Afin de mélanger les sédiments, renversez et faites tourner la poche avant de la connecter.
N’administrez pas la suspension à la température du réfrigérateur.
Retirez le capuchon de protection du connecteur pour cathéter (C2).
Connectez le cathéter du patient au connecteur pour cathéter (C2) de la poche de solvant.
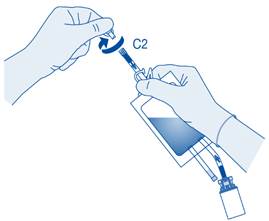
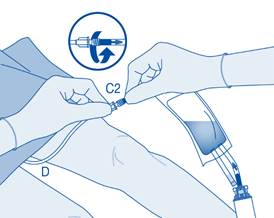
Instillation
11. Pliez le sceau à briser dans le tube du connecteur pour cathéter (C2) dans un sens puis dans l’autre plusieurs fois afin de briser le sceau.
Maintenez fermement le cathéter du patient lors de cette manipulation.
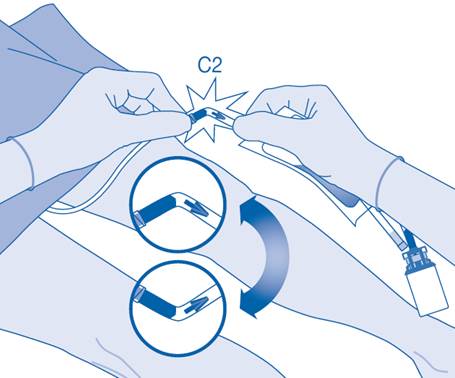
12. Maintenez la poche de solvant avec le flacon à l’envers au‑dessus de la poche.
Pressez délicatement la poche de solvant avec l’autre main afin que le médicament soit instillé lentement dans la vessie du patient.
Continuez de la presser jusqu’à ce que la poche de solvant et le flacon soient vides.
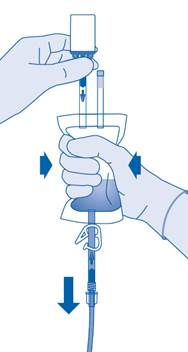
13. Expulsez l’air restant de la poche de solvant pour vider au maximum le cathéter.

Après l’instillation
14. La fermeture de la pince de pression (C3) permet d’éviter un reflux du liquide dans le cathéter et réduit le risque de contamination. Autrement, vous pouvez garder la poche de solvant compressée tout en effectuant les étapes 15 et 16.

15. Avec précaution, retirez le cathéter de la vessie sans déconnecter la poche de solvant du cathéter. Évitez toute contamination provenant de gouttelettes d’éclaboussure.

16. Éliminez le produit conformément aux réglementations nationales à l’aide du sac à déchets de soins.
Le contenu du flacon est destiné à une utilisation unique/une dose unique exclusivement. Toute suspension restante doit être éliminée.
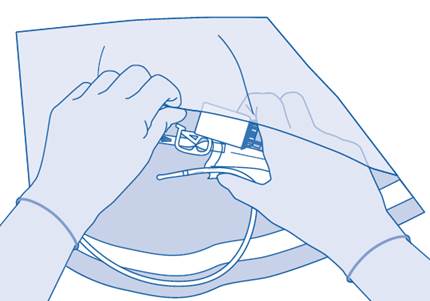
Instructions destinées aux utilisateurs de BCG‑MEDAC
Composants et application du système d’instillation
Principaux composants du système d’instillation
|
Principaux composants |
Description |
|
A |
Flacon de poudre |
|
B |
Enveloppe de protection |
|
C |
Poche de solvant contenant une solution de chlorure de sodium à 0,9 % (9 mg/mL) |
|
C1 |
Connecteur pour flacon avec capuchon de protection et système de scellement à briser |
|
C2 |
Connecteur pour cathéter Luer-Lock avec capuchon de protection et système de scellement à briser |
|
C3 |
Pince de pression |
|
C4 |
Port de remplissage sans fonction d’application |
|
E |
Sac à déchets de soins |
|
F |
Adaptateur Luer‑Lock pour embout conique |
Connexion du flacon à la poche de solvant
1. Posez le sac à déchets de soins (E) pour qu’il soit prêt pour l’élimination directe du système après instillation afin d’éviter toute contamination.
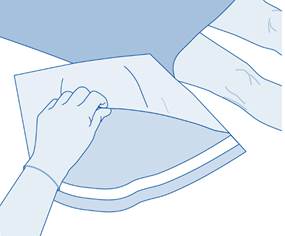
2. Retirez le capuchon amovible du flacon (A) et désinfectez le bouchon conformément aux réglementations locales.

3. Déchirez l’enveloppe de protection (B) de la poche de solvant (C) et retirez complètement l’enveloppe de protection.

4. Retirez le capuchon de protection du connecteur pour flacon (C1).

5. Poussez le connecteur sur le flacon jusqu’à la butée.

Mélange de la poudre avec le solvant
6. Pliez le sceau à briser dans le tube du connecteur pour flacon (C1) dans un sens puis dans l’autre plusieurs fois afin de briser le sceau.
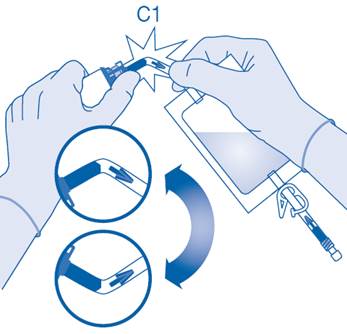
7. Maintenez la poche de solvant afin que le flacon se trouve en dessous.
Pressez plusieurs fois la poche de solvant pour transférer suffisamment de solvant dans le flacon.
Veillez à ne pas remplir complètement le flacon afin de permettre le transfert ultérieur de la suspension dans la poche de solvant. Il est possible qu’il reste un peu de solvant dans la poche.
Remuez lentement le flacon afin de limiter la formation excessive de mousse, tout en mélangeant le médicament au solvant. S’il y a beaucoup de mousse, laissez le flacon reposer brièvement (quelques minutes).
Le contenu du flacon doit former une suspension homogène, ce qui peut prendre quelques minutes.

8. Retournez la poche de solvant et maintenez-la de sorte que le flacon se trouve au‑dessus.
Maintenez le flacon.
Pressez plusieurs fois la poche de solvant jusqu’à ce que le flacon soit complètement vide.
S’il reste de la poudre dans le flacon, répétez les étapes 7 et 8.
D’un point de vue microbiologique, le médicament doit être utilisé immédiatement.
Si le médicament n’est pas utilisé immédiatement, consultez la rubrique 5 « Comment conserver BCG‑MEDAC ».
La suspension ne doit pas être instillée à la température du réfrigérateur afin d’éviter que le patient n’ait envie d’uriner, ce qui entraînerait une durée d’exposition raccourcie.

Cathétérisme
9. Cathétérisez le patient conformément aux réglementations locales et aux instructions d’utilisation à l’aide d’un cathéter et d’un lubrifiant adaptés.
Videz la vessie à l’aide du cathéter.
Ce pack ne contient pas de cathéter. Utilisez le connecteur fourni (F) pour connecter la poche au cathéter du patient avec embout conique (non illustré).
Pour cela, les étapes supplémentaires suivantes doivent être effectuées :
· Retirez le capuchon de protection du connecteur pour cathéter (C2, voir étape 10).
· Connectez l’adaptateur (F) au connecteur pour cathéter (C2) de la poche.
· Connectez soigneusement la poche avec l’adaptateur (F) au cathéter du patient.
· Passez ensuite à l’étape 11.
Connexion du cathéter à la poche de solvant
10. Afin de mélanger les sédiments, renversez et faites tourner la poche avant de la connecter.
N’administrez pas la suspension à la température du réfrigérateur.
Retirez le capuchon de protection du connecteur pour cathéter (C2).
Connectez le cathéter du patient au connecteur pour cathéter (C2) de la poche de solvant.
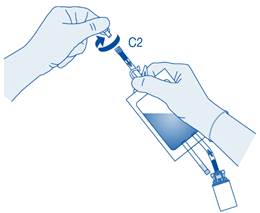

Instillation
11. Pliez le sceau à briser dans le tube du connecteur pour cathéter (C2) dans un sens puis dans l’autre plusieurs fois afin de briser le sceau.
Maintenez fermement le cathéter du patient lors de cette manipulation.
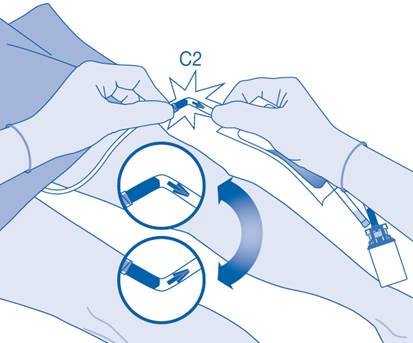
12. Maintenez la poche de solvant avec le flacon à l’envers au‑dessus de la poche.
Pressez délicatement la poche de solvant avec l’autre main afin que le médicament soit instillé lentement dans la vessie du patient.
Continuez de la presser jusqu’à ce que la poche de solvant et le flacon soient vides.

13. Expulsez l’air restant de la poche de solvant pour vider au maximum le cathéter.

Après l’instillation
14. La fermeture de la pince de pression (C3) permet d’éviter un reflux du liquide dans le cathéter et réduit le risque de contamination. Autrement, vous pouvez garder la poche de solvant compressée tout en effectuant les étapes 15 et 16.
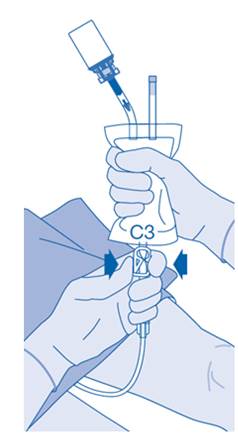
15. Avec précaution, retirez le cathéter de la vessie sans déconnecter la poche de solvant du cathéter. Évitez toute contamination provenant de gouttelettes d’éclaboussure.

16. Éliminez le produit conformément aux réglementations nationales à l’aide du sac à déchets de soins.
Le contenu du flacon est destiné à une utilisation unique/une dose unique exclusivement. Toute suspension restante doit être éliminée.
