Dernière mise à jour le 02/02/2026
BRICANYL TURBUHALER 500 microgrammes/dose, poudre pour inhalation
Indications thérapeutiques
Classe pharmacothérapeutique : AGONISTES SELECTIFS BETA 2 ADRENERGIQUES.
Code ATC : R03AC03
Ce médicament est un bêta 2 mimétique à action rapide et de courte durée (4 à 6 heures) qui s'administre par voie inhalée.
C'est un bronchodilatateur (il augmente le calibre des bronches).
Il est indiqué en cas de crise d'asthme ou de gêne respiratoire au cours de la maladie asthmatique ou de certaines maladies des bronches.
En fonction de la sévérité de votre maladie, votre médecin peut vous le prescrire seul ou en complément d'un traitement de fond continu par un ou plusieurs autres médicaments.
Il peut également vous être prescrit en traitement préventif de l'asthme déclenché par l'effort.
Présentations
> 1 récipient(s) multidose(s) polyéthylène de 60 mg (120 doses)
Code CIP : 34009 301 235 2 2
Déclaration de commercialisation : 07/03/2019
Cette présentation est agréée aux collectivités
- Prix hors honoraire de dispensation : 3,41 €
- Honoraire de dispensation : 1,02 €
- Prix honoraire compris : 4,43 €
- Taux de remboursement :65%
Service médical rendu (SMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprès de la HAS (plus d'informations dans l'aide). Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Important | Avis du 05/12/2018 | Inscription (CT) | Le service médical rendu par BRICANYL TURBUHALER 500 µg/dose, poudre pour inhalation, 60 mg, B/120 doses, est important dans les indications de l’AMM. |
| Important | Avis du 16/03/2016 | Renouvellement d'inscription (CT) | Le service médical rendu par BRICANYL TURBUHALER 500 µg/dose reste important dans : • le traitement symptomatique de la crise d’asthme. • le traitement symptomatique des exacerbations au cours de la maladie asthmatique ou de la bronchite chronique obstructive lorsqu’’il existe une composante réversible. • la prévention de l’asthme d’effort. • le test de réversibilité de l’obstruction bronchique lors des explorations fonctionnelles respiratoires. Le service médical rendu par BRICANYL 5 mg/2 ml reste important dans : • le traitement symptomatique des asthmes aigus graves. • le traitement des poussées aiguës des broncho-pneumopathies chroniques obstructives de l’adulte. Le service médical rendu par BRICANYL 0,5 mg/1 ml, solution injectable en ampoule, reste important dans : • le traitement symptomatique de l’asthme aigu grave de l’adulte et de l’enfant de plus de 2 ans par voie S.C. • le traitement de l’asthme aigu grave de l’adulte (état de mal asthmatique). |
| Insuffisant | Avis du 16/03/2016 | Renouvellement d'inscription (CT) | Le service médical rendu par BRICANYL 0,5 mg/1 ml, solution injectable en ampoule, reste insuffisant dans le traitement à court terme du travail prématuré sans complication. |
| Modéré | Avis du 16/03/2016 | Renouvellement d'inscription (CT) | Le service médical rendu par BRICANYL LP 5 mg, comprimé à libération prolongée, reste modéré. |
Amélioration du service médical rendu (ASMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprés de la HAS (plus d'informations dans l'aide). Les avis et synthéses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur de l'ASMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| V (Inexistant) | Avis du 05/12/2018 | Inscription (CT) | Cette spécialité est un complément de gamme qui n’apporte pas d’amélioration du service médical rendu (ASMR V) par rapport à la présentation existante. |
| V (Inexistant) | Avis du 23/05/2012 | Inscription (CT) | Absence d'amélioration du service médical rendu (ASMR V). |
ANSM - Mis à jour le : 13/11/2023
BRICANYL TURBUHALER 500 microgrammes/dose, poudre pour inhalation
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Chaque dose délivrée comprend :
Terbutaline sulfate 0,4 mg (ce qui correspond à une dose mesurée de 0,5 mg).
Excipient(s) à effet notoire :
Chaque dose délivrée contient environ 0,4 mg de lactose monohydraté.
Pour la liste complète des excipients, voir rubrique 6.1.
4.1. Indications thérapeutiques
· Traitement symptomatique de la crise d'asthme.
· Traitement symptomatique des exacerbations au cours de la maladie asthmatique ou de la bronchite chronique obstructive lorsqu'il existe une composante réversible.
· Prévention de l'asthme d'effort.
· Test de réversibilité de l'obstruction bronchique lors des explorations fonctionnelles respiratoires.
Remarque
Cette spécialité est particulièrement adaptée aux sujets chez qui il a été mis en évidence une mauvaise synchronisation main/poumon nécessaire pour une utilisation correcte des aérosols doseurs classiques sans chambre d'inhalation.
4.2. Posologie et mode d'administration
· Traitement de la crise d'asthme et des exacerbations : dès les premiers symptômes, inhaler 1 dose.
Cette dose est généralement suffisante. En cas de persistance des symptômes, elle peut être renouvelée quelques minutes plus tard.
· Prévention de l'asthme d’effort : inhalation de 1 dose, 15 à 30 minutes avant l'exercice.
La dose quotidienne ne dépassera habituellement pas 8 inhalations par 24 heures (voir rubrique 4.4).
Mode d’administration
Voie inhalée.
Inhalation par distributeur avec embout buccal.
Il est souhaitable que le médecin s'assure que le patient utilise correctement le dispositif.
Le fonctionnement du dispositif est lié à l’inspiration : la poudre contenue dans le récipient est délivrée dans les voies aériennes lorsque le patient inspire au travers de l'embout buccal.
Il doit être recommandé au patient :
· de lire attentivement le mode d'emploi dans la notice d'information jointe à chaque inhalateur,
· d'inspirer à fond au travers de l'embout buccal pour assurer la diffusion optimale de la poudre dans les voies aériennes,
· de ne jamais souffler dans le Turbuhaler.
Il convient d'informer le patient que l'administration ou le goût du médicament ne sont le plus souvent pas perçus, la quantité de produit délivrée au cours de chaque inhalation étant très faible.
4.4. Mises en garde spéciales et précautions d'emploi
Informer le patient qu'une consultation médicale immédiate est nécessaire si, en cas de crise d'asthme, le soulagement habituellement obtenu n'est pas rapidement observé.
Si un patient développe en quelques jours une augmentation rapide de sa consommation en bronchodilatateurs bêta2 mimétiques d'action rapide et de courte durée par voie inhalée, on doit craindre (surtout si les valeurs du débit-mètre de pointe s'abaissent et/ou deviennent irrégulières) une décompensation de sa maladie et la possibilité d'une évolution vers un état de mal asthmatique.
Le médecin devra donc prévenir le patient de la nécessité dans ce cas, d'une consultation immédiate, sans avoir au préalable, dépassé les doses maximales prescrites. La conduite thérapeutique devra alors être réévaluée.
Chez les patients asthmatiques adultes, l'association à un traitement anti-inflammatoire continu doit être envisagée dès qu'il est nécessaire de recourir plus de 1 fois par semaine aux bêta2 mimétiques par voie inhalée.
Les patients doivent être informés qu’ils doivent poursuivre le traitement de fond anti-inflammatoire qui leur a été est prescrit même si les symptômes et leur utilisation BRICANYL TURBUHALER diminuent.
Une diminution de la réponse habituellement obtenue sur les symptômes avec le traitement est le signe d’une aggravation de l’asthme qui nécessite une consultation médicale afin de réévaluer le traitement de l’asthme.
L'utilisation excessive de bêta-agonistes de courte durée d'action peut masquer la progression de la maladie sous-jacente et contribuer à la détérioration du contrôle de l'asthme, entraînant un risque accru d'exacerbations sévères d’asthme et de mortalité.
En cas d’utilisation de terbutaline en traitement de secours « à la demande » plus de deux fois par semaine, le traitement de fond doit être réévalué et ajusté en raison du risque d’utilisation excessive de terbutaline.
L'attention des sportifs sera attirée sur le fait que cette spécialité contient un principe actif pouvant induire une réaction positive des tests pratiqués lors des contrôles antidopage.
Des effets cardiovasculaires peuvent être observés avec les médicaments sympathomimétiques, y compris la terbutaline. Les cas issus de la littérature et de l’expérience acquise depuis la commercialisation ont mis en évidence la survenue de rares cas d’ischémie myocardique en lien avec l’utilisation des bêta2-mimétiques. Les patients traités par BRICANYL TURBUHALER et présentant des pathologies cardiaques sévères (cardiopathie ischémique, arythmie ou insuffisance cardiaque sévère) doivent être informés qu’ils doivent consulter le médecin s’ils ressentent une douleur thoracique ou tout autre symptôme témoignant d’une aggravation de leur pathologie cardiaque. Une attention particulière doit être apportée aux symptômes tels qu’une dyspnée ou une douleur thoracique car ceux-ci peuvent être d’origine respiratoire ou cardiaque.
Précautions particulières d'emploi
En cas d'infection bronchique ou de bronchorrhée abondante, un traitement approprié est nécessaire afin de favoriser la diffusion optimale du produit dans les voies respiratoires.
La terbutaline administrée par voie inhalée avec ce dispositif peut être, aux doses usuelles, normalement utilisée chez les malades atteints d'hyperthyroïdie, de troubles coronariens, de cardiomyopathie obstructive, de troubles du rythme ventriculaire, d'hypertension artérielle, de diabète sucré, contrairement à la terbutaline administrée par voie orale ou injectable qui ne doit être prescrite qu'avec prudence dans ces situations.
Les bêta-bloquants (y compris ceux sous forme de collyres) peuvent inhiber partiellement ou totalement l'effet des bêta2stimulants.
A chaque inhalation, une fraction de la dose délivrée se dépose dans la cavité buccale. Il convient de recommander au patient, dans la mesure du possible, de se rincer la bouche après chaque utilisation afin de minimiser une exposition à la terbutaline.
BRICANYL TURBUHALER contient du lactose monohydraté (<1 mg/inhalation). Cette quantité n’entraine généralement pas de problèmes chez les personnes présentant une intolérance au lactose. Le lactose peut contenir de faibles quantités de protéines de lait. Chez les patients présentant une hypersensibilité aux protéines de lait, ces petites quantités peuvent provoquer des réactions allergiques.
Les patients présentant des problèmes héréditaires rares d’intolérance au galactose, de déficit en lactase de Lapp ou de malabsorption du glucose-galactose ne devraient pas prendre ce médicament.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
+ Halothane
En cas d'intervention obstétricale, majoration de l'inertie utérine avec risque hémorragique ; par ailleurs, risque de survenue de troubles du rythme ventriculaire graves, par augmentation de la réactivité cardiaque.
Interrompre le traitement par bêta-2 mimétiques si l'anesthésie doit se faire sous halothane.
Associations faisant l'objet de précautions d’emploi
+ Antidiabétiques
Elévation de la glycémie par effet bêta-stimulant.
Renforcer la surveillance sanguine et urinaire. Passer éventuellement à l'insuline.
+ Agents entrainant une déplétion potassique
En raison de l'effet hypokaliémiant des bêta2‑mimétiques, l'administration concomitante d’agents entraînant une déplétion potassique connus pour aggraver le risque d'hypokaliémie, comme les diurétiques, la digoxine, les méthyl‑xanthines et les corticostéroïdes doit être effectuée avec prudence après une évaluation minutieuse des bénéfices et des risques avec une attention particulière pour l'augmentation du risque d'arythmies cardiaques résultant d'une hypokaliémie (voir rubrique 4.4). L’hypokaliémie prédispose également à la toxicité de la digoxine.
4.6. Fertilité, grossesse et allaitement
Grossesse
En clinique, il existe un recul important, avec un nombre suffisant de grossesses documentées, pour que l'on puisse conclure à l'innocuité de la terbutaline pendant la grossesse.
En conséquence, la terbutaline, par voie inhalée peut être administrée en cas de grossesse.
Lors de l'administration pendant la grossesse :
L'accélération du rythme cardiaque fœtal peut être observée parallèlement à la tachycardie maternelle. Il est exceptionnel de la voir persister à la naissance.
De même, les valeurs de la glycémie post-natale ne sont qu'exceptionnellement perturbées.
En cas d'administration avant accouchement tenir compte de l'effet vasodilatateur périphérique des bêta2 mimétiques et de l'inertie utérine.
Les bêta2 mimétiques passent dans le lait maternel.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
BRICANYL TURBUHALER poudre pour inhalation contient du lactose. L’excipient, le lactose, peut contenir de faibles quantités de protéines de lait. Chez les patients présentant une hypersensibilité aux protéines de lait, ces petites quantités peuvent provoquer des réactions allergiques.
La gravité des effets indésirables dépend du dosage et de la voie d’administration. Administrée en inhalation, les effets systémiques de la terbutaline sont faibles aux doses recommandées. La plupart de ces effets sont ceux des béta2mimétiques.
|
Fréquence |
Classe de Système d’Organe |
Effets indésirables |
|
Très fréquents (> 1/10) |
Affections du système nerveux |
Céphalées Tremblements des extrémités |
|
Fréquents (< 1/1000 et > 1/100) |
Affections cardiaques |
Tachycardie Palpitations |
|
Affections musculo- squelettiques et systémiques |
Crampes musculaires |
|
|
Troubles du métabolisme et de la nutrition |
Hypokaliémie. |
|
|
Indéterminée* |
Affections cardiaques |
Troubles du rythme cardiaque, en particulier fibrillation auriculaire, tachycardie supraventriculaire et extrasystoles auriculaires ou ventriculaires, ischémie myocardique |
|
Affections gastro-intestinales |
Nausées |
|
|
Affections psychiatriques |
Troubles du sommeil et troubles du comportement : agitation, nervosité, hyperactivité |
|
|
Affections respiratoires, thoraciques et médiastinales |
Irritation de la gorge avec toux, enrouement, bronchospasme** |
|
|
Affections de la peau et tissu sous-cutané |
Éruption cutanée érythémateuse, urticaire, exanthème |
* Notifications spontanées depuis la commercialisation ; la fréquence est donc considérée comme indéterminée.
** Comme avec d’autres produits inhalés, possibilité de survenue de toux et rarement de bronchospasme paradoxal à la suite de l’inhalation du produit. Chez les malades sensibles à l’inhalation d’une poudre sèche, il peut occasionnellement apparaître une irritation de la gorge avec toux et enrouement, ceci peut être prévenu en se rinçant la bouche.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/.
La répétition abusive des inhalations peut favoriser l'apparition des effets indésirables.
En cas de surdosage sont majorés le risque de tachycardie et arythmie cardiaque, modifications tensionnelles, tremblements, sueurs, agitation, nausées.
L'emploi de ce médicament à des doses très supérieures aux doses recommandées est le reflet d'une aggravation de l'affection respiratoire nécessitant une consultation rapide pour réévaluation thérapeutique.
Il existe un risque d'accumulation progressive de poudre sèche dans l’embout de BRICANYL TURBUHALER. En fin d’utilisation de l’inhalateur, cette accumulation de poudre pourrait être inhalée en cas de chute de l’inhalateur (par exemple, chute d’une table).
Afin de minimiser une inutile exposition systémique à la terbutaline, les patients doivent être informés de se rincer la bouche, si possible, après chaque utilisation.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Classe pharmacothérapeutique : AGONISTES SELECTIFS BETA 2 ADRENERGIQUES, code ATC : R03AC03.
Bronchodilatateur bêta2 mimétique à action rapide et de courte durée par voie inhalée.
La terbutaline est un agoniste des récepteurs bêta adrénergiques présentant une action beaucoup plus sélective sur les récepteurs bêta2 en particulier bronchique.
Après inhalation, la terbutaline exerce une action stimulante sur les récepteurs bêta2 du muscle lisse bronchique assurant ainsi une bronchodilatation rapide, significative en quelques minutes, et persistant pendant 4 à 6 heures.
5.2. Propriétés pharmacocinétiques
5.3. Données de sécurité préclinique
Lactose monohydraté (qui peut contenir des résidus de protéines de lait)
3 ans
6.4. Précautions particulières de conservation
A conserver à température ambiante et à l'abri de l'humidité.
6.5. Nature et contenu de l'emballage extérieur
60 mg (120 doses) en récipient doseur (Polyéthylène) avec embout buccal.
L’inhalateur de couleur blanche est composé d’une molette bleue, d’un indicateur de dose et d’un couvercle blanc.
6.6. Précautions particulières d’élimination et de manipulation
Pas d'exigences particulières.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
TOUR CARPE DIEM
31 PLACE DES COROLLES
92400 COURBEVOIE
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 301 235 2 2 : 60 mg (120 doses) en récipient doseur (Polyéthylène) avec embout buccal.
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Liste I.
ANSM - Mis à jour le : 13/11/2023
BRICANYL TURBUHALER 500 microgrammes/dose, poudre pour inhalation
Sulfate de terbutaline
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin ou votre pharmacien.
· Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d’autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
1. Qu'est-ce que BRICANYL TURBUHALER 500 microgrammes/dose, poudre pour inhalation et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant d'utiliser BRICANYL TURBUHALER 500 microgrammes/dose, poudre pour inhalation ?
3. Comment utiliser BRICANYL TURBUHALER 500 microgrammes/dose, poudre pour inhalation ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver BRICANYL TURBUHALER 500 microgrammes/dose, poudre pour inhalation ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE BRICANYL TURBUHALER 500 microgrammes/dose, poudre pour inhalation ET DANS QUELS CAS EST-IL UTILISE ?
Classe pharmacothérapeutique : AGONISTES SELECTIFS BETA 2 ADRENERGIQUES.
Code ATC : R03AC03
Ce médicament est un bêta 2 mimétique à action rapide et de courte durée (4 à 6 heures) qui s'administre par voie inhalée.
C'est un bronchodilatateur (il augmente le calibre des bronches).
Il est indiqué en cas de crise d'asthme ou de gêne respiratoire au cours de la maladie asthmatique ou de certaines maladies des bronches.
En fonction de la sévérité de votre maladie, votre médecin peut vous le prescrire seul ou en complément d'un traitement de fond continu par un ou plusieurs autres médicaments.
Il peut également vous être prescrit en traitement préventif de l'asthme déclenché par l'effort.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D’UTILISER BRICANYL TURBUHALER 500 microgrammes/dose, poudre pour inhalation ?
N'utilisez jamais BRICANYL TURBUHALER 500 microgrammes/dose, poudre pour inhalation :
· Si vous êtes allergique à la terbutaline ou à l’un des autres composants contenus dans ce médicament, mentionnés dans la rubrique 6.
EN CAS DE DOUTE, IL EST INDISPENSABLE DE DEMANDER L’AVIS DE VOTRE MEDECIN.
Avertissements et précautions
Mises en garde
En cas de crise d'asthme ou de gêne respiratoire le soulagement habituellement obtenu doit être observé rapidement après administration de ce médicament. En cas d'échec, consulter immédiatement un médecin.
Si la dose habituellement efficace devient insuffisante, si les crises ou les épisodes de gêne respiratoire deviennent plus fréquents, il faut craindre une aggravation de la maladie, consultez rapidement votre médecin qui réévaluera votre traitement.
EN CAS DE DOUTE, NE PAS HESITER A DEMANDER L'AVIS DE VOTRE MEDECIN.
Précautions d'emploi
Ce produit, actif en inhalation doit atteindre l'extrémité des petites bronches. En cas d'encombrement des voies respiratoires (par des mucosités abondantes) ou d'infection, son efficacité peut être diminuée. Il convient de consulter rapidement votre médecin afin qu'il instaure un traitement adapté.
Autres médicaments et BRICANYL TURBUHALER 500 microgrammes/dose, poudre pour inhalation
Afin d'éviter d'éventuelles interactions entre plusieurs médicaments, informez votre médecin ou pharmacien si vous utilisez, avez récemment utilisé ou pourriez utiliser tout autre médicament, en particulier les antidiabétiques oraux.
Ce médicament dans les conditions normales d'utilisation, peut être utilisé pendant la grossesse.
Si vous êtes enceinte ou que vous allaitez, si vous pensez être enceinte ou si vous envisagez une grossesse, demandez conseil à votre médecin ou pharmacien avant de prendre ce médicament.
Demandez conseil à votre médecin ou à votre pharmacien avant de prendre tout médicament.
Sportifs
Sportifs, attention cette spécialité contient un principe actif pouvant induire une réaction positive des tests pratiqués lors des contrôles antidopage.
Conduite de véhicules et utilisation de machines
Sans objet.
BRICANYL TURBUHALER contient du lactose.
BRICANYL TURBUHALER contient du lactose, qui est un type de sucre. Si votre médecin vous a informé(e) d’une intolérance à certains sucres, contactez-le avant de prendre ce médicament. La quantité de lactose dans ce médicament ne cause généralement pas de problèmes chez les personnes qui sont intolérantes au lactose.
Le lactose contient de faibles quantités de protéines de lait. Chez les patients présentant une hypersensibilité aux protéines de lait, ces faibles quantités peuvent provoquer des réactions allergiques.
3. COMMENT UTILISER BRICANYL TURBUHALER 500 microgrammes/dose, poudre pour inhalation ?
En cas de crise d'asthme ou de gêne respiratoire : dès les premiers symptômes, inhaler 1 dose.
Cette dose peut éventuellement être répétée quelques minutes plus tard si nécessaire.
Si les troubles ne régressent pas rapidement, consultez immédiatement un médecin.
Prévention de l'asthme d’effort : inhaler 1 dose 15 à 30 minutes avant l'exercice.
La dose quotidienne ne doit habituellement pas dépasser 8 doses (voir Mises en garde).
Veillez à toujours utiliser ce médicament en suivant exactement les indications de votre médecin. Vérifiez auprès de votre médecin ou pharmacien en cas de doute.
DANS TOUS LES CAS SE CONFORMER STRICTEMENT A L'ORDONNANCE DE VOTRE MEDECIN.
EN CAS DE PERSISTANCE DES TROUBLES, CONSULTER IMPERATIVEMENT VOTRE MEDECIN.
BRICANYL TURBUHALER doit être utilisé selon les besoins plutôt que régulièrement.
Consultez immédiatement un médecin si vos symptômes d’asthme (toux, essoufflement, respiration sifflante ou oppression thoracique) s’aggravent ou si vous vous sentez trop essoufflé quand vous parlez, mangez ou dormez.
Vous devez contacter votre médecin dès que possible si vous avez besoin de doses de BRICANYL TURBUHALER plus élevées que d’habitude pour soulager vos problèmes respiratoires. Vous pourriez alors avoir besoin de médicaments supplémentaires pour contrôler votre asthme.
Si vous utilisez BRICANYL TURBUHALER plus de deux fois par semaine pour traiter vos symptômes d’asthme, cela indique un asthme mal contrôlé et une augmentation du risque de crises sévères d’asthme (aggravation de l’asthme) et de graves complications pouvant mettre en jeu le pronostic vital ou même être fatales. Vous devez contacter votre médecin dès que possible pour réévaluer votre traitement de l’asthme.
Si vous utilisez quotidiennement un médicament contre l’inflammation des poumons, par exemple un « corticoïde inhalé », il est important de continuer à l’utiliser régulièrement, même si vous vous sentez mieux.
Mode d'administration
Inhalation par distributeur avec embout buccal.
Voie inhalée exclusivement.
L'efficacité de ce médicament est en partie dépendante du bon usage de l'appareil de distribution (Turbuhaler). Il convient donc de lire très attentivement le mode d'emploi. Au besoin, n'hésitez pas à demander à votre médecin ou à votre pharmacien de vous fournir des explications détaillées.
Instructions
Préparer votre nouveau BRICANYL TURBUHALER
Avant d'utiliser votre BRICANYL TURBUHALER pour la première fois, vous devez le préparer pour son utilisation comme suit :
· Dévissez le capuchon et enlevez-le. Vous pouvez entendre un cliquetis.
· Tenez votre BRICANYL TURBUHALER bien droit, en position verticale, avec la molette bleue en bas.
· Tournez la molette bleue à fond dans un sens, puis à fond dans l’autre sens (le premier sens par lequel vous débutez n’a pas d’importance).
· Vous entendrez un « clic ».
· Répétez cette manipulation une deuxième fois
· Votre BRICANYL TURBUHALER est maintenant prêt à être utilisé.
Utilisation du Turbuhaler
Chaque fois que vous avez besoin de prendre une inhalation, suivez les instructions ci-dessous.
|
|
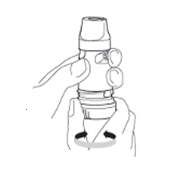
1. Dévissez le capuchon et soulevez-le. Vous pouvez entendre un cliquetis.
2. Tenez votre Turbuhaler bien droit, verticalement avec la molette bleue en bas.
3. Ne pas tenir le Turbuhaler par l'embout buccal lorsque vous chargez une dose de traitement. Pour charger une dose de traitement, tourner la molette bleue à fond dans un sens. Puis tourner à fond dans l'autre sens (le premier sens par lequel vous débutez n’a pas d’importance). Vous entendrez un « clic », la dose est maintenant chargée et prête à être inhalée. Ne chargez votre Turbuhaler que lorsque vous avez besoin de l'utiliser.
|
|
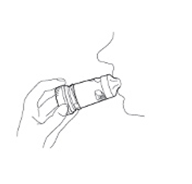
4. Tenez votre Turbuhaler loin de votre bouche. Expirez doucement. Ne pas respirer à travers votre Turbuhaler.
5. Placer l'embout buccal entre vos dents. Ne mâchez pas, ne mordez pas l'embout buccal. Fermez la bouche et inspirez profondément à travers l’embout buccal.
|
|
6. Retirez le Turbuhaler de votre bouche, puis expirez doucement. La quantité de médicament qui est inhalé est très faible et vous pouvez ne pas avoir perçu le goût particulier lors de l’inhalation. Toutefois, si vous avez suivi les instructions, vous pouvez être sûr que la dose est inhalée et que le médicament est maintenant dans vos poumons.
7. Si vous devez prendre une deuxième inhalation, répétez les étapes 2 à 6.
8. Revissez ferment le capuchon après usage.
9. Si possible, rincez-vous la bouche avec de l'eau, sans avaler l’eau, à chaque fois après avoir pris votre dose, pour éliminer tout médicament qui reste dans votre bouche.
Comme pour l’ensemble des inhalateurs, les soignants doivent veiller à ce que les enfants utilisant le BRICANYL TURBUHALER le fasse en respectant la technique d’inhalation décrite ci-dessus.
Ne pas essayer d'enlever l'embout buccal, car il est fixé à votre Turbuhaler et il ne doit pas être enlevé. L'embout buccal peut être tourné mais ne le tordez pas inutilement. Ne pas utiliser votre Turbuhaler s’il a été endommagé ou si l'embout buccal s’est séparé de votre Turbuhaler.
Nettoyage de votre Turbuhaler
Essuyez l'extérieur de l'embout buccal une fois par semaine avec un tissu sec. Ne pas utiliser d'eau ou de liquides.
Quand devez-vous commencer à utiliser un autre Turbuhaler ?
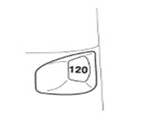
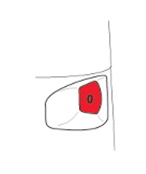
L'indicateur de doses vous indique combien de doses il reste dans le Turbuhaler, en commençant par 120 doses quand il est plein.
|
|
· L'indicateur de doses est marqué par intervalles de 10 doses. Par conséquent, il ne montre pas toutes les doses. Lorsque vous voyez pour la première fois une marque rouge en haut de la fenêtre de l’indicateur, il reste environ 20 doses dans le Turbuhaler. Pour les 10 dernières doses, la fenêtre de l'indicateur de doses est intégralement rouge. Lorsque le chiffre zéro est au milieu de la fenêtre rouge, il n’y a plus de médicament et vous devez commencer à utiliser un nouveau Turbuhaler.
|
|
Remarque :
· La molette tournera toujours et fera «clic», même lorsque votre Turbuhaler sera vide.
· Le bruit que vous entendez lorsque vous secouez votre Turbuhaler est produit par un agent déshydratant (dessicant) et non le médicament. Par conséquent, le bruit entendu ne signifie pas qu’il reste du médicament dans votre Turbuhaler.
· Avant de prendre votre dose, si vous chargez par erreur votre BRICANYL TURBUHALER plus d'une fois, il n’y aura toujours qu’une seule dose prête à être inspirée. Toutefois, l'indicateur de dose enregistrera toutes les doses chargées.
Fréquence d'administration
En cas de crise d'asthme ou de gêne respiratoire : le médicament doit être inhalé dès les premiers symptômes.
En prévention de l'asthme d'effort : le médicament doit être inhalé 15 à 30 minutes avant l'exercice.
Durée de traitement
Se conformer à l'ordonnance de votre médecin.
Si vous avez pris plus de BRICANYL TURBUHALER 500 microgrammes/dose, poudre pour inhalation que vous n’auriez dû :
Consultez immédiatement votre médecin ou votre pharmacien.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Les effets suivants peuvent être observés aux doses thérapeutiques :
· Très fréquemment : tremblements des extrémités, maux de tête ;
· Fréquemment : Tachycardie, palpitations, crampes musculaires, diminution du taux sanguin de potassium ;
· Fréquence indéterminée* : Troubles du rythme cardiaque, nausées, agitation, nervosité, hyperactivité et troubles du sommeil, urticaire, éruption cutanée/rougeur de la peau.
* Signalé spontanément dans les données post-commercialisation ; la fréquence est donc considérée comme indéterminée.
Si vous êtes sensible à l'inhalation d'une poudre sèche, il peut occasionnellement apparaître une irritation de la gorge avec toux et enrouement, ceci peut être prévenu en se rinçant la bouche.
EN CAS DE DOUTE, NE PAS HESITER A PREVENIR VOTRE MEDECIN.
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin, votre pharmacien ou à votre infirmier/ère. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet: https://signalement.social-sante.gouv.fr/
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER BRICANYL TURBUHALER 500 microgrammes/dose, poudre pour inhalation ?
Tenir ce médicament hors de la vue et de la portée des enfants.
N’utilisez pas ce médicament après la date de péremption indiquée sur la boîte. La date de péremption fait référence au dernier jour de ce mois.
Ce médicament doit être conservé à température ambiante et à l'abri de l'humidité.
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient BRICANYL TURBUHALER 500 microgrammes/dose, poudre pour inhalation
· La substance active est :
Sulfate de terbutaline.................................................................................... 500 microgrammes
Pour une dose
· L’autre composant est : Lactose monohydraté (contenant des protéines de lait).
Ce médicament se présente sous forme de poudre pour inhalation.
Flacon de 120 doses.
Titulaire de l’autorisation de mise sur le marché
TOUR CARPE DIEM
31 PLACE DES COROLLES
92400 COURBEVOIE
Exploitant de l’autorisation de mise sur le marché
TOUR CARPE DIEM
31 PLACE DES COROLLES
92400 COURBEVOIE
FORSKARGATAN 18
SE-151 36 SODERTALJE
SUEDE
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Ce médicament est autorisé dans les Etats membres de l'Espace Economique Européen sous les noms suivants : Conformément à la réglementation en vigueur.
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
Sans objet.