Dernière mise à jour le 02/02/2026
IOPIDINE 0,5 %, collyre en solution
Indications thérapeutiques
IOPIDINE appartient à un groupe de médicaments appelés agonistes alpha.
Il est utilisé pour le traitement du glaucome chronique chez les personnes prenant déjà d’autres médicaments pour traiter cette maladie.
Chez ces personnes, IOPIDINE aide à réduire la pression du fluide présent dans l’œil et peut retarder l’intervention chirurgicale nécessaire à la correction de cette pression.
Présentations
> 1 flacon(s) compte-gouttes polyéthylène basse densité (PEBD) de 5 ml
Code CIP : 338 389-8 ou 34009 338 389 8 0
Déclaration de commercialisation : 22/06/2023
Cette présentation est agréée aux collectivités
- Prix hors honoraire de dispensation : 10,76 €
- Honoraire de dispensation : 1,02 €
- Prix honoraire compris : 11,78 €
- Taux de remboursement :65%
Service médical rendu (SMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprès de la HAS (plus d'informations dans l'aide). Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Important | Avis du 04/11/2015 | Renouvellement d'inscription (CT) | Le service médical rendu par les spécialités IOPIDINE reste important dans les indications de l’AMM. |
Amélioration du service médical rendu (ASMR)
Pas d'ASMR disponible pour ce médicament (plus d'informations dans l'aide )
ANSM - Mis à jour le : 21/08/2023
IOPIDINE 0,5 %, collyre en solution
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
1 ml de solution contient 5 mg d’apraclonidine (sous forme de chlorhydrate)
Excipient à effet notoire : 1 ml de solution contient 0,1 mg de chlorure de benzalkonium
Pour la liste complète des excipients, voir rubrique 6.1.
Solution transparente à jaune pâle
4.1. Indications thérapeutiques
L'efficacité de IOPIDINE à réduire la PIO diminue avec le temps chez la majorité des patients. Même si certains patients ont pu être traités avec succès par IOPIDINE sur de plus longues périodes, l'effet bénéfique n'excède pas un mois chez la plupart des patients.
L'ajout de IOPIDINE chez des patients utilisant déjà deux médicaments réduisant la formation d'humeur aqueuse (c'est-à-dire bêta-bloquants plus inhibiteur de l'anhydrase carbonique) comme un traitement médical maximal toléré, ne se traduit pas nécessairement par un effet bénéfique supplémentaire. En effet, IOPIDINE agit en réduisant la formation d'humeur aqueuse et l'addition d'un troisième médicament agissant par ce mécanisme ne conduit pas nécessairement à un abaissement significatif de la PIO.
4.2. Posologie et mode d'administration
Instiller une goutte de IOPIDINE dans l'œil ou les yeux malades trois fois par jour. IOPIDINE devant être utilisé en association avec d'autres médicaments antiglaucomateux, il est nécessaire de respecter un intervalle d'environ cinq minutes entre l'instillation de chaque médicament, afin de ne pas éliminer la dose précédente. Les pommades ophtalmiques doivent être administrées en dernier. Si la goutte de IOPIDINE n’est pas retenue par l’œil qu’elle qu’en soit la raison, le patient doit y instiller une seconde goutte. La durée maximale de traitement recommandée est d'un mois en raison de la perte d'efficacité du produit au cours du temps (tachyphylaxie). Cependant, certains patients pourraient bénéficier du traitement par IOPIDINE sur de plus longues périodes.
L'administration chez le sujet âgé ne nécessite aucune précaution particulière.
Population pédiatrique
La sécurité et l’efficacité de IOPIDINE chez les enfants n’ont pas été établies. Aucune donnée n’est disponible.
Mode d’administration
Usage oculaire uniquement.
Après ouverture du bouchon, si la bague d’inviolabilité au niveau du col du flacon est trop lâche, la retirer avant d’utiliser le produit.
Après instillation, l’occlusion nasolacrymale ou la fermeture douce des paupières est recommandée. Ceci peut réduire l’absorption systémique des médicaments administrés par voie oculaire et diminuer les effets secondaires indésirables systémiques.
· IOPIDINE est contre-indiqué chez les enfants.
· IOPIDINE est contre-indiqué chez les patients ayant une hypersensibilité à l'un des composants de la formule ou à la clonidine administrée par voie générale ainsi que chez les patients recevant des inhibiteurs de monoamine oxydase, des sympathomimétiques systémiques ou des antidépresseurs tricycliques.
4.4. Mises en garde spéciales et précautions d'emploi
IOPIDINE doit être administré avec prudence chez les patients ayant des antécédents d'angor, une insuffisance coronarienne sévère, un infarctus du myocarde récent, une insuffisance cardiaque manifeste, une hypertension, une maladie cardiovasculaire, incluant l’apoplexie, une maladie cérébrovasculaire, un syndrome Parkinsonien, une insuffisance rénale chronique, une maladie de Raynaud ou une thromboangéite oblitérante.
Une attention et une surveillance particulières sont recommandées chez les sujets déprimés, l'apraclonidine ayant été, dans de rares cas, associée à une dépression.
Dans le cas d'un glaucome évolué, si une baisse de l'acuité visuelle apparaît immédiatement après administration de IOPIDINE, le traitement doit être interrompu.
Comme pour tous les patients glaucomateux sous traitement maximal toléré, les patients traités par IOPIDINE pour retarder l'intervention chirurgicale doivent faire l'objet d'examens de suivi fréquents et le traitement doit être interrompu si la pression intra-oculaire augmente significativement. La perte d'efficacité dans le temps, observée chez la plupart des patients apparaît comme un phénomène individuel dont le délai de survenue est variable et justifie une surveillance étroite. De plus, chez ces patients, le champ visuel doit être évalué périodiquement.
Il n'existe pas de données sur l'apraclonidine en administration locale chez les patients ayant une insuffisance rénale ou hépatique. L'absorption systémique d'apraclonidine après une administration locale est faible et conduit à des taux plasmatiques inférieurs à 1,0 ng/ml. Cependant il est conseillé de surveiller les patients ayant une insuffisance rénale ou hépatique. Chez les patients ayant une insuffisance hépatique, les paramètres cardiovasculaires doivent également être étroitement surveillés, étant donné que la clonidine utilisée par voie systémique est partiellement métabolisée dans le foie.
L'utilisation de IOPIDINE peut entraîner une réaction d'intolérance oculaire caractérisée soit entièrement soit en partie par une hyperémie oculaire, un prurit oculaire, une gêne oculaire, un larmoiement augmenté, une sensation anormale dans l'œil, un œdème des paupières et un œdème conjonctival (voir rubrique 4.8). En cas de survenue de tels symptômes oculaires, le traitement par IOPIDINE doit être arrêté. De plus, les données précliniques laissent penser que certains patients pourraient développer une sensibilisation de contact lors de l'utilisation répétée du médicament. Les signes d'intolérance oculaire sont plus fréquents chez les patients traités depuis plus d'un mois.
L'arrêt du traitement dans le cas d'augmentation de la pression intra-oculaire devra coïncider avec la mise en place d'un traitement alternatif, ou d'une intervention chirurgicale destinée à réduire la pression.
L'apraclonidine étant un hypotenseur puissant agissant sur la pression intra-oculaire, les patients chez qui une diminution excessive de la pression intra-oculaire survient, doivent être étroitement surveillés.
IOPIDINE contient du chlorure de benzalkonium
Ce médicament contient 0,5 mg et 1 mg de chlorure de benzalkonium dans respectivement 5 ml et 10 ml de collyre, équivalent à une concentration de 0,1 mg/ml.
IOPIDINE contient du chlorure de benzalkonium qui peut entraîner une irritation et est connu pour teinter les lentilles de contact souples. Le contact avec les lentilles de contact souples doit être évité. Les patients doivent être informés qu’ils doivent enlever leurs lentilles de contact avant l’instillation de IOPIDINE et qu’ils doivent attendre 15 minutes après l’instillation avant de les remettre.
Le chlorure de benzalkonium peut être à l’origine d’une irritation oculaire, de symptômes de sécheresse oculaire, et peut affecter le film lacrymal et la surface cornéenne. Il doit être utilisé avec prudence chez les patients atteints de sécheresse oculaire et chez les patients dont la cornée pourrait être endommagée. Les patients doivent être étroitement surveillés en cas d’utilisation prolongée.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
IOPIDINE est contre-indiqué chez les patients recevant des inhibiteurs de la monoamine oxydase, des sympathomimétiques systémiques ou des antidépresseurs tricycliques (voir rubrique 4.3).
Le risque d’interactions cliniquement pertinentes apparaît faible étant donné les concentrations plasmatiques d’apraclonidine obtenues après administration par voie oculaire. Il n'a été signalé aucun cas d'interaction médicamenteuse chez les patients recevant de façon concomitante des médicaments destinés à traiter un glaucome ou d'autres pathologies oculaires ou toute autre pathologie systémique rencontrée au cours des études cliniques. Bien qu'aucune interaction médicamenteuse spécifique avec les médicaments antiglaucomateux topiques ou avec des médicaments administrés par voie systémique n'ait été identifiée au cours des études cliniques de IOPIDINE, la possibilité d'un effet potentialisateur ou additif avec les dépresseurs du système nerveux central (alcool, barbituriques, opiacés, sédatifs, anesthésiques) doit être prise en compte. En théorie, l'utilisation de IOPIDINE en association avec des sympathomimétiques locaux pourrait provoquer une augmentation de la pression artérielle systémique, et de ce fait, la pression artérielle doit être vérifiée en début de traitement chez les patients recevant ce type d'association thérapeutique.
La prudence est recommandée chez les patients prenant des antidépresseurs tricycliques qui peuvent agir sur le métabolisme et le recaptage des amines circulantes.
Un effet hypotensif additif a été rapporté lorsque la clonidine administrée par voie systémique a été associée à un traitement neuroleptique. L'administration systémique de la clonidine pourrait inhiber la production de catécholamines en réponse à une hypoglycémie induite par l'insuline et pourrait masquer les signes et les symptômes de l'hypoglycémie.
Comme l'apraclonidine peut diminuer la fréquence cardiaque et la pression artérielle, la prudence est recommandée lors de l'utilisation de médicaments tels que les bêta-bloquants (ophtalmiques et systémiques), les antihypertenseurs et les glucosides cardiotoniques. La fréquence cardiaque et la pression artérielle des patients recevant des médicaments cardiovasculaires en même temps que IOPIDINE, doivent être fréquemment surveillées. La prudence s'impose chez les patients recevant simultanément de la clonidine et d'autres agents pharmacologiques similaires.
En cas de traitement concomitant par plusieurs médicaments ophtalmiques topiques, attendre au moins 5 minutes entre chaque administration. Les pommades ophtalmiques doivent être administrées en dernier.
4.6. Fertilité, grossesse et allaitement
Grossesse
Il n’existe pas de données ou il existe des données limitées sur l'utilisation de IOPIDINE chez la femme enceinte.
IOPIDINE n’est pas recommandé pendant la grossesse.
Des études réalisées chez l'animal ont montré l'absence d'effet tératogène chez les rats et les lapins. Une embryotoxicité a été observée lorsque les lapines gravides ont été exposées, par voie orale, à des doses d’apraclonidine (doses > 1,25 mg/kg/jour) qui étaient toxiques pour la mère et administrées pendant toute la période d’organogénèse à des taux (mg/kg/j) 60 fois supérieurs aux posologies de IOPIDINE collyre recommandées pour une personne de 50 kg.
Il n'a pas encore été établi si l'apraclonidine administré par voie topique est excrétée dans le lait maternel.
Un risque pour les nouveau-nés/nourrissons ne peut pas être exclu. L’allaitement doit être interrompu au cours du traitement avec IOPIDINE.
Fertilité
Aucune étude n’a été conduite pour évaluer l’effet d’une administration topique oculaire de IOPIDINE sur la fertilité masculine ou féminine. Chez les rats, aucun effet sur la fertilité n’a été observé après l’administration par voie orale d’apraclonidine.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
IOPIDINE a une influence modérée sur l’aptitude à conduire des véhicules et à utiliser des machines.
Les médicaments de type "clonidine" pouvant provoquer des vertiges ou une somnolence, il est recommandé aux patients présentant ces effets de ne pas conduire de véhicule ni d'utiliser de machine. L'attention des conducteurs de véhicules et des utilisateurs de machines doit être portée sur les risques liés à l'emploi de ce médicament.
Résumé du profil de sécurité
Au cours d’études cliniques avec IOPIDINE, les effets indésirables les plus fréquents étaient l’hyperémie oculaire, le prurit oculaire, et la conjonctivite, survenant chez environ 12% à 23% des patients.
Les effets indésirables suivants sont classés selon la convention suivante : très fréquents (≥ 1/10), fréquents (≥ 1/100 à < 1/10), peu fréquents (≥ 1/1 000 à < 1/100), rares (≥ 1/10 000 à < 1/1 000), très rares (< 1/10 000), ou indéterminés (ne peuvent être estimés sur la base des données disponibles). Dans chaque groupe de fréquence, les effets indésirables sont présentés par ordre décroissant de gravité.
|
Classe de systèmes d'organes |
Terme préféré MedDRA (v. 19.0) |
|
Infections et infestations |
Fréquents : rhinite |
|
Troubles du système immunitaire |
Indéterminés : hypersensibilité |
|
Troubles psychiatriques |
Peu fréquents : dépression, nervosité, insomnie |
|
Troubles du système nerveux |
Fréquents : céphalée, dysgueusie |
|
Peu fréquents : vertiges, anomalie de la coordination, somnolence, paresthésie |
|
|
Troubles oculaires |
Très fréquents : conjonctivite, prurit oculaire, hyperémie oculaire |
|
Fréquents : œdème de la paupière, œil sec, follicules conjonctivaux, sensation de corps étranger dans l'œil, formation de croûtes sur le bord des paupières, augmentation de l’écoulement lacrymal, gêne oculaire |
|
|
Peu fréquents : mydriase, kératite, kératopathie, réduction de l’acuité visuelle, dégradation de la vision, photophobie, vision trouble, érosion cornéenne, infiltrats cornéens, blépharospasme, blépharite, ptôsis de la paupière, érythème de la paupière, douleur oculaire, œdème oculaire, trouble de la paupière, desquamation au niveau de la paupière, rétractation de la paupière, troubles vasculaires conjonctivaux, œdème conjonctival, écoulement oculaire, irritation oculaire |
|
|
Troubles cardiaques |
Peu fréquents : douleur thoracique, œdème périphérique, arythmie |
|
Troubles vasculaires |
Peu fréquents : vasodilatation |
|
Troubles respiratoires, thoraciques et médiastinaux |
Fréquents : sécheresse nasale |
|
Peu fréquents : asthme, dyspnée, rhinorrhée, parosmie, irritation de la gorge |
|
|
Troubles gastro-intestinaux |
Fréquents : sécheresse de la bouche |
|
Peu fréquents : nausée, constipation |
|
|
Troubles cutanés et des tissus sous-cutanés |
Fréquents : dermatite Peu fréquents : dermatite de contact, œdème de la face |
|
Troubles musculo-squelettiques et du tissu conjonctif |
Peu fréquents : myalgie |
|
Troubles généraux et accidents liés au site d'administration |
Fréquents : asthénie |
|
Peu fréquents : malaise, fatigue, irritabilité |
|
|
Investigations |
Peu fréquents : coloration cornéenne |
Description d’effets indésirables sélectionnés
L'utilisation d’IOPIDINE peut entraîner une réaction d'intolérance oculaire (voir rubrique 4.4.). Le délai moyen d'apparition de ces réactions était de 44 jours (de 1 à 127 jours).
Au cours des études cliniques, le taux global d'interruptions de traitement imputables à IOPIDINE était de 15 %. Les événements les plus courants conduisant à l'interruption du traitement incluaient (par ordre décroissant de fréquence) : hyperémie oculaire, prurit oculaire, larmoiement augmenté, gêne oculaire, œdème des paupières, sécheresse de la bouche et sensation anormale dans l'œil.
La possibilité de survenue d’une bradycardie due à l’effet agoniste alpha-2-adrénergique de l’apraclonidine doit être prise en compte. Bien qu’aucun cas de bradycardie n’ait été rapporté lors de l’utilisation de IOPIDINE collyre dans les études cliniques, des rapports occasionnels ont été reçus suite à la surveillance du produit après sa mise sur le marché.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/.
IOPIDINE peut être éliminé de l'œil par lavage à l’eau tiède ou au sérum physiologique stérile.
Les manifestations suivantes ont été rapportées après ingestion intentionnelle ou accidentelle de clonidine par voie orale : hypotension, hypertension transitoire, asthénie, vomissement, irritabilité, réflexes diminués ou absents, léthargie, somnolence, sédation ou coma, pâleur, hypothermie, bradycardie, troubles de la conduction, arythmie, sécheresse de la bouche, myosis, apnée, dépression respiratoire, hypoventilation et convulsion. Le traitement d'un surdosage par voie orale comprend un traitement adapté et symptomatique ; la fonction ventilatoire doit être maintenue. L'hémodialyse a un intérêt limité car elle ne permet d'éliminer au maximum que 5% du produit circulant.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Classe pharmacothérapeutique : Ophtalmologiques ; Antiglaucomateux et myotiques, code ATC : SO1E A03.
L'apraclonidine est un agoniste alpha-2-adrénergique relativement sélectif sans activité stabilisante de membrane significative (anesthésique local). Après instillation dans l'œil, l'apraclonidine entraîne une réduction de la pression intra-oculaire. L'apraclonidine en solution ophtalmique a peu d'effet sur les paramètres cardiovasculaires. Les études de fluorophotométrie chez l'homme suggèrent que le mécanisme d'action de l'effet hypotensif oculaire de l'apraclonidine est lié à une réduction de la formation de l'humeur aqueuse. Le délai d'action de IOPIDINE 0,5 % collyre est d'environ une heure et la réduction de la pression intra-oculaire atteint son maximum habituellement trois à cinq heures après l'application d'une dose unique.
5.2. Propriétés pharmacocinétiques
La concentration plasmatique d'apraclonidine après administration oculaire locale bilatérale trois fois par jour de IOPIDINE chez les volontaires sains, est inférieure à 1,0 ng/ml. L'état d'équilibre est atteint après cinq jours d’administration. La demi-vie du produit est estimée à huit heures.
5.3. Données de sécurité préclinique
Toxicité aiguë
La DL50 per os est comprise entre 5 mg/kg (souris) et 64 mg/kg (rats) ; aucun décès n'est survenu chez les primates à la dose de 55 mg/kg.
Toxicité subchronique et chronique
Par voie orale
Des rats et des souris ont reçu par voie orale des doses journalières s'élevant respectivement jusqu'à 1,2 mg/kg et 2 mg/kg sur une période de 13 semaines. La dose mortelle a été de 1,2 mg/kg/jour à 1,6 mg/kg/jour. Des troubles de la défécation, une distension abdominale et des opacifications cornéennes ont été observées.
Par voie locale
Chez le lapin, l'administration oculaire locale de solutions de chlorhydrate d'apraclonidine (2 gouttes instillées toutes les 30 minutes dans l'œil, pendant 6 heures) a conduit à une irritation cornéenne et conjonctivale dose-dépendante à partir de 5 mg/ml.
Des lapins ont toléré une solution à 15 mg/ml (2 gouttes, 3 fois par jour) sur une période d'un mois, sans manifestation de signes de toxicité systémique. Ont toutefois été observées une irritation conjonctivale et une opacification cornéenne sporadique minime.
Aucune manifestation ophtalmique ou systémique imputable au traitement n'a été observée chez les singes ayant reçu 3 fois par jour pendant 1 an après administration oculaire locale des solutions de chlorhydrate d'apraclonidine à 5, 10 et 15 mg/ml.
Tolérance locale
Les tests du pouvoir sensibilisant réalisés chez le cobaye ont prouvé que le chlorhydrate d'apraclonidine était modérément sensibilisant.
Pouvoir mutagène et carcinogène
Les tests de mutagénécité du chlorhydrate d’apraclonidine utilisant différents systèmes de référence ont tous donné des résultats négatifs. Des atteintes oculaires (kératites) et rénales ont toutefois été signalées pendant ces études de cancérogénèse.
Toxicité pour la reproduction
Des études réalisées chez les rats et les lapins n'ont révélé aucun effet tératogène, toutefois une faible toxicité fœtale a été observée à 60 fois la dose thérapeutique.
4 semaines après la première ouverture.
6.4. Précautions particulières de conservation
A conserver à une température ne dépassant pas 25°C.
Ne pas mettre au réfrigérateur, ne pas congeler.
Conserver le flacon dans l’emballage extérieur.
6.5. Nature et contenu de l'emballage extérieur
5 ml et/ou 10 ml en flacon (polyéthylène basse densité blanc), muni d'un embout compte-gouttes (polyéthylène basse densité naturel) et d'un capuchon blanc (polypropylène).
Toutes les présentations peuvent ne pas être commercialisées.
6.6. Précautions particulières d’élimination
Pas d’exigences particulières.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
Vision Exchange Building
Triq it-Territorjals, Zone 1,
Central Business District,
Birkirkara, CBD 1070,
MALTE
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 338 389 8 0 : 5 ml en flacon (PE).
· 34009 338 390 6 2 : 10 ml en flacon (PE).
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Liste I.
ANSM - Mis à jour le : 21/08/2023
IOPIDINE 0,5 %, collyre en solution
Apraclonidine (sous forme de chlorhydrate)
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin ou votre pharmacien.
· Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d’autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
1. Qu'est-ce que IOPIDINE 0,5 %, collyre en solution et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant d'utiliser IOPIDINE 0,5 %, collyre en solution ?
3. Comment utiliser IOPIDINE 0,5 %, collyre en solution ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver IOPIDINE 0,5 %, collyre en solution ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE IOPIDINE 0,5 %, collyre en solution ET DANS QUELS CAS EST-IL UTILISE ?
IOPIDINE appartient à un groupe de médicaments appelés agonistes alpha.
Il est utilisé pour le traitement du glaucome chronique chez les personnes prenant déjà d’autres médicaments pour traiter cette maladie.
Chez ces personnes, IOPIDINE aide à réduire la pression du fluide présent dans l’œil et peut retarder l’intervention chirurgicale nécessaire à la correction de cette pression.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D’UTILISER IOPIDINE 0,5 %, collyre en solution?
· si vous avez des antécédents de maladie cardiaque grave ou instable ou de problèmes circulatoires,
· si vous êtes allergique à l’apraclonidine, à la clonidine ou à l’un des autres composants contenus dans ce médicament, mentionnés dans la rubrique 6,
· si vous prenez des antidépresseurs qui appartiennent à la classe des inhibiteurs de la monoamine oxydase ou des antidépresseurs tricycliques,
· si vous prenez des médicaments qui appartiennent à la classe des sympathomimétiques, par voie orale ou en injection,
· chez les ENFANTS.
Demandez conseil à votre médecin.
Avertissements et précautions
Faites attention :
· Utilisez IOPIDINE uniquement en gouttes dans l'œil ou les yeux.
· Il est possible que IOPIDINE ne contrôle plus votre pression intraoculaire après avoir été utilisé pendant un certain temps. Votre médecin vous examinera souvent lorsque vous utilisez IOPIDINE afin de vérifier que le collyre continue d’agir.
· Comme IOPIDINE diminue votre pression oculaire, vous devez faire contrôler votre pression intraoculaire régulièrement pour vous assurer que votre pression oculaire reste toujours contrôlée.
Si vous avez les antécédents suivants, ou si vous prenez des médicaments pour traiter l’une des pathologies suivantes :
· Toute maladie cardiaque (notamment l’angine de poitrine, des crises cardiaques ou de l’insuffisance cardiaque)
· Hypertension artérielle ou autres problèmes circulatoires (notamment accident vasculaire cérébral, syndrome de Raynaud et épisodes d’évanouissement)
· Problèmes rénaux ou hépatiques
· Dépression
· Maladie de Parkinson
· Diabète ou hypoglycémie. IOPIDINE peut dissimuler les signes et les symptômes d’une diminution soudaine de la glycémie sanguine telle qu’un pouls accéléré ou des tremblements
· Si vous devez subir prochainement une intervention chirurgicale.
Si l’une de ces pathologies vous concerne, vous pouvez peut-être continuer à utiliser IOPIDINE, mais parlez-en d’abord avec votre médecin.
IOPIDINE avec des aliments, boissons et de l’alcool
Ne consommez pas d’alcool pendant le traitement par IOPIDINE car l’alcool peut augmenter ses effets.
Autres médicaments et IOPIDINE
Informez votre médecin ou pharmacien si vous prenez, avez récemment pris ou pourriez prendre tout autre médicament, y compris un médicament obtenu sans ordonnance.
IOPIDINE ne doit pas être utilisé si vous prenez des antidépresseurs appartenant à la classe des inhibiteurs de la monoamine oxydase ou des antidépresseurs tricycliques. IOPIDINE ne doit pas être utilisé si vous prenez des médicaments qui appartiennent à la classe des sympathomimétiques, administrés par voies orale ou injectable.
IOPIDINE peut augmenter les effets de certains médicaments utilisés pour traiter la dépression, l’asthme ou l’hypertension artérielle, des médicaments pour le cœur contenant de la digoxine ou de la digitoxine, pour traiter certaines formes de maladie mentale et la maladie de Parkinson et il peut interagir avec certains antalgiques, sédatifs, anesthésiques, antidépresseurs tricycliques, phénothiazines, certains médicaments contre la toux et le rhume, les médicaments antiglaucomateux tels que le timolol ,la brimonidine ou la dipivéfrine, et les collyres utilisés pour blanchir l’œil.
Si vous êtes enceinte ou que vous allaitez, si vous pensez être enceinte ou planifiez une grossesse, demandez conseil à votre médecin ou pharmacien avant de prendre ce médicament.
IOPIDINE ne doit pas être utilisé pendant la grossesse ou l’allaitement.
Conduite de véhicules et utilisation de machines
Ce type de médicament peut provoquer des somnolences et des étourdissements. Si c’est le cas, ne pas conduire de véhicules ou utiliser de machines.
Information importante si vous portez des lentilles de contact :
IOPIDINE contient du chlorure de benzalkonium
Ce médicament contient 0,1 mg de chlorure de benzalkonium dans chaque ml de collyre, équivalent à une concentration de 0,01%.
IOPIDINE contient un conservateur (le chlorure de benzalkonium) qui peut être absorbé par les lentilles de contact souples et changer leur couleur. Retirer les lentilles de contact avant application et attendre au moins 15 minutes avant de les remettre. Le chlorure de benzalkonium peut également provoquer une irritation des yeux, surtout si vous souffrez du syndrome de l’œil sec ou de troubles de la cornée (couche transparente à l’avant de l’œil). En cas de sensation anormale, de picotements ou de douleur dans les yeux après avoir utilisé ce médicament, contactez votre médecin.
3. COMMENT UTILISER IOPIDINE 0,5 %, collyre en solution ?
La posologie recommandée est 1 goutte dans votre œil ou vos yeux, 3 fois par jour.

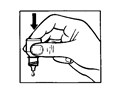

1 2 3
Enlevez la bague détachable du capuchon la première fois que vous ouvrez le flacon.
Respectez toujours la posologie indiquée par votre médecin. En cas de doute, consultez votre médecin ou votre pharmacien.
Mode d’administration
· Lavez-vous les mains avant de commencer.
· Dévissez le capuchon du flacon.
· Tenez le flacon tête en bas, entre votre pouce et vos autres doigts.
· Penchez la tête en arrière.
· Avec un doigt, tirez votre paupière vers le bas pour créer un « sillon » entre la paupière et votre œil. La goutte sera déposée à cet endroit (figure 1).
· Rapprochez l’embout du flacon de l’œil. Si besoin, utilisez le miroir.
· Ne touchez pas votre œil ou vos paupières, les surfaces voisines ou d’autres surfaces avec le compte-gouttes. Cela peut infecter le collyre.
· Appuyez légèrement sur la base du flacon pour libérer une goutte à la fois (figure 2).
· Ne comprimez pas le flacon, il est conçu pour qu’une légère pression sur la base suffise.
· Après avoir utilisé IOPIDINE, appuyez avec un doigt sur le coin de votre œil près du nez (figure 3). Ceci permet d’empêcher la pénétration de IOPIDINE dans le reste du corps.
· Si vous devez traiter les deux yeux, recommencez ces étapes pour l’autre œil. Refermez bien le flacon immédiatement après usage.
· Si une goutte tombe à côté de votre œil, recommencez.
· En cas d’ingestion d’IOPIDINE, consultez immédiatement votre médecin.
Si vous oubliez d’utiliser IOPIDINE :
Continuez votre traitement normalement. Cependant, si le moment de la dose suivante est proche, ne prenez pas la dose oubliée et reprenez votre posologie normale. Ne prenez pas de dose double pour compenser la dose oubliée.
Si vous avez utilisé plus de IOPIDINE que vous n’auriez dû :
Rincez votre œil abondamment à l’eau tiède. Ne mettez pas d’autre goutte jusqu’à ce que le moment soit venu de mettre la goutte suivante.
En cas d’ingestion accidentelle, les symptômes de surdosage peuvent inclure une diminution de la pression artérielle, somnolence, diminution des battements cardiaques, hypoventilation (souffle moins rapide et moins profond), et convulsions.
Si vous utilisez d’autres collyres ou pommades ophtalmiques :
Attendre au moins 5 minutes entre chaque médicament. Les pommades ophtalmiques doivent être administrées en dernier.
Si vous avez d’autres questions sur l’utilisation de IOPIDINE, demandez plus d’informations à votre médecin ou à votre pharmacien.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
IOPIDINE peut entraîner des réactions allergiques. Si vous ressentez un ou plusieurs des symptômes oculaires suivants : rougeur, démangeaison, gêne, larmoiement des yeux, sensation anormale dans l’œil, gonflement de l’œil et de la paupière, mauvaise vision, consultez votre médecin immédiatement.
Si votre vision s’aggrave juste après avoir utilisé IOPIDINE, arrêtez de l’utiliser et consultez votre médecin immédiatement.
· Vous pouvez ressentir un ou plusieurs des effets suivants dans votre œil ou vos yeux :
Très fréquents (pouvant affecter plus d’une personne sur 10) : rougeur qui augmente, démangeaison, inflammation.
Fréquents (pouvant affecter jusqu’à 1 personne sur 10) : gêne oculaire, larmoiement des yeux, gonflement des paupières, sensation d’avoir du sable dans l’œil, œil sec, formation de croûtes sur le bord des paupières.
Peu fréquents (pouvant affecter jusqu’à 1 personne sur 100) : œdème des paupières, gonflement de l’œil, vision anormale, douleur, inflammation et irritation de l’œil ou des paupières, lésion de la surface de la cornée (partie avant de l’œil), sensibilité à la lumière, rougeur de la paupière, élévation ou rétractation des paupières, augmentation de la taille de la pupille, vision diminuée, vision trouble, paupière tombante, écoulement oculaire ou blanchiment oculaire.
· Vous pouvez également ressentir des effets dans d’autres parties du corps, notamment :
Fréquents (pouvant affecter jusqu’à 1 personne sur 10) : sécheresse de la bouche, inflammation à l’intérieur du nez, dermatite, sécheresse du nez, faiblesse corporelle, maux de tête, goût inhabituel dans la bouche.
Peu fréquents (pouvant affecter jusqu’à 1 personne sur 100) : douleur thoracique, gonflement des mains, des pieds ou des extrémités, battements cardiaques irréguliers, constipation, nausées, sensation de fatigue, mal de gorge, nez qui coule, douleurs musculaires, mauvaise coordination, somnolence, vertiges, sensation de fourmillement, anxiété, dépression, difficultés à s’endormir, essoufflement ou difficultés à respirer, odorat perturbé, gonflement du visage, irritabilité, dilatation des vaisseaux sanguins.
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet: https://signalement.social-sante.gouv.fr/
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER IOPIDINE 0,5 %, collyre en solution ?
Tenir ce médicament hors de la vue et de la portée des enfants.
Ne pas réfrigérer ni congeler, ni conserver au-dessus de 25°C.
Conserver le flacon bien fermé dans son emballage extérieur.
N’utilisez pas ce médicament après la date de péremption indiquée sur le flacon et la boîte après EXP. La date de péremption fait référence au dernier jour de ce mois.
Arrêtez d’utiliser le flacon 4 semaines après son ouverture initiale pour éviter toute infection.
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient IOPIDINE 0,5 %, collyre en solution
· La substance active est :
Apraclonidine (sous forme de chlorhydrate)........................................................................ 5 mg
Pour 1 ml de solution.
· Les autres composants sont :
Chlorure de sodium, acétate de sodium trihydraté, chlorure de benzalkonium, acide chlorhydrique et/ou hydroxyde de sodium (ajustement du pH) et eau purifiée.
Qu’est-ce que IOPIDINE 0,5 %, collyre en solution et contenu de l’emballage extérieur
IOPIDINE est une solution limpide, transparente à jaune pâle conditionnée en flacon plastique de 5 ml ou de 10 ml muni d’un bouchon à vis.
Titulaire de l’autorisation de mise sur le marché
Vision Exchange Building
Triq it-Territorjals, Zone 1,
Central Business District,
Birkirkara, CBD 1070,
MALTE
Exploitant de l’autorisation de mise sur le marché
Essential Pharma Limited,
Vision Exchange Building
Triq it-Territorjals, Zone 1,
Central Business District,
Birkirkara, CBD 1070,
MALTE
Vision Exchange Building
Triq it-Territorjals, Zone 1,
Central Business District,
Birkirkara, CBD 1070,
MALTE
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Ce médicament est autorisé dans les Etats membres de l'Espace Economique Européen sous les noms suivants : Conformément à la réglementation en vigueur.
[à compléter ultérieurement par le titulaire]
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).