Dernière mise à jour le 02/02/2026
LEVOFREE 0,05 %, collyre en solution
Indications thérapeutiques
Classe pharmacothérapeutique : Décongestionnant et antiallergique - Code ATC : S01GX02
Ce médicament est utilisé pour traiter les symptômes d’une allergie au niveau de l’œil (conjonctivite allergique) reconnaissable par des yeux et/ou des paupières gonflées, des yeux rouges, qui démangent ou qui larmoient.
Ce collyre ne contient pas de conservateur.
Vous devez vous adresser à votre médecin si vous ne ressentez aucune amélioration ou si vous vous sentez moins bien après 5 jours.
Présentations
> 1 flacon(s) compte-gouttes polyéthylène basse densité (PEBD) avec fermeture à témoin d'effraction de 5 mL
Code CIP : 34009 301 459 5 1
Déclaration de commercialisation : 12/02/2019
Cette présentation est agréée aux collectivités
- Prix hors honoraire de dispensation : 5,32 €
- Honoraire de dispensation : 1,02 €
- Prix honoraire compris : 6,34 €
- Taux de remboursement :30%
Service médical rendu (SMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprès de la HAS (plus d'informations dans l'aide). Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Modéré | Avis du 17/10/2018 | Inscription (CT) | le service médical rendu par LEVOFREE 0,05 %, collyre en solution est modéré dans l’indication de l’AMM. |
Amélioration du service médical rendu (ASMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprés de la HAS (plus d'informations dans l'aide). Les avis et synthéses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur de l'ASMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| V (Inexistant) | Avis du 17/10/2018 | Inscription (CT) | Cette spécialité est un complément de gamme qui n’apporte pas d’amélioration du service médical rendu (ASMR V) par rapport aux présentations déjà inscrites. |
ANSM - Mis à jour le : 05/10/2023
LEVOFREE 0,05 %, collyre en solution
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Lévocabastine........................................................................................................................ 0,05 g
Sous forme de chlorhydrate de lévocabastine
Pour 100 mL de solution
Excipients à effet notoire : Ce médicament contient 39,65 mg de phosphates par 5 mL.
Pour la liste complète des excipients, voir rubrique 6.1.
Solution limpide, incolore.
4.1. Indications thérapeutiques
4.2. Posologie et mode d'administration
Population pédiatrique
La sécurité et l’efficacité de LEVOFREE 0,05%, collyre en solution chez les enfants âgés de moins de 6 ans n’ont pas encore été établies. Ces données sont limitées (voir rubrique 5.1).
Adulte et enfant âgé d’au moins 6 ans : la dose usuelle recommandée est de 1 goutte dans chaque œil, 2 fois par jour.
Cette dose peut être augmentée, si nécessaire, à 1 goutte 3 à 4 fois par jour.
Le collyre doit être utilisé à intervalles réguliers.
Le traitement ne devra pas être prolongé au-delà de 5 jours, sans avis médical.
Mode d’administration
Se laver soigneusement les mains.
A. Avant la toute première instillation dans l’œil (première utilisation)
1. Enlever la bague de sécurité.
2. Oter le bouchon protecteur.
3. Tenir le flacon tête en bas et appuyer sur le milieu du flacon suffisamment fort de façon à extraire 1 à 2 gouttes.
B. Pour instiller le collyre dans l’œil
1. En regardant vers le haut et en tirant la paupière inférieure vers le bas, positionner le flacon au-dessus de l’œil et appuyer progressivement sur le milieu du flacon jusqu’à l’arrivée de la goutte.
Eviter de toucher l’œil ou la paupière avec l’embout du flacon.
2. Cligner des yeux une fois afin que le collyre se répartisse sur toute la surface de l’œil.
L’œil fermé, essuyez proprement l’excédent.
3. Afin d’éviter les effets généraux, il est recommandé de comprimer l’angle interne de l’œil pendant 1 minute après chaque instillation en maintenant l’œil fermé.
4. Replacer le bouchon protecteur après usage.
C. En cas de défaut d’apparition de la goutte, reprendre les étapes A2 et A3.
En cas de traitement concomitant par un autre collyre, espacer de 15 minutes les instillations.
Ce collyre ne contient pas de conservateur.
Hypersensibilité à la substance active ou à l’un des excipients mentionnés à la rubrique 6.1.
4.4. Mises en garde spéciales et précautions d'emploi
LEVOFREE 0,05 %, collyre en solution ne doit pas être utilisé en injection.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
4.6. Fertilité, grossesse et allaitement
Grossesse
Aucune donnée concernant l’espèce humaine n’est disponible. Compte tenu du passage systémique négligeable et du fait qu’aucun effet embryotoxique ou tératogène n’ait été signalé lors d’expérimentation animale, l’utilisation de LEVOFREE 0,05 %, collyre en solution est envisageable avec précaution durant la grossesse.
Du fait de l’absence de données, l’utilisation de la lévocabastine n’est pas recommandée au cours de l’allaitement.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Les effets indésirables issus des essais cliniques, études épidémiologiques et des données de post-marketing sont classés selon leur fréquence d'apparition, comme suit: très fréquents (≥ 1/10), fréquents (≥ 1/100, <1/10), peu fréquents (≥1/1000, < 1/100), rares (≥1/10000, <1/1000) et très rares (<1/10000). Les fréquences des effets rapportés après commercialisation ne sont pas connues.
Affections oculaires
Fréquent : Douleur oculaire, vision floue
Peu fréquent : œdème des paupières
Très rare : conjonctivite, gonflement des yeux, blépharite, hyperémie oculaire, larmoiement des yeux
Quelques très rares cas de calcification cornéenne ont été signalés en association avec l’utilisation de gouttes contenant des phosphates chez certains patients atteints de cornées gravement endommagées.
Très rare : palpitations
Troubles généraux et anomalie au site d’administration
Fréquent : Réaction au site d’administration incluant sensation de brûlure/picotement, irritation oculaire.
Très rare : Réaction au site d’administration incluant rougeur des yeux, prurit oculaire.
Affections du système immunitaire
Très rare : Œdème de Quincke, hypersensibilité, réaction anaphylactique.
Troubles cutanés et sous-cutanés
Très rare : Dermatite de contact, urticaire.
Trouble du système nerveux
Très rare : Maux de tête.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/
Des sédations après un surdosage accidentel ne peuvent être exclues.
En cas de surdosage, rincer abondamment au sérum physiologique stérile.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Classe pharmacothérapeutique : Décongestionnant et antiallergique, code ATC : S01GX02.
Mécanisme d’action
La lévocabastine est un antihistaminique-H1, sélectif, puissant et dont l’action est rapide et prolongée.
Après instillation oculaire, elle soulage rapidement et pendant plusieurs heures les symptômes de la conjonctivite allergique (prurit, érythème, larmoiement, œdème palpébral, chémosis).
Population pédiatrique
Les études pédiatriques réalisées dans la population d’enfants âgés de 6 à 18 ans ont confirmé l’efficacité de la lévocabastine en instillations oculaires. Des données d’utilisation chez les enfants de 4 à 6 ans ont été publiées. En raison de leur caractère limité, le rapport bénéfice-risque doit être pris en compte en cas d’utilisation de la lévocabastine oculaire chez les enfants d’au moins 4 ans et de moins de 6 ans.
5.2. Propriétés pharmacocinétiques
Après instillation oculaire, la lévocabastine est progressivement et partiellement résorbée par la muqueuse.
Chez des patients atteints de conjonctivite allergique, la biodisponibilité absolue est d’environ 30% après administration oculaire unique de lévocabastine collyre en suspension ; après administration oculaire répétée à raison d’une goutte dans les 2 yeux jusqu’à 4 fois par jour pendant 4 semaines, les taux plasmatiques à l’état d’équilibre sont entre 0,24 et 0,83 ng/mL.
Biotransformation
Après administration orale unique (0,5 mg, 1 mg et 2 mg), la lévocabastine est rapidement et totalement résorbée (Tmax = 2 heures). Après administration orale de 0,5mg de solution de lévocabastine, la biodisponibilité est, en moyenne, de 112%. La demi-vie (35 à 45 heures) n’est pas modifiée après administration répétée.
Élimination
A l’état d’équilibre après 9 jours d’administration orale répétée (0,5mg/jour), les concentrations plasmatiques sont en moyenne de 12,3 ng/mL. L’élimination de la lévocabastine se fait essentiellement par voie rénale, principalement sous forme inchangée.
5.3. Données de sécurité préclinique
L’étude de tolérance chez le lapin avec la formulation de LEVOFREE 0,05% n’a pas révélé de risque particulier pour l’homme après administration 4 fois par jour pendant 4 semaines.
Avant ouverture : 2 ans
Durée de conservation après ouverture : 3 mois
6.4. Précautions particulières de conservation
A conserver à une température ne dépassant pas 25°C.
Pour les conditions de conservation du médicament après première ouverture, voir la rubrique 6.3.
6.5. Nature et contenu de l'emballage extérieur
Flacon en polyéthylène basse densité équipé d’un compte-goutte assurant la conservation antimicrobienne du produit.
Flacon de 5 mL.
Boite avec témoin d’inviolabilité.
6.6. Précautions particulières d’élimination et de manipulation
Pas d’exigences particulières.
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
416 RUE SAMUEL MORSE – CS 99535
34961 MONTPELLIER
FRANCE
[Tel, fax, e-Mail : à compléter ultérieurement par le titulaire]
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 301 459 5 1 : 5 mL en flacon compte-gouttes (PEBD).
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
Date de première autorisation : {JJ mois AAAA}
Date de dernier renouvellement : {JJ mois AAAA}
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
{JJ mois AAAA}
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Médicament non soumis à prescription médicale.
ANSM - Mis à jour le : 05/10/2023
LEVOFREE 0,05 %, collyre en solution
Lévocabastine
Vous devez toujours utiliser ce médicament en suivant scrupuleusement les informations fournies dans cette notice ou par votre médecin, ou votre pharmacien.
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Adressez-vous à votre pharmacien pour tout conseil ou information.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin, ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
· Vous devez vous adresser à votre médecin si vous ne ressentez aucune amélioration ou si vous vous sentez moins bien après 5 jours.
1. Qu'est-ce que LEVOFREE 0,05 %, collyre en solution et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant d'utiliser LEVOFREE 0,05 %, collyre en solution ?
3. Comment utiliser LEVOFREE 0,05 %, collyre en solution ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver LEVOFREE 0,05 %, collyre en solution ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE LEVOFREE 0,05 %, collyre en solution ET DANS QUELS CAS EST-IL UTILISE ?
Classe pharmacothérapeutique : Décongestionnant et antiallergique - Code ATC : S01GX02
Ce médicament est utilisé pour traiter les symptômes d’une allergie au niveau de l’œil (conjonctivite allergique) reconnaissable par des yeux et/ou des paupières gonflées, des yeux rouges, qui démangent ou qui larmoient.
Ce collyre ne contient pas de conservateur.
Vous devez vous adresser à votre médecin si vous ne ressentez aucune amélioration ou si vous vous sentez moins bien après 5 jours.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D’UTILISER LEVOFREE 0,05 %, collyre en solution ?
N’utilisez jamais LEVOFREE 0,05 %, collyre en solution :
· si vous êtes allergique à la lévocabastine ou à l’un des autres composants contenus dans ce médicament, mentionnés dans la rubrique 6.
Avertissements et précautions
Adressez-vous à votre médecin ou pharmacien avant d’utiliser LEVOFREE 0,05 %, collyre en solution.
Enfants
L’utilisation de LEVOFREE 0,05%, collyre en solution n’est pas recommandée chez l’enfant de moins de 6 ans en raison du nombre limité de données.
Autres médicaments et LEVOFREE 0,05 %, collyre en solution
Informez votre médecin ou pharmacien si vous utilisez, avez récemment utilisé ou pourriez utiliser tout autre médicament.
LEVOFREE 0,05 %, collyre en solution avec des aliments, boissons et de l’alcool
Sans objet.
Grossesse, allaitement et fertilité
Si vous êtes enceinte ou que vous allaitez, si vous pensez être enceinte ou planifiez une grossesse, demandez conseil à votre médecin ou pharmacien avant de prendre ce médicament.
Grossesse
L’utilisation de ce médicament est envisageable avec précaution durant la grossesse.
Allaitement
Du fait de l’absence de données, l’utilisation de la lévocabastine n’est pas recommandée au cours de l’allaitement.
Conduite de véhicules et utilisation de machines
Les patients présentant un trouble de la vision (légère irritation suite à l’instillation) doivent s’abstenir de conduire des véhicules ou d’utiliser des machines jusqu’à ce que ces symptômes disparaissent.
LEVOFREE 0,05 %, collyre en solution contient des Phosphates
Ce médicament contient 39,65 mg de phosphates par 5 mL (voir rubrique 4 « quels sont les effets indésirables éventuels ? »).
3. COMMENT UTILISER LEVOFREE 0,05 %, collyre en solution ?
Posologie
La dose recommandée est d’une goutte dans chaque œil, 2 fois par jour. Cette dose peut être augmentée, si nécessaire, à 1 goutte 3 à 4 fois par jour.
Utilisation chez les enfants âgés d’au moins 6 ans et les adolescents : la dose recommandée n’est pas modifiée.
Utilisez le collyre à intervalles réguliers.
Ne dépassez jamais la dose recommandée.
Mode d’administration
Ce médicament doit être administré au niveau de l’œil. Il ne doit en aucun cas être injecté.
Lors de l’utilisation de ce collyre, vous devez vous laver soigneusement les mains avant d’ouvrir le flacon et respecter les étapes suivantes :
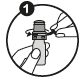
A. Avant la première utilisation
|
|
1. Enlevez la bague de sécurité. |
|
|
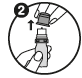
2. Otez le bouchon protecteur. |
|
|
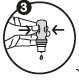
3. Tenez le flacon tête en bas Appuyez sur le milieu du flacon suffisamment fort de façon à extraire 1 à 2 gouttes. |
|
|
|
|
|
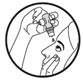
1. En regardant vers le haut et en tirant la paupière inférieure vers le bas, positionnez le flacon au-dessus de l’œil et appuyez progressivement sur le milieu du flacon jusqu’à l’arrivée de la goutte. Evitez de toucher l’œil ou la paupière avec l’embout du flacon. |
|
|
2. Clignez des yeux une fois afin que le collyre se répartisse sur toute la surface de l’œil. L’œil fermé, essuyez proprement l’excédent. |
|
|
3. Afin d’éviter les effets généraux, il est recommandé de comprimer l’angle interne de l’œil pendant 1 minute après chaque instillation en maintenant l’œil fermé. |
|
|
4. Replacez le bouchon protecteur après usage. |
|
|
En cas de défaut d’apparition de la goutte, reprenez les étapes A2et A3. |
En cas de traitement concomitant par un autre collyre, espacez de 15 minutes les instillations.
Durée du traitement
Le traitement ne devra pas être prolongé au-delà de 5 jours sans avis médical.
Si vous ne ressentez pas d’amélioration ou si vos symptômes persistent, vous devez consulter votre médecin.
Si vous avez utilisé plus de LEVOFREE 0,05 %, collyre en solution que vous n’auriez dû :
En cas de surdosage, un endormissement peut être ressenti. Rincez abondamment au sérum physiologique. Et poursuivez simplement votre traitement à l’instillation suivante.
Si vous oubliez d’utiliser LEVOFREE 0,05 %, collyre en solution :
Ne prenez pas de dose double pour compenser la dose que vous avez oubliée de prendre ; Mais poursuivez simplement votre traitement.
Si vous arrêtez d’utiliser LEVOFREE 0,05 %, collyre en solution :
Sans objet.
Si vous avez d’autres questions sur l’utilisation de ce médicament, demandez plus d’informations à votre médecin ou votre pharmacien.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Les affections fréquemment observées (pouvant affecter jusqu’à 1 personne sur 10) sont :
· Douleur de l’œil, vision floue, sensation de brûlure, de picotement, irritation oculaire
Les affections peu fréquemment observées (pouvant affecter jusqu’à 1 personne sur 100) sont :
· Gonflement (œdème) des paupières
Les affections très rarement observées (pouvant affecter jusqu’à 1 personne sur 10 000) sont :
· Conjonctivite, gonflement des yeux et inflammation des paupières, rougeur de l’œil, larmoiement des yeux, et démangeaisons des yeux ;
· Eruption, rougeur de la peau, réaction allergique systémique pouvant être grave et se manifester par un brusque gonflement du visage et du cou ou par un malaise brutal avec chute de la pression artérielle et difficultés respiratoires. Dans ce cas, il faut immédiatement arrêter le traitement et avertir votre médecin.
· Maux de tête ;
· Palpitations.
Si vous présentez des dommages sévères de la cornée (couche transparente située à l’avant de l’œil) les phosphates peuvent causer, dans de très rares cas, des troubles de la vision en raison de l’accumulation de calcium pendant le traitement (nuage) (voir rubrique 2 « Avertissements et précautions »).
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : www.signalement-sante.gouv.fr
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER LEVOFREE 0,05 %, collyre en solution ?
Tenir ce médicament hors de la vue et de la portée des enfants.
N’utilisez pas ce médicament après la date de péremption indiquée sur le flacon après EXP. La date de péremption fait référence au dernier jour de ce mois. Notez la date d’ouverture en clair sur l’emballage.
A conserver à une température ne dépassant pas 25°C.
Durée de conservation après ouverture : 3 mois.
N’utilisez pas ce médicament si vous remarquez des signes visibles de détérioration.
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient LEVOFREE 0,05 %, collyre en solution
· La substance active est :
Lévocabastine.................................................................................................................. 0,05 g
sous forme de chlorhydrate de lévocabastine
Pour 100 mL de solution
· Les autres composants sont :
Hydroxypropylbétadex, phosphate monosodique dihydraté, phosphate disodique dodécahydraté, chlorure de sodium, eau purifiée.
Qu’est-ce que LEVOFREE 0,05 %, collyre en solution et contenu de l’emballage extérieur
Ce médicament se présente sous forme de collyre en solution. Chaque boîte contient 1 flacon de 5 mL.
Titulaire de l’autorisation de mise sur le marché
416 RUE SAMUEL MORSE – CS 99535
34961 MONTPELLIER
FRANCE
Exploitant de l’autorisation de mise sur le marché
LABORATOIRE CHAUVIN
416 RUE SAMUEL MORSE – CS 99535
34961 MONTPELLIER
FRANCE
ZONE INDUSTRIELLE DE RIPOTIER
50 AVENUE JEAN MONNET
07200 AUBENAS
FRANCE
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Sans objet.
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
{mois AAAA}.
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).
Conseil d’éducation sanitaire :
a) Qu’appelle-t-on allergie, qu’est-ce qu’une réaction allergique ?
L’allergie est une réaction excessive de notre organisme vis à vis de substances qu’il considère comme nocives, les allergènes. Les allergènes sont les facteurs et substances déclenchant l’allergie et les troubles qui y sont associés.
Au cours de contacts répétés et intensifs de notre organisme avec l’allergène, une réaction allergique se déclenche.
La réaction allergique désigne l’ensemble des symptômes apparaissant quelques minutes ou quelques heures après l’exposition aux allergènes. Ces allergènes sont issus de plantes, de poils d’animaux, d’aliments, d’acariens, de moisissures ou sont des substances d’origine professionnelle.
Cette réaction allergique provoque la libération dans l’organisme de substances telles que l’histamine responsable des troubles ressentis.
Comme pour toute maladie de nature allergique, il est important de consulter un médecin au moins une fois. IL DETERMINERA NOTAMMENT LA NECESSITE D’EFFECTUER UN BILAN ALLERGOLOGIQUE.
b) Comment reconnaître une conjonctivite allergique ?
Une rougeur de l’œil et de l’intérieur des paupières accompagnée de démangeaisons, gonflement et larmoiement de l’œil sont les signes d’une conjonctivite allergique.
Cette affection accompagne souvent la rhinite allergique (éternuements, écoulement nasal, nez bouché) car elles sont déclenchées par les mêmes allergènes (pollens, acariens, poils d’animaux ).
c) Quelques conseils pratiques
· Ne vous frottez pas les yeux, même s’ils vous démangent car, après un soulagement passager, ce frottement ne peut qu’aggraver la situation.
· Rincez doucement vos yeux à l’eau claire ou avec une solution stérile de lavage pour éliminer le pollen et ainsi vous soulager.
· Supprimez provisoirement le maquillage. La guérison de la conjonctivite ou la réapparition lors d’une nouvelle application peut permettre éventuellement d’identifier la substance responsable. La présence d’une allergie oculaire doit conduire à être vigilant dans le choix de ses cosmétiques.
· Si vous portez des lentilles de contact, mieux vaut les retirer pendant toute la durée du traitement par un collyre.
d) En cas de douleur oculaire aiguë, sensation de baisse de la vision ou de flou visuel, consultez votre médecin.
e) Prévention des récidives
Faire disparaître l’allergène (l’éviction) est la mesure de choix pour supprimer ou réduire les symptômes de l’allergie.
Pour les allergènes de maison : il est indispensable de prendre des mesures pour réduire la présence d’allergènes :
· Le matelas devra être totalement entouré d’une housse plastique anti-acariens ainsi que les oreillers. Le sommier, sauf s’il est en lattes ou en métal, devra être entouré d’un plastique. Toute la literie devra être lavée deux fois par mois à 60°C si possible.
· La chambre doit être aérée et nettoyée régulièrement.
· Sur le sol, on évitera les descentes de lit et les moquettes.
· Evitez les animaux domestiques.
· Pendant la saison pollinique, il est possible de diminuer l’exposition aux pollens.
· Dans votre jardin, diversifiez les plantations en évitant les espèces les plus allergisantes (cyprès, thuyas, bouleaux )
· Evitez de tondre vous-même le gazon pendant la saison pollinique.
· Jardinez de préférence avec des lunettes et un masque de protection.