Dernière mise à jour le 01/12/2025
NEBIVOLOL VIATRIS 5 mg, comprimé quadrisécable
Indications thérapeutiques
Classe pharmacothérapeutique : bêtabloquant sélectif - code ATC : C07AB12.
NEBIVOLOL VIATRIS contient du nébivolol, un médicament du système cardiovasculaire appartenant à la classe des bêtabloquants sélectifs (qui ont une action sélective sur le système cardiovasculaire). Il empêche l'augmentation de la fréquence cardiaque et contrôle la force de pompage du cœur. Il exerce également une action de dilatation au niveau des vaisseaux sanguins, contribuant également à abaisser la pression artérielle.
Ce médicament est préconisé dans le traitement de l'hypertension artérielle essentielle (ou pression artérielle élevée).
NEBIVOLOL VIATRIS est également utilisé dans le traitement de l'insuffisance cardiaque chronique légère et modérée chez des patients âgés de 70 ans ou plus, en association à d'autres traitements.
Présentations
> plaquette(s) PVC polyéthylène PVDC aluminium de 30 comprimé(s)
Code CIP : 34009 300 383 9 0
Déclaration de commercialisation : 22/09/2017
Cette présentation est agréée aux collectivités
- Prix hors honoraire de dispensation : 3,72 €
- Honoraire de dispensation : 1,02 €
- Prix honoraire compris : 4,74 €
- Taux de remboursement :65%
> plaquette(s) PVC polyéthylène PVDC aluminium de 90 comprimé(s)
Code CIP : 34009 300 384 2 0
Déclaration de commercialisation : 31/07/2017
Cette présentation est agréée aux collectivités
- Prix hors honoraire de dispensation : 10,35 €
- Honoraire de dispensation : 2,76 €
- Prix honoraire compris : 13,11 €
- Taux de remboursement :65%
Service médical rendu (SMR)
Amélioration du service médical rendu (ASMR)
Ce médicament étant un générique, l'ASMR n'a pas été évalué par la commission de la transparence (CT), il est possible de se référer à la /aux spécialité(s) de référence du groupe générique auquel appartient ce médicament (cliquez ici pour aller à la rubrique des groupes génériques)
ANSM - Mis à jour le : 18/02/2025
NEBIVOLOL VIATRIS 5 mg, comprimé quadrisécable
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Nébivolol................................................................................................................................. 5 mg
Sous forme de chlorhydrate de nébivolol.............................................................................. 5,45 mg
Excipients à effet notoire : lactose monohydraté.
Pour la liste complète des excipients, voir rubrique 6.1.
Comprimés blancs, ronds biconvexe, quadrisécables et gravés « N5 ».
Le comprimé peut être divisé en doses égales.
4.1. Indications thérapeutiques
Traitement de l'hypertension artérielle essentielle.
Insuffisance cardiaque chronique
Traitement de l'insuffisance cardiaque chronique stable, légère et modérée, en association aux traitements conventionnels chez des patients âgés de 70 ans ou plus.
4.2. Posologie et mode d'administration
Posologie
Hypertension
La posologie est d'un comprimé par jour (5 mg), de préférence au même moment de la journée.
L'effet antihypertenseur se manifeste après 1 à 2 semaines de traitement.
Parfois, l'effet optimal est obtenu seulement après 4 semaines.
Association à d'autres antihypertenseurs
Les bêtabloquants peuvent être administrés seuls ou en association à d'autres traitements antihypertenseurs. A ce jour, une majoration de l'effet antihypertenseur n'a été observée que lors de l'association de NEBIVOLOL VIATRIS avec 12,5 mg à 25 mg d'hydrochlorothiazide.
Insuffisants rénaux
La dose initiale recommandée est de 2,5 mg par jour. Si nécessaire, la dose journalière peut être augmentée à 5 mg par jour.
Insuffisants hépatiques
L'expérience étant limitée en cas d'insuffisance hépatique ou d'altération de la fonction hépatique, l'utilisation de NEBIVOLOL VIATRIS est contre-indiquée chez ces patients.
Sujets âgés
Chez les sujets âgés de plus de 65 ans, la dose initiale recommandée est de 2,5 mg par jour. Si nécessaire, la dose journalière peut être augmentée à 5 mg par jour. Cependant du fait de l'expérience limitée chez les patients de plus de 75 ans, la prudence s'impose et une surveillance étroite doit être assurée.
Population pédiatrique
La sécurité et l’efficacité de NEBIVOLOL VIATRIS chez les enfants et les adolescents âgés de moins de 18 ans n’ont pas été établies. Aucune donnée n’est disponible. L’utilisation chez les enfants et les adolescents n'est donc pas recommandée.
Insuffisance cardiaque chronique
Le traitement de l'insuffisance cardiaque chronique stable doit être débuté par une phase de titration jusqu'à l'atteinte de la dose d'entretien optimale individuelle.
Les patients doivent présenter une insuffisance cardiaque chronique stable, sans épisode aigu au cours des 6 dernières semaines. Il est recommandé que le traitement soit assuré par un médecin ayant l'expérience de la prise en charge de patients atteints d'insuffisance cardiaque chronique.
Chez les patients recevant un traitement conventionnel incluant diurétiques et/ou digoxine et/ou inhibiteurs de l'enzyme de conversion et/ou antagonistes de l'angiotensine II, la posologie de ces médicaments devra être stabilisée durant les 2 semaines précédant l'initiation du traitement par NEBIVOLOL VIATRIS.
La phase initiale de titration doit être réalisée selon le schéma suivant à intervalles de 1 à 2 semaines en fonction de la tolérance :
· 1,25 mg une fois par jour pendant 1 à 2 semaines. Si le traitement est bien toléré augmenter à :
· 2,5 mg une fois par jour pendant 1 à 2 semaines. Si le traitement est bien toléré augmenter à :
· 5 mg une fois par jour pendant 1 à 2 semaines. Si le traitement est bien toléré augmenter à :
· 10 mg une fois par jour.
La dose maximale recommandée est de 10 mg une fois par jour.
L'initiation du traitement et les augmentations successives de la dose devront être réalisées par un médecin ayant l'expérience de la prise en charge de patients atteints d'insuffisance cardiaque chronique, sur une période d'au moins 2 heures afin de s'assurer que l'état clinique du patient demeure stable (en particulier au regard de la pression artérielle, de la fréquence cardiaque, des troubles de la conduction, des signes d'aggravation de l'insuffisance cardiaque).
La dose maximale recommandée peut ne pas être atteinte chez tous les patients du fait de la survenue d'évènements indésirables. Si nécessaire, la dose atteinte peut être diminuée progressivement puis réinstaurée conformément au schéma posologique.
Pendant la phase de titration, en cas d'aggravation de l'insuffisance cardiaque ou de manifestation d'intolérance au traitement, il est recommandé en premier lieu de diminuer la dose de nébivolol, voire d'arrêter le traitement immédiatement si nécessaire (en cas d'hypotension sévère, d'aggravation de l'insuffisance cardiaque accompagnée d'œdème pulmonaire aigu, de choc cardiogénique, de bradycardie symptomatique ou de bloc auriculo-ventriculaire).
Le traitement de l'insuffisance cardiaque chronique stable par le nébivolol est habituellement un traitement au long cours. Le traitement par nébivolol ne doit pas être interrompu brutalement sous peine d'induire une aggravation transitoire de l'insuffisance cardiaque. Si l'arrêt du traitement est nécessaire, la posologie doit être diminuée progressivement, en la divisant de moitié chaque semaine.
Insuffisants rénaux
Chez les sujets ayant une insuffisance rénale légère à modérée, aucun ajustement posologique n'est nécessaire étant donné que la phase de titration pour atteindre la dose maximale tolérée est individuellement ajustée.
En l'absence de données, l'utilisation du nébivolol chez les patients atteints d'une insuffisance rénale sévère (créatininémie ≥ 250 µmol/L) n'est pas recommandée.
Insuffisants hépatiques
Les données étant limitées chez l'insuffisant hépatique, l'utilisation du nébivolol chez ces patients est contre-indiquée.
Sujets âgés
Chez les sujets âgés, aucun ajustement posologique n'est nécessaire étant donné que la phase de titration pour atteindre la dose maximale tolérée est individuellement ajustée.
Population pédiatrique
La sécurité et l’efficacité de NEBIVOLOL VIATRIS chez les enfants et les adolescents âgés de moins de 18 ans n’ont pas été établies. L’utilisation chez les enfants et les adolescents n'est donc pas recommandée. Aucune donnée n’est disponible.
Mode d’administration
Voie orale.
Les comprimés peuvent être pris avec les repas.
· Hypersensibilité à la substance active ou à l'un des excipients mentionnés à la rubrique 6.1.
· Insuffisance hépatique ou altération de la fonction hépatique.
· Insuffisance cardiaque aiguë, choc cardiogénique ou épisodes de décompensation de l'insuffisance cardiaque nécessitant un traitement inotrope intraveineux.
De plus, comme pour d'autres bêtabloquants, NEBIVOLOL VIATRIS est contre-indiqué dans les cas suivants :
· maladie du sinus incluant bloc sino-auriculaire ;
· blocs auriculo-ventriculaires des second et troisième degrés (non appareillés) ;
· antécédents de bronchospasme et d'asthme bronchique ;
· phéochromocytome non traité ;
· acidose métabolique ;
· bradycardie (fréquence cardiaque < 60 battements par minute avant le début du traitement) ;
· hypotension (pression artérielle systolique < 90 mmHg) ;
· troubles circulatoires périphériques dans leurs formes sévères.
4.4. Mises en garde spéciales et précautions d'emploi
Les mises en garde et précautions suivantes sont communes aux bêtabloquants :
Anesthésie générale
· La poursuite du traitement par bêtabloquant diminue le risque d'arythmie pendant l'induction et l'intubation. Si le traitement par bêtabloquant est arrêté en vue d'une intervention, il sera suspendu pour au moins 24 heures avant. Il convient d'observer une prudence particulière avec certains anesthésiques dépresseurs myocardiques. Le patient peut être protégé d'une prédominance vagale par l'administration d'atropine par voie intraveineuse.
Cardiovasculaires
· Généralement, les bêtabloquants ne doivent pas être utilisés chez les patients présentant une insuffisance cardiaque congestive non traitée, à moins qu'elle ne soit stabilisée.
· Chez les patients présentant une cardiopathie ischémique, le traitement par bêtabloquant devra être diminué progressivement c'est-à-dire sur 1 à 2 semaines. Si nécessaire, un traitement substitutif devra être commencé en même temps pour éviter une aggravation de l'angor.
· Les bêtabloquants peuvent induire une bradycardie ; si la fréquence s'abaisse au-dessous de 50-55 battements par minute au repos et/ou que les patients présentent des symptômes suggérant une bradycardie, la posologie devra être diminuée.
· Les bêtabloquants doivent être administrés avec prudence :
o chez les patients souffrant de troubles circulatoires périphériques (maladie ou syndrome de Raynaud, claudication intermittente), une aggravation de ces troubles pouvant apparaître,
o chez les patients présentant un bloc auriculo-ventriculaire du premier degré, en raison de leur effet dromotrope négatif,
o chez les patients souffrant d'un angor de Prinzmetal: les bêtabloquants peuvent augmenter le nombre et la durée des crises.
· L'association du nébivolol avec les antagonistes calciques du type vérapamil ou diltiazem, avec les anti-arythmiques de classe I, et avec les anti-hypertenseurs d'action centrale n'est en général pas recommandée (pour plus d'information, se référer à la rubrique 4.5).
Métaboliques/endocriniennes
· Le nébivolol n’affecte pas les taux de glucose chez les patients diabétiques. Cependant, il faut prêter attention chez les patients diabétiques, car le nébivolol peut cacher certains symptômes d’hypoglycémie (tachycardie, palpitations). Les bêta-bloquants pourraient de surcroît augmenter le risque d’une hypoglycémie sévère, quand ils sont utilisés en concomitance avec les sulfonylurées. Les patients diabétiques doivent être informés qu’ils doivent suivre attentivement leurs taux de glucose dans le sang. (voir rubrique 4.5).
· En cas d'hyperthyroïdie, les antagonistes bêta-adrénergiques peuvent masquer l'apparition d'une tachycardie. Un arrêt brusque du traitement peut intensifier les symptômes.
Respiratoires
· Les bêtabloquants doivent être administrés avec prudence chez les patients présentant une broncho-pneumopathie chronique obstructive, car ils peuvent aggraver la constriction des voies aériennes.
Autres
· L'administration de bêtabloquants mérite d'être pesée chez les patients ayant des antécédents de psoriasis.
· Les bêtabloquants peuvent accroître la sensibilité vis-à-vis des allergènes et la gravité des réactions anaphylactiques.
· L'initiation du traitement de l'insuffisance cardiaque chronique par le nébivolol nécessite une surveillance régulière. Pour la posologie et le mode d'administration, se référer à la rubrique 4.2. Le traitement ne doit pas être interrompu brutalement, sauf indication formelle (pour plus d'information, se référer à la rubrique 4.2).
Excipients
Ce médicament contient du lactose. Les patients présentant une intolérance au galactose, un déficit total en lactase ou un syndrome de malabsorption du glucose et du galactose (maladies héréditaires rares) ne doivent pas prendre ce médicament.
Ce médicament contient moins de 1 mmol (23 mg) de sodium par comprimé, c.-à-d. qu’il est essentiellement « sans sodium ».
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Interactions pharmacodynamiques
Les interactions suivantes sont communes aux bêtabloquants :
Associations déconseillées
+ Anti-arythmiques de classe I (quinidine, hydroquinidine, cibenzoline, flecaïnide, disopyramide, lidocaïne, mexilétine, propafénone)
Potentialisation de l'effet sur le temps de conduction auriculo-ventriculaire et augmentation de l'effet inotrope négatif (voir rubrique 4.4).
+ Antagonistes calciques du type vérapamil ou diltiazem
Effet négatif sur la contractilité et la conduction auriculo-ventriculaire. L'administration de vérapamil par voie IV chez les patients traités par bêtabloquants peut induire une hypotension sévère et un bloc auriculo-ventriculaire (voir rubrique 4.4).
+ Anti-hypertenseurs d'action centrale (clonidine, guanfacine, moxonidine, méthyldopa, rilménidine)
L'utilisation concomitante d'antihypertenseurs d'action centrale peut aggraver l'insuffisance cardiaque par diminution du tonus central sympathique (réduction de la fréquence et du débit cardiaque, vasodilatation) (voir rubrique 4.4). Il existe un risque accru d’« hypertension rebond » en cas d'arrêt brutal du traitement par anti-hypertenseur central, en particulier s'il a lieu avant l'arrêt du bêtabloquant.
Associations faisant l'objet de précautions d’emploi
+ Anti-arythmiques de classe III (amiodarone)
Potentialisation de l'effet sur le temps de conduction auriculo-ventriculaire.
+ Anesthésiques volatiles halogénés
L'administration concomitante de bêtabloquants et d'anesthésiques peut réduire la tachycardie réflexe et augmenter le risque d'hypotension (voir rubrique 4.4). En règle générale, il convient d'éviter l'arrêt brutal d'un traitement par bêtabloquant.
Il convient d'avertir l'anesthésiste lorsque le patient est traité par NEBIVOLOL VIATRIS.
+ Insuline et antidiabétiques oraux
Bien que le nébivolol n'affecte pas les taux de glucose, l’utilisation concomitante peut cacher certains symptômes d’hypoglycémie (palpitations, tachycardie). L’utilisation concomitante de bêta‑bloquants avec des sulfonylurées pourrait augmenter le risque d’une hypoglycémie sévère (voir rubrique 4.4).
+ Baclofène (antispastique), amifostine (adjuvant antinéoplasique)
L'utilisation concomitante de baclofène ou d'amifostine et d'antihypertenseurs peut augmenter la chute de la pression artérielle. Par conséquent, la posologie de l'antihypertenseur devra être adaptée.
Associations à prendre en compte
+ Digitaliques
L'utilisation concomitante de digitaliques peut augmenter le temps de conduction auriculo-ventriculaire. Les études cliniques conduites avec le nébivolol n'ont pas mis en évidence de manifestation clinique d'une interaction. Le nébivolol n'influe pas la cinétique de la digoxine.
+ Antagonistes calciques du type dihydropyridine (amlodipine, félodipine, lacidipine, nifédipine, nicardipine, nimodipine, nitrendipine)
L'utilisation concomitante d'antagonistes calciques peut augmenter le risque d'hypotension, et l'augmentation du risque de détérioration de la fonction ventriculaire chez les patients ayant une insuffisance cardiaque ne peut être exclue.
+ Antipsychotiques, antidépresseurs (tricycliques, barbituriques et phénothiazines)
L'utilisation concomitante d'antipsychotiques ou d'antidépresseurs peut augmenter l'effet hypotenseur des bêtabloquants (effet additif).
+ Anti-inflammatoires non stéroïdiens (AINS)
Il n'y a pas d'interaction avec l'effet anti-hypertenseur du nébivolol.
+ Agents sympathomimétiques
L'utilisation concomitante d'agents sympathomimétiques peut neutraliser l'effet des antagonistes bêta-adrénergiques. Les agents bêta-adrénergiques peuvent contribuer à la potentialisation de l'activité alpha-adrénergique des agents sympathomimétiques par des effets alpha et bêta-adrénergiques (risques d'hypertension, de bradycardie sévère et de bloc cardiaque).
Interactions pharmacocinétiques
Le métabolisme du nébivolol impliquant l'isoenzyme CYP2D6, l'administration concomitante d'inhibiteurs de cette isoenzyme telles la paroxétine, la fluoxétine, la thioridazine et la quinidine peut augmenter les taux plasmatiques de nébivolol, augmenter le risque de bradycardie excessive et d'évènements indésirables.
La co-administration de cimétidine a augmenté les taux plasmatiques de nébivolol sans modifier l'effet clinique. La co-administration de ranitidine n'a pas affecté la pharmacocinétique du nébivolol. La co-prescription de nébivolol et d'anti-acide est possible sous réserve que NEBIVOLOL VIATRIS soit administré pendant le repas et l'anti-acide entre les repas.
L'association du nébivolol à la nicardipine augmente légèrement les taux plasmatiques des deux produits sans changer les effets cliniques. L'administration concomitante d'alcool, de furosémide ou d'hydrochlorothiazide n'influence pas la pharmacocinétique du nébivolol.
Le nébivolol ne modifie pas la pharmacocinétique ni la pharmacodynamie de la warfarine.
4.6. Fertilité, grossesse et allaitement
Grossesse
Le nébivolol possède des propriétés pharmacologiques susceptibles d'entraîner des effets nocifs sur la grossesse et/ou le fœtus/nouveau-né. D'une manière générale, les bêtabloquants diminuent la perfusion placentaire ; cet effet a été associé à des retards de croissance, des morts intra-utérines, des avortements ou un travail précoce. Des effets indésirables (par exemple hypoglycémie, bradycardie) peuvent survenir chez le fœtus et le nouveau-né. Si un traitement par bêtabloquants est nécessaire, il faut préférer un bêtabloquant bêta-1 sélectif. Le nébivolol ne doit pas être utilisé pendant la grossesse sauf en cas de nécessité. Si un traitement par le nébivolol s'avère nécessaire, le flux sanguin utéroplacentaire et la croissance fœtale doivent être surveillés.
En cas d'effets nocifs sur la grossesse ou sur le fœtus, il faut envisager de mettre en route un autre traitement. Le nouveau-né doit faire l'objet d'une surveillance étroite. Les symptômes d'hypoglycémie et de bradycardie surviennent généralement au cours des 3 premiers jours de la vie.
Allaitement
Les études menées chez l'animal ont montré que le nébivolol est excrété dans le lait maternel. Toutefois, l'excrétion du nébivolol dans le lait maternel chez la femme n'est pas connue. La plupart des bêtabloquants, en particulier les composés lipophiles comme le nébivolol et ses métabolites actifs, passent dans le lait maternel encore que l'importance soit variable. Un risque pour les nouveau-nés/nourrissons ne peut être exclu. Aussi, les mères recevant du nébivolol ne doivent pas allaiter.
Fertilité
Le nébivolol n'a pas de conséquence sur la fertilité du rat, sauf à des doses plusieurs fois supérieures à la dose maximale recommandée chez l'homme où des effets indésirables sur les organes reproducteurs mâles et femelles ont été observés chez le rat et la souris. L'effet du nébivolol sur la fertilité humaine est inconnu.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Les effets indésirables sont listés respectivement dans l'hypertension artérielle et dans l'insuffisance cardiaque chronique, compte-tenu des différences entre les pathologies.
Hypertension
Les effets indésirables rapportés, qui sont dans la majorité des cas d'intensité faible à modérée, se trouvent dans le tableau ci-dessous, classés par type d'organes et par ordre de fréquence :
|
Classification par systèmes-organes |
Fréquent |
Peu fréquent |
Très rare |
Indéterminée |
|
Affections du système immunitaire |
Œdème angioneurotique, hypersensibilité |
|||
|
Affections psychiatriques |
Cauchemars, |
|||
|
Affections du Système nerveux |
Céphalées, étourdissements, paresthésie |
Syncope |
||
|
Affections oculaires |
Altération de la vision |
|||
|
Affections cardiaques |
Bradycardie, insuffisance cardiaque, ralentissement de la conduction auriculo- ventriculaire, bloc auriculo-ventriculaire |
|||
|
Affections vasculaires |
Hypotension, (augmentation d'une claudication intermittente) |
|||
|
Affections respiratoires, thoraciques et médiastinales. |
Dyspnée |
Bronchospasme |
||
|
Affections gastro-intestinales |
Constipation, nausées, diarrhée |
Dyspepsie, flatulence, vomissements |
||
|
Affections de la peau et du tissu sous-cutané |
Prurit, rash érythémateux |
Aggravation d'un psoriasis. |
Urticaire |
|
|
Affections des organes de reproduction et du sein |
Impuissance |
|||
|
Troubles généraux et anomalies au site d'administration |
Fatigue, œdème |
Les effets indésirables suivants ont été également observés avec certains bêtabloquants : hallucinations, psychoses, confusion, refroidissement et cyanose des extrémités, syndrome de Raynaud, sécheresse oculaire, syndrome oculo-muco-cutané de type practolol.
Insuffisance cardiaque chronique
Les données de tolérance chez les patients atteints d'insuffisance cardiaque chronique sont issues d'une étude clinique, contrôlée versus placebo ayant inclus 1067 patients dans le groupe nébivolol et 1061 patients dans le groupe placebo. Dans cette étude, 449 patients (42,1 %) du groupe nébivolol et 334 patients (31,5 %) du groupe placebo ont rapporté des effets indésirables dont la relation avec le traitement était au moins possible. Les effets indésirables les plus fréquemment rapportés chez les patients sous nébivolol étaient la bradycardie et des étourdissements, survenant chacun chez 11 % des patients. Chez les patients sous placebo, la fréquence de ces effets était de 2 % et 7 %, respectivement.
Les événements indésirables (ayant une relation avec le traitement au moins possible) considérés comme particulièrement pertinents dans le traitement de l'insuffisance cardiaque chronique ont été rapportés avec les fréquences suivantes :
· une aggravation de l'insuffisance cardiaque est survenue chez 5,8 % des patients sous nébivolol et chez 5,2 % des patients sous placebo ;
· une hypotension orthostatique a été rapportée chez 2,1 % des patients sous nébivolol et chez 1,0 % des patients sous placebo ;
· une intolérance au traitement est survenue chez 1,6 % des patients sous nébivolol et chez 0,8 % des patients sous placebo ;
· un bloc auriculo-ventriculaire du 1er degré est survenu chez 1,4 % des patients sous nébivolol et 0,9 % des patients sous placebo ;
· des œdèmes des membres inférieurs ont été rapportés chez 1,0 % des patients sous nébivolol et 0,2 % des patients sous placebo.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/.
Il n'y a pas de données actuellement disponibles sur le surdosage par NEBIVOLOL VIATRIS.
Symptômes
Les symptômes de surdosage avec les bêtabloquants sont : bradycardie, hypotension, bronchospasme et insuffisance cardiaque aiguë.
Traitement
En cas de surdosage ou en cas d'hypersensibilité, le patient doit être placé sous surveillance stricte en unité de soins intensifs.
La glycémie sera mesurée. L'absorption de tout résidu de médicament encore présent dans le tractus gastro-intestinal peut être évitée par lavage gastrique, administration de charbon actif et d'un laxatif.
La respiration artificielle peut être nécessaire. La bradycardie et les réactions vagales importantes peuvent être traitées par l'administration d'atropine ou de méthylatropine. Hypotension et choc peuvent être traités par l'administration de plasma ou de substituts du plasma et si nécessaire par des catécholamines.
L'effet bêtabloquant peut être neutralisé par des injections intraveineuses lentes de chlorhydrate d'isoprénaline en démarrant avec une posologie approximative de 5 µg/minute, ou de dobutamine en démarrant avec une posologie de 2,5 µg/minute jusqu'à ce que l'effet souhaité soit obtenu.
Dans les cas réfractaires, l'isoprénaline peut être associée à la dopamine. Si cette association ne produit pas l'effet souhaité, une administration intraveineuse de glucagon pourra être envisagée à raison de 50-100 µg/kg.
Si nécessaire, l'injection pourra être répétée dans l'heure et être suivie - si nécessaire - par une perfusion intraveineuse de glucagon à raison de 70 µg/kg/h. Dans les cas extrêmes de résistance de la bradycardie au traitement, un pacemaker pourra être mis en place.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Classe pharmacothérapeutique : bêtabloquant, sélectif, code ATC : C07AB12.
Le nébivolol est un racémique de deux énantiomères, SRRR-nébivolol (ou d-nébivolol) et RSSS‑nébivolol (ou l-nébivolol).
Effets pharmacodynamiques
Il combine 2 activités pharmacologiques :
· c'est un antagoniste sélectif et compétitif des récepteurs bêta 1 : cette activité est attribuée au SRRR-énantiomère (énantiomère d) ;
· il possède des propriétés vasodilatatrices modérées, dues à une interaction avec la voie L‑arginine/oxyde nitrique.
En dose unique ou répétée, le nébivolol réduit la fréquence cardiaque et la pression artérielle au repos et durant l'effort, tant chez les sujets normotendus que chez les patients hypertendus. L'effet anti‑hypertenseur est maintenu au cours des traitements chroniques.
Aux doses thérapeutiques, le nébivolol est dépourvu d'antagonisme alpha-adrénergique.
Au cours d'un traitement aigu ou chronique par nébivolol chez les patients hypertendus, les résistances vasculaires systémiques sont diminuées. Malgré la diminution de la fréquence cardiaque, la réduction du débit cardiaque au repos et à l'effort peut être limitée du fait de l'augmentation du volume d'éjection systolique. La pertinence clinique de ces différences hémodynamiques, comparativement aux autres antagonistes des récepteurs bêta 1, n'a pas été complètement établie.
Chez les hypertendus, le nébivolol accroît la réponse vasculaire à l'acetylcholine (Ach) médié par le NO qui est diminuée chez les patients présentant un dysfonctionnement endothélial.
Efficacité et sécurité clinique
Dans une étude de morbi-mortalité, contrôlée versus placebo, réalisée chez 2128 patients âgés ≥ 70 ans (âge médian 75,2 ans) atteints d'insuffisance cardiaque chronique stable, avec ou sans altération de la fraction d'éjection ventriculaire gauche (FEVG moyenne: 36 ± 12,3 %, avec la répartition suivante: FEVG inférieure à 35 % chez 56% des patients, FEVG comprise entre 35 % et 45 % chez 25 % des patients et FEVG supérieure à 45 % chez 19 % des patients) suivis pendant une durée moyenne de 20 mois, le nébivolol, en addition au traitement conventionnel, a augmenté de façon significative le délai de survenue de décès ou d'hospitalisations pour causes cardiovasculaires (critère principal d'efficacité) avec une réduction relative du risque de 14 % (réduction absolue: 4,2 %). Cette réduction du risque s'est manifestée 6 mois après l'initiation du traitement et s'est maintenue pendant toute la durée du traitement (durée médiane : 18 mois). L'efficacité du nébivolol était indépendante de l'âge, du sexe, ou de la fraction d'éjection ventriculaire gauche de la population de l'étude. Le bénéfice sur la mortalité toutes causes confondues n'a pas atteint le seuil de significativité, comparativement au placebo (réduction absolue : 2,3 %). Une diminution des morts subites a été observée chez les patients traités par nébivolol (4,1 % versus 6,6 %, réduction relative de 38 %).
Les données expérimentales obtenues in vitro et in vivo chez l'animal ont montré que le nébivolol n'a pas d'activité sympathomimétique intrinsèque.
Les données expérimentales obtenues in vitro et in vivo chez l'animal ont montré qu'aux doses pharmacologiques, le nébivolol n'a pas d'effet stabilisant de membrane.
Chez les volontaires sains, le nébivolol n'a pas d'effet significatif sur la capacité d'effort maximale ni sur la durée de résistance à l'effort.
Les données pré-cliniques et cliniques disponibles chez les patients hypertendus ont montré que le nébivolol n’a pas d’effet délétère sur la fonction érectile.
5.2. Propriétés pharmacocinétiques
Les deux énantiomères du nébivolol sont rapidement absorbés après administration orale. L'absorption du nébivolol n'est pas influencée par la nourriture ; le nébivolol peut être administré pendant ou en dehors des repas.
Biotransformation
Le nébivolol est largement métabolisé, en partie en métabolites actifs hydroxylés.
Le nébivolol est métabolisé par hydroxylation alicyclique et aromatique, N-déalkylation et glucuronidation, avec de surcroît, formation de glucuronides avec les métabolites hydroxylés.
Le métabolisme du nébivolol par hydroxylation aromatique est soumis au polymorphisme génétique oxydatif d'expression de l'isoenzyme CYP2D6.
Par voie orale, la biodisponibilité du nébivolol est d'environ 12 % chez les métaboliseurs rapides et est pratiquement complète chez les métaboliseurs lents. A l'état d'équilibre et à dose égale, le pic des concentrations plasmatiques du nébivolol inchangé est environ 23 fois plus élevé chez les métaboliseurs lents que chez les métaboliseurs rapides.
Lorsque l'ensemble, produit inchangé et métabolites actifs, est pris en compte, les niveaux des concentrations au pic plasmatique ne diffèrent entre les 2 phénotypes que d'un facteur 1,3 à 1,4.
Du fait des variations inter-individuelles dans la vitesse de métabolisme, une adaptation posologique doit toujours être réalisée. Des doses plus faibles peuvent donc être nécessaires chez les métaboliseurs lents.
Une importante formation de métabolites hydroxylés lors du premier passage chez la plupart des métaboliseurs, compense les différences en médicament sous forme inchangée entre les deux phénotypes.
Chez les métaboliseurs rapides, les demi-vies d'élimination des énantiomères du nébivolol sont en moyenne de 10 heures. Chez les métaboliseurs lents elles sont 3 à 5 fois plus longues. Chez les métaboliseurs rapides, les taux plasmatiques d'énantiomère RSSS sont légèrement plus élevés que ceux de l'énantiomère SRRR.
Chez les métaboliseurs lents cette différence est plus importante.
Chez les métaboliseurs rapides, les demi-vies d'élimination des métabolites hydroxylés des deux énantiomères sont en moyenne de 24 heures et sont environ deux fois plus longues chez les métaboliseurs lents.
Chez la plupart des sujets (métaboliseurs rapides) les concentrations plasmatiques à l'état d'équilibre sont atteintes en 24 heures pour le nébivolol et en quelques jours pour les métabolites hydroxylés. Les concentrations plasmatiques sont proportionnelles à la dose entre 1 et 30 mg. La pharmacocinétique du nébivolol n'est pas modifiée par l'âge.
Dans le plasma, les deux énantiomères du nébivolol sont principalement liés à l'albumine.
La liaison aux protéines plasmatiques est de 98,1 % pour le SRRR-nébivolol et de 97,9 % pour le RSSS-nébivolol.
Élimination
Après une semaine d'administration, 38 % de la dose est excrétée dans les urines et 48 % dans les fèces. L'excrétion urinaire sous forme inchangée est inférieure à 0,5 % de la dose.
5.3. Données de sécurité préclinique
3 ans
6.4. Précautions particulières de conservation
Pas de conditions particulières de conservation.
6.5. Nature et contenu de l'emballage extérieur
7, 14, 28, 30, 50, 56, 90, 100 ou 500 comprimés sous plaquettes (PVC/PE/PVDC/Aluminium)
7, 14, 28, 30, 50, 56, 90, 100 ou 500 comprimés en flacon (HDPE) muni d’un bouchon (LDPE)
Toutes les présentations peuvent ne pas être commercialisées.
6.6. Précautions particulières d’élimination et de manipulation
Pas d’exigences particulières.
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
1 RUE DE TURIN
69007 LYON
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 300 383 6 9 : 7 comprimés sous plaquettes (PVC/PE/PVDC/Aluminium)
· 34009 300 383 7 6 : 14 comprimés sous plaquettes (PVC/PE/PVDC/Aluminium)
· 34009 300 383 8 3 : 28 comprimés sous plaquettes (PVC/PE/PVDC/Aluminium)
· 34009 300 383 9 0 : 30 comprimés sous plaquettes (PVC/PE/PVDC/Aluminium)
· 34009 300 384 0 6 : 50 comprimés sous plaquettes (PVC/PE/PVDC/Aluminium)
· 34009 300 384 1 3 : 56 comprimés sous plaquettes (PVC/PE/PVDC/Aluminium)
· 34009 300 384 2 0 : 90 comprimés sous plaquettes (PVC/PE/PVDC/Aluminium)
· 34009 300 384 3 7 : 100 comprimés sous plaquettes (PVC/PE/PVDC/Aluminium)
· 34009 300 384 4 4 : Flacon (PEHD) de 7 comprimés
· 34009 300 384 5 1 : Flacon (PEHD) de 14 comprimés
· 34009 300 384 6 8 : Flacon (PEHD) de 28 comprimés
· 34009 300 384 7 5 : Flacon (PEHD) de 30 comprimés
· 34009 300 384 8 2 : Flacon (PEHD) de 50 comprimés
· 34009 300 385 0 5 : Flacon (PEHD) de 56 comprimés
· 34009 300 385 1 2 : Flacon (PEHD) de 90 comprimés
· 34009 300 385 2 9 : Flacon (PEHD) de 100 comprimés
· 34009 550 135 4 9 : 500 comprimés sous plaquettes (PVC/PE/PVDC/Aluminium)
· 34009 550 135 5 6 : Flacon (PEHD) de 500 comprimés
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Liste I.
ANSM - Mis à jour le : 18/02/2025
NEBIVOLOL VIATRIS 5 mg, comprimé quadrisécable
Nébivolol
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d'autres questions, interrogez votre médecin, votre pharmacien ou votre infirmier/ère.
· Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d'autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin, votre pharmacien ou votre infirmier/ère. Ceci s'applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
1. Qu'est-ce que NEBIVOLOL VIATRIS 5 mg, comprimé quadrisécable et dans quels cas est‑il utilisé ?
2. Quelles sont les informations à connaître avant de prendre NEBIVOLOL VIATRIS 5 mg, comprimé quadrisécable ?
3. Comment prendre NEBIVOLOL VIATRIS 5 mg, comprimé quadrisécable ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver NEBIVOLOL VIATRIS 5 mg, comprimé quadrisécable ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE NEBIVOLOL VIATRIS 5 mg, comprimé quadrisécable ET DANS QUELS CAS EST-IL UTILISE ?
Classe pharmacothérapeutique : bêtabloquant sélectif - code ATC : C07AB12.
NEBIVOLOL VIATRIS contient du nébivolol, un médicament du système cardiovasculaire appartenant à la classe des bêtabloquants sélectifs (qui ont une action sélective sur le système cardiovasculaire). Il empêche l'augmentation de la fréquence cardiaque et contrôle la force de pompage du cœur. Il exerce également une action de dilatation au niveau des vaisseaux sanguins, contribuant également à abaisser la pression artérielle.
Ce médicament est préconisé dans le traitement de l'hypertension artérielle essentielle (ou pression artérielle élevée).
NEBIVOLOL VIATRIS est également utilisé dans le traitement de l'insuffisance cardiaque chronique légère et modérée chez des patients âgés de 70 ans ou plus, en association à d'autres traitements.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT DE PRENDRE NEBIVOLOL VIATRIS 5 mg, comprimé quadrisécable ?
Ne prenez jamais NEBIVOLOL VIATRIS 5 mg, comprimé quadrisécable :
· si vous êtes allergique à la substance active (nébivolol) ou à l'un des autres composants contenus dans ce médicament, mentionnés dans la rubrique 6 ;
· si vous souffrez d'un des troubles suivants :
o pression artérielle basse,
o troubles sévères de la circulation sanguine dans les bras ou dans les jambes,
o rythme cardiaque très lent (inférieur à 60 battements par minute),
o certains troubles sévères du rythme cardiaque (tels que blocs auriculo-ventriculaires des 2nd et 3ème degrés, troubles de la conduction cardiaque),
o insuffisance cardiaque survenue récemment ou s'étant récemment aggravée, ou si vous avez un traitement pour le cœur (traitement par voie intraveineuse du choc circulatoire dû à une insuffisance cardiaque aiguë),
o asthme ou respiration sifflante (actuels ou passés),
o phéochromocytome non traité, une tumeur localisée sur la partie supérieure des reins (dans les glandes surrénales),
o trouble de la fonction hépatique,
o trouble métabolique (acidose métabolique), tel qu'une acido-cétose diabétique.
Avertissements et précautions
Adressez-vous à votre médecin, pharmacien ou votre infirmier/ère avant de prendre NEBIVOLOL VIATRIS 5 mg, comprimé quadrisécable.
Informez votre médecin des maladies que vous avez ou avez eues, en particulier :
· fréquence cardiaque anormalement faible ;
· douleur dans la poitrine due à une crampe subite au niveau du cœur appelée angor de Prinzmetal ;
· insuffisance cardiaque chronique non traitée ;
· bloc cardiaque du 1er degré (léger trouble de la conduction cardiaque qui affecte le rythme cardiaque) ;
· mauvaise circulation dans les bras ou dans les jambes, par exemple maladie ou syndrome de Raynaud, douleurs de type crampes à la marche ;
· problèmes respiratoires chroniques ;
· diabète : ce médicament n'a pas d'effet sur la glycémie, toutefois certains signes d'alerte de l'hypoglycémie peuvent être masqués (tels que palpitations, fréquence cardiaque élevée) et il pourrait augmenter le risque d’une hypoglycémie sévère, quand il est utilisé avec un certain type de médicaments antidiabétiques appelés sulfonylurées (par ex., gliquidone, gliclazide, glibenclamide, glipizide, glimépiride ou tolbutamide) ;
· hyperactivité de la glande thyroïdienne : ce médicament peut masquer les signes d'une accélération du rythme cardiaque due à cette hyperactivité ;
· allergie : ce médicament peut intensifier votre réaction aux pollens ou vis-à-vis des substances auxquelles vous êtes allergique ;
· psoriasis (maladie de la peau - plaques roses squameuses) actuel ou passé ;
· si vous devez subir une intervention chirurgicale, toujours prévenir l'anesthésiste que vous prenez du NEBIVOLOL VIATRIS avant l'anesthésie.
Si vous avez de graves troubles de la fonction rénale, ne prenez pas NEBIVOLOL VIATRIS et parlez-en à votre médecin.
Au début du traitement de votre insuffisance cardiaque chronique, vous serez régulièrement surveillé(e) par un médecin ayant l'expérience de la prise en charge des patients atteints d'insuffisance cardiaque (voir rubrique 3).
Ce traitement ne doit pas être arrêté brutalement, sauf si votre médecin vous l'a clairement indiqué après vous avoir consulté (voir rubrique 3).
Enfants et adolescents
En l'absence de données sur l'utilisation de ce médicament, NEBIVOLOL VIATRIS ne doit pas être utilisé chez les enfants et les adolescents.
Autres médicaments et NEBIVOLOL VIATRIS 5 mg, comprimé quadrisécable
Informez votre médecin ou pharmacien si vous prenez, avez récemment pris ou pourriez prendre tout autre médicament.
Prévenez toujours votre médecin si vous prenez un des médicaments suivants, en plus de NEBIVOLOL VIATRIS :
· médicaments pour contrôler la pression artérielle ou médicaments pour des problèmes cardiaques (tels que amiodarone, amlodipine, cibenzoline, clonidine, digoxine, diltiazem, disopyramide, félodipine, flécaïnide, guanfacine, hydroquinidine, lacidipine, lidocaïne, méthyldopa, mexilétine, moxonidine, nicardipine, nifédipine, nimodipine, nitrendipine, propafénone, quinidine, rilménidine, vérapamil) ;
· sédatifs et traitements de la psychose (une maladie mentale), par exemple barbituriques (également utilisés pour l'épilepsie), phénothiazine (également utilisée pour les vomissements et les nausées) et thioridazine ;
· médicaments pour la dépression, par exemple : amitriptyline, paroxétine, fluoxétine ;
· médicaments utilisés pour l'anesthésie pendant une opération ;
· médicaments pour l'asthme, le nez bouché ou certains troubles de l'œil tels que glaucome (augmentation de la pression dans l'œil) ou dilatation (élargissement) de la pupille ;
· baclofène (médicament antispastique), amifostine (un médicament protecteur utilisé dans le traitement du cancer) ;
· médicaments pour le diabète, tels que l’insuline ou des médicaments antidiabétiques oraux.
Ces médicaments tout comme le nébivolol peuvent avoir un effet sur la pression artérielle et/ou sur la fonction cardiaque ;
· médicaments pour traiter un excès d'acidité dans l'estomac ou les ulcères (médicament antiacide). NEBIVOLOL VIATRIS doit être pris pendant les repas et l'antiacide entre les repas.
NEBIVOLOL VIATRIS 5 mg, comprimé quadrisécable avec des aliments et boissons
NEBIVOLOL VIATRIS peut être pris avec de la nourriture ou l'estomac vide, mais il est préférable de prendre le comprimé avec de l'eau.
Si vous êtes enceinte ou que vous allaitez, si vous pensez être enceinte ou planifiez une grossesse, demandez conseil à votre médecin ou pharmacien avant de prendre ce médicament.
NEBIVOLOL VIATRIS ne doit pas être pris pendant la grossesse, sauf si nécessaire.
Il est déconseillé de prendre NEBIVOLOL VIATRIS pendant l'allaitement.
Conduite de véhicules et utilisation de machines
Ce médicament peut entraîner des vertiges ou de la fatigue. Si cela se produit, vous ne devez pas conduire ni utiliser des machines.
NEBIVOLOL VIATRIS 5 mg, comprimé quadrisécable contient du lactose et du sodium.
Si votre médecin vous a informé(e) d'une intolérance à certains sucres, contactez-le avant de prendre ce médicament.
Ce médicament contient moins de 1 mmol (23 mg) de sodium par comprimé, c.-à-d. qu’il est essentiellement « sans sodium ».
3. COMMENT PRENDRE NEBIVOLOL VIATRIS 5 mg, comprimé quadrisécable ?
Veillez à toujours prendre ce médicament en suivant exactement les indications de votre médecin ou pharmacien. Vérifiez auprès de votre médecin ou pharmacien en cas de doute.
NEBIVOLOL VIATRIS peut être pris avant, pendant ou après les repas, mais peut également être pris indépendamment des repas. Il est préférable de prendre le comprimé avec de l'eau.
Traitement de la pression artérielle élevée (hypertension)
La dose habituelle est de 1 comprimé par jour. La dose doit être prise de préférence toujours au même moment de la journée.
Chez les sujets âgés et les patients ayant un trouble de la fonction rénale, la dose initiale est de 1/2 (un demi) comprimé par jour.
L'effet thérapeutique sur la pression artérielle se manifeste après 1 à 2 semaines de traitement. Parfois, l'effet optimal est atteint seulement après 4 semaines de traitement.
Traitement de l'insuffisance cardiaque chronique
L'initiation et le suivi de votre traitement seront effectués par un médecin expérimenté.
Votre médecin commencera votre traitement par 1/4 (un quart) de comprimé par jour. Après 1 à 2 semaines de traitement, cette dose pourra être augmentée à 1/2 (un demi) comprimé par jour, puis à 1 comprimé par jour et enfin à 2 comprimés par jour. Votre médecin vous prescrira la dose qui vous convient à chaque étape et vous devrez scrupuleusement respecter ses instructions.
La dose maximale recommandée est de 2 comprimés (10 mg).
Vous serez sous surveillance pendant 2 heures lors de l'initiation du traitement et à chaque fois que la dose sera augmentée. Cette surveillance doit être faite par un médecin ayant l'expérience de la prise en charge des patients atteints d'insuffisance cardiaque chronique.
Si nécessaire, la dose pourra être diminuée.
Vous ne devez pas arrêter brutalement votre traitement au risque d'aggraver votre insuffisance cardiaque.
Les patients atteints de troubles sévères de la fonction rénale ne doivent pas prendre ce médicament.
Prenez votre médicament chaque jour, de préférence toujours au même moment de la journée.
Si votre médecin vous a prescrit 1/4 (un quart) de comprimé ou 1/2 (un demi) comprimé par jour, NEBIVOLOL VIATRIS doit être cassé comme indiqué ci-après :
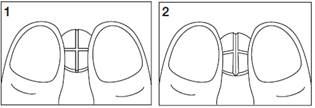
· placer le comprimé, la face présentant les barres de sécabilité vers le haut, sur une surface propre, rigide et plane (par exemple une table ou un plan de travail) ;
· placer vos index le long d'une des barres de sécabilité puis exercer une pression vers le bas pour casser le comprimé (voir schémas 1 et 2) ;
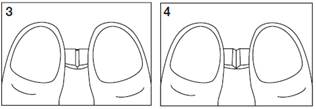
· pour obtenir 1/4 (un quart) de comprimé, recommencez l'opération à partir d'1/2 (un demi) comprimé (voir schémas 3 et 4).
|
|
|
Schémas 1 et 2 : modalités d'obtention de 1/2 (demis) comprimés.
|
|
|
Schémas 3 et 4 : modalités d'obtention de 1/4 (quarts) de comprimés.
Votre médecin peut décider d'associer d'autres médicaments à NEBIVOLOL VIATRIS pour vous traiter.
Utilisation chez les enfants et les adolescents
Ne pas utiliser ce médicament chez les enfants et les adolescents.
Si vous avez pris plus de NEBIVOLOL VIATRIS 5 mg, comprimé quadrisécable que vous n’auriez dû
Si par mégarde vous avez pris plus de comprimés que vous n'auriez dû, prévenez immédiatement votre médecin ou votre pharmacien.
Les symptômes et signes habituels d'une prise excessive de NEBIVOLOL VIATRIS sont des battements cardiaques très lents (bradycardie), une pression artérielle basse et éventuellement évanouissements (hypotension), une difficulté à respirer comme dans l'asthme (bronchospasme), et une insuffisance cardiaque aiguë.
Vous pouvez prendre du charbon activé (disponible en pharmacie) en attendant l'arrivée du médecin.
Si vous oubliez de prendre NEBIVOLOL VIATRIS 5 mg, comprimé quadrisécable
Si vous vous en rendez compte plus tardivement (par exemple, après plusieurs heures) et que le moment de la prise suivante est proche, ne prenez pas la dose que vous avez oublié de prendre et attendez pour prendre la dose normale suivante prévue, à l'horaire habituel. Ne prenez pas de dose double. Les oublis répétés doivent être évités.
Si vous arrêtez de prendre NEBIVOLOL VIATRIS 5 mg, comprimé quadrisécable
Consultez toujours votre médecin avant d'arrêter le traitement par NEBIVOLOL VIATRIS, que vous le preniez pour une pression artérielle élevée ou pour une insuffisance cardiaque chronique.
N'arrêtez pas brutalement le traitement par NEBIVOLOL VIATRIS, cela peut entraîner une aggravation transitoire de votre insuffisance cardiaque.
Si le traitement de l'insuffisance cardiaque chronique par NEBIVOLOL VIATRIS doit être arrêté, la dose quotidienne doit être diminuée progressivement, en la réduisant de moitié par intervalles d'une semaine.
Si vous avez d'autres questions sur l'utilisation de ce médicament, demandez plus d'informations à votre médecin, à votre pharmacien ou à votre infirmier/ère.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Quand NEBIVOLOL VIATRIS est utilisé pour le traitement d'une pression artérielle élevée, les effets indésirables éventuels sont :
Effets indésirables fréquents (pouvant affecter jusqu’à 1 patient sur 10)
· Maux de tête.
· Etourdissements.
· Fatigue.
· Démangeaisons inhabituelles ou sensation de picotements.
· Diarrhée.
· Constipation.
· Nausées.
· Essoufflements.
· Gonflement des mains ou des pieds.
Effets indésirables peu fréquents (pouvant affecter jusqu’à 1 patient sur 100)
· Rythme cardiaque lent ou toute autre affection du cœur.
· Pression artérielle basse.
· Douleurs de type crampes à la marche.
· Troubles de la vue.
· Impuissance.
· Dépression.
· Digestion difficile (dyspepsie), gaz intestinaux, vomissements.
· Eruption cutanée, démangeaisons.
· Difficulté à respirer comme dans l'asthme, due aux contractions soudaines des muscles des voies respiratoires (bronchospasme).
· Cauchemars.
Effets indésirables très rares (pouvant affecter jusqu’à 1 patient sur 10000)
· Evanouissements.
· Aggravation d'un psoriasis (maladie de la peau - plaques roses squameuses).
Les effets indésirables suivants ont été rapportés uniquement dans des cas isolés au cours du traitement par NEBIVOLOL VIATRIS :
· Réactions allergiques apparaissant sur tout le corps, avec éruption cutanée généralisée (réactions d'hypersensibilité).
· Gonflement soudain, particulièrement autour des lèvres, des yeux ou de la langue avec possibilité de difficultés respiratoires soudaines (angio-œdème).
· Eruption cutanée caractérisée par des papules prurigineuses, en relief, rouge pâle, de causes allergique ou non allergique (urticaire).
Au cours d'une étude clinique dans l'insuffisance cardiaque chronique, les effets indésirables étaient :
Effets indésirables très fréquents (pouvant affecter plus de 1 patient sur 10)
· Ralentissement du rythme cardiaque.
· Etourdissements.
Effets indésirables fréquents (pouvant affecter jusqu’à 1 patient sur 10)
· Aggravation de l'insuffisance cardiaque.
· Pression artérielle basse (telle que chute de la pression artérielle lors du passage à la position debout).
· Intolérance au médicament.
· Léger trouble de la conduction cardiaque qui affecte le rythme cardiaque (bloc auriculo-ventriculaire du 1er degré).
· Gonflement des membres inférieurs (tels que chevilles gonflées).
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin, votre pharmacien ou à votre infirmier/ère. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER NEBIVOLOL VIATRIS 5 mg, comprimé quadrisécable ?
Tenir ce médicament hors de la vue et de la portée des enfants.
N’utilisez pas ce médicament après la date de péremption indiquée sur la boîte après EXP. La date de péremption fait référence au dernier jour de ce mois.
Pas de conditions particulières de conservation.
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient NEBIVOLOL VIATRIS 5 mg, comprimé quadrisécable
· La substance active est :
nébivolol dosé à 5 mg (sous forme de chlorhydrate de nébivolol).
· Les autres composants sont :
lactose monohydraté, macrogol 6000, croscarmellose sodique, silice colloïdale anhydre, stéarate de magnésium.
Qu’est-ce que NEBIVOLOL VIATRIS 5 mg, comprimé quadrisécable et contenu de l’emballage extérieur ?
Ce médicament se présente sous la forme de comprimés blancs, ronds biconvexes, quadrisécables et gravés « N5 ».
Boîtes ou flacons de 7, 14, 28, 30, 50, 56, 90, 100 et 500 comprimés. Les comprimés sont conditionnés en plaquettes (PVC/PE/PVDC/aluminium) et en flacons HDPE.
Toutes les présentations peuvent ne pas être commercialisées
Titulaire de l’autorisation de mise sur le marché
1 RUE DE TURIN
69007 LYON
Exploitant de l’autorisation de mise sur le marché
VIATRIS SANTE
1 RUE DE TURIN
69007 LYON
BLB015-016, BULEBEL INDUSTRIAL ESTATE
ZEJTUN ZTN3000
MALTE
ou
BALKANPHARMA DUPNITSA AD
3 SAMOKOVSKO SHOSSE STR
DUPNITSA 2600
BULGARIE
ou
MYLAN HUNGARY KFT
H - 2900
KOMAROM, MYLAN UTCA 1
HONGRIE
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Sans objet.
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).