Dernière mise à jour le 02/03/2026
VITAROS 300 microgrammes, crème
Présentations
> 4 récipient(s) unidose(s) polypropylène polyéthylène de 100 mg
Code CIP : 275 438-7 ou 34009 275 438 7 6
Déclaration de commercialisation : 29/05/2015
Cette présentation est agréée aux collectivités
- Prix hors honoraire de dispensation : 33,94 €
- Honoraire de dispensation : 1,02 €
- Prix honoraire compris : 34,96 €
- Taux de remboursement :15%
Traitement de l'impuissance sexuelle en cas de :
- paraplégie et tétraplégie
- lésion du bassin ayant entraîné des problèmes urinaires
- problèmes consécutifs à certains actes chirurgicaux ou à une radiothérapie abdominopelviens
- séquelles du priapisme
- neuropathie diabétique avérée
- sclérose en plaques. ; JOURNAL OFFICIEL ; 08/07/15
Service médical rendu (SMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprès de la HAS (plus d'informations dans l'aide). Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Faible | Avis du 18/03/2015 | Inscription (CT) | Le service médical rendu par VITAROS est faible en tant que traitement de seconde intention dans le traitement des dysfonctions érectiles d’origine organique visées par la demande de remboursement : • paraplégie et tétraplégie quelle qu’en soit l’origine . • traumatisme du bassin compliqué de troubles urinaires . • séquelles de la chirurgie (anévrisme de l’aorte . prostatectomie radicale, cystectomie totale et exérèse colorectale) ou de la radiothérapie abdominopelvienne . • séquelles du priapisme . • neuropathie diabétique avérée . • sclérose en plaques. |
Amélioration du service médical rendu (ASMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprés de la HAS (plus d'informations dans l'aide). Les avis et synthéses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur de l'ASMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| V (Inexistant) | Avis du 18/03/2015 | Inscription (CT) | VITAROS n’apporte pas d’amélioration du service médical rendu (ASMR V) dans la stratégie thérapeutique. |
ANSM - Mis à jour le : 20/09/2023
VITAROS 300 microgrammes, crème
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Pour la liste complète des excipients, voir rubrique 6.1.
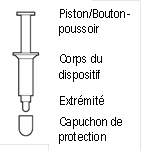
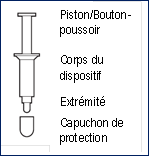
Vitaros est une crème de couleur blanche à blanc cassé se présentant dans un récipient unidose, AccuDose. AccuDose est un récipient unidose qui se compose d’un piston, d’un cylindre formant le corps du dispositif et d’un capuchon de protection et qui est fourni dans un sachet protecteur.
4.1. Indications thérapeutiques
4.2. Posologie et mode d'administration
VITAROS est appliqué à l’extrémité du pénis.
VITAROS doit être utilisé en fonction de ce qui est nécessaire pour obtenir une érection. Chaque récipient unidose VITAROS AccuDose est à usage unique et doit être éliminé comme il convient après utilisation. L’effet apparaît dans un délai de 5 à 30 minutes suivant l’administration. La durée de l’effet est d’environ 1 à 2 heures. Cependant, la durée effective est variable d’un patient à l’autre. Préalablement à toute auto-administration, chaque patient doit être formé à la technique d’administration de VITAROS par un professionnel de santé. La fréquence d’utilisation ne doit pas dépasser 2 à 3 utilisations par semaine, à raison d’une seule fois par tranche de 24 heures.
La dose initiale doit être recommandée par un médecin. Une dose de départ de 300 μg peut être envisagée, en particulier en cas de dysfonction érectile sévère, d’affection concomitante ou d’échec des inhibiteurs de la phosphodiestérase de type 5 (PDE5). Chez les patients présentant une mauvaise tolérance à la dose de 300 μg se manifestant sous forme d’effets indésirables locaux, la posologie peut être diminuée à 200 μg.
Les patients doivent recevoir les instructions leur permettant de maîtriser la technique d’administration ; ils doivent être informés des effets indésirables possibles (sensations de vertige ou évanouissement, par exemple) et de la nécessité d’éviter toute utilisation de machines tant que leur bonne tolérance au produit n’est pas établie. Lors de l’étude clinique réalisée, le taux de sorties d’étude a été plus élevé dans le groupe traité à la dose de 300 μg que dans celui traité à la dose de 200 μg, étant respectivement de 30 % versus 20 %.
Mode d’administration
Il est recommandé d’uriner avant d’appliquer le produit. Après avoir retiré le capuchon, appliquer tout le contenu de VITAROS dans l’ouverture à l’extrémité du pénis (méat) dans les 5 à 30 minutes précédant une tentative de rapport sexuel en suivant les instructions ci-dessous :
1- Se laver les mains avant d’appliquer VITAROS. Retirer le contenant AccuDose (Fig. 1) du sachet, en tirant vers le bas la languette située à l'entaille au haut de l'emballage. Conserver le sachet pour l’élimination du contenant AccuDose usagé ultérieurement.
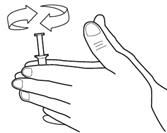
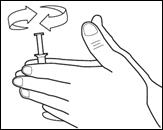
2- Amener le contenu de l’unidose à température ambiante en faisant rouler le corps du dispositif entre vos mains (voir Fig. 2). Cette étape peut être évitée si vous avez déjà sorti le sachet du réfrigérateur (dans les limites décrites dans le paragraphe 6.4 Précautions particulières de conservation) et que le contenu a déjà atteint la température de la pièce.
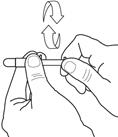
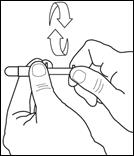
3- Tourner le piston poussoir plusieurs fois pour être sûr qu’il coulissera facilement (voir Fig. 3). Puis, retirer le capuchon de protection de l’AccuDose.
|
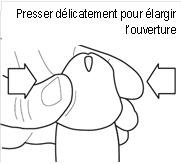
4- Saisir l’extrémité du pénis d’une main et comprimer délicatement pour élargir l’ouverture à l’extrémité de pénis en le maintenant à la verticale (Voir Fig. 4) (remarque : chez les hommes non circoncis, commencer par décalotter le gland et maintenir le prépuce rabattu avant d’élargir l’ouverture à l’extrémité du pénis le méat).
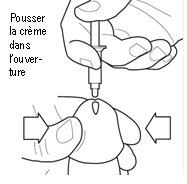
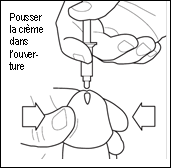
5- Tenir le corps du dispositif AccuDose entre ses doigts et, sans l’insérer à l’intérieur du pénis (voir Fig. 5), placer l’embout du contenant le plus près possible au-dessus de l’ouverture à l’extrémité du pénis pour que la crème puisse descendre dans l’urètre (conduit partant de la vessie et qui transporte et permet l’écoulement de l’urine et du sperme à l’extérieur du corps). Ne pas oublier de pousser toute la crème de l’AccuDose. Doucement mais fermement, appuyer sur le piston du contenant avec le pouce ou l’index, jusqu’à ce que tout le contenu du contenant AccuDose soit expulsé dans l’ouverture à l’extrémité du pénis et dans l’urètre. Remarque : Même s’il est important que toute la crème aille dans l’urètre, faire attention à ne pas introduire l’embout du contenant AccuDose dans l’ouverture à l’extrémité du pénis.
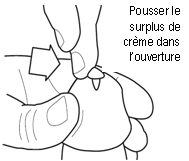
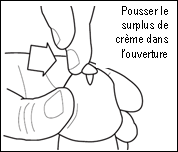
6- Tenir le pénis à la verticale pendant environ 30 secondes afin de permettre une bonne pénétration de la crème. Il est probable que l’ouverture à l’extrémité du pénis ne puisse pas contenir initialement toute la crème. Tout surplus de crème au niveau de l’ouverture de l’extrémité du pénis doit être poussé avec un doigt à l’intérieur de l’ouverture du pénis (Fig. 6). Ne pas utiliser un deuxième contenant AccuDose pour compenser la crème n’ayant pas pénétré dans le méat. Ne pas uriner immédiatement après l’application, le produit risque de ressortir avant d’avoir fait effet. Faire pénétrer tout excès de crème dans l’ouverture du pénis et dans la peau qui entoure le site d’application, en massant délicatement avec le bout du doigt.
7- Attention, chaque dose de VITAROS est à usage unique. Remettre le capuchon sur le contenant AccuDose et placer celui-ci dans le sachet qui a été ouvert, fermer le sachet en le repliant et éliminer conformément à la réglementation en vigueur.
8- VITAROS peut provoquer une irritation des yeux. Se laver les mains après avoir appliqué VITAROS.
|
VITAROS ne doit pas être utilisé chez les patients dans les cas suivants :
· troubles sous-jacents tels qu’une hypotension orthostatique, un infarctus du myocarde ou une syncope,
· hypersensibilité connue à l’alprostadil ou à l’un des autres composants de Vitaros,
· affections susceptibles de prédisposer le patient à un priapisme, telles qu’une anémie falciforme ou la présence du trait drépanocytaire, une hyperplaquettose, une polyglobulie, un myélome multiple ou une leucémie.
· existence d’une anomalie anatomique du pénis comme par exemple un hypospadias sévère, chez les patients présentant une déformation anatomique du pénis, comme une courbure du pénis, et chez les patients présentant une urétrite ou une balanite (inflammation/infection du gland du pénis).
· patient présentant un risque de thrombose veineuse ou présentant un syndrome d’hyperviscosité et donc exposé à un risque accru de priapisme (rigidité pénienne se prolongeant 4 heures ou plus).
· Vitaros ne doit pas être utilisé chez les patients pour lesquels une activité sexuelle est déconseillée, comme par exemple en cas d’instabilité cardiovasculaire ou cérébrovasculaire.
· Vitaros ne doit pas être utilisé lors de rapports sexuels avec une femme en âge de procréer, sauf si le couple utilise un préservatif.
4.4. Mises en garde spéciales et précautions d'emploi
Des érections se prolongeant plus de 4 heures (priapisme), bien que rares, ont été observées lors de l’utilisation de VITAROS. Un priapisme a été observé lors des deux études de 3 mois chez 1 patient (0,06 %) ainsi que lors de l’étude de plus de 6 mois chez 5 patients (0,4 %), dont 4 (0,3 %) dans le groupe 200 μg et 1 (0,1 %) dans le groupe 300 μg. Le patient doit consulter un médecin immédiatement en cas de priapisme. L’absence de traitement immédiat du priapisme peut entraîner des lésions du tissu pénien et une impuissance permanente.
Des cas d’hypotension symptomatique (sensations de vertige) et de syncope ont été signalés chez un faible pourcentage de patients : 2 patients sur 459 (0,4 %), 6 patients sur 1591 (0,4 %) et 6 patients sur 1280 (0,5 %) respectivement aux doses de 100, 200 et 300 μg d’alprostadil, lors d’administrations effectuées au cours des études de phase III. Les patients devront être avertis de la nécessité d’éviter certaines activités comme la conduite ou la réalisation de tâches dangereuses qui seraient susceptibles d’occasionner des blessures en cas d’hypotension ou de syncope après administration de VITAROS.
Avant la mise en route du traitement par VITAROS, il convient d’écarter les causes traitables de la dysfonction érectile au moyen de méthodes diagnostiques appropriées.
De plus, les patients présentant des troubles sous-jacents comme une hypotension orthostatique, un infarctus du myocarde ou une syncope, ne doivent pas utiliser VITAROS (voir Contre-indications, rubrique 4.3).
Il n’a pas été réalisé d’études cliniques chez les patients ayant des antécédents de maladie neurologique ou de lésions rachidiennes.
La pharmacocinétique de VITAROS n’a pas été étudiée formellement chez les patients insuffisants hépatiques et/ou rénaux. Il peut être nécessaire de diminuer la dose chez ces populations en raison d’altérations du métabolisme.
Précautions générales :
VITAROS doit être appliqué conformément aux instructions fournies ci-dessus. Une exposition intra-urétrale accidentelle est susceptible de se traduire par des sensations de brûlure ou de picotements et des douleurs au niveau du pénis. Les effets d’une exposition urétrale plus longue et répétée de VITAROS ne sont pas connus.
Les patients doivent être informés que VITAROS n’offre aucune protection contre la transmission des maladies sexuellement transmissibles (MST). Il convient d’expliquer aux patients utilisant VITAROS et à leurs partenaires quelles sont les mesures de protection à prendre pour éviter la dissémination des agents pathogènes responsables de MST, notamment le virus de l’immunodéficience humaine (VIH).
Les professionnels de santé doivent encourager leurs patients à informer leurs partenaires sexuels qu’ils utilisent VITAROS. Les partenaires d’utilisateurs de VITAROS sont susceptibles de présenter des événements indésirables, du type irritation vaginale essentiellement. L’utilisation d’un préservatif est par conséquent recommandée.
Les effets de VITAROS sur la muqueuse orale ou anale n’ont pas été étudiés. Il convient d’utiliser un préservatif en cas de rapport sexuel oral (fellation) ou anal.
VITAROS est dépourvu de propriétés contraceptives. Il est conseillé aux couples utilisant VITAROS d’avoir recours à une contraception adaptée si la partenaire est en âge de procréer.
On ne dispose d’aucune information concernant les effets de l’alprostadil aux premiers stades de la grossesse aux niveaux reçus par les partenaires. Il convient d’utiliser un préservatif lors de rapports sexuels avec des femmes en âge de procréer, des femmes enceintes ou des femmes qui allaitent.
Seuls des préservatifs à base de latex ont fait l’objet d’études lors de l’utilisation du produit ; le risque que le préservatif soit endommagé ne peut donc pas être exclu si d’autres matières entrent dans sa composition.
Ce médicament contient 5 mg d'alcool (éthanol) par dose de 100 mg équivalent à 50 mg/g (5% p/p).
Cela peut provoquer une sensation de brûlure sur une peau endommagée.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Il n’a pas été réalisé d’étude d’interaction d’ordre pharmacocinétique ou pharmacodynamique avec VITAROS. Compte tenu de la nature de son métabolisme (voir « Propriétés Pharmacocinétiques », section 5.2), les interactions médicamenteuses sont jugées peu probables.
Effet d’interaction
La sécurité et l’efficacité de VITAROS en association avec d’autres traitements utilisés pour la dysfonction érectile, en particulier les inhibiteurs de la phosphodiestérase 5 (PDE5), à savoir le sildénafil, le tadalafil et le vardénafil, n’ont pas été étudiées. En conséquence, VITAROS ne doit pas être utilisé en association avec des inhibiteurs de la PDE5. VITAROS et les inhibiteurs de la PDE5 ayant des effets cardiovasculaires, il n’est pas possible d’exclure une augmentation du risque cardiovasculaire supplémentaire.
Aucune étude d’interaction n’a été réalisée concernant VITAROS en association avec des implants péniens ou avec des spasmolytiques qui relâchent la musculature lisse comme la papavérine, ni avec des médicaments utilisés pour induire des érections tels que les antagonistes des récepteurs alpha adrénergiques (par exemple, la phentolamine par voie intracaverneuse ou le moxisylyte). Il existe un risque de priapisme (érection anormalement prolongée et douloureuse) en cas d’association.
Aucune étude d’interaction n’a été réalisée concernant VITAROS en association avec des sympathomimétiques, des décongestionnants ou des anorexigènes. Une diminution de l’activité de l’alprostadil est possible en cas d’association (inhibition due à l’interaction médicamenteuse).
Aucune étude d’interaction n’a été réalisée concernant VITAROS en association avec des anticoagulants ou des antiagrégants plaquettaires. Une association peut entraîner un risque accru de saignement urétral, d’hématurie.
Les patients recevant un traitement antihypertenseur ou vasoactif concomitant peuvent être exposés à un risque accru d’hypotension, notamment les sujets âgés.
4.6. Fertilité, grossesse et allaitement
Grossesse
Il n’existe pas de données sur l’utilisation de VITAROS chez la femme enceinte. L’exposition indirecte des femmes à l’alprostadil est probablement faible.
Les données obtenues chez l’animal à des doses plus fortes d’alprostadil mettent en évidence une toxicité sur la reproduction (voir rubrique 5.3).
Les femmes enceintes ne doivent pas être exposées à VITAROS.
On ne sait pas si une exposition indirecte à l’alprostadil présent dans VITAROS provoque une excrétion importante dans le lait maternel. Il est déconseillé d’utiliser VITAROS pendant l’allaitement.
Fertilité
Chez le lapin mâle, une atrophie des tubes séminifères des testicules a été observée après administration répétée. Chez l’homme, on ne sait pas si VITAROS a un effet sur la fertilité masculine.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Liste des effets indésirables sous forme de tableau
Les effets indésirables les plus fréquemment rapportés lors de traitements par VITAROS sont présentés dans le tableau ci-dessous. (Très fréquent ≥1/10 ; fréquent ≥1/100, <1/10 ; peu fréquent ≥1/1000, <1/100 ; rare ≥1/10 000, <1/1 000 ; très rare <1/10 000)
Le priapisme (érection se prolongeant plus de 4 heures) est un trouble grave nécessitant une prise en charge rapide par un médecin.
Tableau 1 : Effets indésirables
|
Classe de système d’organes (MedDRA) |
Fréquence |
Effet indésirable |
|
Affections du système nerveux |
Peu fréquent |
Hyperesthésie |
|
Affections vasculaires* |
Peu fréquent |
Sensations de vertige Syncope Hypotension |
|
Affections de la peau et du tissu sous-cutané |
Fréquent |
Rash |
|
Affections musculo-squelettiques et systémiques |
Peu fréquent |
Extrémités douloureuses |
|
Affections du rein et des voies urinaires |
Fréquent |
Douleurs urétrales |
|
Peu fréquent |
Sténose urétrale Inflammation des voies urinaires |
|
|
Affections des organes de reproduction et du sein |
Fréquent |
Sensation de brûlure pénienne Douleurs péniennes Erythème du pénis Douleurs génitales Inconfort génital Erythème génital Erection augmentée Prurit génital OEdème du pénis Balanite Picotements du pénis Douleurs pulsatiles du pénis Engourdissement pénien Chez les partenaires (femmes) : Sensation de brûlure vulvo-vaginale Vaginite |
|
|
Peu fréquent |
Prurit du pénis Eruption génitale Douleurs du scrotum Sensation de lourdeur et de tension au niveau des organes génitaux Rigidité pénienne excessive Absence de sensibilité pénienne Erection prolongée/priapisme Chez les partenaires (femmes) : Prurit vulvo-vaginal |
|
Troubles généraux et anomalies au site d'administration |
Peu fréquent |
Douleur au point d’application |
Populations particulières
* Il n’existe pas de signe manifeste que l’alprostadil augmente le risque d’événements cardiovasculaires, autres que les effets vasodilatateurs. Toutefois, les patients présentant une affection sous-jacente ou des facteurs de risque restent exposés à un risque accru en lien avec l’augmentation de l’activité sexuelle/physique associée à l’utilisation de l’alprostadil (voir 4.3 et 4.4)
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr.
Il n’a pas été signalé de surdosage nécessitant un traitement lors de l’utilisation de VITAROS. Un surdosage en VITAROS est susceptible d’entraîner une hypotension, une syncope, des sensations de vertige, des douleurs péniennes et éventuellement un priapisme (rigidité pénienne persistant plus de 4 heures).
Un priapisme peut être à l’origine d’une aggravation permanente de la dysfonction érectile. Les patients chez lesquels est suspecté un surdosage et présentant ces symptômes devront faire l’objet d’une surveillance médicale jusqu’à la disparition des symptômes systémiques ou locaux.
Il convient d’avertir le patient de la nécessité de consulter un médecin en cas d’érection se prolongeant 4 heures ou plus. Les mesures suivantes peuvent être mises en œuvre :
· Le patient doit être en décubitus dorsal ou latéral. Appliquer alternativement une vessie de glace sur la face interne de la partie supérieure de chaque cuisse pendant deux minutes (cette manœuvre occasionne en principe l’ouverture des valves veineuses par voie réflexe). En l’absence de réponse au bout de 10 minutes, arrêter ce traitement.
· En cas d’échec de ce traitement avec persistance de la rigidité pénienne au-delà de 6 heures, il convient d’avoir recours à un drainage pénien par aspiration. En respectant les règles d’asepsie, introduire une aiguille à ailettes de 19 à 21 G dans le corps caverneux et aspirer 20 à 50 ml de sang. Cette opération entraîne en principe une détumescence du pénis. Si nécessaire, la manœuvre peut être aussi effectuée du côté controlatéral du pénis.
· En cas d'échec de la manœuvre précédente, il est recommandé d'injecter un agoniste alpha adrénergique par voie intracaverneuse. Bien que les contre-indications habituelles à l'administration intra-pénienne d'un vasoconstricteur ne s'appliquent pas au traitement du priapisme, ce geste thérapeutique impose la prudence. La pression artérielle et la fréquence cardiaque doivent être surveillées de façon continue pendant l'exécution de ce geste. Une extrême prudence s'impose chez les malades présentant une coronaropathie, une hypertension artérielle non équilibrée ou une ischémie cérébrale ainsi que chez ceux traités par un inhibiteur de la monoamine oxydase. Dans cette dernière éventualité, l'opérateur doit disposer des moyens nécessaires à la prise en charge d’une crise hypertensive.
· Préparer une solution de phényléphrine à 200 μg/ml et injecter 0,5 à 1 ml de cette solution toutes les 5 à 10 minutes. Une alternative consiste à injecter une solution d’adrénaline à 20 μg/ml. Si nécessaire, cette injection peut être suivie d’une nouvelle évacuation de sang par aspiration à l’aide de la même aiguille à ailettes. La dose de phényléphrine ne doit pas dépasser 1 mg, celle d’adrénaline est quant à elle de 100 μg au maximum (5 ml de solution).
· Une autre alternative thérapeutique consiste à utiliser du métaraminol, mais il convient de souligner que des cas de crises hypertensives aboutissant au décès ont été rapportés sous ce traitement. En cas d’échec de cette dernière mesure, il convient d’adresser immédiatement le patient en vue d’une prise en charge chirurgicale.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Mécanisme d’action
La structure chimique de l’alprostadil est identique à celle de la prostaglandine E1, dont l’action comporte une vasodilatation des vaisseaux sanguins du tissu érectile des corps caverneux et une augmentation du débit des artères caverneuses, entraînant une rigidité pénienne.
L’érection apparaît dans un délai de 5 à 30 minutes suivant l’administration de VITAROS. La demi-vie de l’alprostadil est courte chez l’homme et l’amélioration des érections dure 1 à 2 heures après application.
Efficacité et sécurité clinique
Deux études pivot de phase III ont évalué l’efficacité de VITAROS chez des patients atteints de dysfonction érectile. Comparativement au placebo, une amélioration globale statistiquement significative a été observée dans les groupes de traitement 100, 200 et 300 μg d’alprostadil concernant chacun des principaux critères d’efficacité, c’est-à-dire le score obtenu pour le domaine « fonction érectile » de l’IIEF (Index international de la fonction érectile) et une augmentation des pénétrations vaginales et des éjaculations réussies. De plus, toujours par rapport au placebo, il a été observé des améliorations globales, statistiquement significatives des groupes traités comparés au placebo, concernant plusieurs critères d’efficacité secondaires, comprenant les scores des autres domaines de l’IIEF (fonction orgasmique, satisfaction des rapports, satisfaction globale), l'auto-évaluation de l'érection par le patient (une échelle d’auto-évaluation de 1 à 5 - absence de rigidité à rigidité exagérée (OR) une échelle de cotation subjective quantifiant l’érection) et le questionnaire GAQ (Global Assessment Questionnaire).
Efficacité dans des sous-populations
Des améliorations comparables à celles de la population générale ont été globalement observées au sein de sous-populations (patients diabétiques, cardiaques, ayant subi une prostatectomie, patients hypertendus, patients chez lesquels le traitement précédent par Viagra a été un échec) et dans deux classes d’âge (< 65 ans et > 65 ans) en regard des scores du domaine de la fonction érectile de l’IIEF.
5.2. Propriétés pharmacocinétiques
La biodisponibilité absolue par voie locale n’a pas été déterminée. Lors d’une étude pharmacocinétique, des patients atteints de dysfonction érectile ont été traités par 100 mg de Vitaros Crème, aux doses de 100, 200 et 300 μg d’alprostadil. Les concentrations plasmatiques de la PGE1, et de son métabolite, PGE0, étaient faibles ou indétectables chez la majorité des sujets à la plupart des temps de mesure post administration et les paramètres pharmacocinétiques n’ont pas pu être estimés. Les valeurs de la Cmax et celles de l’ASC de la 15-céto-PGE0 étaient faibles et présentaient une augmentation dose-proportionnelle inférieure à la dose dans l’intervalle de doses compris entre 100 et 300 μg. Les concentrations plasmatiques maximales de 15-céto-PGE0 ont été atteintes dans l’heure suivant l’administration.
Tableau 2 : Moyennes (ET) des paramètres pharmacocinétiques de la 15-céto-13,14-dihydro-PGE1.
|
Paramètre |
Placebo (N=5) |
Vitaros 100 µg (N=5) |
Vitaros 200 µg (N=5) |
Vitaros 300 µg (N=5) |
|
ASCa (pg*h/ml) |
388 (256) |
439 (107) |
504 (247) |
960 (544) |
|
Cmax (pg/ml) |
23 (19) |
202 (229) |
120 (103) |
332 (224) |
|
Tmax (h) |
6 (8) |
0,6 (0,4) |
1 (0,7) |
0,7 (0,3) |
|
T1/2 (h) |
4 (--)b |
5 (3) |
3 (1)c |
6 (6) |
|
a ASC est l’aire sous la courbe des concentrations plasmatiques du temps 0 au temps 24 h b Seul 1 sujet avait suffisamment de données pour permettre une estimation de la demi-vie. c Seuls 3 sujets avaient suffisamment de données pour permettre une estimation de la demi-vie. ET = écart-type |
||||
Distribution
Après administration de l’alprostadil dans le méat et le gland du pénis, l’alprostadil est rapidement absorbé dans le corps spongieux et les corps caverneux par l’intermédiaire de vaisseaux collatéraux. Le reste passe dans la circulation veineuse pelvienne via les veines drainant le corps spongieux.
Biotransformation
Suite à une administration locale, la PGE1 est rapidement métabolisée localement en 15-céto-PGE1 par oxydation enzymatique du groupement 15-hydroxyle. La 15-céto-PGE1 conserve seulement 1 à 2 % de l’activité biologique de la PGE1 et elle est rapidement transformée pour devenir le métabolite inactif le plus abondant, la 13, 14-dihydro, 15-céto-PGE qui est éliminée principalement par voie rénale et par voie hépatique.
Élimination
Après administration intraveineuse d’alprostadil marqué au tritium chez l’homme, le produit marqué disparaît rapidement de la circulation sanguine, dans les 10 premières minutes, et seule une faible radioactivité subsiste dans le sang au bout d’1 heure. Les métabolites de l’alprostadil sont principalement éliminés par voie rénale, environ 90 % de la dose intraveineuse administrée étant retrouvés dans les urines dans les 24 heures suivant l’administration. Le reste est excrété dans les fèces. Il n’existe aucun élément en faveur d’une rétention tissulaire de l’alprostadil ou de ses métabolites après administration intraveineuse.
Pharmacocinétique dans des populations particulières
Affections pulmonaires
Chez les patients atteints d’affections pulmonaires, la capacité d’élimination du médicament peut être diminuée.
Chez les patients présentant un syndrome de détresse respiratoire aiguë, la métabolisation au premier passage dans les poumons de la PGE1 administrée par voie intraveineuse a été réduite d’environ 15 %, comparativement à un groupe témoin de patients dont la fonction respiratoire était normale.
Genre
Les effets du genre sur la pharmacocinétique de VITAROS n’ont pas été étudiés et il n’a pas été réalisé d’études pharmacocinétiques chez les partenaires féminines.
Sujets âgés, enfants
Les effets de l’âge sur la pharmacocinétique de l’alprostadil par voie locale n’ont pas été étudiés. VITAROS n’est pas indiqué chez l’enfant ou les sujets de moins de 18 ans.
5.3. Données de sécurité préclinique
Il n’a pas été réalisé d’études de cancérogénèse avec l’alprostadil ou VITAROS. Les recherches menées sur le pouvoir cancérogène de l’excipient, à savoir le DDAIP, n’ont mis en évidence aucune formation de tumeur lorsque le produit était administré par voie locale chez la souris et par voie sous-cutanée chez le rat. Dans le modèle de souris transgénique Tg.AC, l’administration de DDAIP à une concentration de 1 % et de 2,5 % a entraîné l’apparition de papillomes, respectivement chez les femelles et chez les mâles. Cet effet n’est vraisemblablement pas pertinent chez l’homme, car il est probablement dû à une irritation.
L’alprostadil n’a aucun effet sur la numération des spermatozoïdes ou leur morphologie. Cependant, l’excipient DDAIP a été à l’origine d’une atrophie des tubes séminifères des testicules chez des lapins auxquels le produit avait été administré localement à une concentration de 5 %. Il n’a pas été possible de rechercher un effet spermatotoxique direct du DDAIP, ce qui signifie que la signification de ces données en regard d’une possible diminution de la fertilité masculine est inconnue. Le DDAIP administré par voie sous-cutanée chez le rat n’a eu aucun effet sur la fertilité.
L’alprostadil s’est révélé embryotoxique (diminution du poids fœtal) lorsqu’il était administré sous forme de bolus sous-cutané chez des rats femelles à faibles doses. Des doses plus fortes ont entraîné une augmentation des résorptions, une diminution du nombre de fœtus vivants, une incidence accrue des variations et des malformations viscérales et squelettiques, ainsi qu’une toxicité maternelle. L’administration intra-vaginale de PGE1 à des lapins femelles n’a entraîné aucun effet délétère pour le fœtus.
Il a été réalisé des études de toxicité sur la reproduction évaluant le DDAIP après administration sous-cutanée à des rats et des lapins. Aucun effet n’a été observé chez les rats, mais chez les lapins une toxicité fœtale incluant une augmentation des malformations a été observée à fortes doses, ce qui était probablement dû à une toxicité maternelle. Il n’a pas été détecté d’effets sur le développement post-natal chez les rats.
Ethanol anhydre
Laurate d’éthyle
Gomme de guar d’hydroxypropyle
Chlorhydrate de dodécyl-2-(N,N-diméthylamino)-propionate
Phosphate monopotassique
Hydroxyde de sodium, pour ajustement du pH
Acide phosphorique, pour ajustement du pH
Sans objet.
Après ouverture, utiliser immédiatement, éliminer tout contenant utilisé partiellement.
6.4. Précautions particulières de conservation
A conserver au réfrigérateur (entre 2°C et 8°C). Ne pas congeler.
Les sachets non entamés peuvent être conservés par le patient en dehors du réfrigérateur pendant 3 jours au maximum avant utilisation, à une température inférieure à 25 °C. Une fois ce délai expiré, le produit doit être éliminé s’il n’a pas été utilisé.
A conserver dans le sachet d’origine, à l’abri de la lumière.
6.5. Nature et contenu de l'emballage extérieur
VITAROS est fourni sous sachets individuels renfermant un (1) récipient unidose AccuDose. Chaque récipient unidose contient 100 mg de crème. VITAROS est disponible en boîtes de quatre (4) ou douze (12) récipients unidose. Les sachets sont constitués de papier laminé doublé d’un feuillet d’aluminium. Les éléments composant le contenant sont en polypropylène et en polyéthylène.
Toutes les présentations peuvent ne pas être commercialisées.
6.6. Précautions particulières d’élimination et de manipulation
Chaque récipient unidose est à usage unique.
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
6 RUE COPERNIC
75116 PARIS
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 275 438 7 6 : 4 récipient(s) unidose(s) polypropylène polyéthylène de 100 mg
· 34009 302 798 8 5 : 12 récipient(s) unidose(s) polypropylène polyéthylène de 100 mg
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[À compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[À compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Médicament soumis à prescription médicale.
ANSM - Mis à jour le : 20/09/2023
VITAROS 300 microgrammes, crème
Alprostadil
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin ou votre pharmacien.
· Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d’autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
1. Qu'est-ce que VITAROS 300 microgrammes, crème et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant d'utiliser VITAROS 300 microgrammes, crème ?
3. Comment utiliser VITAROS 300 microgrammes, crème ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver VITAROS 300 microgrammes, crème ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE VITAROS 300 microgrammes, crème ET DANS QUELS CAS EST-IL UTILISE ?
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D’UTILISER VITAROS 300 microgrammes, crème ?
N’utilisez jamais VITAROS 300 microgrammes, crème :
· si vous présentez des troubles sous-jacents comme une chute de la tension artérielle lorsque vous passez de la position couchée ou assise à la position debout, si vous avez des antécédents d’infarctus du myocarde (crise cardiaque) ou de syncope (sensations de vertige),
· si vous êtes allergique à l’alprostadil ou à l’un des autres composants contenus dans ce médicament mentionnés dans la rubrique 6,
· si vous présentez un trouble susceptible d’entraîner une érection prolongée ou une affection comme une anémie falciforme ou que vous êtes porteur du trait drépanocytaire, si vous présentez une hyperplaquettose ou une polyglobulie, si vous êtes atteint d’un myélome multiple ou d’une leucémie,
· si vous avez une malformation du pénis,
· si vous avez une inflammation ou une infection du pénis,
· si vous présentez un risque de thrombose veineuse,
· si vous présentez un syndrome d’hyperviscosité qui pourrait entraîner une érection prolongée,
· s’il vous a été demandé de ne pas avoir de rapports sexuels du fait de raisons de santé telles que des problèmes cardiaques ou la survenue récente d’un accident vasculaire cérébral (AVC),
· si votre partenaire est enceinte, qu’elle allaite ou est en âge de procréer, à moins que vous n’utilisiez un préservatif.
Avertissements et précautions
Adressez-vous à votre médecin ou pharmacien avant d’utiliser VITAROS si vous avez des antécédents des effets locaux suivants qui ont été observés sous VITAROS :
· érections se prolongeant plus de 4 heures (priapisme)
· hypotension symptomatique (sensations de vertige)
· insuffisance hépatique et/ou rénale, il est possible qu’il soit nécessaire d’utiliser une dose plus faible en raison d’altérations du métabolisme
· perte de connaissance (évanouissement)
· Un préservatif doit être utilisé dans les situations suivantes :
· votre partenaire est enceinte ou allaite
· votre partenaire est en âge de procréer
· pour la prévention des maladies sexuellement transmissibles
· lors d’un rapport sexuel oral ou anal
Seuls des préservatifs en latex ont été étudiés. Le risque qu’un préservatif fabriqué dans une autre matière puisse être endommagé n’est pas connu.
Enfants et adolescents
Sans objet.
Autres médicaments et VITAROS 300 microgrammes, crème
Informez votre médecin ou pharmacien si vous prenez, avez récemment pris ou pourriez prendre tout autre médicament.
Il n’a pas été réalisé d’étude sur l’utilisation de VITAROS avec d’autres médicaments employés pour traiter les troubles de l’érection. Par conséquent, si vous prenez d’autres médicaments pour les troubles de l’érection, abstenez-vous de toute association avec VITAROS, car cela risquerait d’entraîner des symptômes comme des sensations de vertige, une perte de connaissance et des érections prolongées. VITAROS n’a pas été étudié dans les cas où une prothèse pénienne était implantée ou lors d’administrations de médicaments relâchant la musculature lisse comme la papavérine ou de médicaments utilisés pour induire des érections tels que les antagonistes des récepteurs alpha adrénergiques (par exemple, la phentolamine par voie intracaverneuse ou le moxisylyte). Il existe un risque de priapisme (érection anormalement prolongée et douloureuse) en cas d’association.
Bien que non étudié, il est possible que VITAROS ait un effet moindre s’il est pris en association avec des traitements de l’hypertension artérielle, des décongestionnants ou des anorexigènes (coupe-faim).
Si vous prenez des médicaments visant à prévenir la formation de caillots sanguins, n’utilisez pas VITAROS car il existe un risque accru de saignement ou de sang dans les urines.
En association avec des médicaments de l’hypertension artérielle, VITAROS peut augmenter les symptômes de sensations vertigineuses et de perte de connaissance, en particulier chez le sujet âgé.
VITAROS 300 microgrammes, crème avec des aliments et boissons
Sans objet.
Grossesse allaitement et fertilité
Il n’existe pas de données sur l’utilisation de VITAROS chez la femme enceinte. Les femmes enceintes ne doivent pas être exposées à VITAROS.
Il est déconseillé d’utiliser VITAROS pendant l’allaitement.
Chez l’homme, on ne sait pas si VITAROS a un effet sur la fertilité masculine.
Conduite de véhicules et utilisation de machines
VITAROS peut provoquer des sensations de vertige ou des pertes de connaissance. Attendez 1 à 2 heures après l’administration pour conduire un véhicule ou utiliser une machine.
VITAROS 300 microgrammes, crème contient de l’éthanol
Ce médicament contient 5 mg d'alcool (éthanol) par dose de 100 mg, équivalent à 50 mg/g (5% w/w).
Cela peut provoquer une sensation de brûlure sur une peau endommagée.
3. COMMENT UTILISER VITAROS 300 microgrammes, crème ?
VITAROS doit être utilisé en fonction de ce qui est nécessaire pour obtenir une érection. Chaque contenant VITAROS AccuDose est à usage unique et doit être éliminé comme il convient après utilisation.
Pour une érection : la dose initiale doit être recommandée par un médecin. N’ajustez pas la dose vous-même. Consultez votre médecin qui vous indiquera la technique à utiliser pour administrer correctement le médicament ainsi que les ajustements de dose nécessaires.
N’appliquez pas VITAROS plus de 2 à 3 fois par semaine et seulement une seule fois par période de 24 heures.
L’effet apparaît dans un délai de 5 à 30 minutes suivant l’administration. La durée de l’effet est d’environ 1 à 2 heures. Cependant, la durée effective est variable d’un patient à l’autre.
Il est conseillé d’uriner avant d’utiliser VITAROS. Après avoir retiré le capuchon, appliquez tout le contenu de VITAROS dans l’ouverture à l’extrémité du pénis (méat) dans les 5 à 30 minutes avant une tentative de rapport sexuel en suivant les instructions ci-dessous :
|
1. Lavez-vous les mains avant d’appliquer VITAROS. Retirer le contenant AccuDose (voir Fig. 1) du sachet, en tirant vers le bas la languette située à l'entaille au haut de l'emballage. Conservez le sachet pour l’élimination du contenant AccuDose usagé ultérieurement. |
|
|
Figure 1
|
|
|
2. Amener le contenu de l’AccuDose à température ambiante en faisant rouler le corps du dispositif entre vos mains (voir Fig. 2). Cette étape peut être évitée si vous avez déjà sorti le sachet du réfrigérateur (dans les limites décrites dans la rubrique 5 Comment conserver VITAROS) et que le contenu a déjà atteint la température de la pièce. |
|
|
|
|
|
Figure 2 |
|
|
3. Tourner le piston poussoir plusieurs fois pour être sûr qu’il coulissera facilement (voir Fig. 3). Puis retirer le capuchon de protection de l’AccuDose. |
|
|
|
|
|
Figure 3 |
|
|
4. Saisir l’extrémité du pénis d’une main et comprimer délicatement pour élargir l’ouverture à l’extrémité du pénis tout en le tenant à la verticale (voir Fig. 4). Remarque : si vous n’êtes pas circoncis, commencez par décalotter le gland et maintenez le prépuce rabattu avant d’élargir le méat. |
|
|
|
|
|
Figure 4 |
|
|
5. Tenir le corps du dispositif AccuDose entre les doigts et, sans l’insérer dans le pénis (voir Fig. 5), placer l’embout du contenant le plus près possible de l’ouverture à l’extrémité du pénis pour que la crème puisse descendre dans l’urètre (conduit partant de la vessie qui transporte et permet l’écoulement de l’urine et du sperme à l’extérieur du corps). Ne pas oublier de pousser toute la crème contenue dans l’AccuDose. Délicatement mais fermement, appuyer sur le piston avec le pouce ou l’index, jusqu’à ce que toute la crème soit expulsée dans l’ouverture à l’extrémité du pénis et dans l’urètre. Remarque : Même s’il est important que toute la crème descende dans l’urètre, n’introduisez pas l’embout de l’AccuDose l’ouverture à l’extrémité du pénis. |
|
|
|
|
|
Figure 5 |
|
|
6. Tenir le pénis à la verticale pendant environ 30 secondes afin de permettre une bonne pénétration de la crème. Il est probable que l’ouverture du pénis ne puisse pas contenir toute la crème Tout excès de crème recouvrant l’ouverture au bout du pénis doit être poussée délicatement dans l’ouverture avec un doigt (Fig. 6). Ne pas utiliser de deuxième contenant AccuDose pour compenser la crème n’ayant pas pénétré dans le méat. Faire pénétrer tout excès de crème dans l’ouverture du pénis. Ne pas uriner immédiatement après l’application, le produit risque de ressortir avant d’avoir fait effet.
|
|
|
|
|
|
Figure 6 |
|
|
7. Attention, chaque dose de VITAROS est à usage unique. Remettre le capuchon sur le contenant AccuDose et placer celui-ci dans le sachet en aluminium qui a été ouvert, fermer le sachet en le repliant et éliminer conformément à la réglementation en vigueur. |
|
|
8. VITAROS peut provoquer une irritation des yeux. Lavez-vous les mains après avoir appliqué VITAROS. Utilisation chez les enfants et les adolescents VITAROS n’est pas indiqué chez l’enfant ou l’adolescent de moins de 18 ans. Si vous avez utilisé plus de VITAROS 300 microgrammes, crème que vous n’auriez dû : Il n’a pas été signalé de surdosage nécessitant un traitement lors de l’utilisation de VITAROS. Un surdosage en VITAROS est susceptible d’entraîner une chute de la tension artérielle, une perte de connaissance, des sensations de vertige, des douleurs persistantes au niveau du pénis et éventuellement une érection se prolongeant plus de 4 heures. Cela peut être à l’origine d’une aggravation permanente des troubles de l’érection. Appelez votre médecin dans les plus brefs délais si vous présentez l’un de ces effets. Si vous oubliez d’utiliser VITAROS 300 microgrammes, crème : Si vous arrêtez d’utiliser VITAROS 300 microgrammes, crème : Sans objet. Si vous avez d’autres questions sur l’utilisation de ce médicament, demandez plus d’informations à votre médecin ou à votre pharmacien. |
|
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Prenez immédiatement contact avec votre médecin en cas d’érection durant plus de 4 heures.
Il se peut que votre médecin réduise votre dose de VITAROS ou qu’il interrompe votre traitement.
Effets indésirables fréquents (peut toucher plus d’1 patient sur 10) :
Vous-même :
· douleurs locales légères à modérées, sensation de brûlure ou douleur et rougeur du pénis,
· éruption cutanée,
· prurit (démangeaisons) génital,
· œdème du pénis
· inflammation du gland du pénis (balanite)
· picotements au niveau du pénis, douleurs pulsatiles, engourdissement, sensation de brûlure
Votre partenaire :
· Sensations de brûlure ou démangeaisons de légère intensité, vaginite
Cet effet peut être dû au médicament ou à l’acte de pénétration vaginale. Le recours à un lubrifiant à base d’eau peut faciliter la pénétration vaginale.
Effets indésirables peu fréquents mais potentiellement graves (peut toucher jusqu’à 1 patient sur 100) :
Vous-même :
· étourdissements/sensations de vertige
· érection se prolongeant pendant plus de 4 heures
· perte de connaissance
· tension artérielle faible ou fréquence cardiaque rapide
· douleurs au point d’application ou dans les membres
· sténose (rétrécissement) urétrale
· sensibilité exagérée
· démangeaisons du pénis
· éruption génitale
· douleurs du scrotum
· sensation de lourdeur et de tension au niveau des organes génitaux
· absence de sensibilité au niveau de la verge
· inflammation des voies urinaires
Votre partenaire :
· prurit vulvo-vaginal
*Une augmentation de l’activité sexuelle/physique sous VITAROS peut majorer le risque d’infarctus du myocarde (crise cardiaque) ou d’accident vasculaire cérébral (AVC) chez les patients présentant des affections sous-jacentes ou des facteurs de risque (voir rubrique 2).
Si l’un des effets indésirables devient grave ou si vous remarquez tout effet indésirable non mentionné dans cette notice, parlez-en à votre médecin ou votre pharmacien.
Durée des effets indésirables :
La plupart des effets sont de courte durée et disparaissent sous 1 à 2 heures.
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin, votre pharmacien ou à votre infirmier/ère. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER VITAROS 300 microgrammes, crème ?
Tenir hors de la vue et de la portée des enfants.
N’utilisez pas VITAROS après la date de péremption indiquée sur la boîte, le sachet et l’étiquette du contenant AccuDose après Exp.
La date de péremption fait référence au dernier jour de ce mois.
A conserver au réfrigérateur (entre 2°C et 8°C).
Ne pas congeler.
Les sachets non entamés peuvent être conservés par le patient en dehors du réfrigérateur pendant 3 jours au maximum avant utilisation, à une température inférieure à 25 °C.
Une fois ce délai expiré, le produit doit être éliminé s’il n’a pas été utilisé.
Chaque applicateur est à usage unique.
Après ouverture, utiliser immédiatement, éliminer tout contenant utilisé partiellement.
A conserver dans le sachet d’origine, à l’abri de la lumière.
Ne jetez aucun médicament au tout-à-l’égout ni avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient VITAROS 300 microgrammes, crème
· La substance active est l’alprostadil.
Chaque récipient contient 300 microgrammes d’alprostadil dans 100 mg de crème.
Vitaros est disponible en boîte de quatre (4) ou douze (12) contenants unidose.
· Les autres composants sont l’eau purifiée, l’éthanol anhydre, le laurate d’éthyle, la gomme de guar d’hydroxypropyle, le chlorhydrate de dodécyl-2-(N,N-diméthylamino)-propionate, le phosphate monopotassique, l’hydroxyde de sodium pour ajustement du pH, l’acide phosphorique pour ajustement du pH.
Qu’est-ce que VITAROS 300 microgrammes, crème et contenu de l’emballage extérieur
Vitaros est une crème de couleur blanche à blanc cassé se présentant dans un contenant unidose, AccuDose. AccuDose est un contenant qui se compose d’un piston, d’un cylindre formant le corps du dispositif et d’un capuchon de protection.
Chaque contenant unidose est fourni dans un sachet protecteur.
Toutes les présentations peuvent ne pas être commercialisées.
Titulaire de l’autorisation de mise sur le marché
6 RUE COPERNIC
75116 PARIS
Exploitant de l’autorisation de mise sur le marché
6 RUE COPERNIC
75116 PARIS
Avenue de provence
13190 Allauch
OU
Recordati Industria Chimica e Farmaceutica, S.p.A.
Via M.Civitali,
20148 Milán
Italie
OU
Casen Recordati, S.L.
Autovía de Logroño, km. 13,300
50180 Utebo (Zaragoza)
Espagne
OU
Delpharm Huningue SAS
26 rue de la Chapelle
68330 Huningue
OU
Centre SpecialitEs Pharmaceutiques
ZAC des Suzots
35, rue de la Chapelle
63450 Saint Amant Tallende
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Ce médicament est autorisé dans les Etats membres de l'Espace Economique Européen sous les noms suivants : Conformément à la réglementation en vigueur.
[À compléter ultérieurement par le titulaire]
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
EFFETS APRES APPLICATION :
VITAROS agit en 5 à 30 minutes, délai au bout duquel vous pouvez avoir un rapport sexuel. Une fois le médicament administré, une stimulation sexuelle préliminaire aide à parvenir à l’excitation et à obtenir une érection. Une dose efficace de VITAROS doit permettre une érection suffisante pour un rapport sexuel. La durée de l’effet est d’environ 1 à 2 heures. Cependant, la durée effective est variable d’un patient à l’autre et dépend de la dose du médicament. Il se peut que VITAROS n’induise pas une érection comparable à celles que vous aviez lorsque vous étiez plus jeune. Certains patients pourront éventuellement présenter de légères douleurs, une sensation de brûlure et un inconfort dans la région du pénis ou de l’aine. Il est en outre possible que votre érection se prolonge pendant un certain temps après l’orgasme ou l’éjaculation. Une fois l’érection terminée, il se peut que vous ressentiez une sensation de lourdeur, de tension et de chaleur au niveau du pénis qui peut être légèrement sensible au contact. Ces effets sont normaux et peuvent durer quelques heures.
INFORMATIONS SUPPLEMENTAIRES ET ASPECTS PRATIQUES :
C’est vous-même et votre médecin qui déterminerez la dose de VITAROS appropriée. Si l’érection ne peut pas être maintenue pendant le temps nécessaire à la stimulation préliminaire et au rapport sexuel, il est possible qu’il faille augmenter votre dose. De même, si une érection dure plus longtemps que souhaité ou si les effets indésirables ne sont pas bien tolérés, une réduction de votre dose peut s’avérer nécessaire. Appelez votre médecin si vous pensez avoir peut-être besoin d’un ajustement de dose.
Facteurs pouvant améliorer l’érection :
· Etre bien reposé.
· Stimulation sexuelle préliminaire avec votre partenaire ou auto-stimulation en position assise ou couchée après application de VITAROS.
· Exercices musculaires pelviens, consistant par exemple à contracter et à relâcher plusieurs fois les muscles pelviens et fessiers. Ce sont les muscles mis en jeu pour arrêter le jet d’urine.
· Positions variées susceptibles de faciliter l’irrigation sanguine du pénis et non la restreindre.
Facteurs susceptibles de diminuer l’érection :
· Anxiété, fatigue, tension ou consommation excessive d’alcool.
· Le fait d’uriner immédiatement après l’application peut entraîner une perte du médicament.