Dernière mise à jour le 01/12/2025
SMOFKABIVEN PROTEINE, émulsion pour perfusion
Composition en substances actives
-
émulsion ( Composition pour 1000 ml d'émulsion après mélange )
- > alanine 9,2 g
- > arginine 7,9 g
- > glycine 7,2 g
- > histidine 2 g
- > isoleucine 3,3 g
- > leucine 4,8 g
- lysine4,3 g
- sous forme de : acétate de lysine
- > méthionine 2,8 g
- > phénylalanine 3,3 g
- > proline 7,3 g
- > sérine 4,3 g
- > taurine 0,65 g
- > thréonine 2,9 g
- > tryptophane L 1,3 g
- > tyrosine 0,26 g
- glucose anhydre85 g
- sous forme de : glucose monohydraté
Présentations
> 6 poches en polypropylène SEBS : styrène-éthylène-butylène-styrène copolyester-éther suremballée (s)/surpochée(s) à 3 compartiments (BIOFINE) de 506 ml
Code CIP : 34009 301 073 1 7
Déclaration de commercialisation : 01/06/2024
Cette présentation est agréée aux collectivités
> 4 poches en polypropylène SEBS : styrène-éthylène-butylène-styrène copolyester-éther suremballée (s)/surpochée(s) à 3 compartiments (BIOFINE) de 1012 ml
Code CIP : 34009 301 073 3 1
Déclaration de commercialisation : 26/03/2018
Cette présentation est agréée aux collectivités
> 4 poches en polypropylène SEBS : styrène-éthylène-butylène-styrène copolyester-éther suremballée (s)/surpochée(s) à 3 compartiments (BIOFINE) de 1518 ml
Code CIP : 34009 301 073 5 5
Déclaration de commercialisation : 26/03/2018
Cette présentation est agréée aux collectivités
> 4 poches en polypropylène SEBS : styrène-éthylène-butylène-styrène copolyester-éther suremballée (s)/surpochée(s) à 3 compartiments (BIOFINE) de 2025 ml
Code CIP : 34009 301 073 8 6
Déclaration de commercialisation : 26/03/2018
Cette présentation est agréée aux collectivités
Service médical rendu (SMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprès de la HAS (plus d'informations dans l'aide). Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Important | Avis du 07/02/2018 | Inscription (CT) | le service médical rendu par SMOFKABIVEN PROTEINE, émulsion pour perfusion est important dans l’indication de l’AMM. |
Amélioration du service médical rendu (ASMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprés de la HAS (plus d'informations dans l'aide). Les avis et synthéses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur de l'ASMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| V (Inexistant) | Avis du 07/02/2018 | Inscription (CT) | Cette spécialité est un complément de gamme qui n’apporte pas d’amélioration du service médical rendu (ASMR V) par rapport aux présentations déjà inscrites. |
ANSM - Mis à jour le : 22/06/2023
SMOFKABIVEN PROTEINE, émulsion pour perfusion
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
SMOFKABIVEN PROTEINE se présente sous la forme d’une poche à trois compartiments. Chacune des poches disponibles contient les volumes suivants selon sa contenance :
|
|
506 ml |
1012 ml |
1518 ml |
2025 ml |
2531 ml |
Pour 1000 ml |
|
Solution d’acides aminés 10% |
331 ml |
662 ml |
993 ml |
1325 ml |
1656 ml |
654 ml |
|
Glucose à 42% |
102 ml |
204 ml |
306 ml |
408 ml |
510 ml |
202 ml |
|
Émulsion lipidique 20% |
73 ml |
146 ml |
219 ml |
292 ml |
365 ml |
144 ml |
Ce qui correspond aux compositions totales suivantes :
|
Substances actives |
506 ml |
1012 ml |
1518 ml |
2025 ml |
2531 ml |
Pour 1000 ml |
|
Alanine |
4,6 g |
9,3 g |
14 g |
19 g |
23 g |
9,2 g |
|
Arginine |
4,0 g |
7,9 g |
12 g |
16 g |
20 g |
7,9 g |
|
Glycine |
3,6 g |
7,3 g |
11 g |
15 g |
18 g |
7,2 g |
|
Histidine |
1,0 g |
2,0 g |
3,0 g |
4,0 g |
5,0 g |
2,0 g |
|
Isoleucine |
1,7 g |
3,3 g |
5,0 g |
6,6 g |
8,3 g |
3,3 g |
|
Leucine |
2,4 g |
4,9 g |
7,3 g |
9,8 g |
12 g |
4,8 g |
|
Lysine (sous forme d’acétate) |
2,2 g |
4,4 g |
6,6 g |
8,7 g |
11 g |
4,3 g |
|
Méthionine |
1,4 g |
2,8 g |
4,3 g |
5,7 g |
7,1 g |
2,8 g |
|
Phénylalanine |
1,7 g |
3,4 g |
5,1 g |
6,8 g |
8,4 g |
3,3 g |
|
Proline |
3,7 g |
7,4 g |
11 g |
15 g |
19 g |
7,3 g |
|
Sérine |
2,2 g |
4,3 g |
6,5 g |
8,6 g |
11 g |
4,3 g |
|
Taurine |
0,33 g |
0,66 g |
1,0 g |
1,3 g |
1,7 g |
0,65 g |
|
Thréonine |
1,5 g |
2,9 g |
4,4 g |
5,8 g |
7,3 g |
2,9 g |
|
Tryptophane |
0,66 g |
1,3 g |
2,0 g |
2,7 g |
3,3 g |
1,3 g |
|
Tyrosine |
0,13 g |
0,26 g |
0,40 g |
0,53 g |
0,66 g |
0,26 g |
|
Valine |
2,1 g |
4,1 g |
6,2 g |
8,2 g |
10 g |
4,1 g |
|
Glucose (sous forme monohydratée) |
43 g |
86 g |
129 g |
171 g |
214 g |
85 g |
|
Huile de soja raffinée |
4,4 g |
8,8 g |
13 g |
18 g |
22 g |
8,7 g |
|
Triglycérides à chaîne moyenne |
4,4 g |
8,8 g |
13 g |
18 g |
22 g |
8,7 g |
|
Huile d’olive raffinée |
3,7 g |
7,3 g |
11 g |
15 g |
18 g |
7,2 g |
|
Huile de poisson riche en acides gras oméga-3 |
2,2 g |
4,4 g |
6,6 g |
8,8 g |
11 g |
4,3 g |
Correspondant à
|
|
506 ml |
1012 ml |
1518 ml |
2025 ml |
2531 ml |
Pour 1000 ml |
|
Acides aminés |
33,1 g |
66,3 g |
99,4 g |
133 g |
166 g |
65,5 g |
|
Azote |
5,3 g |
10,6 g |
15,9 g |
21,2 g |
26,5 g |
10,5 g |
|
Glucides |
|
|
|
|
|
|
|
Glucose (anhydre) |
42,8 g |
85,7 g |
129 g |
171 g |
214 g |
84,7 g |
|
Lipides |
14,6 g |
29,2 g |
43,8 g |
58,4 g |
73,0 g |
28,9 g |
|
Acétate 1) |
48,6 mmol |
97,2 mmol |
146 mmol |
194 mmol |
243 mmol |
96,0 mmol |
|
Phoshate 2) |
1,1 mmol |
2,2 mmol |
3,3 mmol |
4,4 mmol |
5,5 mmol |
2,2 mmol |
|
Apport calorique |
|
|
|
|
|
|
|
Total (environ) |
450 kcal 1,9 MJ |
900 kcal 3,8 MJ |
1350 kcal 5,6 MJ |
1800 kcal 7,5 MJ |
2250 kcal 9,4 MJ |
889 kcal 3,7 MJ |
|
Non-protéique (environ) |
317 kcal 1,3 MJ |
635 kcal 2,7 MJ |
952 kcal 4,0 MJ |
1270 kcal 5,3 MJ |
1590 kcal 6,6 MJ |
327 kcal 2,6 MJ |
1) Apporté par la solution d'acides aminés.
2) Apporté par l’émulsion lipidique
Pour la liste complète des excipients, voir rubrique 6.1.
Les solutions de glucose et d’acides aminés sont limpides, incolores à légèrement jaunes et dépourvues de particules. L’émulsion lipidique est blanche et homogène.
Osmolalité : environ 1400 mosmol/kg d’eau
Osmolarité : environ 1200 mosmol/l
pH (après mélange) : environ 5,6.
4.1. Indications thérapeutiques
4.2. Posologie et mode d'administration
L’aspect du produit après le mélange des 3 compartiments est une émulsion blanche.
La capacité du patient à éliminer les lipides et à métaboliser l’azote et le glucose, ainsi que ses besoins nutritionnels doivent déterminer la posologie et le débit de perfusion (voir rubrique 4.4).
La posologie est individuelle et doit être adaptée en fonction de l’état clinique du patient, de son poids, de ses besoins nutritionnels et énergétiques et être ajustée selon les apports oraux ou entéraux.
Les besoins azotés pour le maintien de la masse protéique de l’organisme dépendent de l’état du patient (par exemple état nutritionnel et degré de stress catabolique ou d’anabolisme).
Adultes
Les besoins sont de 0,6 à 0,9 g d’acides aminés/kg/jour (0,10 à 0,15 g d’azote/kg/jour) quand l’état nutritionnel est normal ou en présence d'un léger stress catabolique. Chez les patients en état de stress métabolique modéré à élevé avec ou sans malnutrition, les besoins sont de l'ordre de 0,9 à 1,6 g d’acides aminés/kg/jour (0,15 à 0,25 g d’azote/kg/jour). Les besoins azotés peuvent même être plus importants dans certaines situations très particulières (par exemple brûlures ou anabolisme important).
Posologie :
La posologie est de 13 à 31 ml de SMOFKABIVEN PROTEINE /kg/jour ce qui correspond à 0,85 à 2,0 g d’acides aminés/kg/jour (0,14 à 0,32 g d’azote/kg/jour) et 12 à 28 kcal/kg/jour d’énergie totale (8 à 19 kcal/kg/jour d’énergie non-protéique). Ces apports couvrent les besoins de la majorité des patients. Chez les patients obèses, la dose doit être déterminée en fonction du poids idéal estimé.
Débit de perfusion :
Le débit maximal de perfusion habituel est de 0,25 g/kg/h pour le glucose, 0,1 g/kg/h pour les acides aminés et 0,15 g/kg/h pour les lipides.
Le débit de perfusion ne doit pas excéder 1,5 ml/kg/heure (correspondant à 0,13 g de glucose, 0,10 g d’acides aminés et 0,04 g de lipides/kg/h). La durée recommandée de perfusion est de 14 à 24 heures.
Nutrition parentérale perdialytique (NPPD)
Le débit de perfusion maximal pour la nutrition parentérale perdialytique (NPPD) chez les patients adultes stables sous traitement de suppléance rénale chronique est de 3,0 ml/kg/h (correspondant à 0,20 g d'acides aminés/kg/h, 0,25 g de glucose/kg/h et 0,09 g lipides/kg/h). Le volume de perfusion dans la NPPD doit être guidé par l’écart entre l’apport alimentaire oral et les apports nutritionnels recommandés, les pertes inévitables de nutriments causées par le traitement de remplacement rénal ainsi que par la tolérance métabolique individuelle du patient. Le temps de perfusion habituel pour une utilisation la NPPD est de 3 à 5 heures, selon les besoins du patient et la durée prévue de la séance de thérapie de remplacement rénal. La dose quotidienne maximale recommandée reste inchangée.
Posologie maximale journalière :
La posologie maximale journalière varie en fonction de l’état clinique du patient et peut même changer d’un jour à l’autre. La posologie maximale journalière recommandée est de 31 ml/kg/jour.
La dose maximale quotidienne recommandée de 31 ml/kg/jour apporte 2,0 g d’acides aminés/kg/jour (correspondant à 0,32 g d’azote/kg/jour), 2,6 g de glucose/kg/jour, 0,9 g de lipides/kg/jour et une énergie totale de 28 kcal/kg/jour (correspondant à 19 kcal/kg/jour d’énergie non protéique).
Population pédiatrique
Enfants (de 2 à 11 ans) :
Posologie :
La dose, pouvant aller jusqu’à 31 ml/kg/jour, doit être régulièrement ajustée en fonction des besoins de l’enfant qui varient davantage que ceux des adultes.
Débit de perfusion :
Le débit de perfusion maximal recommandé est de 1,8 ml/kg/h (correspondant à 0,12 g d’acides aminés/kg/h, 0,15 g de glucose/kg/h et 0,05 g de lipides/kg/h). A ce débit maximal de perfusion, l’administration ne doit pas durer plus de 17 heures, sauf dans des cas exceptionnels sous surveillance particulière.
La durée recommandée de perfusion est de 12 à 24 heures.
Posologie maximale journalière :
La posologie maximale journalière varie en fonction de l’état clinique du patient et peut même changer d’un jour à l’autre. La posologie maximale journalière recommandée est de 31 ml/kg/jour.
La dose maximale quotidienne recommandée de 31 ml/kg/jour apporte 2 g d’acides aminés/kg/jour (correspondant à 0,32 g d’azote/kg/jour) 2,6 g de glucose/kg/jour, 0,9 g de lipides/kg/jour et une énergie totale de 28 kcal/kg/jour (correspondant à 19 kcal/kg/jour d’énergie non-protéique).
Adolescents (de 12 à 18 ans)
Pour les adolescents, SMOFKABIVEN PROTEINE peut être utilisé comme chez les adultes.
Mode d’administration
En perfusion intraveineuse par voie centrale.
Les cinq présentations de SMOFKABIVEN PROTEINE sont destinées aux patients dont les besoins nutritionnels sont élevés, modérément augmentés ou de base.
Pour apporter une nutrition parentérale complète, des oligo-éléments, des électrolytes et des vitamines doivent être ajoutés à SMOFKABIVEN PROTEINE en fonction des besoins du patient.
Pour les instructions concernant la reconstitution du médicament avant administration, voir la rubrique 6.6.
· Hyperlipidémie sévère
· Insuffisance hépatique sévère
· Troubles sévères de la coagulation sanguine
· Anomalies congénitales du métabolisme des acides aminés
· Insuffisance rénale sévère sans possibilité d’hémofiltration ou de dialyse
· Choc aigu
· Hyperglycémie non contrôlée
· Contre-indications générales d’un traitement par perfusion : œdème pulmonaire aigu, hyperhydratation et insuffisance cardiaque décompensée
· Syndrome hémophagocytaire
· État instable (par exemple état post-traumatique sévère, diabète décompensé, phase aiguë d’infarctus du myocarde, accident vasculaire cérébral, embolie, acidose métabolique, sepsis sévère, déshydratation hypotonique et coma hyperosmolaire).
· Nouveau-nés et enfants de moins de 2 ans
4.4. Mises en garde spéciales et précautions d'emploi
La capacité à éliminer les lipides est individuelle et doit donc être suivie conformément à la pratique habituelle du clinicien, généralement en contrôlant la triglycéridémie. La triglycéridémie ne doit pas excéder 4 mmol/l au cours de la perfusion. Un surdosage peut aboutir à un syndrome de surcharge graisseuse (voir rubrique 4.8).
SMOFKABIVEN PROTEINE doit être administré avec prudence en cas d’altération du métabolisme des lipides, qui peut survenir chez un patient présentant une insuffisance rénale, un diabète, une pancréatite, une altération de la fonction hépatique, une hypothyroïdie ou un sepsis.
Ce médicament contient de l’huile de graine de soja, de l’huile de poisson et des phospholipides d’œuf, ce qui peut provoquer dans de rares cas des réactions allergiques. Des réactions d’allergie croisées ont été observées entre le soja et l’arachide.
Afin d’éviter les risques liés à une perfusion trop rapide, il est recommandé de réaliser une perfusion continue et bien contrôlée, si possible au moyen d’une pompe volumétrique.
En raison de l’accroissement du risque d’infection associé à l'utilisation d'une veine centrale, des précautions strictes d'asepsie doivent être prises afin d'éviter toute contamination pendant l'insertion et la manipulation du cathéter.
Il est également nécessaire de surveiller la glycémie, l’ionogramme et l’osmolarité ainsi que le bilan liquidien, l’équilibre acido-basique et les explorations fonctionnelles hépatiques.
La formule sanguine et la coagulation doivent être surveillées quand des lipides sont administrés pendant une longue durée.
SMOFKABIVEN PROTEINE est pratiquement dépourvu d’électrolytes, et donc destiné aux patients ayant des besoins particuliers et/ou limités en électrolytes. Du sodium, du potassium, du calcium, du magnésium et une quantité additionnelle de phosphate doivent être ajoutés en fonction de l’état clinique du patient et des résultats d’un contrôle fréquent des taux sériques.
Les apports en phosphate et en potassium doivent être soigneusement contrôlés chez les insuffisants rénaux afin de prévenir une hyperphosphatémie et une hyperkaliémie.
La quantité de chacun des électrolytes à ajouter dépend de l’état clinique du patient et des résultats d’un contrôle fréquent des taux sériques.
La nutrition parentérale doit être réalisée avec prudence en cas d'acidose lactique, d'oxygénation cellulaire insuffisante ou d'augmentation de l'osmolarité sérique.
Tout signe ou symptôme de réaction anaphylactique (notamment fièvre, frissons, éruption ou dyspnée) doit entraîner l’arrêt immédiat de la perfusion.
En raison de sa teneur en lipides, SMOFKABIVEN PROTEINE peut interférer avec certains examens biologiques (notamment bilirubine, lactate déshydrogénase, saturation en oxygène, hémoglobinémie) si le sang est prélevé avant que les lipides administrés aient été éliminés de façon adéquate de la circulation sanguine. Les lipides sont éliminés après une période sans apport de lipides de 5 à 6 h chez la plupart des patients.
Une perfusion intraveineuse d’acides aminés s’accompagne d’une augmentation de l’excrétion urinaire d’oligo-éléments, notamment de cuivre et de zinc. Cela doit être pris en compte pour la détermination de la dose d’oligo-éléments, notamment au cours d'une nutrition intraveineuse de longue durée.
Chez les patients dénutris, l’instauration d’une nutrition parentérale peut précipiter des déséquilibres liquidiens entraînant un œdème pulmonaire et une insuffisance cardiaque congestive ainsi qu’une diminution de la concentration sérique du potassium, du phosphore, du magnésium et des vitamines hydrosolubles. Ces modifications peuvent apparaître en 24 à 48 heures, et une instauration prudente et lente de la nutrition parentérale est donc recommandée chez ces patients, ainsi qu’une surveillance étroite et une adaptation adéquate des liquides, électrolytes, minéraux et vitamines.
SMOFKABIVEN PROTEINE ne doit pas être administré en même temps que du sang dans le même dispositif de perfusion en raison d’un risque de pseudoagglutination.
Une administration d’insuline peut être nécessaire chez les patients hyperglycémiques.
SMOFKABIVEN PROTEINE est une émulsion de composition complexe. Il est fortement recommandé de ne pas ajouter d’autre solution si la compatibilité n’a pas été démontrée (voir rubrique 6.2).
En raison de la composition de la solution d’acides aminés de SMOFKABIVEN PROTEINE, celui-ci ne doit pas être administré chez le nouveau-né et l’enfant de moins de 2 ans. Il n’existe pas d’expérience clinique de l’utilisation de SMOFKABIVEN PROTEINE chez l’enfant âgé de 2 à 18 ans.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
L’héparine administrée à dose clinique peut induire une libération transitoire de lipoprotéine lipase dans la circulation. Il peut en résulter une augmentation initiale de la lipolyse plasmatique suivie d’une diminution transitoire de l’élimination des triglycérides.
L’huile de graines de soja contient naturellement de la vitamine K1. La concentration de cette vitamine dans SMOFKABIVEN PROTEINE est cependant si faible qu’elle ne devrait pas significativement influencer le processus de la coagulation chez les patients traités par un dérivé coumarinique.
4.6. Fertilité, grossesse et allaitement
Il n’existe pas de donnée concernant l’exposition de femmes enceintes ou qui allaitent à SMOFKABIVEN PROTEINE. Aucune étude de toxicité sur la reproduction chez l’animal n’est disponible. La nutrition parentérale peut devenir nécessaire au cours de la grossesse et de l’allaitement. SMOFKABIVEN PROTEINE ne doit être administré à une femme enceinte ou qui allaite qu’après une étude approfondie de la situation
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
|
|
Fréquent ≥ 1/100 à < 1/10 |
Peu fréquent ≥ 1/1 000 à < 1/100 |
Rare ≥ 1/10 000 à < 1/1 000 |
|
Affections cardiaques |
|
|
Tachycardie |
|
Affections respiratoires, thoraciques et médiastinales |
|
|
Dyspnée |
|
Affections gastro-intestinales |
|
Perte d’appétit, nausées, vomissements |
|
|
Troubles du métabolisme et de la nutrition |
|
Taux plasmatiques élevés d'enzymes hépatiques |
|
|
Affections vasculaires |
|
|
Hypotension, hypertension |
|
Troubles généraux et anomalies au site d’administration |
Légère augmentation de la température corporelle |
Frissons, sensations vertigineuses, céphalées |
Réactions d’hypersensibilité (ex. réactions anaphylactiques ou anaphylactoïdes, éruption cutanée, urticaire, bouffées vasomotrices, céphalées), sensation de chaleur ou de froid, pâleur, cyanose, douleurs cervicales, dorsales, osseuses, thoraciques et lombaires. |
En cas de survenue de l’un de ces effets indésirables au cours de la perfusion de SMOFKABIVEN PROTEINE, celle-ci doit être interrompue ou, si nécessaire, poursuivie à une dose plus faible.
Syndrome de surcharge graisseuse
Une altération de la capacité à éliminer les triglycérides peut aboutir à un « syndrome de surcharge graisseuse », qui peut être dû à un surdosage. Des signes de surcharge métabolique doivent être recherchés. La cause peut être génétique (différences métaboliques interindividuelles), ou le métabolisme lipidique peut être altéré par une affection en cours ou antérieure. Ce syndrome peut également apparaître au cours d'une hypertriglycéridémie sévère, même au débit de perfusion recommandé, et en association à une modification subite de l’état clinique du patient, par exemple une altération de la fonction rénale ou une infection. Le syndrome de surcharge graisseuse se caractérise par les manifestations suivantes : hyperlipémie, fièvre, infiltration lipidique, hépatomégalie avec ou sans ictère, splénomégalie, anémie, leucopénie, thrombopénie, troubles de la coagulation, hémolyse et réticulocytose, anomalies des explorations fonctionnelles hépatiques et coma. Ces troubles disparaissent habituellement à l’arrêt de la perfusion de l'émulsion lipidique.
Perfusion excessive d’acides aminés
Comme avec les autres solutions d’acides aminés, le contenu en acides aminés de SMOFKABIVEN PROTEINE peut induire des effets indésirables si le débit de perfusion excède celui recommandé. Ces effets sont des nausées, des vomissements, des frissons et une sudation. Une perfusion d'acides aminés peut également induire une augmentation de la température corporelle. Un accroissement du taux de métabolites azotés (par exemple créatinine, urée) peut survenir en cas d’altération de la fonction rénale.
Perfusion excessive de glucose
Une hyperglycémie survient en cas de dépassement des capacités d'élimination du glucose du patient.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet :www.signalement-sante.gouv.fr.
Voir rubrique 4.8, « Syndrome de surcharge graisseuse », « Perfusion excessive d’acides aminés » et « Perfusion excessive de glucose ».
La perfusion doit être ralentie ou arrêtée en cas de manifestation de surdosage en lipides ou en acides aminés. Il n’existe aucun antidote spécifique du surdosage. La prise en charge d'urgence doit reposer sur des mesures générales de soutien, avec une surveillance particulière de la fonction respiratoire et du système cardiovasculaire. Une surveillance étroite des paramètres biochimiques est indispensable et les anomalies constatées doivent être traitées de façon adéquate.
Si une hyperglycémie survient, elle doit être traitée en fonction de l’état clinique du patient par administration appropriée d’insuline et/ou adaptation du taux de perfusion.
De plus, un surdosage peut être à l'origine d'une surcharge liquidienne, de déséquilibres électrolytiques et d'une hyperosmolalité.
Dans certains cas rares et graves, une hémodialyse, une hémofiltration ou une hémodiafiltration peuvent être envisagées.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Classe pharmacothérapeutique : solutions pour nutrition parentérale, code ATC : B05BA10
Émulsion lipidique
L’émulsion lipidique de SMOFKABIVEN PROTEINE se compose de SMOFLIPID dont la taille des particules et les propriétés biologiques sont similaires à celles des chylomicrons endogènes. Les composants de SMOFLIPID (huile de graines de soja, triglycérides à chaîne moyenne, huile d’olive et huile de poisson) possèdent leurs propres propriétés pharmacodynamiques, à l’exception de leur teneur en énergie.
L’huile de graine de soja est riche en acides gras essentiels. L’acide linoléique (acide gras oméga-6) est le plus abondant (environ 55 à 60%). L’acide alpha-linolénique, un acide gras oméga-3, représente environ 8% de ces acides gras. Ce constituant du produit apporte la quantité nécessaire en acide gras essentiels.
Les acides gras à chaîne moyenne sont rapidement oxydés et apportent à l'organisme de l'énergie sous forme immédiatement disponible.
L’huile d’olive apporte de l’énergie sous la forme d’acides gras mono-insaturés, qui sont beaucoup moins sujets à une peroxydation que la quantité correspondante d’acides gras poly-insaturés.
L’huile de poisson se caractérise par sa teneur élevée en acide eicosapentaénoïque (EPA) et en acide docosahexaénoïque (DHA). Le DHA est une composante structurelle importante des membranes cellulaires, tandis que l’EPA est un précurseur d'eicosanoïdes tels que les prostaglandines, les thromboxanes et les leucotriènes.
Deux études cliniques ont été réalisées sur des patients recevant une nutrition parentérale à domicile au long cours. Leur objectif principal était de démontrer la bonne tolérance du traitement. L’efficacité était l’objectif secondaire de l’une des études portant sur la population pédiatrique. Cette étude divisait la population pédiatrique en 2 groupes : de 1 mois à moins de 2 ans et de 2 à 11 ans. Ces 2 études montrent que la tolérance de SMOFLIPID est la même que celle du comparateur (Intralipide 20 %). L’efficacité dans une population pédiatrique a été évaluée par la recherche d’une augmentation du poids, de la taille, une mesure de l’indice de masse corporelle, les taux de pré-albuminémie et de RBP plasmatique ainsi que par le profil en acide gras. Après 4 semaines de traitement, aucune différence n’a été observée entre ces deux groupes à l’exception du profil en acide gras. Une augmentation des acides gras oméga-3 dans les lipoprotéines plasmatiques et dans les phospholipides des globules rouges, reflet de la composition de l’émulsion lipidique perfusée, a été observée chez les patients recevant SMOFLIPID.
Acides aminés
Les acides aminés, constituants des protéines de l’alimentation habituelle, sont utilisés pour la synthèse du tissu protéique, et leur éventuel excédent est dirigé vers diverses voies métaboliques. Des études ont montré qu’une perfusion d’acides aminés exerçait un effet thermogène.
Glucose
Le glucose ne devrait exercer aucun effet pharmacodynamique, à l’exception de sa contribution au maintien ou à la restauration d’un état nutritionnel normal.
5.2. Propriétés pharmacocinétiques
Émulsion lipidique
Les taux d’élimination de chacun des triglycérides présents dans SMOFLIPID sont différents, mais SMOFLIPID, à titre de mélange, est éliminé plus rapidement que les triglycérides à chaîne longue (TCL). Sur l'ensemble des composants, le taux d'élimination le plus lent est celui de l'huile d'olive (légèrement plus lent que celui des TCL), le plus rapide étant celui des triglycérides à chaîne moyenne (TCM). Le taux d’élimination de l’huile de poisson mélangée à des TCL est identique à celui des TCL seuls.
Acides aminés
Les propriétés pharmacocinétiques des acides aminés et des électrolytes perfusés ou apportés par l’alimentation habituelle sont quasiment identiques. Cependant, les acides aminés provenant des protéines alimentaires passent tout d’abord par la veine porte puis dans la circulation systémique, tandis que les acides aminés perfusés passent directement dans la circulation systémique.
Glucose
Les propriétés pharmacocinétiques du glucose perfusé ou apporté par l’alimentation habituelle sont quasiment identiques
5.3. Données de sécurité préclinique
Une étude chez le cobaye (test de maximalisation) a montré qu'une émulsion d'huile de poisson possédait un potentiel modéré de sensibilisation cutanée. Une étude de l’antigénicité systémique n’a révélé aucun signe de potentiel anaphylactique de l’huile de poisson.
La perfusion intraveineuse SMOFKABIVEN (la voie d'administration prévue), ainsi que les injections intra-artérielles, intramusculaires, paraveineuses et sous-cutanées n'ont révélé aucun changement imputable à la substance chez les lapins. SMOFKABIVEN est un produit ayant la même composition qualitative que SMOFKABIVEN PROTEINE.
Ce médicament ne peut être mélangé qu'avec des solutions nutritionnelles dont la compatibilité a été documentée, voir section 6.6.
Durée de conservation du médicament dans son conditionnement de vente
2 ans.
Durée de conservation après mélange des compartiments La stabilité physico-chimique dans la poche à trois compartiments après mélange a été démontrée pendant 48 heures à 20-25°C. Toutefois du point de vue microbiologique, le produit doit être utilisé immédiatement. En cas d’utilisation non immédiate, la durée et les conditions de conservation avant utilisation relèvent de la seule responsabilité de l’utilisateur et ne devraient pas dépasser 24 heures à une température comprise entre 2°C et 8°C, sauf si les mélanges ont été effectués en conditions d’asepsie dûment contrôlées et validées
Durée de conservation après mélange avec des additifs
La stabilité physicochimique dans la poche à trois compartiments après mélange avec des additifs (voir section 6.6) a été démontrée pendant 7 jours, c'est-à-dire 6 jours à 2°-8°C suivis de 48 heures à 20-25°C, incluant la durée d'administration. Du point de vue microbiologique, le produit doit être utilisé immédiatement quand un ajout a été effectué. En cas d’utilisation non immédiate, les durées et conditions de conservation avant administration relèvent de la seule responsabilité de l’utilisateur et ne devraient pas dépasser 24 heures à une température comprise entre 2°C et 8°C sauf si les mélanges ont été effectués en conditions d'asepsie dûment contrôlées et validées
6.4. Précautions particulières de conservation
Pour les conditions de conservation du médicament après mélange des compartiments, voir la rubrique 6.3.
Pour les conditions de conservation du médicament après mélange avec des additifs, voir la rubrique 6.3.
6.5. Nature et contenu de l'emballage extérieur
Le conditionnement se compose d’une poche multi-compartiment et d’un suremballage. La poche est divisée en trois compartiments par des soudures pelables. Un absorbeur d’oxygène est placé entre la poche et le suremballage. Le matériau constitutif de la poche est en polymère multicouches Biofine.
Le film Biofine de la poche est en poly (propylène-co-éthylène) ; caoutchouc synthétique poly [styrène-bloc-(butylène-co-éthylène)] (SEBS) et caoutchouc synthétique poly(styrène-bloc-isoprène) SIS.
Les sites de perfusion et de supplémentation sont en polypropylène et en caoutchouc synthétique poly [styrène-bloc-(butylène-co-éthylène)] (SEBS) munis de bouchons synthétiques en polyisoprène (sans latex). Le site condamné, utilisé uniquement lors de la fabrication, est en polypropylène muni d’un bouchon synthétique en polyisoprène (sans latex).
Tailles de conditionnement :
Boîte de 1 ou 6 poches de 506 ml
Boîte de 1 ou 4 poches de 1012 ml
Boîte de 1 ou 4 poches de 1518 ml
Boîte de 1 ou 4 poches de 2025 ml
Boîte de 1 ou 3 poches de 2531 ml
Toutes les présentations peuvent ne pas être commercialisées.
6.6. Précautions particulières d’élimination et de manipulation
Instruction d’utilisation
Ne pas utiliser si le conditionnement est endommagé. N’utiliser que si les solutions d'acides aminés et de glucose sont limpides et incolores ou légèrement jaunes et si l’émulsion lipidique est blanche et homogène. Les contenus des trois compartiments doivent être mélangés avant administration, et avant tout ajout par le site de supplémentation.
Après séparation des soudures pelables, la poche doit être retournée plusieurs fois afin d’assurer un mélange homogène, dépourvu de tout aspect de séparation de phase.
Compatibilité
Des données de compatibilité sont disponibles avec produits nommés Dipeptiven, Suppliven, Glycophos, Addiphos, Vitalipide Adultes/Enfants et Soluvit en quantités définies et avec des électrolytes en concentrations définies. Lors des ajouts d'électrolytes, les quantités déjà présentes dans la poche doivent être prises en compte pour répondre aux besoins cliniques du patient. Les données générées obtenues justifient les ajouts dans la poche indiqués dans le tableau récapitulatif ci-dessous :
Intervalle de compatibilité : stable pendant 8 jours, c'est-à-dire 6 jours de stockage à 2-8°C suivis de 48 heures à 20-25°C
|
|
Unités |
Quantité maximale totale |
||||
|
Taille de la poche SmofKabiven E Protéine |
ml |
506 |
1012 |
1518 |
2025 |
2531 |
|
Additif |
|
Volume |
||||
|
Dipeptiven |
ml |
0 - 150 |
0 - 300 |
0 - 300 |
0 - 300 |
0 - 300 |
|
Suppliven |
ml |
0 - 10 |
0 - 20 |
0 - 20 |
0 - 20 |
0 - 20 |
|
Soluvit |
flacon |
0 - 1 |
0 - 2 |
0 - 2 |
0 - 2 |
0 - 2 |
|
Vitalipid Adultes/Enfants |
ml |
0 - 10 |
0 - 20 |
0 - 20 |
0 - 20 |
0 - 20 |
|
Electrolytes1 |
|
Quantité par poche |
||||
|
Sodium |
mmol |
≤ 150 |
≤ 150 |
≤ 150 |
≤ 150 |
≤ 150 |
|
Potassium |
mmol |
≤ 150 |
≤ 150 |
≤ 150 |
≤ 150 |
≤ 150 |
|
Calcium |
mmol |
≤ 5 |
≤ 5 |
≤ 5 |
≤ 5 |
≤ 5 |
|
Magnésium |
mmol |
≤ 5 |
≤ 5 |
≤ 5 |
≤ 5 |
≤ 5 |
|
Phosphate inorganique (Addiphos) OU Phosphate organique (Glycophos)2 |
mmol |
≤ 15
|
≤ 15
|
≤ 15
|
≤ 15
|
≤ 15
|
|
Zinc |
mmol |
≤ 0.2 |
≤ 0.2 |
≤ 0.2 |
≤ 0.2 |
≤ 0.2 |
|
Sélénium |
µmol |
≤ 2 |
≤ 2 |
≤ 2 |
≤ 2 |
≤ 2 |
1 inclut les quantités de tous les produits.
Remarque : ce tableau est destiné à indiquer la compatibilité. Il ne s'agit pas de recommandations posologiques.
Pour les médicaments cités, avant de prescrire, se référer aux informations de prescription approuvées au niveau national.
La compatibilité avec d’autres additifs et la durée de conservation de divers mélanges seront communiquées sur demande.
Tout ajout doit être effectué de façon aseptique.
A usage unique exclusivement. Tout mélange restant après une perfusion doit être jeté.
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
5, place du Marivel
92316 Sèvres Cedex
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 301 073 0 0: 506 ml en poche à 3 compartiments (BIOFINE) ; boîte de 1
· 34009 301 073 1 7 : 506 ml en poche à 3 compartiments (BIOFINE) ; boîte de 6
· 34009 301 073 2 4 : 1012 ml en poche à 3 compartiments (BIOFINE) ; boîte de 1
· 34009 301 073 3 1 : 1012 ml en poche à 3 compartiments (BIOFINE) ; boîte de 4
· 34009 301 073 4 8 : 1518 ml en poche à 3 compartiments (BIOFINE) ; boîte de 1
· 34009 301 073 5 5 : 1518 ml en poche à 3 compartiments (BIOFINE) ; boîte de 4
· 34009 301 073 6 2 : 2025 ml en poche à 3 compartiments (BIOFINE) ; boîte de 1
· 34009 301 073 8 6 : 2025 ml en poche à 3 compartiments (BIOFINE) ; boîte de 4
· 34009 301 073 9 3 : 2531 ml en poche à 3 compartiments (BIOFINE) ; boîte de 1
· 34009 301 074 0 9 : 2531 ml en poche à 3 compartiments (BIOFINE) ; boîte de 3
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Liste I
ANSM - Mis à jour le : 22/06/2023
SMOFKABIVEN PROTEINE, émulsion pour perfusion
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin, votre pharmacien ou votre infirmier/ère.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin, à votre pharmacien ou à votre infirmier/ère. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
1. Qu'est-ce que SMOFKABIVEN PROTEINE, émulsion pour perfusion et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant d'utiliser SMOFKABIVEN PROTEINE, émulsion pour perfusion ?
3. Comment utiliser SMOFKABIVEN PROTEINE, émulsion pour perfusion ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver SMOFKABIVEN PROTEINE, émulsion pour perfusion ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE SMOFKABIVEN PROTEINE, émulsion pour perfusion ET DANS QUELS CAS EST-IL UTILISE ?
Un professionnel de santé vous administrera SMOFKABIVEN PROTEINE si d'autres formes d'alimentation n'ont pas été suffisantes ou n'ont pas agi.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D’UTILISER SMOFKABIVEN PROTEINE, émulsion pour perfusion ?
N’utilisez jamais SMOFKABIVEN PROTEINE, émulsion pour perfusion :
· si vous êtes allergique (hypersensible) aux substances actives ou à l’un des autres composants contenus dans ce médicament, mentionnés dans la rubrique 6;
· si vous êtes allergique au poisson ou à l’œuf ;
· si vous êtes allergique à l'arachide ou au soja, vous ne devez pas utiliser ce médicament. SMOFKABIVEN PROTEINE contient de l’huile de soja ;
· si le taux de lipide dans votre sang est trop élevé (hyperlipidémie) ;
· si avez une maladie grave du foie ;
· si vous avez des troubles de la coagulation sanguine ;
· si votre organisme utilise mal les acides aminés ;
· si vous avez une maladie grave des reins sans possibilité de dialyse ;
· si vous êtes en état de choc aigu ;
· si vous avez trop de sucre dans votre sang (hyperglycémie) et si cette situation n’est pas contrôlée ;
· si vous avez du liquide dans les poumons (œdème pulmonaire aigu) ;
· si vous avez trop de liquide dans votre organisme (hyperhydratation) ;
· si vous avez une insuffisance cardiaque non traitée ;
· si vous avez une anomalie de la coagulation sanguine (syndrome hémophagocytaire) ;
· si vous êtes dans un état instable, par exemple après un traumatisme grave ou en cas de diabète non contrôlé, de crise cardiaque aiguë, d’accident vasculaire cérébral, de caillot sanguin, d'acidose métabolique (troubles résultant d'une trop grande quantité d'acides dans le sang), d'infection grave (sepsis sévère), de coma ou si votre organisme ne contient pas assez de liquide (déshydratation hypotonique).
· Chez le nourrisson et l’enfant de moins de 2 ans
Avertissements et précautions
Adressez-vous à votre médecin avant d’utiliser SMOFKABIVEN PROTEINE, émulsion pour perfusion si vous avez l’un des problèmes suivants :
· troubles rénaux
· diabète
· pancréatite (inflammation du pancréas)
· troubles hépatiques
· hypothyroïdie (problèmes thyroïdiens)
· sepsis (infection grave).
Prévenez immédiatement le professionnel de santé si vous ressentez l’un des troubles suivants pendant la perfusion : fièvre, éruption, gonflement, difficulté à respirer, frissons, sueurs, nausées ou vomissements, car il peut s’agir de manifestations d’une réaction allergique ou de signes indiquant que vous avez reçu une trop grande quantité de SMOFKABIVEN PROTEINE.
Votre médecin contrôlera régulièrement votre formule sanguine afin de vérifier votre fonction hépatique et les autres éléments du sang.
Enfants et adolescents
SMOFKABIVEN PROTEINE ne doit pas être utilisé chez le nouveau-né ni chez l’enfant de moins de 2 ans. SMOFKABIVEN PROTEINE peut être donné aux enfants entre 2 et 18 ans
Autres médicaments et SMOFKABIVEN PROTEINE, émulsion pour perfusion
Informez votre médecin si vous utilisez, avez récemment utilisé ou pourriez utiliser tout autre médicament.
SMOFKABIVEN PROTEINE, émulsion pour perfusion avec des aliments, boissons et de l’alcool
Sans objet.
Il n’existe aucune donnée sur l’administration de SMOFKABIVEN PROTEINE au cours de la grossesse ou de l’allaitement. SMOFKABIVEN PROTEINE ne doit donc être administré à une femme enceinte ou qui allaite que si le médecin le juge nécessaire. L’utilisation de SMOFKABIVEN PROTEINE pendant la grossesse ou l’allaitement ne doit être envisagée que sur les conseils de votre médecin.
Conduite de véhicules et utilisation de machines
Sans objet.
SMOFKABIVEN PROTEINE, émulsion pour perfusion contient
Sans objet.
3. COMMENT UTILISER SMOFKABIVEN PROTEINE, émulsion pour perfusion ?
Votre médecin décidera de la dose vous convenant en fonction de votre poids et de l’état de vos fonctions.
SMOFKABIVEN PROTEINE vous sera administré par un professionnel de santé.
Si vous avez utilisé plus de SMOFKABIVEN PROTEINE, émulsion pour perfusion que vous n’auriez dû
Il est peu probable que vous receviez une quantité trop élevée de SMOFKABIVEN PROTEINE, car il vous sera administré par un professionnel de santé.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Fréquent (peut affecter jusqu’à 1 personne sur 10) : légère augmentation de la température corporelle.
Peu fréquent (peut affecter jusqu’à 1 personne sur 100) : concentration sanguine (plasma) élevée de composés provenant du foie, manque d’appétit, nausées, vomissements, frissons, étourdissements et maux de tête.
Rare (peut affecter jusqu’à 1 personne sur 1 000) : pression artérielle basse ou élevée, difficulté à respirer, battements rapides du cœur (tachycardie). Réactions d’hypersensibilité (pouvant se traduire par des symptômes tels que gonflement, fièvre, diminution de la pression artérielle, éruption cutanée, urticaire (plaques rouges en relief), bouffées de chaleur, maux de tête). Sensations de chaleur et de froid. Pâleur. Légère coloration bleue des lèvres et de la peau (en raison d’un taux trop bas d’oxygène dans le sang). Douleurs au niveau du cou, du dos, des os, de la poitrine et des lombaires.
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin, à votre pharmacien ou à votre infirmier/ère. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet: www.signalement-sante.gouv.fr
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER SMOFKABIVEN PROTEINE, émulsion pour perfusion ?
Tenir ce médicament hors de la vue et de la portée des enfants.
A conserver à une température ne dépassant pas 25°C. Ne pas congeler. Conserver dans le suremballage.
N’utilisez pas ce médicament après la date de péremption indiquée sur la poche et sur l’étiquette de la boîte après EXP. La date de péremption fait référence au dernier jour de ce mois.
N’utilisez pas ce médicament si vous remarquez des signes visibles de détérioration.
Ne jetez aucun médicament au tout-à-l’égout. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient SMOFKABIVEN PROTEINE, émulsion pour perfusion
· Les substances actives sont (pour 1000 ml) :
Alanine.............................................................................................................................. 9,2 g
Arginine............................................................................................................................. 7,9 g
Glycine.............................................................................................................................. 7,2 g
Histidine............................................................................................................................ 2,0 g
Isoleucine.......................................................................................................................... 3,3 g
Leucine.............................................................................................................................. 4,8 g
Lysine (sous forme d’acétate)............................................................................................. 4,3 g
Méthionine......................................................................................................................... 2,8 g
Phenylalanine..................................................................................................................... 3,3 g
Proline............................................................................................................................... 7,3 g
Sérine................................................................................................................................ 4,3 g
Taurine............................................................................................................................. 0,65 g
Thréonine........................................................................................................................... 2,9 g
Tryptophane...................................................................................................................... 1,3 g
Tyrosine........................................................................................................................... 0,26 g
Valine................................................................................................................................ 4,1 g
Glucose (sous forme monohydratée)................................................................................... 85 g
Huile de soja, raffinée........................................................................................................ 8,7 g
Triglycérides à chaîne moyenne.......................................................................................... 8,7 g
Huile d’olive, raffinée.......................................................................................................... 7,2 g
Huile de poisson, riche en acides gras oméga-3.................................................................. 4,3 g
· Les autres composants sont :
Glycérol, phospholipides d’œuf purifiés, tout-rac-a-tocophérol, hydroxyde de sodium (pour ajustement du pH), oléate de sodium, acide acétique glacial (pour ajustement du pH), acide chlorhydrique (pour ajustement du pH) et eau pour préparations injectables
Qu’est-ce que SMOFKABIVEN PROTEINE, émulsion pour perfusion et contenu de l’emballage extérieur
Ce médicament se présente sous forme d'une émulsion pour perfusion, Les solutions de glucose et d’acides d’aminés sont limpides, incolores ou légèrement jaunes et dépourvues de particules. L’émulsion lipidique est blanche et homogène.
Poches de 506 ml (boîtes de 1 et 6) ; 1012 ml (boîtes de 1 et 4) ; 1518 ml (boîtes de 1 et 4) ; 2025 ml (boîtes de 1 et 4) ; 2531 ml (boîtes de 1 et 3).
Toutes les présentations peuvent ne pas être commercialisées
Titulaire de l’autorisation de mise sur le marché
5, place du Marivel
92316 Sèvres Cedex
Exploitant de l’autorisation de mise sur le marché
FRESENIUS KABI FRANCE
5, place du Marivel
92316 Sèvres Cedex
RAPSGATAN 7
751 74 UPPSALA
SuEDE
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Ce médicament est autorisé dans les Etats membres de l'Espace Economique Européen sous les noms suivants : Conformément à la réglementation en vigueur.
[À compléter ultérieurement par le titulaire]
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
{mois AAAA}.
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).
"------------------------------------------------------------------------------------------------------------------------------------
Les informations suivantes sont destinées exclusivement aux professionnels de santé:
Mises en garde et précautions d’emploi
Afin d’éviter les risques liés à une perfusion trop rapide, il est recommandé de réaliser une perfusion continue et bien contrôlée, si possible au moyen d’une pompe volumétrique.
En raison de l’accroissement du risque d’infection associé à l'utilisation d'une veine centrale, des précautions strictes d'asepsie doivent être prises afin d'éviter toute contamination, particulièrement pendant l'insertion et la manipulation du cathéter.
Les taux sériques de glucose et d’électrolytes et l’osmolarité, de même que l’équilibre hydrique, l’équilibre acido-basique, les paramètres de la fonction hépatique et des enzymes doivent être surveillés.
Tout signe ou symptôme de réaction anaphylactique (notamment fièvre, frissons, éruption ou dyspnée) doit entraîner l’arrêt immédiat de la perfusion.
SMOFKABIVEN PROTEINE ne doit pas être administré en même temps que du sang dans le même dispositif de perfusion en raison d’un risque de pseudoagglutination.
Mode d’administration
En perfusion intraveineuse par voie centrale.
Afin d’apporter une nutrition parentérale complète, des oligo-éléments, des électrolytes et des vitamines doivent être ajoutés à SMOFKABIVEN PROTEINE en fonction des besoins du patient.
Posologie
Adultes
La posologie est de 13 à 31 ml de SMOFKABIVEN PROTEINE /kg/jour ce qui correspond à 0,14 à 0,32 g d’azote/kg/jour (0,85 à 2,0 g d’acides aminés/kg/jour) et 12 à 28 kcal/kg/jour d’énergie totale (8 à 19 kcal/kg/jour d’énergie non-protéique).
Débit de perfusion
Le débit maximal de perfusion est de 0,25 g/kg/h pour le glucose, 0,1 g/kg/h pour les acides aminés et 0,15 g/kg/h pour les lipides.
Le débit de perfusion ne doit pas excéder 1,5 ml/kg/heure (correspondant à 0,13 g de glucose, 0,10 g d’acides aminés et 0,04 g de lipides/kg/h). La durée recommandée de perfusion est de 14 à 24 heures.
Nutrition parentérale perdialytique (NPPD)
Le débit de perfusion maximal pour la nutrition parentérale perdialytique (NPPD) chez les patients adultes stables sous traitement de suppléance rénale chronique est de 3,0 ml/kg/h (correspondant à 0,20 g d'acides aminés/kg/h, 0,25 g de glucose/kg/h et 0,09 g lipides/kg/h). Le volume de perfusion dans la NPPD doit être guidé par l’écart entre l’apport alimentaire oral et les apports nutritionnels recommandés, les pertes inévitables de nutriments causées par le traitement de remplacement rénal ainsi que par la tolérance métabolique individuelle du patient. Le temps de perfusion habituel pour une utilisation en NPPD est de 3 à 5 heures, selon les besoins du patient et la durée prévue de la séance de thérapie de remplacement rénal. La dose quotidienne maximale recommandée reste inchangée.
Posologie maximale journalière
La posologie maximale journalière habituelle varie en fonction de l’état clinique du patient et peut même changer d’un jour à l’autre. La posologie maximale journalière recommandée est de 31 ml/kg/jour.
Population pédiatrique
Enfants (de 2 à 11 ans)
Posologie :
La dose, pouvant aller jusqu’à 31 ml/kg/jour, doit être régulièrement ajustée en fonction des besoins de l’enfant qui varient davantage que ceux des adultes.
Débit de perfusion :
Le débit de perfusion maximal recommandé est de 1,8 ml/kg/h (correspondant à 0,12 g d’acides aminés/kg/h, 0,15 g de glucose/kg/h et 0,05 g de lipides/kg/h). A ce débit maximal de perfusion, l’administration ne doit pas durer plus de 17 heures, sauf dans des cas exceptionnels sous surveillance particulière.
La durée recommandée de perfusion est de 12 à 24 heures.
Posologie maximale journalière :
La posologie maximale journalière varie en fonction de l’état clinique du patient et peut même changer d’un jour à l’autre. La posologie maximale journalière recommandée est de 31 ml/kg/jour.
Adolescents (de 12 à 18 ans)
Pour les adolescents, SMOFKABIVEN PROTEINE peut être utilisé comme chez les adultes.
Précautions particulières d’utilisation
Ne pas utiliser si le conditionnement est endommagé.
N’utiliser que si les solutions d'acides aminés et de glucose sont limpides et incolores ou légèrement jaunes et si l’émulsion lipidique est blanche et homogène. Les contenus des trois compartiments doivent être mélangés avant l’administration, et avant tout ajout par le site de supplémentation.
Après séparation des soudures pelables, la poche doit être retournée plusieurs fois afin d’assurer un mélange homogène dépourvu de tout aspect de séparation de phase.
A usage unique exclusivement. Toute solution inutilisée restant après perfusion doit être jetée.
Compatibilité
Des données de compatibilité sont disponibles avec les produits nommés Dipeptiven, Suppliven, Glycophos, Addiphos, Vitalipide Adultes/Enfants et Soluvit en quantités définies et avec des' électrolytes en concentrations définies. Lors des ajouts d'électrolytes, les quantités déjà présentes dans la poche doivent être prises en compte pour répondre aux besoins cliniques du patient. Les données obtenues justifient les ajouts dans la poche indiqués dans le tableau récapitulatif ci-dessous :
Intervalle de compatibilité stable pendant 7 jours, c'est-à-dire 6 jours de stockage à 2-8°C suivis de 48 heures à 20-25°C
|
|
Unités |
Quantité maximale totale |
||||
|
Taille de la poche SmofKabiven E protéine |
ml |
506 |
1012 |
1518 |
2025 |
2531 |
|
Additif |
|
Volume |
||||
|
Dipeptiven |
ml |
0 - 150 |
0 - 300 |
0 - 300 |
0 - 300 |
0 - 300 |
|
Suppliven |
ml |
0 - 10 |
0 - 20 |
0 - 20 |
0 - 20 |
0 - 20 |
|
Soluvit |
flacon |
0 - 1 |
0 - 2 |
0 - 2 |
0 - 2 |
0 - 2 |
|
Vitalipid Adultes/Enfants |
ml |
0 - 10 |
0 - 20 |
0 - 20 |
0 - 20 |
0 - 20 |
|
Electrolytes1 |
|
Quantité par poche |
||||
|
Sodium |
mmol |
≤ 150 |
≤ 150 |
≤ 150 |
≤ 150 |
≤ 150 |
|
Potassium |
mmol |
≤ 150 |
≤ 150 |
≤ 150 |
≤ 150 |
≤ 150 |
|
Calcium |
mmol |
≤ 5 |
≤ 5 |
≤ 5 |
≤ 5 |
≤ 5 |
|
Magnésium |
mmol |
≤ 5 |
≤ 5 |
≤ 5 |
≤ 5 |
≤ 5 |
|
Phosphate inorganique (Addiphos) OU Phosphate organique (Glycophos) |
mmol |
≤ 15
|
≤ 15
|
≤ 15
|
≤ 15
|
≤ 15
|
|
Zinc |
mmol |
≤ 0.2 |
≤ 0.2 |
≤ 0.2 |
≤ 0.2 |
≤ 0.2 |
|
Sélénium |
µmol |
≤ 2 |
≤ 2 |
≤ 2 |
≤ 2 |
≤ 2 |
1 inclut les quantités de tous les produits.
Remarque : Ce tableau présente des données de compatibilité. Il ne doit pas être considéré comme une recommandation posologique.
Pour les médicaments cités, avant de prescrire, se référer aux informations de prescription approuvées au niveau national.
La compatibilité avec d’autres additifs et la durée de conservation de divers mélanges seront communiquées sur demande. Tout ajout doit être effectué de façon aseptique.
Durée de conservation après mélange
La stabilité physico-chimique dans la poche à trois compartiments après mélange a été démontrée pendant 48 heures à 20-25°C. Toutefois du point de vue microbiologique, le produit doit être utilisé immédiatement. En cas d’utilisation non immédiate, la durée et les conditions de conservation avant administration relèvent de la seule responsabilité de l’utilisateur et ne devraient pas dépasser 24 heures à 2-8°C, sauf si les mélanges ont été effectués e conditions d’asepsie dûment contrôlées et validées.
Durée de conservation après mélange avec des additifs
La stabilité physicochimique dans la poche à trois compartiments après mélange avec des additifs a été démontrée pendant 7 jours, c'est-à-dire 6 jours à 2°-8°C suivis de 48 heures à 20-25°C, incluant la durée d'administration. Pour des raisons de sécurité microbiologique, le produit doit être utilisé immédiatement quand un ajout a été effectué. En cas d’utilisation non immédiate, la durée et les conditions de conservation avant administration relèvent de la responsabilité de l’utilisateur et ne doivent normalement pas excéder 24 heures à 2-8°C, sauf si les mélanges ont été effectués e conditions d’asepsie dûment contrôlées et validées.
Instruction d’utilisation de SMOFKABIVEN PROTEINE
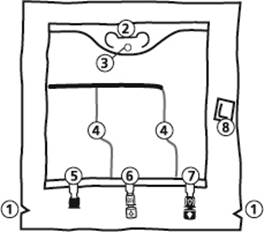
La Poche
|
|
506 mL, 1012 ml, 1518 ml, 2025 ml, 2531 ml |
|
|
|
1. Encoches pour ouverture du suremballage
2. Poignée
3. Orifice de suspension de la poche
4. Soudures pelables
5. Site condamné (utilisé uniquement lors de la fabrication)
6. Site de supplémentation
7. Site de perfusion
8. Absorbeur d’oxygène
|
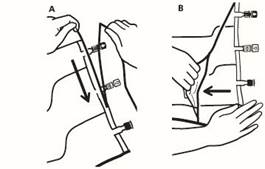
1. Retrait du suremballage |
|
|
|
Pour retirer le suremballage, tenir la poche horizontalement et déchirer les encoches proches des sites de supplémentation et de perfusion (A). Retirer le suremballage et le jeter avec l’absorbeur d’oxygène (B).
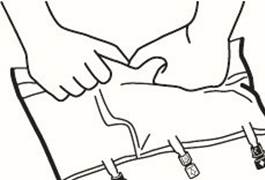
|
2. Reconstitution du mélange |
|
|
|
Placer la poche sur une surface plane.
|
|
|
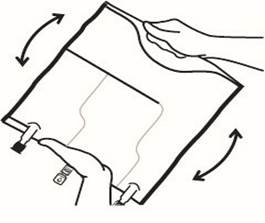
Faire rouler la poche doucement sur elle-même à partir de la poignée en direction des sites, en commençant avec la main droite et en exerçant une pression constante avec la main gauche jusqu'à rupture des soudures verticales. Les soudures verticales s’ouvrent sous la pression des fluides. Le mélange peut également être effectué avant le retrait du suremballage. Remarque : les solutions se mélangent facilement, bien que la soudure horizontale reste fermée.
|
|
|
Mélanger le contenu des 3 compartiments en retournant la poche plusieurs fois de bas en haut jusqu'à ce que les solutions soient complètement mélangées.
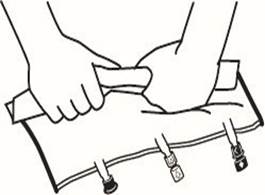
|
3. Supplémentation et perfusion |
|
|
|
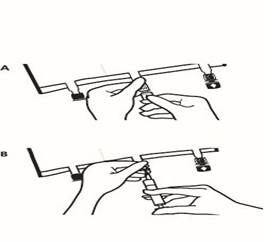
Placer la poche sur une surface plane. Juste avant d’injecter les additifs, rompre le Twist Off (flèche vers la poche) du site blanc de supplémentation (A). Remarque : la membrane à l’intérieur du site de supplémentation est stérile. Maintenir la base du site de supplémentation. Introduire l’aiguille, injecter les additifs (dont la compatibilité a été vérifiée) au centre du site de supplémentation (B). Homogénéiser le mélange, entre chaque supplémentation, en retournant la poche plusieurs fois. Utiliser des seringues avec des aiguilles Gauge 18-23 et de 40 mm de longueur maximum |
|
|
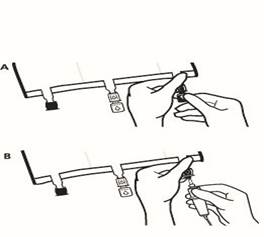
Juste avant la mise en place du perfuseur, rompre le Twist Off (flèche vers le bas) du site bleu de perfusion (A). Remarque : la membrane à l’intérieur du site de supplémentation est stérile. Utiliser une tubulure de perfusion sans prise d’air ou fermer la prise d’air dans le cas contraire. Maintenir la base du site de perfusion Percuter à l’aide du trocart le site de perfusion. Le trocart doit être complètement enfoncé pour sécuriser sa mise en place. Remarque : La partie intérieure du site de perfusion est stérile. |
|
4. Suspension de la poche |
|
|
|
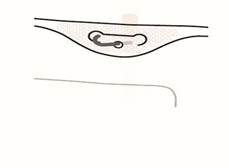
Suspendre la poche par l’orifice situé sous la poignée.
|