
NORDITROPINE NORDIFLEX 10 mg/1,5 ml, solution injectable en stylo prérempli - Résumé des caractéristiques du produit |
 |
|
ANSM - Mis à jour le : 28/04/2023
NORDITROPINE NORDIFLEX 10 mg/1,5 ml, solution injectable en stylo prérempli
2. COMPOSITION QUALITATIVE ET QUANTITATIVE 
Un ml de solution contient 6,7 mg de somatropine.
somatropine (obtenue par la technique de l’ADN recombinant sur E-coli).
1 mg de somatropine correspond à 3 UI (Unité Internationale) de somatropine.
Pour la liste complète des excipients, voir rubrique 6.1.
Solution injectable en stylo prérempli.
Solution incolore et limpide.
4.1. Indications thérapeutiques 
Retard de croissance lié à un déficit somatotrope.
Retard de croissance chez les filles présentant une dysgénésie gonadique (Syndrome de Turner).
Retard de croissance chez les enfants prépubères dû à une insuffisance rénale chronique.
Retard de croissance (taille actuelle < -2,5 DS et taille parentale ajustée < -1 DS) chez les enfants nés petits pour l’âge gestationnel (PTAG) avec un poids et/ou une taille de naissance inférieure à -2 DS, n’ayant pas rattrapé leur retard de croissance (vitesse de croissance < 0 DS au cours de la dernière année) à l’âge de 4 ans ou plus.
Retard de croissance lié au syndrome de Noonan.
Adultes :
Déficit somatotrope acquis dans l’enfance :
Une fois leur croissance achevée, la capacité sécrétoire en hormone de croissance devra être réévaluée chez les patients ayant un déficit somatotrope acquis dans l’enfance. Aucun test n’est requis chez les patients ayant plus de trois déficits hormonaux hypophysaires, chez les patients ayant un déficit somatotrope sévère dû à une cause génétique définie, dû à des anomalies structurales hypothalamo-hypophysaires, dû à des tumeurs du système nerveux central ou dû à une irradiation intra-crânienne à forte dose, ou chez les patients ayant un déficit somatotrope secondaire à une pathologie ou une atteinte hypothalamo-hypophysaire, si le dosage d’IGF-1 (Insulin-like Growth Factor 1) est < -2 DS au moins quatre semaines après l’arrêt du traitement par hormone de croissance.
Chez tous les autres patients, un dosage d’IGF-1 et un test dynamique de stimulation à l’hormone de croissance sont exigés.
Déficit somatotrope acquis à l’âge adulte :
Déficit somatotrope important dans le cadre d’une pathologie hypothalamo-hypophysaire connue, d’une irradiation intra-crânienne ou d’une lésion cérébrale traumatique. Le déficit somatotrope devra être associé à un autre axe déficitaire, autre que la prolactine. Le déficit somatotrope devra être mis en évidence lors d’une épreuve dynamique après instauration d’une substitution hormonale adéquate de tout autre déficit hormonal.
Chez l’adulte, l’hypoglycémie insulinique est l’épreuve dynamique de choix. Lorsque l’hypoglycémie insulinique est contre-indiquée, des tests dynamiques alternatifs doivent être utilisés. La combinaison arginine-GHRH est recommandée. Le test à l’arginine ou au glucagon peut aussi être envisagé ; cependant, la valeur diagnostique de ces tests est moins bien établie que celle du test de l’hypoglycémie insulinique.
4.2. Posologie et mode d'administration 
Norditropine devra être prescrit uniquement par des médecins spécialisés dans ces indications thérapeutiques.
La posologie doit être adaptée à chaque patient et doit toujours être ajustée en fonction des résultats cliniques et biologiques du traitement.
Posologies généralement recommandées :
Population pédiatrique
Retard de croissance lié à un déficit somatotrope
0,025 à 0,035 mg/kg/jour ou 0,7 à 1,0 mg/m2/jour
Si le déficit somatotrope persiste une fois la croissance achevée, le traitement par hormone de croissance devra être maintenu jusqu’au développement somatique complet de l’adulte, incluant la masse maigre et l’accrétion minérale osseuse (pour l’adaptation posologique, voir Déficit en hormone de croissance chez l’adulte).
Syndrome de Turner
0,045 à 0,067 mg/kg/jour ou 1,3 à 2,0 mg/m2/jour
Insuffisance rénale chronique
0,050 mg/kg/jour ou 1,4 mg/m2/jour (voir rubrique 4.4)
Retard de croissance chez les enfants nés petits pour l’âge gestationnel
0,035 mg/kg/jour ou 1,0 mg/m²/jour
Une dose de 0,035 mg/kg/jour est habituellement recommandée jusqu’à ce que la taille finale soit atteinte (voir rubrique 5.1). Le traitement devra être arrêté après la première année de traitement si la vitesse de croissance est inférieure à + 1 DS.
Le traitement devra être arrêté si la vitesse de croissance est < 2 cm/an et, si une confirmation est nécessaire, soit l’âge osseux > 14 ans (pour les filles) soit > 16 ans (pour les garçons), correspondant à la soudure des épiphyses.
Syndrome de Noonan
0,066 mg/kg/jour est la dose recommandée, cependant dans certains cas la dose de 0,033 mg/kg/jour peut-être suffisante (voir rubrique 5.1).
Le traitement doit être interrompu au moment de la fermeture épiphysaire (voir rubrique 4.4).
Population adulte
Déficit en hormone de croissance chez l’adulte
La posologie doit être adaptée en fonction des besoins de chaque patient.
Chez les patients ayant un déficit somatotrope acquis dans l’enfance, la dose recommandée pour ré-instaurer le traitement est de 0,2 à 0,5 mg/jour. La dose devra ensuite être adaptée en fonction des concentrations en IGF-1.
Chez les patients avec un déficit somatotrope acquis à l’âge adulte, il est recommandé de débuter le traitement à une dose faible : 0,1 à 0,3 mg/jour. Il est recommandé d’augmenter la posologie progressivement par intervalles mensuels en fonction des résultats cliniques et des effets secondaires. La détermination du taux sérique d’IGF-1 peut guider l’adaptation de la posologie. Les femmes peuvent nécessiter des doses plus élevées que les hommes, les hommes montrant une sensibilité croissante à l'IGF-1 au fil du temps. Cela signifie qu'il y a un risque que les femmes, notamment celles qui reçoivent un traitement oestrogénique par voie orale, soient sous-traitées alors que les hommes sont sur-traités.
Les doses nécessaires diminuent avec l'âge. La posologie d’entretien varie considérablement d’un patient à l’autre mais elle dépasse rarement 1,0 mg/jour.
Mode d’administration
En général, il est recommandé d’administrer le médicament par voie sous-cutanée tous les soirs.
Il est nécessaire de varier le site d’injection pour prévenir l’apparition de lipoatrophies.
Hypersensibilité à la substance active ou à l’un des excipients mentionnés à la rubrique 6.1.
La somatropine ne doit pas être utilisée s’il existe le moindre élément en faveur d’une activité tumorale. Les tumeurs intracrâniennes doivent être inactives et tout traitement anti-tumoral doit être terminé avant de commencer le traitement par hormone de croissance. Le traitement devra être interrompu en cas d’élément signifiant une croissance tumorale.
La somatropine ne devra pas être utilisée pour améliorer la croissance staturale chez des enfants dont les épiphyses sont soudées.
Les patients présentant un état critique aigu souffrant de complications secondaires à une intervention chirurgicale à cœur ouvert, une intervention chirurgicale abdominale, un polytraumatisme accidentel, une insuffisance respiratoire aiguë ou à une situation similaire ne devront pas être traités par la somatropine (voir rubrique 4.4).
Chez les enfants présentant une insuffisance rénale chronique, le traitement par Norditropine NordiFlex devra être suspendu en cas de transplantation rénale.
4.4. Mises en garde spéciales et précautions d'emploi 
Traçabilité
Afin d'améliorer la traçabilité des médicaments biologiques, le nom et le numéro de lot du produit administré doivent être clairement enregistrés.
Les enfants traités par la somatropine devront être suivis régulièrement par un médecin spécialisé dans la croissance. Le traitement par la somatropine devra toujours être instauré par un médecin spécialisé et expérimenté dans le diagnostic et le traitement de l’insuffisance en hormone de croissance. Ceci est également valable pour le suivi des cas de syndrome de Turner, d’insuffisance rénale chronique, du retard de croissance chez les enfants nés petits pour l’âge gestationnel et du syndrome de Noonan. Les données sur la taille adulte définitive après traitement par Norditropine sont limitées chez les enfants présentant un syndrome de Noonan et ne sont pas disponibles pour les enfants présentant une insuffisance rénale chronique.
La dose journalière maximale recommandée ne devra pas être dépassée (voir rubrique 4.2).
La stimulation de la croissance staturale chez les enfants ne peut se faire qu’avant la soudure des épiphyses.
Enfants
Traitement du déficit en hormone de croissance chez les patients présentant un syndrome de Prader-Willi
Des cas de mort subite ont été rapportés après l’initiation du traitement par la somatropine chez des patients présentant un syndrome de Prader-Willi, et qui présentaient un ou plusieurs des facteurs de risque suivants : obésité sévère, antécédents d’obstruction des voies aériennes supérieures ou d’apnée du sommeil, ou d’infection respiratoire non spécifiée.
Retard de croissance chez les enfants nés petits pour l’âge gestationnel
Chez les enfants nés petits pour l’âge gestationnel, les autres raisons médicales ou traitements pouvant expliquer un retard de croissance devront être exclus avant de commencer le traitement.
L’expérience en ce qui concerne l’initiation du traitement à proximité du démarrage pubertaire chez les enfants nés petits pour l’âge gestationnel est limitée. Par conséquent, il n’est pas recommandé d’initier le traitement à proximité du démarrage pubertaire.
L’expérience chez les patients présentant un syndrome de Silver-Russell est limitée.
Syndrome de Turner
Il est recommandé de surveiller la croissance des mains et des pieds chez les patientes présentant un syndrome de Turner et traitées par la somatropine. Si une augmentation de la croissance des mains et des pieds est observée, une diminution de la dose vers la limite inférieure de l’intervalle de doses devra être envisagée.
Les filles présentant un syndrome de Turner présentent généralement un risque accru de développer des otites moyennes, c’est pourquoi un examen otologique est recommandé au moins une fois par an.
Insuffisance rénale chronique
La posologie chez les enfants présentant une insuffisance rénale chronique est individuelle et doit être adaptée en fonction de la réponse individuelle au traitement (voir rubrique 4.2). Le retard de croissance lié à l’insuffisance rénale devra être clairement établi avant traitement par la somatropine par le suivi de la croissance sous un traitement conservateur optimal de l’insuffisance rénale pendant un an. Le traitement de l’insuffisance rénale devra être maintenu et, si besoin, associé à la dialyse pendant la durée du traitement par la somatropine.
Les patients ayant une insuffisance rénale chronique développent habituellement une dégradation progressive de la fonction rénale liée à l’évolution naturelle de la maladie. Par prudence, lors du traitement par la somatropine, la fonction rénale devra être surveillée pour dépister une dégradation excessive ou une augmentation de la filtration glomérulaire (qui pourrait impliquer une hyperfiltration).
Scoliose
Une scoliose est connue pour être plus fréquente dans certains groupes de patients traités par somatropine comme ceux présentant un syndrome de Turner et un syndrome de Noonan. De plus, chez tous les enfants, la scoliose est susceptible d'évoluer lors d’une croissance rapide. Il n’a pas été démontré que la somatropine augmentait l’incidence ou la sévérité de scolioses. Les signes de scoliose devront être surveillés au cours du traitement.
Glycémie et insulinémie
Chez les enfants présentant un syndrome de Turner et chez les enfants nés petits pour l’âge gestationnel, il est recommandé de mesurer l’insulinémie et la glycémie à jeun avant de commencer le traitement puis annuellement. Chez les patients ayant un risque accru de diabète (par exemple : antécédents familiaux de diabète, obésité, insulino-résistance sévère, acanthosis nigricans), un test d’hyperglycémie provoqué par voie orale devra être réalisé. Si un diabète clinique apparaît, la somatropine ne devra pas être administrée.
La somatropine ayant une influence sur le métabolisme glucidique, les patients devront être surveillés afin de détecter une éventuelle intolérance au glucose.
IGF-1
Chez les enfants présentant un syndrome de Turner et chez les enfants nés petits pour l’âge gestationnel, il est recommandé de mesurer le taux d’IGF-1 avant d’instaurer le traitement et par la suite de le mesurer deux fois par an. Si, sur des mesures répétées, les taux d’IGF-1 sont supérieurs à +2 DS par rapport aux normes pour l’âge et le stade pubertaire, la dose devra être diminuée afin d’obtenir un taux d’IGF-1 dans les limites de la normale.
Une partie du gain de taille chez les enfants nés petits pour l’âge gestationnel traités par la somatropine pourrait disparaître si le traitement est arrêté avant que la taille finale ne soit atteinte.
Adultes
Déficit en hormone de croissance chez l’adulte
Le déficit en hormone de croissance chez l’adulte est une maladie chronique qui doit être traitée comme telle. Cependant, dans le déficit en hormone de croissance chez l’adulte, les données chez les patients âgés de plus de 60 ans et chez les patients traités depuis plus de cinq ans sont encore limitées.
Adultes et enfants
Pancréatite
Bien que rare, la pancréatite doit être envisagée chez les patients traités par somatropine qui développent des douleurs abdominales, en particulier chez les enfants.
Population générale
Tumeurs
Il n’y a aucune preuve en faveur d’une augmentation du risque de nouveaux cancers primitifs chez les enfants ou les adultes traités par la somatropine.
Chez les patients en rémission complète de maladie tumorale bénigne ou maligne, le traitement par la somatropine n’a pas été associé à une augmentation du taux de récidive.
Une légère augmentation globale de tumeurs secondaires a été observée chez les patients traités par hormone de croissance et ayant eu un cancer pendant l’enfance, les tumeurs intracrâniennes étant les plus fréquentes. Le facteur de risque principal pour une tumeur secondaire semble être un traitement préalable par radiothérapie.
Les patients qui ont eu une rémission complète d’une maladie tumorale maligne devront être suivis attentivement après le début de leur traitement par la somatropine afin de détecter une éventuelle récidive du processus tumoral.
Leucémies
Certains cas de leucémies ont été rapportés chez un petit nombre de patients présentant un déficit en hormone de croissance, dont certains avaient été traités par la somatropine. Cependant, il n’a pas été mis en évidence d’augmentation de l’incidence des leucémies chez les sujets recevant de la somatropine et ne présentant pas de facteurs de prédisposition.
Hypertension intracrânienne bénigne
En cas de céphalées sévères ou répétées, de troubles visuels, de nausées et/ou vomissements, il est recommandé d’effectuer un fond d'oeil à la recherche d’un oedème papillaire. En cas d’oedème papillaire confirmé, il faudra envisager un diagnostic d'hypertension intracrânienne bénigne et le traitement par la somatropine devra être interrompu si nécessaire.
A l'heure actuelle, il n’y a pas suffisamment de données pour orienter la décision thérapeutique chez les patients ayant une hypertension intracrânienne résolue. Si le traitement par la somatropine est ré-instauré, une surveillance attentive afin de rechercher l’apparition de signes d'hypertension intracrânienne est nécessaire.
En cas de déficit somatotrope secondaire à une lésion intracrânienne, les patients devront être examinés fréquemment afin de détecter une éventuelle progression ou récidive d’un processus malin sous-jacent.
Fonction thyroïdienne
La somatropine augmente la conversion extra-thyroïdienne de T4 en T3 et peut ainsi révéler une hypothyroïdie débutante. C’est pourquoi la surveillance de la fonction thyroïdienne devra être effectuée chez tous les patients. Chez les patients présentant un hypopituitarisme, le traitement standard substitutif doit être étroitement suivi lors de l’administration du traitement par la somatropine.
Chez les patients présentant une maladie hypophysaire évolutive, une hypothyroïdie peut se développer.
Les patientes présentant un syndrome de Turner présentent un risque accru de développement d’hypothyroïdie primaire lié à des anticorps anti-thyroïdiens. Sachant que l’hypothyroïdie interfère avec la réponse au traitement par la somatropine, les patients devront faire contrôler régulièrement leur fonction thyroïdienne et devront recevoir des hormones thyroïdiennes en traitement de substitution si nécessaire.
Sensibilité à l’insuline
La somatropine pouvant diminuer la sensibilité à l’insuline, une intolérance au glucose devra être recherchée chez les patients traités (voir rubrique 4.5). Chez les patients diabétiques, un ajustement de la dose d’insuline peut s’avérer nécessaire après initiation d’un traitement à base de somatropine. Les patients présentant un diabète ou une intolérance au glucose devront être étroitement surveillés pendant le traitement par la somatropine.
Anticorps
Comme avec tous les produits contenant de la somatropine, un faible pourcentage de patients peut développer des anticorps anti-somatropine. Le potentiel de liaison de ces anticorps est faible et il n’y a pas d’effet sur la croissance. La recherche d’anticorps anti-somatropine devra être réalisée chez tous les patients ne répondant pas au traitement.
Insuffisance surrénalienne aiguë
L'initiation du traitement par la somatropine peut entraîner une inhibition de la 11βHSD-1 et réduire les concentrations sériques de cortisol. Chez les patients traités par la somatropine, une insuffisance surrénale centrale (secondaire) non diagnostiquée auparavant peut être découverte et un traitement substitutif par glucocorticoïde peut être nécessaire. De plus, les patients traités par glucocorticoïde pour une insuffisance surrénalienne préalablement diagnostiquée peuvent nécessiter une augmentation de leurs doses d'entretien ou de leurs doses en cas de stress, après le début du traitement par la somatropine (voir rubrique 4.5).
Utilisation avec un traitement œstrogénique oral
Si une femme traitée par somatropine débute un traitement œstrogénique par voie orale, il peut être nécessaire d'augmenter la dose de somatropine pour maintenir les taux sériques d'IGF-1 dans l’intervalle normal pour l'âge. Inversement, si une femme sous somatropine interrompt un traitement œstrogénique oral, il se peut que la dose de somatropine doive être réduite pour éviter un excès d'hormone de croissance et / ou des effets indésirables (voir rubrique 4.5).
Epiphysiolyse de la tête fémorale
Chez les patients présentant des troubles endocriniens, y compris un déficit en hormone de croissance, des épiphysiolyses de la tête fémorale peuvent apparaître plus fréquemment que dans la population générale. Un patient traité par somatropine qui se met à boiter ou se plaint de douleurs au niveau de la hanche ou du genou doit être examiné par un médecin.
Expérience issue des essais cliniques
Deux essais cliniques contrôlés versus placebo menés chez des patients hospitalisés en unités de soins intensifs ont démontré une augmentation de la mortalité chez les patients présentant un état critique aigu dû à des complications secondaires à une intervention chirurgicale à cœur ouvert ou à une intervention chirurgicale abdominale, à un polytraumatisme accidentel ou à une insuffisance respiratoire aiguë, et qui ont été traités par de fortes doses de somatropine (5,3 à 8 mg/jour). La sécurité relative à la poursuite du traitement par la somatropine chez les patients recevant des doses substitutives dans les indications validées et qui développent un état critique aigu n’a pas été établie. Par conséquent, le bénéfice potentiel de la poursuite du traitement par la somatropine chez les patients en état critique aigu devra être évalué au regard de ce risque potentiel.
Un essai clinique randomisé, en ouvert, mené chez des patients présentant un syndrome de Turner (dose de 0,045 à 0,090 mg/kg/jour) a montré une tendance de risque dose-dépendant d’otites externes et d’otites moyennes. L’augmentation des infections de l’oreille n’a pas conduit à une augmentation des opérations de l’oreille/insertions de tube de drainage tympanique par rapport au groupe ayant la plus faible dose dans l’essai.
Excipients
Norditropine contient moins de 1 mmol de sodium (23 mg) par 1,5 ml, c'est-à-dire essentiellement « sans sodium ».
4.5. Interactions avec d'autres médicaments et autres formes d'interactions 
L'hormone de croissance diminue la conversion de la cortisone en cortisol et peut mettre en évidence une insuffisance surrénale centrale non encore diagnostiquée ou rendre inefficaces de faibles doses des glucocorticoïdes (voir rubrique 4.4).
Chez les femmes sous traitement œstrogénique substitutif par voie orale, une dose plus élevée d'hormone de croissance peut être nécessaire pour atteindre l’objectif du traitement (voir rubrique 4.4).
Selon les résultats d’une étude d’interaction réalisée chez des adultes présentant un déficit en hormone de croissance, l’administration de la somatropine peut augmenter la clairance des composés connus pour être métabolisés par les isoenzymes du cytochrome P450. En particulier, la clairance des composés métabolisés par le cytochrome P450 3A4 (par exemple : hormones sexuelles stéroïdes, corticostéroïdes, anticonvulsivants et ciclosporine) peut être augmentée, entraînant une diminution des taux plasmatiques de ces composés. La conséquence clinique est inconnue.
L’effet de la somatropine sur la taille définitive peut aussi être influencé par un traitement simultané avec d’autres hormones, comme les gonadotrophines, les stéroïdes anabolisants, les estrogènes et les hormones thyroïdiennes.
Chez les patients traités par de l’insuline, un ajustement de la dose d’insuline pourra être nécessaire après l’initiation du traitement par la somatropine (voir rubrique 4.4).
Population pédiatrique
Les études d’interaction n’ont été réalisées que chez l’adulte.
4.6. Fertilité, grossesse et allaitement 
Grossesse
Les études effectuées chez l’animal sont insuffisantes pour juger de l’effet sur la grossesse, le développement embryonnaire et fœtal, l'accouchement ou le développement post-natal. Il n’existe pas de données cliniques chez la femme enceinte.
Par conséquent, les produits contenant de la somatropine ne sont pas recommandés pendant la grossesse et chez les femmes en âge de procréer n’utilisant pas de méthode contraceptive.
Aucune étude clinique n’a été réalisée avec les produits contenant de la somatropine chez les femmes qui allaitent. On ne sait pas si la somatropine est excrétée dans le lait maternel humain. En conséquence, une attention particulière devra être exercée lorsque des médicaments contenant de la somatropine sont administrés chez les femmes qui allaitent.
Fertilité
Les études sur la fertilité n’ont pas été réalisées avec Norditropine.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines 
Le déficit en hormone de croissance est caractérisé par un déficit du volume extracellulaire. Lorsqu’un traitement par la somatropine est initié, ce déficit est rectifié. Une rétention hydrique avec des œdèmes périphériques peut survenir plus particulièrement chez les adultes. Le syndrome du canal carpien est peu fréquent, mais peut apparaître chez les adultes. Ces symptômes sont normalement transitoires, sont dose-dépendants et peuvent nécessiter une diminution temporaire de la dose.
Des arthralgies modérées, des douleurs musculaires et des paresthésies peuvent également survenir mais en général ces symptômes sont autolimitants.
Les effets secondaires chez les enfants sont peu fréquents ou rares.
Selon les expériences sur les essais cliniques :
|
Classes de système d’organe |
Très fréquent (≥ 1/10) |
Fréquent (≥ 1/100, < 1/10) |
Peu fréquent (≥ 1/1 000, < 1/100) |
Rare (≥ 1/10 000, < 1/1 000) |
|
Troubles du métabolisme et de la nutrition |
|
|
Chez l’adulte, diabète de type 2 |
|
|
Affections du système nerveux |
|
Chez l’adulte, céphalée et paresthésie |
Chez l’adulte, syndrome du canal carpien. Chez l’enfant, céphalée |
|
|
Affections de la peau et du tissu sous-cutané |
|
|
Chez l’adulte, prurit |
Chez l’enfant, rash |
|
Affections musculo-squelettiques et systémiques |
|
Chez l’adulte, arthralgie, rigidité articulaire et myalgie |
Chez l’adulte, rigidité musculaire |
Chez l’enfant, arthralgie et myalgie |
|
Affections des organes de reproduction et du sein |
|
|
Chez l’adulte et l’enfant, gynécomastie |
|
|
Troubles généraux et anomalies au site d’administration |
Chez l’adulte, œdème périphérique (voir ci-dessus) |
|
Chez l’adulte et l’enfant, douleur au site d’injection. Chez l’enfant, réaction au site d’injection |
Chez l’enfant, œdème périphérique |
Chez les enfants présentant un syndrome de Turner, une augmentation de la croissance des mains et des pieds a été rapportée pendant le traitement par la somatropine.
Chez des patientes présentant un syndrome de Turner et traitées par de fortes doses de Norditropine, un essai clinique randomisé, en ouvert a rapporté une tendance à l’augmentation de l’incidence des otites moyennes. Cependant, l’augmentation des infections de l’oreille n’a pas conduit à une augmentation des opérations de l’oreille/insertions de tube de drainage tympanique par rapport au groupe ayant la plus faible dose dans l’essai.
Expérience après mise sur le marché :
En complément des effets indésirables mentionnés ci-dessus, ceux présentés ci-dessous ont été spontanément rapportés et sont globalement considérés comme potentiellement liés au traitement par Norditropine. La fréquence de ces effets indésirables ne peut être estimée sur la base des données disponibles :
· Tumeurs bénignes et malignes (y compris kystes et polypes) : certains cas de leucémies ont été rapportés chez un faible nombre de patients présentant un déficit en hormone de croissance (voir rubrique 4.4).
· Affections du système immunitaire : hypersensibilité (voir rubrique 4.3). Formation d’anticorps dirigés contre la somatropine. Le taux de ces anticorps et leur capacité de liaison ont été très faibles et n’ont pas eu de retentissement sur la croissance après l’administration de Norditropine.
· Affections endocriniennes : hypothyroïdie. Diminution des taux sériques de thyroxine (voir rubrique 4.4).
· Troubles du métabolisme et de la nutrition : hyperglycémie (voir rubrique 4.4).
· Affections du système nerveux : hypertension intracrânienne bénigne (voir rubrique 4.4).
· Affections musculo-squelettiques et systémiques : maladie de Legg-Calvé-Perthes. La maladie de Legg-Calvé-Perthes surviendrait plus fréquemment chez les patients de petite taille.
· Investigations : augmentation du taux de phosphatase alcaline dans le sang.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/.
Un surdosage aigu peut entraîner initialement une hypoglycémie, suivie d'une hyperglycémie.
L’hypoglycémie a été mise en évidence par un examen sanguin mais sans signes cliniques.
Un surdosage à long terme pourrait entraîner des signes et des symptômes correspondant aux effets connus d’un excès en hormone de croissance humaine.
5. PROPRIETES PHARMACOLOGIQUES 
5.1. Propriétés pharmacodynamiques 
Classe pharmacothérapeutique : somatropine et agonistes de la somatropine, code ATC : H01AC01.
Mécanisme d’action
Norditropine NordiFlex contient de la somatropine, l'hormone de croissance humaine produite par la technique de l’ADN recombinant. Il s’agit d’un peptide anabolisant de 191 acides aminés stabilisés par deux ponts disulfures et sa masse moléculaire est de 22 000 Daltons environ.
Les effets principaux de la somatropine sont la stimulation de la croissance osseuse et somatique ainsi qu’un effet métabolique important.
Effets pharmacodynamiques
Le traitement d'un déficit en hormone de croissance entraîne une normalisation de la composition corporelle avec une augmentation de la masse maigre et une diminution de la masse grasse.
Les actions de la somatropine s’exercent en majorité par le biais de l’IGF-1 (Insulin-like Growth Factor 1) qui est produit dans tous les tissus de l’organisme, mais essentiellement par le foie. L’IGF-1 se fixe à plus de 90 % aux protéines liantes (IGFBP), la principale d’entre elles étant l’IGFBP-3.
Cette hormone a un effet lipolytique et évite une déperdition protéique, en particulier lors d’un stress.
La somatropine favorise également le renouvellement osseux objectivé par une augmentation des taux plasmatiques des marqueurs biochimiques osseux. Chez l’adulte la masse osseuse diminue légèrement pendant les premiers mois de traitement à cause d’une résorption osseuse plus importante, cependant la masse osseuse augmente au cours d’un traitement au long cours.
Efficacité et sécurité clinique
Lors des essais cliniques chez des enfants nés petits pour l’âge gestationnel, des doses de 0,033 et 0,067 mg/kg/jour ont été utilisées jusqu’à atteinte de la taille finale. Pour 56 patients traités en continu et qui ont atteint (ou presque) leur taille finale, la variation moyenne de taille depuis le début du traitement était de +1,90 DS (0,033 mg/kg/jour) et +2,19 DS (0,067 mg/kg/jour). Les données de la littérature suggèrent une croissance tardive de 0,5 DS chez les enfants nés petits pour l’âge gestationnel non traités et sans rattrapage spontané précoce de croissance. Les données de sécurité à long terme sont encore limitées.
Un effet stimulant de la croissance a été observé après 104 semaines (critère principal) et 208 semaines de traitement avec une dose quotidienne de Norditropine de 0,033 mg/kg/jour et de 0,066 mg/kg/jour chez 51 enfants de petite taille liée au syndrome de Noonan âgés entre 3 et < 11 ans.
Une augmentation statistiquement significative de la taille moyenne en DS de l’inclusion à la semaine 104 (critère principal) a été observée à la dose de 0,033 mg/kg/jour (0,84 DS) et à la dose de 0,066 mg/kg/jour (1,47 DS). Une différence moyenne de 0,63 DS [IC à 95 % : 0,38 ; 0,88] a été observée entre les groupes à la semaine 104 ; la différence était plus importante après la semaine 208 avec une différence moyenne de 0,99 DS [IC à 95 % : 0,62 ; 1,36] (figure 1).
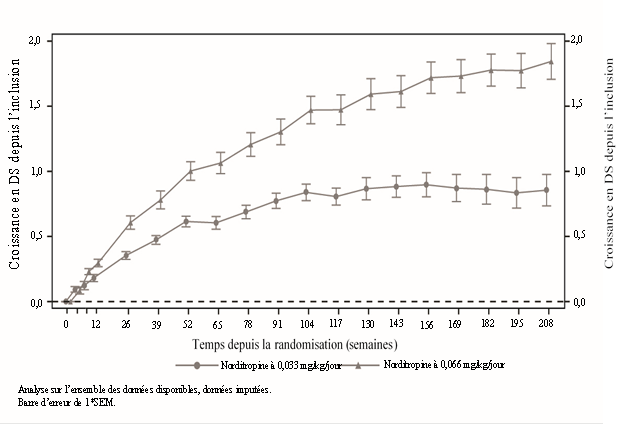 Figure 1 Croissance en DS – de l’inclusion à la semaine 208
Figure 1 Croissance en DS – de l’inclusion à la semaine 208
La vitesse moyenne de croissance et la vitesse de croissance en DS ont augmenté considérablement depuis l’inclusion au cours de la première année de traitement, avec une augmentation plus importante à la dose de 0,066 mg/kg/jour par rapport à la dose de 0,033 mg/kg/jour. La vitesse de croissance moyenne en DS était maintenue au-dessus de 0 dans les deux groupes après un traitement de deux ans et également après quatre ans de traitement dans le groupe avec 0,066 mg/kg/jour. La vitesse de croissance en DS était supérieure avec 0,066 mg/kg/jour par rapport à 0,033 mg/kg/jour pendant toute la durée de l’étude (figure 2).
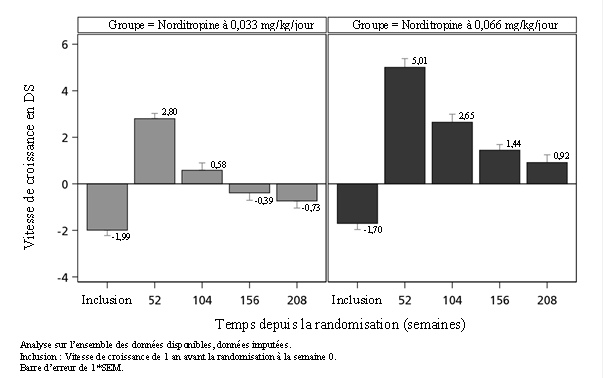 Figure 2 Vitesse de croissance en DS – de l’inclusion à la semaine 208
Figure 2 Vitesse de croissance en DS – de l’inclusion à la semaine 208
Les données de la taille finale ont été collectées chez 24 patients pédiatriques (18 inclus dans une étude de deux ans, prospective, en ouverte, randomisée, en groupes parallèles et six patients ayant suivi le protocole sans randomisation). Après l’étude initiale prospective de deux ans, Norditropine a été poursuivi jusqu’à la taille finale. À la fin du traitement, la majorité des patients (16 sur 24) ont atteint une taille finale dans l’intervalle de référence nationale normale (> 2 DS).
5.2. Propriétés pharmacocinétiques 
Après perfusion intraveineuse de Norditropine (33 ng/kg/min pendant 3 heures) chez neuf patients présentant un déficit en hormone de croissance, les résultats ont été les suivants : demi-vie sérique de 21,1 ± 1,7 min, clairance métabolique de 2,33 ± 0,58 ml/kg/min et volume de distribution de 67,6 ± 14,6 ml/kg.
L’injection sous-cutanée de 2,5 mg/m² de Norditropine SimpleXx (Norditropine SimpleXx est la cartouche contenant la solution pour injection de Norditropine NordiFlex) à 31 sujets sains (la somatropine endogène étant inhibée par perfusion continue de somatostatine) a donné les résultats suivants : concentration maximale d’hormone de croissance (42 à 46 ng/ml) après environ 4 heures. Puis le taux d’hormone de croissance a diminué avec une demi-vie d’environ 2,6 heures.
De plus, il a été démontré après injection sous-cutanée chez des sujets sains que les différentes concentrations de Norditropine SimpleXx étaient bioéquivalentes entre elles et avec la Norditropine pour reconstitution.
5.3. Données de sécurité préclinique 
Les effets pharmacologiques généraux sur le système nerveux central (SNC), les systèmes cardio-vasculaire et respiratoire après l’administration de Norditropine SimpleXx avec et sans dégradation forcée ont été étudiés chez la souris et le rat ; la fonction rénale a aussi été évaluée. L’effet du produit dégradé n’est pas différent de celui de Norditropine SimpleXx et Norditropine. Les trois préparations ont montré la diminution dose-dépendante attendue du volume urinaire et de la rétention de sodium et des chlorures.
Chez le rat, il a été démontré une pharmacocinétique similaire entre Norditropine SimpleXx et Norditropine. Il a également été montré que Norditropine SimpleXx dégradé est bioéquivalent à Norditropine SimpleXx.
Aucune toxicité ni altération des tissus musculaires n’a été révélée lors des études de toxicité à doses uniques ou répétées et des études de tolérance locale avec Norditropine SimpleXx et le produit de dégradation.
La toxicité du poloxamère 188 a été testée chez la souris, le rat, le lapin et le chien et aucune toxicité particulière n’a été détectée.
Le poloxamère 188 a été rapidement absorbé au site d’injection sans rétention significative de la dose au niveau du site d’injection. Le poloxamère 188 a été excrété principalement par voie urinaire.
Norditropine SimpleXx correspond à la cartouche de solution pour injection de Norditropine NordiFlex.
2 ans.
Après première ouverture : à conserver au maximum 4 semaines au réfrigérateur (entre 2°C et 8°C). Alternativement le médicament peut être conservé au maximum 3 semaines à une température ne dépassant pas 25°C.
6.4. Précautions particulières de conservation 
Ne pas conserver à proximité des éléments de refroidissement.
Pour les conditions de conservation du médicament après première ouverture, voir la rubrique 6.3. Ne pas congeler.
En cours d’utilisation, il est nécessaire de toujours replacer le capuchon sur le stylo prérempli Norditropine NordiFlex après chaque injection. Toujours utiliser une aiguille neuve lors de chaque injection.
L’aiguille ne doit pas rester vissée sur le stylo prérempli lorsqu’il n’est pas utilisé.
6.5. Nature et contenu de l'emballage extérieur 
Norditropine NordiFlex 10 mg/1,5 ml est un stylo prérempli multidose jetable, qui contient une cartouche scellée (verre incolore de type I) dans un stylo injecteur en plastique. La cartouche est fermée à l’extrémité inférieure par un bouchon en caoutchouc (fermetures en caoutchouc de type I) en forme de piston et à l’extrémité supérieure par un bouchon laminé en caoutchouc (fermetures en caoutchouc de type I) en forme de disque et scellé par une capsule en aluminium. Le bouton-poussoir du stylo injecteur est coloré en bleu. Boîte de 1 stylo prérempli et emballages multiples avec 5 et 10 x 1 stylo prérempli. Toutes les présentations peuvent ne pas être commercialisées.
Le stylo prérempli est conditionné dans un emballage.
6.6. Précautions particulières d’élimination et de manipulation 
Norditropine NordiFlex est un stylo prérempli conçu pour être utilisé avec les aiguilles NovoFine ou NovoTwist à usage unique d’une longueur maximale de 8 mm.
Norditropine NordiFlex 10 mg/1,5 ml délivre un maximum de 3,0 mg de somatropine par dose, par paliers de 0,050 mg de somatropine.
Pour garantir un dosage correct et éviter toute injection d’air, vérifiez l’écoulement de l’hormone de croissance avant la première injection. N’utilisez pas Norditropine NordiFlex si aucune goutte d’hormone de croissance n’apparaît au bout de l’aiguille. La dose est sélectionnée en tournant le sélecteur de dose, jusqu’à ce que la dose désirée apparaisse dans la fenêtre d’indication de la dose. Si une mauvaise dose est sélectionnée, la dose peut être corrigée en tournant le sélecteur de dose dans le sens inverse. Pour injecter la dose, il faut appuyer sur le bouton-poussoir.
Norditropine NordiFlex ne doit jamais être secoué fortement.
Norditropine NordiFlex ne doit pas être utilisé si la solution injectable d’hormone de croissance est opaque ou colorée. Pour le vérifier, il faut retourner le stylo de haut en bas, une ou deux fois.
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE 
CŒUR DEFENSE
100, AVENUE DU GENERAL DE GAULLE
92400 COURBEVOIE
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE 
· 34009 363 968 8 3: 10 mg/1,5 ml de solution injectable en cartouche (verre de type I) en stylo prérempli jetable (plastique) ; boîte de 1.
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION 
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE 
[à compléter ultérieurement par le titulaire]
Sans objet
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES 
Liste I
Prescription initiale hospitalière annuelle réservée aux spécialistes en pédiatrie ou en endocrinologie et maladies métaboliques exerçant dans les services spécialisés en pédiatrie ou en endocrinologie et maladies métaboliques.
|
| Plan du site | Accessibilité | Contact | Téléchargement | Declaration de confidentialité | Service-Public.fr | Legifrance | Gouvernement.fr |