Dernière mise à jour le 01/12/2025
PENTHROX 99,9 %, liquide pour inhalation par vapeur de 3 mL
Indications thérapeutiques
Classe pharmacothérapeutique : autres analgésiques et antipyrétiques - code ATC : N02BG09.
L’usage prévu de l’inhalateur PENTHROX est l’administration du médicament antalgique PENTHROX (méthoxyflurane). PENTHROX est versé dans le dispositif et lorsque vous respirez à travers l’inhalateur, vous inhalez la vapeur de PENTHROX. La chambre de charbon actif insérée dans le dispositif capte la vapeur de PENTHROX que vous expirez à travers l’inhalateur.
PENTHROX, administré à l’aide de l’inhalateur PENTHROX, est destiné à diminuer l’intensité de la douleur plutôt que la supprimer complètement.
Présentations
> 1 flacon(s) de 3 ml avec inhalateur(s) PENTHROX avec chambre(s) de charbon actif
Code CIP : 34009 300 608 8 9
Déclaration de commercialisation : 06/02/2017
Cette présentation est agréée aux collectivités
Service médical rendu (SMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprès de la HAS (plus d'informations dans l'aide). Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Modéré | Avis du 20/09/2023 | Réévaluation ASMR | Le service médical rendu par PENTHROX 99,9% (méthoxyflurane), liquide pour inhalation par vapeur, reste modéré dans la prise en charge multimodale des douleurs aiguës modérées à sévères d’origine traumatique. |
| Modéré | Avis du 30/11/2016 | Inscription (CT) | Le service médical rendu par PENTHROX est modéré dans l’indication de l’AMM. |
Amélioration du service médical rendu (ASMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprés de la HAS (plus d'informations dans l'aide). Les avis et synthéses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur de l'ASMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| V (Inexistant) | Avis du 20/09/2023 | Réévaluation ASMR | Compte tenu : • de la démonstration de supériorité du méthoxyflurane versus placebo dans la douleur aiguë modérée à sévère d’origine traumatique, mais eu égard : • au manque de données d’efficacité robustes du méthoxyflurane versus comparateur actif, • aux incertitudes sur la pertinence clinique des différences d’effet observées et la transposabilité des données à la pratique clinique, • au profil de tolérance de cet agent anesthésique halogéné, • et au besoin médical couvert par les autres antalgiques disponibles, la Commission considère que PENTHROX 99,9% (méthoxyflurane), liquide pour inhalation par vapeur de 3 mL n’apporte pas d’amélioration du service médical rendu (ASMR V) dans la prise en charge multimodale des douleurs aiguës modérées à sévères d’origine traumatique. |
| V (Inexistant) | Avis du 30/11/2016 | Inscription (CT) | Compte tenu de : • l’efficacité de PENTHROX démontrée versus placebo chez des patients ayant majoritairement une douleur d’intensité modérée, • l’absence d’étude de qualité méthodologique suffisante l’ayant comparé aux autres antalgiques actuellement disponibles, la Commission de la transparence considère que la spécialité PENTHROX n’apporte pas d’amélioration du service médical rendu (ASMR V) par rapport aux autres antalgiques disponibles dans le soulagement d’urgence des douleurs modérées à sévères associées à un traumatisme chez des patients adultes conscients. |
Autres informations
- Titulaire de l'autorisation : LABORATOIRES ETHYPHARM
- Conditions de prescription et de délivrance :
- liste I
- réservé à l'usage professionnel
- Statut de l'autorisation : Valide
- Type de procédure : Procédure décentralisée
- Code CIS : 6 060 750 3
ANSM - Mis à jour le : 29/10/2025
PENTHROX 99,9%, liquide pour inhalation par vapeur de 3 mL
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Chaque flacon contient 3 mL de méthoxyflurane à 99,9 %.
Excipient à effet notoire : hydroxytoluène butylé (E321) (0,01% m/m).
Pour la liste complète des excipients, voir rubrique 6.1.
Liquide pour inhalation par vapeur.
Liquide volatile clair, quasiment incolore avec une odeur fruitée caractéristique.
4.1. Indications thérapeutiques
4.2. Posologie et mode d'administration
L’usage prévu de l’inhalateur PENTHROX est l’administration du médicament antalgique PENTHROX (méthoxyflurane). PENTHROX est versé dans le dispositif et lorsque le patient respire à travers l’inhalateur, il inhale la vapeur de PENTHROX. La chambre de charbon actif insérée dans le dispositif adsorbe la vapeur de PENTHROX expirée par le patient à travers l’inhalateur (voir rubrique 5.2).
Posologie
Adultes
Un flacon de 3 mL de PENTHROX en dose unique, à administrer en utilisant le dispositif fourni avec le produit. Un second flacon de 3 mL peut être utilisé uniquement en cas de besoin.
La fréquence à laquelle PENTHROX peut être utilisé en toute sécurité n'est pas établie (voir rubrique 4.4). Le schéma d'administration suivant est recommandé : pas plus de 6 ml en une seule journée, L'administration sur plusieurs jours consécutifs n'est pas recommandée et la dose totale administrée par semaine à un patient ne doit pas dépasser 15 mL.
Lle début du soulagement de la douleur est rapide et se manifeste après 6 à 10 inhalations. Il faut conseiller aux patients d'inhaler de façon intermittente pour obtenir une antalgie adéquate. Les patients peuvent évaluer leur propre niveau de douleur et inhaler la quantité de PENTHROX nécessaire pour un contrôle adéquat de la douleur. Une inhalation continue d’un flacon de 3 mL produit un effet antalgique de 25-30 minutes. Une inhalation intermittente pourrait permettre de prolonger l'effet antalgique. Il doit être conseillé aux patients d’utiliser la plus faible dose permettant un soulagement de la douleur (voir rubrique 4.4).
Insuffisance rénale
Le méthoxyflurane peut entraîner une insuffisance rénale si la dose recommandée est dépassée. Des précautions doivent être prises chez les patients ayant un état clinique qui prédisposerait à une lésion rénale (voir rubrique 4.4).
Insuffisance hépatique
Une évaluation clinique approfondie est nécessaire lorsque PENTHROX doit être utilisé plus fréquemment qu’une fois tous les 3 mois (voir rubrique 4.4).
Population pédiatrique
PENTHROX ne doit pas être utilisé chez les enfants et les adolescents âgés de moins de 18 ans..
Mode d’administration
Administration par inhalation.
Les instructions pour la préparation de l'inhalateur PENTHROX et pour la bonne administration sont présentées ci-dessous.
Avant utilisation, vérifier l’absence de corps étrangers et de pièces brisées ou détériorées. Dans le cas contraire, ne pas utiliser ce dispositif.
|
1. |
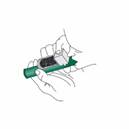
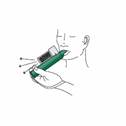
Vérifiez que la chambre de Charbon Actif (CA) est insérée dans l’orifice du diffuseur sur le haut de l'inhalateur PENTHROX. |
|
|
2. |
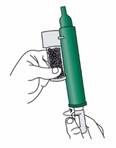
Dévissez le bouchon du flacon à la main. Vous pouvez également utiliser la base de l'inhalateur PENTHROX pour desserrer le bouchon en effectuant un demi-tour. A la main, séparez l'inhalateur du flacon et enlevez le bouchon. |
|
|
3. |
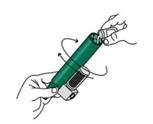
Inclinez l'inhalateur PENTHROX à 45° et versez la totalité du flacon dans la base de l'inhalateur tout en le faisant tourner. |
|
|
4. |
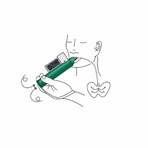
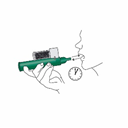
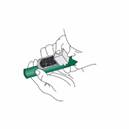
Mettez la dragonne autour du poignet du patient. Le patient inspire et expire PENTHROX à travers l'embout buccal de l'inhalateur pour obtenir un effet antalgique. Les premières inspirations doivent être légères puis le patient peut respirer normalement à travers l’inhalateur. |
|
|
5. |
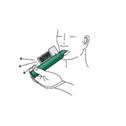
Le patient expire dans l'inhalateur PENTHROX. La vapeur expirée passe à travers la chambre de Charbon Actif pour adsorber le méthoxyflurane expiré. |
|
|
6. |
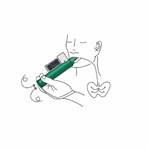
Si un effet antalgique plus puissant est nécessaire, le patient peut boucher avec son doigt l’orifice du diffuseur sur la chambre de Charbon Actif, pendant l’inspiration. |
|
|
7. |
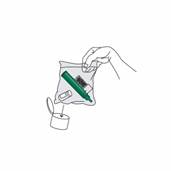
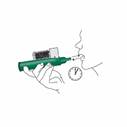
Si le soulagement de la douleur doit continuer après l'utilisation d’un flacon de 3 mL, utilisez un deuxième flacon si disponible. Vous pouvez également utiliser un second flacon d'un nouveau dispositif. Utilisez-le alors de la même manière que le premier flacon selon les étapes 2 et 3 décrites précédemment. Il n’est pas nécessaire d'enlever la chambre de charbon actif. Mettez le flacon utilisé dans le sac plastique mis à disposition.
|
|
|
8. |
Il doit être indiqué au patient d'inhaler de façon intermittente pour atteindre une antalgie adéquate. Une inhalation continue réduira la durée d'utilisation. La dose minimale efficace pour obtenir l'antalgie doit être administrée. |
|
|
9. |
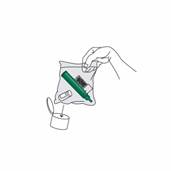
Remettez le bouchon sur le flacon de PENTHROX. Mettez l'inhalateur PENTHROX et le flacon usagé dans le sac en plastique fermé hermétiquement et jetez-le conformément à la réglementation en vigueur (voir rubrique 6.6). |
|
Médecins, infirmier(ière), ambulancier et toutes personnes formées à l’administration de PENTHROX doivent fournir et expliquer la notice d'information du produit au patient.
o Utilisation en tant qu'agent anesthésique.
o Hypersensibilité à la substance active ou à tout autre anesthésique fluoré ou à tout autre excipient mentionné à la rubrique 6.1.
o Hyperthermie maligne : hyperthermie maligne connue ou prédisposition génétique du patient.
o Antécédents d’effets indésirables graves du patient ou dans sa famille après administration d’anesthésiques inhalés.
o Antécédents de signes de lésions hépatiques après utilisation de méthoxyflurane ou après une anesthésie par un hydrocarbure halogéné.
o Atteinte rénale cliniquement significative.
o Altération du niveau de conscience quelle qu’en soit la cause, y compris traumatisme crânien, consommation de drogues ou d'alcool.
o Evidence clinique d’une instabilité cardiovasculaire.
o Evidence clinique d’une dépression respiratoire.
4.4. Mises en garde spéciales et précautions d'emploi
Afin d’assurer un usage analgésique de PENTHROX en toute sécurité, les précautions suivantes doivent être prises :
- Utilisez la plus faible dose efficace pour soulager la douleur
- Utilisez avec précaution chez les personnes âgées et les patients ayant des facteurs de risque de maladies rénales
- Utilisez avec prudence chez les patients ayant un état clinique qui prédisposerait à une lésion rénale.
Le méthoxyflurane provoque une néphrotoxicité importante à des doses élevées. La néphrotoxicité serait associée aux ions fluorures inorganiques, produits de la dégradation métabolique. Lorsqu’administré comme indiqué dans son indication analgésique, une dose unique de 3 mL de methoxyflurane produit une concentration sérique en ions fluorures inorganiques inférieure à 10 μmol/L. Par le passé, lorsqu’il était utilisé comme agent anesthésique, le méthoxyflurane à fortes doses provoquait une néphrotoxicité importante, qui se manifestait lorsque la concentration sérique d’ions fluorures inorganiques était supérieure à 40 μmol/L.
Cette néphrotoxicité est également corrélée au taux de métabolisation. Par conséquent, les facteurs qui augmentent le taux de métabolisation, tels que les médicaments inducteurs des enzymes hépatiques, ou des variations génétiques présentes dans des sous-groupes de patients métaboliseurs rapides, peuvent augmenter le risque de toxicité du méthoxyflurane (voir rubrique 4.5).
Troubles hépatiques
Le méthoxyflurane est métabolisé par le foie ; par conséquent une exposition accrue chez les patients présentant une insuffisance hépatique peut provoquer une toxicité. PENTHROX ne doit pas être utilisé chez les patients ayant des antécédents de signes de lésions hépatiques suite à une utilisation de méthoxyflurane ou à une anesthésie par hydrocarbure halogéné (voir rubrique 4.3). PENTHROX doit être utilisé avec prudence chez les patients présentant des pathologies hépatiques sous-jacentes ou des risques de dysfonctionnement hépatique (tels que les inducteurs enzymatiques - voir également rubrique 4.5).
Il a été rapporté que des antécédents d’exposition aux anesthésiques halogénés (y compris au méthoxyflurane quand il était autrefois utilisé comme agent anesthésique), pouvaient augmenter le risque de lésion hépatique, en particulier si l'intervalle est inférieur à 3 mois.
Une évaluation clinique méticuleuse est nécessaire lorsque PENTHROX doit être utilisé plus fréquemment qu’une fois tous les 3 mois.
Dépression du système cardiovasculaire / Patients âgés
Les effets potentiels sur la tension artérielle et la fréquence cardiaque sont des effets de classe connus de doses élevées de méthoxyflurane utilisées en anesthésie, et d'autres anesthésiques. Ces effets ne semblent pas être significatifs aux doses antalgiques. Suite à l'administration de méthoxyflurane en tant qu'antalgique, il n’y a pas de tendance particulière de modifications de la pression artérielle systolique quel que soit le groupe d'âge. Toutefois, le risque étant potentiellement plus élevé chez les personnes âgées souffrant d'hypotension et de bradycardie, l’utilisation doit être prudente dans cette tranche d'âge en raison d’une possible diminution de la pression artérielle.
Effets sur le système nerveux central
Les effets pharmacodynamiques secondaires y compris les effets potentiels sur le Système Nerveux Central (SNC) comme la sédation, l'euphorie, l'amnésie, la capacité de concentration, l'altération de la coordination sensitivo-motrice et les changements d'humeur sont également des effets de classe connus. L'auto-administration de méthoxyflurane aux doses antalgiques sera limitée par l’apparition d'effets sur le SNC, comme la sédation. Bien que la possibilité d'effets sur le SNC peut être considéré comme un facteur de risque d'abus potentiel, les cas rapportés sont très rares dans l'utilisation post-commercialisation.
Dépression respiratoire
Des cas de dépression respiratoire ont été rapportés à des doses antalgiques également (voir rubrique 4.8). La fonction respiratoire doit être surveillée en raison du risque de dépression respiratoire et d’hypoxie.
Utilisation fréquente et répétée
En raison de la dose totale contenue dans PENTHROX (voir rubrique 4.2) et de la durée du soulagement de la douleur, PENTHROX n’est pas approprié au soulagement des accès douloureux paroxystiques et des exacerbations des douleurs chroniques. PENTHROX n’est pas non plus approprié au soulagement des douleurs associées à des épisodes traumatiques répétés et rapprochés chez un même patient.
Hydroxytoluène butylé E321
PENTHROX contient un excipient stabilisant appelé hydroxytoluène butylé (E321). L'hydroxytoluène butylé peut provoquer des réactions cutanées locales (par exemple : eczéma) ou une irritation des yeux et des muqueuses (voir rubrique 6.1).
Exposition professionnelle
Les professionnels de santé régulièrement exposés aux patients utilisant des inhalateurs PENTHROX doivent être informés de toute recommandation pertinente en matière de santé et sécurité au travail, concernant l'utilisation d'agents d’inhalation. Afin de réduire l'exposition professionnelle au méthoxyflurane, l'inhalateur PENTHROX doit toujours être utilisé avec la chambre de Charbon Actif qui adsorbe le méthoxyflurane expiré.. Des utilisations répétées de l'inhalateur PENTHROX sans la chambre de Charbon Actif engendrent un risque supplémentaire. Une élévation des enzymes hépatiques, de l'urée et de l'acide urique dans le sang a été rapportée au sein du personnel des services de maternité, dans les salles d’accouchement où le méthoxyflurane était autrefois utilisé au cours du travail et de l'accouchement.
Des réactions sans gravité et à caractère transitoire telles que sensations vertigineuses, céphalées, nausées ou malaises, ainsi que des réactions d’hypersensibilité au méthoxyflurane ou à d’autres ingrédients ont été rapportées chez des professionnels de santé exposés au PENTHROX. Les mesures des niveaux d’exposition au méthoxyflurane réalisées sur le personnel hospitalier ont montré des niveaux nettement inférieurs à ceux associés à une néphrotoxicité.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Aucune interaction médicamenteuse n’a été signalée avec les doses antalgiques (3-6 mL).
Le méthoxyflurane est métabolisé par l'intermédiaire des enzymes du CYP 450, en particulier le CYP 2E1, CYP 2B6 et dans une certaine mesure par le CYP 2A6. Il est possible que les inducteurs enzymatiques (tels que l’alcool ou l’isoniazide pour le CYP 2E1, phénobarbital ou rifampicine pour le CYP 2A6 et carbamazépine, éfavirenz, rifampicine ou névirapine pour le CYP 2B6), qui augmentent la métabolisation du méthoxyflurane, puissent également augmenter sa toxicité potentielle ; une administration concomitante avec le méthoxyflurane doit être évitée.
L'utilisation concomitante de méthoxyflurane avec des médicaments connus pour avoir un effet néphrotoxique (par exemple : produits de contraste ou certains antibiotiques) doit être évitée car il pourrait y avoir un effet additif sur la néphrotoxicité. Les antibiotiques dont le potentiel néphrotoxique est connu incluent tétracycline, gentamycine, colistine, polymyxine B et amphotéricine B.
Il est conseillé d’éviter une anesthésie par sévoflurane après une administration de méthoxyflurane en antalgie. En effet, le sévoflurane augmente les concentrations sériques de fluorure et la néphrotoxicité du méthoxyflurane est associée à des concentrations sériques de fluorure élevées.
Aucune interaction médicamenteuse n’a été signalée avec les doses antalgiques (3-6 mL).
L'utilisation concomitante de PENTHROX avec des dépresseurs du Système Nerveux Central (SNC), comme les opioïdes, les sédatifs, les hypnotiques, les anesthésiques généraux, les phénothiazines, les tranquillisants, les myorelaxants, les antihistaminiques sédatifs et l'alcool, peut augmenter les effets dépresseurs. Si des opioïdes sont administrés de manière concomitante à PENTHROX, le patient doit faire l’objet d’une surveillance étroite, conformément aux pratiques cliniques habituelles en matière d'opioïdes.
Lorsque le méthoxyflurane était utilisé en anesthésie, aux doses plus élevées de 40 à 60 mL, les interactions suivantes avaient été rapportées :
1. Interaction médicamenteuse avec les inducteurs enzymatiques hépatiques (ex : les barbituriques) augmentant le métabolisme du méthoxyflurane et résultant en quelques cas rapportés de néphrotoxicité. Les données sont insuffisantes pour montrer si l'induction enzymatique a un effet sur les atteintes hépatiques après une dose antalgique de méthoxyflurane.
2. Diminution du flux sanguin rénal et par conséquent augmentation attendue des effets rénaux lors d’une utilisation en association avec des médicaments réduisant le débit cardiaque (ex : les barbituriques).
3. Effet de classe sur la dépression cardiaque, qui pourrait être renforcé par d'autres médicaments dépresseurs cardiaques, par exemple le practolol (un bêta-bloquant cardiosélectif) par voie intraveineuse pendant une chirurgie cardiaque.
4.6. Fertilité, grossesse et allaitement
Grossesse
Les études chez l'animal ont montré une toxicité sur la reproduction (voir rubrique 5.3).
Lorsque le méthoxyflurane était utilisé dans l’antalgie obstétricale chez les femmes enceintes, un seul cas de dépression respiratoire néonatale, associé à une concentration élevée de méthoxyflurane fœtale, avait été rapporté. Toutefois, lorsque de faibles concentrations étaient administrées ou lorsque des concentrations plus élevées étaient administrées sur de courtes durées, conformément à la posologie recommandée, il avait été observé que le méthoxyflurane a peu d’effet sur le fœtus. Parmi toutes les études finalisées en antalgie obstétricale, aucune complication fœtale imputée à l'utilisation antalgique de méthoxyflurane n'avait été signalée chez les mères.
Comme pour tous les médicaments, le méthoxyflurane doit être utilisé avec prudence au cours de la grossesse, en particulier au cours du premier trimestre.
Les données sur l'excrétion de méthoxyflurane dans le lait maternel sont insuffisantes. L’administration du méthoxyflurane doit être réalisée avec prudence chez la femme qui allaite.
Fertilité
Aucune donnée clinique concernant les effets du méthoxyflurane sur la fertilité n’est disponible. Des données limitées issues d’études chez l’animal n’ont pas montré d’effet sur la morphologie du sperme.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Résumé du profil de sécurité
Les effets indésirables non graves les plus fréquents (≥ 1/100 à < 1/10) sont les effets sur le système nerveux central tels que les sensations vertigineuses et la somnolence. Ces effets sont généralement facilement réversibles.
.
Tableau des effets indésirables
Ce n’est que lors d’une utilisation à forte dose que le méthoxyflurane a été associé à une néphrotoxicité grave liée à la dose pendant de longues périodes au cours d'une anesthésie générale. Le méthoxyflurane n'est par conséquent plus utilisé en anesthésie. Voir rubrique 4.4 « Troubles rénaux ». Par conséquent, la dose maximale recommandée de PENTHROX ne doit pas être dépassée.
Le tableau ci-dessous répertorie les effets indésirables de PENTHROX :
· Observés dans les études cliniques en antalgie,
· Observés lors de l’usage du méthoxyflurane en analgésie en post-commercialisation
· Liés à l’usage du méthoxyflurane en analgésie trouvés en post-commercialisation et dans la littérature scientifique.
Les fréquences suivantes servent de base pour l’évaluation des effets indésirables :
· Très fréquent ; ≥ 1/10
· Fréquent ≥ 1/100 à < 1/10
· Peu fréquent ≥ 1/1 000 à < 1/100
· Rare ≥ 1/10 000 à < 1/1000
· Très rare < 1/10 000
· Fréquence indéterminée (ne peut pas être estimée à partir des données disponibles)
|
Classification systèmes organes MedDRA |
Très fréquent ≥ 1/10 |
Fréquent ≥ 1/100 à < 1/10 |
Peu fréquent ≥ 1/1 000 à < 1/100 |
Fréquence indéterminée |
|
Affections du système immunitaire |
|
|
|
Hypersensibilité |
|
Troubles du métabolisme et de la nutrition |
|
|
Augmentation de l’appétit |
|
|
Affections psychiatriques |
|
Etat euphorique
|
Anxiété Dépression Perturbation de l'attention Effet inapproprié Verbigération
|
Labilité affective^ Agitation^ État confus^ Dissociation^ Impatiences^ |
|
Affections du système nerveux |
Sensations vertigineuses |
Céphalées Somnolence Dysgueusie
|
Amnésie Dysarthrie Paresthésie Neuropathie sensitive périphérique |
Altération de l’état de conscience^ Nystagmus^ |
|
Affections oculaires |
|
|
Trouble de la vision^ |
|
|
Affections vasculaires |
|
|
Flush Hypertension Hypotension |
|
|
Affections respiratoires, thoraciques et médiastinaux |
|
Toux |
|
Etouffement^ Hypoxie^ Dépression respiratoire^ |
|
Affections gastro-intestinales |
|
Nausées |
Bouche sèche Gêne buccale Prurit buccal Hypersécrétion salivaire Vomissement |
|
|
Affections hépatobiliaires |
|
|
|
Insuffisance hépatique* Hépatite* Ictère^ Lésion hépatique^ |
|
Affections de la peau et du tissu sous cutané |
|
|
Hyperhidrose |
|
|
Affections du rein et des voies urinaires |
|
|
|
Insuffisance rénale^ |
|
Troubles généraux et anomalies au site d’administration |
|
Sensation d'ivresse
|
Fatigue Sensation d’état anormal Frissonnement Sensation de relaxation |
|
|
Investigations |
|
|
|
Augmentation des enzymes hépatiques^ Augmentation de l’urée dans le sang Augmentation de l'acide urique dans le sang^ Augmentation de la créatinine dans le sang^ |
*Des cas isolés ont été rapportés en post-commercialisation lors de l'utilisation antalgique du méthoxyflurane.
^Autres effets associés à l'utilisation antalgique du méthoxyflurane rapportés en post-commercialisation et trouvés dans la littérature scientifique.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr
En cas de surdosage, des effets anesthésiques peuvent survenir, caractérisés par des signes de somnolence excessive (y compris avec perte de conscience), de diminution de la pression artérielle, de dépression respiratoire, de pâleur et de relaxation musculaire. Après interruption de PENTHROX, ces effets liés au surdosage disparaissent en général rapidement, souvent sans autre forme d’intervention requise ; une assistance cardiorespiratoire peut toutefois être mise en place, si nécessaire.
Des doses élevées de méthoxyflurane entraînent une néphrotoxicité dose dépendante. Une insuffisance rénale non oligurique est apparue plusieurs heures ou jours après l'administration de doses élevées répétées antalgiques ou anesthésiques de méthoxyflurane.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Classe pharmacothérapeutique : autres analgésiques et antipyrétiques. Code ATC : N02BG09.
(N : système nerveux central)
Mécanisme d’action
Le mécanisme par lequel le methoxyflurane exerce son action analgésique n’a pas été entièrement élucidé.
Effets pharmacodynamiques
Le méthoxyflurane est un agent anesthésique volatile appartenant au groupe des hydrocarbures fluorés et produit un effet antalgique à de faibles concentrations chez les patients conscients. A dose antalgique thérapeutique, le soulagement de la douleur peut entrainer une baisse de la pression artérielle.
Cette baisse peut être accompagnée d'une bradycardie. Le rythme cardiaque est généralement régulier, bien qu’une somnolence puisse apparaitre. Le méthoxyflurane provoque une sensibilisation minime du myocarde à l'adrénaline.
Efficacité et sécurité cliniques
L'efficacité et la sécurité de PENTHROX ont été démontrées dans une étude randomisée, en double aveugle, multicentrique et contrôlée versus placebo dans le traitement des douleurs aiguës chez des patients présentant un traumatisme mineur admis dans un service d'urgence. 300 patients ont été inclus (151 ont reçu du méthoxyflurane et 149 ont reçu un placebo selon un ratio 1:1). Les patients étaient éligibles pour l’étude lorsqu’ils avaient un score de douleur compris entre ≥ 4 et ≤ 7 sur l’échelle d’évaluation numérique. Les scores moyens de douleur (Echelle Visuelle Analogique - EVA) observés à l’inclusion étaient similaires dans le groupe méthoxyflurane (64,8) et dans le groupe placebo (64,0). Le critère principal d'efficacité, la variation moyenne de la douleur estimée par l’EVA entre la valeur initiale et à 5, 10, 15 et 20 minutes, était supérieure dans le groupe méthoxyflurane (-23,1, -28,9, -34,0 et -35,0 respectivement) par rapport au groupe placebo (-11,3, -14,8, -15,5 et -19,0 respectivement). Dans l'ensemble, il existait une différence hautement significative entre le groupe méthoxyflurane et le groupe placebo (effet thérapeutique estimé : -15,1 ; 95 % IC -19,2 à -11,0 ; p < 0,0001). L’effet thérapeutique maximal a été observé à 15 minutes (effet thérapeutique estimé à -18,5). Une analyse a été effectuée dans laquelle un répondeur était défini comme un patient bénéficiant d'une amélioration minimale de 30 % à partir de la valeur initiale de l'EVA. Les résultats de cette analyse ont indiqué que le pourcentage de répondeurs à 5, 10, 15 et 20 minutes était significativement plus élevé dans le groupe méthoxyflurane (51,0 %, 57,7 %, 63,8 %, 63,8 %) par rapport au groupe placebo (23,5 %, 30,9 %, 33,6 %, 37,6 %), avec un p<0,0001 à chaque intervalle de temps. Un total de 126 patients (84,6 %) dans le groupe méthoxyflurane a ressenti un début de soulagement de la douleur après 1-10 inhalations comparé à 76 patients (51 %) dans le groupe placebo.
5.2. Propriétés pharmacocinétiques
Les coefficients de partage du méthoxyflurane sont les suivants :
o coefficient eau/gaz : 4,5
o coefficient sang/gaz : 13
o coefficient huile/gaz : 825
Le méthoxyflurane pénètre dans les poumons sous forme de vapeur et est rapidement transporté dans le sang ; le délai d’action antalgique est donc rapide. Dans une étude pharmacocinétique sur des volontaires sains, les courbes de concentration plasmatique moyenne en fonction du temps ont montré une augmentation extrêmement rapide des concentrations de méthoxyflurane dans le plasma. Après inhalation intermittente pendant une heure d’une dose unique de 3 mL de méthoxyflurane, le profil artériel est démontré par une tmax à 0,25 heure (plage 0,08-0,75 heure), une Cmax de 32,39 µg/mL (ET 13,546 µg/mL, CV 41,8 %) et une ASC de 28,95 h.µg/mL (plage de 12,3-52,6 h.µg/mL).
Distribution
Le coefficient huile/gaz du méthoxyflurane est élevé, d’où une forte lipophilie du méthoxyflurane. Le méthoxyflurane a une grande propension à diffuser dans les tissus adipeux dans lesquels il forme un réservoir à partir duquel il est libéré lentement pendant plusieurs jours.
Biotransformation
Le corps humain métabolise le méthoxyflurane. Le méthoxyflurane est métabolisé par déchloration et O-déméthylation dans le foie, par l’intermédiaire des enzymes CYP 450, en particulier CYP 2E1, CYP 2B6 et CYP 2A6. Le méthoxyflurane est métabolisé en ions fluorures libres, en acide oxalique, en acide difluorométhoxyacétique et en acide dichloroacétique. Les ions fluorures libres et l'acide oxalique peuvent tous les deux provoquer des lésions rénales à des concentrations supérieures à celles obtenues par l’administration d’une dose antalgique unique. Le méthoxyflurane est plus susceptible de se métaboliser que d'autres éthers méthyléthyliques halogénés et possède une plus grande propension à se diffuser dans les tissus adipeux. Ainsi, le méthoxyflurane est lentement relargué à partir de ce réservoir pendant plusieurs jours sous une forme disponible pour une biotransformation.
Élimination
Dans l’étude pharmacocinétique réalisée sur des volontaires sains ayant inhalé 3 mL de méthoxyflurane pendant une heure, on a observé un pic précoce des courbes de concentration plasmatique artérielle et veineuse en fonction du temps de méthoxyflurane, suivi de son élimination rapide du plasma, les concentrations de méthoxyflurane veineuses revenant à leur niveau de référence dans les 24 heures suivant l’administration. Les concentrations artérielles et veineuses des métabolites, des dérivés inorganiques fluorés ont augmenté moins rapidement que celles du méthoxyflurane (tmax médian de 1,5 heure) et ces substances ont été progressivement éliminées du plasma, des concentrations importantes ayant été mesurées dans le plasma veineux 48 heures après l’administration du méthoxyflurane.
Après inhalation intermittente pendant une heure d’une dose unique de 3 mL de méthoxyflurane, la demi-vie médiane veineuse du méthoxyflurane est de 3,16 heures (plage de 1,06-7,89 heures) ; celle des dérivés inorganiques fluorés est de 33,30 heures (plage de 23,50-51,20 heures). Les profils pharmacocinétiques pour le méthoxyflurane et pour les dérivés inorganiques fluorés ont affiché une variabilité inter-sujets élevée.
Environ 60 % du méthoxyflurane absorbé est excrété dans l'urine sous forme de dérivé organique fluoré, de fluorure et d'acide oxalique. Le reste est expiré sous forme inchangée ou sous forme de dioxyde de carbone. Des concentrations sanguines de fluorure plus élevées et plus précoces peuvent être atteintes chez les personnes obèses comparées aux personnes non obèses, ainsi que chez les personnes âgées.
5.3. Données de sécurité préclinique
Génotoxicité et cancérogénicité
Le methoxyflurane n’est pas considéré comme étant mutagène comme indiqué dans l’études d’Ames in vitro et l’étude du micronucleus chez le rat in vivo.
Il n'existe pas de preuve claire que le méthoxyflurane ait des propriétés cancérigènes. Par ailleurs, ce risque potentiel est réduit par le fait que PENTHROX est destiné à être administré en une seule fois ou de manière intermittente sur une brève période.
Reprotoxicité et toxicité développementale
Le méthoxyflurane n’affecte pas les spermatozoïdes chez la souris. Dans des études chez la souris et le rat, le méthoxyflurane a traversé le placenta cependant sans démontrer de propriétés embryotoxique ou tératogène. Toutefois, un retard du développement fœtal (diminutions du poids du fœtus et de l’ossification) a été observé après l’administration de doses répétées pendant 9 jours. La dose sans effet nocif observé (DSENO, ou NOAEL en anglais) du développement embryo-fœtal était de 0,006 % (104 mg/kg) - 4 h/jour chez les souris et proche de 0,01 % (245 mg/kg) - 8 h/jour chez les rats. Les DSENOs déterminées chez la souris et chez le rat correspondent à une marge de 1 à 2 fois sur une base de calcul en mg/kg et de 0,1 à 0,3 fois sur une base de calcul en mg/m2 par rapport à la dose clinique maximale proposée. Étant donné que PENTHROX n'est pas prévu pour une utilisation quotidienne, le risque de développement fœtal retardé est considéré comme étant très faible.
Effets rénaux et hépatiques
L'administration continue de doses anesthésiques élevées de méthoxyflurane à des rats a été associée à une nécrose tubulaire rénale et à un gonflement mitochondrial. Une administration intermittente répétée ou continue, de concentrations sub-anesthésiques de méthoxyflurane a été associée à des modifications hépatiques limitées et généralement réversibles (stéatose hépatique, augmentation des ALAT/ASAT) chez plusieurs espèces.
Après 90 minutes d'inhalation continue de méthoxyflurane pendant 14 jours consécutifs chez le chien, aucune anomalie rénale saillante n'a été notée et dans le foie, il y a eu une accumulation minimale / légère de glycogène centrilobulaire.
Des DSENO (ou NOAEL en anglais) de 396 mg/kg et 153 mg/kg ont été rapportés respectivement chez le rat et le chien pour les études ci-dessus. Les DSENO chez le rat et le chien représentent une marge d’exposition de 0,3 fois sur la base des données d’ASC et une marge d’exposition de 0,2 fois sur la base des valeurs de Cmax par rapport à la dose clinique maximale proposée de 6 mL en un jour. Ces effets rénaux et hépatiques ont cependant été observés avec des administrations prolongées et répétées sur 14 jours et les expositions totales sont supérieures à celles anticipées par une utilisation clinique normale du produit.
Hydroxytoluène butylé E321 (stabilisant)
36 mois.
6.4. Précautions particulières de conservation
Ce médicament ne nécessite pas de précautions particulières de conservation.
6.5. Nature et contenu de l'emballage extérieur
PENTHROX est disponible dans les présentations suivantes :
Flacon de 3 mL avec un film d’inviolabilité (boîte de 10 flacons)
Boîte contenant un flacon de 3 mL PENTHROX, un inhalateur PENTHROX et une chambre de Charbon Actif (boîte de 1 ou 10 flacons).
Toutes les présentations peuvent ne pas être commercialisées.
6.6. Précautions particulières d’élimination et de manipulation
Après le remplissage de l'inhalateur PENTHROX, rebouchez le flacon de PENTHROX. Mettez l'inhalateur et le flacon usagés PENTHROX dans le sac en plastique fourni, fermez-le et éliminez-les conformément à la réglementation en vigueur.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
179 BUREAUX DE LA COLLINE
92210 SAINT-CLOUD
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
o 34009 300 608 7 2 : Boîte de 10 flacons de 3 mL avec un film d’inviolabilité.
o 34009 300 608 8 9 : Boîte contenant un flacon de 3 mL, un inhalateur PENTHROX et une chambre de charbon actif (boîte de 1).
o 34009 300 608 9 6 : Boîte contenant un flacon de 3 mL, un inhalateur PENTHROX et une chambre de charbon actif (boîte de 10).
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire].
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire].
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Liste I.
Médicament réservé à l’usage professionnel.
ANSM - Mis à jour le : 29/10/2025
PENTHROX 99,9%, liquide pour inhalation par vapeur de 3 mL
Méthoxyflurane
o Gardez cette notice. Vous pourriez avoir besoin de la relire.
o Si vous avez d’autres questions, interrogez votre médecin ou votre infirmier/ère.
o Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d’autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
o Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre infirmier/ère. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
1. Qu'est-ce que PenthRox 99,9%, liquide pour inhalation par vapeur de 3 mL et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant d'utiliser Penthrox 99,9%, liquide pour inhalation par vapeur de 3 mL ?
3. Comment utiliser Penthrox 99,9%, liquide pour inhalation par vapeur de 3 mL ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver Penthrox 99,9%, liquide pour inhalation par vapeur de 3 mL ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE PENTHROX 99,9%, liquide pour inhalation par vapeur de 3 ml ET DANS QUELS CAS EST-IL UTILISE ?
Classe pharmacothérapeutique : autres analgésiques et antipyrétiques - code ATC : N02BG09.
L’usage prévu de l’inhalateur PENTHROX est l’administration du médicament antalgique PENTHROX (méthoxyflurane). PENTHROX est versé dans le dispositif et lorsque vous respirez à travers l’inhalateur, vous inhalez la vapeur de PENTHROX. La chambre de charbon actif insérée dans le dispositif capte la vapeur de PENTHROX que vous expirez à travers l’inhalateur.
PENTHROX, administré à l’aide de l’inhalateur PENTHROX, est destiné à diminuer l’intensité de la douleur plutôt que la supprimer complètement.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D’UTILISER PENTHROX 99,9%, liquide pour inhalation par vapeur de 3 ml ?
N’utilisez jamais PENTHROX 99,9%, liquide pour inhalation par vapeur de 3 mL :
o Si vous êtes allergique au méthoxyflurane, aux anesthésiques par inhalation, ou à l’un des autres composants contenus dans ce médicament, mentionnés dans la rubrique 6.
o Si vous ou un membre de votre famille présentez des antécédents d'hyperthermie maligne. L'hyperthermie maligne se caractérise par une très forte fièvre, un rythme cardiaque rapide et irrégulier, des spasmes musculaires et des problèmes respiratoires à la suite de l’administration d’un anesthésique.
o Si vous ou un membre de votre famille avez eu des antécédents d'effets indésirables graves avec des anesthésiques inhalés.
o Si vous avez déjà eu des lésions hépatiques après utilisation de méthoxyflurane ou de tout autre anesthésique par inhalation.
o Si vous avez des problèmes rénaux.
o Si vous avez une altération du niveau de conscience, quelle qu’en soit la cause, y compris en lien avec un traumatisme crânien, ou une consommation de drogues ou d'alcool.
o Si vous avez des problèmes cardiaques graves ou des problèmes graves de la circulation sanguine.
o Si votre respiration est superficielle ou difficile.
Ce médicament ne doit pas être utilisé comme anesthésique.
Si vous avez un doute, adressez-vous à votre médecin ou votre infirmier/ère.
Avertissements et précautions
Adressez-vous à votre médecin ou votre infirmier/ère avant d’utiliser PENTHROX :
· Si vous avez des problèmes hépatiques (foie) ou rénaux ;
· Si vous avez un état de santé pouvant causer des problèmes rénaux ;
· Si vous êtes une personne âgée.
Des cas de dépression respiratoire, se manifestant par des symptômes tels qu’une respiration trop lente et superficielle ou d’autres difficultés respiratoires, ont été rapportés lors du traitement par PENTHROX (voir rubrique 4). Si vous présentez tout problème respiratoire, informez immédiatement votre médecin ou infirmier/ère.
Enfants
Ce médicament ne doit pas être donné aux enfants.
Autres médicaments et PENTHROX 99,9%, liquide pour inhalation par vapeur de 3 mL
Informez votre médecin si vous prenez, avez récemment pris ou pourriez prendre tout autre médicament. Vous devez notamment signaler à votre médecin ou votre infirmier/ère, si vous prenez un ou plusieurs des médicaments suivants :
o Isoniazide, utilisé pour le traitement de la tuberculose.
o Phénobarbital ou carbamazépines, utilisés pour le traitement de l'épilepsie.
o Rifampicine ou tout autre antibiotique, utilisé pour le traitement d’infections.
o Des médicaments, ou des drogues illicites, qui sont des dépresseurs du système nerveux comme les stupéfiants, les analgésiques, les sédatifs, les somnifères, les anesthésiques généraux, les phénothiazines, les tranquillisants, les décontractants musculaires et les antihistaminiques sédatifs.
o Des antibiotiques ou d’autres médicaments susceptibles d’être nocifs pour les reins, comme tétracycline, gentamycine, colistine, polymyxine B, amphotéricine B et produits de contraste.
o Efavirenz ou névirapine, utilisés pour le traitement du VIH.
En cas de doute, adressez-vous à votre médecin ou votre infirmier/ère.
Si vous avez besoin de soins hospitaliers nécessitant une anesthésie générale, prévenez votre médecin que vous avez utilisé ce médicament.
Ne consommez pas d'alcool lorsque vous prenez ce médicament au risque d'accroître son effet.
Vous pouvez manger et boire normalement lorsque vous prenez ce médicament sauf avis contraire de votre médecin ou votre infirmier/ère.
Grossesse, allaitement et fertilité
Si vous êtes enceinte ou que vous allaitez, si vous pensez être enceinte ou planifiez une grossesse, demandez conseil à votre médecin avant de prendre ce médicament. Votre médecin évaluera les risques éventuels et les bénéfices de prendre ce médicament.
Conduite de véhicules et utilisation de machines
Ce médicament peut affecter votre aptitude à conduire ou utiliser des machines en toute sécurité. Vérifiez que vos aptitudes ne sont pas affectées avant de conduire ou d'utiliser des machines. PENTHROX peut provoquer une somnolence ou des vertiges chez certaines personnes.
PENTHROX 99,9%, liquide pour inhalation par vapeur de 3 mL contient de l’hydroxytoluène butylé (E321)
Ce médicament contient un stabilisant appelé hydroxytoluène butylé (E321). L'hydroxytoluène butylé peut provoquer des réactions cutanées localisées (par exemple, une dermatite de contact), ou une irritation des yeux et des muqueuses.
3. COMMENT UTILISER PENTHROX 99,9%, liquide pour inhalation par vapeur de 3 ml ?
Posologie
Adultes
Un ou deux flacons de 3 mL de PENTHROX peuvent être utilisés par administration. La dose maximale est de deux flacons de 3 mL à la suite. La dose maximale ne doit pas être dépassée.
L’inhalateur PENTHROX ne doit être utilisé qu’avec PENTHROX (méthoxyflurane).
Mode d’administration
Comment utiliser PENTHROX 99,9%, liquide pour inhalation par vapeur de 3 mL?

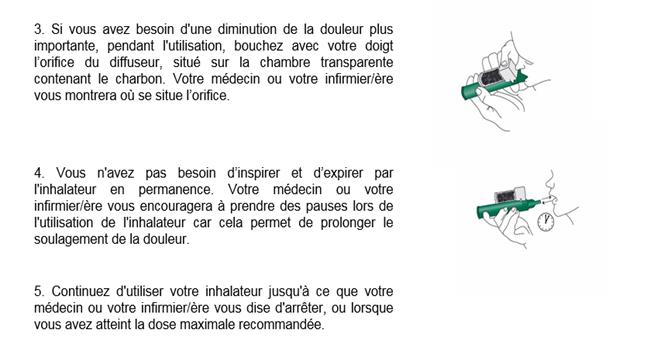
Ne donnez pas ce médicament à d’autres personnes même si les signes de leur maladie sont identiques aux vôtres.
Si vous avez utilisé plus de PENTHROX 99,9%, liquide pour inhalation par vapeur de 3 mL que vous n’auriez dû :
Le professionnel de santé administrant PENTHROX est formé à l'utilisation de PENTHROX et il est fortement improbable que vous dépassiez les dosages prescrits. Vous ne devez pas utiliser plus de 2 flacons à la fois. Si la dose maximale était dépassée, PENTHROX risquerait d'endommager vos reins. Avertissez immédiatement votre médecin si vous pensez avoir dépassé la dose maximale.
Si vous avez d’autres questions sur l’utilisation de ce médicament, demandez plus d’informations à votre médecin ou à votre infirmier/ère.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Effets indésirables graves
Veuillez alerter votre médecin immédiatement, si vous souffrez des effets suivants :
o Réaction allergique grave ; les symptômes incluent des difficultés respiratoires et/ou un gonflement du visage.
o Troubles hépatiques comme la perte d'appétit, nausées, vomissements, jaunisse (jaunissement de la peau et/ou des yeux), urines de couleur foncée, selles de couleur pâle, douleur ou sensibilité au toucher sur votre côté abdominal droit (sous les côtes).
o Troubles rénaux comme réduction ou augmentation de la quantité d’urine, gonflement des pieds ou de la partie inférieure des jambes.
o Respiration trop lente et superficielle ou autres difficultés respiratoires (symptômes de dépression respiratoire) (fréquence indéterminée, ne peut être estimée sur la base des données disponibles).
Ces effets indésirables peuvent mettre en jeu le pronostic vital. Alertez votre professionnel de santé immédiatement.
Autres effets indésirables
Effets indésirables très fréquents (concernent plus d’1 patient sur 10)
o Vertiges
Effets indésirables fréquents (peuvent concerner entre 1 et 10 patients sur 100)
o Somnolence
o Maux de tête ou nausées
o Euphorie
o Sensation d’ivresse
o Trouble du goût
o Toux
Effets indésirables peu fréquents (peuvent concerner entre 1 et 10 patients sur 1000)
o Angoisse ou dépression
o Émotions ou actions inappropriées
o Répétition de mots ou problèmes d’élocution
o Perte de mémoire
o Picotement ou engourdissement des pieds ou des mains
o Engourdissement
o Trouble de la vision
o Rougeur de la peau
o Pression artérielle faible ou élevée
o Sècheresse buccale
o Gêne buccale ou démangeaisons
o Augmentation de la salivation
o Appétit augmenté
o Vomissements
o Sudation
o Fatigue
o Ne pas se sentir bien
o Frissons
o Sensation de relaxation
Fréquence inconnue (ne peut être estimée sur la base des données disponibles)
o Hypersensibilité
o Humeur changeante
o Impatience ou agitation
o Sensation d'être déconnecté de la réalité
o Désorientation
o Altération de l’état de conscience
o Étouffement
o Essoufflement
o Mouvements oculaires incontrôlés
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin, votre pharmacien, ou à votre infirmier/ère. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER PENTHROX 99,9%, liquide pour inhalation par vapeur de 3 ml ?
Tenir ce médicament hors de la vue et de la portée des enfants.
Ce médicament ne nécessite pas de précautions particulières de conservation.
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient PENTHROX 99,9%, liquide pour inhalation par vapeur de 3 mL
o La substance active est le méthoxyflurane. Chaque flacon scellé contient 3 mL de méthoxyflurane 99,9 %.
o L’autre composant est l'hydroxytoluène butylé (E321)
PENTHROX est fourni dans les présentations suivantes :
a) flacon avec film d’inviolabilité (boîtes de 10 flacons) ou
b) boîte contenant un flacon de 3 mL PENTHROX, un inhalateur PENTHROX et une chambre de charbon actif (boîtes de 1 ou 10).
Toutes les présentations peuvent ne pas être commercialisées.
Titulaire de l’autorisation de mise sur le marché
179 BUREAUX DE LA COLLINE
92210 SAINT-CLOUD
Exploitant de l’autorisation de mise sur le marché
179 BUREAUX DE LA COLLINE
92210 SAINT-CLOUD
SUITE 1, FIRST FLOOR, STAFFORD HOUSE,
STRAND ROAD, PORTMARNOCK, CO. DUBLIN, D13 WC83,
IRLANDE
ou
ETHYPHARM
CHEMIN DE LA POUDRIERE
76120 LE GRAND QUEVILLY
FRANCE
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Ce médicament est autorisé dans les Etats membres de l'Espace Economique Européen sous les noms suivants : Conformément à la réglementation en vigueur.
[À compléter ultérieurement par le titulaire]
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
< {MM/AAAA}>< {mois AAAA}.>
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).
Les informations suivantes sont destinées exclusivement aux professionnels de santé.
Les instructions pour la préparation de l'inhalateur PENTHROX et pour la bonne administration sont fournies ci-dessous.
Avant utilisation, vérifier l’absence de corps étrangers et de pièces brisées ou détériorées. Dans le cas contraire, ne pas utiliser ce dispositif.
|
1. |
Vérifiez que la chambre de Charbon Actif (CA) est insérée dans l’orifice du diffuseur sur le haut de l'inhalateur PENTHROX. |
|
|
2. |
Dévissez le bouchon du flacon à la main. Vous pouvez également utiliser la base de l'inhalateur PENTHROX pour desserrer le bouchon en effectuant un demi-tour. A la main, séparez l'inhalateur du flacon et enlevez le bouchon. |
|
|
3. |
Inclinez l'inhalateur PENTHROX à 45° et versez la totalité du flacon dans la base de l'inhalateur tout en le faisant tourner. |
|
|
4. |
Mettez la dragonne autour du poignet du patient. Le patient inhale à travers l'embout buccal de l'inhalateur PENTHROX pour obtenir un effet antalgique. Les premières inspirations doivent être légères puis le patient peut respirer normalement à travers l’inhalateur. |
|
|
5. |
Le patient expire dans l'inhalateur PENTHROX. La vapeur expirée passe à travers la chambre de Charbon Actif pour adsorber le méthoxyflurane expiré. |
|
|
6. |
Si un effet antalgique plus puissant est nécessaire, le patient peut boucher avec son doigt l’orifice du diffuseur sur la chambre de Charbon Actif, pendant l’inspiration. |
|
|
7. |
Si le soulagement de la douleur doit continuer après l’utilisation d’un flacon de 3 mL, utilisez un second flacon si disponible. Vous pouvez également utiliser un second flacon d’un nouveau dispositif. Utilisez alors de la même manière que le premier flacon selon les étapes 2 et 3 décrites précédemment. Il n’est pas nécessaire d’enlever la chambre de charbon actif. Mettez le flacon utilisé dans le sac plastique mis à disposition. |
|
|
8. |
Il doit être indiqué au patient d'inhaler de façon intermittente pour atteindre une antalgie adéquate. Une inhalation continue réduira la durée d'utilisation. La dose minimale efficace pour obtenir l'antalgie doit être administrée |
|
|
9. |
Remettez le bouchon sur le flacon de PENTHROX. Mettez l'inhalateur PENTHROX et le flacon usagé dans le sac en plastique fermé hermétiquement et jetez-le conformément à la réglementation en vigueur. |
|
Médecins, infirmier(ière), ambulancier et toutes personnes formées à l’administration de PENTHROX doivent fournir et expliquer la notice d'information du produit au patient.