Dernière mise à jour le 02/02/2026
CHLORURE DE METHACHOLINE PANPHARMA 100 mg, poudre pour solution pour inhalation par nébuliseur
Indications thérapeutiques
Classe pharmacothérapeutique : autres agents diagnostiques - code ATC : V04CX03
Qu’est-ce que CHLORURE DE METHACHOLINE PANPHARMA ?
CHLORURE DE METHACHOLINE PANPHARMA contient un médicament appelé « chlorure de méthacholine ». Il agit sur les voies aériennes en provoquant leur resserrement, afin qu’elles deviennent plus étroites ou se contractent. Ce médicament est à usage diagnostique uniquement.
Dans quel cas CHLORURE DE METHACHOLINE PANPHARMA est-il utilisé ?
CHLORURE DE METHACHOLINE PANPHARMA est utilisé chez l’adulte et chez l’enfant (âgé de 5 ans ou plus). Il est administré dans le cadre d’un test de la fonction respiratoire appelé « test de provocation à la méthacholine ».
Votre médecin ou votre infirmier/ère réalisera ce test pour :
· établir si vous avez de l’asthme,
· vérifier le degré de sévérité de votre asthme,
· établir si vous souffrez « d’asthme professionnel ».
Présentations
> 6 flacon(s) en verre brun de 100 mg
Code CIP : 34009 550 792 8 6
Déclaration de commercialisation : 19/01/2024
Cette présentation est agréée aux collectivités
Service médical rendu (SMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprès de la HAS (plus d'informations dans l'aide). Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Modéré | Avis du 08/11/2023 | Inscription (CT) | Le service médical rendu par CHLORURE DE METHACHOLINE PANPHARMA 100 mg, poudre pour solution pour inhalation par nébuliseur (chlorure de méthacholine) est modéré dans l’indication de l’AMM. |
Amélioration du service médical rendu (ASMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprés de la HAS (plus d'informations dans l'aide). Les avis et synthéses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur de l'ASMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| V (Inexistant) | Avis du 08/11/2023 | Inscription (CT) | Compte tenu : • de l’usage de la méthacholine depuis plusieurs dizaines d’années pour le diagnostic de l’hyperréactivité bronchique non spécifique chez l’adulte et l’enfant (âgé d’au moins 5 ans), en capacité d’effectuer une spirométrie reproductible, qui présente une spirométrie normale et qui ne présente pas d’asthme cliniquement apparent, mais qui a des antécédents médicaux suggérant cette affection . • de la démonstration de l’efficacité de la méthacholine sur des données bibliographiques . • de la faible robustesse des résultats des études cliniques liée aux limites méthodologiques des études fournies . • de la bonne tolérance de la méthacholine . • du besoin médical partiellement couvert . la Commission considère que CHLORURE DE METHACHOLINE PANPHARMA 100 mg, poudre pour solution pour inhalation par nébuliseur (chlorure de méthacholine) n’apporte pas d’amélioration du service médical rendu (ASMR V) dans la stratégie diagnostique actuelle de l’hyperréactivité bronchique. |
Autres informations
- Titulaire de l'autorisation : METAPHARM LIMITED
- Conditions de prescription et de délivrance :
- liste I
- réservé à l'usage HOSPITALIER
- Statut de l'autorisation : Valide
- Type de procédure : Procédure décentralisée
- Code CIS : 6 058 609 4
ANSM - Mis à jour le : 16/05/2025
CHLORURE DE METHACHOLINE PANPHARMA 100 mg, poudre pour solution pour inhalation par nébuliseur
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Chlorure de méthacholine..................................................................................................... 100 mg
Pour un flacon de 20 mL.
Poudre pour solution pour inhalation par nébuliseur.
Poudre de couleur blanche ou blanchâtre.
4.1. Indications thérapeutiques
Ce médicament est à usage diagnostique uniquement.
CHLORURE DE METHACHOLINE PANPHARMA est indiqué pour le diagnostic de l’hyperréactivité bronchique non spécifique chez l’adulte et l’enfant (âgé d’au moins 5 ans), en capacité d’effectuer une spirométrie reproductible, qui présente une spirométrie normale et qui ne présente pas d’asthme cliniquement apparent, mais qui a des antécédents médicaux suggérant cette affection (voir rubriques 4.2 et 5.1).
4.2. Posologie et mode d'administration
Adultes et enfants (âgés de 5 ans et plus)
CHLORURE DE METHACHOLINE PANPHARMA est administré uniquement sous forme de solution pour inhalation.
Avant de démarrer un test de provocation avec CHLORURE DE METHACHOLINE PANPHARMA, il convient d’effectuer une spirométrie de référence. Pour qu’un(e) patient(e) soit en mesure de passer le test, il/elle doit présenter un VEMS (volume expiratoire maximal par seconde) de référence supérieur ou égal à 60 % de la valeur prévue (chez l’adulte et chez l’enfant) et supérieur ou égal à 1,5 L (chez l’adulte).
Au début du test de provocation et avant la nébulisation avec CHLORURE DE METHACHOLINE PANPHARMA, il convient de mesurer le VEMS après une exposition au diluant nébulisé (VEMS post-diluant). Le test de provocation à la méthacholine est considéré comme positif si la réduction du VEMS est supérieure ou égale à 20 % par rapport au VEMS avec le diluant recommandé. Le test doit être arrêté à ce stade. La valeur de la réduction doit être calculée et enregistrée avant de démarrer le test avec CHLORURE DE METHACHOLINE PANPHARMA.
Population pédiatrique
La sécurité et l’efficacité de CHLORURE DE METHACHOLINE PANPHARMA chez les enfants âgés de moins de 5 ans n’ont pas été établies. Aucune donnée n’est disponible.
Instructions pour la reconstitution et la dilution avant administration
Remarque : ne pas inhaler la poudre. Vous ne devez pas manipuler ce produit si vous souffrez d’asthme ou d’allergies. Toutes les dilutions doivent être réalisées avec une solution injectable de chlorure de sodium à 0,9 % en utilisant des flacons en verre borosilicate de type I, vides et stériles. Après l’ajout de la solution de chlorure de sodium, agitez chaque flacon jusqu’à ce que vous obteniez une solution limpide.
Préparation de dilutions en série
Tableau 1A : Préparation de dilutions en série avec un seul flacon de CHLORURE DE METHACHOLINE PANPHARMA 100 mg, poudre pour solution pour inhalation par nébuliseur (chlorure de méthacholine) – multiplication par deux des concentrations ou des doses
|
Prendre |
AJOUTER DU CHLORURE DE SODIUM A 0,9 % |
Concentration de CHLORURE DE METHACHOLINE PANPHARMA |
Dose de CHLORURE DE METHACHOLINE PANPHARMA* |
|
100 mg de CHLORURE DE METHACHOLINE PANPHARMA |
6,25 mL |
16 mg/mL (A) |
380 µg |
|
3 mL de dilution A |
3 mL |
8 mg/mL (B) |
190 µg |
|
3 mL de dilution B |
3 mL |
4 mg/mL (C) |
95 µg |
|
3 mL de dilution C |
3 mL |
2 mg/mL (D) |
47,5 µg |
|
3 mL de dilution D |
3 mL |
1 mg/mL (E) |
23,75 µg |
|
3 mL de dilution E |
3 mL |
0,5 mg/mL (F) |
11,875 µg |
|
3 mL de dilution F |
3 mL |
0,25 mg/mL (G) |
5,938 µg |
|
3 mL de dilution G |
3 mL |
0,125 mg/mL (H) |
2,969 µg |
|
3 mL de dilution H |
3 mL |
0,0625 mg/mL (I) |
1,484 µg |
|
3 mL de dilution I |
3 mL |
0,0312 mg/mL (J) |
0,742 µg |
*La dose de CHLORURE DE METHACHOLINE PANPHARMA correspondant à chaque concentration a été déterminée sur la base de la dose délivrée par le nébuliseur Wright pendant deux (2) minutes de nébulisation, en utilisant de l’air comprimé sec pour actionner le nébuliseur, avec un régulateur de pression réglé sur 50 psi afin d’obtenir un résultat de l’ordre de 10 % de 0,13 mL/min−1 (ou g/min−1) (mesure gravimétrique)![]() . Le nébuliseur Wright génère un aérosol à particules aérodynamiques de diamètre de masse médian (DMM) compris entre 1,0 et 1,5 µm. Les nébuliseurs avec un DMM compris entre 1,0 et 3,6 µm n’influent pas sur la réponse. Il est possible d’utiliser d’autres nébuliseurs adaptés si le débit du dispositif et la taille des particules sont caractérisés (ou s’il est établi que le nébuliseur délivre un aérosol avec un DMM compris entre 1,0 et 3,6 µm) et si la dose est calculée (voir rubrique « Mode d’administration »).
. Le nébuliseur Wright génère un aérosol à particules aérodynamiques de diamètre de masse médian (DMM) compris entre 1,0 et 1,5 µm. Les nébuliseurs avec un DMM compris entre 1,0 et 3,6 µm n’influent pas sur la réponse. Il est possible d’utiliser d’autres nébuliseurs adaptés si le débit du dispositif et la taille des particules sont caractérisés (ou s’il est établi que le nébuliseur délivre un aérosol avec un DMM compris entre 1,0 et 3,6 µm) et si la dose est calculée (voir rubrique « Mode d’administration »).
Tableau 1B : Préparation de dilutions en série avec un seul flacon de CHLORURE DE METHACHOLINE PANPHARMA 100 mg, poudre pour solution pour inhalation par nébuliseur (chlorure de méthacholine) – multiplication par quatre des concentrations ou des doses
|
Prendre |
AJOUTER DU CHLORURE DE SODIUM A 0,9 % |
Concentration de CHLORURE DE METHACHOLINE PANPHARMA |
Dose de CHLORURE DE METHACHOLINE PANPHARMA* |
|
100 mg de CHLORURE DE METHACHOLINE PANPHARMA |
6,25 mL |
16 mg/mL (A) |
380 µg |
|
3 mL de dilution A |
9 mL |
4 mg/mL (B) |
95 µg |
|
3 mL de dilution B |
9 mL |
1 mg/mL (C) |
23,75 µg |
|
3 mL de dilution C |
9 mL |
0,25 mg/mL (D) |
5,938 µg |
|
3 mL de dilution D |
9 mL |
0,0625 mg/mL (E) |
1,484 µg |
* La dose de CHLORURE DE METHACHOLINE PANPHARMA correspondant à chaque concentration a été déterminée sur la base de la dose délivrée par le nébuliseur Wright pendant deux (2) minutes de nébulisation, en utilisant de l’air comprimé sec pour actionner le nébuliseur, avec un régulateur de pression réglé sur 50 psi afin d’obtenir un résultat de l’ordre de 10 % de 0,13 mL/min−1 (ou g/min−1) (mesure gravimétrique)![]() . Le nébuliseur Wright génère un aérosol à particules aérodynamiques de diamètre de masse médian (DMM) compris entre 1,0 et 1,5 µm. Les nébuliseurs avec un DMM compris entre 1,0 et 3,6 µm n’influent pas sur la réponse. Il est possible d’utiliser d’autres nébuliseurs adaptés si le rendement du dispositif et la taille des particules sont caractérisés (ou s’il est établi que le nébuliseur délivre un aérosol avec un DMM compris entre 1,0 et 3,6 µm) et si la dose est calculée (voir rubrique « Mode d’administration »).
. Le nébuliseur Wright génère un aérosol à particules aérodynamiques de diamètre de masse médian (DMM) compris entre 1,0 et 1,5 µm. Les nébuliseurs avec un DMM compris entre 1,0 et 3,6 µm n’influent pas sur la réponse. Il est possible d’utiliser d’autres nébuliseurs adaptés si le rendement du dispositif et la taille des particules sont caractérisés (ou s’il est établi que le nébuliseur délivre un aérosol avec un DMM compris entre 1,0 et 3,6 µm) et si la dose est calculée (voir rubrique « Mode d’administration »).![]()
Utilisez un filtre hydrophile stérile, conçu pour retenir les bactéries, d’une porosité de 0,22 µm (Millex GV 0,22 µm) pour le transfert de la solution de chaque flacon (au moins 2 mL) dans le nébuliseur.
Mode d’administration
Il est impératif que le test se déroule sous surveillance médicale spécialisée, assurée par un médecin connaissant tous les aspects du test de provocation à la méthacholine ; voir rubrique 4.4.
Posologie
Pour les tests cliniques, il est recommandé de progresser en multipliant les paliers par quatre. Toutefois, si le test de provocation à la méthacholine a pour objectif de déterminer des changements de la réactivité bronchique chez des patients avec un asthme connu, le doublement des concentrations donnera des valeurs PD20 plus précises.
Méthode à volume courant
Dans les études cliniques menées avec CHLORURE DE METHACHOLINE PANPHARMA à l’aide de la méthode à volume courant, un nébuliseur Wright, désormais obsolète, a été utilisé, actionné à l’air comprimé sec avec un régulateur de pression réglé sur 50 psi, afin d’obtenir un résultat de l’ordre de 10 % de 0,13 mL/min−1 (ou g/min−1) (mesure gravimétrique) avec une durée de nébulisation de deux (2) minutes. Le nébuliseur Wright génère un aérosol à particules aérodynamiques de diamètre de masse médian (DMM) compris entre 1,0 et 1,5 µm. Un DMM compris entre 1,0 et 3,6 µm est acceptable.
La méthode à volume courant suivante repose sur l’utilisation du nébuliseur à petit volume Hudson RCI MicroMist actuellement disponible, actionné à l’air comprimé sec, avec un régulateur de pression réglé sur 50 psi, un contrôleur de débit réglé sur 4,5 LPM (litres par minute) et une durée de nébulisation d’une (1) minute.
· Dans ces conditions, similaires à celles appliquées pour le nébuliseur Wright utilisé dans les études cliniques, le débit restait dans les limites de 10 % de 0,13 mL/min−1 (ou g/min−1) (mesure gravimétrique).
· Il a été établi que le DMM mesuré était de 3,4 µm, soit dans la plage de DMM acceptable de 1,0-3,6 µm.
· En utilisant le nébuliseur à petit volume Hudson RCI MicroMist, la dose délivrée de la fraction respirable pour la solution de CHLORURE DE METHACHOLINE PANPHARMA à 16 mg/mL était de 380 µg, soit une dose identique à celle indiquée dans les tableaux 1A et 1B.
1. Utilisez un nébuliseur à petit volume Hudson RCI MicroMist, en l’actionnant à l’air comprimé sec.
2. A l’aide d’une seringue à aiguille de 3 mL, prélevez 2 à 3 mL de diluant (solution de chlorure de sodium à 0,9 %) et transférez-le dans le flacon du nébuliseur. Reliez le nébuliseur et la tubulure nécessaire à la source d’air comprimé.
3. A ce stade, le/la patient(e) doit être informé(e) que l’aérosol peut provoquer une toux légère, une sensation de serrement dans la poitrine ou un essoufflement. Expliquez-lui que, si ces symptômes deviennent gênants, il/elle doit retirer le masque ou l’embout afin d’arrêter immédiatement d’inhaler l’aérosol. Évitez de suggérer que ces symptômes sont inévitables, car le pouvoir de suggestion suffit à faire baisser le VEMS. N’oubliez pas que la perception de la constriction des bronches peut varier considérablement d’un patient à un autre, il est donc recommandé d’être attentif à d’autres signes visuels ou sonores, comme un sifflement ou une altération de la respiration. Avant chaque dose, il convient de répéter la consigne d’interrompre l’inhalation de l’aérosol si les symptômes deviennent problématiques.
4. Demandez au/à la patient(e) de se détendre et de respirer doucement l’aérosol (volume courant) pendant 1 minute.
5. Placez le masque sur le nez ou la bouche du/de la patient(e) sans le serrer ou insérez l’embout dans sa bouche (avec un pince-nez). Le nébuliseur doit être maintenu en position verticale. Le/la patient(e) doit tenir le nébuliseur de manière à éviter de réchauffer la solution et de modifier ainsi le débit.
6. Réglez le régulateur de pression sur 50 psi et commencez la nébulisation en réglant le contrôleur de débit sur 4,5 LPM. Déclenchez immédiatement le chronomètre.
7. Après exactement une minute, arrêtez le nébuliseur et le débitmètre, retirez le masque ou l’embout au/à la patient(e) et éliminez le reste de solution présente dans le nébuliseur.
Mesurez le VEMS à 30 et 90 secondes après la fin de l’inhalation. Ces valeurs peuvent être conservées à température ambiante et pression saturée (Ambient Temperature Pressure Saturated, ATPS). Si le VEMS post-diluant chute de 20 % ou plus par rapport au VEMS moyen de référence, interrompez les inhalations et passez à l’étape 10. Si le VEMS post-diluant chute de moins de 20 %, passez à l’étape 8.
8. La dose/concentration du premier aérosol de CHLORURE DE METHACHOLINE PANPHARMA pour le test de provocation à la méthacholine est soit de 1,484 µg ou 0,0626 mg/mL (dose quadruplée), soit de 0,742 µg ou 0,0312 mg/mL (dose doublée). Les doses suivantes sont administrées toutes les 5 minutes en doublant ou quadruplant les doses/concentrations, selon les incréments de dosages indiqués dans le tableau 1A ou 1B.
9. Répétez les étapes 1 à 8 à chaque augmentation de dose/concentration de CHLORURE DE METHACHOLINE PANPHARMA, jusqu’à ce que le VEMS ait chuté de 20 % ou plus par rapport au VEMS post-diluant ou jusqu'à l’administration de la dose/concentration la plus élevée indiquée dans le tableau 1A ou le 1B. À ce stade du test, arrêtez les inhalations de CHLORURE DE METHACHOLINE PANPHARMA. Notez la dernière et l’avant-dernière dose de CHLORURE DE METHACHOLINE PANPHARMA avant d’arrêter les inhalations.
10. Lorsque le test est terminé, administrez 2 bouffées d’un bêta-agoniste au/à la patient(e). Attendez 10 minutes et mesurez le VEMS et la CV (capacité vitale). Les patients ne doivent pas être autorisés à partir avant que leur VEMS ne soit revenu à 90 % du VEMS de référence.
A la fin du test avec CHLORURE DE METHACHOLINE PANPHARMA, un bêta-agoniste peut être administré au/à la patient(e) pour accélérer le retour au VEMS de référence et pour soulager la gêne ressentie. La majorité des patients retrouvent une fonction pulmonaire normale dans les 5 minutes suivant l’administration d’un bronchodilatateur, ou dans les 30-45 minutes si aucun bronchodilatateur n’est administré
![]() La
La ![]() norme technique de l’ERS (European Respiratory Society) relative au test de provocation bronchique stipule que d’autres nébuliseurs adaptés peuvent être utilisés, dans la mesure où le débit du dispositif et la taille des particules sont caractérisés afin de pouvoir calculer la dose. Les informations concernant le débit par minute du dispositif, la distribution granulométrique, la durée du volume courant et le rapport entre le temps d’inspiration et le temps total de respiration permettront de calculer la dose de CHLORURE DE METHACHOLINE PANPHARMA.
norme technique de l’ERS (European Respiratory Society) relative au test de provocation bronchique stipule que d’autres nébuliseurs adaptés peuvent être utilisés, dans la mesure où le débit du dispositif et la taille des particules sont caractérisés afin de pouvoir calculer la dose. Les informations concernant le débit par minute du dispositif, la distribution granulométrique, la durée du volume courant et le rapport entre le temps d’inspiration et le temps total de respiration permettront de calculer la dose de CHLORURE DE METHACHOLINE PANPHARMA.
Il est attendu que les nébuliseurs de substitution, présentant des caractéristiques différentes (débit et distribution granulométrique), délivrent une dose de méthacholine différente pour la même concentration de la solution.
En cas de changement de nébuliseur et afin d’améliorer la standardisation du test, il conviendra de rapporter la quantité d’aérosol/la réactivité bronchique à la méthacholine en termes de dose (DP20) et non de concentration (CP20).
Calcul et interprétation des résultats
La dose et la concentration de provocation entraînant une diminution de 20 % du VEMS (DP20 ou CP20) peuvent être calculées comme suit :
1. Calcul de DP20
Calculer la DP20 comme suit :
![]()
Où :
D1 = avant-dernière dose de CHLORURE DE METHACHOLINE PANPHARMA (diminution du VEMS < 20 %)
D2 = dernière dose de CHLORURE DE METHACHOLINE PANPHARMA (diminution du VEMS > 20 %)
R1 = % de diminution du VEMS après D1
R2 = % de diminution du VEMS après D2
2. Calcul de la CP20
Avec la méthode à volume courant, la réactivité bronchique peut être exprimée en tant que concentration de CHLORURE DE METHACHOLINE PANPHARMA provoquant une diminution du VEMS de 20 % (CP20). Le pourcentage de diminution du VEMS peut être calculé à l'aide du VEMS moyen de référence, comme indiqué ci-dessous :
![]()
Le pourcentage de diminution du VEMS est ensuite porté en graphique en fonction de la concentration croissante de CHLORURE DE METHACHOLINE PANPHARMA (échelle logarithmique). La CP20 est obtenue par interpolation linéaire entre les deux derniers points, comme illustré par la figure 1 ci-dessous.
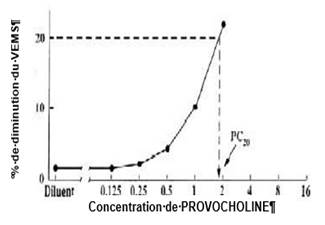
Figure 1 : Calcul de CP20
Il est également possible de calculer la CP20 comme suit :
![]()
Où :
C1 = avant-dernière concentration (diminution du VEMS < 20 %)
C2 = dernière concentration (diminution du VEMS > 20 %)
R1 = % de diminution du VEMS après C1
R2 = % de diminution du VEMS après C2
3. Interprétation des résultats
Un résultat négatif (normal) du test de provocation à la méthacholine se définit par une réduction du VEMS de moins de 20 % après l’administration de toutes les doses (selon la norme technique de l’ERS pour le test de provocation bronchique, un test de provocation à la méthacholine avec une DP20 > 380 µg ou une CP20 > 16 mg/mL est également considéré comme négatif).
CHLORURE DE METHACHOLINE PANPHARMA est contre-indiqué dans les cas suivants :
· Hypersensibilité à la substance active ou à d’autres parasympathomimétiques.
· Enfants âgés de moins de 5 ans.
· Asthme cliniquement apparent, respiration sifflante ou résultats de tests de la fonction respiratoire de référence inférieurs ou égaux à la limite [patients avec un VEMS de référence inférieur à 60 % de la valeur prévue (chez l’adulte et l’enfant) et un VEMS initial de moins de 1,5 L (chez l’adulte)].
· Patients traités par bêtabloquants, car chez ces patients, la réponse au chlorure de méthacholine peut être amplifiée ou prolongée et le patient peut ne pas réagir facilement au traitement utilisé pour rétablir la fonction respiratoire et soulager les symptômes.
· L’inhalation répétée de CHLORURE DE METHACHOLINE PANPHARMA à des doses supérieures à la dose administrée le jour du test diagnostique est contre-indiquée.
· Bradycardie.
· Anévrisme aortique connu.
· Infarctus du myocarde ou AVC au cours des 3 derniers mois.
· Hypertension non stabilisée.
· Patient atteint de myasthénie grave et traité par inhibiteurs de la cholinestérase.
· Chirurgie oculaire récente ou risque d’augmentation de la pression intracrânienne.
· Embolie pulmonaire.
· Grossesse.
· Allaitement.
4.4. Mises en garde spéciales et précautions d'emploi
Généralités
Pour garantir la sécurité d’emploi et l’efficacité du test de provocation avec CHLORURE DE METHACHOLINE PANPHARMA, il convient d’informer les patients des symptômes susceptibles de survenir suite au test et de la prise en charge de ces symptômes.
La liste complète des antécédents respiratoires doit être établie avant de commencer un test de provocation à la méthacholine, compte tenu du risque de faux-positifs lors d’un test à la méthacholine en cas d’autres troubles respiratoires, par exemple après une grippe, une infection des voies respiratoires supérieures ou une vaccination, chez des patients très jeunes ou très âgés souffrant de maladies pulmonaires chroniques (mucoviscidose, sarcoïdose, tuberculose, maladie respiratoire chronique). Le test de provocation peut être positif chez les patients souffrant de rhinite allergique sans asthme, chez les fumeurs ou chez les patients exposés à des contaminants diffusés par voie aérienne.
Il est essentiel que la spirométrie de référence soit précise. Si elle n’est pas effectuée ou mesurée avec précision et si le VEMS de référence est sous-estimé, il est possible que les diminutions suivantes du VEMS suivant l’inhalation de solutions de CHLORURE DE METHACHOLINE PANPHARMA ne soient pas détectées et entraînent l’administration d’une dose trop élevée et la survenue d’une bronchoconstriction excessive.
Les manœuvres non acceptables pendant le test de provocation à la méthacholine peuvent produire des résultats faux-positifs.
Voie d’administration
CHLORURE DE METHACHOLINE PANPHARMA doit être administré uniquement par inhalation.
Patients
CHLORURE DE METHACHOLINE PANPHARMA peut être administré à des patients souffrant d’épilepsie, de maladies cardiovasculaires, de vagotonie, d’ulcère peptique, de maladie thyroïdienne, d’obstruction des voies urinaires ou de toute autre affection pouvant réagir défavorablement à un agent cholinergique si le médecin estime que le rapport bénéfice/risque est positif pour le patient.
L’administration de CHLORURE DE METHACHOLINE PANPHARMA peut se traduire par une bronchoconstriction sévère et par la réduction de la fonction respiratoire. Les patients présentant une hyperréactivité bronchique peuvent ressentir une bronchoconstriction même à une dose minime, de l’ordre de 0,031 mg/mL. Si une bronchoconstriction sévère se produit, elle doit être immédiatement neutralisée par un agent bronchodilatateur à action rapide (bêta-agoniste) administré par voie inhalée.
Les patients souffrant d’asthme sont notablement plus sensibles à la bronchoconstriction induite par la méthacholine que les patients non asthmatiques. La prudence s’impose chez les patients présentant un asthme instable.
Personnel médical
Le test de provocation avec CHLORURE DE METHACHOLINE PANPHARMA doit être supervisé par un médecin spécialiste de la technique de test de provocation à la méthacholine par inhalation qui connaît parfaitement toutes les contre-indications, avertissements et précautions relatifs à cette technique et qui a été formé à la prise en charge de l’insuffisance respiratoire.
Le médecin responsable du test doit être joignable pendant toute la réalisation du test et être immédiatement disponible si nécessaire. Si le médecin pratique le test lui-même, une autre personne doit être disponible pour l’assister si nécessaire. Le patient ne doit rester seul à aucun moment du test. Des équipements et médicaments d’urgence doivent être immédiatement disponibles pour traiter une insuffisance respiratoire aiguë.
Les membres du personnel médical qui souffrent d’asthme ou d’allergies doivent être particulièrement prudents et prendre toutes les précautions nécessaires s’ils manipulent les substances ou s’ils effectuent eux-mêmes le test sur les patients, voir rubrique 6.6.
Population pédiatrique
Les enfants sont plus susceptibles de présenter des résultats positifs en raison d’une réactivité bronchique non asthmatique accrue. Dans ce contexte, il est donc important que les médecins s’assurent de passer en revue les autres affections respiratoires possibles.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Le traitement concomitant par CHLORURE DE METHACHOLINE PANPHARMA et par bêtabloquants est contre-indiqué ; voir rubrique 4.3.
Les médicaments contre l’asthme présentés dans le tableau 2 ci-dessous inhibent la réactivité bronchique à CHLORURE DE METHACHOLINE PANPHARMA. Il est donc nécessaire d’interrompre les traitements suivants avant la réalisation du test en raison de la durée de leur effet : bêta-agonistes, antimuscariniques et théophylline (voir tableau ci-dessous pour de plus amples informations). Les effets de médicaments plus récents n’ont pas été étudiés, voir rubrique 4.4.
Pour les patients qui prennent un traitement de routine contre l’asthme, le test de provocation à la méthacholine ne doit être envisagé que si la précision du diagnostic est remise en question. Le test de provocation à la méthacholine doit être effectué si une spirométrie normale persiste après une interruption contrôlée du médicament antiasthmatique. Une hyperréactivité bronchique de rebond est possible après l’interruption du traitement antiasthmatique et il convient d’en tenir compte lors de l’interprétation des résultats.
Tableau 2 : Médicaments pouvant réduire l’hyperréactivité bronchique et temps d’interruption
|
Médicaments |
Temps d’interruption minimum entre la dernière prise et le test de provocation (heures) |
|
Bêta-agonistes à courte durée d’action à des doses habituelles par inhalation (p. ex. salbutamol 200 µg) |
6 |
|
Bêta-agonistes à longue durée d’action (p. ex. salmétérol) |
36 |
|
Bêta-agonistes à très longue durée d’action (p. ex. indacatérol, vilantérol, olodatérol) |
48 |
|
Ipratropium (Atrovent 40 µg) |
12 |
|
Antimuscariniques à longue durée d’action |
≥ 168 |
|
Théophylline par voie orale |
12-48 |
Les cromones, les corticoïdes inhalés et les modificateurs des leucotriènes n’ont pas ou peu d’effet à dose unique. Il n’est pas nécessaire d’interrompre leur prise avant la réalisation du test, à moins que l’intention ne soit d’éviter un effet anti-inflammatoire ; la durée de cet effet après une utilisation régulière est incertaine, mais un temps d’interruption de 4 à 8 semaines est raisonnable.
Une consommation normale de caféine et de produits associés à la caféine (par exemple, chocolat) n’a aucun effet cliniquement significatif. Il convient d’éviter de fumer une heure avant le test.
4.6. Fertilité, grossesse et allaitement
Grossesse
Aucune étude sur la reproduction n’a été menée chez l’animal avec le chlorure de méthacholine. On ne sait pas si l’administration de chlorure de méthacholine à des patientes enceintes peut avoir des effets nocifs pour le fœtus.
Un apport en oxygène insuffisant pendant la grossesse peut être nocif pour l’enfant. CHLORURE DE METHACHOLINE PANPHARMA ne doit pas être utilisé pendant la grossesse.
On ne sait pas si le chlorure de méthacholine est excrété dans le lait maternel.
Fertilité
On ne sait pas si le chlorure de méthacholine a un effet sur la fertilité.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Les réactions indésirables sont classées par classes de systèmes d’organes et leur fréquence est définie comme suit : très fréquent (≥ 1/10) ; fréquent (≥ 1/100, < 1/10) ; peu fréquent (≥ 1/1 000, < 1/100) ; rare (≥ 1/10 000, < 1/1 000) ; très rare (< 1/10 000), fréquence indéterminée (ne peut être estimée sur la base des données disponibles). Des effets indésirables ont été associés à 153 tests de provocation au chlorure de méthacholine par voie inhalée.
Affections du système nerveux
Fréquence indéterminée : céphalées, étourdissements
Affections respiratoires, thoraciques et médiastinales
Fréquence indéterminée : gorge irritée
Fréquence indéterminée : bronchoconstriction
Fréquence indéterminée : bronchospasme, oppression thoracique, toux, respiration sifflante
Affections de la peau et du tissu sous-cutané
Fréquence indéterminée : démangeaisons
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/.
CHLORURE DE METHACHOLINE PANPHARMA est administré uniquement par inhalation. En cas d’administration par voie orale ou par injection, un surdosage de chlorure de méthacholine peut provoquer une syncope accompagnée d’un arrêt cardiaque et d’une perte de connaissance. Les intoxications graves doivent être traitées par une administration IM ou IV de sulfate d’atropine à une dose de 0,5 à 1 mg.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Classe pharmacothérapeutique : autres agents diagnostiques, code ATC : V04CX03.
Mécanisme d’action
Le chlorure de méthacholine est un homologue β-méthyle de l’acétylcholine et diffère de celle-ci principalement par sa longue durée et sa sélectivité d’action. Les muscles lisses des bronches présentent une innervation parasympathomimétique (cholinergique) importante.
La justification pharmacologique d’un test de provocation au chlorure de méthacholine repose sur le fait que les patients asthmatiques sont nettement plus sensibles à une bronchoconstriction induite que les patients non asthmatiques.
La bronchoconstriction se produit lorsque le nerf vague est stimulé et que l’acétylcholine est libérée par les terminaisons nerveuses. La constriction musculaire est essentiellement limitée au site de libération, puisque l’acétylcholine est rapidement convertie en acétylcholinestérase.
Dans le cas d’une limitation ventilatoire chronique avec un rapport VEMS/CV inférieur à 70 %, le test peut être anormal en raison d’autres causes pathophysiologiques telles qu’une bronchite tabagique, un emphysème ou une mucoviscidose.
Comparé à l’acétylcholine, le chlorure de méthacholine est hydrolysé plus lentement par l’acétylcholinestérase et est presque complètement résistant à l’inactivation par des cholinestérases ou par des pseudocholinestérases non spécifiques.
Le chlorure de méthacholine présente une forte affinité pour les récepteurs muscariniques qui jouent un rôle prépondérant dans la contraction des muscles lisses ; contrairement à l’acétylcholine, son affinité pour les récepteurs nicotiniques est faible. Par conséquent, le chlorure de méthacholine possède une sélectivité accrue pour la bronchoconstriction dans son action pharmacologique.
Efficacité et sécurité cliniques
Le test de provocation à la méthacholine a pour but de détecter l’hyperréactivité bronchique qui peut être associée à d’autres affections respiratoires ; il ne constitue pas un test diagnostique de l’asthme en lui-même. Toutefois, ce test est très utile pour exclure un diagnostic d’asthme. Chez 1 500 patients asthmatiques et 500 patients non-asthmatiques (atopiques et non-atopiques confondus), 90 % des patients asthmatiques présentaient une réponse positive moyenne ou très élevée au chlorure de méthacholine. Moins de 5 % des patients allergiques ou des sujets témoins non atopiques ont montré une réponse très positive. 27 % des patients allergiques ont eu une réponse négative contre 49 % des sujets témoins. Les patients allergiques et non-allergiques ont présenté une incidence similaire de réponses positives. 30 % des patients allergiques présentaient une réponse moyennement positive contre 18 % des patients non allergiques ayant des antécédents familiaux d’asthme et contre 8 % des sujets témoins sans antécédents familiaux. Des différences ont été observées chez les patients non allergiques sans antécédents familiaux d’asthme.
Parmi les patients asthmatiques, la sévérité de l’asthme déterminait la sensibilité au test de provocation à la méthacholine. La variation de la sensibilité allait de 100 à plusieurs milliers par rapport à celle des patients normaux. Cependant, chez les patients anciennement asthmatiques, le degré de bronchoconstriction était également lié à la sévérité des symptômes asthmatiques antérieurs. La sensibilité moyenne des patients anciennement asthmatiques était de l’ordre d’un dixième par rapport aux patients asthmatiques.
Dans les études démographiques, la prévalence de l’hyperréactivité au chlorure de méthacholine est comprise entre 8 et 15 %. Si le taux de sensibilité des patients asthmatiques est similaire à celui des patients non asthmatiques, en revanche, les patients asthmatiques répondent à des doses plus faibles en moyenne. Les patients asthmatiques moins sensibles souffrent généralement de maladies modérées et plus stables.
Une étude cherchant à établir si la synthèse des prostaglandines résulte en une tolérance à la méthacholine a révélé que l’atténuation de l’effet de la méthacholine dans le cadre de tests répétés n’est pas due exclusivement à la synthèse des prostaglandines et implique en partie d’autres mécanismes, comme les changements dans le dépôt des particules de méthacholine, les interactions agonistes-récepteurs ou les réponses post-récepteurs. En outre, les inhibiteurs des prostaglandines peuvent augmenter la réactivité initiale à la méthacholine chez les patients non asthmatiques en bonne santé.
Dans une étude visant à évaluer la méthacholine pour prédire la bronchoconstriction induite par l’effort et à établir un diagnostic clinique de l’asthme, une concentration maximale de méthacholine de 16 mg/mL a été utilisée et les participants à cette étude n’ont présenté aucune réaction indésirable grave.
Population pédiatrique
Une étude a évalué la sensibilité à la méthacholine chez 166 sujets jeunes (âge moyen 10 ans, plage de 5 à 22 ans) dont la spirométrie au repos était normale, mais qui présentaient des signes et des symptômes évocateurs d’une hyperréactivité des voies aériennes inférieures. Neuf concentrations de méthacholine (de 0,075 à 25 mg/mL) ont été utilisées. Le test de provocation a confirmé que la sévérité des symptômes d’asthme concordait avec la sensibilité à la méthacholine. Les enfants positifs étaient plus susceptibles de recevoir un traitement de l’asthme lors du suivi à 1 an.
5.2. Propriétés pharmacocinétiques
L’étendue de l’absorption systémique de la méthacholine après inhalation chez l’homme est inconnue en raison de l’absence de données pharmacocinétiques.
5.3. Données de sécurité préclinique
La toxicité aiguë et subaiguë du chlorure de méthacholine par inhalation chez le macaque crabier a été évaluée en exposant cet animal à une solution de méthacholine. Les études sur l’administration de chlorure de méthacholine par inhalation pendant 7 jours chez le macaque (0,02, 0,08 et 0,4 mg/kg) ont abouti à une bronchoconstriction dose-dépendante qui était attendue.
La réponse aiguë se caractérisait par des changements au niveau de la fonction respiratoire après 2 à 3 minutes d’exposition et une récupération complète était obtenue dans les 30 minutes suivant la fin de l’exposition.
La toxicité subaiguë liée à l’inhalation de méthacholine a été évaluée par le biais d’une exposition unique quotidienne des macaques à des doses graduelles de méthacholine pendant 7 jours. Aucun changement hématologique ou biochimique n’a pu être attribué à l’exposition à la méthacholine. De même, aucune modification histopathologique liée au traitement n’a été observée chez les animaux exposés. Des modifications des caractéristiques mécaniques des poumons des animaux exposés à la méthacholine pendant 7 jours ont été observées.
Il n’existe pas de données sur la génotoxicité. Aucune étude à long terme n’a été menée sur l’effet carcinogène du chlorure de méthacholine chez l’animal. En outre, aucune étude sur la toxicité pour la reproduction n’a été effectuée.
Flacons non reconstitués (poudre) : 3 ans.
Les solutions peuvent être conservées et utilisées dans les 28 jours suivant leur reconstitution seulement si elles sont réfrigérées (2°-8°C). Médicament à usage unique : une fois le médicament utilisé, toute solution restante doit être éliminée.
6.4. Précautions particulières de conservation
Flacons non reconstitués (poudre) :
Ce médicament ne nécessite pas de précautions particulières de conservation.
Flacons reconstitués :
Les solutions peuvent être conservées et utilisées dans les 28 jours suivant leur reconstitution seulement si elles sont réfrigérées (2°-8°C). Médicament à usage unique : une fois le médicament utilisé, toute solution restante doit être éliminée.
6.5. Nature et contenu de l'emballage extérieur
CHLORURE DE METHACHOLINE PANPHARMA est conditionné dans un flacon en verre ambré de type I, d’une contenance de 20 mL, fermé par un bouchon en caoutchouc bromobutyle et une capsule amovible. Le flacon contient 100 mg de chlorure de méthacholine et est conditionné en boîte de 6 flacons.
6.6. Précautions particulières d’élimination et de manipulation
CHLORURE DE METHACHOLINE PANPHARMA est un bronchoconstricteur puissant. Ne pas inhaler la poudre. Ne pas manipuler si vous avez de l’asthme ou le rhume des foins. Si nécessaire, un filtre de faible résistance doit être appliqué à un port expiratoire du dispositif de dosage afin d’éviter la libération d’aérosols de CHLORURE DE METHACHOLINE PANPHARMA dans l’air ambiant.
La solution reconstituée de CHLORURE DE METHACHOLINE PANPHARMA est limpide et inodore et ne contient pas de particules étrangères.Tout liquide non utilisé doit être éliminé de manière sécurisée. Les solutions peuvent être conservées et utilisées dans les 28 jours suivant leur reconstitution seulement si elles sont réfrigérées (2°-8°C). Médicament à usage unique : une fois le médicament utilisé, toute solution restante doit être éliminée.
Lors de l’utilisation de CHLORURE DE METHACHOLINE PANPHARMA, toute solution inutilisée doit être retirée du nébuliseur et éliminée après chaque concentration.
Après le test, les nébuliseurs réutilisables doivent être stérilisés en suivant les recommandations du fabricant. Les nébuliseurs jetables doivent être éliminés convenablement.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
Methapharm Ltd.
The Black Church
St Mary's Place
Dublin 7
D07 P4AX
Irlande
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 550 792 8 6 : Flacon (verre brun) ; boîte de 6.
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Liste I
Médicament réservé à l'usage hospitalier
ANSM - Mis à jour le : 16/05/2025
CHLORURE DE METHACHOLINE PANPHARMA 100 mg, poudre pour solution pour inhalation par nébuliseur
Chlorure de méthacholine
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin ou votre infirmier/ère.
· Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d’autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre infirmier/ère. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
1. Qu'est-ce que CHLORURE DE METHACHOLINE PANPHARMA 100 mg, poudre pour solution pour inhalation par nébuliseur et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant d'utiliser CHLORURE DE METHACHOLINE PANPHARMA 100 mg, poudre pour solution pour inhalation par nébuliseur ?
3. Comment utiliser CHLORURE DE METHACHOLINE PANPHARMA 100 mg, poudre pour solution pour inhalation par nébuliseur ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver CHLORURE DE METHACHOLINE PANPHARMA 100 mg, poudre pour solution pour inhalation par nébuliseur ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE CHLORURE DE METHACHOLINE PANPHARMA 100 mg, poudre pour solution pour inhalation par nébuliseur ET DANS QUELS CAS EST-IL UTILISE ?
Classe pharmacothérapeutique : autres agents diagnostiques - code ATC : V04CX03
Qu’est-ce que CHLORURE DE METHACHOLINE PANPHARMA ?
CHLORURE DE METHACHOLINE PANPHARMA contient un médicament appelé « chlorure de méthacholine ». Il agit sur les voies aériennes en provoquant leur resserrement, afin qu’elles deviennent plus étroites ou se contractent. Ce médicament est à usage diagnostique uniquement.
Dans quel cas CHLORURE DE METHACHOLINE PANPHARMA est-il utilisé ?
CHLORURE DE METHACHOLINE PANPHARMA est utilisé chez l’adulte et chez l’enfant (âgé de 5 ans ou plus). Il est administré dans le cadre d’un test de la fonction respiratoire appelé « test de provocation à la méthacholine ».
Votre médecin ou votre infirmier/ère réalisera ce test pour :
· établir si vous avez de l’asthme,
· vérifier le degré de sévérité de votre asthme,
· établir si vous souffrez « d’asthme professionnel ».
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D’UTILISER CHLORURE DE METHACHOLINE PANPHARMA 100 mg, poudre pour solution pour inhalation par nébuliseur ?
· si vous êtes allergique au chlorure de méthacholine ou à d’autres médicaments cholinergiques comme ceux utilisés pour traiter des affections telles que la myasthénie grave, le glaucome ou la rétention urinaire ;
· si vous êtes un enfant âgé de moins de 5 ans ;
· si vous avez de l’asthme ou des difficultés respiratoires ;
· si vous prenez des médicaments appartenant à la classe des « bêtabloquants » ;
· si vous avez déjà passé un « test de provocation à la méthacholine » avec CHLORURE DE METHACHOLINE PANPHARMA le même jour, car vous ne pouvez pas être soumis à plus d’un test par jour ;
· si vous avez un rythme cardiaque lent, appelé « bradycardie » ;
· si vous présentez un problème précis au niveau de l’aorte appelé « anévrisme aortique », l’aorte étant l’artère principale du corps humain ;
· si vous avez eu une crise cardiaque ou un accident vasculaire cérébral au cours des 3 derniers mois ;
· si vous avez une hypertension non stabilisée ;
· si vous souffrez d’une maladie appelée « myasthénie grave » et êtes traité(e) par des médicaments appartenant à la classe des « inhibiteurs de la cholinestérase » ;
· si vous avez récemment subi une intervention chirurgicale oculaire ou si vous êtes à risque de pression intracrânienne élevée ;
· si vous avez eu un caillot dans les poumons, appelé « embolie pulmonaire » ;
· si vous êtes enceinte ;
· si vous allaitez.
Ne prenez pas CHLORURE DE METHACHOLINE PANPHARMA si vous êtes dans l’un des cas décrits ci-dessus. En cas de doute, adressez-vous à votre médecin ou votre infirmier/ère avant d’utiliser CHLORURE DE METHACHOLINE PANPHARMA.
Avertissements et précautions
Adressez-vous à votre médecin ou votre infirmier/ère avant d’utiliser CHLORURE DE METHACHOLINE PANPHARMA 100 mg, poudre pour solution pour inhalation par nébuliseur :
· si vous êtes épileptique ;
· si vous avez un problème cardiovasculaire ;
· si vous avez un ulcère ;
· si vous avez une maladie de la thyroïde ;
· si vous présentez un blocage du flux urinaire (appelé « obstruction des voies urinaires ») ;
· si vous avez des problèmes causés par un nerf appelé « nerf vague ».
Si vous présentez l’un des problèmes ci-dessus (ou en cas de doute), adressez-vous à votre médecin ou votre infirmier/ère avant de prendre CHLORURE DE METHACHOLINE PANPHARMA.
Enfants et adolescents
La sécurité et l’efficacité de CHLORURE DE METHACHOLINE PANPHARMA chez les enfants âgés de moins de 5 ans n’ont pas été établies. Aucune donnée n’est disponible.
Autres médicaments et CHLORURE DE METHACHOLINE PANPHARMA 100 mg, poudre pour solution pour inhalation par nébuliseur
Informez votre médecin ou votre infirmier/ère si vous prenez, avez récemment pris ou pourriez prendre tout autre médicament. Cela inclut les médicaments obtenus sans ordonnance et les médicaments à base de plantes.
· En effet, certains médicaments peuvent rendre le test de la fonction respiratoire avec CHLORURE DE METHACHOLINE PANPHARMA moins sûr.
· Par ailleurs, certains médicaments peuvent affecter les résultats du test de la fonction respiratoire avec CHLORURE DE METHACHOLINE PANPHARMA.
Demandez à votre médecin si vous devez arrêter de prendre ces médicaments avant de passer le test. Votre médecin ou votre infirmier/ère vous indiquera pendant combien de temps vous devrez arrêter de prendre ces médicaments.
En particulier, n’utilisez pas ce médicament si vous prenez un ou plusieurs des médicaments suivants, et parlez-en à votre médecin ou votre infirmier/ère :
· bêtabloquants pour diminuer votre tension artérielle
· inhibiteurs de la cholinestérase pour traiter une maladie appelée « myasthénie grave »
Si vous êtes dans l’un des cas présentés ci-dessus, ou en cas de doute, adressez-vous à votre médecin ou votre infirmier/ère avant de prendre CHLORURE DE METHACHOLINE PANPHARMA.
Si vous êtes enceinte ou que vous allaitez, si vous pensez être enceinte ou planifiez une grossesse, demandez conseil à votre médecin ou votre infirmier/ère avant de prendre ce médicament.
N’utilisez pas CHLORURE DE METHACHOLINE PANPHARMA si vous êtes enceinte ou si vous pensez être enceinte. Ce médicament pourrait être nocif pour votre enfant à naître.
N’utilisez pas CHLORURE DE METHACHOLINE PANPHARMA si vous allaitez. On ne sait pas si ce médicament passe dans le lait maternel.
Conduite de véhicules et utilisation de machines
CHLORURE DE METHACHOLINE PANPHARMA n’a aucun effet sur l’aptitude à conduire des véhicules et à utiliser des machines.
CHLORURE DE METHACHOLINE PANPHARMA 100 mg, poudre pour solution pour inhalation par nébuliseur contient : sans objet.
3. COMMENT UTILISER CHLORURE DE METHACHOLINE PANPHARMA 100 mg, poudre pour solution pour inhalation par nébuliseur ?
A propos du test de provocation à la méthacholine
CHLORURE DE METHACHOLINE PANPHARMA est administré par un médecin ou un(e) infirmier/ère dans le cadre d’un test de la fonction respiratoire appelé « test de provocation à la méthacholine ».
· Vous inhalez le médicament : votre médecin ou votre infirmier/ère vous indiquera comment procéder avant le début du test.
· Vous devriez normalement recevoir plusieurs doses pendant le test. Vous commencez par une faible dose qui est ensuite progressivement augmentée. Les doses sont administrées dans l’ordre suivant :
o 0,0312 mg/mL ![]() 0,0625 mg/mL
0,0625 mg/mL ![]() 0,125 mg/mL
0,125 mg/mL ![]() 0,25 mg/mL
0,25 mg/mL ![]() 0,5 mg/mL
0,5 mg/mL ![]() 1 mg/mL
1 mg/mL ![]() 2 mg/mL
2 mg/mL ![]() 4 mg/mL
4 mg/mL ![]() 8 mg/mL
8 mg/mL ![]() 16 mg/mL.
16 mg/mL.
o Le test sera arrêté à la dose à laquelle votre fonction pulmonaire (la manière dont vos poumons fonctionnent) atteint le niveau cible (niveau auquel vous montrez une réponse de bronchoconstriction ou concentration maximale du test).
Quand le test sera-t-il arrêté ?
Le test sera arrêté si :
· votre fonction pulmonaire atteint le niveau déterminé par le professionnel de santé.
· vous avez atteint la dose la plus élevée de CHLORURE DE METHACHOLINE PANPHARMA.
· votre médecin ou votre infirmier/ère décide que vous n’êtes pas en mesure de poursuivre le test en raison d’effets indésirables.
À la fin du test, un médicament appelé « agent désactivateur » vous sera peut-être administré. Cet agent désactivateur provoquera l’expansion et la dilatation de vos voies aériennes afin d’annuler l’effet constricteur de CHLORURE DE METHACHOLINE PANPHARMA. Votre médecin ou infirmier/ère mesurera le fonctionnement de vos poumons pour s’assurer que votre respiration est redevenue normale avant que vous ne rentriez chez vous.
Si vous avez d’autres questions sur l’utilisation de ce médicament, demandez plus d’informations à votre médecin ou à votre infirmier/ère.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
La prise de ce médicament peut entraîner les effets indésirables suivants. Leur fréquence est indéterminée, car elle ne peut pas être estimée sur la base des données disponibles.
· Maux de tête, étourdissements
· Gorge irritée
· Bronchospasme, oppression thoracique, toux, respiration sifflante
· Bronchoconstriction
· Démangeaisons
Si vous ressentez un ou plusieurs des effets indésirables mentionnés ci-dessus pendant ou après le test, parlez-en à votre médecin ou votre infirmier/ère. Si l’un des effets secondaires s’aggrave, informez-en immédiatement votre médecin ou votre infirmier/ère.
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou à votre infirmier/ère. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER CHLORURE DE METHACHOLINE PANPHARMA 100 mg, poudre pour solution pour inhalation par nébuliseur ?
Tenir ce médicament hors de la vue et de la portée des enfants.
N’utilisez pas ce médicament après la date de péremption indiquée sur l’étiquette du flacon ou l’emballage après « EXP ». La date de péremption fait référence au dernier jour de ce mois.
Le médicament non reconstitué ne nécessite pas de précautions particulières de conservation.
Les solutions peuvent être conservées et utilisées dans les 28 jours suivant leur reconstitution seulement si elles sont réfrigérées (2°-8°C). Médicament à usage unique : une fois le médicament utilisé, toute solution restante doit être éliminée.
Tout liquide non utilisé doit être éliminé de manière sécurisée.
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
Remarque : CHLORURE DE METHACHOLINE PANPHARMA est un médicament à usage diagnostique. Il ne doit jamais sortir du service clinique spécialiste de l’asthme ou du laboratoire de tests de la fonction pulmonaire.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
· La substance active est :
Chlorure de méthacholine............................................................................................... 100 mg
Pour un flacon de 20 mL.
· Les autres composants sont : CHLORURE DE METHACHOLINE PANPHARMA ne contient pas d’autres composants.
CHLORURE DE METHACHOLINE PANPHARMA est une poudre de couleur blanche ou blanchâtre pour solution pour inhalation par nébuliseur.
CHLORURE DE METHACHOLINE PANPHARMA est conditionné dans un flacon en verre ambré. Chaque boîte contient 6 flacons.
Titulaire de l’autorisation de mise sur le marché
The Black Church
St Mary's Place
Dublin 7
D07 P4AX
Irlande
Exploitant de l’autorisation de mise sur le marché
PANPHARMA
ZI DU CLAIRAY
35133 LUITRE
LEONTIOU, 163
CLERIMOS BUILDING, 2nd FLOOR
3022 LIMASSOL
CHYPRE
TRAMCO SP.Z.O.O.
WOLSKIE, UL. WOLSKA 14,
PLOCHOCIN, MAZOWIEKIE, 05-860
POLOGNE
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Ce médicament est autorisé dans les Etats membres de l'Espace Economique Européen sous les noms suivants : Conformément à la réglementation en vigueur.
[À compléter ultérieurement par le titulaire]
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
Aout 2024
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).
Les informations suivantes sont destinées exclusivement aux professionnels de la santé :
CHLORURE DE METHACHOLINE PANPHARMA est fourni sous forme de poudre et doit être reconstitué et dilué avant utilisation. CHLORURE DE METHACHOLINE PANPHARMA est administré uniquement sous forme de solution pour inhalation par nébuliseur.
Ne pas inhaler la poudre. Vous ne devez pas manipuler ce produit si vous souffrez d’asthme ou d’allergies. Toutes les dilutions doivent être réalisées avec une solution injectable de chlorure de sodium à 0,9 % en utilisant des flacons en verre borosilicate de type I, vides et stériles. Après l’ajout de la solution de chlorure de sodium, agitez chaque flacon jusqu’à ce que vous obteniez une solution claire. Si nécessaire, un filtre de faible résistance doit être appliqué à un port expiratoire du dispositif de dosage afin d’éviter la libération d’aérosols de CHLORURE DE METHACHOLINE PANPHARMA dans l’air ambiant.
Avant de démarrer un test de provocation avec CHLORURE DE METHACHOLINE PANPHARMA, des tests de la fonction pulmonaire de référence doivent être réalisés avec le diluant recommandé. Pour qu’un(e) patient(e) puisse passer le test, il/elle doit présenter un VEMS (volume expiratoire maximal par seconde) supérieur ou égal à 60 % de la valeur prévue (chez l’adulte et chez l’enfant) et supérieur ou égal à 1,5 L (chez l’adulte) après exposition à un diluant nébulisé, ce qui pourra être considéré comme une spirométrie de référence normale. Le test de provocation à la méthacholine est considéré comme positif si la réduction du VEMS est supérieure ou égale à 20 % par rapport au VEMS avec le diluant recommandé. Le test doit être arrêté à ce stade.
La valeur de la réduction doit être calculée et enregistrée avant de démarrer le test avec CHLORURE DE METHACHOLINE PANPHARMA.
Ce médicament ne nécessite pas de précautions particulières de conservation. Les solutions peuvent être conservées et utilisées dans les 28 jours suivant leur reconstitution seulement si elles sont réfrigérées (2°-8°C). Médicament à usage unique : une fois le médicament utilisé, toute solution restante doit être éliminée.
. Tout liquide restant doit être éliminé.
D’un point de vue microbiologique, la solution doit être utilisée immédiatement, sauf si la méthode d’ouverture/de reconstitution/de dilution exclut tout risque de contamination microbienne.