Dernière mise à jour le 01/12/2025
SUMATRIPTAN SUN 6 mg/0,5 ml, solution injectable en seringue préremplie (voie SC)
Indications thérapeutiques
Classe pharmacothérapeutique : Analgésique; Antimigraineux; Agonistes sélectifs des récepteurs 5-HT1, Code ATC: N02CC01.
La substance active contenue dans SUMATRIPTAN SUN est le sumatriptan. Il appartient à un groupe de médicaments appelés agonistes des récepteurs 5-HT1.
Le sumatriptan est indiqué dans le traitement de la crise de migraine et de la crise d’algie vasculaire de la face. Les symptômes de la migraine peuvent être dus à une dilatation temporaire des vaisseaux sanguins crâniens. Le sumatriptan agit en réduisant la taille de ces vaisseaux sanguins.
Présentations
> 2 seringue(s) préremplie(s) en verre de 0,5 ml avec injecteur(s) automatique(s)
Code CIP : 492 690-6 ou 34009 492 690 6 8
Déclaration de commercialisation : 23/09/2013
Cette présentation est agréée aux collectivités
- Prix hors honoraire de dispensation : 31,19 €
- Honoraire de dispensation : 1,02 €
- Prix honoraire compris : 32,21 €
- Taux de remboursement :65%
Service médical rendu (SMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprès de la HAS (plus d'informations dans l'aide). Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Important | Avis du 06/07/2011 | Inscription (CT) | Le service médical rendu par cette spécialité est important dans la crise d'algie vasculaire de la face. |
Amélioration du service médical rendu (ASMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprés de la HAS (plus d'informations dans l'aide). Les avis et synthéses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur de l'ASMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| V (Inexistant) | Avis du 06/07/2011 | Inscription (CT) | Cette spécialité n'apporte pas d'amélioration du service médical rendu (ASMR V) par rapport à IMIJECT dans le traitement de la crise d'algie vasculaire de la face. |
ANSM - Mis à jour le : 15/10/2025
SUMATRIPTAN SUN 6 mg/0,5 ml, solution injectable en seringue préremplie (voie SC)
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Sumatriptan............................................................................................................................. 6 mg
Sous forme de succinate de sumatriptan.
Pour une seringue préremplie de 0,5 ml.
Excipient à effet notoire: sodium 1,3 mg.
Pour la liste complète des excipients, voir rubrique 6.1.
La solution est claire, incolore à jaune pâle.
Le pH est compris entre 3,0 et 4,0. L’osmolarité est comprise entre 260 à 340 mosmol/l.
4.1. Indications thérapeutiques
SUMATRIPTAN SUN doit être utilisé uniquement quand le diagnostic de migraine ou d'algie vasculaire de la face est bien établi.
4.2. Posologie et mode d'administration
SUMATRIPTAN SUN ne doit pas être utilisé en prophylaxie.
L'efficacité du sumatriptan est indépendante de la durée de la crise lors de l'initiation du traitement. L'administration durant l'aura migraineuse, avant la survenue de tous les autres symptômes, peut ne pas prévenir le développement de la céphalée.
Posologie
Adultes
Crise de migraine et crise d'algie vasculaire de la face:
Il est conseillé de prendre le traitement dès les premiers signes de crise de migraine ou d'algie vasculaire de la face, ou dès l’apparition des symptômes associés tels que les nausées, les vomissements ou la photophobie. Le traitement est aussi efficace quel que soit le stade de la crise auquel il est administré.
Crise de migraine:
La posologie recommandée de SUMATRIPTAN SUN chez l’adulte est une seule injection sous-cutanée de 6 mg.
Les patients qui ne sont pas soulagés après la première injection ne doivent pas prendre une deuxième dose au cours de la même crise. . Le sumatriptan pourra être utilisé pour les crises suivantes. Si le patient a été soulagé après la première dose mais que les symptômes réapparaissent, une seconde injection peut être utilisée dans les 24 heures suivantes à condition de respecter un intervalle d'au moins 1 heure entre les 2 injections.
La posologie maximale par 24 heures est de 2 injections de 6 mg (soit 12 mg).
Il est recommandé d'utiliser SUMATRIPTAN SUN en monothérapie dans le traitement de la crise de migraine et de ne pas le donner de façon concomitante avec de l'ergotamine ou des dérivés de l'ergotamine (y compris le méthysergide) (voir rubrique 4.3).
Si un patient n’a pas été soulagé par une dose de SUMATRIPTAN SUN, il n’y a aucune raison, que ce soit pour des raisons théoriques ou de l’expérience clinique limitée, de ne pas utiliser des médicaments à base d’aspirine, d’anti-inflammatoires non-stéroïdiens ou de paracétamol pour le traitement ultérieur de cette crise.
Crise d'algie vasculaire de la face:
La posologie recommandée est de 1 injection sous-cutanée de 6 mg par crise. La posologie maximale par 24 heures est de 2 injections de 6 mg (soit 12 mg) avec un intervalle d'au-moins 1 heure entre les 2 injections.
Population pédiatrique (de moins de 18 ans)
L’utilisation du sumatriptan n’est pas recommandée chez les enfants et les adolescents compte-tenu de l’absence de données d’utilisation sumatriptan injectable dans ces catégories d’âges.
Patient âgé (de plus de 65 ans)
L’expérience de l’utilisation de SUMATRIPTAN SUN chez les patients âgés de plus de 65 ans est limitée. La pharmacocinétique n’est pas significativement différente de celle d’une population plus jeune. Cependant, tant que des données cliniques complémentaires ne seront pas disponibles, l'utilisation du sumatriptan chez les patients âgés de plus de 65 ans n'est pas recommandée.>
Mode d’administration
SUMATRIPTAN SUN doit être administré par voie sous-cutanée à l’aide d’une seringue préremplie avec injecteur automatique. Après avoir retiré le capuchon protecteur de l’aiguille, la partie ouverte de l’injecteur automatique doit être placée sur le site d’injection, à la verticale avec un angle droit (90°). En pressant et en relâchant immédiatement le bouton bleu un premier clic est entendu, indiquant que l’injection a commencé. L’injecteur automatique doit être maintenu appuyé sur la peau jusqu’à ce qu’un second clic soit entendu. Ceci indique que l’injection est terminée. L’injecteur automatique peut alors être retiré de la peau. La gaine blanche protectrice de l’aiguille de l’injecteur automatique se déploiera automatiquement pour recouvrir l'aiguille. La fenêtre d’inspection sera bleue confirmant que l’injection est terminée. Les patients doivent être avertis qu’il faut strictement respecter la notice d’utilisation de SUMATRIPTAN SUN et notamment la partie concernant l’utilisation de l’injecteur automatique.
Hypersensibilité à la substance active ou à l’un des excipients mentionnés à la rubrique 6.1.
Le sumatriptan ne doit pas être utilisé chez les patients ayant des antécédents d'infarctus du myocarde ou une pathologie cardiaque ischémique, un vasospasme coronarien (Angor de Prinzmetal), une pathologie vasculaire périphérique ou chez les patients présentant des symptômes ou des signes compatibles avec une pathologie cardiaque ischémique.
Le sumatriptan ne doit pas être administré aux patients présentant des antécédents d'accident vasculaire cérébral (AVC) ou d'accident ischémique transitoire (AIT).
Le sumatriptan ne doit pas être administré aux patients ayant une insuffisance hépatique sévère.
L'utilisation du sumatriptan est contre-indiquée chez les patients ayant une hypertension modérée ou sévère et chez les patients ayant une hypertension légère non contrôlée.
L’administration concomitante avec l'ergotamine ou les dérivés de l'ergotamine (y compris le méthysergide), un autre triptan/agoniste des récepteurs de la 5-hydroxytriptamine1 (5-HT1) est contre-indiquée (voir rubrique 4.5).
L'association du sumatriptan avec les inhibiteurs de la monoamine-oxydase est contre-indiquée. Le sumatriptan ne doit pas être utilisé dans les 2 semaines suivant l'arrêt d'un traitement par les inhibiteurs de la monoamine-oxydase (voir rubrique 4.5).
4.4. Mises en garde spéciales et précautions d'emploi
Sumatriptan SUN ne doit être utilisé qu’après avoir clairement établi le diagnostic de migraine ou d’algie vasculaire de la face.
SUMATRIPTAN SUN n'est pas indiqué dans le traitement des migraines hémiplégiques, basilaires ou ophtalmoplégiques.
Les doses recommandées de sumatriptan ne doivent pas être dépassées.
Ce médicament contient moins de 1 mmol de sodium (23 mg) par dose, c'est à dire pratiquement «sans sodium».
SUMATRIPTAN SUN ne doit pas être administré par voie intraveineuse en raison de risque de spasme coronaire. Le spasme coronaire peut se traduire par des arythmies, des modifications de l’ECG de type ischémique ou un infarctus du myocarde.
Avant de traiter les céphalées des patients sans diagnostic antérieur de migraine, et des patients migraineux présentant des symptômes atypiques, il est nécessaire d'exclure d'autres pathologies neurologiques potentiellement graves. Il faut noter que les migraineux peuvent présenter un risque accru de survenue d’événements vasculaires cérébraux (par exemple, accidents cérébro-vasculaires, accident ischémique transitoire)
Après administration, la prise de sumatriptan peut être associée à des symptômes transitoires comprenant des douleurs thoraciques ou une sensation d'oppression pouvant être intense et pouvant s'étendre au niveau de la gorge. Si la symptomatologie évoque une ischémie cardiaque, des doses supplémentaires de sumatriptan ne doivent pas être administrées et des explorations appropriées devront être réalisées.
Le sumatriptan ne doit pas être administré aux patients ayant des facteurs de risque de maladie cardiaque ischémique, y compris les gros fumeurs ou les patients utilisant des thérapies de substitution à base de nicotine, sans un bilan cardiovasculaire préalable (voir rubrique 4.3). Une attention particulière doit être portée aux femmes ménopausées et aux hommes de plus de 40 ans présentant ces facteurs de risque. Cependant, ce bilan peut ne pas identifier tous les patients qui ont une maladie cardiovasculaire et, dans de très rares cas, des événements cardiaques graves sont survenus chez des patients sans maladie cardiovasculaire sous-jacente (voir section 4.8).
Si le patient présente des symptômes qui sont graves ou persistants ou compatibles avec l'angine de poitrine, des doses supplémentaires ne doivent pas être prises jusqu'à ce que des examens appropriés aient été effectués pour vérifier la possibilité de changements ischémiques.
Le sumatriptan doit être administré avec prudence chez les patients présentant une hypertension légère contrôlée, en raison de l’augmentation transitoire de la pression artérielle et des résistances vasculaires périphériques observée chez une petite proportion de patients (rubrique section 4.3).
Après commercialisation, de rares cas de syndrome sérotoninergique (incluant une modification de de la conscience, des manifestations neurovégétatives et des troubles neuromusculaires) ont été décrits après utilisation concomitante d'un inhibiteur sélectif de la recapture de la sérotonine (ISRS) et du sumatriptan. Des cas de syndrome sérotoninergique ont également été rapportés après administration concomitante de triptans et d'inhibiteurs de la recapture de la sérotonine et de la noradrénaline (IRSN). Si l'association du sumatriptan et d'un ISRS/IRSN est cliniquement justifiée, une surveillance appropriée du patient est recommandée (voir rubrique 4.5).
Le sumatriptan doit être administré avec précaution chez les patients présentant des facteurs pouvant modifier l'absorption, le métabolisme ou l'élimination du médicament, par exemple chez l'insuffisant hépatique ou rénal.
Le sumatriptan doit être utilisé avec précaution chez les patients ayant des antécédents de convulsions ou présentant d'autres facteurs de risque susceptibles d'abaisser le seuil épileptogène, car des cas de convulsions ont été rapportés en association avec le sumatriptan (voir rubrique 4.8).
Chez les patients ayant une hypersensibilité connue aux sulfamides, des réactions allergiques peuvent être observées après administration de sumatriptan. Ces réactions vont de l'allergie cutanée aux réactions anaphylactiques.
La démonstration d'une allergie croisée est limitée, cependant la prudence est recommandée avant d'utiliser le sumatriptan chez ces patients.
La fréquence des effets indésirables peut être augmentée par l'association de triptans à des préparations contenant du millepertuis (Hypericum perforatum).
L'utilisation prolongée d'un traitement antalgique pour traiter les céphalées peut entraîner une aggravation de celles-ci. Dans ces cas ou en cas de suspicion, un avis médical est nécessaire et le traitement doit être interrompu. Le diagnostic de céphalée par abus médicamenteux (CAM) doit être suspecté chez les patients présentant des céphalées fréquentes ou quotidiennes malgré (ou à cause) de l’utilisation régulière d’un traitement antimigraineux.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Les données concernant l'interaction du sumatriptan avec les médicaments contenant de l'ergotamine sont limitées. Le risque accru de vasospasme coronarien est théoriquement possible. L'administration concomitante de ces deux produits est donc contre-indiquée (voir section 4.3).
L'intervalle nécessaire entre l'utilisation du sumatriptan et des médicaments contenant de l'ergotamine ou un autre triptan/agoniste des récepteurs 5-HT1 n'est pas connu. Il dépendra aussi des doses et du type de produits utilisés. Les effets peuvent être additifs. Il est conseillé d'attendre au moins 24 heures après l'utilisation de médicaments contenant de l'ergotamine ou un autre triptan/agoniste des récepteurs 5-HT1, avant l'administration du sumatriptan. Inversement, il est conseillé d'attendre au moins 6 heures après l'utilisation du sumatriptan avant l'administration d'un médicament contenant de l'ergotamine et au moins 24 heures avant l'administration d’un autre triptan/agoniste des récepteurs 5-HT1.
Une interaction peut se produire entre le sumatriptan et les IMAO. L'administration concomitante de ces deux produits est donc contre-indiquée (voir rubrique 4.3).
Après commercialisation, de rares cas de syndrome sérotoninergique (incluant une modification de la conscience, des manifestations neurovégétatives et des troubles neuromusculaires) ont été décrits après utilisation concomitante d'un inhibiteur sélectif de la recapture de la sérotonine (ISRS) et du sumatriptan. Des cas de syndrome sérotoninergique ont également été rapportés après administration concomitante de triptans et d’IRSN (voir section 4.4). Il existe aussi un risque de syndrome sérotoninergique en cas d’utilisation concomitante du lithium et du sumatriptan.
4.6. Fertilité, grossesse et allaitement
Grossesse
Des données d'après commercialisation, provenant de l'utilisation du sumatriptan au cours du premier trimestre de la grossesse chez plus de 1 000 femmes, sont disponibles. Bien que ces données soient insuffisantes pour tirer des conclusions définitives, elles ne montrent pas une augmentation du risque tératogène. L'expérience de l'utilisation du sumatriptan au cours des deuxième et troisième trimestres de la grossesse est limitée.
Les études chez l'animal n'indiquent pas d'effets tératogènes directs ou des effets nuisibles sur le développement péri et postnatal. Toutefois, la viabilité embryofœtale peut être altérée chez le lapin (voir rubrique 5.3).
En conséquence, l'administration de sumatriptan ne doit être envisagée que si le bénéfice attendu pour la mère est supérieur aux risques possibles pour le fœtus.
Allaitement
Le sumatriptan est excrété dans le lait maternel, avec des doses relatives moyennes pour le nourrisson de < 4 % après administration d'une dose unique de sumatriptan. L'exposition du nourrisson peut être minimisée en évitant l'alimentation au lait maternel dans les 12 heures suivant le traitement, période pendant laquelle le lait maternel exprimé doit être jeté.
Des cas de douleur mammaire et/ou du mamelon ont été rapportés après l’utilisation du sumatriptan chez des femmes qui allaitent (voir rubrique 4.8). La douleur était généralement transitoire et disparaissait en 3 à 12 heures.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Les effets indésirables sont classés ci-dessous par système-organe et par fréquence.
La classification selon la fréquence utilise la convention suivante: très fréquent (≥ 1/10), fréquent (≥ 1/100 et < 1/10), peu fréquent (≥ 1/1 000 et< 1/100), rare (≥ 1/10 000 et < 1/1 000) et très rare (< 1/10 000), incluant les cas isolés, inconnu (ne pouvant pas être estimé sur la base des données disponibles). Certains symptômes rapportés comme effets indésirables peuvent être considérés comme des symptômes associés à la migraine.
Affections du système immunitaire
Inconnu : réactions d'hypersensibilité allant d'une allergie cutanée à une réaction anaphylactique.
Affections psychiatriques
Inconnu : anxiété.
Affections du système nerveux
Fréquent : vertiges, somnolence, troubles de la sensibilité dont paresthésie et hypoesthésie.
Inconnu : convulsions, bien que certaines de ces convulsions soient survenues chez des patients présentant soit des antécédents de convulsions soit des facteurs de risque. Quelques cas ont été rapportés chez des patients en l'absence de tels facteurs de risque. Tremblements, dystonie, nystagmus, scotome.
Affections oculaires
Inconnu : papillotements, diplopie, baisse de la vision. Perte de la vision, dont certains cas peuvent être permanents. Toutefois, des troubles visuels peuvent également survenir au cours de la crise de migraine.
Affections cardiaques
Inconnu : bradycardie, tachycardie, palpitations, arythmies cardiaques, signes ischémiques transitoires à l'ECG, vasospasme des artères coronaires, angor, infarctus du myocarde (voir rubriques 4.3 et 4.4).
Affections vasculaires
Fréquent : augmentations transitoires de la pression artérielle survenant juste après le traitement, flush.
Inconnu : hypotension, syndrome de Raynaud.
Affections respiratoires, thoraciques et médiastinales
Fréquent : dyspnée
Affections gastro-intestinales
Fréquent : des nausées et vomissements sont survenus chez certains patients, sans que l'on puisse déterminer si ces symptômes sont liés au SUMATRIPTAN SUN ou à la pathologie sous-jacente.
Inconnu : colites ischémiques, diarrhées, dysphagie.
Affections de la peau et du tissu sous-cutané
Inconnu : hyperhidrose.
Affections musculo-squelettiques et systémiques
Fréquent : sensation de lourdeur (habituellement transitoire, mais pouvant être intense et intéresser n'importe quelle partie du corps, y compris la poitrine et la gorge). Myalgies.
Inconnu : raideur de la nuque, arthralgies.
Troubles du système reproducteur et des seins
Rare : Douleurs mammaires
Troubles généraux et anomalies au site d'administration
Très fréquents : douleur transitoire au site d’injection. piqûre/brûlure, gonflement, érythème, hématome et saignements au site d’injection, ont aussi été rapportés.
Fréquent: douleur, sensation de chaleur ou de froid, de pression ou d'oppression (ces effets sont habituellement transitoires, mais ils peuvent être intenses et intéresser n'importe quelle partie du corps, y compris la poitrine et la gorge). Sensation de faiblesse, fatigue (ces deux effets sont le plus souvent d'intensité faible à modérée et transitoires).
Inconnu : douleur traumatique provoquée, douleur inflammatoire provoquée.
Bien qu'il n'y ait eu aucune comparaison directe, les bouffées de chaleurs, paresthésies et sensations de chaleur, de pression et de lourdeur peuvent être plus fréquentes après injection de sumatriptan.
Inversement, les nausées, vomissements et la fatigue apparaissent moins fréquemment lors de l’administration sous-cutanée en comparaison avec les comprimés.
Investigations
Inversement, les nausées, vomissements et la fatigue apparaissent moins fréquemment lors de l’administration sous-cutanée en comparaison avec les comprimés
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet https://signalement.social-sante.gouv.fr/.
Des cas de surdosage avec le sumatriptan injectable ont été rapportés.
Des patients ont reçu des injections uniques allant jusqu'à 12 mg par voie sous-cutanées sans entraîner d'effets indésirables significatifs. Des doses allant jusqu'à 16 mg par voie sous-cutanée n'ont pas entraîné d'effets indésirables autres que ceux mentionnés.
En cas de surdosage avec SUMATRIPTAN SUN, le patient doit être mis sous surveillance pendant au moins 10 heures et un traitement symptomatique standard doit être administré, si nécessaire. L'effet de l'hémodialyse ou de la dialyse péritonéale sur les concentrations plasmatiques de sumatriptan n'est pas connu.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Le sumatriptan est un agoniste sélectif des récepteurs vasculaires à la 5-hydroxy-tryptamine-1 (5HT1d) sans effet sur les autres sous-types de récepteurs 5HT (5HT2 à 5HT7). Les récepteurs vasculaires 5HT1d sont localisés principalement au niveau des vaisseaux sanguins crâniens et induisent une vasoconstriction. Chez l'animal, le sumatriptan est responsable d'une vasoconstriction sélective de la circulation artérielle carotidienne. La circulation artérielle carotidienne vascularise les tissus extracrâniens et intracrâniens tels que les méninges et on pense que la dilatation et/ou la formation d'œdèmes au niveau de ces vaisseaux pourraient correspondre au mécanisme de la migraine chez l'homme. De plus, les résultats des études chez l'animal indiquent que le sumatriptan inhibe l'activité du nerf trijumeau. Ces deux actions (vasoconstriction crânienne et inhibition de l'activité du nerf trijumeau) pourraient contribuer à l'action anti-migraineuse du sumatriptan chez l'homme.
Le sumatriptan est également efficace dans le traitement de la crise de migraine périmenstruelle, c'est-à-dire la migraine sans aura qui survient entre 3 jours avant et jusqu’à 5 jours après le début des menstruations. SUMATRIPTAN SUN doit être administré le plus tôt possible lors d’une crise.
La réponse clinique débute 10 à 15 minutes après injection sous-cutanée.
En raison de sa voie d’administration, SUMATRIPTAN SUN peut être particulièrement adapté aux patients souffrant de nausées et vomissements au cours d’une crise.
5.2. Propriétés pharmacocinétiques
La liaison aux protéines plasmatiques est faible (14-21 %), le volume de distribution total moyen est de 170 litres. La clairance plasmatique moyenne est d'environ 1160 ml/min et la clairance plasmatique rénale moyenne est d'environ 260 ml/min. La clairance non rénale représente environ 80 % de la clairance totale. Le sumatriptan est éliminé tout d'abord par métabolisme oxydatif dû à la monoamine oxydase A. Le principal métabolite, l'analogue acide indolacétique du sumatriptan, est principalement excrété dans les urines, où il est retrouvé sous forme d'acide libre ou de glucuroconjugué. Il n'a pas d'activité 5HT1 ou 5HT2 connue. Les métabolites mineurs n'ont pas été identifiés.
Dans une étude pilote, aucune différence significative n'a été observée dans les paramètres pharmacocinétiques entre les personnes âgées et les jeunes volontaires sains.
5.3. Données de sécurité préclinique
Lors d'une étude de fertilité chez le rat, des doses orales de sumatriptan entraînant des concentrations plasmatiques d'environ 150 fois supérieures à celles observées chez l'homme après une dose de 6mg par voie sous-cutanée ont été associées à une réduction du succès de l'insémination.
Cet effet n'est pas survenu au cours d'une étude en administration par voie sous-cutanée où les concentrations plasmatiques maximales obtenues étaient d’environ 100 fois supérieures à celles chez l'homme après administration par voie sous-cutanée.
Chez le lapin, une embryolétalité sans anomalies tératogènes marquées a été observée. La pertinence de ces résultats chez l'homme n'est pas connue.
Chlorure de sodium, eau pour préparations injectables.
3 ans.
6.4. Précautions particulières de conservation
Ce médicament ne nécessite pas de précautions particulières de conservation.
6.5. Nature et contenu de l'emballage extérieur
0,5 ml en seringue préremplie (verre incolore de type I) avec aiguille 27 gauge de 1/2 pouce de longueur et butée de piston noire en chlorobutyle, incluse dans un injecteur automatique, emballé dans un blister en PVC (polychlorure de vinyle) recouvert d’un film pelable en PET (polyéthyléne téréphtalate).
Boîte de 1 seringue préremplie avec injecteur automatique.
Boîte de 2 seringues préremplies avec injecteurs automatiques.
Boîte de 6 seringues préremplies avec injecteurs automatiques.
Boîte de 12 seringues préremplies avec injecteurs automatiques.
Toutes les présentations peuvent ne pas être commercialisées.
6.6. Précautions particulières d’élimination et de manipulation
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
SUN PHARMACEUTICAL INDUSTRIES EUROPE B.V.
POLARISAVENUE 87
2132 JH HOOFDDORP
PAYS-BAS
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 492 689 8 6: 0,5 ml en seringue préremplie (verre) avec injecteur automatique, boîte de 1.
· 34009 492 690 6 8: 0,5 ml en seringue préremplie (verre) avec injecteur automatique, boîte de 2.
· 34009 301 368 0 5: 0,5 ml en seringue préremplie (verre) avec injecteur automatique, boîte de 6.
· 34009 550 789 9 9 : 0,5 ml en seringue préremplie (verre) avec injecteur automatique, boîte de 12.
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Liste I.
ANSM - Mis à jour le : 15/10/2025
SUMATRIPTAN SUN 6 mg/0,5 ml, solution injectable en seringue préremplie (voie SC)
Succinate de sumatriptan
Veuillez lire attentivement cette notice avant d’utiliser ce médicament car elle contient des informations importantes pour vous.
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin ou votre pharmacien.
· Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d’autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
1. Qu'est-ce que SUMATRIPTAN SUN 6 mg/0,5 ml, solution injectable en seringue préremplie (voie SC) et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant d’utiliser SUMATRIPTAN SUN 6 mg/0,5 ml, solution injectable en seringue préremplie (voie SC) ?
3. Comment utiliser SUMATRIPTAN SUN 6 mg/0,5 ml, solution injectable en seringue préremplie (voie SC) ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver SUMATRIPTAN SUN 6 mg/0,5 ml, solution injectable en seringue préremplie (voie SC) ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE SUMATRIPTAN SUN 6 mg/0,5 ml, solution injectable en seringue préremplie (voie SC) ET DANS QUELS CAS EST-IL UTILISE ?
Classe pharmacothérapeutique : Analgésique; Antimigraineux; Agonistes sélectifs des récepteurs 5-HT1, Code ATC: N02CC01.
La substance active contenue dans SUMATRIPTAN SUN est le sumatriptan. Il appartient à un groupe de médicaments appelés agonistes des récepteurs 5-HT1.
Le sumatriptan est indiqué dans le traitement de la crise de migraine et de la crise d’algie vasculaire de la face. Les symptômes de la migraine peuvent être dus à une dilatation temporaire des vaisseaux sanguins crâniens. Le sumatriptan agit en réduisant la taille de ces vaisseaux sanguins.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D’UTILISER SUMATRIPTAN SUN 6 mg/0,5 ml, solution injectable en seringue préremplie (voie SC) ?
· Si vous êtes allergique au sumatriptan ou à l'un des autres composants contenus dans ce médicament (mentionnés dans la rubrique 6).
· Si vous avez des troubles cardiaques ou des antécédents d'infarctus.
· Si vous avez des troubles circulatoires au niveau des bras et des jambes.
· Si vous avez des antécédents d'accident vasculaire cérébral ou de mini-AVC (aussi appelé accident ischémique transitoire ou AIT).
· Si vous avez une maladie grave du foie.
· Si vous avez une hypertension artérielle sévère ou non contrôlée par un traitement.
· En association à certains autres médicaments utilisés également dans le traitement de la migraine contenant de l’ergotamine et dérivés de l'ergotamine, y compris le méthysergide, un autre triptan ou un agoniste 5-HT.
· En association aux IMAO (inhibiteur de la monoamine oxydase) ou si vous avez pris un IMAO dans les deux dernières semaines.
Avertissements et précautions
Adressez-vous à votre médecin avant d’utiliser SUMATRIPTAN SUN 6 mg/0,5 ml, solution injectable en seringue préremplie (voie SC) si :
· vous avez l'une des maladies suivantes : maladie cardiaque telle que : insuffisance cardiaque, angine de poitrine ou infarctus du myocarde (crise cardiaque), hypertension artérielle, maladie du foie ou des reins, épilepsie ou une maladie du cerveau (les femmes ménopausées et les hommes de plus de 40 ans en particulier doivent avoir un examen cardiaque et des vaisseaux sanguins avant d'utiliser ce médicament) ;
· vous avez des facteurs de risque de maladies cardiaques, tels que des antécédents familiaux de maladie cardiaque, du diabète, un taux de cholestérol sanguin élevé, si vous êtes un fumeur régulier de cigarettes ou si vous présentez une surcharge pondérale ;
· vous êtes allergique à certains antibiotiques (sulfamides) : les personnes allergiques aux sulfamides peuvent présenter une réaction allergique au sumatriptan ;
· vous utilisez certains médicaments pour traiter une dépression (appelés ISRS ou IRSN) ou du lithium (un médicament utilisé pour le traitement les troubles maniaco-dépressifs (troubles bipolaires)). Vous pouvez développer un syndrome sérotoninergique (comprenant confusion mentale, augmentation du rythme cardiaque, frissons, sueurs et contractions musculaires). Demandez conseil à votre médecin si vous remarquez un de ces symptômes.
Après avoir discuté de ce qui précède, votre médecin peut encore vous conseiller d'utiliser SUMATRIPTAN SUN et vous donnera des directives sur l'utilisation de l'injection.
Comme avec d'autres traitements de la migraine, l’abus peut aggraver votre migraine et rendre les crises plus fréquentes.
Vous devez utiliser SUMATRIPTAN SUN seulement lorsque votre médecin est certain que vous souffrez de crises de migraine ou de crises d’algie vasculaire de la face
Autres médicaments et SUMATRIPTAN SUN 6 mg/0,5 ml, solution injectable en seringue préremplie (voie SC)
Avant d'utiliser SUMATRIPTAN SUN informez votre médecin si :
· vous prenez d’autres médicaments pour votre migraine qui contiennent des dérivés de l'ergotamine ou de l'ergotamine, tels que le tartrate d'ergotamine ou de maléate méthysergide (si c’est le cas, vous devez arrêter de les prendre au moins 24 heures avant de prendre du SUMATRIPTAN SUN) ;
· vous prenez des médicaments sur ordonnance d'un médecin pour le traitement de la dépression tels que les IMAO ou les ISRS (y compris le citalopram, la fluoxétine, la fluvoxamine, la paroxétine et la sertraline), ou si vous avez pris un IMAO dans les 2 dernières semaines ;
· vous prenez du lithium (un médicament utilisé pour le traitement des troubles maniaco-dépressifs (troubles bipolaires)) ;
· vous prenez des médicaments sur ordonnance d'un médecin afin de vous aider à perdre du poids, ou pour le traitement de l'épilepsie ;
· vous prenez un produit qui contient la plante médicinale millepertuis (Hypericum perforatum). Le prendre avec SUMATRIPTAN SUN peut augmenter les possibilités de présenter d'effets indésirables.
Informez votre médecin ou pharmacien si vous prenez, avez récemment pris ou pourriez prendre tout autre médicament.
Demandez conseil à votre médecin ou votre pharmacien avant de prendre ce médicament :
· si vous êtes enceinte, si vous pensez être enceinte ou planifiez une grossesse.
· si vous allaitez. Votre médecin peut vous conseiller de prendre du sumatriptan, mais l'allaitement doit être suspendu pendant 12 heures après une dose et pendant ce temps tout le lait maternel collecté doit être éliminé.
Certaines femmes qui allaitent signalent de la douleur mammaire et/ou au mamelon après l’utilisation du sumatriptan. La douleur est généralement temporaire et disparaît en 3 à 12 heures.
Conduite de véhicules et utilisation de machines
SUMATRIPTAN SUN peut entraîner une somnolence. Si vous êtes concerné, ne conduisez pas et n’utilisez pas de machines.
SUMATRIPTAN SUN 6 mg/0,5 ml, solution injectable en seringue préremplie (voie SC) contient du sodium
Ce médicament contient moins de 1 mmol de sodium (23 mg) par dose (soit 0,5 ml), c'est à dire pratiquement «sans sodium».
3. COMMENT UTILISER SUMATRIPTAN SUN 6 mg/0,5 ml, solution injectable en seringue préremplie (voie SC) ?
Vérifiez auprès de votre médecin ou pharmacien en cas de doute.
SUMATRIPTAN SUN est habituellement injecté dans la cuisse.
Lisez attentivement la section « Comment utiliser l'injecteur automatique», à la fin de la notice. La seringue préremplie avec injecteur automatique injectera une dose de SUMATRIPTAN SUN juste sous la peau, rapidement et sans douleur. L'injection ne doit PAS être réalisée par une autre voie que la voie indiquée.
NE PAS injecter SUMATRIPTAN SUN dans une veine.
NE PAS utiliser de SUMATRIPTAN SUN pour prévenir une crise.
Pour la crise de migraine:
Utilisez une seringue préremplie avec injecteur automatique dès le premier signe d'une crise de migraine (bien qu'il soit tout aussi efficace s'il est utilisé plus tard au cours d'une crise).
En cas de soulagement de votre crise de migraine après la première dose mais que la douleur réapparait, vous pouvez utiliser une deuxième seringue préremplie avec injecteur automatique, à condition de respecter un intervalle d'au moins une heure entre les 2 injections.
NE PAS utiliser plus de DEUX injections en 24 heures.
Si l'injection ne soulage pas votre migraine, vous pouvez prendre vos antalgiques habituels, à condition qu'ils ne contiennent pas d'ergotamine ou ses dérivés. Attendez au moins six heures après l'utilisation du SUMATRIPTAN SUN avant de prendre un médicament contenant de l'ergotamine ou ses dérivés.
Si votre migraine n’est pas soulagée, n'utilisez pas une deuxième injection pour la même crise. SUMATRIPTAN SUN pourra être utilisé lors de votre prochaine crise.
Pour la crise d'algie vasculaire de la face:
Utilisez UNE seringue préremplie avec injecteur automatique pour chaque crise. Il est recommandé d'utiliser le médicament dès l'apparition des premiers signes de crise d'algie vasculaire de la face (bien que le médicament soit aussi efficace s’il est utilisé pendant la crise). NE PAS utiliser plus de DEUX injections en 24 heures et assurez-vous de laisser au moins une heure entre les deux doses.
Utilisation chez les enfants et les adolescents de moins de 18 ans
Le sumatriptan injectable ne doit pas être utilisé chez les enfants et les adolescents de moins de 18 ans.
Personnes âgées de plus de 65 ans
Il y a peu d'expérience du sumatriptan injectable chez les personnes âgées de plus de 65 ans, il n'est donc pas indiqué pour ce groupe d'âge.
Si vous avez utilisé plus de SUMATRIPTAN SUN 6 mg/0,5 ml, solution injectable en seringue préremplie (voie SC) que vous n’auriez dû :
Utiliser une quantité supérieure à celle prescrite vous rendra malade. En cas de surdosage, N’ATTENDEZ PAS, demandez à votre médecin ce qu'il faut faire ou contactez le service des urgences le plus proche.
Si vous avez d'autres questions sur l'utilisation de ce médicament, demandez plus d'informations à votre médecin ou à votre pharmacien.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Très fréquents (pouvant affecter plus de 1 personne sur 10)
· douleur temporaire au site d'injection ;
· picotements/brûlure, rougeur, gonflement, ecchymoses et des saignements au site d'injection.
Fréquents (pouvant affecter jusqu’à 1 personne sur 10)
· bouffées vasomotrices (rougeur de la face durant quelques minutes), vertiges, sensation de faiblesse, fatigue et somnolence ;
· augmentation de la pression artérielle de courte durée, peu après l’utilisation de ce médicament ;
· nausées et vomissements, lorsqu'ils ne font pas partie de la crise de migraine ;
· douleur, des sensations inhabituelles, comme des picotements, d’engourdissement, de chaleur ou de froid, de lourdeur et de pression ou d'oppression. Ces symptômes disparaissent généralement rapidement, mais peuvent être intenses et affecter n'importe quelle partie du corps, notamment la poitrine et la gorge. Si ces symptômes persistent ou sont particulièrement graves, en particulier si vous avez une douleur au niveau de la poitrine ou du cœur qui se propage dans les bras, parlez-en immédiatement à votre médecin car il y a eu de rares cas pour lesquels ces problèmes ont été causés par une crise cardiaque ;
· essoufflement ;
· douleurs musculaires (myalgies).
Rares
· Douleur mammaire
Très rares (pouvant affecter jusqu’à 1 personne sur 10 000)
· modifications de la fonction hépatique: si vous avez un test sanguin afin de vérifier comment votre foie fonctionne et que vous avez utilisé du sumatriptan, parlez-en à votre médecin car cela peut affecter les résultats.
Fréquence inconnue (ne peut être estimée à partir des données disponibles)
· réactions allergiques, qui peuvent aller de la réaction cutanée comme l’éruption cutanée ou l’urticaire aux réactions anaphylactiques, comme le collapsus ;
· convulsions, tremblements, contractions musculaires, mouvements involontaires des yeux ;
· troubles visuels, y compris le scintillement, une vision double et une vision réduite. Il y a eu des cas où les défauts de vision permanents se sont produits ;
· abaissement de la pression artérielle qui peut entraîner une sensation de malaise en particulier en se relevant ;
· le ralentissement ou accélération de votre fréquence cardiaque, des palpitations (sensation de battements cardiaques rapides), des changements du rythme cardiaque ;
· le phénomène de Raynaud, qui pourrait se manifester par une pâleur ou une teinte bleue de la peau et / ou des douleurs des doigts, les orteils, les oreilles, le nez ou de la mâchoire en réaction au froid ou au stress ;
· crise cardiaque ;
· douleur thoracique (angine de poitrine) ;
· colite ischémique avec les symptômes suivants: douleurs abdominales, des saignements rectaux et de la fièvre ;
· diarrhée ;
· raideur de la nuque ;
· douleurs articulaires ;
· anxiété, transpiration ;
· Si vous avez eu une blessure récente ou si vous avez une inflammation (rhumatisme ou inflammation du côlon, par exemple), vous pouvez ressentir une douleur ou une aggravation de la douleur au niveau de la blessure ou de l'inflammation ;
· difficultés à avaler.
Si vous ressentez les effets indésirables suivants, vous devez contacter votre médecin immédiatement et ne plus utiliser le sumatriptan, sauf indication contraire de votre médecin.
· Respiration sifflante soudaine, battements ou oppression dans la poitrine, gonflement des paupières, du visage ou des lèvres, éruptions cutanées - tâches rouges ou urticaire (bosses sur la peau)-, qui peuvent être des signes d'une réaction allergique ;
· convulsions (habituellement chez les personnes ayant des antécédents d'épilepsie) ;
· inflammation du côlon (partie de l'intestin), qui peut se présenter sous la forme d’une douleur en bas à gauche du ventre et / ou des diarrhées sanglantes ;
· le phénomène de Raynaud, qui pourrait se manifester par une pâleur ou une teinte bleue de la peau et / ou des douleurs des doigts, des orteils, d’oreilles, dans le nez ou la mâchoire en réaction au froid ou au stress ;
· douleur thoracique (angine de poitrine) ;
· crise cardiaque.
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet: https://signalement.social-sante.gouv.fr/.
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER SUMATRIPTAN SUN 6 mg/0,5 ml, solution injectable en seringue préremplie (voie SC) ?
Tenir ce médicament hors de la vue et de la portée des enfants.
N’utilisez pas ce médicament après la date de péremption indiquée sur la boîte après « EXP ». La date de péremption fait référence au dernier jour de ce mois.
Ce médicament ne nécessite pas de précautions particulières de conservation.
N’utilisez pas ce médicament si vous remarquez des particules dans la solution.
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient SUMATRIPTAN SUN 6 mg/0,5 ml, solution injectable en seringue préremplie (voie SC)
· La substance active est le sumatriptan.
Chaque seringue préremplie contient 6 mg de sumatriptan sous forme de succinate de sumatriptan.
· Les autres composants sont : chlorure de sodium et eau pour préparations injectables.
Seringue préremplie avec injecteur automatique, contenant une solution pour injection claire, incolore ou pâle.
Chaque boîte contient 1 seringue préremplie avec injecteur automatique.
Chaque boîte contient 2 seringues préremplies avec injecteurs automatiques.
Chaque boîte contient 6 seringues préremplies avec injecteurs automatiques.
Chaque boîte contient 12 seringues préremplies avec injecteurs automatiques.
Toutes les présentations peuvent ne pas être commercialisées.
Titulaire de l’autorisation de mise sur le marché
SUN PHARMACEUTICAL INDUSTRIES EUROPE B.V.
POLARISAVENUE 87
2132 JH HOOFDDORP
PAYS-BAS
Exploitant de l’autorisation de mise sur le marché
SUN PHARMA FRANCE
31 RUE DES POISSONNIERS
92200 NEUILLY-SUR-SEINE
SUN PHARMACEUTICAL INDUSTRIES EUROPE B.V.
POLARISAVENUE 87
2132 JH HOOFDDORP
PAYS-BAS
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Ce médicament est autorisé dans les Etats membres de l'Espace Economique Européen sous les noms suivants : Conformément à la réglementation en vigueur.
[À compléter ultérieurement par le titulaire]
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).
|
COMMENT UTILISER L'INJECTEUR AUTOMATIQUE Sumatriptan SUN 6 mg/0,5 ml, solution injectable solution injectable en seringue préremplie (voie SC) Cette notice explique comme utiliser l'injecteur automatique SUMATRIPTAN SUN. Lisez cette notice DEUX FOIS avant la première utilisation. Si vous avez des questions, demandez plus d'informations à votre médecin ou votre pharmacien. Ce médicament est utilisé uniquement chez les patients pour lesquels une dose de 6 mg a été prescrite. ATTENTION: |
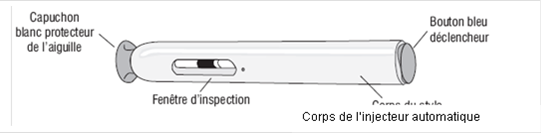
Figure 1 (Vue de face de l’injecteur automatique) |
|
|
|
||
|
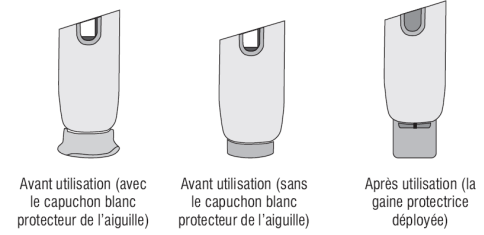
· VERIFIEZ l'apparence de la solution de SUMATRIPTAN SUN à travers la fenêtre d'inspection. La solution doit être claire, incolore à jaune pâle. Ne pas injecter la solution si elle semble décolorée ou trouble ou si elle contient des grumeaux, des flocons, ou des particules. · NE PAS retirer le capuchon blanc protecteur de l'aiguille avant que vous soyez prêt à effectuer l'injection. · NE JAMAIS enfoncer le capuchon blanc protecteur de l'aiguille dans l'injecteur automatique. · NE JAMAIS mettre ou appuyer le pouce, les doigts ou la main sur la gaine blanche protectrice de l'aiguille. |
||
|
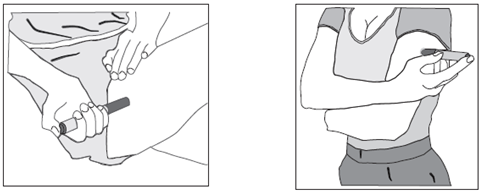
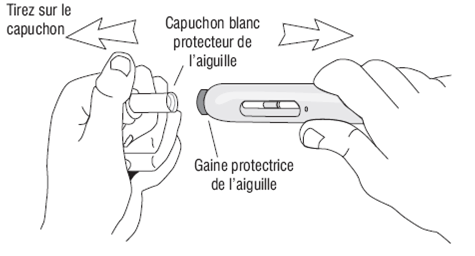
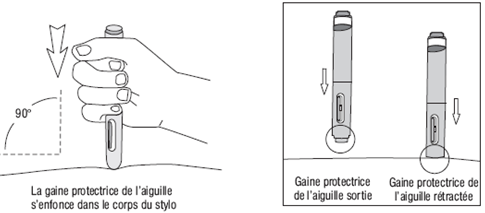
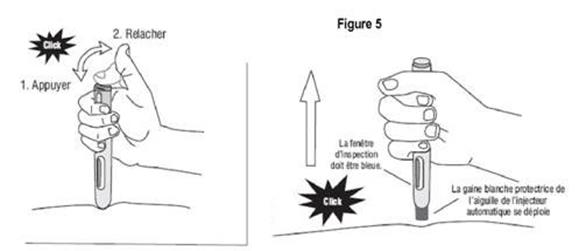
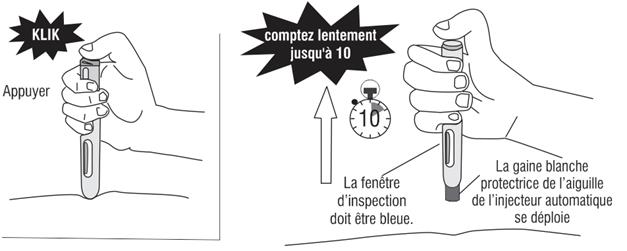
Comment utiliser l'injecteur automatique a) Lavez-vous soigneusement les mains. b) Trouvez un endroit confortable et bien éclairé et mettez tout ce dont vous avez besoin à portée de main (injecteur automatique, alcool ou des compresses stériles). c) Identifiez une zone d'application avec une couche suffisante de tissu adipeux, par exemple sur la partie supérieure du bras ou sur la cuisse. Ne pas injecter dans les zones où la peau est sensible, blessée, rouge ou dure. d) Nettoyez le site d'injection avec de l'alcool ou une compresse stérile neuve et laisser sécher votre peau. Ne touchez cette zone avant de faire l'injection. e) Sortez l'injecteur automatique de sa boîte. f) Prenez l'injecteur automatique dans une main et enlevez doucement le capuchon blanc protecteur de l'aiguille en tirant dessus avec l’autre main. Ne le tournez pas et ne remettez pas le capuchon blanc protecteur de l'aiguille, car ces manipulations pourraient endommager l'aiguille qui se trouve à l'intérieur de l'injecteur automatique Comment commencer l'injection: (1) Sans appuyer sur le bouton bleu déclencheur, placez l'extrémité ouverte de l'injecteur automatique sur le site d'injection avec un angle droit (90°) et poussez la gaine blanche protectrice de l'aiguille fermement sur la peau pour déverrouiller le système. L’injecteur automatique ne fonctionne que si la gaine protectrice de l’aiguille est complètement rétractée. Continuez à tenir l'injecteur automatique fermement sur la peau. (2) Appuyez et relâchez le bouton bleu déclencheur (un premier « clic » sonore se fait entendre). Cela déclenche l'injection. (3) Ne pas retirer l'injecteur automatique de la peau. (4) Attendez jusqu'à ce que vous entendiez un deuxième « clic ».La fenêtre d’inspection deviendra bleue, confirmant que l’injection est finie. (5) Levez l'injecteur automatique directement vers le haut. L'injection est terminée. Si la fenêtre d'inspection n'est pas bleue, n'essayez pas d'utiliser une seconde fois l'injecteur automatique. |
|
|
|
Figure 2 |
||
|
|
||
|
Figure 3 |
||
|
|
||
|
Figure 4 |
||
|
Figure 5 |
||
|
(6) La gaine blanche protectrice de l'aiguille du l'injecteur automatique se déploiera automatiquement pour recouvrir l'aiguille et se verrouillera. L'aiguille ne sera plus visible. Il n'est pas nécessaire de remettre le capuchon blanc. |
Figure 6 |
|
|
|
||
|
NE JAMAIS ESSAYER DE RE-UTILISER UN INJECTEUR AUTOMATIQUE. Si vous pensez que vous n'avez pas reçu la totalité de la dose, ne répétez pas l'injection en utilisant un nouvel injecteur automatique. (7) Si vous remarquez une goutte de sang au site d'injection, essuyez la avec du coton ou un mouchoir. Ne frottez pas le site d'injection. Si besoin, vous pouvez couvrir le site d'injection avec un bandage. |
|
|
|
|
||
|
Figure 1 |
|
|
|
|
||
|
Figure 2 |
|
|
|
|
|
|
|
Figure 3 |
|
|
|
|
||
|
Figure 4 |
||
|
|
||
|
Figure 5 |
||
|
|
||
|
Figure 6 |
||
|
|
||
[1] Indiquer le libellé détaillé qui figure dans l’application form avec le code de la modification selon les lignes directrices https://ec.europa.eu/health//sites/health/files/files/eudralex/vol-2/c_2013_2008/c_2013_2008_pdf/c_2013_2804_fr.pdf