Dernière mise à jour le 01/12/2025
SOLU-MEDROL 40 mg/1 mL, poudre et solvant pour solution injectable
Présentations
> 1 flacon bicompartimenté en verre
Code CIP : 34009 302 814 6 8
Déclaration de commercialisation : 10/10/2024
Cette présentation est agréée aux collectivités
- Prix hors honoraire de dispensation : 2,66 €
- Honoraire de dispensation : 1,02 €
- Prix honoraire compris : 3,68 €
- Taux de remboursement :65 %
Service médical rendu (SMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprès de la HAS (plus d'informations dans l'aide). Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Important | Avis du 20/12/2023 | Inscription (CT) | Le service médical rendu par SOLU-MEDROL 40 mg/1 ml (méthylprednisolone), poudre et solvant pour solution injectable, est important dans les indications de l’AMM. |
Amélioration du service médical rendu (ASMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprés de la HAS (plus d'informations dans l'aide). Les avis et synthéses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur de l'ASMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| V (Inexistant) | Avis du 20/12/2023 | Inscription (CT) | Cette spécialité est un complément de gamme qui n’apporte pas d’amélioration du service médical rendu (ASMR V) par rapport à la présentation SOLUMEDROL 40 mg (méthylprednisolone), poudre pour solution injectable, déjà inscrite. |
ANSM - Mis à jour le : 28/07/2025
SOLU-MEDROL 40 mg/1 mL, poudre et solvant pour solution injectable
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Hémisuccinate de méthylprednisolone................................................................................ 50,70 mg
Quantité correspondant en méthylprednisolone base.......................................................... 40,00 mg
Pour un flacon bi-compartimenté.
Solvant
Eau pour préparations injectables............................................................................................. 1 mL
La quantité de SOLU-MEDROL reconstitué est de 40 mg par mL.
Pour la liste complète des excipients, voir rubrique 6.1.
Poudre et solvant pour solution injectable.
La poudre lyophilisée est de couleur blanc à blanc cassé.
Le solvant est clair et incolore.
4.1. Indications thérapeutiques
Les indications de SOLU-MEDROL sont :
· celles de la corticothérapie générale per os lorsque la voie parentérale est nécessaire en cas d'impossibilité de la voie orale (vomissements, aspiration gastrique, troubles de la conscience).
· les affections nécessitant un effet thérapeutique rapide :
o Allergiques :
§ œdème de Quincke sévère en complément des antihistaminiques,
§ choc anaphylactique en complément de l'adrénaline.
o Infectieuses :
§ fièvre typhoïde sévère, en particulier avec confusion mentale, choc, coma,
§ laryngite striduleuse (laryngite sous-glottique) chez l'enfant.
o Neurologiques :
§ œdème cérébral (tumeurs, abcès à toxoplasme ).
o ORL :
§ dyspnée laryngée.
4.2. Posologie et mode d'administration
SOLU-MEDROL n'est pas adapté à l'administration par voie inhalée par nébulisateur.
Equivalence anti-inflammatoire (équipotence) pour 5 mg de prednisone : 4 mg de méthylprednisolone.
Posologie
Les doses requises sont variables et doivent être individualisées en fonction de la maladie traitée, de sa gravité et de la réponse du patient pendant toute la durée du traitement. Une évaluation continue du rapport bénéfice/risque doit être faite selon chaque cas individuellement.
La dose la plus faible possible de corticostéroïdes doit être utilisée pour contrôler la maladie en cours de traitement pendant la durée minimale. La dose d'entretien adéquate doit être déterminée en diminuant peu à peu la dose initiale du médicament à des intervalles de temps appropriés jusqu'à ce que la dose la plus faible permettant de maintenir une réponse clinique adéquate soit atteinte.
Si le médicament doit être arrêté après un traitement de longue durée, il doit être réduit progressivement jusqu’à l’arrêt plutôt que stoppé brutalement (voir rubrique 4.4).
Après la phase initiale d'urgence, il convient d'envisager l'utilisation d'une préparation injectable à action prolongée ou d'une forme orale.
Après mélange, la solution obtenue peut être administrée directement par voie intramusculaire (IM) profonde, par voie intraveineuse (IV) lente (durée minimum : 20 à 30 minutes) ou par perfusion IV après dilution dans une solution isotonique de chlorure de sodium ou de glucose.
Adulte : 20 à 60 mg par jour. Cette dose peut être renouvelée 2 à 3 fois par 24 heures, si nécessaire.
Enfant : 1 à 3 mg/kg/jour.
Mode d’administration
INJECTIONS INTRAVEINEUSE OU INTRAMUSCULAIRE.
Pour les instructions concernant la reconstitution du médicament avant administration, voir la rubrique 6.6.
· tout état infectieux à l'exclusion des indications spécifiées (voir rubrique 4.1),
· certaines viroses en évolution (notamment hépatites, herpes, varicelle, zona),
· états psychotiques encore non contrôlés par un traitement,
· vaccins vivants, ou vaccins vivants atténués (vaccins contre la fièvre jaune, la tuberculose, le rotavirus, la rougeole, les oreillons, la rubéole, la varicelle, le zona, la grippe) chez les patients recevant des posologies supérieures à 10 mg/j d’équivalent-prednisone (ou > 2 mg/kg/j chez l’enfant ou > 20 mg/j chez l’enfant de plus de 10 kg) pendant plus de deux semaines et pour les « bolus » de corticoïdes (à l'exception des voies inhalées et locales), et pendant les 3 mois suivant l’arrêt de la corticothérapie : risque de maladie vaccinale généralisée éventuellement mortelle,
· hypersensibilité à la substance active ou à l’un des excipients mentionnés à la rubrique 6.1.
· en administration par voie intrathécale,
· en administration par voie épidurale,
· troubles de l'hémostase ou traitement anticoagulant en cours en cas d'injection intra-musculaire.
4.4. Mises en garde spéciales et précautions d'emploi
Effets immunosuppresseurs/susceptibilité accrue aux infections
La corticothérapie peut favoriser la survenue de diverses complications infectieuses dues notamment à des bactéries, des levures et des parasites. La survenue d'une anguillulose maligne est un risque important. Tous les sujets venant d'une zone d'endémie (régions tropicale, subtropicale, sud de l'Europe) doivent avoir un examen parasitologique des selles et un traitement éradicateur systématique avant la corticothérapie.
Les signes évolutifs d'une infection peuvent être masqués par la corticothérapie. Les corticostéroïdes peuvent exacerber les infections existantes, augmenter le risque de réactivation ou d'exacerbation des infections latentes.
Surveiller le développement de l'infection et envisager l'arrêt des corticostéroïdes ou une réduction de la dose si nécessaire.
Les sujets traités par des immunosuppresseurs sont plus sensibles aux infections que les sujets sains. Les patients doivent éviter le contact avec des sujets atteints de varicelle ou de rougeole. Ces viroses peuvent suivre une évolution plus sévère, voire mortelle, chez les enfants non immunisés ou chez les adultes prenant des corticostéroïdes.
L’administration des vaccins vivants ou vivants atténués est contre-indiquée chez les patients recevant des posologies supérieures à 10 mg/j d’équivalent-prednisone (ou > 2 mg/kg/j chez l’enfant ou > 20 mg/j chez l’enfant de plus de 10 kg) pendant plus de deux semaines et pour les « bolus » de corticoïdes (à l'exception des voies inhalées et locales), et pendant les 3 mois suivant l’arrêt de la corticothérapie (voir rubriques 4.3 et 4.5). Les vaccins non vivants ou inactivés peuvent être administrés chez les patients recevant des doses immunosuppressives de corticostéroïdes. Cependant, la réponse à ces vaccins peut être diminuée. Les procédures d'immunisation indiquées peuvent être menées chez les patients recevant des doses non immunosuppressives de corticostéroïdes.
Il importe, avant la mise en route du traitement, d'écarter toute possibilité de foyer viscéral, notamment tuberculeux, et de surveiller, en cours de traitement l'apparition de pathologies infectieuses.
En cas de tuberculose ancienne, un traitement prophylactique antituberculeux est nécessaire, s'il existe des séquelles radiologiques importantes et si l'on ne peut s'assurer qu'un traitement bien conduit de 6 mois par la rifampicine a été donné.
L'utilisation de corticostéroïdes dans la tuberculose active doit être limitée aux cas de tuberculose fulminante ou disséminée dans lesquels les corticoïdes sont utilisés pour contrôler la maladie en association avec un régime thérapeutique antituberculeux approprié.
Des cas de sarcome de Kaposi ont été rapportés chez les patients recevant une corticothérapie. L’arrêt de la corticothérapie peut entraîner une rémission clinique.
Le rôle des corticostéroïdes dans le choc septique est controversé, les premières études rapportant des effets bénéfiques et des effets nocifs. Plus récemment, il a été démontré qu’un traitement complémentaire par corticostéroïdes pouvait être bénéfique aux patients présentant un choc septique établi et une insuffisance surrénalienne. Cependant, leur utilisation en routine en cas de choc septique n’est pas recommandée et une revue systématique a conclu que l’utilisation de corticostéroïdes à haute dose pendant une brève période n’était pas recommandée. Cependant, des méta-analyses et une autre revue suggèrent que des traitements plus longs (5 - 11 jours) par corticostéroïdes à faible dose pouvaient réduire la mortalité, en particulier chez les patients présentant un choc septique sensible aux vasoconstricteurs.
Effets sur le système immunitaire
Des réactions allergiques peuvent se produire. De rares cas de réactions cutanées et de réactions anaphylactiques/anaphylactoïdes étant survenus chez des patients traités par une corticothérapie, une attention particulière sera portée avant toute administration, en particulier chez les sujets présentant un terrain atopique.
Effets endocriniens
Chez les patients sous corticothérapie soumis à un stress inhabituel, l'augmentation de la dose de corticostéroïdes à action rapide avant, pendant et après la situation stressante est indiquée.
L’administration prolongée de doses pharmacologiques de corticostéroïdes peut entraîner une inhibition hypothalamo-hypophyso-surrénalienne (insuffisance corticosurrénale secondaire). L’importance et la durée de l’insuffisance corticosurrénale produite varient d’un patient à l’autre et dépendent de la dose, de la fréquence, de l’heure d’administration et de la durée du traitement par glucocorticoïdes. Cet effet peut être minimisé en administrant le traitement tous les deux jours.
De plus, l’arrêt brutal des corticostéroïdes peut entraîner une insuffisance surrénale aiguë pouvant être fatale.
L’insuffisance corticosurrénale secondaire d'origine médicamenteuse peut ainsi être minimisée par la réduction progressive de la posologie. Ce type d'insuffisance relative peut persister pendant des mois après l'arrêt du traitement. Par conséquent, dans toute situation de stress survenant pendant cette période, l'hormonothérapie devrait être réintroduite.
Un « syndrome de sevrage » lié aux stéroïdes, visiblement sans rapport avec l’insuffisance corticosurrénale, peut également se produire après l'interruption brutale de glucocorticoïdes. Ce syndrome comprend des symptômes tels que : anorexie, nausées, vomissements, léthargie, céphalées, fièvre, douleurs articulaires, desquamation, myalgie, perte de poids, et/ou une hypotension. Il semblerait que ces effets sont dus au brusque changement de la concentration de glucocorticoïdes plutôt qu’à de faibles niveaux de corticostéroïdes.
Sachant que les glucocorticoïdes peuvent entraîner ou aggraver un syndrome de Cushing, l’utilisation de glucocorticoïdes doit être évitée chez les patients atteints de la maladie de Cushing.
Les corticostéroïdes ont un effet majoré chez les patients atteints d'hypothyroïdie.
La paralysie périodique thyrotoxique (PPT) peut survenir chez les patients présentant une hyperthyroïdie et une hypokaliémie induite par la méthylprednisolone.
Une PPT doit être suspectée chez les patients traités par méthylprednisolone présentant des signes ou symptômes de faiblesse musculaire, en particulier chez les patients présentant une hyperthyroïdie.
En cas de suspicion de PPT, le taux sanguin de potassium doit être immédiatement contrôlé et doit faire l’objet d’une prise en charge adéquate afin d’assurer un retour à la normale de la kaliémie.
Métabolisme et nutrition
Les corticoïdes, dont la méthylprednisolone, peuvent augmenter la glycémie, aggraver un diabète préexistant ou prédisposer à un diabète les patients qui les reçoivent à long terme.
Lorsque la corticothérapie est indispensable, le diabète n’est pas une contre-indication mais le traitement peut entraîner son déséquilibre. Il convient de réévaluer sa prise en charge.
Effets psychiatriques
Des troubles psychiques peuvent apparaître lors de l’utilisation des corticostéroïdes, tels que l’euphorie, l’insomnie, les sautes d'humeur, les changements de personnalité, dépression sévère et aussi les manifestations psychotiques franches. De plus, l'instabilité émotionnelle existante ou les tendances psychotiques peuvent être aggravés par les corticostéroïdes.
Des réactions indésirables psychiatriques potentiellement sévères peuvent survenir avec les stéroïdes systémiques. Les symptômes apparaissent généralement dans les quelques jours ou semaines suivant le début du traitement. Bien qu’un traitement spécifique puisse dans certains cas être nécessaire, la plupart de ces réactions régressent après réduction de la dose ou arrêt du traitement. Des effets psychologiques ont été rapportés lors de l’arrêt des corticostéroïdes ; leur fréquence est inconnue. Les patients/soignants doivent demander un avis médical en cas d’apparition de symptômes psychologiques chez le patient, en particulier en cas de suspicion de dépression ou d’idées suicidaires. Les patients/soignants doivent être alertés de la possible survenue de troubles psychiatriques pouvant survenir pendant ou immédiatement après diminution de la dose ou l’arrêt des stéroïdes systémiques.
Effets sur le système nerveux
Les corticostéroïdes doivent être utilisés avec précaution chez les patients présentant des troubles convulsifs.
Les corticostéroïdes doivent être utilisés avec précaution chez les patients atteints de myasthénie grave (voir aussi paragraphe sur la myopathie dans la section Effets musculo-squelettiques).
Bien que des essais cliniques contrôlés aient démontré l’efficacité des corticostéroïdes dans l’accélération de la résolution des poussées aiguës de la sclérose en plaques, ils ne démontrent pas que les corticostéroïdes affectent le résultat final ou l'évolution naturelle de la maladie. Les études indiquent que des doses relativement élevées de corticostéroïdes sont nécessaires pour démontrer un effet significatif.
Des événements médicaux sévères ont été rapportés en association avec les voies d’administration intrathécales/épidurales (voir rubrique 4.8).
Des cas de lipomatose épidurale ont été rapportés chez des patients sous corticothérapie, généralement à long terme et avec des doses élevées.
Effets oculaires
Les corticostéroïdes doivent être utilisés avec prudence chez les patients souffrant d'herpès oculaire en raison de la possible perforation cornéenne.
L’utilisation prolongée des corticoïdes peut causer des cataractes sous-capsulaires postérieures et des cataractes nucléaires (en particulier chez l’enfant), une exophtalmie ou une augmentation de la pression intra-oculaire, pouvant entraîner un glaucome avec une possible atteinte des nerfs optiques. La survenue d’infections oculaires fongiques et virales secondaires peut aussi être majorée chez les patients sous glucocorticoïdes.
La corticothérapie a été associée à une choriorétinopathie séreuse centrale, pouvant occasionner un décollement de la rétine.
Troubles visuels
Des troubles visuels peuvent apparaître lors d’une corticothérapie par voie systémique ou locale. En cas de vision floue ou d’apparition de tout autre symptôme visuel apparaissant au cours d’une corticothérapie, un examen ophtalmologique est requis à la recherche notamment d’une cataracte, d’un glaucome, ou d’une lésion plus rare telle qu’une choriorétinopathie séreuse centrale, décrits avec l’administration de corticostéroϊdes par voie systémique ou locale.
Effets cardiaques
Les effets indésirables des glucocorticoïdes sur le système cardiovasculaire, tels que la dyslipidémie et l'hypertension, peuvent prédisposer les patients traités présentant des facteurs de risque cardiovasculaire à d’autres effets cardiovasculaires, en cas de traitements prolongés et d’utilisation de doses élevées. Par conséquent, les corticoïdes doivent être utilisés judicieusement chez ces patients, une attention particulière à une modification du risque et une surveillance cardiaque supplémentaire si nécessaire devront être accordées. Un traitement à faibles doses ou tous les deux jours peut réduire l'incidence des complications de la corticothérapie.
Des cas d'arythmies cardiaques et/ou de collapsus circulatoire et/ou d’arrêt cardiaque suite à une administration rapide de fortes doses intraveineuses d’hémisuccinate de méthylprednisolone ont été rapportés (plus de 0,5 g administré sur une durée de moins de 10 minutes). Une bradycardie a été rapportée pendant ou après l'administration de fortes doses d’hémisuccinate de méthylprednisolone, et peut ne pas être liée avec la vitesse ou la durée de la perfusion.
En cas d'insuffisance cardiaque congestive, les corticostéroïdes systémiques doivent être utilisés avec précaution, et seulement si cela est strictement nécessaire.
Effets vasculaires
Des thromboses, y compris des cas de maladie thromboembolique veineuse, ont été rapportées avec les corticostéroïdes. En conséquence, les corticostéroïdes doivent être utilisés avec prudence chez les patients qui ont ou qui peuvent être prédisposés à des troubles thromboemboliques.
En cas d’hypertension, les corticostéroïdes doivent être utilisés avec précaution.
Lorsque la corticothérapie est indispensable, l’hypertension n’est pas une contre-indication mais le traitement peut entraîner son déséquilibre. Il convient de réévaluer sa prise en charge.
Effets gastro-intestinaux
De fortes doses de corticostéroïdes peuvent provoquer une pancréatite aiguë.
Il n'existe pas de consensus sur le fait que les corticostéroïdes en soi soient responsables des ulcères gastroduodénaux rencontrés au cours du traitement. Cependant, les glucocorticoïdes peuvent masquer les symptômes de l'ulcère gastroduodénal de sorte qu’une perforation ou une hémorragie pourrait survenir sans douleur importante.
La corticothérapie peut masquer une péritonite ou d'autres signes ou symptômes associés à des troubles gastro-intestinaux tels qu’une perforation, une obstruction ou une pancréatite.
Le risque de développer des ulcères gastro-intestinaux augmente en cas d’association avec des anti-inflammatoires non stéroïdiens.
En cas d'ulcère gastroduodénal, la corticothérapie n'est pas contre-indiquée si un traitement antiulcéreux est associé.
En cas d'antécédents ulcéreux, la corticothérapie peut être prescrite, avec une surveillance clinique et au besoin après fibroscopie.
L'emploi des corticoïdes nécessite une surveillance particulièrement adaptée chez les sujets présentant une colite ulcéreuse notamment en cas de risque de perforation, abcès ou autres infections pyogènes, diverticulites, anastomoses intestinales récentes, ulcère gastroduodénal évolutif ou latent.
Effets hépatobiliaires
Des injections IV cycliques de méthylprednisolone à fortes doses (habituellement à 1 g/jour), sur un court intervalle de temps et durant plusieurs jours peuvent induire une atteinte hépatique telle qu’une hépatite aigüe. Le délai de survenue de l'hépatite aiguë peut être de plusieurs semaines ou plus. La résolution de l'événement indésirable a été observée après l’arrêt du traitement.
Des lésions hépatiques d'origine médicamenteuse incluant des hépatites aiguës ou l’augmentation des enzymes hépatiques peuvent être une conséquence de l'administration de méthylprednisolone par voie intraveineuse en traitement intermittent cyclique (en général à une dose initiale ≥ 1 g/jour). De rares cas d'hépatotoxicité ont été rapportés. Le délai d'apparition peut être de plusieurs semaines ou plus. Dans la majorité des études de cas, la résolution des effets indésirables a été observée après arrêt du traitement. Une surveillance adéquate est par conséquent requise.
Effets musculo-squelettiques
Une myopathie aiguë a été rapportée lors de l’utilisation de doses élevées de corticostéroïdes, le plus souvent chez des patients présentant des troubles de la transmission neuromusculaire (par exemple myasthénie grave) ou chez des patients recevant un traitement concomitant par des anticholinergiques tels que les inhibiteurs neuromusculaires (par exemple pancuronium). Cette myopathie aiguë est généralisée, peut toucher les muscles oculaires et respiratoires et peut entraîner une quadriparésie. On peut observer une augmentation de la créatine kinase. L’amélioration clinique ou le rétablissement, après arrêt des corticostéroïdes peut nécessiter plusieurs semaines à plusieurs années.
L'ostéoporose est un effet fréquent, mais rarement reconnu comme effet indésirable associé à une utilisation à long terme de fortes doses de glucocorticoïdes.
L'emploi des corticoïdes nécessite une surveillance en cas d’ostéoporose et de myasthénie grave.
Les corticoïdes oraux ou injectables peuvent favoriser l'apparition de tendinopathie, voire de rupture tendineuse (exceptionnelle). Ce risque est augmenté lors de la co-prescription avec des fluoroquinolones et chez les patients dialysés avec hyperparathyroïdisme secondaire ou ayant subi une transplantation rénale.
Troubles rénaux et urinaires
La prudence est requise chez les patients atteints de sclérodermie systémique, car une augmentation de l’incidence de la crise rénale sclérodermique a été observée avec les corticostéroïdes, y compris la méthylprednisolone. La pression sanguine et la fonction rénale (créatinine S) doivent dès lors être vérifiées régulièrement. En cas de suspicion de crise rénale, la pression sanguine doit être minutieusement contrôlée.
Les corticostéroïdes doivent être utilisés avec prudence chez les patients atteints d'insuffisance rénale.
Investigations
Des doses moyennes à fortes d'hydrocortisone ou de cortisone peuvent provoquer une élévation de la pression artérielle, une rétention hydrosodée et une excrétion accrue de potassium. Ces effets sont le moins susceptibles de se produire avec les dérivés synthétiques, sauf s’ils sont utilisés à fortes doses. Un régime hyposodé et une supplémentation potassique peuvent être nécessaires.
Tous les corticostéroïdes augmentent l'excrétion de calcium.
Lésions, intoxications et complications liées aux procédures
Les corticostéroïdes par voie orale ne sont pas indiqués dans le traitement des traumatismes crâniens, et ne doivent donc pas être utilisés dans ces cas.
Une étude multicentrique, a montré une augmentation de la mortalité à deux semaines et à six mois après un traumatisme crânien chez les patients recevant de l'hémisuccinate de méthylprednisolone, comparé au groupe placebo. Une relation de causalité avec le traitement par l’hémisuccinate de méthylprednisolone n'a pas été établie.
Utilisation chez l’enfant
Il convient d’observer attentivement la croissance et le développement des nourrissons et des enfants recevant un traitement prolongé par corticostéroïdes.
La croissance peut être empêchée chez les enfants recevant un traitement quotidien à long terme de doses fractionnées de glucocorticoïdes. Ce protocole d’utilisation doit être limité aux indications les plus urgentes. La prise de glucocorticoïdes tous les deux jours évite habituellement ou minimise cet effet secondaire.
Les nourrissons et les enfants sous corticothérapie prolongée sont particulièrement à risque d'hypertension intracrânienne.
Des doses élevées de corticostéroïdes peuvent provoquer une pancréatite chez les enfants.
Des cardiomyopathies hypertrophiques ont été rapportées après administration systémique de glucocorticoïdes dont la méthylprednisolone chez des nourrissons nés prématurément ; il convient donc de procéder à une évaluation diagnostique et à une surveillance appropriée de la fonction et de la structure cardiaques, chez les nourrissons traités par méthylprednisolone à usage systémique.
Autres
Les complications liées au traitement par glucocorticoïdes dépendent de la dose et la durée du traitement. De ce fait, une évaluation bénéfice/risque doit se faire au cas par cas, tant sur la dose et la durée du traitement que sur l’utilisation de la thérapie quotidienne ou intermittente.
La dose la plus faible possible de corticostéroïdes devra être utilisée pour contrôler l’état du patient sous traitement et lorsque la diminution de la dose est possible, elle doit être progressive.
L’acide acétylsalicylique (aspirine) et les anti-inflammatoires non stéroïdiens doivent être utilisés avec prudence en association avec les corticostéroïdes.
L'utilisation concomitante d'anticoagulants oraux et de méthylprednisolone peut augmenter le risque de saignement. Des effets diminués des anticoagulants oraux ont également été rapportés. Pour les patients traités par antivitamines K, une surveillance plus fréquente du temps de prothrombine (INR) est recommandée, notamment lors de l'initiation du traitement ou des ajustements posologiques de méthylprednisolone (voir rubrique 4.5).
L’administration concomitante avec des inhibiteurs de CYP3A, incluant des produits contenant du cobicistat, devrait augmenter le risque d’effets secondaires systémiques. Cette association devrait être évitée à moins que les bénéfices l’emportent sur l’augmentation du risque d’effets secondaires systémique lié aux corticostéroïdes, auquel cas les patients devront être surveillés pour les effets secondaires systémiques liés aux corticostéroïdes (voir rubrique 4.5).
Une crise de phéochromocytome, pouvant être fatale, a été rapportée après administration des corticostéroïdes par voie systémique. Les corticostéroïdes ne doivent être administrés aux patients présentant un phéochromocytome suspecté ou avéré qu’après une évaluation appropriée du rapport bénéfice/risque.
Au cours de l’expérience après commercialisation, des cas de syndrome de lyse tumorale (SLT) ont été rapportés chez des patients atteints de tumeurs malignes, notamment des tumeurs malignes hématologiques et des tumeurs solides, après l'utilisation de corticostéroïdes systémiques seuls ou en association avec d’autres agents chimiothérapeutiques. Les patients présentant un risque élevé de SLT, comme les patients dont les tumeurs présentent un taux de prolifération élevé, une charge tumorale élevée et une grande sensibilité aux agents cytotoxiques, doivent être étroitement surveillés et des précautions appropriées doivent être prises.
L'attention des sportifs est attirée sur le fait que cette spécialité contient de la méthylprednisolone ; ce principe actif est inscrit sur la liste des substances dopantes.
Excipients
Précautions d'emploi
Un traitement par voie orale sera institué en relais dès que possible.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
L'hypokaliémie est un facteur favorisant l'apparition de troubles du rythme cardiaque (torsades de pointes, notamment) et augmentant la toxicité de certains médicaments, par exemple la digoxine. De ce fait, les médicaments qui peuvent entraîner une hypokaliémie sont impliqués dans un grand nombre d'interactions. Il s'agit des diurétiques hypokaliémiants, seuls ou associés, des laxatifs stimulants, des glucocorticoïdes, du tétracosactide et de l'amphotéricine B (voie IV).
METABOLISME PAR CYP3A4
La méthylprednisolone est un substrat des enzymes du cytochrome P450 (CYP) et est principalement métabolisée par l’enzyme CYP3A4. CYP3A4 est l’enzyme dominante de la sous-famille la plus abondante du CYP dans le foie des sujets adultes. Elle catalyse la 6β-hydroxylation des stéroïdes, l’étape essentielle du métabolisme de phase I des corticoïdes endogènes ou de synthèse.
De nombreux autres composés sont également des substrats de CYP3A4, dont certains (ainsi que d’autres médicaments) modifient le métabolisme des glucocorticoïdes par induction ou inhibition de cette enzyme.
Inhibiteurs de CYP3A4 : [Antibiotiques (isoniazide), antiémétiques (aprépitant, fosaprépitant), antifongiques (itraconazole, kétoconazole), antiviraux (inhibiteurs de la protéase du VIH : indinavir, ritonavir), agents de potentialisation pharmacocinétique (cobicistat), antagonistes calciques (diltiazem), contraceptifs oraux (éthinylestradiol, noréthindrone), jus de pamplemousse, immunosuppresseurs (ciclosporine), antibiotiques macrolides (clarithromycine, érythromycine, troléandomycine)]
Les médicaments qui inhibent l’activité de CYP3A4 diminuent généralement la clairance hépatique et augmentent la concentration plasmatique des médicaments substrats de cette enzyme telle la méthylprednisolone. En cas de traitement concomitant avec un inhibiteur de CYP3A4, il est nécessaire d'adapter la dose de méthylprednisolone afin d’éviter des manifestations de toxicité des corticoïdes.
Inducteurs de CYP3A4 : [Antibiotiques, antituberculeux (rifampicine), anticonvulsivants (carbamazépine, phénobarbital, et phénytoïne)]
Les médicaments qui induisent l’activité de CYP3A4 augmentent généralement la clairance hépatique et diminuent la concentration plasmatique des médicaments substrats de cette enzyme. En cas d’administration concomitante, une augmentation de la dose de méthylprednisolone peut être nécessaire pour l’obtention du résultat souhaité.
Substrats de CYP3A4 : [Anticonvulsivants (carbamazépine), antiémétiques (aprépitant, fosaprépitant), antifongiques (itraconazole, kétoconazole), antiviraux (inhibiteurs de la protéase du VIH : indinavir, ritonavir), antagonistes calciques (diltiazem), contraceptifs oraux (éthinylestradiol/noréthindrone), immunosuppresseurs (ciclosporine, cyclophosphamide, tacrolimus), antibiotiques macrolides (clarithromycine, érythromycine)]
En présence d’un autre substrat de CYP3A4, la clairance hépatique de la méthylprednisolone peut être altérée, ce qui nécessite une adaptation correspondante de la dose. Une administration conjointe pourrait accroître la probabilité d’effets indésirables associés à l’un ou l’autre médicament administré seul.
Associations contre-indiquées
+ Vaccins vivants atténués (vaccins contre la fièvre jaune, la tuberculose, le rotavirus, la rougeole, les oreillons, la rubéole, la varicelle, le zona, la grippe)
Chez les patients recevant des posologies supérieures à 10 mg/j d’équivalent-prednisone (ou > 2 mg/kg/j chez l’enfant ou > 20 mg/j chez l’enfant de plus de 10 kg) pendant plus de deux semaines et pour les « bolus » de corticoïdes (à l'exception des voies inhalées et locales), et pendant les 3 mois suivant l’arrêt de la corticothérapie : risque de maladie vaccinale généralisée éventuellement mortelle.
Associations déconseillées
+ Acide acétylsalicylique aux doses anti-inflammatoires ≥ 1 g par prise et /ou ≥ 3 g par jour
Majoration du risque hémorragique.
Par ailleurs, la méthylprednisolone peut augmenter la clairance de l’acide acétylsalicylique administré à fortes doses ce qui peut provoquer une baisse des concentrations sériques de salicylate. L’arrêt du traitement par la méthylprednisolone peut entraîner une augmentation des concentrations sériques de salicylate et conduire à un risque accru de toxicité aux salicylates.
+ Mifamurtide
Risque de moindre efficacité du mifamurtide.
+ Inhibiteurs puissants du CYP3A4
En cas d’utilisation prolongée par voie orale ou inhalée : augmentation des concentrations plasmatiques du corticoïde par diminution de son métabolisme hépatique par l’inhibiteur, avec risque d’apparition d’un syndrome cushingoïde voire d’une insuffisance surrénalienne.
Préférer un corticoïde non métabolisé.
Associations faisant l'objet de précautions d’emploi
+ Médicaments susceptibles de donner des torsades de pointe
Risque majoré de troubles du rythme ventriculaire, notamment de torsades de pointe.
Corriger toute hypokaliémie avant d’administrer le produit et réaliser une surveillance clinique, électrolytique et électrocardiographique.
+ Anticoagulants oraux tels que acénocoumarol, apixaban, dabigatran, fluindione, phenindione, rivaroxaban, warfarine
Glucocorticoïdes (voies générale et rectale) : impact éventuel de la corticothérapie sur le métabolisme de l'antivitamine K et sur celui des facteurs de la coagulation.
Des cas de majoration et aussi de diminution de l’effet de l’anticoagulant ont été rapportés lorsqu’il est administré en concomitance avec les corticostéroïdes.
Risque hémorragique propre à la corticothérapie (muqueuse digestive, fragilité vasculaire) à fortes doses ou en traitement prolongé supérieur à 10 jours.
Lorsque l'association est justifiée, renforcer la surveillance : le cas échéant, avec les antivitamines K, contrôle biologique au 8ème jour, puis tous les 15 jours pendant la corticothérapie et après son arrêt.
+ Antivitamines K (acénocoumarol, fluindione, warfarine)
Pour des doses de 0,5 à 1 g de méthylprednisolone administrées en bolus : augmentation de l'effet de l'antivitamine K et du risque hémorragique.
Contrôle de l'INR 2 à 4 jours après le bolus de méthylprednisolone ou en présence de tous signes hémorragiques.
+ Autres hypokaliémiants : diurétiques hypokaliémiants (seuls ou associés), laxatifs stimulants, amphotéricine B (voie IV)
Risque majoré d’hypokaliémie.
Surveillance de la kaliémie, avec, si besoin, correction.
+ Digitaliques (digoxine)
Hypokaliémie favorisant les effets toxiques des digitaliques.
Corriger auparavant toute hypokaliémie et réaliser une surveillance clinique, électrolytique et électrocardiographique.
+ Inducteurs enzymatiques
Diminution des concentrations plasmatiques et de l’efficacité des corticoïdes par augmentation de leur métabolisme hépatique par l’inducteur : les conséquences sont particulièrement importantes chez les addisoniens traités par l’hydrocortisone et en cas de transplantation.
Surveillance clinique et biologique ; adaptation de la posologie des corticoïdes pendant le traitement par l’inducteur et après son arrêt.
+ Anticonvulsivants inducteurs enzymatiques (carbamazépine, phénobarbital, phénytoïne, primidone, fosphénytoïne)
Diminution des concentrations plasmatiques et de l'efficacité des corticoïdes par augmentation de leur métabolisme hépatique par l’inducteur ; les conséquences sont particulièrement importantes chez les addisoniens traités par l’hydrocortisone et en cas de transplantation.
Surveillance clinique et biologique ; adaptation de la posologie des corticoïdes pendant le traitement par l’inducteur et après son arrêt.
+ Antidiabétiques
Elévation de la glycémie avec parfois cétose (diminution de la tolérance aux glucides par les corticoïdes).
Prévenir le patient et renforcer l'autosurveillance sanguine et urinaire, surtout en début de traitement. Adapter éventuellement la posologie de l'antidiabétique pendant le traitement par les corticoïdes et après son arrêt.
+ Isoniazide (décrit pour la prednisolone)
Diminution des concentrations plasmatiques de l'isoniazide. Mécanisme invoqué : augmentation du métabolisme hépatique de l'isoniazide, potentiellement par acétylation, et diminution de celui des glucocorticoïdes et effet potentiel sur la clairance de l’isoniazide.
Surveillance clinique et biologique.
+ Cobimétinib
Augmentation du risque hémorragique.
Surveillance clinique.
Associations à prendre en compte
+ Acide acétylsalicylique aux doses antalgiques ou antipyrétiques ≥ 500 mg par prise et/ou < 3 g par jour
Majoration du risque hémorragique.
+ Anti-inflammatoires non stéroïdiens
Augmentation du risque d’ulcération et d’hémorragie gastro-intestinale.
+ Antihypertenseurs
Diminution de l'effet antihypertenseur (rétention hydrosodée des corticoïdes).
+ Ciclosporine
Avec la méthylprednisolone administrée par voie IV : augmentation possible des concentrations plasmatiques de ciclosporine et de la créatinémie.
Mécanisme invoqué : diminution de l'élimination hépatique de la ciclosporine.
Par conséquent, il est possible que les effets indésirables liés à l'administration d’un des deux médicaments surviennent lors d’une administration concomitante.
Des cas de convulsions ont été rapportés suite à l’administration concomitante de méthylprednisolone et de ciclosporine.
+ Fluoroquinolones
Possible majoration du risque de tendinopathie, voire de rupture tendineuse (exceptionnelle), particulièrement chez les patients recevant une corticothérapie prolongée.
+ Interféron alpha
Risque d'inhibition de l'action de l'interféron.
+ Curares non dépolarisants
Avec les glucocorticoïdes par voie IV : risque de myopathie sévère, réversible après un délai éventuellement long (plusieurs mois) (voir rubrique 4.4).
Un antagonisme des effets bloquants neuromusculaires du pancuronium et du vécuronium a été décrit chez des patients recevant une corticothérapie. Cette interaction peut être attendue avec tous les curarisants compétitifs.
+ Inhibiteur de l'aromatase (aminoglutéthimide)
L’inhibition de la fonction surrénalienne induite par l’aminoglutéthimide peut exacerber les changements endocriniens causés par un traitement prolongé par glucocorticoïdes.
+ Anticholinestérasiques
Les stéroïdes peuvent réduire les effets des anticholinestérasiques sur la myasthénie grave.
+ Antiviraux (inhibiteurs de la protéase du VIH)
Les corticostéroïdes peuvent avoir un effet inducteur sur le métabolisme des inhibiteurs de la protéase du VIH et réduire ainsi leurs concentrations plasmatiques.
+ Héparines
Augmentation du risque hémorragique.
Incompatibilités
Afin d’éviter les problèmes de compatibilité et de stabilité, il est recommandé d’administrer l’hémisuccinate de méthylprednisolone séparément des autres produits administrés par voie IV. Les médicaments physiquement incompatibles en solution avec l’hémisuccinate de méthylprednisolone comprennent mais ne sont pas limités aux médicaments suivants : allopurinol sodium, chlorhydrate de doxapram, tigécycline, chlorhydrate de diltiazem, gluconate de calcium, bromure de vécuronium, bromure de rocuronium, bésilate de cisatracurium, glycopyrrolate, propofol (voir rubrique 6.2).
4.6. Fertilité, grossesse et allaitement
Grossesse
Chez l'animal, l'expérimentation met en évidence un effet tératogène des corticostéroïdes lorsqu’ils sont administrés chez les femelles à fortes doses. Cependant, les corticoïdes ne semblent pas provoquer d’anomalies congénitales lorsqu'ils sont administrés chez des femmes enceintes. Etant donné qu’aucune étude de reproduction humaine adéquate n’a été réalisée avec l’hémisuccinate de méthylprednisolone, ce médicament ne sera utilisé pendant la grossesse qu'après une évaluation approfondie du rapport bénéfice/risque pour la mère et le fœtus.
Dans l'espèce humaine, certains corticostéroïdes traversent facilement le placenta. Cependant, les études épidémiologiques n'ont décelé aucun risque malformatif lié à la prise de corticoïdes lors du premier trimestre.
Une étude rétrospective a montré une incidence accrue de faible poids à la naissance chez les nourrissons nés de mères recevant des corticostéroïdes. Chez l'Homme, le risque de faible poids de naissance semble être dose-dépendant et peut être minimisé par l'administration de doses plus faibles de corticostéroïdes. Bien que l'insuffisance surrénale néonatale semble être rare chez les nourrissons ayant été exposés in utero aux corticoïdes, les enfants nés de mères ayant reçu des doses substantielles de corticostéroïdes pendant la grossesse doivent être soigneusement observés et évalués pour des signes d’insuffisance surrénale.
Il n'y a aucun effet connu des corticostéroïdes sur le travail et l’accouchement.
Après corticothérapie à long terme pendant la grossesse, des cas de cataractes ont été observés chez les nourrissons.
Les corticostéroïdes passent dans le lait maternel et peuvent inhiber la croissance et perturber la production endogène de glucocorticoïdes chez le nourrisson allaité. Ce médicament ne devra être utilisé pendant l'allaitement qu'après une évaluation approfondie du rapport bénéfice/risque pour la mère et le nourrisson.
En cas de traitement à doses importantes et de façon chronique, l'allaitement est déconseillé.
Fertilité
Une altération de la fertilité a été mise en évidence lors de l’administration de corticostéroïdes dans les études menées chez l’animal (voir rubrique 5.3).
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Les réactions indésirables suivantes ont été signalées lors de l’administration contre-indiquée par voie intrathécale/épidurale : arachnoïdite, trouble gastro-intestinal fonctionnel/dysfonctionnement de la vessie, maux de tête, méningite, paraparésie/paraplégie, crise convulsive, troubles sensoriels.
Les évènements indésirables sont listés par classe de système d’organes selon la classification MedDRA. La convention suivante a été utilisée pour la classification par fréquence : très fréquent (≥1/10) ; fréquent (≥1/100, <1/10) ; peu fréquent (≥1/ 1000, <1/100) ; rare ( ≥1/ 10 000, <1/1 000) ; très rare (< 1/10 000) et fréquence indéterminée (ne peut être estimée sur la base des données disponibles).
|
Classes de systèmes d’organes |
Fréquence |
Effets indésirables |
|
Infections et infestations |
Fréquence indéterminée |
Infection opportuniste, infection, péritonite# |
|
Affections hématologiques et du système lymphatique |
Fréquence indéterminée |
Leucocytose |
|
Affections du système immunitaire |
Fréquence indéterminée |
Hypersensibilité (réactions anaphylactiques, réactions anaphylactoïdes) |
|
Affections endocriniennes |
Fréquence indéterminée |
Cushingoïde, inhibition de l'axe hypothalamo-pituito-surrénal, syndrome de sevrage des stéroïdes |
|
Troubles du métabolisme et de la nutrition |
Fréquence indéterminée |
Acidose métabolique, rétention hydrosodée, alcalose hypokaliémique, dyslipidémie, troubles de la tolérance au glucose, augmentation des besoins en insuline (ou en hypoglycémiants oraux chez les diabétiques), lipomatose, augmentation de l'appétit (pouvant entraîner une prise de poids) |
|
Affections psychiatriques |
Fréquence indéterminée |
Troubles affectifs (incluant humeur dépressive, humeur euphorique, labilité, dépendance aux drogues, idées suicidaires), troubles psychotiques (incluant manie, illusion, hallucination et schizophrénie), troubles mentaux, changement de personnalité, état confusionnel, anxiété, sautes d'humeur, comportement anormal, insomnie, irritabilité |
|
Affections du système nerveux |
Fréquence indéterminée |
Lipomatose épidurale, augmentation de la pression intracrânienne (avec œdème papillaire [l'hypertension intracrânienne bénigne]), crise convulsive, amnésie, troubles cognitifs, étourdissements, maux de tête |
|
Affections oculaires |
Fréquence indéterminée |
Choriorétinopathie, cataracte, glaucome, exophtalmie, vision floue (voir rubrique 4.4) |
|
Affections de l'oreille et du labyrinthe |
Fréquence indéterminée |
Vertige |
|
Affections cardiaques |
Fréquence indéterminée |
Insuffisance cardiaque congestive (chez les patients à risque), arythmie, cardiomyopathies hypertrophiques chez les nourrissons prématurés (voir rubrique 4.4) |
|
Affections vasculaires |
Fréquence indéterminée |
Thrombose, hypertension, hypotension, événements thrombotiques, bouffées congestives |
|
Affections respiratoires, thoraciques et médiastinales |
Fréquence indéterminée |
Embolie pulmonaire, hoquets |
|
Affections gastro-intestinales |
Fréquence indéterminée |
Ulcère gastroduodénal (éventuellement avec perforation et hémorragie), perforation intestinale, hémorragie digestive, pancréatite, œsophagite ulcéreuse, œsophagite, distension abdominale, douleur abdominale, diarrhée, dyspepsie, nausées |
|
Affections hépatobiliaires |
Fréquence indéterminée |
Hépatite** |
|
Affections de la peau et du tissu sous-cutané |
Fréquence indéterminée |
Œdème de Quincke, hirsutisme, pétéchies, ecchymoses, atrophie cutanée, érythème, hyperhidrose, vergetures, rash, prurit, urticaire, acné, hypopigmentation cutanée |
|
Affections musculo-squelettiques et systémiques |
Fréquence indéterminée |
Faiblesse musculaire, myalgie, myopathie, atrophie musculaire, ostéoporose, ostéonécrose, fracture pathologique, arthropathie neuropathique, arthralgie, retard de croissance |
|
Affections des organes de reproduction et du sein |
Fréquence indéterminée |
Irrégularités menstruelles |
|
Troubles généraux et anomalies au site d'administration |
Fréquence indéterminée |
Retard de cicatrisation, œdème périphérique, fatigue, malaise, réaction au site d’injection |
|
Investigations |
Fréquence indéterminée |
Augmentation de la pression intraoculaire, diminution de la tolérance glucidique, diminution du potassium sanguin, augmentation du calcium urinaire, augmentation de l’alanine aminotransférase, augmentation de l’aspartate aminotransférase, augmentation des phosphatases alcalines dans le sang, augmentation de l’uricémie, suppression des réactions aux tests cutanés* |
|
Lésions, intoxications et complications liées aux procédures |
Fréquence indéterminée |
Fracture vertébrale par compression, rupture tendineuse |
* n’est pas un terme MedDRA
** Des cas d’hépatite ont été rapportés en administration par voie IV (voir rubrique 4.4).
# La péritonite peut être le principal signe ou symptôme d'un trouble gastro-intestinal tel qu’une perforation, une obstruction ou une pancréatite (voir rubrique 4.4).
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Classe pharmacothérapeutique : CORTICOIDES A USAGE SYSTEMIQUE NON ASSOCIES, Code ATC : H02AB04.
Les glucocorticoïdes physiologiques (cortisone et hydrocortisone) sont des hormones métaboliques essentielles. Les corticoïdes synthétiques, incluant la méthylprednisolone sont utilisés principalement pour leur effet anti-inflammatoire. A forte dose, ils diminuent la réponse immunitaire. Leur effet métabolique et de rétention sodée est moindre que celui de l'hydrocortisone.
La méthylprednisolone est un anti-inflammatoire puissant. Sa puissance anti-inflammatoire est supérieure à celle de la prednisolone et elle entraîne moins de rétention hydrosodée que cette dernière.
La méthylprednisolone est 4 fois plus puissante que l’hydrocortisone.
5.2. Propriétés pharmacocinétiques
Absorption
Après l’administration d’une dose de 40 mg de succinate sodique de méthylprednisolone par voie intramusculaire (IM) à quatorze volontaires sains, adultes, de sexe masculin et en bonne santé, le pic de concentration moyenne de 454 ng/mL a été atteint en 1 heure. À 12 heures, la concentration plasmatique de méthylprednisolone a diminué à 31,9 ng/mL. La méthylprednisolone n’a pas été détectée 18 heures après l'administration. Sur la base de l'aire sous la courbe concentration-temps, une indication de la quantité totale de médicament absorbé, le succinate sodique de méthylprednisolone intramusculaire a été jugé équivalent à la même dose de méthylprednisolone administrée par voie intraveineuse (IV).
Les résultats d'une étude ont montré que l’ester de succinate sodique de méthylprednisolone est rapidement et largement transformé en méthylprednisolone active après toutes les voies d'administration. Le niveau d'absorption de la méthylprednisolone libre après administration IV et IM a été jugé équivalent et significativement supérieur par rapport à celui après administration de solution buvable et de comprimés de méthylprednisolone par voie orale. Etant donné que le niveau d’absorption de la méthylprednisolone après administration IV et IM était équivalent en dépit de la plus grande quantité de l'ester d’hémisuccinate atteignant la voie systémique après administration IV, il apparaît que l'ester est converti dans le tissu après injection IM avec une absorption ultérieure en méthylprednisolone libre.
Distribution
La diffusion est rapide. La méthylprednisolone est largement distribuée dans les tissus, traverse la barrière hémoméningée et est secrétée dans le lait. Son volume de distribution apparent est d’environ 1,4 l/kg. Le taux de liaison de la méthylprednisolone aux protéines plasmatiques est d’environ 77 % chez l’Homme.
Biotransformation
Chez l’Homme, la méthylprednisolone est métabolisée dans le foie en métabolites inactifs ; les principaux sont la 20α-hydroxyméthylprednisolone et la 20β-hydroxyméthylprednisolone. Le métabolisme hépatique s’effectue principalement par les enzymes du CYP3A4. (voir rubrique 4.5).
La méthylprednisolone, comme de nombreux substrats de CYP3A4 peut également être un substrat de la glycoprotéine P, protéine de transport de la famille des ABC (ATP-binding cassette), ce qui peut avoir un impact sur la distribution tissulaire et les interactions avec d’autres médicaments.
Élimination
La demi-vie moyenne d’élimination de la méthylprednisolone totale est de 1,8 à 5,2 heures. La clairance totale est d’environ 5 à 6 mL/min/kg.
L'élimination est à la fois urinaire et biliaire.
5.3. Données de sécurité préclinique
Carcinogenèse
La carcinogénicité de la méthylprednisolone n'a pas été évaluée convenablement à travers des études chez les rongeurs. Des résultats variables ont été obtenus avec d'autres glucocorticoïdes testés pour leur potentiel carcinogène chez les souris et les rats. Cependant, les données publiées indiquent que plusieurs glucocorticoïdes apparentés, dont le budésonide, la prednisolone et l'acétonide de triamcinolone peuvent augmenter l'incidence des adénomes et des carcinomes hépatocellulaires après administration orale dans l'eau potable des rats mâles. Ces effets tumorigènes ont été observés à des doses qui étaient plus faibles que les doses cliniques habituelles sur une base mg/m2.
Mutagenèse
La génotoxicité de la méthylprednisolone n'a pas été évaluée convenablement. Cependant, le sulfonate de méthylprednisolone, qui possède une structure similaire à la méthylprednisolone, n'a pas été mutagène avec ou sans activation métabolique chez Salmonella typhimurium à des doses de 250 à 2 000 µg/plaque, ou via le test de mutation génique sur des cellules de mammifères utilisant des cellules ovariennes de hamster chinois à des doses de 2 000 à 10 000 µg/mL. Le suleptanate de méthylprednisolone n'a pas induit la synthèse d'ADN non programmée dans les hépatocytes primaires de rat à des doses de 5 à 1 000 µg/mL.
En outre, une revue des données publiées indique que la prednisolone farnésylée, qui possède une structure similaire à la méthylprednisolone, n'a pas été mutagène avec ou sans activation métabolique chez des souches Salmonella typhimurium et d'Escherichia coli à des doses de 312 à 5 000 µg/plaque. Dans une lignée de cellules fibroblastiques de hamster chinois, la prednisolone farnésylée a entraîné une légère augmentation de l'incidence des aberrations chromosomiques structurelles avec activation métabolique à la plus forte concentration testée 1 500 µg/mL.
Toxicité sur la reproduction
Une réduction de la fertilité a été mise en évidence lors de l’administration de corticostéroïdes chez le rat. Des doses de corticostérone de 0, 10 et 25 mg/kg/jour ont été administrées à des rats mâles par injection sous-cutanée une fois par jour pendant 6 semaines et ces rats mâles ont été accouplés à des femelles non traitées. La forte dose a été réduite à 20 mg/kg/jour après le 15ème jour. Une diminution du bouchon copulatoire a été observée, ce qui peut avoir été secondaire à une diminution du poids des organes accessoires. Le nombre d’implantations et de fœtus viables ont été réduits.
Les corticostéroïdes se sont révélés tératogènes chez de nombreuses espèces après administration de doses équivalentes à celle chez l’Homme. Dans les études animales sur la reproduction, les glucocorticoïdes tels que la méthylprednisolone se sont avérés augmenter l’incidence des malformations (fente palatine, malformations squelettiques), de la létalité embryo-fœtale (par exemple, augmentation des résorptions), et un retard de croissance intra-utérine.
Poudre (compartiment inférieur) :
Phosphate monosodique monohydraté, phosphate disodique anhydre, solution d’hydroxyde de sodium à 10 %, saccharose.
Solvant (compartiment supérieur) :
Eau pour préparations injectables.
Après reconstitution avec le solvant :
La solution reconstituée conservée à une température ne dépassant pas 25 °C doit être utilisée immédiatement.
La stabilité physico-chimique de la solution reconstituée a été démontrée sur une période de 48 heures entre 2 °C et 8 °C. Toutefois d’un point de vue microbiologique, elle doit être utilisée immédiatement. Dans le cas contraire, la durée et les conditions de conservation avant utilisation sont de la responsabilité de l’utilisateur et ne devront pas dépasser 24 h entre 2 °C et 8 °C sauf si la reconstitution a été réalisée dans des conditions d’asepsie validées.
Après reconstitution avec le solvant puis dilution pour perfusion :
La solution reconstituée puis diluée pour perfusion doit être utilisée dans les 3 heures après reconstitution si conservée entre 20 °C et 25 °C ou dans les 24 heures après reconstitution si conservée entre 2 °C et 8 °C.
6.4. Précautions particulières de conservation
SOLU-MEDROL ne nécessite pas de précautions particulières de conservation.
Pour les conditions de conservation du médicament après reconstitution et dilution, voir la rubrique 6.3.
6.5. Nature et contenu de l'emballage extérieur
Boîte de 1 flacon bi-compartimenté.
6.6. Précautions particulières d’élimination et de manipulation
Les deux compartiments sont séparés par un joint central en caoutchouc. Le compartiment inférieur contient la poudre et le compartiment supérieur contient le solvant (eau pour préparation injectable).
La reconstitution de la solution à administrer est obtenue en suivant les instructions ci-dessous :
|
|
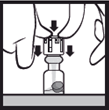
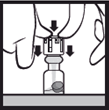
1. Placer les doigts de part et d’autre de l’opercule situé au centre du bouchon et exercer une forte pression verticale vers le bas jusqu’à enclenchement. Le joint en caoutchouc tombe et le solvant s’écoule dans le compartiment inférieur contenant la poudre. Il faut éviter d’appliquer une pression excessive car cela peut casser le flacon et potentiellement blesser l’utilisateur. |
|
|
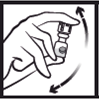
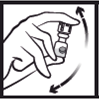
2. Agiter doucement par retournement pour dissoudre la poudre. |
|
|
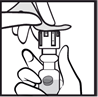
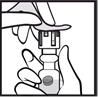
3. Soulever et retirer l’opercule au centre du bouchon. |
|
|
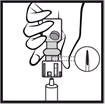
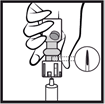
4. Désinfecter le dessus du bouchon en caoutchouc avec un agent antiseptique. |
|
|
5. Insérer l'aiguille perpendiculairement au centre du bouchon en caoutchouc de façon que la pointe de l'aiguille soit tout juste visible. Renverser le flacon et effectuer le prélèvement. |
Ce médicament est administré par voie parentérale. De ce fait, la solution doit être inspectée visuellement avant administration pour détecter l’apparition de particules ou une éventuelle décoloration.
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
23-25, AVENUE DU DOCTEUR LANNELONGUE
75014 PARIS
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 302 814 6 8 : Boîte de 1 flacon bi-compartimenté.
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Liste I.
ANSM - Mis à jour le : 28/07/2025
SOLU-MEDROL 40 mg/1 mL, poudre et solvant pour solution injectable
Hémisuccinate de méthylprednisolone
Veuillez lire attentivement cette notice avant d'utiliser ce médicament car elle contient des informations importantes pour vous.
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin, votre pharmacien ou votre infirmier/ère.
· Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d'autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin, votre pharmacien ou votre infirmier/ère. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
2. Quelles sont les informations à connaître avant d'utiliser SOLU-MEDROL 40 mg/1 mL, poudre et solvant pour solution injectable ?
3. Comment utiliser SOLU-MEDROL 40 mg/1 mL, poudre et solvant pour solution injectable ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver SOLU-MEDROL 40 mg/1 mL, poudre et solvant pour solution injectable ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE SOLU-MEDROL 40 mg/1 mL, poudre et solvant pour solution injectable ET DANS QUELS CAS EST-IL UTILISE ?
Classe pharmacothérapeutique : CORTICOIDES A USAGE SYSTEMIQUE NON ASSOCIES - code ATC : H02AB04.
Ce médicament est un corticoïde.
Il est indiqué dans certaines maladies, où il est utilisé pour son effet anti-inflammatoire.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D’UTILISER SOLU-MEDROL 40 mg/1 mL, poudre et solvant pour solution injectable ?
N’utilisez jamais SOLU-MEDROL 40 mg/1 mL, poudre et solvant pour solution injectable :
· dans la plupart des infections,
· dans certaines maladies virales en évolution (hépatites virales, herpès, varicelle, zona),
· dans certains troubles mentaux non traités,
· en cas de vaccination par des vaccins vivants ou vivants atténués (vaccins contre la fièvre jaune, la tuberculose, le rotavirus, la rougeole, les oreillons, la rubéole, la varicelle, le zona, la grippe) en cas de traitement par des corticoïdes à des posologies supérieures à 10 mg/j d’équivalent-prednisone (ou > 2 mg/kg/j chez l’enfant ou > 20 mg/j chez l’enfant de plus de 10 kg) pendant plus de deux semaines et pour les « bolus » de corticoïdes (à l’exception des voies inhalées et locales), et pendant les 3 mois suivant l’arrêt de la corticothérapie : risque de maladie vaccinale généralisée éventuellement mortelle,
· si vous êtes allergique à l’hémisuccinate de méthylprednisolone ou à l’un des autres composants contenus dans ce médicament, mentionnés dans la rubrique 6,
· en administration par voie intrathécale et épidurale,
· troubles de la coagulation ou traitement anticoagulant en cours, en cas d'injection intramusculaire.
EN CAS DE DOUTE, IL EST INDISPENSABLE DE DEMANDER L’AVIS DE VOTRE MEDECIN OU DE VOTRE PHARMACIEN.
Avertissements et précautions
Adressez-vous à votre médecin, pharmacien ou votre infirmier/ère avant d’utiliser SOLU-MEDROL 40 mg/1 mL, poudre et solvant pour solution injectable.
Ce médicament doit être pris sous stricte surveillance médicale.
AVANT LE TRAITEMENT
Prévenez votre médecin en cas de :
· allergie,
· vaccination récente,
· ulcère digestif, maladies du côlon, intervention chirurgicale récente au niveau de l'intestin,
· diabète,
· hypertension artérielle, insuffisance cardiaque congestive ou facteurs de risque cardiovasculaire,
· infection (notamment antécédents de tuberculose) ou en cas de séjour dans les régions tropicales, subtropicales ou du sud de l'Europe, en raison du risque de maladie parasitaire,
· insuffisance hépatique,
· insuffisance rénale,
· sclérodermie (également connue sous le nom de sclérodermie systémique, une maladie auto-immune), car le risque d’une complication grave appelée crise rénale sclérodermique peut être augmenté,
· ostéoporose,
· myasthénie grave (maladie des muscles avec fatigue musculaire),
· troubles convulsifs,
· stress inhabituel,
· maladie de Cushing,
· hypothyroïdie,
· hyperactivité de la glande thyroïde (hyperthyroïdie),
· herpès oculaire,
· phéochromocytome (tumeur généralement bénigne caractérisée par une production excessive d’hormones pouvant notamment provoquer une hypertension artérielle).
Un syndrome de lyse tumorale peut apparaître lorsque des corticostéroïdes sont utilisés pendant le traitement d'un cancer. Prévenez votre médecin si vous avez un cancer et si vous présentez des symptômes du syndrome de lyse tumorale tels que des crampes musculaires, une faiblesse musculaire, de la confusion mentale, des battements de cœur irréguliers, une perte de la vision ou des troubles visuels et un essoufflement.
PENDANT LE TRAITEMENT
Prévenez votre médecin en cas d’apparition de :
· symptômes psychologiques ou psychiatriques en particulier en cas de suspicion de dépression ou d’idées suicidaires,
· manifestations cutanées (sarcome de Kaposi),
· troubles oculaires,
· troubles du rythme cardiaque,
· troubles musculaires.
Ce médicament doit être évité en association avec l’aspirine (acide acétylsalicylique) à hautes doses, avec le mifamurtide ou avec certains médicaments appelés inhibiteurs puissants du cytochrome CYP3A4, enzyme hépatique chargée du métabolisme des médicaments (voir la rubrique « Autres médicaments et SOLU-MEDROL 40 mg/1 mL, poudre et solvant pour solution injectable »).
Contactez votre médecin en cas de vision floue ou d'autres troubles visuels.
Les anticoagulants oraux (médicaments pris par voie orale pour prévenir la coagulation sanguine) s’ils sont utilisés en association avec SOLU-MEDROL, peuvent augmenter le risque de saignement. Dans certains cas, leur effet peut également être réduit. Votre médecin devra surveiller régulièrement votre risque de saignement en effectuant des analyses sanguines supplémentaires pendant votre traitement par SOLU-MEDROL. Il pourra également ajuster votre dose de SOLU-MEDROL si nécessaire.
Les corticoïdes oraux ou injectables peuvent favoriser l'apparition de tendinopathie, voire de rupture tendineuse (exceptionnelle). Prévenir votre médecin en cas d'apparition de douleur tendineuse.
Pendant le traitement, votre médecin pourra vous conseiller de suivre un régime, en particulier pauvre en sel et une supplémentation en potassium.
L’utilisation prolongée des corticoïdes chez les enfants et les personnes âgées nécessite une surveillance particulière.
Le traitement par SOLU-MEDROL peut masquer certains signes d'infection, aggraver des infections existantes ou provoquer la réapparition ou l'aggravation d'anciennes infections cachées.
Votre médecin vous surveillera étroitement pour détecter toute infection et envisagera d'arrêter le traitement ou d'en réduire la dose si nécessaire.
APRES LE TRAITEMENT
L’arrêt brutal des corticoïdes peut entrainer des conséquences pouvant être fatales. Respectez toujours les indications de votre médecin.
Eviter le contact avec les sujets atteints de varicelle ou de rougeole.
Sportifs, attention ce médicament contient de la méthylprednisolone qui est inscrite sur la liste des substances dopantes.
Enfants
Autres médicaments et SOLU-MEDROL 40 mg/1 mL, poudre et solvant pour solution injectable
Chez des patients recevant de fortes doses ou des doses prolongées de corticoïdes, les vaccins vivants ou vivants atténués (vaccins contre la fièvre jaune, la tuberculose, le rotavirus, la rougeole, les oreillons, la rubéole, la varicelle, le zona, la grippe), NE DOIVENT PAS ETRE ADMINISTRES en raison d’un risque de maladie vaccinale généralisée éventuellement mortelle.
SOLU-MEDROL EST DECONSEILLE en association avec :
· l’acide acétylsalicylique (Aspirine) aux doses anti-inflammatoires,
· le mifamurtide (médicament indiqué dans le traitement du cancer des os),
· certains médicaments appelés inhibiteurs puissants du cytochrome CYP3A4 (enzyme hépatique chargée du métabolisme des médicaments).
Il existe d'autres médicaments qui, associés à SOLU-MEDROL, peuvent être nocifs ou affecter son mode d’action, tels que ceux mentionnés ci-dessous :
· Antibiotiques (médicaments utilisés pour traiter les infections causées par des bactéries) – tels que l’isoniazide, la clarithromycine, l’érythromycine, la troléandomycine, les fluoroquinolones ;
· Anticancéreux (médicaments utilisés pour traiter le cancer) – notamment l’interféron alpha, l’aminoglutéthimide ;
· Anticoagulants oraux (médicaments pris par voie orale, utilisés en prévention de la coagulation sanguine) – tels que l’acide acétylsalicylique, l’acénocoumarol, l’apixaban, le dabigatran, la fluindione, la phénindione, le rivaroxaban, la warfarine, les héparines, les anti-inflammatoires non stéroïdiens ;
· Antiépileptiques (médicaments utilisés pour traiter ou prévenir les crises d’épilepsie) – tels que la carbamazépine, le phénobarbital, la phénytoïne, la primidone, la fosphénitoine ;
· Antidiabétiques (médicaments utilisés pour traiter l’hyperglycémie) – tels que l’insuline et les antidiabétiques oraux. Votre médecin pourrait avoir besoin d’ajuster la dose de votre traitement antidiabétique ;
· Antiémétiques (médicaments utilisés pour prévenir et/ou traiter les nausées et les vomissements) – tels que l’aprépitant, le fosaprépitant ;
· Antifongiques (médicaments utilisés dans les infectons causées par les champignons) – tels que l’itraconazole, le kétoconazole ;
· Antituberculeux (médicaments utilisés dans le traitement de la tuberculose, une infection qui affecte les poumons et les autres organes) – tels que la rifampicine, l’isoniazide ;
· Antiviraux (médicaments utilisés pour traiter les infections causées par des virus) – tels que l’indinavir, le ritonavir ;
· Ciclosporine (médicament utilisé pour traiter les affections telles que la polyarthrite rhumatoïde sévère, le psoriasis sévère ou après une transplantation d'organe ou de moelle osseuse) – Si vous utilisez ce médicament en même temps que SOLU-MEDROL, les effets secondaires des deux médicaments peuvent augmenter ;
· Cobicistat (médicament utilisé pour traiter l'infection par le VIH) ;
· Contraceptifs oraux (médicaments utilisés pour prévenir les grossesses) – tels que l'éthinylestradiol, la noréthindrone ;
· Curares (médicaments qui bloquent les signaux entre les nerfs et les muscles et qui sont donc utilisés lors de certaines interventions chirurgicales) – tels que le pancuronium et le vécuronium. Des effets sur les muscles (myopathie aiguë) peuvent survenir si de fortes doses de SOLU-MEDROL sont utilisées en même temps que ce type de médicament ;
· Immunosuppresseurs (médicaments qui inhibent le système immunitaire et qui sont utilisés pour traiter des affections telles que la polyarthrite rhumatoïde sévère, le psoriasis sévère ou à la suite d'une greffe d'organe ou de moelle osseuse) – tels que la cyclosporine, le cyclophosphamide, le tacrolimus. Si vous utilisez ce médicament en même temps que SOLU-MEDROL, les effets secondaires des deux médicaments peuvent augmenter ;
· Jus de pamplemousse ;
· Médicaments qui réduisent le taux de potassium dans le sang – notamment les diurétiques hypokaliémiants (seuls ou en association), les laxatifs stimulants, certains corticostéroïdes, le tétracosactide et l'amphotéricine B (en injection dans la veine). Les diurétiques hypokaliémiants (seuls ou en association), les laxatifs qui augmentent les mouvements des intestins et l'amphotéricine B (en injection dans la veine) peuvent augmenter le risque de taux élevés de potassium dans le sang ;
· Médicaments utilisés pour traiter les problèmes cardiaques ou l'hypertension artérielle – notamment les inhibiteurs calciques (comme le diltiazem) et la digitaline (digoxine).
Informez votre médecin ou votre pharmacien si vous prenez, avez récemment pris ou pourriez prendre tout autre médicament, y compris des médicaments délivrés sur ordonnance ou en vente libre, des vitamines et des suppléments à base de plantes.
Sans objet.
Grossesse, allaitement et fertilité
Grossesse
Ce médicament ne sera utilisé pendant la grossesse qu'en cas de nécessité. Si vous découvrez que vous êtes enceinte pendant le traitement, consultez votre médecin car lui seul peut juger de la nécessité de poursuivre ce traitement.
Allaitement
Si vous êtes enceinte ou que vous allaitez, si vous pensez être enceinte ou planifiez une grossesse, demandez conseil à votre médecin ou pharmacien avant de prendre ce médicament.
Fertilité
Aucune donnée ne prouve que les corticostéroïdes altèrent la fertilité.
Conduite de véhicules et utilisation de machines
La prise de ce médicament peut entraîner des étourdissements, des vertiges, des troubles visuels et une fatigue. Evitez de conduire des véhicules ou d’utiliser des machines en cas d’apparition de ces symptômes.
SOLU-MEDROL 40 mg/1 mL, poudre et solvant pour solution injectable contient du sodium
Ce médicament contient moins de 1 mmol (23 mg) de sodium par flacon, c’est-à-dire qu’il est essentiellement « sans sodium ».
3. COMMENT UTILISER SOLU-MEDROL 40 mg/1 ml, poudre et solvant pour solution injectable ?
Veillez à toujours utiliser ce médicament en suivant exactement les indications de votre médecin. Vérifiez auprès de votre médecin en cas de doute.
Posologie
La dose à utiliser est déterminée par votre médecin, en fonction de votre poids et de la maladie traitée.
Elle est strictement individuelle.
Votre médecin vous injectera la dose la plus faible pendant la durée la plus courte possible pour obtenir un soulagement efficace de vos symptômes.
Mode et voie d’administration
VOIE INTRAVEINEUSE (en injection directe lente ou en perfusion) OU INTRAMUSCULAIRE.
La reconstitution de la solution à administrer est obtenue en suivant les instructions détaillées à la fin de cette notice (Instructions destinées aux professionnels de santé).
Durée du traitement
Elle est déterminée par votre médecin.
Si vous avez utilisé plus de SOLU-MEDROL 40 mg/1 mL, poudre et solvant pour solution injectable que vous n’auriez dû
Si vous pensez avoir reçu trop d'injections de SOLU-MEDROL, veuillez en parler immédiatement à votre médecin.
Si vous oubliez d’utiliser SOLU-MEDROL 40 mg/1 mL, poudre et solvant pour solution injectable
Sans objet.
Si vous arrêtez d’utiliser SOLU-MEDROL 40 mg/1 mL, poudre et solvant pour solution injectable
Votre médecin décidera quand il sera temps d'arrêter votre traitement. Vous devrez arrêter ce médicament lentement pour éviter des symptômes de sevrage.
Votre médecin décidera du moment où vous devrez passer à un traitement oral.
Si vous avez d’autres questions sur l’utilisation de ce médicament, demandez plus d’informations à votre médecin, à votre pharmacien ou à votre infirmier/ère.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Ce médicament, indispensable est le plus souvent bien toléré lorsque les recommandations données par votre médecin sont suivies (voir « Avertissements et précautions »).
Il peut néanmoins entraîner, selon la dose et la durée du traitement, des effets plus ou moins gênants.
Les effets indésirables suivants ont été rapportés avec une fréquence indéterminée :
· infection opportuniste, infection, inflammation du péritoine,
· augmentation des globules blancs (leucocytose),
· coagulation sanguine augmentée,
· signes d’origine médicamenteuse liés à un excès de sécrétion de corticoïdes (Cushingoïde), tels que : obésité de la partie supérieure du corps ou visage bouffi, insuffisance de sécrétion des hormones de l’hypophyse (glande du cerveau), syndrome de sevrage,
· acidose métabolique, accumulation de tissus adipeux sur des parties localisées du corps (lipomatose), rétention hydrosodée, diminution de l’acidité du sang entrainant une baisse du taux de potassium sanguin (alcalose hypokaliémique), anomalie du bilan lipidique (taux sanguin des lipides), troubles de la tolérance au glucose, besoin croissant d'insuline ou d’hypoglycémiants oraux chez les diabétiques, perte accrue de protéines par l’organisme, augmentation des taux d’acide urique dans le sang, augmentation de l’appétit (pouvant entraîner une prise de poids),
· troubles affectifs (humeur dépressive, humeur euphorique, labilité, dépendance aux drogues et idées suicidaires), troubles psychotiques (manie, illusion, hallucination, schizophrénie), troubles mentaux, changement de personnalité, état confusionnel, anxiété, sautes d’humeur, comportement anormal, insomnie, irritabilité,
· lipomatose épidurale, augmentation anormalement importante de la pression à l’intérieur du crâne (avec œdème au niveau du nerf optique), convulsions, amnésie, détérioration des processus mentaux de la mémoire, du jugement, de la compréhension, et du raisonnement (troubles cognitifs), étourdissements, maux de tête,
· maladie affectant la rétine et de la membrane choroïde (choriorétinopathie), cataracte (opacification du cristallin), globe oculaire saillant (exophtalmie), vision floue,
· vertige,
· insuffisance cardiaque congestive (chez les patients à risque), troubles du rythme cardiaque, augmentation du volume du muscle cardiaque chez les nourrissons prématurés,
· thrombose, hypertension, hypotension, chaleur et rougeur de la peau (bouffées congestives),
· embolie pulmonaire, hoquets,
· ulcère digestif avec éventuellement perforation et hémorragie intestinale, hémorragie digestive, inflammation du pancréas, inflammation du péritoine, inflammation de l’œsophage (pouvant être accompagnée de lésions ulcéreuses), distension abdominale, douleur abdominale, diarrhée, digestion difficile, nausée,
· hépatite,
· brusque gonflement du visage et du cou d’origine allergique (œdème de Quincke), développement exagéré du système pileux chez la femme (hirsutisme), petites taches rouges violacées sur la peau (pétéchies), bleus sur la peau (ecchymoses), fragilisation de la peau (atrophie cutanée), rougeur de la peau (érythème), production excessive de sueur (hyperhidrose), vergetures, éruption cutanée (rash), démangeaisons (prurit), urticaire, acné, coloration moins forte de la peau,
· faiblesse musculaire, douleurs musculaires (myalgie), maladie des muscles (myopathie), diminution de la musculature (atrophie musculaire), fragilisation osseuse (ostéoporose), destruction des cellules osseuses (ostéonécrose), fracture, maladie des articulations d’origine nerveuse, douleurs articulaires, retard de croissance,
· règles irrégulières,
· retard de cicatrisation, gonflement des membres dû à l’accumulation de liquide (œdème périphérique), fatigue, malaise, réaction au site d’injection,
· augmentation de la quantité de calcium dans les urines, diminution de la quantité de potassium dans le sang, diminution de la tolérance aux sucres, augmentation de la pression à l’intérieur de l’œil, augmentation des enzymes du foie, augmentation des taux d’acide urique dans le sang, suppression des réactions aux tests cutanés,
· fracture due à la compression de la moelle épinière, rupture du tendon.
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin, votre pharmacien ou à votre infirmier/ère. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/.
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER SOLU-MEDROL 40 mg/1 mL, poudre et solvant pour solution injectable ?
Tenir ce médicament hors de la vue et de la portée des enfants.
N’utilisez pas ce médicament après la date de péremption indiquée sur l’emballage.
Avant reconstitution : ce médicament ne nécessite pas de précautions particulières de conservation.
Après reconstitution avec le solvant : ce médicament conservé à une température ne dépassant pas 25 °C doit être utilisé immédiatement. Dans le cas contraire, la durée et les conditions de conservation avant utilisation sont de la responsabilité de l’utilisateur et ne devront pas dépasser 24 h entre 2 °C et 8 °C sauf si la reconstitution a été réalisée dans des conditions d’asepsie validées.
Après reconstitution avec le solvant puis dilution pour perfusion : La solution reconstituée puis diluée pour perfusion doit être utilisée dans les 3 heures après reconstitution si conservée entre 20 °C et 25 °C ou dans les 24 heures après reconstitution si conservée entre 2 °C et 8 °C.
N’utilisez pas ce médicament si vous remarquez des signes visibles de détérioration.
Ne jetez aucun médicament au tout-à-l'égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l'environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient SOLU-MEDROL 40 mg/1 mL, poudre et solvant pour solution injectable
· La substance active est :
Hémisuccinate de méthylprednisolone ......................................................................... 50,70 mg
Quantité correspondant en méthylprednisolone base .................................................... 40,00 mg
Pour un flacon bi-compartimenté.
· Les autres composants sont :
Poudre :
Phosphate monosodique monohydraté, phosphate disodique anhydre, solution d'hydroxyde de sodium à 10 %, saccharose.
Solvant :
Eau pour préparations injectables.
Ce médicament se présente sous forme de poudre et solvant pour solution injectable.
La poudre lyophilisée est de couleur blanc à blanc cassé.
Le solvant est clair et incolore.
Boîte de 1 flacon bi-compartimenté.
Titulaire de l’autorisation de mise sur le marché
23-25, AVENUE DU DOCTEUR LANNELONGUE
75014 PARIS
Exploitant de l’autorisation de mise sur le marché
23-25, AVENUE DU DOCTEUR LANNELONGUE
75014 PARIS
PFIZER MANUFACTURING BELGIUM NV
RIJKSWEG 12
2870 PUURS-SINT-AMANDS
BELGIQUE
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Sans objet.
La dernière date à laquelle cette notice a été révisée est :
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).
Les informations suivantes sont destinées exclusivement aux professionnels de santé :
SOLU-MEDROL est présenté sous forme de flacon bi-compartimenté en verre.
Les deux compartiments sont séparés par un joint central en caoutchouc. Le compartiment inférieur contient la poudre et le compartiment supérieur contient le solvant (eau pour préparation injectable).
La reconstitution de la solution à administrer est obtenue en suivant les instructions ci-dessous :
ATTENTION : Il est impératif de ne pas insérer l’aiguille dans le bouchon en caoutchouc avant l’étape 5.
|
|
1. Placer les doigts de part et d’autre de l’opercule situé au centre du bouchon et exercer une forte pression verticale vers le bas jusqu’à enclenchement. Le joint en caoutchouc tombe et le solvant s’écoule dans le compartiment inférieur contenant la poudre. Il faut éviter d’appliquer une pression excessive car cela peut casser le flacon et potentiellement blesser l’utilisateur.
|
|
|
2. Agiter doucement par retournement pour dissoudre la poudre. |
|
|
3. Soulever et retirer l’opercule au centre du bouchon. |
|
|
4. Désinfecter le dessus du bouchon en caoutchouc avec un agent antiseptique. |
|
|
5. Insérer l'aiguille perpendiculairement au centre du bouchon en caoutchouc de façon que la pointe de l'aiguille soit tout juste visible. Renverser le flacon et effectuer le prélèvement. |
Ce médicament est administré par voie parentérale. De ce fait, la solution doit être inspectée visuellement avant administration pour détecter l’apparition de particules ou une éventuelle décoloration.
Le prélèvement de la solution doit s’effectuer à l’aide d’une seringue munie d’une aiguille d’un calibre équivalent à 21 gauge afin d’éviter la survenue de problèmes liés à des particules du bouchon en caoutchouc.