
ENOXAPARINE BIOGARAN 8000 UI (80 mg)/0,8 mL, solution injectable en seringue préremplie - Résumé des caractéristiques du produit |
 |
|
ANSM - Mis à jour le : 01/04/2022
![]() Ce médicament fait l’objet d’une surveillance supplémentaire qui permettra l’identification rapide de nouvelles informations relatives à la sécurité. Les professionnels de la santé déclarent tout effet indésirable suspecté. Voir rubrique 4.8 pour les modalités de déclaration des effets indésirables.
Ce médicament fait l’objet d’une surveillance supplémentaire qui permettra l’identification rapide de nouvelles informations relatives à la sécurité. Les professionnels de la santé déclarent tout effet indésirable suspecté. Voir rubrique 4.8 pour les modalités de déclaration des effets indésirables.
ENOXAPARINE BIOGARAN® 8 000 UI (80 mg)/0,8 mL, solution injectable en seringue préremplie
2. COMPOSITION QUALITATIVE ET QUANTITATIVE 
Seringues préremplies :
8 000 UI (80 mg)/0,8 mL
Chaque seringue préremplie contient 8 000 UI d’activité anti-Xa (correspondant à 80 mg) d’énoxaparine sodique dans 0,8 mL d’eau pour préparations injectables.
Pour la liste complète des excipients, voir rubrique 6.1.
L’énoxaparine sodique est une substance biologique obtenue par dépolymérisation alcaline d’ester benzylique d’héparine dérivé de la muqueuse intestinale porcine.
Solution injectable en seringue préremplie.
Liquide transparent incolore ou jaune clair, le pH de la solution se situe entre 5,5 et 7,5.
4.1. Indications thérapeutiques 
ENOXAPARINE BIOGARAN® est indiqué chez l’adulte dans :
· Le traitement prophylactique de la maladie thromboembolique veineuse en chirurgie à risque modéré et élevé, en particulier en chirurgie orthopédique ou générale, dont la chirurgie oncologique.
· Le traitement prophylactique de la maladie thromboembolique veineuse chez les patients atteints d’une affection médicale aiguë (telle qu‘insuffisance cardiaque aiguë, insuffisance respiratoire, infections sévères ou maladies rhumatismales) et dont la mobilité est réduite, à risque thromboembolique veineux augmenté.
· Le traitement de la thrombose veineuse profonde (TVP) et de l’embolie pulmonaire (EP), à l’exclusion de l’EP susceptible de relever d’un traitement thrombolytique ou chirurgical.
· Le traitement prolongé de la thrombose veineuse profonde (TVP) et de l'embolie pulmonaire (EP) et la prévention de leur(s) récidive(s) chez les patients atteints d'un cancer actif.
· La prévention de la formation d’un thrombus dans le circuit de circulation extracorporelle au cours de l’hémodialyse.
· Le syndrome coronaire aigu :
o Traitement de l’angor instable et de l’infarctus du myocarde sans élévation du segment ST (NSTEMI), administré en association avec l’acide acétylsalicylique par voie orale.
o Traitement de l’infarctus du myocarde aigu avec élévation du segment ST (STEMI), incluant les patients éligibles à un traitement médical ou à une intervention coronaire percutanée (ICP) secondaire.
4.2. Posologie et mode d'administration 
Traitement prophylactique de la maladie thromboembolique veineuse en chirurgie à risque modéré et élevé
Le risque thromboembolique individuel pour chaque patient peut être estimé à l’aide d’un modèle de stratification du risque validé.
· Chez les patients à risque thromboembolique modéré, la dose recommandée d’énoxaparine sodique est de 2 000 UI (20 mg) une fois par jour par injection SC. L’administration préopératoire (2 heures avant l’intervention chirurgicale) de 2 000 UI (20 mg) d’énoxaparine sodique s’est révélée être efficace et sûre en chirurgie à risque modéré.
Chez les patients à risque modéré, le traitement par énoxaparine sodique doit être maintenu pendant une période minimale de 7 à 10 jours, quel que soit le statut de rétablissement du patient (par ex., mobilité). Le traitement prophylactique doit être poursuivi tant que le patient est en mobilité significativement réduite.
· Chez les patients à risque thromboembolique élevé, la dose recommandée d’énoxaparine sodique est de 4 000 UI (40 mg) une fois par jour administrée par injection SC. Le traitement doit de préférence être initié 12 heures avant l’intervention chirurgicale. S’il est nécessaire d’instaurer le traitement prophylactique préopératoire par énoxaparine sodique plus de 12 heures avant l’intervention chirurgicale (par ex., patient à risque élevé en attente d’une intervention chirurgicale orthopédique différée), la dernière injection doit être administrée au plus tard 12 heures avant l’intervention chirurgicale et le traitement doit être repris 12 heures après l’intervention chirurgicale.
o Pour les patients faisant l’objet d’une intervention chirurgicale orthopédique majeure, il est recommandé de prolonger le traitement thromboprophylactique jusqu’à 5 semaines.
o Pour les patients à risque thromboembolique veineux élevé (TEV) faisant l’objet d’une intervention chirurgicale abdominale ou pelvienne pour un cancer, il est recommandé de prolonger le traitement thromboprophylactique jusqu’à 4 semaines.
Traitement prophylactique de la maladie thromboembolique veineuse chez les patients atteints d’une affection médicale aiguë
La dose recommandée d’énoxaparine sodique est de 4 000 UI (40 mg) une fois par jour par injection SC. Le traitement par énoxaparine sodique est prescrit pendant au moins 6 à 14 jours, quel que soit le degré de rétablissement du patient (par ex : mobilité). Le bénéfice n’est pas établi pour un traitement au-delà de 14 jours.
Traitement de la TVP et de l’EP
L’énoxaparine sodique peut être administrée par voie SC soit en une injection de 150 UI/kg (1,5 mg/kg) une fois par jour, soit en une injection de 100 UI/kg (1 mg/kg) deux fois par jour.
Le schéma thérapeutique doit être sélectionné par le médecin en fonction d’une évaluation individuelle incluant l’évaluation du risque thromboembolique et du risque hémorragique. Le schéma posologique de 150 UI/kg (1,5 mg/kg) administré une fois par jour doit être utilisé chez les patients sans complications présentant un faible risque de récidive d’événement thromboembolique. Le schéma posologique de 100 UI/kg (1 mg/kg) administré deux fois par jour doit être utilisé pour tous les autres patients, tels que les patients obèses, présentant une EP symptomatique, un cancer, une récidive d’événement thromboembolique ou une thrombose veineuse proximale (veine iliaque).
Le traitement par énoxaparine sodique est prescrit pour une durée moyenne de 10 jours. Un traitement anticoagulant oral doit être instauré quand cela est approprié (voir « Relais entre l’énoxaparine sodique et les anticoagulants oraux » à la fin de la rubrique 4.2).
La dose recommandée est de 100 UI / kg (1 mg / kg) administrée deux fois par jour par voie SC pendant 5 à 10 jours, suivie d'une injection SC de 150 UI / kg (1,5 mg / kg) une fois par jour jusqu'à 6 mois. Le bénéfice d'un traitement anticoagulant continu devra être réévalué après 6 mois de traitement.
Prévention de la formation d’un thrombus dans le circuit de circulation extracorporelle au cours de l’hémodialyse.
La dose recommandée est de 100 UI/kg (1 mg/kg) d’énoxaparine sodique.
Pour les patients à risque hémorragique élevé, la dose doit être réduite à 50 UI/kg (0,5 mg/kg) pour un abord vasculaire double ou à 75 UI/kg (0,75 mg/kg) pour un abord vasculaire simple.
Pendant l’hémodialyse, l’énoxaparine sodique doit être introduite dans la ligne artérielle du circuit au début de la séance de dialyse. L’effet de cette dose est généralement suffisant pour une séance de 4 heures ; cependant, si des anneaux de fibrine sont décelés, par exemple après une séance plus longue que d’habitude, il est possible d’administrer une dose supplémentaire de 50 UI à 100 UI/kg (0,5 à 1 mg/kg).
Aucune donnée n’est disponible chez les patients utilisant l’énoxaparine sodique pour la prophylaxie ou le traitement et durant les séances d’hémodialyse.
Syndrome coronaire aigu : traitement de l’angor instable et du NSTEMI, et traitement du STEMI aigu
· Pour le traitement de l’angor instable et du NSTEMI, la dose recommandée d’énoxaparine sodique est de 100 UI/kg (1 mg/kg) toutes les 12 heures par injection SC administrée en association avec un traitement antiplaquettaire. Le traitement doit être maintenu pendant au moins 2 jours, puis doit être poursuivi jusqu’à stabilisation clinique. La durée habituelle du traitement est de 2 à 8 jours.
L’acide acétylsalicylique est recommandé pour tous les patients sans contre-indications à une dose de charge initiale de 150 à 300 mg (chez les patients naïfs d’acide acétylsalicylique) et à une dose d’entretien de 75 à 325 mg/jour au long cours, quelle que soit la stratégie de traitement.
· Pour le traitement d’un STEMI aigu, la dose recommandée d’énoxaparine sodique est un bolus intraveineux (IV) unique de 3 000 UI (30 mg) suivie immédiatement d’une dose SC de 100 UI/kg (1 mg/kg), puis par une dose de 100 UI/kg (1 mg/kg) administrée par voie SC toutes les 12 heures (avec un maximum de 10 000 UI [100 mg] pour chacune des deux premières doses SC). Le traitement antiplaquettaire approprié, tel que l’acide acétylsalicylique par voie orale (75 mg à 325 mg une fois par jour) doit être administré concomitamment, sauf en cas de contre-indication. La durée de traitement recommandée est de 8 jours, ou jusqu’à la sortie de l’hôpital, selon la première occurrence. Lorsqu’elle est administrée conjointement avec un agent thrombolytique (spécifique de la fibrine ou non spécifique de la fibrine), l’énoxaparine sodique doit être administrée entre 15 minutes avant et 30 minutes après le début du traitement fibrinolytique.
o Posologie chez les patients âgés de 75 ans ou plus, voir le paragraphe « patients âgés ».
o Pour les patients pris en charge par une ICP, si la dernière dose d’énoxaparine sodique SC a été administrée moins de 8 heures avant l’inflation du ballonnet, il n’est pas nécessaire d’administrer une dose supplémentaire. Si la dernière administration SC a eu lieu plus de 8 heures avant l’inflation du ballonnet, un bolus IV de 30 UI/kg (0,3 mg/kg) d’énoxaparine sodique doit être administré.
Population pédiatrique
La sécurité d’emploi et l’efficacité de l’énoxaparine sodique n’ont pas été établies dans la population pédiatrique.
Patients âgés
Pour toutes les indications, à l’exception du STEMI, aucune diminution de la dose n’est nécessaire chez les patients âgés, sauf si la fonction rénale est altérée (voir ci-dessous « insuffisance rénale » et la rubrique 4.4).
Pour le traitement d’un STEMI aigu chez les patients âgés de 75 ans ou plus, ne pas administrer le bolus IV initial. Il est recommandé de démarrer le traitement avec une dose de 75 UI/kg (0,75 mg/kg) SC toutes les 12 heures (maximum de 7500 UI [75 mg] pour les deux premières injections SC uniquement, suivies par l’administration de 75 UI/kg [0,75 mg/kg] SC pour les doses restantes). Pour une administration chez des patients âgés présentant une insuffisance rénale, voir ci-dessous le paragraphe « insuffisance rénale » et la rubrique 4.4.
Insuffisance hépatique
Les données disponibles relatives aux patients présentant une insuffisance hépatique sont limitées (voir rubriques 5.1 et 5.2) et la prudence est recommandée en cas d’utilisation chez ces patients (voir la rubrique 4.4).
Insuffisance rénale (voir les rubriques 4.4 et 5.2)
· Insuffisance rénale sévère
En raison du manque de données dans cette population, l’énoxaparine sodique n’est pas recommandée chez les patients présentant une insuffisance rénale terminale (clairance de la créatinine < 15 mL/min) mis à part lors de la prévention de la formation d’un thrombus dans le circuit de circulation extracorporelle au cours de l’hémodialyse.
Tableau de la posologie pour les patients présentant une insuffisance rénale sévère (clairance de la créatinine [15 à 30] mL/min) :
|
Indication |
Schéma posologique |
|
Prophylaxie de la maladie thromboembolique veineuse |
2 000 UI (20 mg) SC une fois par jour |
|
Traitement de la TVP et de l’EP |
100 UI/kg (1 mg/kg) SC une fois par jour |
|
Traitement prolongé de la TVP et de l’EP chez les patients atteints d'un cancer actif |
100 UI/kg (1 mg/kg) SC une fois par jour |
|
Traitement de l’angor instable et du NSTEMI |
100 UI/kg (1 mg/kg) SC une fois par jour |
|
Traitement du STEMI aigu (patients âgés de moins de 75 ans) |
Bolus IV de 1 x 3 000 UI (30 mg) suivi immédiatement de 100 UI/kg (1 mg/kg) SC, puis 100 UI/kg (1 mg/kg) SC toutes les 24 heures |
|
Traitement du STEMI aigu (patients âgés de plus de 75 ans) |
Pas de bolus IV initial, 100 UI/kg (1 mg/kg) SC, puis 100 UI/Kg (1 mg/kg) SC toutes les 24 heures |
Les ajustements posologiques recommandés ne s’appliquent pas à l’indication d’hémodialyse.
· Insuffisance rénale modérée et légère
Même si aucun ajustement posologique n’est recommandé chez les patients atteints d’insuffisance rénale modérée (clairance de la créatinine de 30 à 50 mL/min) et légère (clairance de la créatinine de 50 à 80 mL/min), il est conseillé de mettre en place une surveillance clinique étroite.
Mode d’administration
ENOXAPARINE BIOGARAN® ne doit pas être administré par voie intramusculaire.
Pour le traitement prophylactique de la maladie thromboembolique faisant suite à une intervention chirurgicale, le traitement de la TVP et de l’EP, le traitement prolongé de la TVP et de l'EP chez les patients atteints d'un cancer actif, le traitement de l’angor instable et du NSTEMI, l’énoxaparine sodique doit être administré par injection SC.
· Dans le cas d’un STEMI aigu, le traitement doit être instauré par une injection bolus IV unique, immédiatement suivie d’une injection SC.
· Pour la prévention de la formation d’un thrombus dans le circuit de circulation extracorporelle au cours de l’hémodialyse, l’énoxaparine est administrée à travers la ligne artérielle du circuit de dialyse.
La seringue préremplie jetable est prête à l’emploi.
· Technique d’injection SC :
Il est préférable de pratiquer l’injection lorsque le patient est allongé. L’énoxaparine sodique est administrée par injection SC profonde.
En cas d’utilisation de seringues préremplies, ne pas expulser la bulle d’air de la seringue avant l’injection afin d’éviter la perte d’une quantité de médicament. Lorsque la quantité de médicament à injecter nécessite d’être ajustée en fonction du poids corporel du patient, utiliser les seringues préremplies graduées permettant d’atteindre le volume requis, en éliminant l’excédent avant l’injection. Dans certains cas, il n’est pas possible d’atteindre la dose exacte en raison des graduations sur la seringue ; le volume doit alors être arrondi à la graduation la plus proche.
L’administration doit se faire dans la paroi abdominale antérolatérale ou postérolatérale alternativement à droite ou à gauche.
L’aiguille doit être introduite verticalement dans un pli cutané pincé entre le pouce et l’index sur toute sa longueur. Le pli cutané doit être maintenu pendant toute la durée de l’injection. Ne pas frotter le site d’injection après administration.
Pour les seringues préremplies équipées d’un système de sécurité: Le système de sécurité est activé manuellement à la fin de l'injection (voir les instructions à la rubrique 6.6).
En cas d’auto-administration, il convient de recommander au patient de suivre les instructions fournies dans la notice d’information destinée au patient incluse dans la boîte de ce médicament.
· Injection par voie IV (bolus) (uniquement pour l’indication de STEMI aigu) :
Dans le cas d’un STEMI aigu, le traitement doit être instauré par une injection bolus IV unique, immédiatement suivie d’une injection SC.
Pour l’injection IV, il est possible d’utiliser soit le flacon multidose, soit une seringue préremplie.
L’énoxaparine sodique doit être administrée par une voie veineuse. Elle ne doit pas être mélangée ou administrée concomitamment avec d’autres médicaments. Afin d’éviter l’éventuel mélange de l’énoxaparine sodique avec d’autres médicaments, l’accès IV choisi doit être rincé avec une quantité suffisante de solution saline ou de solution de glucose avant et après l’administration du bolus IV d’énoxaparine sodique, afin de nettoyer le dispositif d’administration du médicament. L’énoxaparine sodique peut être administrée en toute sécurité avec une solution saline normale (0,9 %) ou du glucose à 5 % dans de l’eau.
o Bolus initial de 3 000 UI (30 mg)
Pour le bolus initial de 3 000 UI (30 mg), à l’aide d’une seringue préremplie d’énoxaparine sodique graduée, expulser le volume en excès pour ne conserver que 3 000 UI (30 mg) dans la seringue. La dose de 3 000 UI (30 mg) peut être directement injectée dans la voie veineuse.
o Bolus supplémentaire en cas d’ICP, lorsque la dernière administration SC a été pratiquée plus de 8 heures avant l’inflation du ballonnet.
Pour les patients pris en charge par une ICP, un bolus IV supplémentaire de 30 UI/kg (0,3 mg/kg) doit être administré si la dernière administration SC a été pratiquée plus de 8 heures avant l’inflation du ballonnet.
Afin de garantir l’exactitude du petit volume à injecter, il est recommandé de diluer le médicament jusqu’à 300 UI/mL (3 mg/mL).
Pour obtenir une solution de 300 UI/mL (3 mg), il est recommandé d’utiliser une seringue préremplie de 6 000 UI (60 mg) d’énoxaparine sodique et une poche de perfusion de 50 mL (c’est-à-dire, en utilisant soit une solution saline normale [0,9 %] soit du glucose à 5 % dans de l’eau) de la façon suivante :
Prélever 30 mL de la poche de perfusion avec une seringue, puis éliminer le liquide. Injecter l’intégralité du contenu de la seringue préremplie de 6 000 UI (60 mg) d’énoxaparine sodique dans les 20 mL restant dans la poche. Mélanger délicatement le contenu de la poche. Prélever le volume requis de solution diluée avec une seringue et administrer dans la voie veineuse.
Lorsque la dilution est terminée, le volume à injecter peut être calculé en utilisant la formule suivante [Volume de solution diluée (mL) = poids du patient (kg) x 0,1] ou en utilisant le tableau ci-dessous. Il est recommandé de préparer la dilution immédiatement avant utilisation.
Volume à injecter à travers la ligne IV une fois la dilution terminée à une concentration de 300 UI (3 mg)/mL.
|
Poids |
Dose requise 30 UI/kg (0,3 mg/kg) |
Volume à injecter après dilution jusqu’à une concentration finale de 300 UI (3 mg)/mL |
|
|
[kg] |
UI |
[mg] |
[mL] |
|
45 |
1350 |
13,5 |
4,5 |
|
50 |
1500 |
15 |
5 |
|
55 |
1650 |
16,5 |
5,5 |
|
60 |
1800 |
18 |
6 |
|
65 |
1950 |
19,5 |
6,5 |
|
70 |
2100 |
21 |
7 |
|
75 |
2250 |
22,5 |
7,5 |
|
80 |
2400 |
24 |
8 |
|
85 |
2550 |
25,5 |
8,5 |
|
90 |
2700 |
27 |
9 |
|
95 |
2850 |
28,5 |
9,5 |
|
100 |
3000 |
30 |
10 |
|
105 |
3150 |
31,5 |
10,5 |
|
110 |
3300 |
33 |
11 |
|
115 |
3450 |
34,5 |
11,5 |
|
120 |
3600 |
36 |
12 |
|
125 |
3750 |
37,5 |
12,5 |
|
130 |
3900 |
39 |
13 |
|
135 |
4050 |
40,5 |
13,5 |
|
140 |
4200 |
42 |
14 |
|
145 |
4350 |
43,5 |
14,5 |
|
150 |
4500 |
45 |
15 |
· Injection dans une ligne artérielle :
Pour la prévention de la formation d’un thrombus dans la circulation extracorporelle au cours de l’hémodialyse, il est administré via la ligne artérielle d’un circuit de dialyse.
Relais entre l’énoxaparine sodique et les anticoagulants oraux
· Relais entre l’énoxaparine sodique et les antivitamines K (AVK)
Le suivi clinique et les tests de laboratoire [temps de prothrombine exprimé par le rapport international normalisé (INR)] doivent être intensifiés pour surveiller l’effet des AVK.
Étant donné qu’il y a un intervalle de temps avant que l’AVK atteigne son effet maximal, le traitement par énoxaparine sodique doit être poursuivi à une dose constante pendant aussi longtemps que nécessaire afin de maintenir l’INR au cours de deux tests successifs dans la plage de valeurs thérapeutiques souhaitées pour l’indication.
Pour les patients en cours de traitement par AVK, l’AVK doit être interrompu et la première dose d’énoxaparine sodique doit être administrée lorsque l’INR est en dessous de la plage de valeurs thérapeutiques.
· Relais entre l’énoxaparine sodique et les anticoagulants oraux directs (AOD)
Pour les patients en cours de traitement par énoxaparine sodique, arrêter l’énoxaparine sodique et démarrer l’AOD entre 0 et 2 heures avant le moment auquel l’administration suivante d’énoxaparine sodique aurait dû avoir lieu, conformément à l’information produit de l’AOD.
Pour les patients en cours de traitement par AOD, la première dose d’énoxaparine sodique doit être administrée au moment où la dose d’AOD suivante serait prise.
Administration lors d’une rachianesthésie/péridurale ou d’une ponction lombaire
Lors d’une anesthésie/analgésie péridurale ou rachidienne ou d’une ponction lombaire, un suivi neurologique attentif est recommandé en raison du risque d’hématomes intra-rachidiens (voir rubrique 4.4).
o Aux doses utilisées pour la prophylaxie
Aux doses prophylactiques un délai sans injection d’au moins 12 heures doit être respecté entre la dernière injection d’énoxaparine sodique et la mise en place d’une aiguille ou d’un cathéter.
Pour les techniques continues, un intervalle similaire d’au moins 12 heures doit être respecté avant de retirer le cathéter.
Pour les patients dont la clairance de la créatinine est de [15 à 30] mL/min, envisager de doubler à au moins 24 heures le délai entre le moment de l’injection et la mise en place du cathéter ou son retrait.
L’instauration d’un traitement pré-opératoire par énoxaparine sodique à la dose de 2 000 UI (20 mg) 2 heures avant une rachianesthésie n’est pas compatible avec celle-ci.
o Aux doses utilisées pour le traitement
Aux doses curatives, un délai sans injection d’au moins 24 heures doit être respecté entre la dernière injection d’énoxaparine sodique et la mise en place d’une aiguille ou d’un cathéter (voir également la rubrique 4.3).
Pour les techniques continues, un délai similaire de 24 heures doit être respecté avant de retirer le cathéter.
Pour les patients dont la clairance de la créatinine est de [15 à 30] mL/min, envisager de doubler à au moins 48 heures le délai entre le moment de l’injection et la mise en place du cathéter ou son retrait.
Les patients recevant les doses biquotidiennes (c’est-à-dire, 75 UI/kg [0,75 mg/kg] deux fois par jour ou 100 UI/kg [1 mg/kg] deux fois par jour) ne doivent pas prendre la deuxième dose d’énoxaparine sodique afin de permettre un délai suffisant avant la mise en place ou le retrait d’un cathéter.
Les taux d’anti-Xa sont encore décelables à la fin des délais décrits ci-dessus et le fait de retarder ces injections n’exclut pas la survenue d’un hématome intra-rachidien.
De même, il est préférable de ne pas utiliser l’énoxaparine sodique pendant au moins 4 heures suite à une ponction rachidienne/péridurale ou après le retrait d’un cathéter. Ce délai doit se baser sur l’évaluation du rapport bénéfice-risque, en tenant compte à la fois du risque de thrombose et du risque de saignement dans le contexte de la procédure, ainsi que des facteurs de risque du patient.
L’énoxaparine sodique est contre-indiquée chez les patients présentant:
· Une l’hypersensibilité à l’énoxaparine sodique, à l’héparine ou à ses dérivés, y compris à d’autres héparines de bas poids moléculaire (HBPM), ou à l’un des excipients mentionnés dans la rubrique 6.1.
· Un antécédent de thrombopénie induite par héparine (TIH) à médiation immunitaire au cours des 100 derniers jours ou en présence d’anticorps circulants (voir également la rubrique 4.4).
· Un saignement actif cliniquement significatif ou une affection associée à un risque élevé d’hémorragie, telle qu’ un accident vasculaire cérébral hémorragique récent, un ulcère gastro-intestinal, la présence d’une tumeur maligne à risque élevé de saignement, une intervention chirurgicale récente du cerveau, du rachis ou ophtalmologique, des varices œsophagiennes connues ou suspectées, des malformations artérioveineuses, un anévrysme vasculaire ou des anomalies vasculaires intrarachidiennes ou intracérébrales majeures.
· Rachianesthésie ou anesthésie péridurale ou locorégionale lorsque l’énoxaparine sodique est utilisée pour un traitement curatif dans les 24 heures précédentes (voir rubrique 4.4).
4.4. Mises en garde spéciales et précautions d'emploi 
L’énoxaparine sodique n’est pas interchangeable (unité pour unité) avec d’autres HBPM. Ces médicaments diffèrent par leurs procédés de fabrication, leurs poids moléculaires, leurs activités anti-Xa et anti-IIa spécifiques, leurs unités, leurs posologies et leur efficacité clinique et sécurité d’emploi. Cela se traduit par des différences au niveau de leurs propriétés pharmacocinétiques et activités biologiques associées (par ex., activité antithrombine et interactions avec les plaquettes). Par conséquent, une attention particulière et un respect des règles de bon usage spécifiques à chaque médicament sont nécessaires.
· Antécédents de TIH (> 100 jours)
L’utilisation d’énoxaparine sodique chez les patients ayant des antécédents de TIH à médiation immunitaire au cours des 100 derniers jours ou en présence d’anticorps circulants est contre-indiquée (voir rubrique 4.3). Les anticorps circulants peuvent persister plusieurs années.
L’énoxaparine sodique doit être utilisée avec une extrême prudence chez les patients ayant des antécédents (> 100 jours) de thrombopénie induite par héparine sans anticorps circulants. La décision d’utiliser de l’énoxaparine sodique dans de tels cas doit être prise uniquement après une évaluation soigneuse du rapport bénéfice-risque et après avoir envisagé des alternatives thérapeutiques non hépariniques (par ex., danaparoïde sodique ou lépirudine).
· Surveillance de la numération plaquettaire
Le risque de TIH médiée par des anticorps existe également avec les HBPM. En cas de survenue de thrombopénie, elle se manifeste généralement entre le 5e et le 21e jour après le début du traitement par énoxaparine sodique.
Le risque de TIH est plus élevé chez les patients postopératoires et principalement après une intervention cardiaque ainsi que chez les patients atteints de cancer.
Il est donc recommandé de réaliser une numération plaquettaire avant l’instauration du traitement par énoxaparine sodique, puis régulièrement par la suite au cours du traitement.
En cas de symptômes cliniques suggérant une TIH (tout nouvel épisode de thromboembolie artérielle et/ou veineuse, toute lésion cutanée douloureuse au site d’injection, toute réaction allergique ou anaphylactoïde sous traitement), une numération plaquettaire doit être réalisée. Les patients doivent être informés que ces symptômes peuvent survenir et dans ce cas, ils doivent en informer leur médecin traitant.
En pratique, si une diminution significative confirmée de la numération plaquettaire est observée (30 à 50 % de la valeur initiale), le traitement par énoxaparine sodique doit être immédiatement interrompu et relayé par un autre traitement anticoagulant non héparinique.
· Hémorragie
Comme avec d’autres anticoagulants, des saignements peuvent se produire dans n’importe quel site. En cas de saignement, l’origine de l’hémorragie doit être recherchée et un traitement approprié doit être instauré.
L’énoxaparine sodique, comme tout autre anticoagulant, doit être utilisée avec prudence dans les situations associées à un risque accru de saignement telles que :
o hémostase altérée,
o antécédent d’ulcère gastroduodénal,
o accident vasculaire cérébral ischémique récent,
o hypertension artérielle sévère,
o rétinopathie diabétique récente,
o chirurgie neurologique ou ophtalmologique,
o utilisation concomitante de médicaments affectant l’hémostase (voir rubrique 4.5).
· Tests biologiques
Aux doses utilisées pour le traitement prophylactique de la maladie thromboembolique veineuse, l’énoxaparine sodique n’a pas d’influence significative sur le temps de saignement, les tests de coagulation sanguine globale, l’agrégation plaquettaire et sur la liaison du fibrinogène aux plaquettes.
À des doses plus élevées, des augmentations du temps de céphaline activée (TCA) et du temps de coagulation activée (ACT) peuvent se produire. Ces augmentations du TCA et de l’ACT ne sont pas corrélées de façon linéaire avec l’augmentation de l’activité antithrombotique de l’énoxaparine sodique et, par conséquent ne permettent pas de contrôler l’activité de l’énoxaparine sodique.
· Anesthésie rachidienne/péridurale ou ponction lombaire
Les anesthésies rachidiennes/péridurales ou les ponctions lombaires ne doivent pas être pratiquées dans les 24 heures suivant l’administration d’énoxaparine sodique à des doses curatives (voir également la rubrique 4.3).
Des cas d’hématomes intrarachidiens ont été signalés lors de l’utilisation d’énoxaparine sodique lors d’une anesthésie rachidienne/péridurale ou de ponctions lombaires ayant entraîné une paralysie prolongée ou permanente. Ces événements sont rares avec les schémas posologiques d’énoxaparine sodique de 4 000 UI (40 mg) une fois par jour ou à une dose inférieure. Le risque de survenue de ces événements est plus élevé avec l’utilisation postopératoire de cathéters périduraux implantés, avec l’utilisation concomitante de traitements modifiant l’hémostase, tels que les anti-inflammatoires non stéroïdiens (AINS), en cas de procédure péridurale ou de ponction lombaire traumatique ou répétée, ou chez les patients présentant des antécédents de chirurgie rachidienne ou de malformation rachidienne.
Il faut tenir compte du profil pharmacocinétique de l’énoxaparine sodique pour réduire le risque potentiel de saignement associé à l’utilisation d’énoxaparine sodique lors d’une anesthésie/analgésie péridurale ou rachidienne ou d’une rachicentèse (voir la rubrique 5.2). La pose ou le retrait d’un cathéter péridural ou une ponction lombaire sont à réaliser de préférence lorsque l’effet anticoagulant de l’énoxaparine sodique est faible. Toutefois, le délai exact pour atteindre un effet anticoagulant suffisamment faible chez chaque patient n’est pas connu. Pour les patients présentant une clairance de la créatinine de [15 à 30 mL/minute], d’autres paramètres doivent être pris en compte, en raison d’une élimination plus lente de l’énoxaparine sodique (voir la rubrique 4.2).
Si le traitement anticoagulant est administré dans le cadre d’une anesthésie/analgésie péridurale ou rachidienne ou d’une ponction lombaire, un suivi fréquent doit être mis en place afin de déceler tout signe et symptôme d’une atteinte neurologique, tel qu’une douleur dorsale au niveau de la colonne vertébrale, des déficits moteurs et sensoriels (engourdissement ou faiblesse au niveau des membres inférieurs), un dysfonctionnement des intestins et/ou de la vessie. Les patients doivent être informés qu’ils doivent signaler immédiatement tout signe ou symptôme décrit ci-dessus. Si des signes ou symptômes d’hématome rachidien sont suspectés, il est urgent de poser le diagnostic et d’initier un traitement, notamment envisager une décompression de la moelle épinière, même s’il est possible que ce traitement ne parvienne pas à prévenir ou à récupérer les séquelles neurologiques.
· Nécrose cutanée/Vascularite cutanée
Des cas de nécrose et de vascularite cutanées ont été signalés avec des HBPM et doivent conduire à un arrêt rapide du traitement.
· Procédures de revascularisation coronaire percutanée
Afin de minimiser le risque de saignement suite à une procédure vasculaire pendant la prise en charge d’un angor instable, d’un NSTEMI et d’un STEMI aigu, les intervalles de temps recommandés entre les doses d’injection d’énoxaparine sodique doivent être respectés précisément. Il est important d’atteindre l’hémostase au site de ponction après une ICP. Si un dispositif de fermeture est utilisé, la gaine peut être immédiatement retirée. Si une méthode de compression manuelle est utilisée, la gaine doit être retirée 6 heures après la dernière injection IV/SC d’énoxaparine sodique. Si le traitement par énoxaparine sodique doit se poursuivre, la dose suivante programmée doit être administrée au plus tôt 6 à 8 heures après le retrait de la gaine. Le site de la procédure doit être surveillé pour déceler tout signe de saignement ou de formation d’un hématome.
· Endocardite infectieuse aiguë
L’utilisation d’héparine n’est généralement pas recommandée chez les patients atteints d’endocardite infectieuse aiguë en raison du risque d’hémorragie cérébrale. Si une telle utilisation est considérée comme étant absolument nécessaire, la décision doit être prise uniquement après une évaluation prudente du rapport bénéfice-risque.
· Prothèses valvulaires cardiaques mécaniques
Il n’existe pas d’étude spécifique sur l’utilisation d’énoxaparine sodique pour la thromboprophylaxie chez les patients porteurs de prothèses valvulaires cardiaques mécaniques. Des cas isolés de thrombose sur prothèses de valve mécaniques ont été signalés chez des patients ayant reçu de l’énoxaparine sodique en thromboprophylaxie. Des facteurs confondants, incluant la maladie sous-jacente et des données cliniques limitées, ne permettent pas d’évaluer correctement ces cas. Dans certains cas, il s’agissait de femmes enceintes chez lesquelles la thrombose a entraîné le décès de la mère et du fœtus.
· Femmes enceintes porteuses de prothèses valvulaires cardiaques mécaniques
L’utilisation d’énoxaparine sodique en thromboprophylaxie chez les femmes enceintes porteuses de prothèses valvulaires cardiaques mécaniques n’a pas été étudiée de façon spécifique. Dans le cadre d’une étude clinique chez des femmes enceintes porteuses de prothèses valvulaires cardiaques mécaniques traitées par énoxaparine sodique (100 UI/kg [1 mg/kg], 2 fois par jour) pour réduire le risque thromboembolique, 2 femmes sur 8 ont développé des caillots résultant en un blocage de la valve et entraînant le décès de la mère et du fœtus. Des cas isolés de thrombose de valves ont été rapportés post-commercialisation chez des femmes enceintes porteuses de prothèses valvulaires cardiaques mécaniques traitées par énoxaparine sodique en thromboprophylaxie. Les femmes enceintes porteuses de prothèses valvulaires cardiaques mécaniques peuvent être à haut risque thromboembolique.
· Patients âgés
Aucune tendance d’augmentation des saignements n’est observée chez les patients âgés traités à doses prophylactiques. Les patients âgés (en particulier les patients âgés de 80 ans et plus) pourraient présenter un risque accru de complications hémorragiques aux doses thérapeutiques. Une surveillance clinique étroite est recommandée, et une diminution de la posologie chez les patients âgés de plus de 75 ans traités pour un STEMI pourraient être envisagées (voir les rubriques 4.2 et 5.2).
· Insuffisance rénale
Chez les patients présentant une insuffisance rénale, l’exposition à l’énoxaparine est augmentée, associée à une élévation du risque de saignement. Chez ces patients, une surveillance clinique étroite est recommandée, et une surveillance biologique par la mesure de l’activité anti-Xa pourrait être envisagée (voir les rubriques 4.2 et 5.2).
En raison du manque de données dans cette population, l’énoxaparine sodique n’est pas recommandée chez les patients atteints d’une insuffisance rénale terminale (clairance de la créatinine < 15 mL/min) en dehors de la prévention de la formation d’un thrombus dans le circuit de circulation extracorporelle au cours de l’hémodialyse.
Chez les patients atteints d’insuffisance rénale sévère (clairance de la créatinine de 15 à 30 mL/min), il est recommandé d’ajuster la posologie pour les traitements curatif et prophylactique (voir rubrique 4.2), en raison d’une exposition à l’énoxaparine sodique significativement augmentée.
Aucun ajustement posologique n’est recommandé chez les patients atteints d’insuffisance rénale modérée (clairance de la créatinine de 30 à 50 mL/min) et légère (clairance de la créatinine de 50 à 80 mL/min).
· Insuffisance hépatique
L’énoxaparine sodique doit être utilisée avec précaution chez les patients ayant une insuffisance hépatique, en raison du risque augmenté de saignements. Une adaptation de la posologie, sur la base d’une surveillance de l’activité anti-Xa, n’est pas fiable chez les patients avec une cirrhose hépatique et n’est pas recommandée (voir rubrique 5.2).
· Patients de faible poids
Une augmentation de l’exposition à l’énoxaparine sodique avec des doses prophylactiques (non ajustées en fonction du poids) a été observée chez des femmes et des hommes de faible poids corporel (< 45 kg et < 57 kg respectivement), ce qui pourrait augmenter le risque hémorragique. Une surveillance clinique étroite est donc recommandée chez ces patients (voir rubrique 5.2).
· Patients obèses
Les patients obèses ont un risque thromboembolique plus élevé. La sécurité d’emploi et l’efficacité des doses prophylactiques chez les patients obèses (IMC > 30 kg/m2) n’ont pas été entièrement déterminées et il n’existe aucun consensus sur l’ajustement de la posologie. Ces patients doivent faire l’objet d’une surveillance étroite pour déceler tout signe ou symptôme de maladie thromboembolique.
· Hyperkaliémie
Les héparines peuvent supprimer la sécrétion surrénale d’aldostérone et entraîner une hyperkaliémie (voir rubrique 4.8), en particulier chez les patients atteints de diabète, présentant une insuffisance rénale chronique, une acidose métabolique préexistante, prenant des médicaments connus pour augmenter les taux de potassium (voir rubrique 4.5). Les taux plasmatiques de potassium doivent être régulièrement surveillés, en particulier chez les patients à risque.
· Traçabilité
Les HBPM sont des médicaments biologiques. Afin d’améliorer la traçabilité des HBPM, il est recommandé aux professionnels de santé de consigner le nom commercial et le numéro de lot du produit administré dans le dossier médical du patient.
· Pustuloses exanthématiques aiguës généralisées (PEAG)
Des pustuloses exanthématiques aiguës généralisées (PEAG) ont été rapportées avec une fréquence inconnue en association avec le traitement par énoxaparine. Au moment de la prescription, les patients doivent être informés des signes et des symptômes et doivent faire l’object d’une surveillance étroite pour détecter ces réactions cutanées. Si des signes et des symptômes évocateurs de ces réactions apparaissent, l'énoxaparine doit être arrêtée immédiatement et un traitement alternatif doit être envisagé (le cas échéant).
· Sodium
Ce médicament contient moins de 1 mmol (23 mg) de sodium par dose, c’est-à-dire qu’il est essentiellement « sans sodium »
4.5. Interactions avec d'autres médicaments et autres formes d'interactions 
· Médicaments modifiant l’hémostase (voir rubrique 4.4)
Il est recommandé d’arrêter certains médicaments qui modifient l’hémostase avant un traitement par énoxaparine sodique, à moins que cela ne soit strictement indiqué. Si l’association est indiquée, l’énoxaparine sodique doit être utilisée sous surveillance clinique et biologique étroite, lorsque nécessaire.
Ces médicaments incluent :
o les salicylés systémiques, l’acide acétylsalicylique à des doses anti-inflammatoires et les AINS, y compris le kétorolac ;
o les thrombolytiques (par ex., altéplase, rétéplase, streptokinase, ténectéplase, urokinase) et anticoagulants (voir rubrique 4.2).
Associations faisant l'objet de précautions d’emploi
Les médicaments suivants peuvent être administrés avec prudence en association avec l’énoxaparine sodique :
· Autres médicaments modifiant l’hémostase, tels que :
o Les inhibiteurs de l’agrégation plaquettaire, y compris l’acide acétylsalicylique utilisé à une dose antiagrégante (cardioprotection), le clopidogrel, la ticlopidine et les antagonistes de la glycoprotéine IIb/IIIa indiqués dans le syndrome coronaire aigu, en raison du risque de saignement ;
o le Dextran 40 ;
o les glucocorticoïdes systémiques.
· Médicaments augmentant le taux de potassium :
Les médicaments augmentant le taux de potassium sérique peuvent être administrés en association avec l’énoxaparine sodique dans le cadre d’une surveillance clinique et biologique étroite (voir rubriques 4.4 et 4.8).
4.6. Fertilité, grossesse et allaitement 
Grossesse
Dans l’espèce humaine, aucune donnée ne montre que l’énoxaparine traverse la barrière placentaire pendant le deuxième et le troisième trimestre de la grossesse. Aucune information n’est disponible en ce qui concerne le premier trimestre.
Les études chez l’animal n’ont pas en mis en évidence de fœtotoxicité ni de tératogénicité (voir rubrique 5.3). Les données chez l’animal ont montré que le passage de l’énoxaparine à travers le placenta est minime.
L’énoxaparine sodique ne doit être utilisée pendant la grossesse que si le médecin en a clairement établi la nécessité.
Les femmes enceintes recevant de l’énoxaparine sodique doivent faire l’objet d’une surveillance étroite pour déceler tout signe de saignement ou d’anticoagulation excessive, et elles doivent être informées du risque d’hémorragie. Dans l’ensemble, les données suggèrent qu’il n’y a aucune preuve d’augmentation du risque d’hémorragie, de thrombopénie ou d’ostéoporose par rapport aux femmes qui ne sont pas enceintes, à l’exception des femmes enceintes porteuses de prothèses valvulaires cardiaques (voir rubrique 4.4).
S’il est prévu de procéder à une anesthésie péridurale, il est recommandé d’arrêter le traitement par héparine avant (voir rubrique 4.4).
Chez la femme, l’excrétion de l’énoxaparine sous forme inchangée dans le lait n’est pas connue. Chez les rates allaitantes, le passage de l’énoxaparine ou de ses métabolites dans le lait est très faible.
L’absorption orale d’énoxaparine sodique est peu probable. ENOXAPARINE BIOGARAN® peut être utilisé pendant l’allaitement.
Fertilité
Il n’existe aucune donnée clinique sur l’énoxaparine sodique relative à la fertilité. Les études chez l’animal n’ont montré aucun effet sur la fertilité (voir rubrique 5.3).
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines 
Résumé du profil de sécurité
L’énoxaparine sodique a été évaluée chez plus de 15 000 patients dans le cadre d’essais cliniques : 1 776 en prophylaxie de la thrombose veineuse profonde suite à une chirurgie orthopédique ou abdominale chez des patients à risque de complications thromboemboliques, 1 169 en prophylaxie médicale de la thrombose veineuse profonde chez des patients atteints d’une affection médicale aiguë et présentant une mobilité très restreinte, 559 pour le traitement de la TVP avec ou sans EP, 1 578 pour le traitement d’un angor instable et d’un infarctus du myocarde sans onde Q et 10 176 pour le traitement d’un STEMI aigu.
Le schéma posologique de l’énoxaparine sodique administré pendant ces essais cliniques varie selon les indications. La dose d’énoxaparine sodique était de 4 000 UI (40 mg) SC une fois par jour en prophylaxie de la thrombose veineuse profonde suite à une chirurgie ou en prophylaxie chez les patients atteints d’une affection médicale aiguë présentant une mobilité très restreinte. Dans le traitement de la TVP avec ou sans EP, les patients recevant de l’énoxaparine sodique étaient traités soit par une dose SC de 100 UI/kg (1 mg/kg) toutes les 12 heures, soit par une dose SC de 150 UI/kg (1,5 mg/kg) une fois par jour. Dans les études cliniques pour le traitement de l’angor instable et de l’infarctus du myocarde sans onde Q, les doses étaient de 100 UI/kg (1 mg/kg) par voie SC toutes les 12 heures, et dans l’étude clinique pour le traitement d’un STEMI aigu, le schéma posologique de l’énoxaparine sodique était un bolus IV de 3 000 UI (30 mg) suivi par une dose SC de 100 UI/kg (1 mg/kg) toutes les 12 heures.
Dans les études cliniques, les hémorragies, la thrombopénie et la thrombocytose étaient les effets les plus fréquemment rapportés (voir rubrique 4.4 et « Description d’effets indésirables sélectionnés » ci-dessous).
Des pustuloses exanthématiques aiguës généralisées (PEAG) ont été rapportées en association avec le traitement par énoxaparine (voir rubrique 4.4).
Liste récapitulative des effets indésirables
Les autres effets indésirables observés dans les études cliniques et rapportés au cours de l’expérience post-commercialisation (* indique les effets rapportés durant l’expérience post-commercialisation) sont détaillés ci-dessous.
Les fréquences sont déterminées de la façon suivante : très fréquent (≥ 1/10) ; fréquent (≥ 1/100, < 1/10) ; peu fréquent (≥ 1/1 000, < 1/100) ; rare (≥ 1/10 000, < 1/1 000) ; très rare (< 1/10 000) et fréquence indéterminée (ne peut être estimée sur la base des données disponibles). Au sein de chaque classe de système d’organes, les effets indésirables sont présentés suivant un ordre décroissant de gravité.
Affections hématologiques et du système lymphatique
· Fréquent : hémorragie, anémie hémorragique*, thrombopénie, thrombocytose
· Rare : éosinophilie*, cas de thrombopénie immuno-allergique avec thrombose ; dans certains cas, la thrombose s’est compliquée d’un infarctus d’un organe ou d’une ischémie d’un membre (voir rubrique 4.4)
Affections du système immunitaire
· Fréquent : réaction allergique
· Rare : réactions anaphylactiques/anaphylactoïdes, y compris choc*
Affections du système nerveux
· Fréquent : maux de tête*
Affections vasculaires
· Rare : hématome intrarachidien*. Ces réactions ont entraîné des lésions neurologiques de gravité variable, comprenant la paralysie prolongée ou permanente (voir la rubrique 4.4).
Affections hépatobiliaires
· Très fréquent : élévations des enzymes hépatiques (principalement des taux de transaminases > 3 fois la limite supérieure de la normale)
· Peu fréquent : atteintes hépatocellulaires*
· Rare : atteinte hépatique cholestatique*
Affections de la peau et du tissu sous-cutané
· Fréquent : urticaire, prurit, érythème
· Peu fréquent : dermatite bulleuse
· Rare : alopécie*, vascularite cutanée*, nécrose cutanée* survenant généralement au site d’injection (ces réactions ont généralement été précédées d’un purpura ou de placards érythémateux, infiltrés et douloureux). Nodules au site d’injection* (nodules inflammatoires qui ne sont pas une formation kystique d’énoxaparine). Ils se résorbent après quelques jours et ne sont pas un motif d’arrêt du traitement.
· Indéterminée : Pustuloses exanthématiques aiguës généralisées (PEAG).
Affections musculo-squelettiques, systémiques et osseuses
· Rare : ostéoporose* lors d’un traitement prolongé (plus de 3 mois).
Troubles généraux et anomalies au site d’administration
· Fréquent : hématome au site d’injection, douleur au site d’injection, autre réaction au site d’injection (telle qu’un œdème, une hémorragie, une hypersensibilité, une inflammation, un nodule, une douleur ou une réaction)
· Peu fréquent : irritation locale ; nécrose cutanée au site d’injection.
Investigations
· Rare : hyperkaliémie* (voir rubriques 4.4 et 4.5)
Description d’effets indésirables sélectionnés
Hémorragies
Des hémorragies majeures ont été rapportées au maximum chez 4,2 % des patients (patients en chirurgie), dont certaines ont été fatales. Chez les patients en chirurgie, les complications hémorragiques étaient considérées comme majeures : (1) hémorragie avec conséquence clinique significative ou (2) hémorragie accompagnée d’une diminution du taux d’hémoglobine ≥ 2 g/dl ou ayant nécessité la transfusion de 2 ou plus culots globulaires. Les hémorragies rétropéritonéales et intracrâniennes étaient dans tous les cas considérées comme majeures.
Comme avec les autres anticoagulants, une hémorragie peut survenir en présence de facteurs de risques associés, tels que des lésions organiques susceptibles de saigner, des procédures invasives ou l’utilisation concomitante de médicaments ayant un effet sur l’hémostase (voir les rubriques 4.4 et 4.5).
|
Classe de systèmes d’organes |
Prophylaxie en chirurgie |
Prophylaxie médicale |
Traitement des TVP, avec ou sans EP |
Traitement prolongé de la TVP et de l’EP chez les patients atteints d'un cancer actif |
Traitement de l’angor instable et de l’IDM sans onde Q |
Traitement du STEMI aigu |
|
Affections hématologiques et du système lymphatique |
Très fréquent : Hémorragieα |
Fréquent : Hémorragieα |
Très fréquent Hémorragieα |
Fréquentb Hémorragiea |
Fréquent : Hémorragieα |
Fréquent : Hémorragieα |
|
Rare : Hémorragie rétropéritonéale |
Peu fréquent : Hémorragie intracrânienne, hémorragie rétropéritonéale |
|
Rare : Hémorragie rétropéritonéale |
Peu fréquent : Hémorragie intracrânienne, hémorragie rétropéritonéale |
||
|
α : tel que, hématome, ecchymoses en dehors du site d’injection, hématome au niveau d’une plaie, hématurie, épistaxis et hémorragie gastro-intestinale. b: fréquence basée sur une étude rétrospective conduite à partir d’un registre incluant 3526 patients (voir rubrique 5.1) |
||||||
Thrombopénie et thrombocytose (voir rubrique 4.4 : « Surveillance de la numération plaquettaire »)
|
Classe de systèmes d’organes |
Prophylaxie en chirurgie |
Prophylaxie médicale |
Traitement des TVP, avec ou sans EP |
Traitement prolongé de la TVP et de l’EP chez les patients atteints d'un cancer actif |
Traitement de l’angor instable et de l’IDM sans onde Q |
Traitement du STEMI aigu |
|
Affections hématologiques et du système lymphatique |
Très fréquent : ThrombocytoseC |
Peu fréquent : Thrombopénie |
Très fréquent : ThrombocytoseC |
Fréquence inconnue : Thrombocytopénie |
Peu fréquent : Thrombopénie |
Fréquent : Thrombocytosec Thrombopénie |
|
Fréquent : Thrombopénie |
Fréquent : Thrombocytopénie |
Très rare : Thrombopénie immuno-allergique |
||||
|
c : Augmentation de la numération plaquettaire > 400 G/l |
||||||
Population pédiatrique
La sécurité et l’efficacité de l’énoxaparine sodique chez les enfants n’ont pas été établies (voir rubrique 4.2).
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : www.signalement-sante.gouv.fr.
Signes et symptômes
Le surdosage accidentel après administration IV, extracorporelle ou SC d’énoxaparine sodique pourrait entraîner des complications hémorragiques. Suite à l’administration par voie orale de doses même massives, il est peu probable que l’énoxaparine sodique soit absorbée.
Prise en charge
Les effets anticoagulants peuvent être largement neutralisés par l’injection IV lente de protamine. La dose de protamine dépend de la dose d’énoxaparine sodique injectée :
· 1 mg de protamine neutralise l’effet anticoagulant de 100 UI (1 mg) d’énoxaparine sodique, si cette dernière a été administrée au cours des 8 dernières heures.
· Une perfusion de 0,5 mg de protamine pour100 UI (1 mg) d’énoxaparine sodique peut être administrée si l’énoxaparine sodique a été administrée plus de 8 heures avant l’administration de protamine, ou s’il a été déterminé qu’une deuxième dose de protamine est requise.
· Au-delà de 12 heures après l’injection d’énoxaparine sodique, il n’est pas nécessaire d’administrer la protamine.
Cependant, même à des doses élevées de protamine, l’activité anti-Xa de l’énoxaparine sodique n’est jamais complètement neutralisée (environ 60 % au maximum) (voir les informations de prescription pour les sels de protamine).
5. PROPRIETES PHARMACOLOGIQUES 
5.1. Propriétés pharmacodynamiques 
Classe pharmacothérapeutique : agentS antithrombotiqueS, groupe de l’héparine ; Code ATC : B01AB05.
Effets pharmacodynamiques
L’énoxaparine est une héparine de bas poids moléculaire (HBPM) dont le poids moléculaire moyen est d’environ 4 500 daltons, au sein de laquelle les activités antithrombotiques et anticoagulantes de l’héparine standard ont été dissociées. La substance médicamenteuse est le sel de sodium.
Dans le système purifié in vitro, l’énoxaparine sodique a une activité anti-Xa élevée (environ 100 UI/mg) et une faible activité anti-IIa ou antithrombine (environ 28 UI/mg) et le rapport entre les deux est de 3,6. Ces activités anticoagulantes sont médiées par l’antithrombine III (ATIII) résultant en activités antithrombotiques chez l’homme.
Au-delà de l’activité anti-Xa/IIa, d’autres propriétés antithrombotiques et anti-inflammatoires de l’énoxaparine ont été identifiées chez des sujets sains et des patients, ainsi que dans des modèles non cliniques.
Elles comprennent l’inhibition dépendante de l’ATIII d’autres facteurs de coagulation, tels que le facteur VIIa, l’induction de la libération d’un inhibiteur de la voie du facteur tissulaire (TFPI) endogène ainsi qu’une libération réduite du facteur de von Willebrand (vWF) de l’endothélium vasculaire dans la circulation sanguine. Ces facteurs sont connus pour contribuer à l’effet antithrombotique global de l’énoxaparine sodique.
Lorsqu’elle est utilisée comme traitement prophylactique, l’énoxaparine sodique n’affecte pas significativement le temps de céphaline activée (TCA). Lorsque l’énoxaparine sodique est utilisée comme traitement curatif, le TCA peut être prolongé de 1,5 à 2,2 fois au pic d’activité, par rapport au temps de contrôle.
Efficacité et sécurité clinique
Prévention de la maladie thromboembolique veineuse en chirurgie
Prophylaxie prolongée de la MTEV en chirurgie orthopédique :
Dans une étude menée en double aveugle portant sur la prophylaxie prolongée des patients ayant bénéficié d’une chirurgie de remplacement de la hanche, 179 patients ne présentant pas de maladie thromboembolique veineuse initialement traités, durant leur hospitalisation, par de l’énoxaparine sodique à une dose de 4 000 UI (40 mg) SC, ont été randomisés pour recevoir, après la sortie de l’hôpital, un traitement comprenant soit de l’énoxaparine sodique à une dose de 4 000 UI (40 mg) (n = 90) SC une fois par jour, soit un placebo (n = 89) pendant 3 semaines. L’incidence de TVP pendant la prophylaxie prolongée était significativement plus faible pour l’énoxaparine sodique comparée au placebo, et aucune EP n’a été rapportée. Aucune hémorragie majeure n’est survenue.
Les données d’efficacité sont fournies dans le tableau ci-dessous.
|
Enoxaparine sodique |
Placebo |
|
|
Tous les patients ayant reçu une prophylaxie prolongée |
90 (100) |
89 (100) |
|
Total de TEV |
6 (6,6) |
18 (20,2) |
|
· Total de TVP (%) |
6 (6,6)* |
18 (20,2) |
|
· TVP proximale (%) |
5 (5,6)# |
7 (8,8) |
|
*valeur p par rapport au placebo = 0,008 #chiffre de la valeur p par rapport au placebo = 0,537 |
||
Dans une deuxième étude menée en double aveugle, 262 patients ne présentant pas de MTEV et ayant bénéficié d’une chirurgie de remplacement de la hanche, initialement traités, pendant leur hospitalisation, avec de l’énoxaparine sodique à une dose de 4 000 UI (40 mg) SC, ont été randomisés pour recevoir après la sortie de l’hôpital un traitement comprenant soit de l’énoxaparine sodique à une dose de 4 000 UI (40 mg) (n = 131) SC une fois par jour, soit un placebo (n = 131) pendant 3 semaines. Comme dans la première étude, l’incidence de MTEV pendant la prophylaxie prolongée était significativement plus faible pour l’énoxaparine sodique comparée au placebo pour le total d’événements thromboemboliques veineux (énoxaparine sodique : 21 [16 %] par rapport au placebo : 45 [34,4 %] ; p = 0,001), de même que pour la TVP proximale (énoxaparine sodique : 8 [6,1 %] par rapport au placebo : 28 [21,4 %] ; p = < 0,001).
Aucune différence au niveau des saignements majeurs n’a été constatée entre le groupe de l’énoxaparine sodique et le groupe du placebo.
Prophylaxie prolongée de la TVP suite à une chirurgie oncologique
Un essai multicentrique, en double aveugle, a comparé un schéma posologique de quatre semaines et un schéma posologique d’une semaine de prophylaxie par énoxaparine sodique en termes de sécurité d’emploi et d’efficacité chez 332 patients bénéficiant d’une intervention programmée pour un cancer abdominal ou pelvien. Les patients ont reçu de l’énoxaparine sodique (4 000 UI [40 mg] SC) 1 fois par jour pendant 6 à 10 jours, puis ils ont été randomisés pour recevoir soit de l’énoxaparine sodique, soit un placebo pendant 21 jours supplémentaires. Une vénographie bilatérale a été réalisée entre le 25è et le 31è jour, ou plus tôt si des symptômes de thromboembolie veineuse survenaient. Les patients ont été suivis pendant trois mois. La prophylaxie par énoxaparine sodique pendant quatre semaines après l’intervention chirurgicale pour un cancer abdominal ou pelvien a réduit significativement l’incidence des thromboses confirmées par vénographie, comparativement à la prophylaxie par énoxaparine sodique pendant une semaine. Les taux de thromboembolie veineuse à la fin de la phase en double aveugle étaient de 12,0 % (n = 20) dans le groupe du placebo et de 4,8 % (n = 8) dans le groupe de l’énoxaparine sodique ; p = 0,02. Cette différence persistait à trois mois [13,8 % vs 5,5 % (n = 23 vs 9), p = 0,01]. Il n’y a pas eu de différences dans les taux de saignement, ni d’autres complications durant les périodes en double aveugle ou de suivi.
Traitement prophylactique de la maladie thromboembolique veineuse chez les patients atteints d’une affection médicale aiguë avec mobilité réduite
Dans une étude multicentrique menée en double aveugle, en groupes parallèles, l’énoxaparine sodique à une dose de 2 000 UI (20 mg) ou de 4 000 UI (40 mg) SC une fois par jour a été comparée à un placebo dans la prophylaxie médicale de la TVP chez des patients présentant une réduction importante de la mobilité lors d’une affection médicale aiguë (définie par une distance de marche < 10 mètres pendant ≤ 3 jours). Cette étude a inclus des patients atteints d’insuffisance cardiaque (classe III ou IV selon la NYHA) ; d’insuffisance respiratoire aiguë ou d’insuffisance respiratoire chronique compliquée et d’une infection aiguë ou de rhumatisme aigu ; si ces affections étaient associées à au moins un facteur de risque d’ETEV (âge ≥ 75 ans, cancer, antécédent d’ETEV, obésité, varices, hormonothérapie et maladie cardiaque ou insuffisance respiratoire chroniques).
Au total, 1 102 patients ont été inclus dans l’étude et 1 073 patients ont été traités. Le traitement a été poursuivi pendant 6 à 14 jours (durée médiane de 7 jours). Administrée à une dose de 4 000 UI (40 mg) SC une fois par jour, l’énoxaparine sodique a significativement réduit l’incidence d’ETEV comparativement au placebo. Les données d’efficacité sont fournies dans le tableau ci-dessous.
|
Énoxaparine sodique |
Énoxaparine sodique |
Placebo |
|
|
Tous les patients traités pendant une affection médicale aiguë |
287 (100) |
291 (100) |
288 (100) |
|
Total d’ETEV (%) |
43 (15,0) |
16 (5,5)* |
43 (14,9) |
|
· TVP totales (%) |
43 (15,0) |
16 (5,5) |
40 (13,9) |
|
· TVP proximale (%) |
13 (4,5) |
5 (1,7) |
14 (4,9) |
|
ETEV = événements thromboemboliques veineux incluant la TVP, l’EP et le décès considéré comme étant d’origine thromboembolique. *valeur p par rapport au placebo = 0,0002 |
|||
Environ 3 mois après l’inclusion, l’incidence des ETEV restait significativement plus faible dans le groupe énoxaparine sodique à la dose de 4 000 UI (40 mg) par rapport au groupe placebo.
La survenue d’hémorragies totales et majeures était respectivement de 8,6 % et de 1,1 % dans le groupe placebo, de 11,7 % et de 0,3 % dans le groupe énoxaparine sodique à la dose de 2 000 UI (20 mg) et de 12,6 % et 1,7 % dans le groupe énoxaparine sodique à la dose de 4 000 UI (40 mg).
Traitement de la thrombose veineuse profonde avec ou sans embolie pulmonaire
Dans une étude multicentrique, en groupes parallèles, 900 patients présentant une TVP aiguë d’un membre inférieur, avec ou sans EP, ont été randomisés pour recevoir un traitement dans le cadre d’une hospitalisation par soit (i) de l’énoxaparine sodique à la dose de 150 UI/kg (1,5 mg/kg) SC une fois par jour, soit (ii) de l’énoxaparine sodique à la dose de 100 UI/kg (1 mg/kg) SC toutes les 12 heures, soit (iii) un bolus IV d’héparine (5 000 UI) suivi par une perfusion continue (administrée pour atteindre un TCA de 55 à 85 secondes). Au total, 900 patients ont été randomisés dans l’étude et tous les patients ont été traités. Tous les patients ont également reçu de la warfarine sodique (dose ajustée en fonction du temps de prothrombine nécessaire pour atteindre un rapport international normalisé [INR] de 2,0 à 3,0), en commençant dans les 72 heures de l’instauration du traitement par énoxaparine sodique ou par héparine standard, et ce traitement s’est poursuivi pendant 90 jours. Le traitement par énoxaparine sodique ou héparine standard a été administré pendant au moins 5 jours et jusqu’à ce que l’INR cible pour la warfarine sodique ait été atteint. Les deux schémas posologiques de l’énoxaparine sodique étaient équivalents au traitement par héparine standard sur la réduction du risque de récidive de maladie thromboembolique veineuse (TVP et/ou EP). Les données d’efficacité sont fournies dans le tableau ci-dessous.
|
Énoxaparine sodique |
Énoxaparine sodique |
Héparine |
|
|
Tous les patients traités atteints de TVP, avec ou sans EP |
298 (100) |
312 (100) |
290 (100) |
|
ETEV totales (%) |
13 (4,4)* |
9 (2,9)* |
12 (4,1) |
|
· TVP seule (%) |
11 (3,7) |
7 (2,2) |
8 (2,8) |
|
· TVP proximale (%) |
9 (3,0) |
6 (1,9) |
7 (2,4) |
|
· EP (%) |
2 (0,7) |
2 (0,6) |
4 (1,4) |
|
ETEV = événement thromboembolique veineux (TVP et/ou EP) *Les intervalles de confiance à 95 % pour les différences entre les traitements pour le total d’ETEV étaient les suivants : · Enoxaparine sodique une fois par jour vs héparine (-3,0 à 3,5). · Enoxaparine sodique toutes les 12 heures vs héparine (-4,2 à 1,7). |
|||
Les taux d’hémorragies majeures étaient respectivement de 1,7 % dans le groupe énoxaparine sodique à la dose de 150 UI/kg (1,5 mg/kg) une fois par jour, de 1,3 % dans le groupe énoxaparine sodique à la dose de 100 UI/kg (1 mg/kg) deux fois par jour et de 2,1 % dans le groupe héparine.
Dans les essais cliniques avec un nombre limité de patients, les taux rapportés de récidives des évènements thromboemboliques veineux chez les patients traités par l’énoxaparine administrée une ou deux fois par jour pendant 3 à 6 mois semblent comparables aux taux de récidives des patients traités par la warfarine.
L'efficacité en vie réelle a été évaluée dans une étude de cohorte incluant 4 451 patients présentant une maladie thromboembolique veineuse symptomatique et un cancer actif. Cette étude a été réalisée à partir du registre international RIETE incluant des patients atteints de maladie thromboembolique veineuse et d'autres affections thrombotiques. 3 526 patients avaient reçu de l'énoxaparine SC jusqu'à 6 mois et 925 patients avaient reçu de la tinzaparine ou de la daltéparine en SC. Parmi les 3 526 patients recevant un traitement par l'énoxaparine, 891 patients ont été traités avec 1,5 mg/kg une fois par jour comme traitement initial et traitement prolongé jusqu'à 6 mois (une fois par jour seulement), 1 854 patients ont été traités avec 1,0 mg/kg deux fois par jour comme traitement initial et traitement prolongé jusqu'à 6 mois (deux fois par jour), et 687 patients ont été traités avec 1,0 mg/kg deux fois par jour comme traitement initial suivi de 1,5 mg/kg une fois par jour (deux fois par jour suivi d’une fois par jour) comme traitement prolongé jusqu'à 6 mois. La durée moyenne et médiane du traitement jusqu'au changement de posologie était de 17 jours et 8 jours, respectivement. L’étude a montré qu’il n’y avait aucune différence significative des taux de récidive des évènements thromboemboliques veineux entre les deux groupes de traitement (voir tableau), l'énoxaparine répondant au critère prédéfini de non-infériorité de 1,5 (HR ajusté par les covariables pertinentes 0,817, IC à 95%: 0,499-1,336). Les deux groupes étudiés ne présentaient pas de différence statistiquement significative en ce qui concerne le risque relatif de saignements majeurs (fatals ou non) et de décès toutes causes confondues (voir tableau).
Résultats d'efficacité et de sécurité dans l'étude RIETECAT
|
Résultat |
Enoxaparine |
Autres HBPM |
Hazard Ratios ajustés |
|
Récidive d’évènements thromboemboliques veineux |
70 (2,0%) |
23 (2,5%) |
0,817, [0,499-1,336] |
|
Saignements majeurs |
111 (3,1%) |
18 (1,9%) |
1,522, [0,899-2,577] |
|
Saignements non majeurs |
87 (2,5%) |
24 (2,6%) |
0,881, [0,550-1,410] |
|
Décès toutes causes confondues |
666 (18,9%) |
157 (17,0%) |
0,974, [0,813-1,165] |
Un résumé des résultats selon chaque schéma thérapeutique utilisé dans l'étude RIETECAT parmi les patients traités pendant 6 mois est fourni ci-dessous :
Résultats à 6 mois chez les patients traités pendant 6 mois par différents schémas thérapeutiques
* Toutes les données avec IC à 95 %
Traitement de l’angor instable et de l’infarctus du myocarde sans élévation du segment ST
Dans une étude multicentrique de grande envergure, 3 171 patients inclus à phase aiguë d’un angor instable ou d’un infarctus du myocarde sans onde Q ont été randomisés pour recevoir en association avec de l’acide acétylsalicylique (100 à 325 mg une fois par jour), soit de l’énoxaparine sodique à 100 UI/kg (1 mg/kg) toutes les 12 heures, soit une injection IV d’héparine non fractionnée ajustée en fonction du TCA. Les patients devaient être traités à l’hôpital pendant au moins 2 jours et au maximum 8 jours, jusqu’à la stabilisation clinique, procédures de revascularisation ou leur sortie de l’hôpital. Les patients devaient être suivis jusqu’à 30 jours.
En comparaison avec l’héparine, l’énoxaparine sodique a significativement réduit l’incidence du critère combiné associant angine de poitrine, infarctus du myocarde et décès, avec une diminution de 19,8 % à 16,6 % (réduction du risque relatif de 16,2 %) au jour 14. Cette réduction de cette incidence du critère combiné a été maintenue après 30 jours (de 23,3 à 19,8 % ; réduction du risque relatif de 15 %).
Il n’y a pas eu de différence significative dans les hémorragies majeures, même si des hémorragies au site de l’injection SC étaient plus fréquentes.
Traitement de l’infarctus du myocarde avec élévation du segment ST
Dans une étude multicentrique de grande envergure, 20 479 patients présentant un STEMI et éligibles à un traitement fibrinolytique ont été randomisés pour recevoir soit de l’énoxaparine sodique sous la forme d’un bolus IV unique de 3 000 UI (30 mg) et une dose SC de 100 UI/kg (1 mg/kg) suivie d’une injection SC de 100 UI/kg (1 mg/kg) toutes les 12 heures, soit de l’héparine non fractionnée ajustée en fonction du TCA par voie IV pendant 48 heures. Tous les patients ont également été traités par de l’acide acétylsalicylique pendant au moins 30 jours. La posologie de l’énoxaparine sodique était ajustée pour les patients atteints d’une insuffisance rénale sévère et pour les patients âgés de plus de 75 ans. Les injections SC d’énoxaparine sodique ont été administrées jusqu’à la sortie de l’hôpital ou pendant huit jours au maximum (selon la première occurrence).
4 716 patients ont bénéficié d’une intervention coronarienne percutanée (ICP) associée à un traitement antithrombotique en aveugle. Par conséquent, pour les patients sous énoxaparine sodique, l’ICP a été pratiquée sous énoxaparine sodique (pas de changement de traitement) en utilisant le schéma posologique établi dans les études précédentes, à savoir, aucune administration supplémentaire si la dernière administration par voie SC a été effectuée moins de 8 heures avant l’inflation du ballonnet, ou un bolus IV de 30 UI/kg (0,3 mg/kg) d’énoxaparine sodique si la dernière administration SC a été effectuée plus de 8 heures avant l’inflation du ballonnet.
L’énoxaparine sodique comparée à l’héparine non fractionnée a significativement diminué l’incidence du critère principal d’évaluation, un critère composite du décès toutes causes confondues ou d’une récidive d’infarctus du myocarde au cours des 30 premiers jours suivant la randomisation [9,9 pour cent dans le groupe énoxaparine sodique, vs 12,0 pour cent dans le groupe héparine non fractionnée], avec une réduction du risque relatif de 17 pour cent (p < 0,001).
Les bénéfices du traitement par l’énoxaparine sodique, démontrés sur plusieurs critères d’efficacité, sont apparus à 48 heures, où il a été observé une réduction du risque relatif de 35 pour cent de récidive d’infarctus du myocarde, comparativement au traitement par héparine non fractionnée (p < 0,001).
L’effet bénéfique de l’énoxaparine sodique sur le critère principal d’évaluation était homogène dans les sous-groupes clés, dont l’âge, le sexe, la localisation de l’infarctus, les antécédents de diabète, les antécédents d’infarctus du myocarde, le type d’agent fibrinolytique administré et le délai écoulé jusqu’au traitement par le médicament à l’étude.
Un bénéfice thérapeutique significatif a été observé avec l’énoxaparine sodique, comparée à l’héparine non fractionnée, chez les patients ayant bénéficié d’une intervention coronarienne percutanée dans les 30 jours suivant la randomisation (réduction du risque relatif de 23 pour cent) ou ayant été traités médicalement (réduction du risque relatif de 15 pour cent, p = 0,27).
Le taux de survenue à 30 jours du critère d’évaluation composite associant décès, récidive d’infarctus du myocarde ou une hémorragie intracrânienne (une mesure du bénéfice clinique net) était significativement plus faible (p < 0,0001) dans le groupe énoxaparine sodique (10,1 %) comparativement au groupe héparine (12,2 %), ce qui correspond à une réduction du risque relatif de 17 % en faveur du traitement par énoxaparine sodique.
L’incidence des saignements majeurs à 30 jours était significativement plus élevée (p < 0,0001) dans le groupe énoxaparine sodique (2,1 %) par rapport au groupe héparine (1,4 %). L’incidence de saignements gastro-intestinaux était plus élevée dans le groupe énoxaparine sodique (0,5 %) par rapport au groupe héparine (0,1 %), tandis que l’incidence d’hémorragies intracrâniennes était similaire entre les deux groupes (0,8 % avec l’énoxaparine sodique par rapport à 0,7 % avec l’héparine).
L’effet bénéfique de l’énoxaparine sodique sur le critère principal d’évaluation observé durant les 30 premiers jours s’est maintenu au cours d’une période de suivi de 12 mois.
Insuffisance hépatique
Selon les données de la littérature, l’utilisation de l’énoxaparine sodique à 4000 UI (40 mg) chez les patients cirrhotiques (classe B-C de Child-Pugh) s’est avérée sûre et efficace en prévention des thromboses de la veine porte. Ces données comportent toutefois quelques limites. Une attention doit être portée chez les patients avec une insuffisance hépatique en raison de leur risque augmenté de saignement (voir rubrique 4.4) et aucune étude pour déterminer une posologie n’a été réalisée chez les patients cirrhotiques (classe A, B ou C de Child Pugh).
5.2. Propriétés pharmacocinétiques 
Les paramètres pharmacocinétiques de l’énoxaparine sodique ont principalement été étudiés en termes de durée de l’activité anti-Xa dans le plasma et également par l’activité anti-IIa, aux doses recommandées après une administration SC unique et répétée, et après une administration IV unique. La détermination quantitative des activités pharmacocinétiques anti-Xa et anti-IIa a été effectuée par des méthodes amidolytiques validées.
Absorption
La biodisponibilité absolue de l’énoxaparine sodique après une injection SC, en fonction de l’activité anti-Xa, est proche de 100 %.
Différentes doses, formules et schémas posologiques peuvent être utilisés.
Le niveau plasmatique maximal moyen d’activité anti-Xa est observé dans un délai de 3 à 5 heures après l’injection SC et atteint une activité anti-Xa d’environ 0,2, 0,4, 1,0 et 1,3 UI anti-Xa/mL suite à l’administration SC unique de doses de 2 000 UI, 4 000 UI, 100 UI/kg et 150 UI/kg (20 mg, 40 mg, 1 mg/kg et 1,5 mg/kg), respectivement.
Un bolus IV de 3 000 UI (30 mg) immédiatement suivi d’une injection SC de 100 UI/kg (1 mg/kg) toutes les 12 heures a fourni un niveau d’activité anti-Xa maximum initial de 1,16 UI/mL (n = 16) et une exposition moyenne correspondant à 88 % des taux à l’état d’équilibre. L’état d’équilibre est atteint le deuxième jour du traitement.
Après une administration SC de doses répétées de 4 000 UI (40 mg) une fois par jour et de 150 UI/kg (1,5 mg/kg) une fois par jour chez des volontaires sains, l’état d’équilibre est atteint le 2e jour, avec un rapport d’exposition moyen environ 15 % plus élevé qu’après une dose unique. Après l’administration SC de doses répétées de 100 UI/kg (1 mg/kg) deux fois par jour, l’état d’équilibre est atteint entre le 3e et le 4e jour, avec une exposition moyenne environ 65 % plus élevée qu’après une dose unique et des taux d’activité anti-Xa maximaux et résiduels moyens d’environ 1,2 et 0,52 UI/mL, respectivement.
Le volume d’injection et la concentration de la dose sur une plage allant de 100 à 200 mg/mL ne modifient pas les paramètres pharmacocinétiques chez les volontaires sains.
La pharmacocinétique de l’énoxaparine sodique semble être linéaire dans l’intervalle de doses recommandées.
La variabilité intra et inter-individuelle est faible. Suite à l’administration SC répétée, aucune accumulation ne se produit.
L’activité plasmatique anti-IIa après l’administration SC est environ dix fois plus faible que l’activité anti-Xa. Le niveau maximal moyen d’activité anti-IIa est observé environ 3 à 4 heures après une injection SC et atteint 0,13 UI/mL et 0,19 UI/mL suite à l’administration répétée de la dose de 100 UI/kg (1 mg/kg) deux fois par jour et de la dose de 150 UI/kg (1,5 mg/kg) une fois par jour, respectivement.
Distribution
Le volume de distribution de l’activité anti-Xa de l’énoxaparine sodique est d’environ 4,3 litres et est proche du volume sanguin.
Biotransformation
L’énoxaparine sodique est principalement métabolisée dans le foie par désulfatation ou dépolymérisation en composés de poids moléculaire plus bas, ayant un pouvoir biologique réduit.
Élimination
L’énoxaparine sodique est un médicament à faible clairance, avec une clairance plasmatique anti-Xa moyenne de 0,74 l/h après une perfusion IV de 150 UI/kg (1.5 mg/kg) pendant 6 heures.
L’élimination est monophasique, avec une demi-vie d’environ 5 heures après une dose SC unique, jusqu’à environ 7 heures après une administration répétée.
La clairance rénale de fragments actifs représente environ 10 % de la dose administrée et l’excrétion rénale totale des fragments actifs et non actifs représente 40 % de la dose.
Populations particulières
Patients âgés
D’après les résultats d’une analyse pharmacocinétique de la population, le profil cinétique de l’énoxaparine sodique n’est pas différent chez les sujets âgés comparativement à des sujets plus jeunes lorsque la fonction rénale est normale.
Cependant, étant donné que la fonction rénale décline avec l’âge, les patients âgés peuvent montrer une élimination réduite de l’énoxaparine sodique (voir rubrique 4.4).
Insuffisance hépatique
Dans une étude menée chez des patients atteints d’une cirrhose avancée et traités par énoxaparine sodique à la dose de 4 000 UI (40 mg) une fois par jour, une diminution de l’activité anti-Xa maximale a été associée à une augmentation de la sévérité de l’insuffisance hépatique (évaluée par les catégories de Child-Pugh). Cette diminution a été principalement attribuée à une diminution du taux d’ATIII faisant suite à une diminution de la synthèse d’ATIII chez les patients présentant une insuffisance hépatique.
Insuffisance rénale
Une relation linéaire entre la clairance plasmatique anti-Xa et la clairance de la créatinine à l’état d’équilibre a été observée, ce qui indique une diminution de la clairance de l’énoxaparine sodique chez les patients présentant une fonction rénale diminuée. Une exposition anti-Xa représentée par l’ASC, à l’état d’équilibre, est marginalement augmentée en cas d’insuffisance rénale légère (clairance de la créatinine de 50 à 80 mL/min) et modérée (clairance de la créatinine de 30 à 50 mL/min) après l’administration SC de doses répétées de 4 000 UI (40 mg) une fois par jour. Chez les patients présentant une insuffisance rénale sévère (clairance de la créatinine < 30 mL/min), l’ASC à l’état d’équilibre est significativement augmentée de 65 % en moyenne après l’administration SC de doses répétées de 4 000 UI (40 mg) une fois par jour (voir les rubriques 4.2 et 4.4).
Hémodialyse
La pharmacocinétique de l’énoxaparine sodique a semblé être similaire à celle de la population témoin après l’administration d’une dose IV unique de 25 UI, 50 UI ou 100 UI/kg (0,25, 0,50 ou 1,0 mg/kg), cependant, l’ASC était deux fois plus élevée que celle de la population témoin.
Poids
Après l’administration répétée d’une dose SC de 150 UI/kg (1,5 mg/kg) une fois par jour, l’ASC moyenne de l’activité anti-Xa est marginalement plus élevée à l’état d’équilibre chez des volontaires sains obèses (IMC de 30 à 48 kg/m2) comparée à celle des sujets témoins non obèses, tandis que le niveau d’activité anti-Xa plasmatique n’est pas augmenté. On observe une clairance ajustée en fonction du poids plus faible chez les sujets obèses recevant des doses SC.
Lorsqu’une dose non ajustée en fonction du poids a été administrée, il a été découvert qu’après l’administration d’une dose SC unique de 4 000 UI (40 mg), l’exposition anti-Xa est 52 % plus élevée chez les femmes de faible poids (< 45 kg) et 27 % plus élevée chez les hommes de faible poids (< 57 kg) comparativement à celle des sujets témoins de poids normal (voir la rubrique 4.4).
Interactions pharmacocinétiques
Aucune interaction pharmacocinétique n’a été observée entre l’énoxaparine sodique et les thrombolytiques lors d’une administration concomitante.
5.3. Données de sécurité préclinique 
Dans les tests in vitro, incluant le test d’Ames, le test de mutation directe des lymphomes chez la souris, l’énoxaparine sodique n’a montré aucune activité mutagène. Dans les tests d’aberration chromosomique in vitro sur des lymphocytes humains et le test d’aberration chromosomique in vivo sur de la moelle osseuse de rat, l’énoxaparine sodique n’a montré aucune activité clastogène.
Aucune preuve d’effet tératogène ou de foetotoxicité n’a été montrée lors des études conduites chez les rates et les lapines gravides, recevant des doses d’énoxaparine SC jusqu’à 30 mg/kg/j. Il a été découvert que l’énoxaparine sodique n’avait aucun effet sur la fertilité ou la performance de reproduction des rats mâles et femelles à des doses SC allant jusqu’à 20 mg/kg/jour.
Eau pour préparations injectables.
Injection par voie SC
Ne pas mélanger avec d’autres produits.
Injection par voie IV (bolus) (uniquement pour l’indication STEMI aigu) :
L’énoxaparine sodique peut être administrée en toute sécurité avec une solution saline normale (0,9 %) ou du glucose à 5 % dans de l’eau (voir rubrique 4.2).
3 ans
6.4. Précautions particulières de conservation 
A conserver à une température ne dépassant pas 25°C.
Ne pas congeler.
Ce médicament est à usage unique. Jeter tout produit non utilisé.
6.5. Nature et contenu de l'emballage extérieur 
0,8 mL de solution dans une seringue en verre neutre de type 1 incolore avec aiguille fixée avec capuchon protecteur et gaine d'aiguille fermée par un bouchon en caoutchouc bromobutylee et munie d'un piston en polypropylène marron (avec ou sans système de sécurité).
Boîtes de 1, 2, 6, 10, 12, 20, 24, 30 et 50 seringues préremplies.
Seringues graduées.
Toutes les présentations peuvent ne pas être commercialisées.
6.6. Précautions particulières d’élimination et de manipulation 
MODE D’EMPLOI: SERINGUE PREREMPLIE
L'utilisation appropriée de seringues est nécessaire pour réduire le risque de douleur et l'apparition d'ecchymoses au site d'injection. Veillez à suivre les instructions.
Instructions pour les seringues sans système de sécurité
· Préparation du site d’injection:
Avant de procéder à l'injection, lavez-vous les mains et séchez-les. Utilisez une boule de coton pour nettoyer (sans frotter) la zone choisie pour l’injection.
Choisissez une zone différente de l'estomac pour chaque injection.
· Retirez le capuchon protecteur de l'aiguille.
L'apparition d'une goutte au bout de l'aiguille est possible. Dans ce cas, retirez la goutte avant l'injection en tapotant sur le corps de la seringue (l'aiguille pointée vers le bas).
|
|
· Effectuer l'injection:
La seringue préremplie est prête pour une utilisation immédiate. L'injection doit être réalisée, de préférence avec le patient allongé, sous la peau de la taille, que ce soit à droite ou à gauche. L'aiguille doit être introduite perpendiculairement et non tangentiellement dans l'épaisseur d'un pli cutané pincé entre le pouce et l'index de l'opérateur. Le pli doit être maintenu pendant toute l'injection.
|
|
· Jetez immédiatement la seringue dans le récipient approprié.
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
Instructions pour les seringues avec système de sécurité
· Préparation du site d’injection:
Avant de procéder à l'injection, lavez-vous les mains et séchez-les. Utilisez une boule de coton pour nettoyer (sans frotter) la zone choisie pour l’injection.
Choisissez une zone différente de l'estomac pour chaque injection.
· Tout d’abord, pliez le dispositif de sécurité vers le bas d’environ 90 degrés. Important : ne retirez pas le capuchon avant d’avoir plié le dispositif de sécurité.
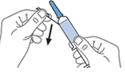
· Retirez le capuchon protecteur de l'aiguille.
L'apparition d'une goutte au bout de l'aiguille est possible. Dans ce cas, retirez la goutte avant l'injection en tapotant sur le corps de la seringue (l'aiguille pointée vers le bas).
|
|
· Effectuer l'injection:
La seringue préremplie est prête pour une utilisation immédiate. L'injection doit être réalisée, de préférence avec le patient allongé, sous la peau de la taille, que ce soit à droite ou à gauche. L'aiguille doit être introduite perpendiculairement et non tangentiellement dans l'épaisseur d'un pli cutané pincé entre le pouce et l'index de l'opérateur. Le pli doit être maintenu pendant toute l'injection.
|
|
· Sécurisez l’aiguille dans le dispositif de sécurité :
Placez le dispositif de sécurité contre une surface dure et stable avec une seule main. Important : n’utilisez pas votre doigt pour placer l’aiguille dans le dispositif de sécurité. Appuyez ensuite sur le dispositif de sécurité. Pliez le dispositif de sécurité jusqu’à ce que l’aiguille s’enclenche dans la partie plastique par un déclic audible.

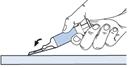
· Jetez immédiatement la seringue sécurisée dans le récipient approprié.
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE 
15, BOULEVARD CHARLES DE GAULLE
92700 COLOMBES
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE 
· 34009 302 448 9 0 : 0,8 mL en seringue préremplie (verre). Boîte de 1.
· 34009 302 449 1 3 : 0,8 mL en seringue préremplie (verre). Boîte de 2.
· 34009 302 449 2 0 : 0,8 mL en seringue préremplie (verre). Boîte de 6.
· 34009 302 449 3 7 : 0,8 mL en seringue préremplie (verre). Boîte de 10.
· 34009 302 449 4 4 : 0,8 mL en seringue préremplie (verre). Boîte de 12.
· 34009 302 470 6 8 : 0,8 mL en seringue préremplie (verre). Boîte de 20.
· 34009 302 449 5 1 : 0,8 mL en seringue préremplie (verre). Boîte de 24.
· 34009 302 449 6 8 : 0,8 mL en seringue préremplie (verre). Boîte de 30.
· 34009 550 866 6 6 : 0,8 mL en seringue préremplie (verre). Boîte de 50.
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION 
[à compléter ultérieurement par le titulaire]
Date de première autorisation:{JJ mois AAAA}
10. DATE DE MISE A JOUR DU TEXTE 
[à compléter ultérieurement par le titulaire]
{JJ mois AAAA}
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES 
Liste I
|
| Plan du site | Accessibilité | Contact | Téléchargement | Declaration de confidentialité | Service-Public.fr | Legifrance | Gouvernement.fr |