Dernière mise à jour le 02/02/2026
AZELASTINE CHLORHYDRATE / FLUTICASONE PROPIONATE BIOGARAN 137 microgrammes/50 microgrammes, suspension pour pulvérisation nasale
Indications thérapeutiques
AZELASTINE CHLORHYDRATE / FLUTICASONE PROPIONATE BIOGARAN contient deux principes actifs : le chlorhydrate d'azélastine et le propionate de fluticasone.
· Le chlorhydrate d'azélastine appartient à un groupe de médicaments appelés anti-histaminiques. Les anti-histaminiques agissent en empêchant les effets de substances comme l'histamine que le corps produit au cours d’une réaction allergique, ce qui a pour but de réduire ainsi les symptômes de la rhinite allergique.
· Le propionate de fluticasone appartient à un groupe de médicaments appelés corticostéroïdes, qui réduisent l'inflammation.
Indications thérapeutiques
AZELASTINE CHLORHYDRATE / FLUTICASONE PROPIONATE BIOGARAN est utilisé pour le traitement symptomatique de la rhinite allergique saisonnière et perannuelle modérée à sévère lorsqu'un traitement par un anti-histaminique ou un glucocorticoïde seul par voie intranasale n'est pas considéré comme suffisant.
La rhinite allergique saisonnière et la rhinite allergique perannuelle sont des réactions allergiques à certaines substances, comme les pollens (rhume des foins), les acariens, les moisissures, la poussière ou les animaux domestiques.
AZELASTINE CHLORHYDRATE / FLUTICASONE PROPIONATE BIOGARAN soulage les symptômes de l’allergie comme l’écoulement nasal, les écoulements rhino-pharyngés, les éternuements, les démangeaisons du nez ou le nez bouché.
Présentations
> 1 flacon en verre brun de 23 g (120 pulvérisations) avec pompe doseuse et applicateur nasal (polypropylène)
Code CIP : 34009 302 829 7 7
Déclaration de commercialisation : 15/05/2025
Cette présentation est agréée aux collectivités
- Prix hors honoraire de dispensation : 8,85 €
- Honoraire de dispensation : 1,02 €
- Prix honoraire compris : 9,87 €
- Taux de remboursement :30 %
Service médical rendu (SMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprès de la HAS (plus d'informations dans l'aide). Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Modéré | Avis du 31/01/2024 | Inscription (CT) | Le service médical rendu par AZELASTINE CHROHYDRATE / FLUTICASONE PROPIONATE BIOGARAN (azelastine/fluticasone) 137 µg/50 µg, suspension pour pulvérisation nasale est modéré dans l’indication de l’AMM. |
Amélioration du service médical rendu (ASMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprés de la HAS (plus d'informations dans l'aide). Les avis et synthéses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur de l'ASMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| V (Inexistant) | Avis du 31/01/2024 | Inscription (CT) | Cette spécialité est un hybride qui n’apporte pas d’amélioration du service médical rendu (ASMR V) par rapport à la présentation de référence DYMISTA (azelastine/fluticasone) 137 µg/50 µg, suspension pour pulvérisation nasale déjà inscrite. |
ANSM - Mis à jour le : 27/11/2023
AZELASTINE CHLORHYDRATE / FLUTICASONE PROPIONATE BIOGARAN 137 microgrammes/50 microgrammes, suspension pour pulvérisation nasale
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Propionate de fluticasone.................................................................................... 365 microgrammes
Pour un mL de suspension.
Une pulvérisation (0,14 g) délivre une dose contenant 137 microgrammes de chlorhydrate d'azélastine (équivalant à 125 microgrammes d'azélastine) et 50 microgrammes de propionate de fluticasone.
Excipient à effet notoire : une pulvérisation (0,14 g) délivre 0,014 mg de chlorure de benzalkonium.
Pour la liste complète des excipients, voir rubrique 6.1.
Suspension pour pulvérisation nasale.
Suspension homogène blanche.
4.1. Indications thérapeutiques
4.2. Posologie et mode d'administration
Pour un effet thérapeutique optimal, le traitement doit être administré de façon régulière.
Éviter tout contact avec les yeux.
Adultes et adolescents (âgés de 12 ans et plus)
Une pulvérisation dans chaque narine deux fois par jour (matin et soir).
Enfants de moins de 12 ans
AZELASTINE CHLORHYDRATE / FLUTICASONE PROPIONATE BIOGARAN n'est pas recommandé chez l’enfant de moins de 12 ans dans la mesure où la sécurité et l'efficacité n'ont pas été établies dans cette tranche d’âge.
Sujets âgés
Il n’y a pas lieu d’adapter la posologie chez les sujets âgés.
Insuffisance hépatique et rénale
Aucune donnée n'est disponible chez l'insuffisant rénal et hépatique.
Durée du traitement
La durée du traitement doit correspondre à la période d'exposition à l'allergène.
Mode d'administration
Voie nasale exclusivement.
Mode d'emploi
Préparation du spray :
Avant usage, le flacon sera agité doucement pendant environ 5 secondes en le retournant à plusieurs reprises ; puis le capuchon de protection sera retiré. Avant la première utilisation, il convient d’amorcer AZELASTINE CHLORHYDRATE / FLUTICASONE PROPIONATE BIOGARAN en actionnant 6 fois la pompe.
Si AZELASTINE CHLORHYDRATE / FLUTICASONE PROPIONATE BIOGARAN n'a pas été utilisé depuis plus de 7 jours, il devra être de nouveau amorcé en actionnant la pompe une fois.
Utilisation du spray :
Le flacon sera agité doucement avant usage pendant environ 5 secondes en le retournant à plusieurs reprises ; puis le capuchon de protection sera retiré. Après s'être mouché, il convient d’administrer une pulvérisation de la suspension dans chaque narine en maintenant la tête penchée vers le bas (voir figure). Après utilisation, l'embout du spray sera essuyé et le capuchon de protection remis en place.
Hypersensibilité aux substances actives ou à l'un des excipients mentionnés à la rubrique 6.1.
4.4. Mises en garde spéciales et précautions d'emploi
Des effets systémiques peuvent survenir avec les corticostéroïdes administrés par voie nasale, en particulier en cas de prescription à fortes doses pendant des périodes prolongées. Le risque de survenue de ces effets est moins élevé qu'avec les corticostéroïdes oraux et les effets peuvent varier selon les patients et selon les corticostéroïdes utilisés. Les effets systémiques potentiels incluent un syndrome de Cushing, un tableau clinique cushingoïde, une inhibition de la fonction surrénalienne, un retard de croissance chez les enfants et les adolescents, une cataracte, un glaucome et, plus rarement, des effets psychologiques ou comportementaux, notamment hyperactivité psychomotrice, troubles du sommeil, anxiété, dépression ou agressivité (en particulier chez l'enfant).
AZELASTINE CHLORHYDRATE / FLUTICASONE PROPIONATE BIOGARAN subit un effet de premier passage hépatique important ; en conséquence l'exposition systémique au propionate de fluticasone administré par voie intranasale risque d’augmenter chez les patients présentant une insuffisance hépatique sévère, ce qui peut entraîner une fréquence plus élevée d'effets indésirables systémiques. La prudence est requise en cas d’insuffisance hépatique sévère.
Un traitement à des doses supérieures à la dose recommandée de corticostéroïdes par voie nasale peut entraîner une inhibition de la fonction surrénalienne cliniquement significative. Lorsqu'il est nécessaire d’utiliser des doses supérieures aux doses recommandées, une corticothérapie de supplémentation par voie générale doit être envisagée pendant les périodes de stress ou en cas de chirurgie programmée.
D’une façon générale, la dose de fluticasone intranasal doit être réduite à la dose la plus faible permettant un contrôle efficace des symptômes de rhinite. Des doses supérieures à la dose recommandée (voir rubrique 4.2) n'ont pas été étudiées pour AZELASTINE CHLORHYDRATE / FLUTICASONE PROPIONATE BIOGARAN. Comme avec tous les corticostéroïdes par voie nasale, l’exposition systémique totale aux corticostéroïdes devra être prise en compte lors de la prescription concomitante d'autres formes de corticothérapie.
Un retard de croissance a été rapporté chez des enfants recevant des corticostéroïdes administrés par voie nasale aux doses thérapeutiques. Il est recommandé de surveiller régulièrement la croissance des adolescents recevant un traitement prolongé par corticostéroïdes par voie nasale. En cas de retard de croissance, le traitement devra être réévalué afin de réduire si possible la dose de corticostéroïde par voie nasale pour atteindre la dose minimale efficace pour le contrôle des symptômes.
Des troubles visuels peuvent apparaître lors d’une corticothérapie par voie systémique ou locale. En cas de vision floue ou d’apparition de tout autre symptôme visuel apparaissant au cours d’une corticothérapie, un examen ophtalmique est requis à la recherche notamment d’une cataracte, d’un glaucome, ou d’une lésion plus rare telle qu’une choriorétinopathie séreuse centrale, décrits avec l’administration de corticostéroïdes par voie systémique ou locale.
Une surveillance étroite est recommandée chez les patients présentant des troubles de la vue ou des antécédents de pression intra-oculaire élevée, de glaucome et/ou de cataractes.
En cas de suspicion d’altération de la fonction surrénalienne, la prudence est requise lors du passage d'un traitement par un corticoïde systémique à un traitement avec AZELASTINE CHLORHYDRATE / FLUTICASONE PROPIONATE BIOGARAN.
Chez les patients présentant une tuberculose, une infection non traitée, ou en cas de blessures ou d’interventions chirurgicales récentes au niveau du nez ou de la bouche, le bénéfice attendu de la corticothérapie doit être évalué face aux risques encourus.
Les infections des voies nasales doivent être traitées par un traitement antibactérien ou antifongique, mais ne constituent pas une contre-indication spécifique au traitement par AZELASTINE CHLORHYDRATE / FLUTICASONE PROPIONATE BIOGARAN.
AZELASTINE CHLORHYDRATE / FLUTICASONE PROPIONATE BIOGARAN contient du chlorure de benzalkonium. Une utilisation à long terme peut provoquer un œdème de la muqueuse nasale.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Dans les conditions normales d’utilisation, les concentrations plasmatiques de propionate de fluticasone après administration intranasale sont faibles, du fait d'un effet de premier passage hépatique important et d'une clairance systémique élevée par l’intermédiaire du cytochrome P450 3A4 dans l'intestin et le foie. Le risque d’interaction médicamenteuse cliniquement significative liée à la présence de propionate de fluticasone est faible.
Une étude d'interactions médicamenteuses menée chez des volontaires sains a montré que le ritonavir (un inhibiteur très puissant du cytochrome P450 3A4) peut fortement augmenter les concentrations plasmatiques de propionate de fluticasone, entraînant une forte réduction des concentrations de cortisol plasmatique. Des interactions médicamenteuses cliniquement significatives ont été rapportées chez des patients utilisant les spécialités à base de propionate de fluticasone par voies intranasale ou inhalée avec le ritonavir, entraînant des effets systémiques des corticostéroïdes. Il est prévu que l’administration concomitante d’inhibiteurs du CYP 3A4, y compris de produits contenant du cobicistat augmente le risque d’effets secondaires systémiques. L’association doit être évitée, sauf si les bénéfices sont supérieurs au risque accru d’effets secondaires systémiques des corticostéroïdes ; dans ce cas, les patients doivent être surveillés en vue de détecter les éventuels effets secondaires systémiques des corticostéroïdes.
Des études ont montré que d'autres inhibiteurs du cytochrome P450 3A4 entraînent des augmentations négligeables (érythromycines) ou faibles (kétoconazole) de l'exposition systémique au propionate de fluticasone sans diminutions notables des concentrations de cortisol plasmatique. Toutefois, la prudence est requise en cas d'administration concomitante d'inhibiteurs puissants du cytochrome P450 3A4 (par exemple : kétoconazole), en raison du risque d'augmentation de l'exposition systémique au propionate de fluticasone.
Chlorhydrate d'azélastine
Aucune étude spécifique d'interaction n'a été menée avec le spray nasal de chlorhydrate d'azélastine. Les études d'interaction existantes ont été conduites par voie orale à fortes doses et ne reflètent donc pas les faibles expositions systémiques obtenues avec les doses plus faibles utilisées par voie nasale. Néanmoins, la prudence est requise lors de l'administration concomitante de chlorhydrate d'azélastine et de sédatifs ou de médicaments agissant sur le système nerveux central en raison du risque d’augmentation de leur effet sédatif. L'alcool peut aussi majorer cet effet (voir rubrique 4.7).
4.6. Fertilité, grossesse et allaitement
Fertilité
Les données concernant l’effet sur la fertilité sont limitées (voir rubrique 5.3).
Grossesse
Les données concernant l'utilisation du chlorhydrate d'azélastine et du propionate de fluticasone chez la femme enceinte sont limitées ou inexistantes. Par conséquent AZELASTINE CHLORHYDRATE / FLUTICASONE PROPIONATE BIOGARAN ne doit être utilisé pendant la grossesse que si le bénéfice attendu pour la mère l’emporte sur les risques potentiels encourus par le fœtus (voir rubrique 5.3).
Allaitement
Le passage du chlorhydrate d'azélastine et de ses métabolites ou celui du propionate de fluticasone et de ses métabolites dans le lait maternel n’a pas été étudié. AZELASTINE CHLORHYDRATE / FLUTICASONE PROPIONATE BIOGARAN ne doit être utilisé pendant l’allaitement que si le bénéfice attendu pour la mère l’emporte sur les risques potentiels encourus par le nouveau-né ou le nourrisson.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
AZELASTINE CHLORHYDRATE / FLUTICASONE PROPIONATE BIOGARAN a une influence mineure sur l’aptitude à conduire des véhicules et à utiliser des machines.
Dans des cas isolés, une sensation de fatigue, de lassitude, d’épuisement, de faiblesse ou des vertiges, pouvant être également provoqués par la pathologie elle-même, peuvent survenir pendant l'utilisation de AZELASTINE CHLORHYDRATE / FLUTICASONE PROPIONATE BIOGARAN. Dans ces cas, la capacité à conduire et à utiliser des machines peut être altérée. Cet effet peut être potentialisé par la prise d'alcool.
Une dysgueusie avec perception d’un goût désagréable spécifique du produit, est fréquemment ressentie après administration (souvent du fait d’une inclinaison trop importante de la tête vers l'arrière pendant l'administration).
Les effets indésirables sont énumérés ci-dessous par classe de système d’organe et par fréquence de survenue. Les fréquences sont définies comme suit :
Très fréquent : (≥ 1/10)
Fréquent : (≥ 1/100 à <1/10)
Peu fréquent : (≥ 1/1 000 à < 1/100)
Rare : (≥ 1/10 000 à < 1/1 000)
Très rare : (< 1/10 000)
Inconnue : (les données disponibles ne permettent pas d’estimer la fréquence de survenue).
|
Fréquence |
Très fréquent |
Fréquent |
Peu fréquent |
Rare |
Très rare |
Fréquence indéterminée (ne peut être estimée sur la base des données disponibles) |
|
Classe de système d'organe |
|
|
|
|
|
|
|
Troubles du système immunitaire |
|
|
|
|
Hypersensibilité, incluant réactions anaphylactiques, angio-œdème (œdème du visage ou de la langue et éruption cutanée), bronchospasme |
|
|
Troubles du système nerveux |
|
Céphalée, dysgueusie (goût désagréable), odeur désagréable |
|
|
États vertigineux, somnolence |
|
|
Troubles oculaires* |
|
|
|
|
Glaucome, augmentation de la pression intraoculaire, cataracte |
Vision floue (voir rubrique 4.4) |
|
Troubles respiratoires, thoraciques et médiastinaux |
Epistaxis |
|
Gêne nasale (incluant irritation nasale, picotement, démangeaison), éternuement, sécheresse nasale, toux, gorge sèche, gorge irritée. |
|
Perforation de la cloison nasale**, érosion muqueuse |
Ulcérations nasales |
|
Troubles gastro-intestinaux |
|
|
|
Bouche sèche |
Nausées |
|
|
Trouble de la peau et du tissu sous-cutané |
|
|
|
|
Éruption, prurit, urticaire |
|
|
Troubles généraux et anomalies au site d’administration |
|
|
|
|
Fatigue (sensation de lassitude, épuisement), faiblesse (voir rubrique 4.7) |
|
* Un très petit nombre de notifications spontanées ont été identifiées après traitement prolongé par propionate de fluticasone par voie intranasale.
** Une perforation de la cloison nasale a été rapportée après l'utilisation de corticostéroïdes par voie nasale.
Les corticostéroïdes par voie nasale peuvent avoir des effets systémiques, en particulier lorsqu'ils sont administrés à des fortes doses pendant des périodes prolongées (voir rubrique 4.4).
Un retard de croissance a été observé chez des enfants recevant des corticostéroïdes par voie nasale. Un retard de croissance est aussi possible chez l'adolescent (voir rubrique 4.4).
Dans de rares cas, une ostéoporose a été observée après utilisation prolongée de glucocorticoïdes par voie nasale.
Déclaration des effets indésirables suspectés.
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/.
Aucune réaction de surdosage n'est attendue après administration par voie nasale.
Aucune donnée clinique n'est disponible concernant les effets d'un surdosage aigu ou chronique de propionate de fluticasone.
Il n’a pas été observé d’effet sur la fonction de l'axe hypothalamo-hypophyso-surrénalien (HHS) lors de l'administration intranasale de 2 mg de propionate de fluticasone (10 fois la dose quotidienne recommandée) deux fois par jour pendant sept jours à des volontaires sains.
L'administration de doses supérieures aux doses recommandées au long cours peut entraîner une inhibition temporaire de la fonction surrénalienne. Dans ce cas, le traitement par AZELASTINE CHLORHYDRATE / FLUTICASONE PROPIONATE BIOGARAN doit être poursuivi à la dose minimale efficace ; la fonction surrénalienne peut se rétablir en quelques jours et être vérifiée par le dosage du cortisol plasmatique.
En cas de surdosage suite à une ingestion accidentelle, des perturbations du système nerveux central (incluant somnolence, confusion, coma, tachycardie et hypotension), provoquées par le chlorhydrate d'azélastine, sont attendues compte tenu des résultats des études menées chez l’animal.
Le traitement de ces troubles sera symptomatique. Selon la quantité ingérée, un lavage gastrique peut être réalisé. Il n'y a pas d'antidote connu.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Mécanisme d'action et effets pharmacodynamiques.
AZELASTINE CHLORHYDRATE / FLUTICASONE PROPIONATE BIOGARAN contient du chlorhydrate d'azélastine et du propionate de fluticasone, qui ont des modes d'action différents et exercent des effets synergiques sur l'amélioration des symptômes de la rhinite et de la rhino-conjonctivite allergiques.
Propionate de fluticasone
Le propionate de fluticasone est un corticostéroïde trifluoré de synthèse présentant une affinité très élevée pour le récepteur des glucocorticoïdes et possède une action anti-inflammatoire puissante, environ 3 à 5 fois plus puissante que celle de la dexaméthasone lors des tests de liaison au récepteur humain des glucocorticoïdes et des tests d'expression génétique.
Chlorhydrate d'azélastine
L'azélastine, dérivé de la phtalazinone, est décrit comme un anti-allergique d'action prolongée antagoniste sélectif des récepteurs H1, stabilisateur des mastocytes et exerçant des propriétés anti-inflammatoires. Les données d'études in vivo (précliniques) et in vitro ont mis en évidence un effet inhibiteur de l'azélastine sur la synthèse ou la libération des médiateurs impliqués dans les réactions allergiques immédiates et retardées tels que les leucotriènes, l'histamine, le facteur d'activation des plaquettes (FAP) et la sérotonine.
Un soulagement des symptômes nasaux d'allergie est observé dans les 15 minutes suivant l'administration par voie nasale.
Spray nasal de chlorhydrate d'azélastine et propionate de fluticasone
Dans 4 études cliniques incluant des adultes et des adolescents présentant une rhinite allergique, une pulvérisation de chlorhydrate d'azélastine et de propionate de fluticasone dans chaque narine deux fois par jour a significativement soulagé les symptômes nasaux (incluant rhinorrhée, congestion nasale, éternuements et démangeaisons nasales) comparativement au placebo, au chlorhydrate d'azélastine seul et au propionate de fluticasone seul. Les symptômes oculaires (comprenant démangeaisons, larmoiement/humidification et rougeur des yeux) ont été significativement améliorés ainsi que la qualité de vie des patients (questionnaires RQLQ, Rhinoconjunctivitis Quality of Life) dans les 4 études.
Une amélioration des symptômes (réduction de 50 % de la sévérité des symptômes nasaux) a été obtenue significativement plus tôt (3 jours et plus) avec du chlorhydrate d'azélastine et du propionate de fluticasone comparé à l’administration de fluticasone par voie nasale seule. La supériorité de l'effet obtenu avec du chlorhydrate d'azélastine et du propionate de fluticasone, par rapport à une spécialité à base de propionate de fluticasone s'est maintenue dans une étude conduite sur un an chez des patients présentant une rhinite allergique persistante ou une rhinite non allergique/vasomotrice.
Dans une étude en chambre d'exposition aux allergènes du pollen d'ambroisie, le premier soulagement significatif des symptômes nasaux a été observé à 5 minutes après l’administration de chlorhydrate d'azélastine et de propionate de fluticasone (comparé au placebo). Une réduction cliniquement pertinente des scores des symptômes d'au moins 30 % a été rapportée à 15 minutes après l’administration de chlorhydrate d'azélastine et de propionate de fluticasone par 60 % des patients.
5.2. Propriétés pharmacocinétiques
Après administration intranasale de deux pulvérisations par narine (548 µg de chlorhydrate d'azélastine et 200 µg de propionate de fluticasone) de chlorhydrate d'azélastine et de propionate de fluticasone, la concentration plasmatique maximale moyenne (± écart type) (Cmax) était de 194,5 ± 74,4 pg/ml pour l'azélastine et de 10,3 ± 3,9 pg/ml pour le propionate de fluticasone et l'exposition totale moyenne (ASC) a été de 4 217 ± 2 618 pg/ml*h pour l'azélastine et de 97,7 ± 43,1 pg/ml*h pour le propionate de fluticasone. Le temps médian écoulé pour atteindre la concentration maximale (tmax) après une dose unique a été de 0,5 heure pour l'azélastine et d'une heure pour le propionate de fluticasone.
L'exposition systémique au propionate de fluticasone a été augmentée d'environ 50 % avec un spray nasal de chlorhydrate d'azélastine et de propionate de fluticasone comparativement à un spray nasal de propionate de fluticasone du commerce. L’exposition systémique à l’azélastine avec un spray nasal de chlorhydrate d'azélastine et de propionate de fluticasone était équivalente à celle obtenue avec du spray nasal d'azélastine seule. Aucune preuve d'interactions pharmacocinétiques entre le chlorhydrate d'azélastine et le propionate de fluticasone n'a été relevée.
Distribution
Le volume de distribution du propionate de fluticasone à l'état d'équilibre est important (environ 318 litres). La liaison aux protéines plasmatiques est de 91 %.
Le volume de distribution de l'azélastine est élevé, se répartissant principalement dans les tissus périphériques. Le taux de liaison aux protéines est de 80-90 %. La marge thérapeutique de chacun des principes actifs est large ce qui rend peu probable le risque d’interactions significatives au niveau des récepteurs.
Biotransformation
Le propionate de fluticasone est rapidement éliminé de la circulation systémique, principalement par métabolisation hépatique en un métabolite inactif de l'acide carboxylique, par l'enzyme CYP3A4 du cytochrome P450. Le propionate de fluticasone dégluti est aussi soumis à un effet de premier passage hépatique important. L'azélastine est métabolisée en N-desméthylazélastine par diverses isoenzymes du CYP, principalement CYP3A4, CYP2D6 et CYP2C19.
Élimination
L’élimination du propionate de fluticasone administré par voie intraveineuse est linéaire pour des doses allant de 250 à 1 000 microgrammes et est caractérisé par une clairance plasmatique élevée (Cl=1,1 l/min). Les concentrations plasmatiques maximales diminuent d'environ 98 % en 3 à 4 heures et seules de faibles concentrations plasmatiques ont été associées à la demi-vie terminale de 7,8 h.
La clairance rénale du propionate de fluticasone est négligeable (< 0,2 %) et moins de 5 % sont éliminées sous forme de métabolite de l'acide carboxylique. L’élimination du propionate de fluticasone et de ses métabolites est réalisée par sécrétion biliaire.
Les demi-vies d'élimination plasmatique après administration d'une dose unique d'azélastine sont d'environ 20-25 heures pour l'azélastine et d'environ 45 heures pour son métabolite actif sur le plan thérapeutique N-desméthylazélastine. L'excrétion se fait principalement par voie fécale. L'excrétion prolongée de petites quantités de la dose dans les fèces semble indiquer qu'un cycle entéro-hépatique pourrait intervenir.
5.3. Données de sécurité préclinique
Propionate de fluticasone
Les études de toxicologie générale ont retrouvé des résultats similaires aux autres glucocorticoïdes correspondant aux effets pharmacodynamiques exacerbés. Le risque de telles observations chez l’homme recevant les doses thérapeutiques préconisées par voie nasale est peu probable compte tenu des expositions systémiques moindres. Il n’a pas été observé d’effets génotoxiques avec le propionate de fluticasone dans les tests standards de génotoxicité. Les études conduites par inhalation pendant 2 ans chez le rat et la souris n’ont pas mis en évidence d’augmentation significative liée au traitement de l’incidence de tumeurs.
Des malformations, notamment des fentes palatines et un retard de croissance intra-utérine ont été observées dans les études conduites chez l’animal avec la fluticasone. Ces résultats sont peu prédictifs d’un risque chez l’homme recevant le traitement aux doses thérapeutiques par voie nasale compte tenu des expositions systémiques faibles (voir rubrique 5.2).
Chlorhydrate d'azélastine
Le chlorhydrate d'azélastine n'a présenté aucun potentiel sensibilisant chez le cobaye. Il n’a pas été observé de potentiel génotoxique de l’azélastine lors des tests réalisés in vitro et in vivo, ni aucun potentiel carcinogène chez le rat ou la souris. Chez le rat mâle et femelle, l'azélastine à des doses orales supérieures à 3 mg/kg/jour a provoqué une diminution dose dépendante de l'indice de fécondité ; il n’a pas été détecté d’altération liée à la substance sur les organes de la reproduction des mâles ou des femelles au cours des études de toxicité chronique mais des effets embryotoxiques et tératogènes ont été observés chez le rat, la souris et le lapin à des doses maternelles toxiques (par exemple, malformations au niveau du squelette observées chez le rat et la souris à des doses de 68,6 mg/kg/jour).
Spray nasal de chlorhydrate d'azélastine et propionate de fluticasone
Des études de toxicité intranasale en doses répétées réalisées chez le rat pendant 90 jours maximum et chez le chien pendant 14 jours avec du chlorhydrate d'azélastine et du propionate de fluticasone n'ont révélé aucun nouvel effet indésirable en comparaison avec chacune des substances actives individuellement.
Edétate disodique, glycérol (E422), cellulose microcristalline, carmellose sodique, polysorbate 80, chlorure de benzalkonium, alcool phényléthylique, eau pour préparations injectables.
3 ans.
Durée de conservation en cours d'utilisation (après la première utilisation) : 6 mois.
6.4. Précautions particulières de conservation
Ne pas mettre au réfrigérateur. Ne pas congeler.
6.5. Nature et contenu de l'emballage extérieur
Présentations :
1 flacon de 23 g de suspension en flacons de 25 mL (au moins 120 pulvérisations)
Conditionnements multiples contenant 69 g (3 flacons de 23 g, correspondant à au moins 120 pulvérisations) de suspension pour pulvérisation nasale.
Toutes les présentations peuvent ne pas être commercialisées.
6.6. Précautions particulières d’élimination et de manipulation
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
15 BOULEVARD CHARLES DE GAULLE
92700 COLOMBES
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 302 829 7 7 : 23 g (120 pulvérisations) de suspension en flacon (verre) avec pompe doseuse et applicateur nasal (polypropylène).
· 34009 550 985 5 3 : 23 g (120 pulvérisations) de suspension en flacons (verre) avec pompe doseuse et applicateur (polypropylène). Boîte de 3.
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Liste I.
ANSM - Mis à jour le : 27/11/2023
Chlorhydrate d’azélastine/propionate de fluticasone
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin ou votre pharmacien.
· Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d’autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
1. Qu'est-ce que AZELASTINE CHLORHYDRATE / FLUTICASONE PROPIONATE BIOGARAN 137 microgrammes/50 microgrammes, suspension pour pulvérisation nasale et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant d’utiliser AZELASTINE CHLORHYDRATE / FLUTICASONE PROPIONATE BIOGARAN 137 microgrammes/50 microgrammes, suspension pour pulvérisation nasale ?
3. Comment utiliser AZELASTINE CHLORHYDRATE / FLUTICASONE PROPIONATE BIOGARAN 137 microgrammes/50 microgrammes, suspension pour pulvérisation nasale ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver AZELASTINE CHLORHYDRATE / FLUTICASONE PROPIONATE BIOGARAN 137 microgrammes/50 microgrammes, suspension pour pulvérisation nasale ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE AZELASTINE CHLORHYDRATE / FLUTICASONE PROPIONATE BIOGARAN 137 microgrammes/50 microgrammes, suspension pour pulvérisation nasale ET DANS QUELS CAS EST-IL UTILISE ?
AZELASTINE CHLORHYDRATE / FLUTICASONE PROPIONATE BIOGARAN contient deux principes actifs : le chlorhydrate d'azélastine et le propionate de fluticasone.
· Le chlorhydrate d'azélastine appartient à un groupe de médicaments appelés anti-histaminiques. Les anti-histaminiques agissent en empêchant les effets de substances comme l'histamine que le corps produit au cours d’une réaction allergique, ce qui a pour but de réduire ainsi les symptômes de la rhinite allergique.
· Le propionate de fluticasone appartient à un groupe de médicaments appelés corticostéroïdes, qui réduisent l'inflammation.
Indications thérapeutiques
AZELASTINE CHLORHYDRATE / FLUTICASONE PROPIONATE BIOGARAN est utilisé pour le traitement symptomatique de la rhinite allergique saisonnière et perannuelle modérée à sévère lorsqu'un traitement par un anti-histaminique ou un glucocorticoïde seul par voie intranasale n'est pas considéré comme suffisant.
La rhinite allergique saisonnière et la rhinite allergique perannuelle sont des réactions allergiques à certaines substances, comme les pollens (rhume des foins), les acariens, les moisissures, la poussière ou les animaux domestiques.
AZELASTINE CHLORHYDRATE / FLUTICASONE PROPIONATE BIOGARAN soulage les symptômes de l’allergie comme l’écoulement nasal, les écoulements rhino-pharyngés, les éternuements, les démangeaisons du nez ou le nez bouché.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D’UTILISER AZELASTINE CHLORHYDRATE / FLUTICASONE PROPIONATE BIOGARAN 137 microgrammes/50 microgrammes, suspension pour pulvérisation nasale ?
N’utilisez jamais AZELASTINE CHLORHYDRATE / FLUTICASONE PROPIONATE BIOGARAN 137 microgrammes/50 microgrammes, suspension pour pulvérisation nasale :
· si vous êtes allergique au chlorhydrate d'azélastine, au propionate de fluticasone ou à l'un des autres composants contenus dans ce médicament, mentionnés dans la rubrique 6.
Avertissements et précautions
Adressez-vous à votre médecin ou votre pharmacien avant d'utiliser AZELASTINE CHLORHYDRATE / FLUTICASONE PROPIONATE BIOGARAN 137 microgrammes/50 microgrammes, suspension pour pulvérisation nasale :
· Si vous avez récemment subi une opération du nez.
· Si vous avez une infection du nez. Les infections des voies nasales doivent être traitées par un traitement antibactérien ou antifongique. Si vous êtes traité pour votre infection du nez, vous pouvez continuer à utiliser AZELASTINE CHLORHYDRATE / FLUTICASONE PROPIONATE BIOGARAN pour traiter vos allergies.
· Si vous avez la tuberculose ou une infection non traitée.
· Si vous ressentez une modification de votre vision ou si vous avez un antécédent d'élévation de la pression dans les yeux, de glaucome et/ou de cataractes. Si vous êtes dans ce cas, vous serez étroitement surveillé(e) pendant l'utilisation de AZELASTINE CHLORHYDRATE / FLUTICASONE PROPIONATE BIOGARAN.
· Si vous présentez des troubles de la fonction des glandes surrénales, la prudence est requise lors du passage d'un traitement par corticoïde par voie générale à un traitement par AZELASTINE CHLORHYDRATE / FLUTICASONE PROPIONATE BIOGARAN.
· Si vous avez une insuffisance hépatique sévère. Votre risque d'avoir des effets indésirables généraux est plus important.
Si vous présentez un de ces problèmes, votre médecin décidera si vous pouvez utiliser AZELASTINE CHLORHYDRATE / FLUTICASONE PROPIONATE BIOGARAN.
Il est important que vous preniez votre dose comme indiqué ci-dessous à la rubrique 3 ou en suivant les indications de votre médecin. Le traitement à des doses de corticostéroïdes par voie nasale supérieures aux doses recommandées peut entraîner une inhibition de la fonction surrénalienne, ce qui peut causer : perte de poids, fatigue, faiblesse musculaire, hypoglycémie, envies de sel, douleurs articulaires, dépression et coloration foncée de la peau. Si cela se produisait, votre médecin pourrait vous recommander de prendre un autre médicament pendant les périodes de stress ou en cas de chirurgie programmée.
Pour éviter une inhibition de la fonction surrénalienne, votre médecin vous conseillera d'utiliser la dose la plus faible permettant un contrôle efficace de vos symptômes de rhinite.
Les corticostéroïdes par voie nasale (comme AZELASTINE CHLORHYDRATE / FLUTICASONE PROPIONATE BIOGARAN) peuvent ralentir la croissance des enfants et des adolescents, lorsqu'ils sont pris de façon prolongée. Le médecin vérifiera régulièrement la taille de votre enfant et s'assurera qu'il ou elle prend la dose efficace la plus faible possible.
Contactez votre médecin en cas de vision floue ou d’autres troubles visuels.
Si vous avez un doute sur l’application de ce qui précède à votre cas, consultez votre médecin ou votre pharmacien avant d'utiliser AZELASTINE CHLORHYDRATE / FLUTICASONE PROPIONATE BIOGARAN.
Enfants
Ce médicament n’est pas recommandé chez l’enfant de moins de 12 ans.
Autres médicaments et AZELASTINE CHLORHYDRATE / FLUTICASONE PROPIONATE BIOGARAN 137 microgrammes/50 microgrammes, suspension pour pulvérisation nasale
Informez votre médecin ou pharmacien si vous prenez, avez récemment pris ou pourriez prendre tout autre médicament, y compris des médicaments obtenus sans ordonnance.
Certains médicaments peuvent augmenter les effets de AZELASTINE CHLORHYDRATE / FLUTICASONE PROPIONATE BIOGARAN et il est possible que votre médecin souhaite vous surveiller attentivement si vous prenez ces médicaments (y compris certains médicaments pour soigner l’infection à VIH : ritonavir, cobicistat et des médicaments pour le traitement des infections fongiques : kétoconazole).
AZELASTINE CHLORHYDRATE / FLUTICASONE PROPIONATE BIOGARAN 137 microgrammes/50 microgrammes, suspension pour pulvérisation nasale avec des aliments, boissons et de l’alcool
Sans objet.
Si vous êtes enceinte ou que vous allaitez, si vous pensez être enceinte ou planifiez une grossesse, demandez conseil à votre médecin ou à votre pharmacien avant d’utiliser ce médicament.
Conduite de véhicules et utilisation de machines
AZELASTINE CHLORHYDRATE / FLUTICASONE PROPIONATE BIOGARAN a une influence mineure sur l’aptitude à conduire des véhicules et à utiliser des machines.
Très rarement, vous pourrez ressentir une fatigue ou des vertiges provoqués par la rhinite allergique elle-même ou pendant l'utilisation de AZELASTINE CHLORHYDRATE / FLUTICASONE PROPIONATE BIOGARAN. Dans ce cas, il est recommandé de ne pas conduire ou d'utiliser des machines. La prise d'alcool peut également augmenter cet effet.
AZELASTINE CHLORHYDRATE / FLUTICASONE PROPIONATE BIOGARAN 137 microgrammes/50 microgrammes, suspension pour pulvérisation nasale contient du chlorure de benzalkonium
Ce médicament contient 14 microgrammes de chlorure de benzalkonium par pulvérisation. Le chlorure de benzalkonium peut provoquer des irritations ou un gonflement à l’intérieur du nez, surtout s’il est utilisé sur une longue période.
Si vous ressentez une gêne lors de l'utilisation du spray, parlez-en à votre médecin ou à votre pharmacien.
3. COMMENT UTILISER AZELASTINE CHLORHYDRATE / FLUTICASONE PROPIONATE BIOGARAN 137 microgrammes/50 microgrammes, suspension pour pulvérisation nasale ?
Posologie
Pour un effet thérapeutique optimal, AZELASTINE CHLORHYDRATE / FLUTICASONE PROPIONATE BIOGARAN doit être administré régulièrement.
Éviter tout contact avec les yeux.
Adultes et adolescents (12 ans et plus)
· La dose recommandée est d'une pulvérisation dans chaque narine matin et soir.
Enfants de moins de 12 ans
· Ce médicament n’est pas recommandé chez l’enfant de moins de 12 ans.
Utilisation en cas d’insuffisance rénale ou hépatique
Aucune donnée n'est disponible chez les patients atteints d'insuffisance rénale et d’insuffisance hépatique.
Mode et voie d'administration
Voie nasale.
Veuillez lire attentivement les instructions qui suivent et respecter la prescription.
MODE D’EMPLOI
Préparation du spray
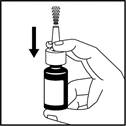
1. Agitez doucement le flacon pendant 5 secondes en le retournant plusieurs fois puis retirez le capuchon de protection de l’embout du spray (voir figure 1).
Figure 1

2. Lors de la première utilisation du spray, la pompe doit être amorcée en l'actionnant dans le vide et vers le haut.
3. Amorcez la pompe en plaçant un doigt de chaque côté et en plaçant votre pouce au fond du flacon.
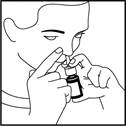
4. Appuyez et relâchez 6 fois jusqu'à ce qu'un fin brouillard soit libéré (voir figure 2).
5. Votre pompe est maintenant amorcée et prête à l'emploi.
Figure 2
6. Si le spray nasal n'a pas été utilisé depuis plus de 7 jours, il devra être de nouveau amorcé en actionnant la pompe une fois.
Utilisation du spray
1. Agitez doucement le flacon pendant 5 secondes en le retournant plusieurs fois puis retirez le capuchon de protection de l’embout nasal du spray (voir figure 1).
2. Mouchez-vous pour vider vos narines.
3. Inclinez votre tête vers le bas en direction de vos orteils. N'inclinez pas la tête vers l'arrière.
4. Maintenez le flacon verticalement et insérez délicatement l'embout du spray dans une de vos narines.
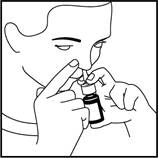
5. Fermez l'autre narine avec un doigt, appuyez rapidement sur la pompe en inspirant doucement (voir figure 3).
6. Expirez par la bouche.
Figure 3
7. Répétez les étapes ci-dessus pour l'autre narine.
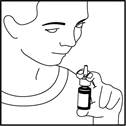
8. Inspirez doucement et n'inclinez pas la tête vers l'arrière après administration. Ceci empêche que le médicament ne coule dans votre gorge et ne produise un goût désagréable (voir figure 4).
Figure 4
9. Après usage, essuyez l'embout du spray à l'aide d'un mouchoir en papier ou d'un chiffon propre puis remettez en place le capuchon protecteur.
10. Ne pas percer l’embout si la pulvérisation ne s’effectue pas. Nettoyer l’applicateur avec de l’eau.
Il est important que vous preniez la dose prescrite par votre médecin. N'utilisez pas le spray nasal plus que ce que le médecin recommande.
Durée du traitement
AZELASTINE CHLORHYDRATE / FLUTICASONE PROPIONATE BIOGARAN est adapté pour une utilisation à long terme. La durée du traitement doit correspondre à la période pendant laquelle vous avez des symptômes d'allergie.
Si vous avez utilisé plus de AZELASTINE CHLORHYDRATE / FLUTICASONE PROPIONATE BIOGARAN 137 microgrammes/50 microgrammes, suspension pour pulvérisation nasale que vous n’auriez dû
Si vous pulvérisez une trop grande quantité de ce médicament dans votre nez, vous n'aurez probablement aucun problème. Si vous êtes inquiet(ète) ou si vous avez utilisé des doses supérieures à la dose recommandée pendant une longue période, contactez votre médecin.
Si quelqu'un, en particulier un enfant, boit accidentellement AZELASTINE CHLORHYDRATE / FLUTICASONE PROPIONATE BIOGARAN, contactez dès que possible votre médecin ou le service des urgences de l'hôpital le plus proche.
Si vous oubliez d’utiliser AZELASTINE CHLORHYDRATE / FLUTICASONE PROPIONATE BIOGARAN 137 microgrammes/50 microgrammes, suspension pour pulvérisation nasale
Utilisez le spray nasal dès que vous vous en rendez compte, puis prenez la dose suivante à l'heure prévue. Ne prenez pas de dose double pour compenser celle que vous avez oublié de prendre.
Si vous arrêtez d’utiliser AZELASTINE CHLORHYDRATE / FLUTICASONE PROPIONATE BIOGARAN 137 microgrammes/50 microgrammes, suspension pour pulvérisation nasale
N'arrêtez pas d'utiliser AZELASTINE CHLORHYDRATE / FLUTICASONE PROPIONATE BIOGARAN sans en parler à votre médecin, car cela pourrait faire échouer le traitement.
Si vous avez d'autres questions sur l’utilisation de ce médicament, demandez plus d'informations à votre médecin ou à votre pharmacien.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Effets indésirables très fréquents (pouvant affecter plus d’1 personne sur 10) :
· Saignement de nez.
Effets indésirables fréquents (pouvant affecter jusqu'à 1 personne sur 10) :
· Céphalée.
· Goût amer dans la bouche, en particulier si vous inclinez la tête en arrière lors de l'utilisation du spray. Ce goût devrait disparaître si vous buvez une boisson sucrée quelques minutes après utilisation.
· Odeur désagréable.
Effets indésirables peu fréquents (pouvant affecter jusqu'à 1 personne sur 100) :
· Légère irritation à l'intérieur du nez. Cette irritation peut produire un léger picotement, une démangeaison ou des éternuements.
· Sécheresse du nez, toux, sécheresse de la gorge ou irritation de la gorge.
Effets indésirables rares (pouvant affecter jusqu'à 1 personne sur 1 000) :
· Bouche sèche.
Effets indésirables très rares (pouvant affecter jusqu'à 1 personne sur 10 000) :
· Vertiges ou somnolence.
· Cataracte, glaucome ou augmentation de la pression dans les yeux, pouvant entraîner une perte de vision et/ou des yeux rouges et douloureux. Ces effets indésirables ont été rapportés après un traitement prolongé avec des sprays nasaux de propionate de fluticasone.
· Lésion de la peau et de la muqueuse du nez.
· Nausées, sensation de fatigue, d’épuisement ou de faiblesse.
· Éruption, démangeaison cutanée ou papules rouges qui démangent sur la peau.
· Bronchospasme (rétrécissement des voies aériennes dans les poumons).
Informez immédiatement votre médecin si vous constatez l’un des symptômes suivants :
· Gonflement du visage, des lèvres, de la langue ou de la gorge, qui peut entraîner des difficultés à avaler et/ou à respirer et apparition soudaine d'une éruption cutanée. Il pourrait s'agir des signes d'une réaction allergique sévère. Remarque : cette réaction est très rare.
Effets indésirables avec une fréquence indéterminée (ne peut être estimée sur la base des données disponibles)
· Vision floue.
· Ulcérations dans le nez.
Des effets indésirables systémiques (affectant l’ensemble du corps) peuvent survenir lorsque ce médicament est utilisé à des doses élevées pendant une longue période. Le risque que ces effets surviennent est bien moins élevé avec un spray nasal qu'avec les corticostéroïdes pris par voie orale. Ces effets peuvent varier selon les patients et selon les différentes formulations de corticostéroïdes (voir rubrique 2).
Les corticostéroïdes nasaux peuvent affecter la production normale d'hormones dans votre corps, en particulier si vous utilisez des doses élevées pendant une longue période. Chez l'enfant et l'adolescent, cet effet indésirable peut entraîner une croissance moins rapide.
Dans de rares cas, une diminution de la densité de l'os (ostéoporose) a été observée après utilisation prolongée de corticostéroïdes par voie nasale.
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin, votre pharmacien ou à votre infirmier/ère. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence Nationale de Sécurité du Médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER AZELASTINE CHLORHYDRATE / FLUTICASONE PROPIONATE BIOGARAN 137 microgrammes/50 microgrammes, suspension pour pulvérisation nasale ?
Tenir ce médicament hors de la vue et de la portée des enfants.
N’utilisez pas ce médicament après la date de péremption indiquée sur l’étiquette du flacon et sur la boîte après « EXP ». La date de péremption fait référence au dernier jour de ce mois.
Ne pas mettre au réfrigérateur. Ne pas congeler.
Durée de conservation après première ouverture : éliminer le médicament inutilisé 6 mois après la première ouverture du spray nasal.
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
· Les substances actives sont :
Chlorhydrate d’azélastine............................................................................ 1 000 microgrammes
Propionate de fluticasone.............................................................................. 365 microgrammes
Pour un mL de suspension.
Une pulvérisation (0,14 g) délivre une dose contenant 137 microgrammes de chlorhydrate d'azélastine (équivalant à 125 microgrammes d'azélastine) et 50 microgrammes de propionate de fluticasone.
Les autres composants sont : édétate disodique, glycérol (E422), cellulose microcristalline, carmellose sodique, polysorbate 80, chlorure de benzalkonium, alcool phényléthylique et eau pour préparations injectables.
AZELASTINE CHLORHYDRATE / FLUTICASONE PROPIONATE BIOGARAN est une suspension blanche pour pulvérisation nasale en flacon en verre brun doté d'une pompe doseuse, d'un applicateur et d'un capuchon de protection.
Le flacon de 25 mL contient 23 g de suspension pour pulvérisation nasale (au moins 120 pulvérisations).
Chaque emballage contient 1 flacon de 23 g de suspension pour pulvérisation nasale ou des conditionnements multiples contenant 3 flacons, contenant chacun 23 g de suspension pour pulvérisation nasale.
Toutes les présentations peuvent ne pas être commercialisées.
Titulaire de l’autorisation de mise sur le marché
15 BOULEVARD CHARLES DE GAULLE
92700 COLOMBES
Exploitant de l’autorisation de mise sur le marché
BIOGARAN
15 BOULEVARD CHARLES DE GAULLE
92700 COLOMBES
OSTRAVSKA 305/29
747 70 KOMAROV, OPAVA
REPUBLIQUE TCHEQUE
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Sans objet.
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).