Dernière mise à jour le 02/02/2026
ATRACURIUM KALCEKS 10 mg/mL, solution injectable/pour perfusion
Indications thérapeutiques
ATRACURIUM KALCEKS appartient à une famille de médicaments appelée myorelaxants.
ATRACURIUM KALCEKS est utilisé au cours des interventions chirurgicales pour relâcher les muscles ainsi que pour faciliter l’intubation endotrachéale et la ventilation assistée. Elle est également utilisée pour permettre une ventilation artificielle chez des patients en service de réanimation.
Présentations
> 5 ampoule(s) en verre de 2,5 mL
Code CIP : 34009 550 520 3 6
Déclaration de commercialisation : 28/12/2018
Cette présentation est agréée aux collectivités
> 5 ampoule(s) en verre de 5 mL
Code CIP : 34009 550 520 5 0
Déclaration de commercialisation : 28/12/2018
Cette présentation est agréée aux collectivités
Service médical rendu (SMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprès de la HAS (plus d'informations dans l'aide). Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Important | Avis du 03/10/2018 | Inscription (CT) | Le service médical rendu par ATRACURIUM KALCEKS est important dans l’indication de l’AMM. |
Amélioration du service médical rendu (ASMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprés de la HAS (plus d'informations dans l'aide). Les avis et synthéses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur de l'ASMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| V (Inexistant) | Avis du 03/10/2018 | Inscription (CT) | Ces spécialités sont des génériques qui n’apportent pas d’amélioration du service médical rendu (ASMR V) par rapport aux princeps. |
Autres informations
- Titulaire de l'autorisation : AS KALCEKS
- Conditions de prescription et de délivrance :
- liste I
- réservé à l'usage HOSPITALIER
- Statut de l'autorisation : Valide
- Type de procédure : Procédure décentralisée
- Code CIS : 6 040 678 1
ANSM - Mis à jour le : 26/06/2024
ATRACURIUM KALCEKS 10 mg/mL, solution injectable/pour perfusion
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Bésilate d’atracurium............................................................................................................. 10 mg
Pour 1 mL de solution injectable/pour perfusion.
Une ampoule de 2,5 mL contient 25 mg de bésilate d’atracurium.
Une ampoule de 5 mL contient 50 mg de bésilate d’atracurium.
Pour la liste complète des excipients, voir rubrique 6.1.
Solution injectable/pour perfusion.
Solution limpide incolore à jaunâtre, sans particules visibles.
Le pH de la solution est de 3,30 à 3,65 et l’osmolarité est de 10 à 30 mOsmol/kg.
4.1. Indications thérapeutiques
4.2. Posologie et mode d'administration
Adultes
Injection intraveineuse
Le bésilate d'atracurium doit être administré par injection intraveineuse. La dose habituelle pour les adultes varie de 0,3 à 0,6 mg/kg (selon la durée de la curarisation souhaitée) et assure une relaxation suffisante pendant 15 à 35 minutes.
L’intubation endotrachéale est généralement possible 90 secondes après l’injection intraveineuse de 0,5 à 0,6 mg/kg.
Le bloc complet peut être prolongé par des doses d’entretien de 0,1 à 0,2 mg/kg si besoin. L’administration de doses supplémentaires successives n’entraîne pas d’augmentation du blocage neuromusculaire.
Césarienne :
Le bésilate d’atracurium peut être utilisé pour maintenir le relâchement musculaire au cours d’une césarienne puisqu’il ne traverse le placenta qu’en faibles quantités aux doses recommandées (0,3-0,6 mg/kg).
Le temps de récupération spontanée du tonus musculaire normal est d’environ 35 minutes lorsque les fonctions neuromusculaires sont rétablies à 95 % par rapport à la normale (mesuré par la récupération de la réponse tétanique)
Le bloc neuromusculaire induit par l'atracurium peut être levé par l’administration d’un anticholinestérasique tel la néostigmine ou l’édrophonium, généralement associé ou précédé d’atropine, sans risque de recurarisation.
Perfusion
Après un bolus initial de 0,3 à 0,6 mg/kg, le bloc neuromusculaire peut être maintenu par administration de bésilate d'atracurium en perfusion continue de 0,3 à 0,6 mg/kg//h lors d’interventions chirurgicales prolongées.
Le bésilate d’atracurium peut être administré par perfusion au cours des chirurgies de pontage cardiopulmonaire aux doses recommandées.
Une hypothermie induite avec une température corporelle de 25 à 26°C diminue la vitesse d’inactivation du bésilate d’atracurium, le bloc neuromusculaire complet peut alors être maintenu en diminuant de moitié le débit de perfusion.
Population pédiatrique
La posologie chez l’enfant de plus d’un mois est identique à celle recommandée chez l’adulte rapportée au poids corporel.
L’utilisation de bésilate d’atracurium n’est pas recommandée chez le nouveau-né en raison de l’insuffisance des données disponibles (voir rubrique 5.1).
Patients âgés
La dose standard d'atracurium peut être utilisée chez le sujet âgé. Il est néanmoins recommandé que la dose initiale corresponde à une dose minimale qui doit être administrée en injection lente.
Patients insuffisants rénaux ou hépatiques
Aucune modification de posologie n'est nécessaire quel que soit le degré de l’insuffisance rénale ou hépatique, même au stade terminal.
Patients atteints d’une pathologie cardiovasculaire
Chez les patients atteints d’une pathologie cardiovasculaire significative sur le plan clinique, la dose initiale d'atracurium doit être administrée en injection lente d’au moins 60 secondes.
Unité de soins intensifs (USI)
Après un bolus initial facultatif de 0,3 à 0,6 mg/kg, le bloc neuromusculaire peut être maintenu par administration de bésilate d'atracurium en perfusion continue de 11 à 13 microgrammes/kg/min (0,65 à 0,78 mg/kg/h). Il existe une grande variabilité individuelle. La posologie peut évoluer avec le temps. Des débits de perfusion aussi faibles que 4,5 microgrammes/kg/min (0,27 mg/kg/h) ou aussi élevés que 29,5 microgrammes/kg/min (1,77 mg/kg/h) sont nécessaires chez certains patients.
La vitesse de récupération spontanée du bloc neuromusculaire chez un patient en USI est indépendante de la durée d'administration. La récupération spontanée jusqu'à un T4/T1 > 0,75 (proportion de la hauteur de la quatrième stimulation par rapport à la première dans un train de quatre) se produit en moyenne en 60 minutes, avec une fourchette de 32 à 108 minutes.
Conseils de surveillance
Comme avec tous les curares, une surveillance des fonctions neuromusculaires (monitorage) est recommandée lors de l’utilisation de bésilate d’atracurium afin d'ajuster individuellement la posologie.
Mode d’administration
Injection intraveineuse ou perfusion.
Pour les instructions sur la dilution du médicament avant administration, voir rubrique 6.6.
4.4. Mises en garde spéciales et précautions d'emploi
Comme avec tous les curares, le bésilate d’atracurium paralyse les muscles respiratoires tout autant que les muscles striés, mais n’a pas d’effet sur la conscience. Ce médicament doit être administré uniquement dans une unité disposant de matériel d’intubation endotrachéale et de ventilation artificielle, avec une anesthésie générale adéquate et par des anesthésistes expérimentés ou sous leur contrôle.
Il peut y avoir une libération d'histamine chez les patients sensibles au cours de l'administration de bésilate d'atracurium. La prudence est de rigueur chez les patients ayant des antécédents évocateurs d’une sensibilité accrue aux effets de l'histamine. Des bronchospasmes peuvent notamment survenir chez des patients ayant des antécédents d’allergie ou d’asthme.
Lors de l’administration de bésilate d’atracurium, une attention particulière sera portée aux patients qui ont des antécédents d’hypersensibilité à d’autres curares, car un taux élevé de réactions allergiques croisées (supérieur à 50 %) entre les curares a été rapporté (voir rubrique 4.3).
Aux doses recommandées, le bésilate d’atracurium n'a pas de propriétés vagolytiques ou ganglioplégiques significatives. Par conséquent, l’atracurium n'a aucun effet clinique significatif sur la fréquence cardiaque, aux doses recommandées, et ne neutralise pas la bradycardie induite par de nombreux agents anesthésiques ou par la stimulation vagale au cours des interventions.
Comme avec les autres curares non dépolarisants, le bésilate d’atracurium doit être utilisé avec précaution chez les patients souffrant de myasthénie ou d'autres maladies neuromusculaires, d'anomalies électrolytiques, en raison de la possibilité d’augmentation de la sensibilité aux curares chez ces patients.
Les patients souffrant d'insuffisance cardiovasculaire peuvent être plus sensibles à une éventuelle hypotension induite par l'atracurium. Chez ces patients, l'injection sera lente, en plus de 60 secondes, et la dose fractionnée.
Le bésilate d'atracurium doit être administré en un minimum de 60 secondes chez les patients pouvant présenter une sensibilité inhabituelle aux hypotensions, par exemple les hypovolémiques.
Le bésilate d'atracurium est inactivé par un pH élevé, par conséquent, il ne faut pas le mélanger à du thiopental ou d’autres solutions alcalines dans la même seringue.
Lors du choix d’une veine de petit calibre pour l’injection, un rinçage du bésilate d’atracurium avec une solution saline physiologique doit être réalisé après l’injection. En cas d'administration d'autres anesthésiques au travers de la même aiguille ou canule à demeure, il est important de rincer chaque produit avec un volume adéquat de solution saline physiologique.
Le bésilate d'atracurium injectable est hypotonique et ne doit pas être injecté dans la même tubulure qu'une transfusion sanguine.
Des études réalisées chez des animaux sensibles à l’hyperthermie maligne (porc) et des études cliniques réalisées chez des patients sensibles à l’hyperthermie maligne ont montré que le bésilate d’atracurium ne déclenche pas ce syndrome.
Comme pour d'autres curares non dépolarisants, un moindre effet de l'atracurium peut apparaître chez les brûlés. En cas d’utilisation chez ce type de patients, une augmentation de posologie pourra être nécessaire en fonction de l'étendue et du temps écoulé depuis la survenue de la brûlure.
Patients en Unité de Soins Intensifs (USI)
L'administration de laudanosine, métabolite du bésilate d’atracurium, chez des animaux de laboratoire, a été accompagnée d'hypotension transitoire et chez quelques espèces, d'effets d'excitation cérébrale.
Il a été rapporté des cas de convulsions chez des patients en Unités de Soins Intensifs qui avaient reçu du bésilate d’atracurium, cependant une relation de cause à effet n'a pu être établie avec la laudanosine (voir rubrique 4.8).
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
L’administration concomitante d’anesthésiques en inhalation tels que l’halothane, l’isoflurane ou l’enflurane peut potentialiser l’effet du bésilate d’atracurium.
Comme avec d'autres curares non dépolarisants, l'intensité et/ou la durée des effets de l'atracurium peuvent être augmentées avec :
· Des antibiotiques : aminoglycosides, polymyxines, spectinomycine, tétracyclines, lincomycine et clindamycine ;
· Des anti-arythmiques : propranolol, inhibiteurs des canaux calciques, lidocaïne, procaïnamide et quinidine ;
· Des diurétiques : furosémide et potentiellement mannitol, thiazides, acétazolamide ;
· Du sulfate de magnésium ;
· De la kétamine ;
· Des sels de lithium ;
· Des ganglioplégiques : trimétaphan, hexaméthonium.
Rarement, certains médicaments peuvent aggraver ou révéler une myasthénie latente, voire déclencher un syndrome myasthénique. Dans ces cas, une sensibilité accrue à ce médicament est attendue. Ces médicaments sont notamment les antibiotiques, les bêta-bloquants (propranolol, oxprénolol), les anti-arythmiques (procainamide, quinidine), les médicaments utilisés en rhumatologie (chloroquine, pénicillamine), le trimétaphan, la chlorpromazine, les stéroïdes, la phénytoïne et le lithium.
L'administration d'une association d’un curare non dépolarisant à l'atracurium peut induire un degré de bloc neuromusculaire supérieur à ce que produirait normalement une dose totale équipotente d'atracurium. L'effet synergique éventuel est variable d'une association médicamenteuse à l'autre.
Un myorelaxant dépolarisant tel le chlorure de suxaméthonium ne doit pas être administré pour prolonger le bloc neuromusculaire d’un curare non dépolarisant tel que le bésilate d’atracurium car cela risque de provoquer un bloc complexe difficile à antagoniser par les anticholinestérasiques.
L’administration d’anticholinestérases, utilisés habituellement dans le traitement de la maladie d’Alzheimer (comme le donépézil), peut diminuer la durée et l’intensité du bloc neuromusculaire induit par le bésilate d’atracurium.
4.6. Fertilité, grossesse et allaitement
Grossesse
Les études chez l’animal n’ont pas mis en évidence d’effet sur la toxicité de la reproduction.
Comme pour tous les curares, ce médicament ne doit être administré pendant le premier trimestre de la grossesse que si les bénéfices pour la mère l’emportent sur les risques potentiels pour le fœtus.
Ce médicament peut être utilisé pour maintenir le relâchement musculaire au cours d’une césarienne puisqu’il ne traverse le placenta qu’en faibles quantités aux doses recommandées.
L’excrétion du bésilate d’atracurium dans le lait maternel n’est pas connue.
Fertilité
Il n’existe pas de données sur la fertilité.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Cette précaution n’est pas pertinente compte tenu de l’utilisation de l’atracurium. Le bésilate d’atracurium doit toujours être administré pour une anesthésie générale, ainsi, les précautions habituelles concernant l’aptitude à conduire des véhicules et à utiliser des machines après une anesthésie générale s’appliquent.
Les effets indésirables les plus souvent rapportés sont l’hypotension (légère, transitoire), et rougeurs cutanées, qui ont été attribuées à la libération d’histamine. De très rares cas de réactions anaphylactiques ou anaphylactoïdes ont été rapportés chez des patients recevant du bésilate d’atracurium en association avec un ou plusieurs anesthésiques.
Les effets indésirables suivants sont présentés par classe organe et par fréquence. Les fréquences sont définies comme suit : très fréquent (≥ 1/10), fréquent (≥ 1/100 et < 1/10), peu fréquent (≥ 1/1 000 et < 1/100), rare (≥ 1/10 000 et < 1/1 000), très rare (< 1/10 000) et fréquence indéterminée (ne peut être estimée sur la base des données disponibles).
|
Les effets indésirables très fréquents, fréquents et peu fréquents sont basés sur les données issues des études cliniques. Les effets indésirables rares et très rares sont pour la plupart basés sur des signalements spontanés. |
||
|
Affections vasculaires |
Fréquent |
Hypotension (modérée, transitoire)*, rougeurs cutanées* |
|
Affections respiratoires, thoraciques et médiastinales |
Peu fréquent |
Bronchospasme* |
|
Données post-commercialisation |
||
|
Affections du système immunitaire |
Très rare |
Réaction anaphylactique, réaction anaphylactoïde incluant crises convulsives, défaillance circulatoire et arrêt cardiaque |
|
Des très rares cas de réactions anaphylactiques et anaphylactoïdes graves ont été rapportées chez des patients recevant du bésilate d’atracurium en association avec un ou plusieurs anesthésiques. |
||
|
Affections du système nerveux |
Fréquence inconnue |
Convulsions |
|
Des cas de convulsions ont été rapportées chez les patients en unité de soins intensifs ayant reçu du bésilate d’atracurium simultanément avec d’autres agents pharmacologiques. Ces patients présentaient généralement une ou plusieurs prédispositions aux convulsions, par exemple un traumatisme crânien, un œdème cérébral, une encéphalite virale, une encéphalopathie hypoxique ou une urémie. Aucune relation causale à la laudanosine (un métabolite du bésilate d’atracurium) n’a été établie. Aucune corrélation entre la concentration plasmatique en laudanosine et l’apparition de convulsions n’a été démontrée lors des études cliniques. |
||
|
Affections de la peau et du tissu sous cutané |
Rare |
Urticaire |
|
Affections musculo-squelettiques et systémiques |
Fréquence inconnue |
Myopathie, faiblesse musculaire |
|
Chez les patients en unité de soins intensifs gravement malades, une faiblesse musculaire et des myopathies ont été observée après une administration prolongée de relaxant musculaire. La majorité de ces patients ont reçu une administration de corticostéroïdes concomitante. Aucune relation causale avec l’administration de bésilate d’atracurium n’a été établie. |
||
* effets indésirables attribués à la libération d’histamine.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : www.signalement-sante.gouv.fr.
Signes et symptômes
Les principaux signes de surdosage sont une paralysie musculaire prolongée et ses conséquences.
Traitement
Il est essentiel de maintenir les voies aériennes du patient avec une ventilation assistée sous pression positive jusqu'à l'obtention d'une respiration spontanée adéquate. La sédation totale est nécessaire, puisque la vigilance n'est pas modifiée par l'atracurium. La récupération peut être accélérée par l'administration d'anticholinestérasiques associés à l'atropine ou du glycopyrrolate, dès l'observation des premiers signes de récupération spontanée.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Mécanisme d’action
Le bésilate d'atracurium est un agent non dépolarisant, hautement sélectif et compétitif, bloquant la transmission neuromusculaire.
Effets pharmacodynamiques
Le bésilate d'atracurium ne semble pas modifier la pression intra-oculaire, et est donc un produit adapté pour la chirurgie ophtalmique.
Population pédiatrique
Les données limitées de littérature chez le nouveau-né suggèrent une variabilité dans le délai d’action et la durée d’action du bésilate d’atracurium dans cette population, comparée aux enfants (voir rubrique 4.2).
5.2. Propriétés pharmacocinétiques
La diminution du taux plasmatique de bésilate d’atracurium a été étudiée pour une injection en bolus ainsi qu’en perfusion continue. L’effet apparaît en approximativement 2 à 3 minutes et la durée d’action est de 45 minutes.
Distribution
La demi-vie plasmatique (T1/2) du bésilate d’atracurium est de 19,9 (± 0,6) minutes et le volume de distribution totale (Vd) est d’environ 0,16 l/kg. Le taux de fixation protéique du bésilate d’atracurium est de 82 %.
Selon des études préliminaires, le passage du bésilate d’atracurium au travers de la barrière placentaire est insignifiant.
Biotransformation
Le bésilate d’atracurium est inactivé d’une part par l’élimination d’Hofmann, qui est une dégradation non-enzymatique spontanée survenant à pH et température physiologiques, et d’autre part par l’hydrolyse enzymatique des liaisons esters catalysées par des estérases sont spécifiques.
Lors d’études sur du plasma sanguin de patients atteints d’un déficit en pseudocholinestérase, l’inactivation du bésilate d’atracurium n’était pas modifiée.
Les variations de pH sanguin et de température corporelle dans les limites physiologiques n’ont pas montré de changement significatif de la durée d’action de l’atracurium.
Élimination
La fin du blocage neuromusculaire induit par le bésilate d’atracurium est indépendante de la biotransformation ou de l’excrétion hépatique ou rénale. Par conséquent, il est peu probable qu’un dysfonctionnement rénal, hépatique ou circulatoire puisse avoir un effet sur la durée d’action.
La demi-vie d’élimination du bésilate d’atracurium est d’environ 20 minutes, et le volume de distribution est de 0,16 l/kg.
L’hémofiltration et l’hémodiafiltration ont un effet minime sur les taux plasmatiques du bésilate d’atracurium et de ses métabolites, y compris la laudanosine. Les effets de l’hémodialyse et de l’hémofiltration sur les taux plasmatiques de l’atracurium et de ses métabolites ne sont pas connus.
Les concentrations en métabolites sont plus élevées chez les patients en unité de soins intensifs ayant des dysfonctionnements rénaux ou hépatiques (voir rubrique 4.4). Ces métabolites n’ont pas d’activité curarisante.
5.3. Données de sécurité préclinique
Mutagenèse
La recherche de mutations géniques imputables au bésilate d’atracurium chez les bactéries et de lésions chromosomiques au niveau de la moelle osseuse du rat a donné des résultats négatifs. Une réponse positive dans le test in vitro sur lymphomes de souris a été observée à des concentrations cytotoxiques.
Etant donné la nature de l’exposition humaine au bésilate d’atracurium, le risque mutagène pour les patients devant subir une myorelaxation par du bésilate d’atracurium pour une intervention chirurgicale est considéré comme négligeable.
Cancérogenèse
Aucune étude de cancérogenèse n’a été réalisée.
Acide benzènesulfonique (pour l’ajustement du pH), eau pour préparations injectables.
Le bésilate d’atracurium est inactivé par des pH élevé, par conséquent, il ne doit pas être mélangé dans la même seringue avec des solutions alcalines (par exemple des solutions de thiopental).
Ce médicament est une solution hypotonique, par conséquent, il ne doit pas être administré dans la même tubulure qu’une transfusion sanguine.
Ce médicament ne doit pas être mélangé avec d’autres médicaments à l’exception de ceux mentionnés dans la rubrique 6.6.
Avant première ouverture : 2 ans.
A usage unique. Après ouverture, le produit doit être utilisé immédiatement.
Après dilution :
La stabilité physico-chimique en cours d’utilisation a été démontrée dans une perfusion intraveineuse de chlorure de sodium pendant 24 heures à 25°C, ainsi que dans d’autres liquides pour perfusion communs pendant 4 à 8 heures à 25°C (voir rubrique 6.6).
Toutefois, d’un point de vue microbiologique, à moins que la méthode de dilution écarte tout risque de contamination microbienne, le produit doit être utilisé immédiatement. En cas d’utilisation non immédiate, les durées et les conditions de conservation en cours d’utilisation sont de la responsabilité de l’utilisateur.
6.4. Précautions particulières de conservation
A conserver au réfrigérateur (entre 2°C et 8°C). Ne pas congeler.
A conserver dans l’emballage d’origine, à l’abri de la lumière.
Pour les précautions de conservation après première ouverture, voir section 6.3.
Pour les précautions de conservation après dilution, voir section 6.3 et 6.6.
6.5. Nature et contenu de l'emballage extérieur
2,5 mL ou 5,0 mL de solution en ampoule (verre incolore borosilicate de type I) avec une ligne de cassure ou un point de coupe.
Les ampoules sont conditionnées sous barquette PVC, dans une boîte.
Boîte de 1 ou 5 ampoules.
Toutes les présentations peuvent ne pas être commercialisées.
6.6. Précautions particulières d’élimination et de manipulation
La solution doit être vérifiée visuellement avant utilisation. Seules les solutions limpides pratiquement exemptes de particules doivent être utilisées.
Le bésilate d’atracurium est compatible avec les solutions pour perfusions suivantes :
|
Solution pour perfusion |
Période de stabilité |
|
Perfusion intraveineuse de chlorure de sodium (9 mg/mL) |
24 heures |
|
Perfusion intraveineuse de glucose (50 mg/mL) |
8 heures |
|
Perfusion intraveineuse de solution de Ringer |
8 heures |
|
Perfusion intraveineuse de chlorure de sodium (1,8 mg/mL) et de glucose (40 mg/mL) |
8 heures |
|
Perfusion intraveineuse de solution de Ringer Lactate |
4 heures |
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
KRUSTPILS IELA 71E
RĪGA, LV 1057
LETTONIE
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 550 520 2 9 : Ampoule (verre) de 2,5 mL de solution. Boîte de 1
· 34009 550 520 3 6 : Ampoule (verre) de 2,5 mL de solution. Boîte de 5
· 34009 550 520 4 3 : Ampoule (verre) de 5 mL de solution. Boîte de 1
· 34009 550 520 5 0 : Ampoule (verre) de 5 mL de solution. Boîte de 5
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Liste I
Médicament réservé à l’usage hospitalier.
ANSM - Mis à jour le : 26/06/2024
ATRACURIUM KALCEKS 10 mg/mL, solution injectable/pour perfusion
bésilate d’atracurium
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin ou votre infirmier/ère.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre infirmier/ère. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
1. Qu'est-ce que ATRACURIUM KALCEKS 10 mg/mL, solution injectable/pour perfusion et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant d'utiliser ATRACURIUM KALCEKS 10 mg/mL, solution injectable/pour perfusion ?
3. Comment utiliser ATRACURIUM KALCEKS 10 mg/mL, solution injectable/pour perfusion ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver ATRACURIUM KALCEKS 10 mg/mL, solution injectable/pour perfusion ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE ATRACURIUM KALCEKS 10 mg/mL, solution injectable/pour perfusion ET DANS QUELS CAS EST-IL UTILISE ?
ATRACURIUM KALCEKS appartient à une famille de médicaments appelée myorelaxants.
ATRACURIUM KALCEKS est utilisé au cours des interventions chirurgicales pour relâcher les muscles ainsi que pour faciliter l’intubation endotrachéale et la ventilation assistée. Elle est également utilisée pour permettre une ventilation artificielle chez des patients en service de réanimation.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D’UTILISER ATRACURIUM KALCEKS 10 mg/mL, solution injectable/pour perfusion ?
N’utilisez jamais ATRACURIUM KALCEKS 10 mg/mL, solution injectable/pour perfusion :
· si vous êtes allergique au bésilate d’atracurium, au cisatracurium ou à l’un des autres composants contenus dans ce médicament, mentionnés dans la rubrique 6.
Si vous pensez que cela s’applique pour vous, parlez-en à votre médecin avant de prendre ATRACURIUM KALCEKS.
Avertissements et précautions
Adressez-vous à votre médecin ou votre infirmier/ère avant d’utiliser ATRACURIUM KALCEKS 10 mg/mL, solution injectable/pour perfusion :
· si vous avez des allergies ou de l’asthme ;
· si vous avez des antécédents connus de réaction allergique à d’autres médicaments similaires à ATRACURIUM KALCEKS qui bloquent la transmission entre les nerfs et les muscles ;
· si vous souffrez de faiblesse musculaire, de fatigue ou de difficulté dans la coordination des mouvements (myasthénie) ;
· si vous souffrez d’une maladie neuromusculaire ;
· si vous avez des problèmes cardiaques ou êtes sensibles à une chute de la pression artérielle ;
· si vous présentez des anomalies électrolytiques graves (taux anormaux en ions tels que sodium, potassium ou chlorure dans le sang)
· si vous avez récemment souffert de brûlures graves nécessitant une aide médicale.
Si vous pensez que vous êtes dans l’un des cas ci-dessus, parlez-en à votre médecin.
Enfants
Ce médicament n’est pas indiqué chez les nourrissons de moins d’un mois.
Autres médicaments et ATRACURIUM KALCEKS 10 mg/mL, solution injectable/pour perfusion
Informez votre médecin si vous prenez, avez récemment pris ou pourriez prendre tout autre médicament. Ceci s’applique également aux médicaments disponibles sans ordonnance.
Certains médicaments peuvent influer sur les effets d’ATRACURIUM KALCEKS. Veuillez indiquer à votre médecin si vous prenez ou avez pris l’un des médicaments suivants :
· anesthésiques (médicaments utilisés pour vous endormir pendant une intervention chirurgicale) tels que l’halothane, l’isoflurane, l’enflurane ou la kétamine ;
· antibiotiques (utilisés pour traiter les infections bactériennes) tels que les aminoglycosides, les polymyxines, la spectinomycine, les tétracyclines, la lincomycine et la clindamycine ;
· médicaments anti-arythmiques (utilisés pour traiter les anomalies du rythme cardiaque) tels que le propranolol, l’oxprénolol, les inhibiteurs de canaux calciques, la lidocaïne, la procaïnamide et la quinidine ;
· diurétiques tels que le furosémide, le mannitol, les thiazides et l’acétazolamide ;
· sels de magnésium (utilisé pour éviter les taux faibles de magnésium dans le corps) ;
· médicaments utilisés pour traiter les troubles mentaux tels que le lithium ou la chlorpromazine ;
· médicaments utilisés pour réduire la pression artérielle (hypertension) tels que le trimétaphan et l’hexaméthonium ;
· médicaments utilisés pour traiter les inflammations articulaires (médicaments antirhumatismaux) tels que la chloroquine et la pénicillamine ;
· médicaments utilisés pour traiter la maladie d’Alzheimer tels que le donépézil ;
· stéroïdes (utilisés pour traiter les inflammations ou l’asthme) tels que le prednisolone ;
· médicaments utilisés pour traiter l’épilepsie tels que la phénytoïne.
ATRACURIUM KALCEKS 10 mg/mL, solution injectable/pour perfusion avec des aliments et boissons
Sans objet.
Si vous êtes enceinte ou que vous allaitez, si vous pensez être enceinte ou planifiez une grossesse, demandez conseil à votre médecin avant de prendre ce médicament. Votre médecin décidera si les bénéfices du traitement l’emportent sur les risques de l’administration d’ATRACURIUM KALCEKS pour votre enfant.
L’atracurium peut être utilisé pour maintenir la relaxation des muscles au cours d’une césarienne.
Conduite de véhicules et utilisation de machines
ATRACURIUM KALCEKS a un effet majeur sur la capacité à conduire et à utiliser des machines. Demandez conseil à votre médecin pour reprendre la conduite et l’utilisation de machines.
Ne conduisez pas et n’utilisez pas de machines si vous ne vous sentez pas bien.
ATRACURIUM KALCEKS 10 mg/mL, solution injectable/pour perfusion contient
Sans objet.
3. COMMENT UTILISER ATRACURIUM KALCEKS 10 mg/mL, solution injectable/pour perfusion ?
ATRACURIUM KALCEKS est utilisé au cours de procédures nécessitant une complète anesthésie du patient (état d’inconscience) ou une sédation profonde. Il sera toujours administré sous la supervision d’un médecin expérimenté.
Quelle quantité doit être administrée ?
Votre médecin déterminera la dose appropriée d’ATRACURIUM KALCEKS selon :
· votre poids corporel ;
· l’étendue et la durée désirée de la relaxation musculaire ;
· votre réponse (réaction) à l’administration du médicament.
Comment ATRACURIUM KALCEKS 10 mg/mL, solution injectable/pour perfusion doit-il être administré ?
ATRACURIUM KALCEKS vous sera administré en une seule injection dans une veine ou par perfusion continue (habituellement à l’aide d’une pompe à perfusion) dans une veine. Dans ce cas, le médicament être administré lentement sur une période donnée.
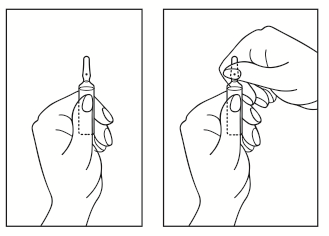
Instruction pour l’ouverture de l’ampoule :
1. Tenir l’ampoule en orientant le point de couleur vers le haut. Si du liquide se trouve dans la partie haute de l’ampoule, tapoter pour le faire descendre dans le corps de l’ampoule.
2. Utilisez vos deux mains pour ouvrir l’ampoule ; maintenez le corps de l’ampoule d’une main et cassez la partie haute de l’ampoule avec l’autre main dans le sens opposé au point de couleur (voir l’image ci-dessous).
|
|
Utilisation chez les enfants
Les nourrissons de moins d’un mois ne doivent pas recevoir ce médicament.
Si vous avez utilisé plus de ATRACURIUM KALCEKS 10 mg/mL, solution injectable/pour perfusion que vous n’auriez dû
ATRACURIUM KALCEKS ne doit être administré que par des médecins qualifiés pour effectuer l’administration.
Etant donné que ce médicament vous sera administré à l’hôpital, il est peu probable que vous receviez une dose trop forte ou trop faible. Toutefois, en cas de doute, parlez-en à votre médecin ou au personnel soignant. En cas d’administration d’une dose trop forte, the mesures appropriées seront mises à œuvre immédiatement.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Si l’un des effets suivants survient, veuillez en informer votre médecin immédiatement :
· réaction allergique grave, pouvant provoquer des démangeaisons soudaines (urticaire), un gonflement des mains, des pieds, des chevilles, du visage, des lèvres, de la bouche ou de la gorge (provoquant des difficultés pour avaler ou respirer), et une sensation de malaise ;
· crises convulsives ;
· insuffisance cardiaque ;
· arrêt cardiaque.
Les effets indésirables ci-dessus sont très graves. Ils requièrent une prise en charge médicale urgente.
Si vous constatez l’apparition de l’une des réactions suivantes, veuillez en informer votre médecin dès que possible :
Effets indésirables fréquents (pouvant affecter jusqu’à 1 personne sur 10) :
· diminution de la pression artérielle (hypotension), habituellement modérée et transitoire ;
· rougeurs cutanées.
Effets indésirables peu fréquents (pouvant affecter jusqu’à 1 personne sur 100) :
· difficulté à respirer et sifflement (bronchospasme).
Effets indésirables de fréquence inconnue (ne pouvant être estimée à partir des données disponibles) :
· convulsions ;
· troubles musculaires (myopathie), faiblesse musculaire.
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou à votre infirmier/ère. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : www.signalement-sante.gouv.fr
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER ATRACURIUM KALCEKS 10 mg/mL, solution injectable/pour perfusion ?
Tenir ce médicament hors de la vue et de la portée des enfants.
N’utilisez pas ce médicament après la date de péremption indiquée sur l’étiquette et la boîte après « EXP ». La date de péremption fait référence au dernier jour de ce mois.
A conserver au réfrigérateur (entre 2°C et 8°C). Ne pas congeler.
A conserver dans l’emballage d’origine, à l’abri de la lumière.
A usage unique. Après ouverture, le produit doit être utilisé immédiatement.
La solution doit être vérifiée visuellement avant utilisation. Seules les solutions limpides pratiquement exemptes de particules doivent être utilisées.
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient ATRACURIUM KALCEKS 10 mg/mL, solution injectable/pour perfusion
· La substance active est :
Bésilate d’atracurium............................................................................................................. 10 mg
Pour 1 mL de solution injectable/pour perfusion.
Une ampoule de 2,5 mL contient 25 mg de bésilate d’atracurium.
Une ampoule de 5 mL contient 50 mg de bésilate d’atracurium.
· Les autres composants sont :
Acide benzènesulfonique (pour l’ajustement du pH), eau pour préparations injectables.
Solution injectable/pour perfusion, limpide, incolore à jaunâtre, sans particules visibles.
2,5 mL ou 5,0 mL de solution en ampoules de 5,0 mL en verre incolore de type I.
Les ampoules sont conditionnées sous barquette PVC, dans une boîte.
Boîte de 1 ou 5 ampoules.
Toutes les présentations peuvent ne pas être commercialisées.
Titulaire de l’autorisation de mise sur le marché
KRUSTPILS IELA 71E
RĪGA, LV 1057
LETTONIE
Exploitant de l’autorisation de mise sur le marché
84 QUAI JOSEPH GILLET
69004 LYON
KRUSTPILS IELA 71E
RĪGA, LV 1057
LETTONIE
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Ce médicament est autorisé dans les Etats membres de l'Espace Economique Européen et au Royaume-Uni (Irlande du Nord) sous les noms suivants : Conformément à la réglementation en vigueur.
[À compléter ultérieurement par le titulaire]
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
< {MM/AAAA}>< {mois AAAA}.>
Les informations suivantes sont destinées exclusivement aux professionnels de santé :
A usage unique. Après ouverture, le produit doit être utilisé immédiatement.
D’un point de vue microbiologique, à moins que la méthode de dilution écarte tout risque de contamination microbienne, le produit doit être utilisé immédiatement. S’il n’est pas utilisé dans l’immédiat, les durées et les conditions de conservation en cours d’utilisation sont de la responsabilité de l’utilisateur.
Le bésilate d'atracurium est inactivé par un pH élevé, par conséquent, il ne faut pas le mélanger à du thiopental ou d’autres solutions alcalines dans la même seringue.
Après injection d’ATRACURIUM KALCEKS dans une veine de petit calibre, un rinçage avec une solution saline physiologique doit être réalisé après l’injection. En cas d'administration d'autres médicaments au travers de la même aiguille ou canule à demeure, il est nécessaire de rincer chaque produit avec un volume adéquat de solution saline physiologique après administration de chaque médicament.
ATRACURIUM KALCEKS est une solution hypotonique, par conséquent il ne doit pas être injecté dans la même tubulure qu'une transfusion sanguine.
Le bésilate d’atracurium est compatible avec les solutions pour perfusions suivantes :
|
Solution pour perfusion |
Période de stabilité |
|
Perfusion intraveineuse de chlorure de sodium (9 mg/mL) |
24 heures |
|
Perfusion intraveineuse de glucose (50 mg/mL) |
8 heures |
|
Perfusion intraveineuse de solution de Ringer |
8 heures |
|
Perfusion intraveineuse de chlorure de sodium (1,8 mg/mL) et de glucose (40 mg/mL) |
8 heures |
|
Perfusion intraveineuse de solution de Ringer Lactate |
4 heures |
Lorsque le bésilate d’atracurium est dilué dans ces solutions pour obtenir une concentration de 0,5 mg/mL et au-delà, les solutions obtenues sont stables à la lumière du jour pendant la durée indiquée à une température allant jusqu’à 25°C.