Dernière mise à jour le 01/12/2025
TIMOPTOL 0,25 %, collyre en solution
Présentations
> 1 flacon(s) compte-gouttes OCUMETER PLUS polyéthylène haute densité (PEHD) de 3 ml
Code CIP : 322 432-6 ou 34009 322 432 6 6
Déclaration de commercialisation : 19/04/1979
Cette présentation est agréée aux collectivités
- Prix hors honoraire de dispensation : 3,49 €
- Honoraire de dispensation : 1,02 €
- Prix honoraire compris : 4,51 €
- Taux de remboursement :65%
> 1 flacon(s) compte-gouttes polyéthylène basse densité (PEBD) de 5 ml
Code CIP : 34009 301 644 7 1
Déclaration de commercialisation : 03/08/2020
Cette présentation est agréée aux collectivités
- Prix hors honoraire de dispensation : 5,61 €
- Honoraire de dispensation : 1,02 €
- Prix honoraire compris : 6,63 €
- Taux de remboursement :65 %
Service médical rendu (SMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprès de la HAS (plus d'informations dans l'aide). Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Important | Avis du 12/06/2019 | Inscription (CT) | Le service médical rendu par les spécialités TIMOPTOL L.P. et TIMOPTOL est important dans les indications de l’AMM. |
| Important | Avis du 07/09/2016 | Renouvellement d'inscription (CT) | le service médical rendu par TIMOPTOL reste important dans les indications de l’AMM. |
Amélioration du service médical rendu (ASMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprés de la HAS (plus d'informations dans l'aide). Les avis et synthéses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur de l'ASMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| V (Inexistant) | Avis du 12/06/2019 | Inscription (CT) | Ces présentations sont des compléments de gamme qui n’apportent pas d’amélioration du service médical rendu (ASMR V) par rapport aux présentations déjà inscrites. |
ANSM - Mis à jour le : 12/07/2023
TIMOPTOL 0,25 %, collyre en solution
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Maléate de timolol................................................................................................................ 0,342 g
Quantité correspondant à timolol base................................................................................... 0,250 g
Pour 100 ml de collyre en solution.
Excipients à effet notoire : chaque ml de solution contient 8,15 mg de phosphate monosodique dihydraté, 29,21 mg de phosphate disodique dodécahydraté et 0,10 mg de chlorure de benzalkonium.
Pour la liste complète des excipients, voir rubrique 6.1.
4.1. Indications thérapeutiques
· Glaucome chronique à angle ouvert.
4.2. Posologie et mode d'administration
EN INSTILLATION OCULAIRE.
Il est recommandé de débuter le traitement par l'instillation dans l'œil malade d'une goutte de TIMOPTOL 0,25 %, deux fois par jour.
En cas d'efficacité insuffisante, la concentration supérieure sera utilisée à raison d'une goutte de TIMOPTOL 0,50 %, deux fois par jour dans l'œil malade.
Le passage systémique peut être réduit par une occlusion nasolacrymale ou par la fermeture des paupières pendant 2 minutes. Cette méthode peut contribuer à diminuer les effets indésirables systémiques et à augmenter l’efficacité locale.
Chez une petite proportion de patients, une goutte 2 fois par jour de timolol 0,10 % dans l'œil malade peut être suffisante. Si la réponse clinique est insuffisante avec la solution à 0,10 %, la concentration devra être augmentée à raison d'une goutte à 0,25 % deux fois par jour dans l'œil malade.
L'ophtalmologiste pourra, s'il le juge nécessaire, associer TIMOPTOL à un ou plusieurs autres traitements antiglaucomateux (par voie locale et/ou générale). Cependant, l'association de deux collyres bêta-bloquants est déconseillée (voir rubrique 4.4).
Les autres collyres doivent être administrés au moins 15 minutes avant TIMOPTOL.
Toutefois, la normalisation de la tension oculaire par TIMOPTOL requiert parfois quelques semaines, aussi l'évaluation du traitement doit-elle inclure une mesure de la tension intra-oculaire après une période de traitement d'environ 4 semaines.
Dans un certain nombre de cas, l'administration quotidienne d'une seule goutte de TIMOPTOL peut s'avérer suffisante, en particulier lorsque la pression intra-oculaire a été maintenue à des niveaux satisfaisants.
Substitution d'un traitement antérieur
Quand TIMOPTOL doit prendre le relais d'un autre collyre antiglaucomateux, ce collyre doit être arrêté à la fin d'une journée complète de traitement, et TIMOPTOL doit être administré le lendemain à la posologie d'une goutte à 0,25 % dans l'œil malade, deux fois par jour.
En cas d'efficacité insuffisante, passer au TIMOPTOL 0,50 % à raison d'une goutte dans l'œil malade, deux fois par jour.
Si TIMOPTOL doit être substitué à plusieurs antiglaucomateux associés, les suppressions ne doivent concerner qu'un seul médicament à la fois.
En cas de substitution de collyres myotiques par TIMOPTOL, un examen de la réfraction peut s'avérer nécessaire quand les effets des myotiques ont disparu.
La prescription médicale sera accompagnée du contrôle de la pression intra-oculaire, surtout lors de l'instauration du traitement.
Population pédiatrique
En raison de données limitées, le timolol peut être seulement recommandé pour une utilisation pendant une période transitoire, lors de glaucomes primaires congénital ou juvénile, en attendant que la décision d’une approche chirurgicale soit prise ou en cas d’échec chirurgical dans l’attente de nouvelles options.
Posologie
Les cliniciens doivent évaluer avec une grande attention les risques et les bénéfices lorsqu’un traitement médical est envisagé avec du timolol chez les patients pédiatriques. Avant l’utilisation du timolol, une anamnèse pédiatrique détaillée ainsi qu’un examen pour déterminer la présence d’anomalies systémiques doivent être réalisés.
Aucune recommandation spécifique sur la posologie ne peut être donnée en raison de données cliniques limitées (voir également rubrique 5.1).
Cependant, si le bénéfice l’emporte sur le risque. Il est recommandé d’utiliser la plus faible concentration de principe actif disponible une seule fois par jour. Si la PIO ne peut être suffisamment contrôlée, une augmentation prudente du dosage à un maximum de deux gouttes par jour et par œil affecté doit être envisagée. En cas d’administration deux fois par jour, un intervalle de 12 heures doit être préféré.
De plus, les patients, en particulier les nouveau-nés, doivent être surveillés avec une grande attention pendant une à deux heures après la première instillation au cabinet médical et les effets indésirables oculaires et systémiques étroitement surveillés jusqu’à ce que la chirurgie soit réalisée.
Concernant l’utilisation en pédiatrie, la concentration de 0,1 % en principe actif peut être déjà suffisante.
Mode d’administration
Afin de limiter les effets indésirables éventuels, une seule goutte doit être instillée lors de chaque administration.
L’absorption systémique des bêta-bloquants administrés localement peut être réduite par l’occlusion lacrymonasale et en gardant les yeux fermés aussi longtemps que possible (par exemple pendant 3 à 5 minutes) après l’instillation des gouttes.
Voir également les rubriques 4.4 et 5.2.
Durée du traitement
Traitement transitoire chez la population pédiatrique (voir aussi rubrique 4.2 « Population pédiatrique »).
· hypersensibilité à la substance active (maléate de timolol) ou à l'un des excipients mentionnés à la rubrique 6.1.
· pathologies associées à une hyperréactivité bronchique notamment asthme ou antécédents d’asthme et bronchopneumopathie chronique obstructive sévère,
· bradycardie sinusale, maladie du sinus (y compris bloc sino-auriculaire), bloc auriculo-ventriculaire du second ou du troisième degré non contrôlé par un pacemaker,
· insuffisance cardiaque confirmée, choc cardiogénique,
· angor de Prinzmetal,
· phéochromocytome non traité,
· hypotension.
4.4. Mises en garde spéciales et précautions d'emploi
Générales
Comme d’autres médicaments ophtalmiques à usage local, le maléate de timolol passe dans la circulation générale. Du fait de la présence d’un composant bêta-adrénergique, le timolol, des effets indésirables cardiovasculaires, pulmonaires et d’autres effets indésirables identiques à ceux observés avec les agents bloquants bêta-adrénergiques administrés par voie systémique, peuvent se produire. La fréquence de survenue des effets indésirables systémiques après administration par voie ophtalmique est plus faible qu’après administration par voie générale. Pour réduire l’absorption systémique, voir rubrique 4.2.
Une diminution de la sensibilité au timolol pourrait apparaître après un traitement prolongé. Il convient, dans les traitements au long cours, de vérifier chaque année l'absence d'échappement thérapeutique.
Affections cardiaques
Chez les patients atteints de maladies cardiovasculaires (par exemple, maladie coronarienne, angor de Prinzmetal et insuffisance cardiaque) ou d’hypotension, le traitement par bêta-bloquant doit être soigneusement évalué et un traitement avec d’autres principes actifs doit être envisagé. Chez ces patients, une surveillance doit être effectuée afin de rechercher des signes d’aggravation de ces pathologies ou des effets indésirables.
En raison de leur effet dromotrope négatif, les bêta-bloquants devront être prescrits avec prudence aux patients atteints d’un bloc auriculo-ventriculaire de premier degré.
Affections vasculaires
Les patients atteints de troubles circulatoires périphériques sévères (c’est-à-dire des formes sévères de la maladie ou du syndrome de Raynaud) doivent être traités avec prudence.
Affections respiratoires
Chez les patients asthmatiques, des manifestations respiratoires pouvant aller jusqu’au décès par bronchospasme ont été rapportées après administration de bêta-bloquants ophtalmiques.
TIMOPTOL doit être administré avec prudence chez les patients souffrant de bronchopneumopathie chronique obstructive (BPCO) légère à modérée et doit être administré seulement si le bénéfice semble supérieur au risque.
Hypoglycémie/diabète
Les bêta-bloquants doivent être administrés avec prudence chez les patients sujets à une hypoglycémie spontanée ou chez des patients présentant un diabète instable, dans la mesure où les bêta-bloquants sont susceptibles de masquer les signes et symptômes d’hypoglycémie aiguë.
Les bêta-bloquants peuvent également masquer les signes d’hyperthyroïdie. Un arrêt brutal du traitement par bêta-bloquant peut précipiter une aggravation des symptômes.
Utilisation concomitante d’autres bêta-bloquants
L’effet sur la pression intra-oculaire ou les effets connus des bêta-bloquants systémiques peuvent être potentialisés lorsque le timolol est administré à des patients déjà traités par un bêta-bloquant systémique. La réponse de ces patients devra être étroitement surveillée. L’utilisation de 2 agents bêta-bloquants administrés par voie locale n’est pas recommandée (voir rubrique 4.5).
Chez les patients ayant un glaucome par fermeture de l'angle, l'objectif immédiat du traitement est la réouverture de l'angle, ce qui nécessite l'emploi d'un myotique afin d'obtenir une constriction pupillaire. TIMOPTOL a peu ou pas d'effet sur la pupille. Lorsque TIMOPTOL est utilisé pour réduire la pression intra-oculaire élevée chez les patients ayant un glaucome par fermeture de l’angle, TIMOPTOL ne doit pas être utilisé seul et un myotique doit lui être associé.
Réactions allergiques/anaphylactiques
Les patients prenant des bêta-bloquants et ayant des antécédents d’atopie ou des antécédents de réactions anaphylactiques sévères à divers allergènes peuvent avoir des réactions plus intenses lors d’une provocation allergénique par contacts répétés avec ces allergènes et peuvent ne pas répondre à la dose habituelle d’adrénaline utilisée pour traiter de telles réactions anaphylactiques.
Maladies cornéennes
Les bêta-bloquants ophtalmiques peuvent entraîner une sécheresse oculaire. Les patients souffrant de maladie cornéenne doivent être traités avec prudence.
Décollement de la choroïde
Des décollements de la choroïde ont été observés après chirurgie filtrante du glaucome lors de l'administration de traitements diminuant la sécrétion d'humeur aqueuse (ex : timolol, acétazolamide).
Utilisateurs de lentilles de contact
Il existe un risque d'intolérance aux lentilles de contact par diminution de la sécrétion lacrymale, liée d'une manière générale aux bêta-bloquants.
Ce médicament contient un conservateur, le chlorure de benzalkonium, qui peut entrainer une irritation oculaire et est connu pour teinter les lentilles de contact souples. Par conséquent, TIMOPTOL ne doit pas être administré lors du port de lentilles de contact souples. Les lentilles doivent être enlevées avant l'instillation des gouttes et ne doivent pas être remises avant un délai minimum de 15 minutes après l'utilisation de TIMOPTOL.
Des kératopathies ponctuées et/ou des kératopathies ulcératives toxiques ont aussi été rapportées avec le chlorure de benzalkonium. Une surveillance étroite des patients est nécessaire en cas d’utilisation fréquente ou prolongée.
Le chlorure de benzalkonium est connu pour provoquer une irritation des yeux, des symptômes du syndrome de l’oeil sec et peut affecter le film lacrymal et la surface de la cornée. Doit être utilisé avec prudence chez les patients atteints d’oeil sec et ceux présentant un risque d’endommagement de la cornée.
Les patients doivent être surveillés en cas d’utilisation prolongée.
Anesthésie chirurgicale
Les préparations ophtalmiques contenant des bêta-bloquants peuvent bloquer les effets des agents bêta-agonistes systémiques tels que l’adrénaline. Les anesthésistes doivent être informés lorsque le patient est traité par le timolol.
Si l'arrêt du traitement est jugé nécessaire, les médecins doivent effectuer une surveillance jusqu’à la réapparition de la sensibilité aux catécholamines.
Dans certains cas le traitement bêta-bloquant ne peut être interrompu :
· chez les malades atteints d'insuffisance coronaire, il peut être souhaitable de poursuivre le traitement jusqu'à l'intervention, étant donné le risque lié à l'arrêt brutal des bêta-bloquants ;
· en cas d'urgence ou d'impossibilité d'arrêt, des mesures appropriées devront être prises afin d’éviter une prédominance vagale ou d’autres complications.
L'anesthésiste devra utiliser avec précaution les dépresseurs myocardiques et les pertes sanguines devront être compensées.
Arrêt du traitement
L’arrêt du traitement par bêta-bloquants utilisés par voie générale chez les patients angineux peut entraîner des troubles du rythme graves, un infarctus du myocarde ou une mort subite.
La posologie sera diminuée progressivement.
Phéochromocytome
L'utilisation des bêta-bloquants dans le traitement de l'hypertension due au phéochromocytome traité nécessite une surveillance étroite de la pression artérielle.
Psoriasis
Des aggravations de la maladie ayant été rapportées sous bêta-bloquant, l'indication mérite d'être pesée.
Thyrotoxicose
Les bêta-bloquants sont capables d'en masquer certains signes, en particulier cardiovasculaires.
Sujets âgés, insuffisants rénaux et/ou hépatiques
Chez ces patients à risque et quand un collyre bêta-bloquant est administré avec un bêta-bloquant par voie générale, une adaptation posologique est souvent nécessaire.
Sportifs
L'attention des sportifs est attirée sur le fait que cette spécialité contient un principe actif pouvant induire une réaction positive des tests pratiqués lors des contrôles antidopage.
Population pédiatrique
Les solutions de timolol doivent d’une manière générale être utilisées avec précaution chez les jeunes patients glaucomateux (voir aussi rubrique 5.2).
Il est important d’informer les parents des effets indésirables éventuels afin qu’ils puissent arrêter immédiatement le traitement. Les signes à rechercher sont par exemple la toux et une respiration sifflante.
A cause de la possibilité d’apnée et de respiration de Cheyne-Stokes, ce médicament doit être utilisé avec une extrême précaution chez les nouveau-nés, les nourrissons et les jeunes enfants. Un moniteur d’apnée portable peut également être utile chez les nouveau-nés sous timolol.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Aucune étude spécifique d’interactions médicamenteuses n’a été réalisée avec le timolol.
Des cas de mydriase résultant de l’utilisation concomitante de collyre bêta-bloquant et d’adrénaline (épinéphrine) ont été rapportés occasionnellement.
Une potentialisation des effets systémiques bêta-bloquants (par exemple diminution de la fréquence cardiaque, dépression) a été rapportée lors de traitements associant les inhibiteurs du CYP2D6 (par exemple quinidine, fluoxétine, paroxétine) et le timolol.
Il y a un risque d’effets additifs, entraînant une hypotension et/ou une bradycardie marquée lorsqu’un collyre bêta-bloquant est administré de façon concomitante avec des inhibiteurs calciques par voie orale, des médicaments entraînant une diminution des catécholamines, des bêta-bloquants, des antiarythmiques (y compris l’amiodarone), des digitaliques, des parasympathomimétiques, de la guanéthidine.
Associations déconseillées
+ Inhibiteurs calciques par voie orale (ex diltiazem, vérapamil) :
Troubles de l'automatisme (bradycardie excessive, arrêt sinusal), troubles de la conduction sino-auriculaire et auriculo-ventriculaire et défaillance cardiaque. Une telle association ne doit se faire que sous surveillance clinique et ECG étroite, en particulier chez le sujet âgé ou en début de traitement.
Associations faisant l'objet de précautions d’emploi
+ Lidocaïne utilisée par voie IV :
Augmentation des concentrations plasmatiques de lidocaïne avec possibilité d’effets indésirables neurologiques et cardiaques (diminution de la clairance hépatique de la lidocaïne). Surveillance clinique, ECG et éventuellement contrôle des concentrations plasmatiques de lidocaïne pendant l’association et après l’arrêt du bêta-bloquant. Adaptation si besoin de la posologie de la lidocaïne.
+ Propafénone :
Troubles de la contractilité, de l'automatisme et de la conduction (suppression des mécanismes sympathiques compensateurs). Surveillance clinique et ECG.
Autres associations faisant l’objet de précautions d’emploi
+ Antidiabétiques :
Les bêta-bloquants peuvent augmenter l’effet hypoglycémiant des antidiabétiques (ex glinides, gliptines, insulines, sulfamides hypoglycémiants).
+ Antihypertenseurs centraux :
Les bêta-bloquants par voie orale peuvent exacerber le rebond hypertensif qui peut suivre l’arrêt des antihypertenseurs centraux (ex clonidine).
Associations à prendre en compte
+ AINS :
Réduction de l'effet antihypertenseur (inhibition des prostaglandines vasodilatatrices par les anti-inflammatoires non stéroïdiens et rétention hydrosodée avec la phénylbutazone).
+ Dihydropyridines :
Hypotension, défaillance cardiaque chez les patients en insuffisance cardiaque latente ou non contrôlée (addition des effets inotropes négatifs). Le bêta-bloquant peut par ailleurs minimiser la réaction sympathique réflexe mise en jeu en cas de répercussion hémodynamique excessive.
+ Dipyridamole :
Avec le dipyridamole par voie injectable : majoration de l’effet antihypertenseur.
4.6. Fertilité, grossesse et allaitement
Le passage systémique des bêta-bloquants administrés par voie oculaire est moindre que par voie orale mais néanmoins réel.
Grossesse
Il n’existe pas de données pertinentes concernant l’utilisation des bêta-bloquants chez la femme enceinte.
Les bêta-bloquants ne doivent pas être utilisés pendant la grossesse sauf en cas de nécessité absolue. Pour réduire l’absorption systémique, voir la rubrique 4.2.
Les études épidémiologiques n'ont pas révélé d'effet malformatif mais ont montré un risque de retard de croissance intra-utérin lorsque les bêta-bloquants sont administrés par la voie orale. De plus, les signes et les symptômes d’un effet bêta-bloquant (par exemple : bradycardie, hypotension, détresse respiratoire et hypoglycémie) ont été observés chez le nouveau-né lorsque les bêta-bloquants ont été administrés jusqu’à l’accouchement. Si le bêta-bloquant est administré jusqu’à l’accouchement, le nouveau-né doit être surveillé attentivement pendant les premiers jours de sa vie.
Allaitement
Les bêta-bloquants sont excrétés dans le lait maternel. Cependant, aux doses thérapeutiques de timolol contenu dans le collyre, il est improbable que des quantités suffisantes soient présentes dans le lait maternel pour induire des symptômes cliniques de blocage bêta-adrénergique chez le nourrisson. Pour réduire l’absorption systémique, voir rubrique 4.2.
Fertilité
Il n’y a aucune donnée disponible concernant l’impact du timolol sur la fertilité.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Aucune étude sur l’aptitude à conduire des véhicules et à utiliser des machines n'a été menée.
Cependant, il faut tenir compte de la possibilité de survenue d’effets indésirables tels que vision trouble, qui peuvent altérer l'aptitude de certains patients à conduire et/ou à utiliser des machines.
Comme les autres médicaments ophtalmiques administrés localement, le timolol est absorbé dans la circulation générale. Cela peut provoquer des effets indésirables similaires à ceux observés avec les bêta-bloquants systémiques. L’incidence d’effets indésirables systémiques après une instillation locale est plus faible qu’en cas d’administration par voie générale.
Les effets indésirables cités incluent les effets observés avec la classe des bêta-bloquants ophtalmiques.
Affections du système immunitaire
Réactions allergiques systémiques incluant angio-œdème, urticaire, rash localisé et généralisé, prurit, réaction anaphylactique.
Troubles du métabolisme et de la nutrition
Hypoglycémie.
Affections psychiatriques
Insomnie, dépression, cauchemars, pertes de mémoire.
Affections du système nerveux
Syncope, accident vasculaire cérébral, ischémie cérébrale, augmentation des signes et symptômes de myasthénie grave, vertiges, paresthésies, céphalées, étourdissements et nervosité.
Affections oculaires
Signes et symptômes d’irritation oculaire (par exemple brûlures, picotements, démangeaisons, larmoiements, rougeur), blépharite, hyperhémie conjonctivale, conjonctivite, kératite, vision trouble et décollement de la choroïde suite à une chirurgie filtrante (voir rubrique 4.4), diminution de la sensibilité cornéenne, sécheresse oculaire, érosion de la cornée, ptosis, diplopie.
Quelques cas rares de calcification cornéenne ont été signalés en association avec l’utilisation de gouttes contenant des phosphates chez certains patients atteints de cornées gravement endommagées.
Affections cardiaques
Bradycardie, douleurs thoraciques, palpitations, œdème, arythmie, insuffisance cardiaque congestive, bloc auriculo-ventriculaire, arrêt cardiaque, insuffisance cardiaque.
Affections de l’oreille et du labyrinthe
Acouphènes.
Affections vasculaires
Hypotension, syndrome de Raynaud, refroidissement des mains et des pieds, aggravation d’une claudication intermittente existante.
Affections respiratoires, thoraciques et médiastinales
Bronchospasme (surtout chez les patients présentant une maladie bronchospastique préexistante), dyspnée, toux, insuffisance respiratoire, essoufflement.
Affections gastro-intestinales
Dysgueusie, nausées, dyspepsie, diarrhée, sécheresse buccale, douleurs abdominales, vomissements.
Affections de la peau et du tissu sous-cutané
Alopécie, éruptions psoriasiformes ou aggravation d’un psoriasis, rash, éruption cutanée.
Affections musculo-squelettiques et systémiques
Myalgie, lupus érythémateux disséminé, arthropathie.
Affections des organes de reproduction et du sein
Dysfonction sexuelle, diminution de la libido, impuissance, maladie de Lapeyronie.
Troubles généraux et anomalies au site d’administration
Asthénie/fatigue, soif.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : www.signalement-sante.gouv.fr.
Il y a eu des cas de surdosage accidentel avec TIMOPTOL se traduisant par des effets systémiques identiques à ceux observés avec les bêta-bloquants administrés par voie générale tels que étourdissements, céphalées, essoufflement, bradycardie, bronchospasme, et arrêt cardiaque (voir rubrique 4.8).
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Classe pharmacothérapeutique : ANTIGLAUCOMATEUX, code ATC : S01ED01, BETA-BLOQUANT
(S : organes sensoriels).
Sur le plan général
Le timolol se caractérise par trois propriétés pharmacologiques :
· bêta-bloquant non cardiosélectif,
· absence de pouvoir agoniste partiel [ou absence d'activité sympathomimétique intrinsèque (ASI)],
· effet stabilisant de membrane (anesthésique local ou quinidine-like) non significatif.
Sur le plan oculaire
· le maléate de timolol en collyre abaisse la tension intra-oculaire, associée ou non à un glaucome ;
· son activité se manifeste environ 20 minutes après instillation, atteint son maximum en 1 à 2 heures et est encore présente au bout de 24 heures ;
· stabilité de l'effet hypotenseur dans le temps : l'effet peut rester constant pendant un an. Une diminution de la sensibilité au maléate de timolol reste cependant possible, notamment après un traitement plus prolongé ;
· il n'y a pratiquement pas de modification du diamètre pupillaire ou de l'accommodation.
Population pédiatrique
Il y a très peu de données disponibles sur l’utilisation du timolol (0,25 %, 0,5 % une goutte deux fois par jour) dans la population pédiatrique pour une période de traitement allant jusqu’à 12 semaines. Une petite étude clinique publiée, en double aveugle, randomisée, menée sur 105 enfants (n = 71 sous timolol) âgés de 12 jours à 5 ans a montré dans une certaine mesure la preuve que le timolol est efficace pour un traitement à court terme dans l’indication du glaucome primaire congénital et du glaucome primaire juvénile.
5.2. Propriétés pharmacocinétiques
Dans une étude sur les concentrations plasmatiques du médicament chez six patients, l'exposition systémique au timolol fut déterminée après administration locale de TIMOPTOL 0,5 % deux fois par jour. Les concentrations plasmatiques moyennes après la prise du matin étaient de 0,46 ng/ml et de 0,35 ng/ml après la prise de l'après-midi.
Population pédiatrique
Comme le confirme déjà les données obtenues chez les adultes, 80 % de chaque goutte de collyre passe par le système nasolacrymal, où elle peut être rapidement absorbée dans la circulation systémique par l’intermédiaire de la muqueuse nasale, la conjonctive, du conduit lacrymonasal, de l’oropharynx et de l’intestin ou par la peau en contact avec une larme.
Chez les enfants, il convient de prendre en compte une concentration plasmatique plus élevée du fait d’un volume sanguin inférieur à celui des adultes. De plus, les nouveau-nés ont un système métabolique enzymatique immature et cela peut aboutir à une augmentation de la demi-vie d’élimination et des effets indésirables éventuels.
Des données limitées montrent que les taux plasmatiques de timolol chez les enfants après 0,25 % dépassent largement ceux de l’adulte après 0,5 %, surtout chez les nourrissons et sont supposés augmenter le risque d’effets secondaires, tels qu’un bronchospasme et une bradycardie.
5.3. Données de sécurité préclinique
Avant ouverture du flacon : 3 ans.
Après ouverture du flacon, le médicament peut être conservé 28 jours maximum.
6.4. Précautions particulières de conservation
A conserver dans l’emballage d'origine à l’abri de la lumière.
6.5. Nature et contenu de l'emballage extérieur
Le flacon de TIMOPTOL contient 3 ml ou 5 ml de solution. Deux types de flacons peuvent être commecialisés.
Flacon blanc translucide en polyéthylène basse densité muni d’un embout compte-goutte transparent et un bouchon blanc.
Flacon OCUMETER PLUS à usage ophtalmique constitué d’un flacon translucide en polyéthylène haute densité muni d'un embout compte-gouttes scellé, d'une face latérale dépressible permettant la libération des gouttes et d'un bouchon assemblé en deux parties. Le mécanisme d'action du bouchon dissocié permet la perforation du compte-gouttes scellé lors de la première utilisation, puis se verrouille pour ne faire plus qu'un pendant la période d'utilisation. L'inviolabilité est assurée par une languette de sécurité située sur l'étiquette du flacon.
Toutes les présentations peuvent ne pas être commercialisées.
6.6. Précautions particulières d’élimination et de manipulation
Mode d'emploi
Les patients doivent être avertis qu'il faut éviter de mettre en contact l'extrémité du flacon et l'œil ou les parties avoisinantes.
Les patients doivent aussi être informés que les solutions ophtalmiques, incorrectement manipulées, peuvent être contaminées par des bactéries communes, connues pour entraîner des infections oculaires. L'usage de solutions contaminées peut provoquer des lésions oculaires graves, voire même une perte de la vision.
Instructions concernant la manipulation
Flacon de 5 ml :
Ne pas utiliser le flacon si la languette de sécurité en plastique n’est pas présente ou est endommagée. Lorsque vous ouvrez le flacon pour la première fois, déchirez la languette de sécurité en plastique.
Chaque fois que vous utilisez TIMOPTOL :
· 1. Lavez-vous les mains.
· 2. Ouvrez le flacon. Faites attention de ne pas toucher votre œil, la peau autour de votre œil ou vos doigts avec l’embout du flacon.
· 3. Inclinez la tête vers l’arrière et tenez le flacon à l’envers au-dessus de votre œil.
· 4. Tirez la paupière inférieure vers le bas et regardez vers le haut. Pressez doucement le flacon pour laisser tomber une goutte dans l’espace entre la paupière inférieure et l’œil.
· 5. Appuyez votre doigt dans le coin de votre œil, à côté du nez, ou fermez vos paupières pendant deux minutes. Cela aide à stopper la propagation du médicament dans le reste du corps.
· 6. Répétez les étapes 3 à 5 pour l’autre œil si votre médecin vous l’a prescrit.
· 7. Remettez le bouchon et fermez soigneusement le flacon.
Flacons OCUMETER PLUS de 3 ml :
1. Avant d'utiliser ce collyre pour la première fois, assurez-vous que la languette de sécurité sur le devant du flacon n’est pas déchirée. Un espace entre le flacon et le bouchon est normal lorsque le flacon n'est pas ouvert.
2. Lavez-vous les mains et déchirez la languette de sécurité pour rompre l'inviolabilité.
3. Pour ouvrir le flacon, dévissez le bouchon en tournant comme indiqué par les flèches sur le dessus du bouchon. Ne tirez pas directement le bouchon vers le haut. En le faisant, vous empêcheriez votre flacon de fonctionner normalement.
4. Inclinez la tête vers l'arrière et tirez légèrement la paupière inférieure vers le bas pour pouvoir instiller les gouttes entre la paupière et l'œil.
5. Renversez le flacon en le tenant au niveau du poussoir avec le pouce ou l'index et pressez doucement jusqu'à ce qu'une seule goutte tombe dans l'œil comme indiqué par votre médecin. NE TOUCHEZ PAS L'ŒIL OU LA PAUPIERE AVEC L'EMBOUT DU FLACON.
6. Une compression du canal lacrymal ou une fermeture des paupières pendant 2 minutes réduit l’absorption systémique. Cela peut entraîner une diminution des effets secondaires systémiques et une augmentation de l’activité locale.
7. Après la première ouverture, si les gouttes s’écoulent difficilement, replacez le bouchon sur le flacon et vissez (NE VISSEZ PAS TROP FORT), puis retirez le bouchon en le dévissant dans l’autre sens comme indiqué par les flèches sur le dessus du bouchon.
8. Répétez les étapes 4 et 5 pour l'autre œil si votre médecin vous l'a prescrit.
9. Revissez le bouchon en tournant jusqu'à ce qu'il soit fermement en contact avec le flacon. Pour une fermeture correcte, la flèche située sur le côté gauche du bouchon doit être alignée avec la flèche située sur le côté gauche de l’étiquette du flacon. Ne vissez pas trop fort, cela pourrait endommager le flacon et le bouchon.
10. L'embout est conçu pour délivrer une seule goutte ; par conséquent, n'élargissez pas le trou de l'embout.
11. Lorsque vous n'arrivez plus à extraire de gouttes, il restera un peu de collyre dans le flacon. Cela ne doit pas vous inquiéter car une quantité supplémentaire de TIMOPTOL a été ajoutée pour vous permettre d'avoir le nombre suffisant de gouttes comme prescrit par votre médecin.
N'essayez pas d'extraire du flacon l'excès de collyre.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
NIITTYHAANKATU 20
33720 TAMPERE
FINLANDE
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 322 432 6 6 : 3 ml en flacon compte-gouttes OCUMETER PLUS (polyéthylène haute densité), boîte de 1.
· 34009 301 644 7 1 : 5 ml en flacon compte-gouttes (polyéthylène basse densité), boîte de 1.
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[À compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[À compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Liste I
ANSM - Mis à jour le : 12/07/2023
TIMOPTOL 0,25 %, collyre en solution
Maléate de timolol
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin, votre pharmacien ou votre infirmier/ère.
· Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d’autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin, votre pharmacien ou votre infirmier/ère. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
1. Qu'est-ce que TIMOPTOL 0,25 %, collyre en solution et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant d'utiliser TIMOPTOL 0,25 %, collyre en solution ?
3. Comment utiliser TIMOPTOL 0,25 %, collyre en solution ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver TIMOPTOL 0,25 %, collyre en solution ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE TIMOPTOL 0,25 %, collyre en solution ET DANS QUELS CAS EST-IL UTILISE ?
Classe pharmacothérapeutique : ANTIGLAUCOMATEUX – code ATC : S01ED01
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D’UTILISER TIMOPTOL 0,25 %, collyre en solution ?
N’utilisez jamais TIMOPTOL 0,25 %, collyre en solution :
· si vous êtes allergique (hypersensible) au maléate de timolol, aux bêta-bloquants ou à l'un des autres composants contenus dans ce médicament mentionnés dans la rubrique 6,
· si vous avez maintenant ou avez eu dans le passé des problèmes respiratoires tels qu’un asthme sévère ou une bronchite chronique obstructive sévère (maladie sévère des poumons pouvant entraîner des sifflements, une difficulté à respirer et/ou une toux persistante),
· si vous avez un rythme cardiaque lent, ou des troubles du rythme cardiaque (battements irréguliers du cœur),
· si vous avez une maladie cardiaque telle que insuffisance cardiaque, non contrôlée médicalement (défaillance des fonctions du cœur non contrôlées par le traitement), hypotension, choc cardiogénique (choc d’origine cardiaque), dysfonctionnement sinusal du cœur (y compris bloc sino-auriculaire), troubles de la conduction cardiaque (bloc auriculo-ventriculaire des 2ème et 3ème degrés),
· si vous avez un angor de Prinzmetal (variété de crises d’angine de poitrine),
· si vous avez un phéochromocytome non traité (production excessive d’hormone des glandes médullo-surrénales provoquant une hypertension artérielle sévère).
En cas de doute, il est indispensable de demander l'avis de votre médecin ou de votre pharmacien.
Avertissements et précautions
Adressez-vous à votre médecin, pharmacien ou votre infirmier/ère avant d’utiliser TIMOPTOL 0,25 %, collyre en solution.
NE PAS INTERROMPRE BRUTALEMENT LE TRAITEMENT SANS L’AVIS DE VOTRE MEDECIN.
NE PAS INJECTER, NE PAS AVALER.
Le suivi de ce traitement nécessite des contrôles ophtalmologiques réguliers, notamment pour vérifier l’absence d’échappement thérapeutique (perte d’efficacité du médicament lors de traitement au long cours).
L’association de deux collyres bêta-bloquants est déconseillée.
Avant d’utiliser ce médicament, informez votre médecin si vous avez maintenant ou avez eu dans le passé :
· des troubles de la fréquence cardiaque tels que rythme cardiaque lent,
· une maladie cardiaque telle que bloc auriculo-ventriculaire du premier degré (les symptômes peuvent inclure douleur ou oppression thoracique, essoufflement ou suffocation), insuffisance cardiaque, pression artérielle basse,
· des problèmes respiratoires, asthme ou maladie pulmonaire chronique obstructive,
· des problèmes de circulation sanguine (tels que la maladie de Raynaud ou le syndrome de Raynaud),
· du diabète car le timolol peut masquer les signes et les symptômes d’une baisse du taux de sucre dans le sang,
· une hyperactivité de la glande thyroïde car le timolol peut en masquer les signes et les symptômes,
· un phéochromocytome : une surveillance étroite de votre pression artérielle sera effectuée,
· un psoriasis,
· des réactions allergiques : chez les patients susceptibles de faire une réaction allergique sévère, notamment au cours d’une désensibilisation,
· une insuffisance rénale ou hépatique : une surveillance étroite sera effectuée, notamment de votre rythme cardiaque,
· une thyrotoxicose (maladie de la thyroïde) : cette classe de médicaments (les bêta-bloquants) peut masquer les signes cardiovasculaires.
Si vous devez subir une intervention chirurgicale, prévenez votre médecin que vous prenez TIMOPTOL car le timolol peut modifier les effets de certains médicaments utilisés pendant l’anesthésie.
Si vous portez des lentilles de contact, demandez l’avis de votre médecin avant d’utiliser ce médicament du fait de la diminution de la sécrétion de larmes et du risque d’altération des lentilles souples par le conservateur.
En cas de doute, n’hésitez pas à demander l'avis de votre médecin ou de votre pharmacien.
Utilisation chez le sujet âgé
La posologie doit être réduite lors de l’initiation du traitement et une surveillance attentive doit être effectuée.
Enfants
Les collyres en solution contenant du timolol doivent être d’une manière générale utilisés avec précaution chez les jeunes patients. Chez les nouveau-nés, les nourrissons et les jeunes enfants, le timolol doit être utilisé avec une extrême précaution. Si de la toux, une respiration sifflante, une respiration anormale ou des pauses anormales de respiration (apnée) apparaissent, l’utilisation de ce médicament doit être arrêtée immédiatement. Contactez votre médecin aussi vite que possible. Un moniteur d’apnée portable peut également être utile.
Le timolol a été étudié chez des nourrissons et des enfants âgés de 12 jours à 5 ans dont la pression de (des) l’œil (yeux) était augmentée ou à qui un glaucome avait été diagnostiqué. Pour plus d’information, parlez-en à votre médecin.
Autres médicaments et TIMOPTOL 0,25 %, collyre en solution
Une surveillance ophtalmologique est nécessaire en cas de traitement concomitant par un collyre contenant de l’adrénaline (risque de mydriase).
L’activité de TIMOPTOL peut modifier ou être modifiée par d’autres médicaments que vous utilisez y compris d’autres collyres pour le traitement du glaucome.
Informez votre médecin si vous utilisez ou avez l’intention de prendre des médicaments qui baissent la pression artérielle, traitent les maladies cardiaques ou le diabète.
Informez votre médecin ou votre pharmacien si vous prenez, avez récemment pris ou pourriez prendre tout autre médicament, notamment de l'amiodarone, certains antagonistes du calcium (bépridil, vérapamil, diltiazem), des bêta-bloquants, y compris des médicaments délivrés sans ordonnance.
Ceci est particulièrement important si :
· vous prenez des médicaments pour diminuer la pression artérielle, pour traiter une maladie cardiaque (tels qu’inhibiteurs calciques, bêta-bloquants ou digoxine),
· vous prenez des médicaments pour traiter un rythme cardiaque irrégulier ou perturbé (tels que inhibiteurs calciques, bêta-bloquants ou digoxine),
· vous utilisez un autre collyre qui contient un bêta-bloquant,
· vous prenez un parasympathomimétique qui peut vous avoir été prescrit pour vous aider à uriner. Les parasympathomimétiques appartiennent à une famille de médicaments qui sont parfois également utilisés pour aider à la restauration d’un transit intestinal normal,
· vous prenez un médicament pour traiter le diabète,
· vous prenez un médicament antidépresseur tel que fluoxétine ou paroxétine,
· vous prenez un médicament de la classe des sulfamides,
· vous prenez de la quinidine (médicament utilisé dans le traitement des maladies cardiaques et certains types de paludisme).
TIMOPTOL 0,25 %, collyre en solution avec des aliments et boissons
Sans objet.
Grossesse, allaitement et fertilité
Vous ne devez pas utiliser TIMOPTOL si vous êtes enceinte à moins que votre médecin ne le juge nécessaire.
Si vous êtes enceinte ou que vous allaitez, si vous pensez être enceinte ou planifiez une grossesse, demandez conseil à votre médecin ou votre pharmacien avant de prendre ce médicament.
N’utilisez pas TIMOPTOL si vous allaitez. Le maléate de timolol peut passer dans le lait maternel. Demandez conseil à votre médecin avant de prendre tout médicament pendant l’allaitement.
Sportifs
Attention : cette spécialité contient un principe actif pouvant induire une réaction positive des tests pratiqués lors des contrôles antidopage.
Conduite de véhicules et utilisation de machines
Aucune étude sur l’aptitude à conduire des véhicules et à utiliser des machines n'a été menée.
Cependant, il faut tenir compte de la possibilité de survenue d’effets indésirables tels que vision trouble, qui peuvent altérer l'aptitude de certains patients à conduire et/ou à utiliser des machines.
TIMOPTOL 0,25 %, collyre en solution contient du chlorure de benzalkonium et des phosphates
Ce médicament contient 0,10 mg de chlorure de benzalkonium par ml de solution.
Le chlorure de benzalkonium peut être absorbé par les lentilles de contact souples et changer leur couleur. Retirer les lentilles de contact avant application et attendre au moins 15 minutes avant de les remettre.
Le chlorure de benzalkonium peut également provoquer une irritation des yeux, surtout si vous souffrez du syndrôme de l’œil sec ou de troubles de la cornée (couche transparente à l’avant de l’œil). En cas de sensation anormale, de picotements ou de douleur dans les yeux après avoir utilisé ce médicament, contactez votre médecin.
Ce médicament contient 8,15 mg de phosphate monosodique dihydraté et 29,21 mg de phosphate disodique dodécahydraté par ml de solution.
Si vous souffrez de dommages sévères de la cornée (couche transparente située à l’avant de l’oeil) les phosphates peuvent causer, dans de très rares cas, des troubles de la vision en raison de l’accumulation de calcium pendant le traitement (nuage).
3. COMMENT UTILISER TIMOPTOL 0,25 %, collyre en solution ?
Veillez à toujours utiliser ce médicament en suivant exactement les indications de votre médecin. Verifiez auprès de votre médecin ou pharmacien en cas de doute.
A titre indicatif la posologie usuelle est de : 1 goutte dans l'œil malade, 2 fois par jour (matin et soir).
Mode et voie d’administration
Voie locale.
EN INSTILLATION OCULAIRE.
· Evitez tout contact de l'embout du flacon avec l'œil ou les parties avoisinantes. Il pourrait être contaminé par des bactéries responsables d’infections qui peuvent entraîner des lésions graves de l’œil, voire même la perte de la vision. Pour éviter la contamination possible du flacon, lavez-vous les mains avant utilisation de ce collyre et empêchez tout contact de l’embout du flacon avec son environnement. Si vous pensez que votre médicament a pu être contaminé ou si vous présentez une infection oculaire, contactez immédiatement votre médecin afin de savoir si vous pouvez réutiliser ce flacon.
Mode d’administration
Flacon de 5 ml :
Ne pas utiliser le flacon si la languette de sécurité en plastique n’est pas présente ou est endommagée. Lorsque vous ouvrez le flacon pour la première fois, déchirez la languette de sécurité en plastique.
Chaque fois que vous utilisez TIMOPTOL :
|
|||
|
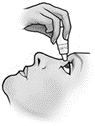
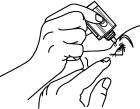
3. Inclinez la tête vers l’arrière et tenez le flacon à l’envers au-dessus de votre œil. |
|
||
|
4. Tirez la paupière inférieure vers le bas et regardez vers le haut. Pressez doucement le flacon pour laisser tomber une goutte dans l’espace entre la paupière inférieure et l’œil. |
|
||
|
5. Appuyez votre doigt dans le coin de votre œil, à côté du nez, ou fermez vos paupières pendant deux minutes. Cela aide à stopper la propagation du médicament dans le reste du corps. 6. Répétez les étapes 3 à 5 pour l’autre œil si votre médecin vous l’a prescrit 7. Remettez le bouchon et fermez soigneusement le flacon. |
|
||
Flacons OCUMETER PLUS de 3ml :
|
|
1. Avant d’utiliser ce collyre pour la première fois, assurez-vous que la languette de sécurité sur le devant du flacon n’est pas déchirée. Un espace entre le flacon et le bouchon est normal lorsque le flacon n’est pas ouvert.
|
|
|
2. Lavez-vous les mains et déchirez la languette de sécurité pour rompre l’inviolabilité.
|
|
|
3. Pour ouvrir le flacon, dévissez le bouchon en tournant comme indiqué par les flèches sur le dessus du bouchon. Ne tirez pas directement le bouchon vers le haut. En le faisant vous empêcheriez votre flacon de fonctionner normalement.
|
|
|
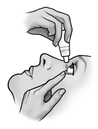
4. Inclinez la tête vers l'arrière et tirez légèrement la paupière inférieure vers le bas pour pouvoir instiller les gouttes entre la paupière et l'œil.
|
|
|
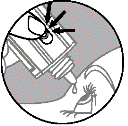
5. Renversez le flacon en le tenant au niveau du poussoir avec le pouce ou l'index (voir schéma). Pressez doucement jusqu’à ce qu’une seule goutte tombe dans l’œil comme indiqué par votre médecin.
|
NE TOUCHEZ PAS L'ŒIL OU LA PAUPIERE AVEC L'EMBOUT DU FLACON.
|
|
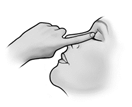
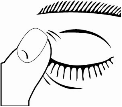
6. Après instillation de TIMOPTOL, appuyez votre doigt dans le coin de l’œil, à côté du nez (comme indiqué sur le schéma ci-dessous) pendant environ deux minutes. Cela permet de mieux conserver TIMOPTOL dans votre œil. L’œil fermé, essuyez proprement l’excédent.
|
7. Après la première ouverture, si les gouttes s’écoulent difficilement, replacez le bouchon sur le flacon et vissez (NE VISSEZ PAS TROP FORT), puis retirez le bouchon en le dévissant dans l’autre sens comme indiqué par les flèches sur le dessus du bouchon.
8. Répétez les étapes 4 et 5 pour l'autre œil si votre médecin vous l'a prescrit.
9. Revissez le bouchon en tournant jusqu'à ce qu'il soit fermement en contact avec le flacon. Pour une fermeture correcte, la flèche située sur le côté gauche du bouchon doit être alignée avec la flèche située sur le côté gauche de l’étiquette du flacon. Ne vissez pas trop fort, cela pourrait endommager le flacon et le bouchon.
10. L’embout est conçu pour délivrer une seule goutte ; par conséquent, n’élargissez pas le trou de l’embout.
11. Lorsque vous n’arrivez plus à extraire de gouttes, il restera un peu de collyre dans le flacon. Cela ne doit pas vous inquiéter car une quantité supplémentaire de TIMOPTOL a été ajoutée pour vous permettre d’avoir le nombre suffisant de gouttes comme prescrit par votre médecin. N’essayez pas d’extraire du flacon l’excès de collyre.
Les solutions ophtalmiques, incorrectement manipulées, peuvent être contaminées par des bactéries communes, connues pour entraîner des infections oculaires. L'usage de solutions contaminées peut provoquer des lésions oculaires graves et une baisse de la vision. Si vous pensez que votre médicament a pu être contaminé ou si vous présentez une infection oculaire, contactez immédiatement votre médecin afin de savoir si vous pouvez réutiliser ce flacon.
Fréquence d'administration
2 instillations par jour.
Les horaires des 2 instillations quotidiennes vous seront précisés par votre ophtalmologiste.
Durée du traitement
Respecter la prescription du médecin.
Ne pas interrompre le traitement sans avis médical.
Utilisation chez les enfants
Posologie
Un examen médical complet doit être réalisé avant l’utilisation de timolol. Votre médecin fera très attention à évaluer les risques et les bénéfices avant d’envisager un traitement avec du timolol. Si les bénéfices sont supérieurs aux risques, il est recommandé d’utiliser la plus petite concentration disponible de principe actif une fois par jour.
Concernant « l’utilisation chez l’enfant », la concentration de 0,1 % en principe actif peut être suffisante pour contrôler la pression à l’intérieur de l’œil. Si la pression n’est pas suffisamment contrôlée avec ce dosage, une administration deux fois par jour à 12 heures d’intervalle peut être nécessaire. Les patients, particulièrement les nouveau-nés, doivent être étroitement surveillés pendant une à deux heures après la première administration et les effets indésirables doivent être attentivement surveillés jusqu’à ce que la chirurgie soit réalisée.
Mode d’administration
Seule une goutte de timolol doit être instillée à chaque administration.
Après instillation, gardez les yeux fermés aussi longtemps que possible (par exemple 3 à 5 minutes) et maintenez une pression au niveau de l’angle de l’œil le plus près de votre nez pour empêcher la diffusion de la goutte de timolol dans tout votre corps.
Durée du traitement
Chez l’enfant, le timolol sera prescrit dans le cadre d’un traitement transitoire.
Si vous avez utilisé plus de TIMOPTOL 0,25 %, collyre en solution que vous n’auriez dû
Si vous mettez trop de gouttes ou si vous avalez accidentellement le contenu du flacon, il se peut entre autres effets, que vous ayez des étourdissements, que vous ayez des difficultés à respirer ou que vous sentiez que votre pouls a ralenti.
Consultez immédiatement votre médecin ou votre pharmacien.
Si vous oubliez d’utiliser TIMOPTOL 0,25 %, collyre en solution
Il est important d’utiliser TIMOPTOL selon la prescription de votre médecin.
Si vous oubliez de mettre une dose, mettez-la dès que possible, sauf s’il est presque l’heure de la dose suivante. Dans ce cas, passez la dose oubliée et reprenez votre traitement normalement.
Ne mettez pas de dose double pour compenser la dose que vous avez oubliée.
Si vous arrêtez d’utiliser TIMOPTOL 0,25 %, collyre en solution
Si vous interrompez votre traitement, votre pression intra-oculaire peut augmenter et entraîner une détérioration de votre vision.
N’interrompez pas votre traitement sans l’avis de votre médecin.
Si vous avez d’autres questions sur l’utilisation de ce médicament, demandez plus d’informations à votre médecin ou à votre pharmacien.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Vous pouvez continuer à prendre les gouttes normalement à moins que les effets ne soient graves. Si vous êtes inquiet, parlez-en à votre médecin ou pharmacien. N’arrêtez pas TIMOPTOL sans en avoir parlé à votre médecin.
Comme d’autres médicaments instillés dans l’œil, le timolol passe dans le sang. Ceci peut provoquer des effets indésirables similaires à ceux observés avec des médicaments bêta-bloquants administrés par voie orale ou intraveineuse. L’incidence de ces effets indésirables après instillation dans l’œil est moins importante que si le médicament est pris par exemple par voie orale ou par injection. Les effets indésirables listés incluent les réactions observées dans la classe des bêta-bloquants lors de leur utilisation dans le traitement des maladies oculaires.
· Réactions allergiques généralisées, notamment des gonflements sous la peau (qui peuvent se produire dans des zones comme le visage et les membres, et qui peuvent obstruer les voies aériennes, en entraînant des difficultés respiratoires ou de déglutition), urticaire (ou démangeaisons), éruptions cutanées localisées ou généralisées, démangeaisons, réaction allergique brusque et grave pouvant entraîner un risque vital.
· Diminution du taux de sucre dans le sang (hypoglycémie).
· Troubles du sommeil (insomnie), dépression, cauchemars, pertes de mémoire, nervosité.
· Perte de connaissance, accidents vasculaires cérébraux, diminution de l’apport sanguin au niveau du cerveau, augmentation des signes et symptômes de la myasthénie grave (désordre musculaire), vertiges, sensations inhabituelles (comme des picotements), maux de tête, étourdissements.
· Signes et symptômes d’irritation oculaire (par exemple sensation de brûlure, picotements, démangeaisons, larmoiements, rougeurs), inflammation de la paupière, rougeur conjonctivale, conjonctivite, inflammation de la cornée, vision trouble et décollement de la couche sous la rétine contenant les vaisseaux sanguins suite à une chirurgie filtrante pouvant entraîner des troubles visuels, réduction de la sensibilité de la cornée, sécheresse des yeux, érosion de la cornée (dommages à la couche supérieure du globe oculaire), affaissement de la paupière supérieure (rendant l’œil mi-clos), vision double, troubles visuels comprenant des modifications de la réfraction (dues parfois à l’arrêt du traitement par les myotiques).
· Pouls lent, douleur dans la poitrine, palpitations, œdème (accumulation de fluides), changements de rythme ou de vitesse des battements du cœur, insuffisance cardiaque congestive (maladie cardiaque caractérisée par un essoufflement et un gonflement des pieds et des jambes due à l’accumulation de fluides), un certain type de trouble du rythme cardiaque, attaque cardiaque, insuffisance cardiaque.
· Hypotension, syndrome de Raynaud, mains et pieds froids, claudication (crampes dans les jambes et/ou douleurs dans les jambes lors de la marche).
· Constriction des voies respiratoires au niveau des poumons (de façon prédominante chez les patients déjà atteints par une pathologie), difficultés respiratoires, toux, insuffisance respiratoire, essoufflement.
· Troubles du goût, nausées, indigestion, diarrhées, bouche sèche, douleurs abdominales, vomissements.
· Perte de cheveux, éruptions cutanées d’aspect blanc argenté (éruptions psoriasiformes) ou aggravation de psoriasis, éruptions cutanées.
· Douleurs musculaires non provoquées par de l’exercice, lupus érythémateux disséminé.
· Troubles sexuels, diminution de la libido, impuissance.
· Faiblesse/fatigue musculaire.
· Soif.
· Acouphènes.
· Hallucination.
En présence de tout symptôme anormal, consultez immédiatement votre médecin.
Si vous remarquez des effets indésirables non mentionnés dans cette notice, parlez-en à votre médecin ou votre pharmacien.
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : www.signalement-sante.gouv.fr
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER TIMOPTOL 0,25 %, collyre en solution ?
Tenir ce médicament hors de la vue et de la portée des enfants.
N’utilisez pas ce médicament après la date de péremption indiquée sur l’étiquette du flacon et la boîte après « EXP ». La date de péremption fait référence au dernier jour de ce mois.
Après ouverture du flacon, le médicament peut être conservé 28 jours maximum.
Ce médicament ne nécessite pas de précautions particulières de conservation concernant la température.
A conserver dans l’emballage d'origine à l’abri de la lumière.
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient TIMOPTOL 0,25 %, collyre en solution
· La substance active est :
Maléate de timolol.......................................................................................................... 0,342 g
Quantité correspondant à timolol base............................................................................. 0,250 g
Pour 100 ml de collyre en solution.
· Les autres composants sont :
Phosphate monosodique dihydraté, phosphate disodique dodécahydraté, chlorure de benzalkonium, hydroxyde de sodium, eau purifiée.
Qu’est-ce que TIMOPTOL 0,25 %, collyre en solution et contenu de l’emballage extérieur
Ce médicament se présente sous forme de collyre en solution en flacon de 3 ml ou 5 ml.
Titulaire de l’autorisation de mise sur le marché
NIITTYHAANKATU 20
33720 TAMPERE
FINLANDE
Exploitant de l’autorisation de mise sur le marché
TOUR W, 102 TERRASSE BOIELDIEU
92800 PUTEAUX
LABORATOIRES MERCK SHARP & DOHME-CHIBRET
ROUTE DE MARSAT, LIEU-DIT MIRABEL
RIOM
63963 CLERMONT-FERRAND CEDEX 9
Ou
SANTEN OY
KELLOPORTINKATU 1
33100 TAMPERE
FINLANDE
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Sans objet.
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).