Dernière mise à jour le 08/01/2026
AMBRISENTAN STRAGEN 10 mg, comprimé pelliculé
Indications thérapeutiques
Classe pharmacothérapeutique : Anti-hypertenseurs, autres anti-hypertenseurs - code ATC : C02KX02
Qu’est-ce que AMBRISENTAN STRAGEN 10 mg, comprimé pelliculé
AMBRISENTAN STRAGEN contient la substance active « ambrisentan ». Ce médicament appartient à une classe de médicaments appelés « autres anti-hypertenseurs » (utilisés pour traiter une pression artérielle élevée).
Dans quels cas AMBRISENTAN STRAGEN 10 mg, comprimé pelliculé est-il utilisé
AMBRISENTAN STRAGEN est utilisé pour traiter l’hypertension artérielle pulmonaire (HTAP) chez l’adulte, l’adolescent et l’enfant âgé de 8 ans et plus. L’HTAP est définie par une élévation de la pression artérielle dans les vaisseaux sanguins (les artères pulmonaires) qui transportent le sang entre le cœur et les poumons. Chez les patients atteints d’HTAP, ces artères se rétrécissent, et le cœur doit fournir un effort supplémentaire pour pomper le sang. Ceci provoque une fatigue, des vertiges et des essoufflements.
AMBRISENTAN STRAGEN élargit les artères pulmonaires et facilite ainsi le pompage du sang par le cœur. Ceci fait diminuer la pression sanguine et réduit les symptômes.
AMBRISENTAN STRAGEN peut aussi être utilisé en association avec d’autres médicaments pour traiter l’HTAP.
Présentations
> plaquette(s) PVC PVDC aluminium de 30 comprimé(s)
Code CIP : 34009 302 013 9 8
Déclaration de commercialisation : 03/11/2020
Cette présentation est agréée aux collectivités
Service médical rendu (SMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprès de la HAS (plus d'informations dans l'aide). Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Modéré | Avis du 24/06/2020 | Inscription (CT) | Le service médical rendu par AMBRISENTAN OHRE PHARMA 5 mg et AMBRISENTAN OHRE PHARMA 10 mg est modéré dans l’indication de l’AMM. |
Amélioration du service médical rendu (ASMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprés de la HAS (plus d'informations dans l'aide). Les avis et synthéses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur de l'ASMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| V (Inexistant) | Avis du 24/06/2020 | Inscription (CT) | Ces spécialités sont des génériques qui n’apportent pas d’amélioration du service médical rendu (ASMR V) par rapport aux princeps déjà inscrits (VOLIBRIS 5 mg et 10 mg, comprimé pelliculé). |
Autres informations
- Titulaire de l'autorisation : STRAGEN-France
- Conditions de prescription et de délivrance :
- liste I
- médicament nécessitant une surveillance particulière pendant le traitement
- prescription hospitalière
- prescription réservée aux spécialistes et services CARDIOLOGIE
- prescription réservée aux spécialistes et services MEDECINE INTERNE
- prescription réservée aux spécialistes et services PNEUMOLOGIE
- Statut de l'autorisation : Valide
- Type de procédure : Procédure nationale
- Code CIS : 6 008 555 3
ANSM - Mis à jour le : 05/07/2024
AMBRISENTAN STRAGEN 10 mg, comprimé pelliculé
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Ambrisentan ......................................................................................................................... 10 mg
Pour un comprimé pelliculé.
Excipient(s) à effet notoire :
Chaque comprimé contient 95 mg de lactose (sous forme monohydratée), environ 0,21 mg de lécithine (de soja) (E322) et environ 0,405 mg de laque aluminique rouge Allura AC (E129).
Pour la liste complète des excipients, voir rubrique 6.1.
Comprimé pelliculé rose, oblong, biconvexe, avec la marque « 10 » sur une face et lisse sur l’autre, d’une taille d’environ 11,1 mm et une largeur nominale d'environ 5,6 mm.
4.1. Indications thérapeutiques
AMBRISENTAN STRAGEN est indiqué, seul ou en association, dans le traitement de l'hypertension artérielle pulmonaire (HTAP) chez les patients adolescents et les enfants (âgés de 8 ans à moins de 18 ans) en classe fonctionnelle II et III (classification OMS). L'efficacité a été montrée dans l'HTAP idiopathique, familiale, congénitale corrigée et dans l'HTAP associée à une collagénose systémique (voir rubrique 5.1).
4.2. Posologie et mode d'administration
Posologie
Adulte
Ambrisentan en monothérapie
L’ambrisentan doit être débuté par voie orale à la dose de 5 mg une fois par jour et peut être augmenté à 10 mg par jour en fonction de la réponse clinique et de la tolérance.
Ambrisentan en association avec le tadalafil
Utilisé en association avec le tadalafil, la dose préconisée d’ambrisentan est de 10 mg une fois par jour.
Dans l’étude AMBITION, les patients recevaient 5 mg par jour d’ambrisentan durant les 8 premières semaines et la dose quotidienne était ensuite augmentée à 10 mg en fonction de la tolérance (voir rubrique 5.1). Associé au tadalafil à la dose de 20 mg, le traitement par ambrisentan était débuté à la dose de 5 mg. En fonction de la tolérance, la dose de tadalafil était ensuite augmentée à 40 mg après 4 semaines et celle de l'ambrisentan était augmentée à 10 mg après 8 semaines. Plus de 90 % des patients ont suivi ce schéma posologique. Les doses pouvaient aussi être baissées en fonction de la tolérance.
Des données limitées suggèrent que l'interruption brutale de l’ambrisentan n'est pas associée à un effet rebond avec aggravation de l’hypertension artérielle pulmonaire.
Ambrisentan en association avec la cyclosporine A
Chez l’adulte, en cas de co-administration avec la ciclosporine A, la dose d'ambrisentan doit être limitée à 5 mg une fois par jour et le patient devra faire l'objet d'une étroite surveillance (voir rubriques 4.5 et 5.2).
Enfants et adolescents âgés de 8 ans à moins de 18 ans
Ambrisentan en monothérapie ou en association avec d'autres traitements de l'HTAP
L’ambrisentan doit être pris par voie orale selon le schéma posologique décrit ci-dessous :
|
Poids corporel (kg) |
Dose initiale journalière (mg) |
Dose suivante journalière ajustée (mg)a |
|
≥ 50 ≥ 35 to < 50 ≥ 20 to < 35 |
5 5 2,5 |
10 7,5 5 |
|
a = dépend de la réponse clinique et de la tolérance (voir rubrique 5.1) |
||
Ambrisentan en association avec la cyclosporine A
Dans la population pédiatrique, en association avec la ciclosporine A, la dose d'ambrisentan pour les patients ≥ 50 kg doit être limitée à 5 mg une fois par jour, et pour les patients ≥ 20 et < 50 kg doit être limitée à 2,5 mg une fois par jour. Le patient devra être étroitement surveillé (voir rubriques 4.5 et 5.2).
Populations particulières
Sujets âgés
Aucune adaptation posologique n'est nécessaire chez les patients de plus de 65 ans (voir rubrique 5.2).
Patients insuffisants rénaux
Aucune adaptation posologique n'est nécessaire chez les patients insuffisants rénaux (voir rubrique 5.2). Les données d'utilisation de l’ambrisentan étant limitées chez les patients atteints d'insuffisance rénale sévère (clairance de la créatinine < 30 mL/min), le traitement doit être initié avec précaution dans cette population et une attention particulière doit être portée en cas d’augmentation de la dose à 10 mg d’ambrisentan.
Patients insuffisants hépatiques
L’ambrisentan n'a pas été étudié chez les sujets présentant une insuffisance hépatique (avec ou sans cirrhose). Comme les principales voies métaboliques de l'ambrisentan sont la glucuronoconjugaison et l'oxydation avec élimination par voie biliaire, l'insuffisance hépatique pourrait augmenter l'exposition systémique (Cmax et ASC) en ambrisentan. Par conséquent, un traitement par ambrisentan ne doit pas être instauré chez les patients présentant une insuffisance hépatique sévère ou une augmentation des aminotransférases hépatiques cliniquement significative (plus de 3 fois la limite normale supérieure (> 3 x LNS) ; voir rubriques 4.3 et 4.4).
Population pédiatrique
La sécurité et l'efficacité de l’ambrisentan n’ont pas été établies chez l’enfant de moins de 8 ans. Aucune donnée clinique humaine n’est disponible (voir rubrique 5.3 concernant les données disponibles chez les jeunes animaux).
Mode d’administration
Il est recommandé d’avaler le comprimé entier sans le croquer, au cours ou en dehors des repas. Il est recommandé de ne pas couper, écraser ou mâcher le comprimé.
· Grossesse (voir rubrique 4.6)
· Femmes en âge de procréer n’utilisant pas de méthode de contraception fiable (voir rubriques 4.4 et 4.6)
· Allaitement (voir rubrique 4.6)
· Insuffisance hépatique sévère (avec ou sans cirrhose) (voir rubrique 4.2)
· Taux initial des aminotransférases hépatiques (aspartate aminotransférase (ASAT) et/ou alanine aminotransférase (ALAT) > 3 x LNS (voir rubriques 4.2 et 4.4)
· Fibrose pulmonaire idiopathique avec ou sans hypertension pulmonaire associée (voir rubrique 5.1)
4.4. Mises en garde spéciales et précautions d'emploi
L'efficacité de l’ambrisentan en monothérapie n'a pas été établie chez les patients atteints d'hypertension artérielle pulmonaire en classe fonctionnelle IV (classification OMS). En cas de détérioration de l'état clinique, un traitement recommandé pour le stade sévère de la maladie (ex. époprosténol) doit être envisagé.
Fonction hépatique
Des anomalies de la fonction hépatique ont été associées à l'HTAP. Des cas compatibles avec une hépatite auto-immune, incluant une possible exacerbation d’hépatite auto-immune sous-jacente, des cas d’atteinte hépatique et d’élévations des enzymes hépatiques potentiellement liés au traitement ont été observés avec l’ambrisentan (voir rubriques 4.8 et 5.1). Les aminotransférases hépatiques sériques (ALAT et ASAT) doivent par conséquent être dosées avant l'initiation du traitement par ambrisentan et le traitement ne doit pas être initié chez les patients dont les taux sériques d'ASAT et/ou ALAT sont supérieurs à 3 fois la limite normale supérieure (3 x LNS) (voir rubrique 4.3).
Les patients doivent faire l’objet d’une surveillance afin de déceler tout signe d’atteinte hépatique et un suivi mensuel des taux d'ALAT et ASAT est recommandé. Si un patient présente une augmentation cliniquement significative, prolongée et inexpliquée des taux d'ALAT et/ou d'ASAT, ou si cette augmentation s'accompagne de signes ou de symptômes d'atteinte hépatique (ex. ictère), la prise d’ambrisentan doit être interrompue.
Chez les patients ne présentant pas de symptôme clinique d'atteinte hépatique ou d'ictère, la réintroduction de l’ambrisentan après normalisation des taux sériques d'enzymes hépatiques peut être envisagée. L'avis d'un médecin spécialiste hépatologue est recommandé.
Taux d'hémoglobine
Des diminutions du taux d'hémoglobine et de l'hématocrite ont été associées aux antagonistes des récepteurs de l'endothéline (ARE), y compris avec l’ambrisentan. Dans la majorité des cas, la diminution a été observée au cours des 4 premières semaines de traitement et le taux d'hémoglobine s'est ensuite généralement stabilisé. Au cours de l'étude d'extension en ouvert des études cliniques pivotales de phase 3, les diminutions moyennes des taux d'hémoglobine observées sur le long terme par rapport aux taux à l'inclusion (de 0,9 jusqu'à 1,2 g/dL) ont persisté jusqu'à 4 ans de traitement par ambrisentan. Depuis la mise sur le marché, des cas d'anémie nécessitant une transfusion sanguine ont été rapportés (voir rubrique 4.8).
L'instauration du traitement par ambrisentan n'est pas recommandée chez des patients présentant une anémie cliniquement significative. Un contrôle des taux d'hémoglobine et/ou de l'hématocrite est recommandé pendant la prise d’ambrisentan, par exemple 1 mois et 3 mois après le début du traitement et ensuite périodiquement selon la pratique clinique. Si une diminution cliniquement significative de l'hémoglobine ou de l'hématocrite est observée, alors que d'autres causes ont été exclues, une diminution de la dose ou une interruption du traitement devra être envisagée. L’incidence des anémies était plus élevée lorsque l’ambrisentan était associé avec du tadalafil (15 % de la fréquence des évènements indésirables), comparativement au traitement en monothérapie par ambrisentan ou tadalafil (7 % et 11 % respectivement).
Rétention hydrique
Des œdèmes périphériques ont été observés avec les antagonistes des récepteurs de l'endothéline (ARE), y compris avec l’ambrisentan. La plupart des cas d'œdèmes périphériques rapportés au cours des études cliniques avec l’ambrisentan ont été d’intensité légère à modérée, cependant ils peuvent être plus fréquents et d’intensité plus importante chez les patients d'âge ≥ 65 ans. Les œdèmes périphériques ont été plus fréquemment rapportés avec la dose de 10 mg d’ambrisentan dans les études cliniques à court terme (voir rubrique 4.8).
Des cas de rétention hydrique survenant dans les semaines suivant la mise en route d'un traitement par l’ambrisentan ont été rapportés depuis sa commercialisation.
Certains cas ont nécessité un traitement diurétique ou une hospitalisation pour traitement de la surcharge hydrique ou d'une décompensation cardiaque. En cas de rétention hydrique préexistante, le traitement par ambrisentan ne sera initié qu'après traitement approprié de la surcharge hydrique.
Si une rétention hydrique, avec ou sans prise de poids associée, apparait au cours du traitement par ambrisentan, les investigations appropriées devront être menées afin de distinguer si elle est liée à la prise d’ambrisentan ou à une décompensation cardiaque sous-jacente, et décider en conséquence de la nécessité d'un traitement spécifique ou de l'arrêt du traitement par ambrisentan. L’incidence des œdèmes périphériques était plus élevée lorsque l’ambrisentan était associé avec le tadalafil (45 % de la fréquence des évènements indésirables), comparativement aux traitements en monothérapie par ambrisentan ou tadalafil (38 % et 28 % respectivement). Les œdèmes périphériques sont survenus en majorité au cours du premier mois de traitement.
Femmes en âge de procréer
Chez la femme en âge de procréer, une grossesse doit être exclue avant la mise en route du traitement et doit ensuite être évitée par une méthode de contraception fiable. En cas de doute sur le choix du mode de contraception adapté à la patiente, la consultation d'un médecin spécialiste gynécologue doit être envisagée. Des tests de grossesse mensuels sont recommandés pendant le traitement par ambrisentan (voir rubriques 4.3 et 4.6).
Maladie veino-occlusive pulmonaire
Des cas d'œdème pulmonaire ont été rapportés avec des médicaments vasodilatateurs, tels que les antagonistes des récepteurs de l'endothéline (ARE), lorsqu'ils sont utilisés chez des patients ayant une maladie veino-occlusive pulmonaire. Par conséquent, si des patients atteints d'hypertension artérielle pulmonaire développent un œdème pulmonaire aigu sous traitement par ambrisentan, la possibilité d'une maladie pulmonaire veino-occlusive devra être évoquée.
Utilisation concomitante avec d'autres médicaments
Les patients traités par ambrisentan doivent faire l'objet d'une étroite surveillance lorsqu'ils débutent un traitement par rifampicine (voir rubriques 4.5 et 5.2).
Excipients
Lactose
Ce médicament contient du lactose. Les patients présentant une intolérance au galactose, un déficit total en lactase ou un syndrome de malabsorption du glucose et du galactose (maladies héréditaires rares) ne doivent pas prendre ce médicament.
Agent colorant azoïque
Ce médicament contient un agent colorant azoïque (laque aluminique rouge Allura AC (E129)), qui peut provoquer des réactions allergiques.
Lécithine de soja
Ce médicament contient de la lécithine de soja, il ne doit pas être utilisé en cas d'allergie à l’arachide ou au soja (voir rubrique 4.3).
Sodium
Ce médicament contient moins de 1 mmol (23 mg) de sodium par comprimé, c’est-à-dire qu’il est essentiellement « sans sodium ».
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Dans des études réalisées in vitro et in vivo chez l'animal, l'ambrisentan n'a provoqué ni inhibition ni induction des enzymes impliquées dans les phases I ou II du métabolisme des médicaments aux concentrations utilisées en thérapeutique, ce qui suggère un faible potentiel d'interactions sur le profil pharmacocinétique des médicaments métabolisés par ces voies.
L'induction potentielle de l'activité du CYP3A4 par l'ambrisentan a été étudiée chez des volontaires sains ; les résultats suggèrent une absence d'effet inducteur de l'ambrisentan sur l'isoenzyme CYP3A4.
Ciclosporine A
A l'état d'équilibre, la co-administration d'ambrisentan et de ciclosporine A a doublé l'exposition à l'ambrisentan chez des volontaires sains. Ce phénomène peut être dû à l'inhibition par la ciclosporine A des transporteurs et des enzymes métaboliques impliqués dans la pharmacocinétique de l'ambrisentan. Par conséquent, en cas d’administration concomitante avec la ciclosporine A, la dose d'ambrisentan doit être limitée à 5 mg une fois par jour chez l’adulte ou les patients pédiatriques pesant ≥ 50 kg et à 2,5 mg une fois par jour chez les patients pédiatriques pesant de ≥ 20 kg à < 50 kg (voir rubrique 4.2). L'administration de doses multiples d'ambrisentan n'a pas eu d'effet sur l'exposition à la ciclosporine A et aucun ajustement posologique de la ciclosporine A n'est justifié.
Rifampicine
L’administration concomitante de rifampicine (qui est un inhibiteur du transporteur polypeptide des anions organiques (OATP), un puissant inducteur des cytochromes CYP3A et 2C19, et un inducteur de la glycoprotéine P (P-gp) et des uridine-diphospho-glucuronosyltransférases [UGT]), a été associée à une augmentation transitoire (environ 2 fois) de l'exposition à l'ambrisentan suite à l'initiation du traitement chez des volontaires sains. Toutefois, à J8, l’administration à l’état d’équilibre de la rifampicine n'a pas entraîné d’effet cliniquement significatif sur l'exposition à l'ambrisentan. Les patients traités par ambrisentan doivent faire l'objet d'une étroite surveillance lorsqu'ils débutent un traitement par rifampicine (voir rubriques 4.4 et 5.2).
Inhibiteurs de la phosphodiestérase
L'administration concomitante d'ambrisentan et d'un inhibiteur de la phosphodiestérase, que ce soit le sildénafil ou le tadalafil (tous deux substrats du CYP3A4) chez des volontaires sains, n'a pas entraîné de modifications significatives de la pharmacocinétique de l'inhibiteur de la phosphodiestérase ni de celle de l'ambrisentan (voir rubrique 5.2).
Autres traitements ciblés de l’HTAP
L'efficacité et la sécurité de l’ambrisentan lors de l’administration concomitante avec d'autres traitements de l'hypertension artérielle pulmonaire (ex. prostanoïdes et stimulateurs de la guanylate cyclase soluble) n'ont pas été spécifiquement étudiées dans des essais cliniques contrôlés menés chez des patients atteints d'HTAP (voir rubrique 5.1). Au vu des données disponibles concernant la métabolisation, il n'est pas attendu d'interaction médicamenteuse entre l’ambrisentan et les stimulateurs de la guanylate cyclase soluble ou les prostanoïdes (voir rubrique 5.2). Cependant aucune étude spécifique d’interactions médicamenteuses n’a été réalisée avec ces médicaments. Par conséquent, la prudence est recommandée en cas d'administration concomitante.
Contraceptifs oraux
Dans une étude clinique menée chez des volontaires sains, l’administration à l’état d’équilibre pharmacocinétique de 10 mg d'ambrisentan une fois par jour n'a pas entraîné de modifications significatives de la pharmacocinétique d'une dose unique d'un contraceptif oral associant l'éthinylestradiol et la noréthindrone (voir rubrique 5.2). Selon cette étude pharmacocinétique, l'ambrisentan ne devrait pas avoir d'effet significatif sur l'exposition aux œstrogènes ou à la progestérone des contraceptifs oraux.
Warfarine
L'ambrisentan n'a eu aucun effet sur la pharmacocinétique à l'état d'équilibre et sur l'activité anticoagulante de la warfarine chez le volontaire sain (voir rubrique 5.2). Par ailleurs, la warfarine n'a eu aucun effet cliniquement significatif sur la pharmacocinétique de l'ambrisentan. De plus, chez les patients atteints d'hypertension artérielle pulmonaire, il n'a pas été observé de retentissement sur la dose hebdomadaire utilisée des anticoagulants de type warfarine nécessaire, sur le temps de prothrombine (TP) et sur le rapport normalisé international (INR).
Kétoconazole
L'administration de kétoconazole (puissant inhibiteur du CYP3A4) à l'état d'équilibre pharmacocinétique n'a pas entraîné d'augmentation cliniquement significative de l'exposition à l'ambrisentan (voir rubrique 5.2).
Effet de l'ambrisentan sur les transporteurs de xénobiotiques
In vitro, l'ambrisentan n'a eu aucun effet inhibiteur sur les transporteurs humains à des concentrations cliniquement significatives, incluant la glycoprotéine P (P-gp), la BCRP (breast cancer resistance protein), la MRP2 (multi-drug resistance protein isoform-2), la BSEP (bile salt export pump), les OATPB1 et OATPB3 (organic anion transporting polypeptides) et le NTCP (sodium-dependent taurocholate co-transporting polypeptide).
Ambrisentan est un substrat de la glycoprotéine P (P-gp).
Des études in vitro effectuées sur des hépatocytes de rat ont également montré que l'ambrisentan n’était pas un inducteur des protéines P-gp, BSEP ou MRP2.
L’administration répétée de l'ambrisentan chez des volontaires sains n'a pas eu d'effets cliniquement significatifs sur la pharmacocinétique de la digoxine administrée en dose unique, substrat de la P-gp (voir rubrique 5.2).
Population pédiatrique
Les études d'interaction n'ont été réalisées que chez l’adulte.
4.6. Fertilité, grossesse et allaitement
Femmes en âge de procréer
Chez les femmes en âge de procréer, le traitement par ambrisentan ne doit être initié qu’après obtention d'un test de grossesse négatif et à condition qu’une méthode de contraception fiable soit utilisée. Des tests mensuels de grossesse sont recommandés au cours du traitement par ambrisentan.
Grossesse
L’ambrisentan est contre-indiqué durant la grossesse (voir rubrique 4.3). Les études réalisées chez l'animal ont montré que l'ambrisentan était tératogène. Il n'y a pas de données chez l'homme.
Les femmes traitées par ambrisentan doivent être informées du risque pour le fœtus et un traitement alternatif devra être initié en cas de grossesse (voir rubriques 4.3, 4.4 et 5.3).
Allaitement
Il n'existe pas de données sur le passage de l'ambrisentan dans le lait maternel humain. L'excrétion de l'ambrisentan dans le lait n'a pas été étudiée chez l'animal. L’allaitement est par conséquent contre-indiqué pendant le traitement par ambrisentan (voir rubrique 4.3).
Fertilité masculine
Le développement d'une atrophie tubulaire testiculaire lié à l'administration chronique des antagonistes des récepteurs de l'endothéline (ARE) a été observé chez les animaux mâles, y compris avec l’ambrisentan (voir rubrique5.3). Bien qu'il n’ait pas été clairement mis en évidence d'effet délétère sur le nombre de spermatozoïdes lors d'une administration au long cours de l’ambrisentan dans l'étude ARIES E, l'administration chronique d'ambrisentan a été associée à des modifications des marqueurs de la spermatogénèse. Une diminution de la concentration plasmatique de l'inhibine B et une augmentation de la concentration plasmatique de la FSH ont été observées. L'effet de l’ambrisentan sur la fertilité chez l'homme n'est pas connu mais l'éventualité d'une altération de la spermatogenèse ne peut être exclue. L'administration chronique d'ambrisentan n'a pas été associée à une modification de la testostérone plasmatique dans les études cliniques.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Résumé du profil de sécurité
Les effets indésirables les plus fréquemment observés avec l'ambrisentan ont été : œdème périphérique (37 %) et céphalées (28 %). L’utilisation de la dose la plus forte (10 mg) a été associée à une incidence plus élevée de ces effets indésirables, et une tendance à une majoration de la sévérité des œdèmes périphériques a été observée chez les sujets ≥ 65 ans dans les études cliniques à court-terme (voir rubrique 4.4).
Les effets indésirables graves associés à l'utilisation de l'ambrisentan comprennent l'anémie (diminution de l'hémoglobine, diminution de l'hématocrite) et l'hépatotoxicité.
Des diminutions de concentration en hémoglobine et de l’hématocrite (10 %) ont été associées à des antagonistes des récepteurs de l’endothéline (ARE) incluant l'ambrisentan. La plupart de ces diminutions ont été détectées au cours des 4 premières semaines de traitement et la concentration en hémoglobine s'est généralement stabilisée par la suite (voir rubrique 4.4).
Des élévations des enzymes hépatiques (2 %), des lésions hépatiques et des hépatites auto-immunes (y compris l'exacerbation de la maladie sous-jacente) ont été observées avec l'ambrisentan (voir rubriques 4.4 et 5.1).
Liste tabulée des effets indésirables
La convention suivante a été utilisée pour la classification des fréquences : très fréquent (≥ 1/10), fréquent (≥ 1/100 à < 1/10), peu fréquent (≥ 1/1000 à < 1/100), rare (≥ 1/10 000 à < 1/1000), très rare (< 1/10 000) et fréquence indéterminée (ne peut être estimée sur la base des données disponibles). Pour les effets indésirables dose dépendants les fréquences de survenue correspondent à la dose la plus élevée d’ambrisentan. Dans chaque groupe de fréquence, les effets indésirables sont présentés par ordre de sévérité décroissante.
|
Catégorie de système d’organes |
Fréquence |
Effet(s) indésirable(s) |
|
Affections hématologiques et du système lymphatique |
Très fréquent |
Anémie (diminution de l’hémoglobine, diminution de l'hématocrite)1 |
|
Affections du système immunitaire |
Fréquent |
Réactions d'hypersensibilité (ex : angioedème, éruption cutanée, prurit) |
|
Affections du système nerveux |
Très fréquent |
Céphalées (incluant des céphalées sinusales, migraines)2, sensations vertigineuses |
|
Affections oculaires |
Fréquent |
Vision floue, troubles visuels |
|
Affections de l’oreille et du labyrinthe |
Fréquent |
Acouphènes3 |
|
Peu fréquent |
Perte soudaine de l’audition3 |
|
|
Affections cardiaques |
Très fréquent |
Palpitations |
|
Fréquent |
Insuffisance cardiaque4 |
|
|
Affections vasculaires |
Très fréquent |
Bouffées vasomotrices5 |
|
Fréquent |
Hypotension, syncope |
|
|
Affections respiratoires, thoraciques et médiastinales |
Très fréquent |
Dyspnée6, congestion des voies respiratoires hautes (ex. nez, sinus)7, rhinopharyngite7 |
|
Fréquent |
Epistaxis, rhinite7, sinusite7 |
|
|
Affections gastro-intestinales |
Très fréquent |
Nausées, diarrhée, vomissements5 |
|
Fréquent |
Douleurs abdominales, constipation |
|
|
Affections hépatobiliaires |
Fréquent |
Elévation des transaminases hépatiques |
|
Peu fréquent |
Atteinte hépatique (voir rubrique 4.4), hépatite auto-immune (voir rubrique 4.4) |
|
|
Affections de la peau et du tissu sous-cutané |
Fréquent |
Eruption cutanée8 |
|
Troubles généraux et anomalies au site d'administration |
Très fréquent |
Oedème périphérique, rétention hydrique, douleur/gêne thoracique5, fatigue |
|
Fréquent |
Asthénie |
1 Voir paragraphe « Description de certains effets indésirables ».
2 La fréquence des céphalées apparait plus élevée avec 10 mg d’ambrisentan.
3 Des cas ont été observés uniquement dans une étude clinique contrôlée contre placebo, de l’ambrisentan associé au tadalafil.
4 La plupart des cas d'insuffisance cardiaque rapportés étaient associés à une rétention hydrique.
5 Ces fréquences ont été observées dans une étude clinique contrôlée de l’ambrisentan associé au tadalafil comparativement au placebo. Une incidence plus faible a été observée avec l'ambrisentan en monothérapie.
6 Des cas d'aggravation de dyspnée d'étiologie indéterminée ont été rapportés peu de temps après le début du traitement par ambrisentan.
7 L'incidence des congestions nasales pendant le traitement par ambrisentan est apparue dose-dépendante.
8 Eruption cutanée incluant des éruptions érythémateuses, des éruptions généralisées, des éruptions papuleuses et des éruptions prurigineuses.
Description de certains effets indésirables
Diminution de l'hémoglobine
Depuis la mise sur le marché, des cas d’anémie nécessitant une transfusion sanguine ont été rapportés (voir rubrique 4.4). La fréquence de diminution de l'hémoglobine (anémie) apparaît plus élevée avec 10 mg d’ambrisentan. Durant les 12 semaines d’études cliniques de Phase 3 contrôlées versus placebo, les taux moyens d'hémoglobine ont diminué chez les patients des groupes ambrisentan et ces diminutions ont été détectées dès la quatrième semaine (diminution de 0,83 g/dL). Les variations par rapport à la valeur à l’inclusion ont semblé se stabiliser au cours des huit semaines suivantes. Au total, 17 patients (6,5 %) des groupes traités par ambrisentan ont présenté une diminution du taux d'hémoglobine d'au moins 15 % par rapport à l’inclusion et le taux était inférieur à la limite inférieure de la normale.
Population pédiatrique
La sécurité de l'ambrisentan chez les patients pédiatriques atteints d'HTAP âgés de 8 ans à moins de 18 ans a été évaluée chez 41 patients traités par ambrisentan 2,5 mg ou 5 mg une fois par jour (groupe à faible dose) ou par ambrisentan 2,5 mg ou 5 mg une fois par jour augmenté jusqu’à 5 mg, 7,5 mg ou 10 mg en fonction du poids corporel (groupe à dose élevée), seul ou en association avec d'autres médicaments de l'HTAP pendant 24 semaines dans une étude en ouvert de phase 2b. La sécurité a ensuite été évaluée dans une étude d'extension à long terme chez 38 des 41 sujets. Les effets indésirables observés, qui ont été évalués comme étant liés à l'ambrisentan, correspondaient à ceux observés dans les études contrôlées chez les patients adultes : les céphalées (15 %, 6/41 sujets pendant les 24 semaines de l'étude en ouvert de phase 2b et 8 %, 3/38 sujets pendant l’étude d’extension à long terme) et la congestion nasale (7 %, 3/41 sujets pendant les 24 semaines de l'étude en ouvert de phase 2b) étant les plus fréquentes.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/.
Du fait de son mécanisme d'action, un surdosage par ambrisentan peut potentiellement entraîner une hypotension (voir rubrique 5.3). L'hypotension induite peut être sévère et nécessiter un traitement de réanimation. Aucun antidote n'est disponible.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Classe pharmacothérapeutique : Anti-hypertenseurs, autres anti-hypertenseurs, code ATC : C02KX02
Mécanisme d'action
Ambrisentan est un antagoniste sélectif des récepteurs de type A de l'endothéline (ETA), actif par voie orale appartenant à la catégorie des acides propioniques. L'endothéline joue un rôle important dans la physiopathologie de l'hypertension artérielle pulmonaire.
Ambrisentan est un antagoniste ETA (environ 4000 fois plus sélectif pour ETA par rapport à ETB). Ambrisentan bloque les récepteurs de sous-type ETA, principalement localisés sur les cellules des muscles lisses vasculaires et sur les cardiomyocytes, ce qui empêche l'activation des médiateurs de l'endothéline, messagers secondaires dans le processus de vasoconstriction et de prolifération des cellules musculaires lisses. La sélectivité d'ambrisentan pour le récepteur ETA plus que pour le récepteur ETB permet de respecter la production médiée par le récepteur ETB de vasodilatateurs comme le monoxyde d'azote et de prostacycline.
Efficacité et sécurité cliniques
Deux essais pivot de phase 3, multicentriques, randomisés, en double aveugle, contrôlés contre placebo ont été réalisés (ARIES-1 et 2). L'essai ARIES-1 incluant 201 patients, a comparé ambrisentan 5 mg et ambrisentan 10 mg au placebo. L'essai ARIES-2 incluant 192 patients, a comparé ambrisentan 2,5 mg et ambrisentan 5 mg au placebo. Dans ces deux études, l’ambrisentan a été ajouté au traitement préexistant, qui pouvait inclure une association de digoxine, d'anticoagulants, de diurétiques, d'oxygène et de vasodilatateurs (inhibiteurs des canaux calciques et inhibiteurs ACE). Les patients inclus présentaient une HTAP idiopathique ou une HTAP associée à une collagénose systémique. La majorité des patients était en classe fonctionnelle II (38,4 %) ou III (55,0 %) selon la classification OMS. Les patients atteints d'insuffisance hépatique préexistante (cirrhose ou taux d’aminotransférases cliniquement significatif) et les patients utilisant d'autres thérapies de l'hypertension artérielle pulmonaire (par exemple prostanoïdes) ont été exclus. Les paramètres hémodynamiques n'ont pas été évalués durant ces études.
Le critère principal défini pour ces études de phase 3 était l'amélioration de la capacité à l'exercice mesurée par le changement par rapport à la valeur à l’inclusion des résultats au test de marche de 6 minutes à 12 semaines. Dans les deux études, le traitement par ambrisentan a entraîné une amélioration significative du test de marche à 6 minutes pour chacune des doses d’ambrisentan étudiées.
Dans les études ARIES-1 et ARIES- 2, l'amélioration de la distance moyenne parcourue durant le test de marche pendant 6 minutes à la semaine 12 était, après ajustement de l'effet placebo, respectivement de 30,6 m (IC 95 % : 2,9 à 58,3 ; p = 0,008) et de 59,4 m (IC 95 %: 29,6 à 89,3 ; p < 0,001) dans le groupe ambrisentan 5 mg. Pour l’étude ARIES-1, l'amélioration de la distance moyenne parcourue durant le test de marche à 6 minutes à la semaine 12 était de 51,4 m (IC 95 % : 26,6 à 76,2 ; p < 0,001) dans le groupe ambrisentan 10 mg.
Une analyse combinée des études de phase 3 (ARIES-C) conduite selon des modalités pré-spécifiées dans le protocole a retrouvé une amélioration sur la moyenne des différences observées par rapport au placebo des tests de marche à 6 minutes après 12 semaines de traitement : 44,6 m (IC 95 % : 24,3 à 64,9 ; p < 0,001) dans le groupe ambrisentan 5 mg et de 52,5 m (IC 95 % : 28,8 à 76,2 ; p< 0,001) dans le groupe ambrisentan 10 mg.
Dans l’étude ARIES-2 (groupe recevant des doses combinées), l’ambrisentan a significativement retardé l'aggravation clinique de l’HTAP par rapport au placebo (p < 0,001), le Hazard ratio a démontré une réduction de 80 % (IC 95 % : 47 % à 92 %). Cette évaluation englobait : le décès, la transplantation, l'hospitalisation pour HTAP, la septostomie auriculaire, l’ajout d'autres agents thérapeutiques pour le traitement de l’HTAP. Une amélioration statistiquement significative dans le domaine concernant les fonctions physiques évalué par le questionnaire d'échelle de qualité de vie SF-36 Health Survey, a été observée pour le groupe recevant les doses combinées d’ambrisentan (3,41 ± 6,96) par rapport au placebo (- 0,20 ± 8,14, p = 0,005). Le traitement par ambrisentan a amélioré de façon statistiquement significative la dyspnée évaluée par l'Index de Dyspnée de Borg (IDB) à la semaine 12 après ajustement de l’effet placebo de - 1,1 (IC 95 % : - 1,8 à - 0,4 ; p = 0,019 ; groupe recevant la dose combinée).
Données à long terme
Les patients inclus dans les études ARIES-1 et 2 étaient éligibles pour entrer dans l’étude d'extension à long terme en ouvert ARIES-E (n = 383). L'exposition moyenne calculée sur l'ensemble des données des 2 études était d'environ 145 ± 80 semaines, et l'exposition maximale d'environ 295 semaines. Les critères d'évaluation principaux de cette étude étaient l'incidence et la sévérité des effets indésirables associés à une administration au long cours de l'ambrisentan, incluant les anomalies des tests sanguins de la fonction hépatique. La tolérance observée à long terme dans cette étude était globalement superposable à celle observée dans les études contrôlées comparativement au placebo de 12 semaines.
Le taux de survie des patients sous ambrisentan (tous groupes de doses d’ambrisentan combinés) à 1, 2 et 3 ans était respectivement de 93 %, 85 % et 79 %.
Dans une étude conduite en ouvert (AMB222), l’ambrisentan a été administré chez 36 patients afin d'évaluer l'incidence de l'augmentation des taux sériques d'aminotransférases chez les patients qui avaient précédemment arrêté d’autres traitements avec un antagoniste des récepteurs de l'endothéline en raison d'anomalies des taux d'aminotransférases. Pendant une durée moyenne de 53 semaines de traitement par ambrisentan, aucun des patients inclus n'a présenté un taux d'ALAT sérique confirmé > 3 x LNS nécessitant un arrêt définitif du traitement. Cinquante pour cent des patients étaient passés de 5 mg à 10 mg d’ambrisentan pendant cette période.
L'incidence cumulée des anomalies des taux d'aminotransférases sériques > 3 x LNS dans l'ensemble des études cliniques de phase 2 et 3 (y compris les extensions d'essais) a été de 17 sur 483 patients sur une durée d'exposition moyenne de 79,5 semaines. Soit un taux d'évènements de 2,3 pour 100 patients-années exposés à l’ambrisentan. Au cours de l'étude d'extension à long terme en ouvert ARIES-E, le risque à 2 ans de développer des élévations des aminotransférases sériques > 3 x LNS chez les patients traités par ambrisentan était de 3,9 %.
Autres informations cliniques
Dans l'étude de phase 2 (AMB220), une amélioration des paramètres hémodynamiques a été observée après 12 semaines de traitement chez les patients (n = 29) présentant une HTAP. Le traitement par ambrisentan a entraîné une augmentation de l'index cardiaque moyen, une diminution de la pression artérielle pulmonaire moyenne et une diminution de la résistance vasculaire pulmonaire moyenne.
Une diminution de la pression artérielle systolique et diastolique a été rapportée sous traitement par ambrisentan. Dans des études cliniques contrôlées comparativement au placebo d'une durée de 12 semaines, la réduction moyenne de la pression artérielle systolique et diastolique entre les valeurs à l'inclusion et celles observées à la fin du traitement ont été respectivement, de 3 mmHg et 4,2 mmHg. Au cours de l'étude d'extension en ouvert ARIES E, les diminutions moyennes de la pression artérielle systolique et diastolique ont persisté jusqu'à 4 ans de traitement par ambrisentan.
Aucun effet cliniquement significatif relatif à la pharmacocinétique de l’ambrisentan ou du sildénafil n’a été observé pendant une étude d’interaction effectuée chez des volontaires sains, et l’association a été bien tolérée. Dans les études ARIES-E et AMB222, 22 patients (5,7 %) et 17 patients (47 %) respectivement ont reçu un traitement concomitant d’ambrisentan et de sildénafil. Aucun problème d'intolérance supplémentaire n'a été détecté chez ces patients.
Efficacité clinique en association avec le tadalafil
Une étude clinique de phase 3 conduite en fonction de la survenue d’événements, multicentrique en double aveugle utilisant un comparateur actif a été menée afin d'évaluer l’efficacité de l’association thérapeutique en première intention d’ambrisentan et de tadalafil (bithérapie) comparativement à un traitement en monothérapie par l’ambrisentan ou le tadalafil chez 500 patients naïfs de traitement pour l’HTAP, randomisés selon le ratio 2:1:1 (AMB112565/AMBITION). Aucun des patients n’avait reçu de placebo seul. L'analyse principale reposait sur la comparaison des données en bithérapie avec celles regroupées des deux en monothérapies. Des comparaisons entre le groupe en bithérapie et chacun des deux groupes en monothérapie ont également été effectuées. Les patients ayant une anémie, une rétention hydrique ou des maladies rares de la rétine cliniquement significatives selon le jugement de l’investigateur, étaient exclus de l’étude. Les patients ayant des valeurs d’ALAT et d’ASAT > 2 x LNS à l’inclusion ont également été exclus.
A l’inclusion, 96 % des patients étaient naïfs de tout traitement spécifique de l’HTAP et le délai médian entre le diagnostic et l’inclusion dans l’étude était de 22 jours. Les patients débutaient leur traitement avec 5 mg d’ambrisentan et 20 mg de tadalafil puis les doses étaient augmentées à 40 mg de tadalafil à la 4ème semaine et à 10 mg d’ambrisentan à la 8ème semaine sauf en cas d'intolérance. La durée médiane de traitement en double aveugle pour la bithérapie était supérieure à 1,5 ans.
Le critère principal était le délai de survenue du premier échec clinique défini par :
· la survenue du décès ou
· une hospitalisation pour aggravation de l’HTAP
· une progression de la maladie
· une réponse clinique à long terme jugée non satisfaisante
La moyenne d’âge des patients était de 54 ans (DS 15; 18 - 75 ans). A l’inclusion, les patients étaient en classe fonctionnelle II (31 %) et III (69 %) (classification de l’OMS). Par ordre de fréquence, l'étiologie de l'HTAP dans la population de l'étude était : HTAP idiopathique ou familiale (56 %), HTAP associée à une connectivite (37 %), HTAP associée à la prise de médicaments ou une exposition à des toxiques (3 %), HTAP associée à une malformation cardiaque congénitale opérée (2 %) et HTAP associée à une infection par le VIH (2 %).
Les patients en classe fonctionnelle II et III (classification de l’OMS) avaient une distance moyenne de marche de 6 minutes de 353 mètres à l’inclusion
Résultats sur le critère principal combiné
Le traitement par bithérapie a réduit le risque de 50 % (hazard ratio [HR] : 0,502 [IC 95 %: 0,348 ; 0,724], p = 0,0002) du critère composite de survenue du premier échec clinique jusqu'à la dernière visite d'évaluation par rapport aux monothérapies groupées (figure 1 et tableau 1 ci-dessous). L'effet du traitement observé était principalement en relation avec à une réduction de 63 % des hospitalisations dans le groupe traité par la bithérapie. Cet effet a été observé précocement et s’est maintenu dans le temps. L’efficacité de la bithérapie sur le critère principal a été retrouvée lors de la comparaison avec chacune des monothérapies et dans les sous-groupes d'âge, d'origine ethnique, de région géographique, d'étiologie (HTAP idiopathique ou familiale et HTAP associée à une connectivite). L'effet était significatif pour les patients en classe fonctionnelle II et pour les patients en classe fonctionnelle III.
Figure 1
Délai de survenue d’échec clinique
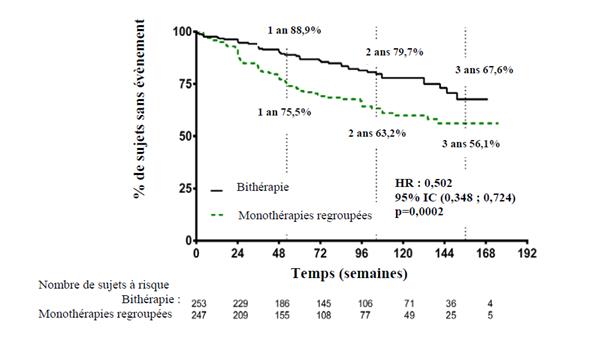 Tableau 1
Tableau 1
|
|
Ambrisentan + Tadalafil (N = 253) |
Monothérapies Regroupées (N = 247) |
Ambrisentan en monothérapie (N = 126) |
Tadalafil en monothérapie (N = 121) |
|
Délai de survenue du premier échec clinique (adjudiqué) |
||||
|
Echec clinique, no. (%) |
46 (18 %) |
77 (31 %) |
43 (34 %) |
34 (28 %) |
|
Hazard ratio (95 % IC) |
|
0,502 (0,348 ; 0,724) |
0,477 (0,314; 0,723) |
0,528 (0,338; 0,827) |
|
P-value, test du log-rank |
|
0,0002 |
0,0004 |
0,0045 |
|
Evènements du critère principal composite (délai de survenue du premier échec clinique) (adjudiqué) |
||||
|
Décès (toutes causes confondues) |
9 (4 %) |
8 (3 %) |
2 (2 %) |
6 (5 %) |
|
Hospitalisation pour aggravation de l’HTAP |
10 (4 %)
|
30 (12 %)
|
18 (14 %)
|
12 (10 %)
|
|
Progression de la maladie |
10 (4 %) |
16 (6 %) |
12 (10 %) |
4 (3 %) |
|
Réponse clinique insatisfaisante à long terme |
17 (7 %)
|
23 (9 %)
|
11 (9 %)
|
12 (10 %)
|
|
Délai de survenue de la première hospitalisation pour aggravation de l’HTAP (adjudiqué) |
||||
|
Première hospitalisation, no. (%) |
19 (8 %)
|
44 (18 %)
|
27 (21 %)
|
17 (14 %)
|
|
Hazard ratio (95 % IC) |
|
0,372 |
0,323 |
0,442 |
|
P-value, test du log-rank |
|
0,0002 |
< 0,0001 |
0,0124 |
Critères secondaires
Des critères secondaires ont été testés :
Tableau 2
|
Critères secondaires (changement entre la valeur initiale et la semaine 24) |
Ambrisentan + Tadalafil
|
Monothérapies regroupées
|
Différence [Intervalle de Confiance]
|
p value
|
|
NT-pro BNP (% de réduction) |
- 67,2
|
- 50,4
|
Différence en %: - 33,8; [95 % IC: - 44,8 ; - 20,7] |
p < 0,0001
|
|
% de sujets ayant une réponse clinique satisfaisante à la semaine 24 |
39
|
29
|
Odds ratio 1,56; [95 % IC: 1,05 ; 2,32]
|
p = 0,026
|
|
Distance de marche à 6 minutes (mètres, changement médian) |
49,0 |
23,8 |
22,75 [95 % IC: 12,00 ; 33,50] |
p < 0,0001 |
Fibrose pulmonaire idiopathique
Une étude a été conduite chez 492 patients (ambrisentan N = 329, placebo N = 163) atteints de fibrose pulmonaire idiopathique, parmi lesquels 11 % présentaient une hypertension pulmonaire associée (groupe 3 de la classification OMS) ; cette étude a été prématurément arrêtée lorsqu'il a été mis en évidence que l'objectif sur le critère de jugement principal d'efficacité ne pourrait pas être atteint (étude ARTEMIS-IPF). Quatre-vingt-dix patients traités par ambrisentan (27 %) ont présenté des événements correspondant à une progression de la fibrose pulmonaire idiopathique (incluant des hospitalisations pour aggravations respiratoires) ou un décès comparativement à 28 patients (17 %) dans le groupe placebo. L'ambrisentan est par conséquent contre-indiqué chez les patients ayant une fibrose pulmonaire idiopathique avec ou sans hypertension pulmonaire associée (voir rubrique 4.3).
Population pédiatrique
Étude AMB112529
La sécurité et la tolérance de l'ambrisentan une fois par jour pendant 24 semaines ont été évaluées dans une étude non contrôlée en ouvert chez 41 patients pédiatriques atteints d'HTAP âgés de 8 ans à moins de 18 ans (médiane : 13 ans). L'étiologie de l'HTAP était idiopathique (n = 26 ; 63 %), congénitale persistante malgré une correction chirurgicale (n = 11 ; 27 %), secondaire à une maladie du tissu conjonctif (n = 1 ; 2 %), ou familiale (n = 3 ; 7,3 %). Parmi les 11 sujets présentant une cardiopathie congénitale, 9 avaient une communication interventriculaire, 2 une communication interauriculaire et 1 une persistance du canal artériel. Les patients étaient en classe fonctionnelle II (n = 32 ; 78 %) ou III (n = 9 ; 22 %) (classification OMS) au début du traitement de l'étude. A l'entrée dans l'étude, les patients étaient traités par des médicaments de l'HTAP (le plus souvent PDE5i en monothérapie [n = 18 ; 44 %], PDE5i en association avec des prostanoïdes [n = 8 ; 20 %]) ou des prostanoïdes en monothérapie [n = 1 ; 2 %], et ils ont poursuivi leur traitement de l'HTAP pendant toute la durée de l'étude. Les patients ont été divisés en deux groupes selon la dose : ambrisentan 2,5 mg ou 5 mg une fois par jour (faible dose, n = 21) et ambrisentan 2,5 mg ou 5 mg une fois par jour augmentée jusqu’à 5 mg, 7,5 mg ou 10 mg en fonction du poids corporel (forte dose, n = 20). Un total de 20 patients des deux groupes a reçu la dose ajustée à 2 semaines en fonction de la réponse clinique et de la tolérance ; 37 patients ont terminé l'étude ; 4 patients sont sortis d'étude.
Il n’a pas été observé de tendance à une dose dépendance de l'effet de l'ambrisentan sur le principal critère d'efficacité, à savoir la capacité à l’effort (TDM6 : Test de marche de 6 minutes). La variation moyenne entre l’inclusion et la semaine 24 du TDM6 pour les patients des groupes recevant une faible ou une forte dose ayant une mesure à l’inclusion et à 24 semaines était respectivement de + 55,14 m (IC 95 % : 4,32 à 105,95) chez 18 patients et de + 26,25 m (IC 95 % : 4,59 à 57,09) chez 18 patients. La variation moyenne du TDM6 entre l’inclusion et la semaine 24 pour l'ensemble des 36 patients (regroupant les deux groupes) était de + 40,69 m (IC à 95 % : 12,08 à 69,31). Ces résultats étaient cohérents avec ceux observés chez les adultes. À la semaine 24, 95 % des patients du groupe à faible dose et 100 % de ceux du groupe à forte dose sont restés stables (classe fonctionnelle inchangée ou améliorée). L'estimation de la survie sans événement par la méthode de Kaplan Meyer concernant l'aggravation de l'HTAP (décès [toutes causes confondues], transplantation pulmonaire ou hospitalisation pour aggravation de l'HTAP ou détérioration liée à l'HTAP) à 24 semaines était respectivement de 86 % et 85 % dans les groupes à faible et forte dose.
Les paramètres hémodynamiques ont été mesurés chez 5 patients (groupe à faible dose). L'augmentation moyenne de l'index cardiaque par rapport à l’inclusion était de + 0,94 L/min/m2, la diminution moyenne de la pression artérielle pulmonaire moyenne était de - 2,2 mmHg et la diminution moyenne de la résistance vasculaire pulmonaire (RVP) était de – 277 dyn s/cm5 (- 3,46 mmHg/L/min).
Chez les patients pédiatriques atteints d'HTAP ayant reçu de l'ambrisentan pendant 24 semaines, la diminution de la moyenne géométrique par rapport à l’inclusion du NT-pro-BNP était de 31 % dans le groupe à faible dose (2,5 et 5 mg) et de 28 % dans le groupe à forte dose (5, 7,5 et 10 mg).
Étude AMB114588
Des données à long terme ont été générées à partir de 38 des 41 patients pédiatriques atteints d’HTAP et âgés de 8 à moins de 18 ans qui ont été traités par l'ambrisentan dans l'étude randomisée de 24 semaines. La plupart des patients qui ont complété cette étude d’extension à long terme présentaient une HTAP idiopathique ou héréditaire (68%) conformément à l’inclusion de l’étude AMB112529. La durée moyenne d'exposition (± écart-type) au traitement par ambrisentan était d’environ 4,0 ± 2,5 ans (intervalle : 3 mois à 10,0 ans). Les patients pouvaient recevoir un traitement supplémentaire de l’HTAP si nécessaire dans l’étude d'extension en ouvert et la dose d’ambrisentan pouvait être ajustée par paliers de 2,5 mg. Globalement, 66 % des patients qui ont complété l’étude d’extension ont conservé la même dose d’ambrisentan que celle utilisée dans l’étude AMB112529.
L'aggravation clinique a été définie comme un décès (toutes causes confondues), une inscription sur la liste des patients devant bénéficier d’une transplantation pulmonaire ou d’une septostomie auriculaire, ou une détérioration de l'HTAP entraînant une hospitalisation, une modification de la dose d'ambrisentan, l'ajout ou la modification de dose d’un traitement spécifique HTAP existant, une aggravation de la classe fonctionnelle de l'OMS, une diminution de 20 % du TDM6 ou des signes/symptômes d'insuffisance cardiaque droite. A un moment déterminé de l’évaluation, 71 % des patients n’avaient pas eu d'aggravation de l'HTAP, tandis que 11 participants (29 %) dans les 4 groupes de doses avaient eu au moins un critère d’aggravation clinique avec pour 5 d’entre eux (45 %) plusieurs critères d’aggravation. Les estimations de la survie de Kaplan Meier étaient de 94,74 % et 92,11 %, 3 et 4 ans après le début du traitement.
L’analyse des variations entre le début de l’étude AMB112529 et la fin de l’étude d’extension a montré une augmentation moyenne du TDM6 de 58,4 ± 88 mètres (amélioration de 17 % par rapport au début de l'étude) dans tous les groupes de dose.
A l’inclusion de l'étude AMB114588, les 4 classes fonctionnelles de l'OMS (I, II, III et IV) étaient représentées par les patients, dont plus de la moitié d'entre eux étaient en classe II (n = 22 ; 58 %) et les autres patients en classe I (n = 9 ; 24 %), en classe III (n = 6 ; 16 %) ou en classe IV (n = 1 ; 3 %). L’analyse des changements survenus entre le début et la fin de l'étude d’extension (N = 29) a montré une amélioration (45 %) ou aucun changement (55 %), et aucune détérioration de la classe fonctionnelle de l'OMS, ainsi qu'une augmentation moyenne du TDM6 de 17,0 %.
5.2. Propriétés pharmacocinétiques
L’ambrisentan est rapidement absorbé chez l’homme. Après administration orale, les concentrations plasmatiques maximales (Cmax) de l’ambrisentan sont obtenues généralement en 1,5 h environ après la prise, à jeun ou non. La Cmax et l’aire sous la courbe de la concentration plasmatique en fonction du temps (ASC) augmentent proportionnellement à la dose, dans l'intervalle posologique administré. L’état d'équilibre est généralement obtenu après 4 jours de doses répétées.
Une étude de l'influence de l'alimentation portant sur l’administration d’ambrisentan chez des volontaires sains à jeun et après un repas riche en graisses a indiqué que la Cmax était diminuée de 12 % tandis que l’ASC demeurait identique. Cette diminution du pic de concentration n’est pas cliniquement significative et par conséquent, l’ambrisentan peut être pris avec ou sans repas.
Distribution
L’ambrisentan est fortement lié aux protéines plasmatiques. In vitro, l’ambrisentan était lié en moyenne à 98,8 % aux protéines plasmatiques indépendamment de la concentration dans l'intervalle de 0,2 à 20 μg/mL. L’ambrisentan est lié principalement à l’albumine (96,5 %) et dans une moindre mesure, à la glycoprotéine acide alpha1.
L’ambrisentan est faiblement distribué dans les érythrocytes, avec un rapport moyen sang/plasma de 0,57 chez l’homme et de 0,61 chez la femme.
Biotransformation
L’ambrisentan n’est pas un ARE du groupe des Sulfonamides (Groupe des acides propioniques).
L’ambrisentan est glucuronoconjugué par plusieurs isoenzymes UGT (UGT1A9S, UGT2B7S et UGT1A3S) sous forme de glucuronoconjugué d’ambrisentan (13 %). L’ambrisentan subit également un métabolisme oxydatif, principalement par le CYP3A4, et dans une moindre mesure par le CYP3A5 et le CYP2C19 pour former le 4-hydroxyméthyl ambrisentan (21 %), ensuite glucuroconjugué en glucuroconjugué de 4-hydroxyméthyl ambrisentan (5 %). L’affinité de liaison du 4-hydroxyméthyl ambrisentan au récepteur de l'endothéline humaine est 65 fois moindre que celle de l’ambrisentan. Par conséquent, aux concentrations observées dans le plasma (environ 4 % par rapport à l’ambrisentan parent), le 4-hydroxyméthyl ambrisentan ne devrait pas contribuer à l’activité pharmacologique de l’ambrisentan.
Des données in vitro indiquent que l’ambrisentan à une concentration de 300 μM entraîne moins de 50 % d’inhibition des isoenzymes UGT1A1, UGT1A6, UGT1A9, UGT2B7 (jusqu’à 30 %) ou des isoenzymes du cytochrome P450 1A2, 2A6, 2B6, 2C8, 2C9, 2C19, 2D6, 2E1 et 3A4 (jusqu’à 25 %). In vitro, ambrisentan n’a pas d’effet inhibiteur sur les transporteurs humains à des concentrations cliniquement significatives, y compris P-gp, BCRP, MRP2, BSEP, OATP1B1, OATP1B3 et NTCP. En outre, les modèles in vitro sur hépatocytes de rats n’ont pas mis en évidence d’effet inducteur d’ambrisentan sur l’expression des protéines MRP2, P-gp ou BSEP. L’analyse globale des données in vitro suggère qu’ambrisentan à des concentrations cliniquement significatives (Cmax plasmatique jusqu'à 3,2 μM) ne devrait pas avoir d’effet sur UGT1A1, UGT1A6, UGT1A9, UGT2B7 ou les isoenzymes du cytochrome P450 1A2, 2A6, 2B6, 2C8, 2C9, 2C19, 2D6, 2E1, 3A4 ou les protéines de transport BSEP, BCRP, P-gp, MRP2, OATP1B1/3 ou NTCP.
Les effets de l’ambrisentan administré à l'état d’équilibre (10 mg, une fois par jour) sur les propriétés pharmacocinétiques et pharmacodynamiques d’une seule dose de warfarine (25 mg), mesurés par le taux de prothrombine (TP) et le rapport normalisé international (INR), ont été étudiés chez 20 volontaires sains. L’ambrisentan n’a eu aucun effet cliniquement significatif sur la pharmacocinétique ou la pharmacodynamique de la warfarine. De même, la co-administration avec la warfarine n’a pas modifié les propriétés pharmacocinétiques de l’ambrisentan (voir rubrique 4.5).
L’effet de l'administration de sildénafil pendant 7 jours (20 mg, trois fois par jour) sur la pharmacocinétique d’une seule dose d’ambrisentan, et les effets de l’administration d’ambrisentan pendant 7 jours (10 mg, une fois par jour) sur la pharmacocinétique d’une seule dose de sildénafil ont été étudiés chez 19 volontaires sains. À l’exception d’une augmentation de 13 % de la Cmax de sildénafil après co-administration avec l’ambrisentan, il n'y a eu aucun changement dans les paramètres pharmacocinétiques du sildénafil, du N-desméthyl-sildénafil et de l’ambrisentan. Cette faible augmentation de la Cmax du sildénafil n’est pas considérée comme cliniquement significative (voir rubrique 4.5).
Les effets de l'ambrisentan, administré aux doses permettant d'atteindre l'état d'équilibre pharmacocinétique (10 mg, une fois par jour), sur les propriétés pharmacocinétiques d’une seule dose de tadalafil et les effets de l’administration aux doses permettant d'obtenir l'état d'équilibre pharmacocinétique de tadalafil (40 mg, une fois par jour), sur les propriétés pharmacocinétiques d’une seule dose d'ambrisentan, ont été étudiés chez 23 volontaires sains. L’ambrisentan n’a eu aucun effet cliniquement significatif sur la pharmacocinétique de tadalafil. De même, l'administration concomitante de tadalafil n’a pas eu d'effets sur les paramètres pharmacocinétiques de l’ambrisentan (voir rubrique 4.5).
Les effets des doses répétées de kétoconazole (400 mg, une fois par jour) sur la pharmacocinétique d’une seule dose de 10 mg d’ambrisentan ont été étudiés chez 16 volontaires sains. Les expositions systémiques de l'ambrisentan mesurées par l’aire sous la courbe des concentrations plasmatiques (ASC(0-inf)) et la Cmax ont été légèrement augmentées respectivement de 35 % et de 20 %. Cette modification de l'exposition systémique ne devrait pas avoir de retentissement cliniquement significatif et par conséquent, l’ambrisentan peut être administré de façon concomitante avec le kétoconazole.
Les effets de doses répétées de ciclosporine A (100 - 150 mg deux fois par jour) sur la pharmacocinétique à l'état d'équilibre de l'ambrisentan (5 mg une fois par jour), et les effets de doses répétées d'ambrisentan (5 mg une fois par jour) sur la pharmacocinétique à l'état d'équilibre de la ciclosporine A (100 – 150 mg deux fois par jour) ont été étudiés chez des volontaires sains. La Cmax et l'ASC(0-t) de l'ambrisentan ont augmenté (respectivement 48 % et 121 %) en présence de doses multiples de ciclosporine A. Au vu de ces données, en cas d’administration concomitante de ciclosporine A, la dose d'ambrisentan chez les patients adultes ou les patients pédiatriques pesant ≥ 50 kg doit être limitée à 5 mg une fois par jour et à 2,5 mg une fois par jour chez les patients pédiatriques ≥ 20 à < 50 kg (voir rubrique 4.2). Toutefois, l'administration de doses multiples d'ambrisentan n'a pas eu d'effet cliniquement significatif sur l'exposition à la ciclosporine A et aucun ajustement posologique de la ciclosporine A n'est justifié.
Les effets de l'administration en dose unique ou en doses répétées de rifampicine (600 mg une fois par jour) sur les paramètres pharmacocinétiques de l'ambrisentan (10 mg une fois par jour) à l'état d'équilibre ont été étudiés chez des volontaires sains. Après l'initiation du traitement par rifampicine, une augmentation transitoire de l'ASC(0– τ) (121 % et 116 % après l'administration de la première et de la seconde dose de rifampicine) a été observée, probablement due à une inhibition de l'OATP par la rifampicine. Toutefois, il n'a pas été observé de modification cliniquement significative de l'exposition systémique de l'ambrisentan au 8ème jour suivant l'administration de rifampicine en doses répétées. Les patients traités par ambrisentan doivent faire l'objet d'une étroite surveillance lorsqu'ils débutent un traitement par rifampicine (voir rubriques 4.4 et 4.5).
Les effets de doses répétées d’ambrisentan (10 mg) sur la pharmacocinétique d’une seule dose de digoxine ont été étudiés chez 15 volontaires sains. L'administration de doses répétées d'ambrisentan augmente légèrement l'ASC0-last et les concentrations résiduelles de la digoxine, la Cmax de la digoxine est augmentée de 29 %. L'augmentation de l’exposition à la digoxine en présence de doses multiples d'ambrisentan n'a pas été considérée cliniquement significative, et aucun ajustement de dose de la digoxine n’est nécessaire (voir rubrique 4.5).
Les effets de l'administration de l’ambrisentan pendant 12 jours (10 mg, une fois par jour) sur les paramètres pharmacocinétiques d’une dose unique d'un contraceptif oral associant de l'éthinylestradiol (35 μg) et de la noréthindrone (1 mg) ont été étudiés chez des femmes volontaires saines. La Cmax et l'ASC(0-inf) ont été légèrement diminuées pour l'éthinylestradiol (respectivement 8 % et 4 %) et légèrement augmentées pour la noréthindrone (respectivement 13 % et 14 %). Ces modifications d'expositions systémiques de l'éthinylestradiol ou de la noréthindrone sont considérées comme faibles et ne devraient pas avoir de retentissement cliniquement significatif (voir rubrique 4.5).
Elimination
L’ambrisentan et ses métabolites sont éliminés principalement dans la bile après le métabolisme hépatique et/ou extra-hépatique. Environ 22 % de la dose administrée sont retrouvés dans l’urine après administration orale, dont 3,3 % d’ambrisentan inchangé. La demi-vie d’élimination plasmatique chez l’homme est comprise entre 13,6 et 16,5 heures.
Populations spécifiques
Population adulte (sexe, âge)
D’après les résultats d’une analyse pharmacocinétique de population réalisée sur des volontaires sains et des patients atteints d’hypertension artérielle pulmonaire, les propriétés pharmacocinétiques de l’ambrisentan n’ont pas été significativement influencées par le sexe ou l’âge (voir rubrique 4.2).
Population pédiatrique
Les données pharmacocinétiques disponibles dans la population pédiatrique sont limitées. La pharmacocinétique a été étudiée chez des sujets pédiatriques âgés de 8 ans à moins de 18 ans dans une étude clinique (AMB112529).
Les données de pharmacocinétique de l'ambrisentan après administration orale chez des sujets âgés de 8 ans à moins de 18 ans atteints d'HTAP concordaient avec celles observées chez l’adulte après ajustement de la dose en fonction du poids corporel. Sur la base des résultats de modélisation, l’exposition des patients pédiatriques à l'état d'équilibre (AUCSS) pour les faibles et les fortes doses dans tous les groupes de poids corporel se situaient respectivement dans les 5ème et 95ème percentiles de l'exposition observée chez l'adulte à faible (5 mg) ou à forte dose (10 mg).
Insuffisance rénale
L'élimination rénale ou la clairance rénale (excrétion) de l’ambrisentan ne sont pas significatifs. Dans une analyse pharmacocinétique de population, la clairance de la créatinine était une covariable affectant la pharmacocinétique de l’ambrisentan de façon statistiquement significative. L’intensité de la diminution de la clairance est modeste (20 à 40 %) chez les patients souffrant d’insuffisance rénale modérée et cette diminution est par conséquent peu susceptible d’avoir une pertinence clinique quelconque. Toutefois, la prudence s’impose chez les patients présentant une insuffisance rénale sévère (voir rubrique 4.2)
Insuffisance hépatique
Les principales voies métaboliques de l’ambrisentan sont la glucurono-conjugaison et l’oxydation, avec élimination dans la bile ; par conséquent, l’insuffisance hépatique devrait augmenter l'exposition systémique (Cmax et ASC) de l’ambrisentan. Une analyse pharmacocinétique de population a montré que la clairance orale de l'ambrisentan diminuait en fonction de l'augmentation de la bilirubine. Toutefois, l’effet de la bilirubine apparait mineur : pour une élévation du taux de bilirubine de 4,5 mg/dL, (par rapport à la valeur normale de 0,6 mg/dL) la clairance de l’ambrisentan serait environ 30 % moindre. La pharmacocinétique de l’ambrisentan n'a pas été étudiée chez les sujets présentant une insuffisance hépatique avec ou sans cirrhose. Par conséquent, un traitement par ambrisentan ne doit pas être instauré chez les patients souffrant d'insuffisance hépatique sévère ou présentant une augmentation des aminotransférases hépatiques cliniquement significative (plus de 3 fois la limite normale supérieure (> 3 x LNS) ; voir rubriques 4.3 et 4.4).
5.3. Données de sécurité préclinique
L’ambrisentan n'a pas montré un effet inhibiteur du transport des acides biliaires ou une hépatotoxicité.
Chez le rongeur, lors de l’administration chronique d’ambrisentan à des niveaux d’exposition inférieurs aux doses thérapeutiques utilisées chez l’homme, une inflammation et des modifications de l’épithélium de la cavité nasale ont été observées. Chez le chien des réponses inflammatoires légères ont été observées lors de l’administration chronique d’ambrisentan à des doses élevées correspondant à une exposition 20 fois supérieure à celle observée chez les patients.
Une hyperplasie osseuse des cornets ethmoïdaux a été observée dans la cavité nasale de rats traités par l'ambrisentan, à des niveaux d'exposition 3 fois supérieurs à l'aire sous la courbe (ASC) en clinique humaine. L’hyperplasie de l’os nasal n'a pas été observée avec ambrisentan chez les souris ou les chiens. Chez le rat, une hyperplasie osseuse des cornets ethmoïdaux est une conséquence reconnue de l'inflammation nasale, basée sur l'expérience acquise avec d'autres composés.
L’ambrisentan s'est révélé clastogène à des concentrations élevées dans des tests sur cellules de mammifères in vitro. Les tests sur bactéries n'ont pas montré d'effet mutagène et il n'a pas été observé de génotoxicité chez les rongeurs dans deux études menées in vivo.
Aucun potentiel cancérogène n'a été mis en évidence dans des études par voie orale de 2 ans menées chez le rat et la souris. Une légère augmentation de l'incidence des fibroadénomes mammaires, une tumeur bénigne, a été observée chez le rat mâle, à la dose la plus élevée uniquement. L'exposition systémique avec l’ambrisentan chez les rats mâles à cette dose (basée sur l’ASC à l'état d'équilibre), était 6 fois celle obtenue à la dose clinique de 10 mg/jour.
Une atrophie tubulaire testiculaire, occasionnellement associée à une aspermie, a été observée dans des études de toxicité à doses répétées et de fertilité par voie orale effectuées sur des souris et des rats mâles à des doses sans marge de sécurité. Les modifications au niveau testiculaire n'ont pas entièrement régressé au cours du suivi mené après arrêt du traitement. Cependant aucunes modifications n’ont été observées au cours des études chez les chiens, jusqu'à la 39ème semaine à une exposition de 35 fois la dose utilisée chez l'homme sur la base de l’ASC. Chez les rats mâles, aucun effet de l’ambrisentan sur la mobilité des spermatozoïdes n’a été mis en évidence, quelle que soit la dose testée (jusqu’à 300 mg/kg/jour). Une légère diminution (< 10 %) du pourcentage de spermatozoïdes morphologiquement normaux a été observée à la dose de 300 mg/kg/jour, mais pas à celle de 100 mg/kg/jour (> 9 fois l'exposition clinique à une dose de 10 mg/jour). L'effet de l'ambrisentan sur la fertilité masculine humaine n'est pas connu.
L’ambrisentan s'est révélée tératogène chez le rat et le lapin. Des anomalies de la mâchoire inférieure, de la langue et/ou du palais ont été observées à toutes les doses testées. De plus, l’étude chez le rat a montré une augmentation de l’incidence des défauts du septum interventriculaire et du tronc vasculaire, des anomalies de la thyroïde et du thymus, une ossification du basi-sphénoïde et la survenue de cas pour lesquels l’artère ombilicale était positionnée du côté gauche de la vessie au lieu du côté droit. La tératogénicité est associée à la classe des antagonistes des récepteurs aux endothélines.
L’administration d’ambrisentan à des rats femelles à partir de la fin de la gestation et pendant la lactation a entraîné des effets indésirables sur le comportement maternel, une réduction de la survie des petits et une altération de la capacité de reproduction de la descendance (avec l'observation de petits testicules à l'autopsie) à une exposition 3 fois supérieure l'ASC à la dose maximale recommandée chez l'homme.
Chez des rats juvéniles traités avec de l’ambrisentan par voie orale une fois par jour aux jours 7 à 26, 36 ou 62 après la naissance (correspondant à la période allant du nouveau-né à la fin de l’adolescence chez l’homme), une diminution du poids du cerveau (- 3 % à - 8 %) sans changement morphologique ni neuro-comportemental a été constatée suite à l’observation de bruits respiratoires, d’apnée et d’hypoxie. Ces effets sont apparus à des niveaux d’ASC qui étaient 1,8 à 7 fois plus élevés que l’exposition pédiatrique humaine de 10 mg. Dans une autre étude, lorsque des rats âgés de 5 semaines (correspondant à un âge d'environ 8 ans chez l'homme) ont été traités, une diminution du poids du cerveau n'a été observée qu'à des doses très élevées chez les mâles uniquement. Les données non cliniques disponibles ne permettent pas d’établir la pertinence clinique de cette observation chez les enfants âgés de moins de 8 ans.
Lactose monohydraté, cellulose microcristalline (E460), croscarmellose sodique (E468), stéarate de magnésium (E572).
Pelliculage
Alcool polyvinylique, talc, dioxyde de titane (E171), macrogol, lécithine (de soja) (E322), laque aluminique rouge Allura AC (E129).
Pour les plaquettes blanches en PVC/PVDC/Aluminium
5 ans.
Pour les plaquettes transparentes en PVC/PE/PVDC/Aluminium
4 ans.
6.4. Précautions particulières de conservation
A conserver dans l’emballage d’origine, à l’abri de la lumière.
6.5. Nature et contenu de l'emballage extérieur
Plaquettes blanches en PVC/PVDC/Aluminium et/ou transparentes en PVC/PE/PVDC/Aluminium.
Boîte de 30 comprimés pelliculés sous plaquettes en conditionnement unitaire.
Toutes les présentations peuvent ne pas être commercialisées.
6.6. Précautions particulières d’élimination et de manipulation
Pas d'exigences particulières.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
30 rue edouard nieuport
69008 lyon
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 302 013 9 8 : 30 comprimés sous plaquettes (PVC/PVDC/Aluminium).
· 34009 302 014 0 4 : 30 comprimés sous plaquettes (PVC/PE/PVDC/Aluminium).
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Liste I.
Médicament nécessitant une surveillance particulière pendant le traitement.
Prescription hospitalière.
Prescription réservée aux spécialistes et services CARDIOLOGIE.
Prescription réservée aux spécialistes et services MEDECINE INTERNE.
Prescription réservée aux spécialistes et services PNEUMOLOGIE.
ANSM - Mis à jour le : 05/07/2024
AMBRISENTAN STRAGEN 10 mg, comprimé pelliculé
ambrisentan
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin, votre pharmacien ou votre infirmier/ère.
· Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d’autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin, votre pharmacien ou votre infirmier/ère. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
1. Qu'est-ce que AMBRISENTAN STRAGEN 10 mg, comprimé pelliculé et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant de prendre AMBRISENTAN STRAGEN 10 mg, comprimé pelliculé ?
3. Comment prendre AMBRISENTAN STRAGEN 10 mg, comprimé pelliculé ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver AMBRISENTAN STRAGEN 10 mg, comprimé pelliculé ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE AMBRISENTAN STRAGEN 10 mg, comprimé pelliculé ET DANS QUELS CAS EST-IL UTILISE ?
Classe pharmacothérapeutique : Anti-hypertenseurs, autres anti-hypertenseurs - code ATC : C02KX02
Qu’est-ce que AMBRISENTAN STRAGEN 10 mg, comprimé pelliculé
AMBRISENTAN STRAGEN contient la substance active « ambrisentan ». Ce médicament appartient à une classe de médicaments appelés « autres anti-hypertenseurs » (utilisés pour traiter une pression artérielle élevée).
Dans quels cas AMBRISENTAN STRAGEN 10 mg, comprimé pelliculé est-il utilisé
AMBRISENTAN STRAGEN est utilisé pour traiter l’hypertension artérielle pulmonaire (HTAP) chez l’adulte, l’adolescent et l’enfant âgé de 8 ans et plus. L’HTAP est définie par une élévation de la pression artérielle dans les vaisseaux sanguins (les artères pulmonaires) qui transportent le sang entre le cœur et les poumons. Chez les patients atteints d’HTAP, ces artères se rétrécissent, et le cœur doit fournir un effort supplémentaire pour pomper le sang. Ceci provoque une fatigue, des vertiges et des essoufflements.
AMBRISENTAN STRAGEN élargit les artères pulmonaires et facilite ainsi le pompage du sang par le cœur. Ceci fait diminuer la pression sanguine et réduit les symptômes.
AMBRISENTAN STRAGEN peut aussi être utilisé en association avec d’autres médicaments pour traiter l’HTAP.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT DE PRENDRE AMBRISENTAN STRAGEN 10 mg, comprimé pelliculé ?
Ne prenez pas AMBRISENTAN STRAGEN 10 mg, comprimé pelliculé :
· si vous êtes allergique à l’ambrisentan, à l’arachide ou au soja, ou à l’un des autres composants contenus dans ce médicament (mentionnés à la rubrique 6)
· si vous êtes enceinte, si vous prévoyez d’être enceinte ou si vous pourriez le devenir parce que vous n’utilisez pas une méthode de contraception fiable. Veuillez lire les informations indiquées au paragraphe « Grossesse »
· si vous allaitez. Lisez les informations du paragraphe « Allaitement »
· si vous souffrez d’une maladie du foie. Parlez-en à votre médecin ; il décidera si vous pouvez prendre ce médicament
· si vous présentez une fibrose pulmonaire idiopathique (maladie du tissu pulmonaire dont la cause n'est pas connue)
Avertissements et précautions
Contactez votre médecin avant de prendre ce médicament si vous avez :
· des problèmes au niveau du foie
· une anémie (diminution du nombre de globule rouges dans le sang)
· un gonflement au niveau des mains, des chevilles ou des pieds causé par une accumulation de liquide (œdème périphérique)
· une maladie des poumons caractérisée par l’obstruction des veines pulmonaires (maladie pulmonaire veino-occlusive)
→ Votre médecin décidera si vous pouvez prendre AMBRISENTAN STRAGEN.
Vous devrez effectuer régulièrement des analyses de sang avant un traitement par AMBRISENTAN STRAGEN, puis à intervalles réguliers lorsque vous prendrez ce médicament, votre médecin vous prescrira des analyses de sang afin de vérifier :
· si vous souffrez d’anémie
· si votre foie fonctionne normalement
→ Il est important de faire régulièrement ces analyses de sang pendant toute la durée du traitement par AMBRISENTAN STRAGEN.
Signes pouvant indiquer que votre foie ne fonctionne pas correctement :
· perte d’appétit
· envie de vomir (nausées)
· vomissements
· fièvre
· douleur d'estomac (maux de ventre)
· coloration jaune de la peau ou du blanc des yeux (jaunisse)
· urines foncées
· démangeaisons de la peau
→ Informez immédiatement votre médecin si vous présentez l’un de ces signes.
Enfants
Ce médicament n’est pas destiné aux enfants âgés de moins de 8 ans, sa sécurité et son efficacité n’étant pas connues dans ce groupe d'âge.
Autres médicaments et AMBRISENTAN STRAGEN 10 mg, comprimé pelliculé
Informez votre médecin ou votre pharmacien si vous prenez, avez récemment pris ou pourriez prendre tout autre médicament.
Votre médecin peut être amené à modifier votre dose d’AMBRISENTAN STRAGEN si vous commencez un traitement par ciclosporine A (un médicament utilisé après une transplantation d'organe ou dans le traitement du psoriasis).
Si vous prenez de la rifampicine (un antibiotique utilisé dans le traitement d'infections graves), vous serez attentivement suivi par votre médecin lors de l'initiation de votre traitement par AMBRISENTAN STRAGEN.
Si vous prenez d’autres médicaments utilisés dans le traitement de l'hypertension artérielle pulmonaire (par exemple : iloprost, époprosténol, sildénafil), une surveillance par votre médecin pourra être nécessaire.
→ Informez votre médecin ou votre pharmacien si vous prenez l’un de ces médicaments.
Grossesse, allaitement et fertilité
Grossesse
AMBRISENTAN STRAGEN peut présenter des risques pour le bébé conçu avant, pendant ou peu après le traitement.
→ Si vous êtes en âge d’être enceinte, vous devez utiliser une méthode de contraception fiable pendant le traitement par AMBRISENTAN STRAGEN. Parlez-en à votre médecin.
→ Ne prenez pas AMBRISENTAN STRAGEN si vous êtes enceinte ou si vous envisagez une grossesse.
→ Si vous découvrez que vous êtes enceinte ou si vous pensez être enceinte pendant votre traitement par AMBRISENTAN STRAGEN, consultez immédiatement votre médecin.
Si vous êtes une femme en âge d'être enceinte, votre médecin vous demandera de réaliser un test de grossesse avant de prendre AMBRISENTAN STRAGEN, puis à intervalles réguliers tout au long de votre traitement par ce médicament.
Allaitement
Le passage de la substance active d’AMBRISENTAN STRAGEN dans le lait maternel n'est pas connu.
→ Vous ne devez pas allaiter pendant que vous prenez AMBRISENTAN STRAGEN. Parlez-en à votre médecin.
Fertilité
Si vous êtes un homme et que vous prenez AMBRISENTAN STRAGEN, il est possible que ce médicament diminue le nombre de vos spermatozoïdes. Si vous avez des questions ou des inquiétudes à ce sujet, parlez-en à votre médecin.
Conduite de véhicules et utilisation de machines
AMBRISENTAN STRAGEN peut avoir des effets indésirables tels qu'une baisse de la pression artérielle, des sensations de vertige ou de la fatigue (voir rubrique 4), qui peuvent altérer votre aptitude à conduire des véhicules ou à utiliser des machines. Les symptômes de votre maladie peuvent également compromettre votre aptitude à conduire un véhicule ou à utiliser des machines.
→ Ne conduisez pas et n’utilisez pas de machines si vous ne vous sentez pas bien.
AMBRISENTAN STRAGEN 10 mg, comprimé pelliculé contient du lactose, de la lécithine de soja, de la laque aluminique rouge Allura AC (E129) et du sodium.
Si votre médecin vous a informé(e) d’une intolérance à certains sucres, contactez-le avant de prendre ce médicament.
Ce médicament contient moins de 1 mmol (23 mg) de sodium par comprimé, c’est-à-dire qu’il est essentiellement « sans sodium ».
Ce médicament contient un agent colorant azoïque (laque aluminique rouge Allura AC (E129)), qui peut provoquer des réactions allergiques (voir rubrique 4).
Ce médicament contient de la lécithine de soja. Si vous êtes allergiques à l’arachide ou au soja, ne prenez pas ce médicament (voir rubrique 2 « Ne prenez jamais AMBRISENTAN STRAGEN 10 mg, comprimé pelliculé »).
3. COMMENT PRENDRE AMBRISENTAN STRAGEN 10 mg, comprimé pelliculé ?
Quelle dose d’AMBRISENTAN STRAGEN faut-il prendre ?
Adulte
La dose habituelle d’AMBRISENTAN STRAGEN est un comprimé de 5 mg, une fois par jour. Votre médecin peut décider d'augmenter votre dose à 10 mg, une fois par jour.
Si vous prenez de la ciclosporine A, ne prenez pas plus d'un comprimé de 5 mg d’AMBRISENTAN STRAGEN une fois par jour.
Adolescents et enfants âgés de 8 ans à moins de 18 ans
|
Dose initiale habituelle de Volibris |
|
|
Patient pesant 35 kg ou plus |
Un comprimé de 5 mg, une fois par jour |
|
Patient pesant au moins 20 kg, et moins de 35 kg |
Un comprimé de 2,5 mg, une fois par jour |
Votre médecin peut décider d'augmenter votre dose. Il est important que les enfants se rendent régulièrement à leurs rendez-vous chez le médecin, car leur dose doit être ajustée en fonction de leur âge ou de leur poids.
S'il est pris en association avec la ciclosporine A, la dose d’AMBRISENTAN STRAGEN pour les adolescents et les enfants pesant moins de 50 kg sera limitée à 2,5 mg une fois par jour, ou à 5 mg une fois par jour s'ils pèsent 50 kg ou plus.
Comment prendre AMBRISENTAN STRAGEN ?
Il est préférable de prendre votre comprimé chaque jour à la même heure. Avalez le comprimé entier, avec un grand verre d’eau, sans le couper, le croquer ni le mâcher. Vous pouvez prendre AMBRISENTAN STRAGEN pendant ou en dehors des repas.
Si vous avez pris plus d’AMBRISENTAN STRAGEN 10 mg, comprimé pelliculé que vous n’auriez dû
Si vous avez pris trop de comprimés, vous serez davantage susceptible d’avoir des effets indésirables tels que des maux de tête, des bouffées de chaleur, des sensations de vertige, des nausées (envie de vomir), ou une pression artérielle basse pouvant entraîner des étourdissements :
→ Demandez conseil à votre médecin ou à votre pharmacien si vous avez pris plus de comprimés que ce qui vous a été prescrit.
Si vous oubliez de prendre AMBRISENTAN STRAGEN 10 mg, comprimé pelliculé
Si vous avez oublié de prendre une dose d’AMBRISENTAN STRAGEN, prenez un comprimé dès que vous vous en apercevez puis continuez normalement le traitement.
→ Ne prenez pas deux doses en même temps pour compenser la dose que vous avez oublié de prendre.
Si vous arrêtez de prendre AMBRISENTAN STRAGEN 10 mg, comprimé pelliculé
AMBRISENTAN STRAGEN est un traitement que vous devrez continuer à prendre pour contrôler votre HTAP.
→ N’arrêtez pas de prendre AMBRISENTAN STRAGEN sans en avoir discuté avec votre médecin et obtenu son accord.
Si vous avez d’autres questions sur l’utilisation de ce médicament, demandez plus d’informations à votre médecin ou à votre pharmacien.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Effet indésirable grave
Informez votre médecin si vous constatez l’un de ces effets indésirables :
Réactions allergiques
Il s’agit d’un effet indésirable fréquent pouvant concerner jusqu’à 1 personne sur 10. Vous pouvez présenter une éruption cutanée, des démangeaisons ou un gonflement (habituellement au niveau du visage, des lèvres, de la langue ou de la gorge), susceptibles d'entraîner des difficultés pour respirer ou avaler.
Gonflement (œdème), plus particulièrement au niveau des chevilles et des pieds
Il s’agit d’un effet indésirable très fréquent qui peut concerner plus d’1 personne sur 10.
Insuffisance cardiaque
Elle est due au fait que le cœur ne pompe pas suffisamment de sang. Il s’agit d’un effet indésirable fréquent, pouvant concerner jusqu’à 1 personne sur 10. Les symptômes comprennent :
· essoufflement
· intense fatigue
· gonflement au niveau des chevilles et des jambes
Diminution du nombre de globules rouges dans le sang (anémie)
C’est un effet indésirable très fréquent qui peut concerner plus d’1 personne sur 10. Cela nécessite parfois une transfusion sanguine. Les symptômes comprennent :
· fatigue et faiblesse
· essoufflement
· généralement une sensation de malaise
Pression artérielle basse (hypotension)
Il s’agit d’un effet indésirable fréquent qui peut concerner jusqu’à 1 personne sur 10. Les symptômes comprennent :
· étourdissements
→ Informez immédiatement votre médecin si vous (ou votre enfant) observez ces effets indésirables ou s'ils surviennent soudainement après la prise d’AMBRISENTAN STRAGEN.
Il est important que vous effectuiez régulièrement des analyses de sang afin de rechercher une éventuelle anémie et de vérifier que votre foie fonctionne correctement. Assurez-vous également d'avoir pris connaissance des informations mentionnées à la rubrique 2, aux paragraphes « Vous devrez effectuer régulièrement des analyses de sang » et « Signes pouvant indiquer que votre foie ne fonctionne pas correctement ».
Autres effets indésirables
Très fréquents (peuvent affecter plus d’1 personne sur 10)
· maux de tête
· sensations vertigineuses
· palpitations (accélération ou irrégularité des battements cardiaques)
· aggravation de l'essoufflement peu de temps après le début du traitement par AMBRISENTAN STRAGEN
· écoulement ou sensation de nez bouché, congestion ou douleur dans les sinus
· nausée
· diarrhée
· sensation de fatigue
En association avec le tadalafil (autre médicament de l’HTAP)
Peuvent également survenir en plus de ce qui est décrit ci-dessus :
· bouffées de chaleur (rougeurs de la peau)
· vomissements
· douleur ou gêne dans la poitrine
Fréquents (peuvent affecter jusqu’à 1 personne sur 10)
· vision floue ou autres altérations de la vision
· évanouissements
· résultats anormaux des analyses de sang destinées à contrôler la fonction hépatique
· écoulement du nez
· constipation
· douleur d'estomac (maux de ventre)
· douleur ou gêne dans la poitrine
· bouffées de chaleur (rougeurs de la peau)
· vomissements
· sensation de faiblesse générale
· saignement de nez
· éruption cutanée
En association avec le tadalafil
Peuvent également survenir en plus de ce qui est décrit ci-dessus à l’exception des résultats anormaux des analyses de sang destinées à contrôler la fonction hépatique :
· bourdonnements d'oreilles (acouphènes)
Peu fréquents (peuvent affecter jusqu’à 1 personne sur 100)
· atteinte du foie
· inflammation du foie provoquée par le propre système de défense de l’organisme (hépatite auto-immune).
En association avec le tadalafil
· perte soudaine de l’audition
Effets secondaires chez les enfants et les adolescents
Il est attendu que les effets soient similaires à ceux listés ci-dessus pour l’adulte.
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr.
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER AMBRISENTAN STRAGEN 10 mg, comprimé pelliculé ?
Tenir ce médicament hors de la vue et de la portée des enfants.
N’utilisez pas ce médicament après la date de péremption indiquée sur la boîte et la plaquette après EXP. La date de péremption fait référence au dernier jour de ce mois.
A conserver dans l’emballage d’origine, à l’abri de la lumière.
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient AMBRISENTAN STRAGEN 10 mg, comprimé pelliculé
· La substance active est :
Ambrisentan ......................................................................................................................... 10 mg
Pour un comprimé pelliculé.
· Les autres composants sont :
Noyau du comprimé : lactose monohydraté, cellulose microcristalline, croscarmellose sodique, stéarate de magnésium.
Pelliculage : alcool polyvinylique, talc (E553b), dioxyde de titane (E171), macrogol, lécithine (de soja) (E322), laque aluminique rouge Allura AC (E129).
Qu’est-ce que AMBRISENTAN STRAGEN 10 mg, comprimé pelliculé et contenu de l’emballage extérieur
AMBRISENTAN STRAGEN se présente sous la forme d’un comprimé pelliculé rose, oblong, biconvexe, avec la marque « 10 » sur une face et lisse sur l’autre, d’une taille d’environ 11,1 mm et une largeur nominale d'environ 5,6 mm.
AMBRISENTAN STRAGEN est présenté en :
· Boîte de 30 comprimés sous plaquettes blanches (PVC/PVDC/Aluminium).
· Boîte de 30 comprimés sous plaquettes transparentes (PVC/PE/PVDC/Aluminium).
Toutes les présentations peuvent ne pas être commercialisées.
Titulaire de l’autorisation de mise sur le marché
30 rue edouard nieuport
69008 lyon
Exploitant de l’autorisation de mise sur le marché
STRAGEN france
30 rue edouard nieuport
69008 lyon
18 KM MARATHONOS AVENUE
153 51 PALLINI ATTIKI
GRECE
OU
DELORBIS PHARMACEUTICALS LTD
17 ATHINON STR.,
ERGATES INDUSTRIAL AREA,
2643 LEFKOSIA
CHYPRE
OU
CENTRE LAB
ZONE ARTISANALE GRANDERAIE
23000 GUERET
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Sans objet.
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).