Dernière mise à jour le 01/12/2025
GLUCAGEN 1 mg/ml, poudre et solvant pour solution injectable
Ce médicament n'est ou ne sera bientôt plus disponible sur le marché.
Si vous prenez actuellement ce médicament, il vous est recommandé d'en parler avec votre médecin
ou avec votre pharmacien qui pourra vous orienter vers un autre traitement.
Indications thérapeutiques
Classe pharmacothérapeutique - code ATC : hormones pancréatiques, hormones glycogénolytiques, H04AA01.
La substance active de GLUCAGEN est le glucagon.
GLUCAGEN est utilisé pour traiter immédiatement et en urgence les enfants et les adultes diabétiques utilisant de l’insuline. GLUCAGEN est utilisé en cas de perte de connaissance (évanouissement) due à un taux de sucre très bas dans le sang, appelé « hypoglycémie sévère ». GLUCAGEN est utilisé lorsque ces patients ne sont pas en mesure de prendre du sucre par voie orale.
Le glucagon est une hormone naturelle qui a une action contraire à celle de l’insuline dans le corps humain. Il facilite la transformation du glycogène en glucose (sucre) par le foie. Le glucose est alors libéré dans la circulation sanguine, augmentant ainsi le taux de sucre dans le sang.
Pour les professionnels de santé : Voir en fin de notice.
Service médical rendu (SMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprès de la HAS (plus d'informations dans l'aide). Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Important | Avis du 16/09/2015 | Renouvellement d'inscription (CT) | Le service médical rendu par GLUCAGEN reste important dans les indications de l'AMM. |
Amélioration du service médical rendu (ASMR)
Pas d'ASMR disponible pour ce médicament (plus d'informations dans l'aide )
ANSM - Mis à jour le : 27/11/2023
GLUCAGEN 1 mg/ml, poudre et solvant pour solution injectable
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Substance active : glucagon humain produit par la technique de l’ADN recombinant sur Saccharomyces cerevisiae.
Un flacon contient 1 mg de glucagon sous forme chlorhydrate correspondant à 1 mg (1 UI) de glucagon/ml après reconstitution.
Pour la liste complète des excipients, voir rubrique 6.1.
Poudre et solvant pour solution injectable.
Avant la reconstitution, la poudre compactée doit être blanche ou pratiquement blanche. Le solvant doit être limpide, incolore et sans particules.
4.1. Indications thérapeutiques
GLUCAGEN est indiqué dans le traitement des hypoglycémies sévères qui peuvent survenir chez les enfants et les adultes diabétiques insulinotraités.
Indication diagnostique
GLUCAGEN est indiqué dans l’inhibition de la motilité dans les explorations du tractus gastro-intestinal chez les adultes.
4.2. Posologie et mode d'administration
· Indication thérapeutique (Hypoglycémie sévère)
Posologie pour adultes : administrer 1 mg par injection sous-cutanée ou intramusculaire.
Populations particulières
Population pédiatrique (< 18 ans) : GLUCAGEN peut être utilisé dans le traitement de l’hypoglycémie sévère chez les enfants et les adolescents.
Posologie pour enfants : administrer 0,5 mg (enfants de moins de 25 kg ou ayant moins de 6-8 ans) ou 1 mg (enfants de plus de 25 kg ou ayant plus de 6-8 ans).
Patients âgés (≥ 65 ans) : GLUCAGEN peut être utilisé chez les patients âgés.
Insuffisance rénale ou hépatique : GLUCAGEN peut être utilisé chez les patients présentant une insuffisance rénale ou hépatique.
· Indication diagnostique (Inhibition de la motilité gastro-intestinale)
Posologie pour adultes : La dose diagnostique pour obtenir un relâchement de l’estomac, du bulbe duodénal, du duodénum et de l’intestin grêle est de 0,2 à 0,5 mg administré par injection intraveineuse ou de 1 mg administré par voie intramusculaire ; la dose pour obtenir le relâchement du côlon est de 0,5 à 0,75 mg administré par voie intraveineuse ou de 1 à 2 mg administrés par voie intramusculaire.
Populations particulières
Population pédiatrique (< 18 ans) : La sécurité et l’efficacité de GLUCAGEN dans l’inhibition de la motilité gastro-intestinale chez les enfants et les adolescents n’ont pas été établies. Aucune donnée n’est disponible.
Patients âgés (≥ 65 ans) : GLUCAGEN peut être utilisé chez les patients âgés.
Insuffisance rénale ou hépatique : GLUCAGEN peut être utilisé chez les patients présentant une insuffisance rénale ou hépatique.
Mode d’administration
Dissoudre la poudre compactée dans le solvant joint, comme décrit à la rubrique 6.6.
Indication thérapeutique (Hypoglycémie sévère) :
Administrer par injection sous-cutanée ou intramusculaire. Le patient réagira normalement dans les 10 minutes qui suivent l’injection. Si le patient a réagi au traitement, lui administrer des glucides par voie orale afin de reconstituer les réserves de glycogène hépatique et de prévenir une récidive de l’hypoglycémie. Si le patient ne réagit pas dans les 10 minutes qui suivent l’injection, du glucose doit être administré par voie intraveineuse.
Indication diagnostique (Inhibition de la motilité gastro-intestinale) :
GLUCAGEN doit être administré par le personnel médical. Après une injection intraveineuse de 0,2 à 0,5 mg, l’efficacité survient dans la minute qui suit l’injection et dure entre 5 et 20 minutes. Après une injection intramusculaire de 1 à 2 mg, l’efficacité se produit après 5 à 15 minutes et dure environ 10 à 40 minutes.
À la fin de l’épreuve diagnostique, des glucides doivent être administrés par voie orale, si cela est compatible avec l’épreuve diagnostique réalisée.
Hypersensibilité à la substance active ou à l’un des excipients mentionnés à la rubrique 6.1.
Phéochromocytome.
4.4. Mises en garde spéciales et précautions d'emploi
Traçabilité
Dans le but d’améliorer la traçabilité des médicaments biologiques, le nom et le numéro de lot du produit administré doivent être clairement enregistrés.
Compte-tenu de l’instabilité de GLUCAGEN en solution, le produit doit être administré immédiatement après reconstitution. GLUCAGEN ne doit pas être administré par perfusion intraveineuse.
Indication thérapeutique
Afin de prévenir une récidive de l’hypoglycémie, dès que le patient a réagi au traitement, il est nécessaire d’administrer des glucides par voie orale afin de reconstituer la réserve de glycogène hépatique.
Le glucagon ne sera pas efficace chez les patients dont les réserves de glycogène hépatique sont épuisées. C’est pourquoi le glucagon a peu ou pas d’effet en cas de jeûne prolongé, d’insuffisance adrénergique, d’hypoglycémie chronique ou d’hypoglycémie induite par l’alcool.
Contrairement à l’adrénaline, le glucagon n’a aucun effet sur la phosphorylase musculaire et ne peut donc pas contribuer au transfert de glucides à partir des réserves de glycogène plus importantes présentes dans les muscles squelettiques.
Indication diagnostique
Les personnes ayant reçu du glucagon dans le cadre d’une épreuve diagnostique peuvent ressentir un inconfort, en particulier si elles sont à jeun. Des nausées, des hypoglycémies et des modifications de la pression artérielle ont été rapportées dans ces situations. À la fin de l’épreuve diagnostique, des glucides doivent être administrés par voie orale aux patients à jeun, si cela est compatible avec l’épreuve diagnostique réalisée. Si une période de jeûne est nécessaire après l’examen ou en cas d’hypoglycémie sévère, l’administration de glucose par voie intraveineuse peut être nécessaire.
GLUCAGEN peut augmenter la demande en oxygène du myocarde, la pression artérielle, et le pouls. Surveiller les patients atteints de maladie cardiaque pendant l’utilisation de GLUCAGEN comme aide au diagnostic et traiter les si nécessaire.
GLUCAGEN peut provoquer une hyperglycémie de courte durée chez les patients diabétiques lorsqu'il est utilisé comme aide au diagnostic. Surveiller les patients diabétiques pour détecter les modifications de la glycémie pendant l'utilisation et traiter les si nécessaire.
Des précautions d’emploi doivent être respectées chez les patients atteints de glucagonémie lorsqu'il est utilisé comme aide au diagnostic.
Indications thérapeutique et diagnostique
Le glucagon exerçant une action antagoniste à celle de l’insuline, des précautions d’emploi doivent être respectées si GLUCAGEN est utilisé chez les patients avec un insulinome.
Le glucagon stimule la libération de catécholamines. En cas de phéochromocytome, le glucagon peut provoquer une libération massive de catécholamines par la tumeur, avec survenue d’une crise hypertensive aiguë. Le glucagon est contre-indiqué chez les patients présentant un phéochromocytome (voir rubrique 4.3).
Excipients
GLUCAGEN contient moins de 1 mmol de sodium (23 mg) par dose maximale (2 ml), c’est-à-dire essentiellement « sans sodium ».
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Insuline : réaction antagoniste vis-à-vis du glucagon.
Indométacine : le glucagon peut perdre son efficacité à augmenter la glycémie ou peut même paradoxalement induire une hypoglycémie.
Warfarine : le glucagon peut augmenter l’effet anticoagulant de la warfarine.
Bêtabloquants : les patients prenant des bêtabloquants pourraient avoir une augmentation plus importante du pouls ainsi que de la pression artérielle, qui sera temporaire compte-tenu de la courte demi-vie du glucagon. L’augmentation de la pression artérielle et du pouls peuvent nécessiter la prise d’un traitement chez les patients présentant une maladie coronarienne.
Aucune interaction n’a été rapportée entre GLUCAGEN et d’autres médicaments lorsque GLUCAGEN est utilisé dans ses indications approuvées.
4.6. Fertilité, grossesse et allaitement
Grossesse
Le glucagon ne traverse pas la barrière placentaire humaine. Une utilisation du glucagon a été rapportée chez des femmes enceintes diabétiques et aucun effet délétère n’a été observé sur l’évolution de la grossesse, la santé du fœtus ou celle du nouveau-né. GLUCAGEN peut être utilisé pendant la grossesse.
Le glucagon est très rapidement éliminé de la circulation sanguine (principalement par le foie) (t1/2 = 3 à 6 min). Ainsi, après traitement d’une hypoglycémie sévère, la quantité de glucagon excrétée dans le lait des mères qui allaitent serait extrêmement faible. Le glucagon étant dégradé dans le tube digestif, la forme active n’est donc pas absorbée ; de ce fait, aucun effet métabolique n’est à observer chez le nourrisson. GLUCAGEN peut être utilisé pendant l’allaitement.
Fertilité
Aucune étude de reproduction animale n’a été réalisée avec GLUCAGEN. Les études réalisées chez les rats n’ont pas mis en évidence d’altération de la fertilité liée au glucagon.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Après des épreuves diagnostiques, les hypoglycémies rapportées ont été peu fréquentes. En conséquence, la conduite d’un véhicule ou l’utilisation d’une machine doit être évitée jusqu’à ce que le patient ait pris un repas par voie orale contenant des glucides.
Résumé du profil de sécurité
Les effets indésirables graves sont très rares, bien que des nausées, des vomissements et des douleurs abdominales peuvent survenir occasionnellement. Les réactions d’hypersensibilité, y compris les réactions anaphylactiques, ont été rapportées comme « très rares » (moins de 1 cas pour 10 000 patients). Des hypoglycémies / comas hypoglycémiques ont été rapportés au cours de l’utilisation de GLUCAGEN dans l’indication diagnostique, en particulier chez les patients ayant jeûné. Les évènements indésirables cardiovasculaires, tels qu’une tachycardie et une modification de la pression artérielle, n’ont été rapportés que lorsque GLUCAGEN était utilisé dans les procédures endoscopiques ou radiographiques.
Résumé tabulé des effets indésirables
Les fréquences des effets indésirables issus des essais cliniques et/ou de la surveillance après commercialisation et considérés comme imputables au traitement par GLUCAGEN sont répertoriés ci-dessous. Les effets indésirables qui n’ont pas été observés dans les essais cliniques, mais qui ont été rapportés spontanément, sont considérés comme « très rares ». Depuis la mise sur le marché, la survenue des effets indésirables est très rare (<1/10 000). Cependant, le recueil après commercialisation d’effets indésirables est susceptible d’être sous-évalué et les fréquences présentées doivent donc être interprétées dans ce contexte.
Indication thérapeutique
|
Classes de systèmes d’organes |
Fréquence |
Effet indésirable |
|
Affections du système immunitaire |
Très rare (< 1/10 000) |
Réactions d’hypersensibilité y compris réaction/choc anaphylactique |
|
Affections gastro-intestinales |
Fréquent (≥ 1/100, < 1/10) Peu fréquent (≥ 1/1 000, < 1/100) Rare (≥ 1/10 000, < 1/1 000) |
Nausées Vomissements Douleurs abdominales |
|
Troubles généraux et anomalies au site d’administration |
Fréquence indéterminée (ne peut pas être estimé à partir des données disponibles) |
Réactions au site d’injection |
Population pédiatrique
D’après les données issues des essais cliniques et de l’expérience depuis la mise sur le marché, la fréquence, le type et la sévérité des effets indésirables observés chez les enfants seraient identiques à ceux observés chez les adultes.
Autres populations particulières
D’après les données issues des essais cliniques et de l’expérience depuis la mise sur le marché, la fréquence, le type et la sévérité des effets indésirables observés chez les patients âgés et chez les patients présentant une insuffisance rénale ou hépatique seraient identiques à ceux observés dans la population générale.
Indication diagnostique
|
Classes de systèmes d’organes |
Fréquence |
Effet indésirable |
|
Affections du système immunitaire |
Très rare (< 1/10 000) |
Réactions d’hypersensibilité y compris réaction/choc anaphylactique |
|
Troubles du métabolisme et de la nutrition |
Peu fréquent (≥ 1/1 000, < 1/100) Très rare (< 1/10 000) |
Hypoglycémie*1 Coma hypoglycémique |
|
Affections cardiaques |
Très rare (< 1/10 000) |
Tachycardie*2 |
|
Affections vasculaires |
Très rare (< 1/10 000) Très rare (< 1/10 000) |
Hypotension artérielle*2 Hypertension artérielle*2 |
|
Affections gastro-intestinales |
Fréquent (≥ 1/100, < 1/10) Peu fréquent (≥ 1/1 000, < 1/100) Rare (≥ 1/10 000, < 1/1 000) |
Nausées Vomissements Douleurs abdominales |
|
Troubles généraux et anomalies au site d’administration |
Fréquence indéterminée (ne peut pas être estimé à partir des données disponibles) |
Réactions au site d’injection |
*1 Après une épreuve diagnostique, l’hypoglycémie pourrait être plus prononcée chez les patients ayant jeûné (voir rubrique 4.4).
*2 Les effets indésirables cardiovasculaires ont été rapportés uniquement lorsque GLUCAGEN est utilisé dans les épreuves endoscopiques ou radiographiques.
Population pédiatrique
Aucune donnée n’est disponible dans l’utilisation diagnostique de GLUCAGEN chez les enfants.
Autres populations particulières
D’après les données issues des essais cliniques et de l’expérience depuis la mise sur le marché, la fréquence, le type et la sévérité des effets indésirables observés chez les patients âgés et chez les patients présentant une insuffisance rénale ou hépatique seraient identiques à ceux observés dans la population générale.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr.
En cas de surdosage, des nausées et des vomissements peuvent survenir chez le patient. Ces symptômes seront temporaires compte-tenu de la courte demi-vie du glucagon.
En cas d’administration de doses substantiellement supérieures aux doses approuvées, la kaliémie peut chuter, et doit être surveillée et corrigée si nécessaire.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Mécanisme d’action
Le glucagon est une substance hyperglycémiante qui mobilise le glycogène hépatique, celui-ci étant alors libéré dans le sang sous forme de glucose. Le glucagon inhibe la tonicité et la motilité des muscles lisses du tractus gastro-intestinal.
Effets pharmacodynamiques
Dans le traitement de l’hypoglycémie sévère, un effet du glucagon sur la glycémie est habituellement observé dans les 10 minutes qui suivent l’injection.
Après une injection intraveineuse, l’efficacité sur la motilité gastro-intestinale survient dans la minute qui suit l’injection. L’efficacité se prolonge pendant 5 à 20 minutes selon la dose. Après une injection intramusculaire, l’efficacité survient dans les 5 à 15 minutes qui suivent l’injection et se prolonge pendant 10 à 40 minutes.
5.2. Propriétés pharmacocinétiques
Le glucagon subit une dégradation enzymatique dans le plasma et les organes de distribution. Le glucagon est éliminé principalement par le foie et le rein, chacun contribuant pour 30 % environ au taux de clairance métabolique total.
Élimination
Le glucagon a une demi-vie plasmatique courte, d’environ 3 à 6 minutes. Le taux de clairance métabolique du glucagon chez l’homme est approximativement de 10 ml/kg/min.
5.3. Données de sécurité préclinique
Aucune donnée préclinique utile au prescripteur n’a été mise en évidence.
Acide chlorhydrique pour ajustement du pH
Hydroxyde de sodium pour ajustement du pH
Eau pour préparations injectables
La solution reconstituée contient 1 mg/ml de glucagon et 107 mg/ml de lactose monohydraté.
Il n’y a pas d’incompatibilité connue avec GLUCAGEN.
Avant reconstitution, la durée de conservation du produit est de 36 mois.
La solution reconstituée de GLUCAGEN doit être utilisée immédiatement après la préparation.
6.4. Précautions particulières de conservation
Si, dans de rares cas, la solution reconstituée présente des filaments (apparence visqueuse) ou des particules insolubles, elle doit être jetée.
GLUCAGEN doit être conservé au réfrigérateur (entre 2 °C et 8 °C). À conserver dans l’emballage d’origine à l’abri de la lumière.
6.5. Nature et contenu de l'emballage extérieur
Récipient contenant GLUCAGEN :
Flacon en verre de type I, Ph. Eur., obturé par un bouchon en bromobutyle et couvert par un disque en aluminium.
Récipient contenant le solvant :
Flacon en verre de type I, Ph. Eur., obturé par un bouchon en bromobutyle téflonné et couvert par un disque en aluminium.
Les flacons sont fournis avec une capsule en plastique inviolable qui doit être retirée avant utilisation.
Toutes les présentations peuvent ne pas être commercialisées.
6.6. Précautions particulières d’élimination et de manipulation
Reconstitution
Prélever l’eau pour préparations injectables (1,1 ml) dans une seringue jetable. Injecter l’eau pour préparations injectables dans le flacon contenant la poudre compactée de glucagon.
Remuer doucement le flacon jusqu’à ce que le glucagon soit complètement dissout et que la solution soit limpide. Prélever la solution dans la seringue.
La solution reconstituée doit être limpide et incolore et représente une injection de 1 mg (1 UI) par ml à administrer par voie sous-cutanée, intramusculaire ou intraveineuse (injection).
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
10-12 COURS MICHELET
92800 PUTEAUX
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 335 905 5 0 : Poudre en flacon (verre de type I), obturé par un bouchon (bromobutyle) et couvert par un disque (aluminium) + solvant en flacon (verre de type I), obturé par un bouchon (bromobutyle téflonné) et couvert par un disque (aluminium).
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
{JJ mois AAAA}
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Liste I
ANSM - Mis à jour le : 27/11/2023
GLUCAGEN 1 mg/ml, poudre et solvant pour solution injectable
glucagon
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin, votre pharmacien ou votre infirmier/ère.
· Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d’autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
1. Qu'est-ce que GLUCAGEN 1 mg/ml, poudre et solvant pour solution injectable et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant d'utiliser GLUCAGEN 1 mg/ml, poudre et solvant pour solution injectable ?
3. Comment utiliser GLUCAGEN 1 mg/ml, poudre et solvant pour solution injectable ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver GLUCAGEN 1 mg/ml, poudre et solvant pour solution injectable ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE GLUCAGEN 1 mg/ml, poudre et solvant pour solution injectable ET DANS QUELS CAS EST-IL UTILISE ?
Classe pharmacothérapeutique - code ATC : hormones pancréatiques, hormones glycogénolytiques, H04AA01.
La substance active de GLUCAGEN est le glucagon.
GLUCAGEN est utilisé pour traiter immédiatement et en urgence les enfants et les adultes diabétiques utilisant de l’insuline. GLUCAGEN est utilisé en cas de perte de connaissance (évanouissement) due à un taux de sucre très bas dans le sang, appelé « hypoglycémie sévère ». GLUCAGEN est utilisé lorsque ces patients ne sont pas en mesure de prendre du sucre par voie orale.
Le glucagon est une hormone naturelle qui a une action contraire à celle de l’insuline dans le corps humain. Il facilite la transformation du glycogène en glucose (sucre) par le foie. Le glucose est alors libéré dans la circulation sanguine, augmentant ainsi le taux de sucre dans le sang.
Pour les professionnels de santé : Voir en fin de notice.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D’UTILISER GLUCAGEN 1 mg/ml, poudre et solvant pour solution injectable ?
· Assurez-vous que les membres de votre famille, vos collègues et vos amis proches connaissent GLUCAGEN. Dites-leur que si vous perdez connaissance (si vous vous évanouissez), ils devront utiliser GLUCAGEN immédiatement.
· Indiquez aux membres de votre famille ainsi qu’aux autres personnes l’endroit où vous conservez GLUCAGEN et montrez-leur comment utiliser GLUCAGEN. Ils doivent réagir rapidement – si vous restez longtemps inconscient, cela peut être dangereux. Il est important qu’ils soient entraînés à l’utilisation de GLUCAGEN et qu’ils sachent l’utiliser avant que vous n’en ayez besoin.
· Mélangez la poudre compactée de GLUCAGEN et le solvant avant l’injection. Dites aux membres de votre famille ainsi qu’aux autres personnes de suivre les instructions de la rubrique 3 : comment utiliser GLUCAGEN 1 mg/ml, poudre et solvant pour solution injectable ?
· Toute solution mélangée de GLUCAGEN non utilisée doit être jetée.
· Après avoir utilisé GLUCAGEN, vous-même ou une autre personne devez contacter votre médecin ou un professionnel de santé pour trouver la cause de votre très faible taux de sucre dans le sang et éviter que cela ne se reproduise.
N’utilisez jamais GLUCAGEN 1 mg/ml, poudre et solvant pour solution injectable
· si vous êtes allergique (hypersensible) à la substance active ou à l’un des autres composants contenus dans ce médicament, mentionnés dans la rubrique 6.
· si vous avez une tumeur de la glande surrénale.
Si vous êtes dans une de ces situations, n’utilisez pas GLUCAGEN.
Avertissements et précautions
Adressez-vous à votre médecin, pharmacien ou votre infirmier/ère avant d’utiliser GLUCAGEN.
GLUCAGEN ne sera pas aussi efficace si :
· vous êtes à jeun depuis trop longtemps,
· vous avez un faible niveau d’adrénaline,
· vous avez un faible taux de sucre dans le sang causé par une consommation trop élevée d’alcool,
· vous avez une tumeur qui sécrète du glucagon ou de l’insuline.
Si vous êtes dans une de ces situations, adressez-vous à votre médecin ou votre pharmacien.
Enfants et adolescents
Sans objet.
Autres médicaments et GLUCAGEN 1 mg/ml, poudre et solvant pour solution injectable
Les médicaments suivants peuvent modifier le fonctionnement de GLUCAGEN :
· insuline – utilisée pour traiter le diabète.
· indométacine – utilisée pour traiter les douleurs et les raideurs au niveau des articulations.
GLUCAGEN peut modifier l’action de certains médicaments :
· warfarine – utilisée pour prévenir les caillots de sang. GLUCAGEN peut augmenter l’effet anticoagulant de la warfarine.
· bêtabloquants – utilisés pour traiter la pression artérielle élevée et les battements cardiaques irréguliers. GLUCAGEN peut augmenter la pression artérielle et le pouls, uniquement pendant une courte durée.
Si vous êtes dans une de ces situations (ou que vous n’en êtes pas sûr), adressez-vous à votre médecin ou votre pharmacien avant d’utiliser GLUCAGEN.
Informez votre médecin ou pharmacien si vous prenez, avez récemment pris ou pourriez prendre tout autre médicament, y compris un médicament obtenu sans ordonnance.
GLUCAGEN 1 mg/ml, poudre et solvant pour solution injectable avec des aliments, boissons et de l’alcool
Sans objet.
Grossesse et allaitement
Si vous avez un taux de sucre dans le sang très bas alors que vous êtes enceinte ou que vous allaitez, que vous pensez être enceinte ou planifiez une grossesse, vous pouvez utiliser GLUCAGEN.
Si vous êtes enceinte demandez conseil à votre médecin ou pharmacien avant de prendre tout médicament.
Conduite de véhicules et utilisation de machines
Attendez que les effets d’un taux de sucre dans le sang très bas se soient dissipés avant de conduire un véhicule ou d’utiliser des outils ou des machines.
GLUCAGEN 1 mg/ml, poudre et solvant pour solution injectable contient du sodium
GLUCAGEN contient moins de 1 mmol de sodium (23 mg) par dose maximale (2 ml), c’est-à-dire essentiellement « sans sodium ».
3. COMMENT UTILISER GLUCAGEN 1 mg/ml, poudre et solvant pour solution injectable ?
|
Mode d’administration |
|
|
|
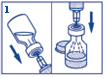
1. Enlevez les deux capsules en plastique des flacons. Prélevez toute l’eau dans une seringue jetable. Insérez l’aiguille dans le bouchon en caoutchouc (au niveau du cercle marqué) du flacon contenant GLUCAGEN et injectez tout le liquide de la seringue dans le flacon. |
|
|
|
2. Sans sortir l’aiguille du flacon, agitez doucement le flacon jusqu’à ce que GLUCAGEN soit complètement dissout et que la solution soit limpide. |
|
|
|
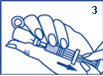
3. Assurez-vous que le piston soit complètement repoussé. En gardant l’aiguille dans le liquide, aspirez lentement toute la solution dans la seringue. Faites attention à ne pas retirer le piston de la seringue. Il est important d’évacuer les bulles d’air de la seringue en : · tapotant la seringue avec votre doigt, tout en gardant l’aiguille pointée vers le haut, · en appuyant légèrement sur le piston pour chasser l’air qui se trouve dans le haut de la seringue. Continuez à pousser le piston jusqu’à obtenir la dose correcte pour l’injection. Une petite quantité de liquide apparaîtra au bout de l'aiguille. Voir Posologie. |
|
|
|
4. Injectez la dose sous la peau ou dans un muscle. 5. Tournez la personne inconsciente sur le côté afin de prévenir tout étouffement. 6. Dès que cette personne a repris connaissance et est à nouveau capable d’avaler, donnez-lui un aliment riche en sucre, comme des sucreries, des biscuits ou un jus de fruits pour éviter qu’un faible taux de sucre dans le sang ne revienne. Après avoir utilisé GLUCAGEN, vous-même ou une autre personne devez contacter votre médecin ou un professionnel de santé pour trouver la cause de votre très faible taux de sucre dans le sang et éviter que cela ne se reproduise. |
Posologie
La dose recommandée est :
· Adultes : administrez la totalité du médicament (1 ml).
· Enfants ayant moins de 8 ans ou enfants ayant plus de 8 ans et pesant moins de 25 kg : administrez la moitié du médicament (0,5 ml).
· Enfants ayant plus de 8 ans ou enfants ayant moins de 8 ans et pesant plus de 25 kg : administrez la totalité du médicament (1 ml).
Si vous avez utilisé plus de GLUCAGEN 1 mg/ml, poudre et solvant pour solution injectable que vous n’auriez dû
Une prise importante de GLUCAGEN peut entraîner des nausées et des vomissements. En général, un traitement spécifique n’est pas nécessaire.
Si vous oubliez d’utiliser GLUCAGEN 1 mg/ml, poudre et solvant pour solution injectable
Si vous arrêtez d’utiliser GLUCAGEN 1 mg/ml, poudre et solvant pour solution injectable
Sans objet.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Informez immédiatement votre médecin si vous remarquez un des effets indésirables graves suivants :
Très rares : pouvant affecter jusqu’à 1 personne sur 10 000
· Réaction allergique – les signes peuvent inclure : respiration sifflante, transpiration, rythme cardiaque rapide, éruption cutanée, gonflement du visage, perte de connaissance.
► Adressez-vous immédiatement à un médecin si vous remarquez un de ces effets indésirables graves.
Autres effets indésirables
Fréquents : pouvant affecter jusqu’à 1 personne sur 10
· Nausées.
Peu fréquents : pouvant affecter jusqu’à 1 personne sur 100
· Vomissements.
Rares : pouvant affecter jusqu’à 1 personne sur 1 000
· Douleurs d’estomac (abdominales).
Fréquence indéterminée : nous ne connaissons pas la fréquence à laquelle cela peut se produire
· Réactions au site d’injection.
► Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice.
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr.
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER GLUCAGEN 1 mg/ml, poudre et solvant pour solution injectable ?
Tenir ce médicament hors de la vue et de la portée des enfants.
À conserver au réfrigérateur (entre 2 °C et 8 °C).
À conserver dans l’emballage d’origine à l’abri de la lumière.
Ne pas congeler, afin d’éviter d’endommager le produit.
À utiliser immédiatement après mélange – ne pas conserver pour une utilisation ultérieure.
N’utilisez pas ce médicament après la date de péremption indiquée sur l’étiquette. La date de péremption fait référence au dernier jour de ce mois.
N’utilisez pas la solution mélangée si elle a une apparence de gel ou si la poudre n’a pas été correctement dissoute.
N’utilisez pas si les capsules en plastique ont été perdues ou si elles sont manquantes quand vous recevez la boîte – rapportez la boîte à votre pharmacie.
Ne jetez aucun médicament au tout-à-l’égout ni avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient GLUCAGEN 1 mg/ml, poudre et solvant pour solution injectable
· La substance active est : le glucagon 1 mg, sous forme de chlorhydrate, produit dans des levures par la technique de l’ADN recombinant.
· Les autres composants sont : le lactose monohydraté, l’eau pour préparations injectables, l’acide chlorhydrique et/ou l’hydroxyde de sodium (pour ajustement du pH).
Aspect de GLUCAGEN et contenu de l’emballage extérieur
GLUCAGEN se présente sous forme d’une poudre blanche stérile de glucagon dans un flacon et d’un solvant également dans un flacon. La poudre est compactée. Une fois mélangée, la solution contient 1 mg/ml de glucagon.
GLUCAGEN se présente dans des boîtes de 1 x 1 mg et 10 x 1 mg. Toutes les présentations peuvent ne pas être commercialisées.
Titulaire de l’autorisation de mise sur le marché
10-12 COURS MICHELET
92800 PUTEAUX
Exploitant de l’autorisation de mise sur le marché
NOVO NORDISK
10-12 COURS MICHELET
92800 PUTEAUX
NOVO ALLÉ
DK-2880 BAGSVÆRD
DANEMARK
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Ce médicament est autorisé dans les Etats membres de l'Espace Economique Européen et au Royaume-Uni (Irlande du Nord) sous les noms suivants : Conformément à la réglementation en vigueur.
[À compléter ultérieurement par le titulaire]
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
{mois AAAA}.
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).
Les informations suivantes sont destinées exclusivement aux professionnels de santé :
Les professionnels de santé doivent se référer à toutes les rubriques précédentes avant de lire cette information supplémentaire.
Compte-tenu de l’instabilité de GLUCAGEN en solution, le produit doit être utilisé immédiatement après la reconstitution et ne doit pas être administré en perfusion intraveineuse.
Traitement de l’hypoglycémie sévère
Administrez par injection sous-cutanée ou intramusculaire. Si le patient ne réagit pas dans les 10 minutes qui suivent l’injection, injectez du glucose par voie intraveineuse. Si le patient a réagi au traitement, administrez-lui des glucides par voie orale afin de reconstituer les réserves de glycogène hépatique et de prévenir une récidive de l’hypoglycémie.
Épreuve diagnostique
Des glucides doivent être donnés par voie orale à la fin de l’examen, si cela est compatible avec l’épreuve diagnostique concernée. Rappelez-vous que GLUCAGEN exerce une action contraire à celle de l’insuline. Des précautions d’emploi sont à respecter, en particulier en cas d’endoscopie ou de radiographie, lors de l’administration de GLUCAGEN chez des patients diabétiques ou chez des sujets atteints de maladies cardiaques.
Examen du tractus gastro-intestinal :
Les doses varient de 0,2 à 2 mg selon l’indication diagnostique utilisée et la voie d’administration. Une dose de 0,2 à 0,5 mg administrée par voie intraveineuse ou une dose de 1 mg administré par voie intramusculaire est nécessaire pour obtenir un relâchement de l’estomac, du bulbe duodénal, du duodénum et de l’intestin grêle. Une dose de 0,5 à 0,75 mg administrée par voie intraveineuse ou une dose de 1 à 2 mg administrée par voie intramuscuslaire est nécessaire pour obtenir un relâchement du côlon. Après une injection intraveineuse de 0,2 à 0,5 mg, l’efficacité survient dans la minute qui suit l’injection ; cet effet se prolonge entre 5 à 20 minutes. Après une injection intramusculaire de 1 à 2 mg, l’efficacité se produit dans les 5 à 15 minutes qui suivent l’injection et dure environ 10 à 40 minutes.
Effets indésirables supplémentaires en cas d’utilisation dans une épreuve diagnostique
Changements de la pression artérielle, rythme cardiaque rapide, hypoglycémie et coma hypoglycémique.