
BUDESONIDE/FORMOTEROL SANDOZ FORSPIRO 320 microgrammes/9 microgrammes/dose, poudre pour inhalation en récipient unidose - Résumé des caractéristiques du produit |
 |
|
ANSM - Mis à jour le : 07/07/2021
BUDESONIDE/FORMOTEROL SANDOZ FORSPIRO 320 microgrammes/9 microgrammes/dose, poudre pour inhalation en récipient unidose
2. COMPOSITION QUALITATIVE ET QUANTITATIVE 
Budésonide...................................................................................................... 346,3 microgrammes
Fumarate de formotérol dihydraté....................................................................... 10,8 microgrammes
Pour chaque dose nominale
Budésonide........................................................................................................ 320 microgrammes
Fumarate de formotérol dihydraté............................................................................ 9 microgrammes
Pour chaque dose délivrée au travers de l’embout buccal
Excipients à effet notoire :
Chaque dose délivrée contient 7,9 mg de lactose (sous forme monohydratée) et chaque dose nominale contient 9,1 mg de lactose (sous forme monohydratée).
Pour la liste complète des excipients, voir rubrique 6.1.
Poudre pour inhalation en récipient unidose.
Poudre blanc à blanc-cassé ou légèrement jaune sans agglomérats.
4.1. Indications thérapeutiques 
BUDESONIDE/FORMOTEROL SANDOZ FORSPIRO est indiqué chez les adultes et les adolescents âgés de 12 à 17 ans en traitement continu de l'asthme persistant, dans les situations où l’administration par voie inhalée d’un médicament associant un corticoïde et un bronchodilatateur β2-mimétique à longue durée d’action est justifiée :
· chez les patients insuffisamment contrôlés par une corticothérapie inhalée et la prise d’un bronchodilatateur β2-mimétique à courte durée d’action par voie inhalée à la demande.
ou
· chez les patients déjà contrôlés par l’administration d’une corticothérapie inhalée associée à un traitement continu par β2-mimétique à longue durée d’action par voie inhalée.
Bronchopneumopathie chronique obstructive (BPCO)
BUDESONIDE/FORMOTEROL SANDOZ FORSPIRO est indiqué en traitement symptomatique de la BPCO chez les adultes âgés de 18 ans et plus dont le VEMS (mesuré après administration d’un bronchodilatateur) est inférieur à 70 % de la valeur théorique et ayant des antécédents d’exacerbations malgré un traitement bronchodilatateur continu (voir également la rubrique 4.4).
4.2. Posologie et mode d'administration 
Voie d’administration : voie inhalée.
Posologie
Asthme
BUDESONIDE/FORMOTEROL SANDOZ FORSPIRO ne doit pas être utilisé pour l’initiation d’un traitement antiasthmatique.
La posologie de BUDESONIDE/FORMOTEROL SANDOZ FORSPIRO est individuelle et sera ajustée en fonction de la sévérité de la maladie. Ceci devra être respecté non seulement lorsque l’association est initiée, mais également lors de l’ajustement de la posologie.
Si les dosages disponibles de l’association fixe de BUDESONIDE/FORMOTEROL SANDOZ FORSPIRO ne permettent pas d’ajuster la posologie de chacun des principes actifs en fonction de l’état clinique du patient, β2- mimétiques et/ou corticostéroïdes devront être prescrits individuellement.
Le médecin vérifiera régulièrement que le dosage prescrit de budésonide/formotérol est adapté pour un traitement optimal du patient. Il convient de toujours rechercher la posologie minimale efficace permettant d'obtenir le contrôle des symptômes. Lorsque celui-ci est obtenu avec la posologie minimale recommandée, l’administration d’un corticoïde seul pourra être envisagée comme étape suivante.
S’il est approprié de diminuer la posologie à une dose plus faible ou de prescrire une dose plus importante que celle qui est disponible dans BUDESONIDE/ FORMOTEROL SANDOZ, il est recommandé de passer à une autre association fixe de budésonide et de fumarate de formotérol contenant une dose plus faible ou plus élevée du corticostéroïde inhalé.
En pratique courante, lorsque les symptômes ont régressé avec deux prises quotidiennes, un rythme d’administration en une prise par jour peut éventuellement être envisagé dans le cadre de la recherche de la dose minimale efficace si le médecin estime nécessaire de maintenir un traitement par bronchodilatateur à longue durée d’action pour le contrôle des symptômes.
Une augmentation de la consommation du bronchodilatateur d'action rapide est le signe d'une déstabilisation de l'asthme et nécessite une réévaluation du traitement.
BUDESONIDE/FORMOTEROL SANDOZ FORSPIRO devra être utilisé exclusivement en traitement de fond continu. Des dosages plus faibles sont disponibles pour une utilisation de BUDESONIDE/FORMOTEROL SANDOZ FORSPIRO à la fois pour le traitement continu et pour soulager les symptômes d’asthme (160 microgrammes/4,5 microgrammes par dose délivrée).
Posologie préconisée :
Adultes (18 ans et plus) : 1 inhalation deux fois par jour.
Certains patients peuvent nécessiter jusqu’à un maximum de 2 inhalations deux fois par jour.
Adolescents (12-17 ans) : 1 inhalation deux fois par jour.
Enfants de moins de 12 ans : comme il n’existe aucune donnée disponible, BUDESONIDE/ FORMOTEROL SANDOZ n'est pas recommandé chez les enfants de moins de 12 ans.
BRONCHOPNEUMOPATHIE CHRONIQUE OBSTRUCTIVE (BPCO) :
Posologie préconisée
Adultes : 1 inhalation deux fois par jour.
Informations générales
Populations spécifiques :
Sujets âgés : pas de recommandation posologique particulière.
Insuffisance hépatique ou rénale : aucune donnée n'est disponible concernant l'utilisation de BUDESONIDE/FORMOTEROL SANDOZ FORSPIRO chez les patients insuffisants hépatiques ou insuffisants rénaux. Compte tenu de l'élimination principalement par métabolisme hépatique du budésonide et du formotérol, une augmentation de l'exposition systémique est attendue chez les patients présentant une cirrhose hépatique sévère.
Mode d’administration
Instructions d’utilisation
Il conviendra de démontrer aux patients comment utiliser l’inhalateur FORSPIRO et une utilisation correcte devra être vérifiée régulièrement.
L’inhalateur contient 60 doses de médicament en poudre dans une bandelette d’aluminium enroulée. Il comporte un compteur de doses qui indique le nombre de doses restant en comptant de 60 à 0. Lorsque les 10 dernières doses sont atteintes les nombres apparaissent sur un fond rouge.
L’inhalateur n’est pas rechargeable – il doit être jeté lorsqu’il est vide et remplacé par un neuf.

Avant d’utiliser l’inhalateur
· Le volet transparent de la chambre latérale doit être ouvert.
· La bandelette d’aluminium doit être retirée de la chambre latérale en tirant soigneusement toute la longueur de la bandelette contre les « dents » de la chambre latérale comme indiqué ci-dessous. La bandelette ne doit pas être tirée ou tiraillée.
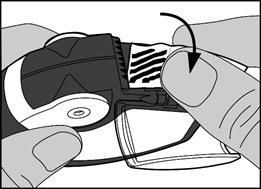
· Le volet de la chambre latérale doit être fermé et la bandelette utilisée doit être jetée.
Note : lorsque l’inhalateur est utilisé, la chambre latérale va se remplir progressivement avec la bandelette utilisée. La bandelette d’aluminium avec les barres noires ne contient pas de médicament. Finalement les sections numérotées de la bandelette vont apparaitre dans la chambre latérale. Il ne doit jamais y avoir plus de 2 sections de la bandelette d’aluminium dans la chambre latérale car elles pourraient boucher l’inhalateur. La bandelette doit être découpée soigneusement comme indiqué ci-dessus et jetée de manière sécurisée.
Utilisation de l’inhalateur
L’inhalateur doit être tenu dans les mains, comme indiqué sur les illustrations.
1. Ouvert
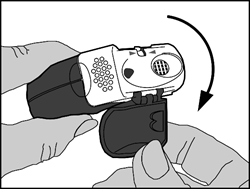
· Le couvercle de protection doit être ouvert vers le bas pour dégager l’embout buccal.
· Le compteur de doses doit être vérifié pour connaître le nombre de doses restantes.
2. Préparation de la dose
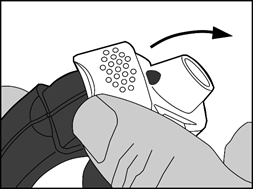
· Le bord du levier blanc doit être soulevé. La chambre latérale doit être fermée.
Remarque : le levier blanc ne doit être actionné que lorsque le patient est prêt à inhaler une dose du médicament. Des doses seront gaspillées si le patient joue avec le levier blanc.

· Ouverture : le levier blanc doit être ouvert entièrement jusqu’au maximum et jusqu’au clic. Cette action déplace une nouvelle dose dans la position avec le numéro au-dessus.
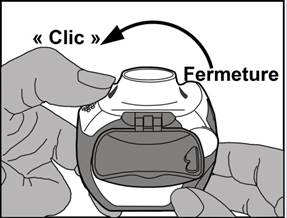
· Fermeture : ensuite, le levier blanc doit être fermé complètement jusqu’à ce qu’il retrouve sa position d’origine en émettant un clic. L’inhalateur est maintenant prêt pour une utilisation immédiate.
3 - Inhalation de la dose
· À distance de l’embout buccal, le patient doit expirer le plus possible sans que cela lui soit inconfortable. Il ne doit jamais expirer directement dans l’inhalateur car cela pourrait affecter la dose.
· L’inhalateur doit être maintenu horizontal avec le couvercle de protection dirigé vers le bas.
· Les lèvres doivent être refermées fermement autour de l’embout buccal.
· Le patient doit inspirer aussi profondément et aussi fort que possible à travers l’inhalateur et non par le nez.

· L’inhalateur doit être retiré de la bouche et le souffle doit être retenu pendant 5 à 10 secondes ou aussi longtemps que possible sans que cela ne soit inconfortable.
· Ensuite le patient doit expirer lentement, mais pas dans l’inhalateur.
· Le couvercle de protection doit être refermé sur l’embout buccal.
· La bouche doit être rincée avec de l’eau qui doit être recrachée ensuite. Cela pourra aider à éviter une infection fongique buccale et un enrouement.
Nettoyage
· L’extérieur de l’embout buccal doit être essuyé avec un tissu propre et sec, si nécessaire.
· L’inhalateur ne doit pas être démonté pour le nettoyer ou pour toute autre raison.
· Les éléments de l’inhalateur ne doivent pas être nettoyés avec de l’eau ou des chiffons humides car l’humidité peut affecter la dose.
· Ne jamais insérer d’aiguilles ou d’objets pointus dans l’embout buccal ou tout autre élément car cela pourrait endommager l’inhalateur.
Hypersensibilité à la substance active ou à l’un des excipients mentionnés à la rubrique 6.1.
4.4. Mises en garde spéciales et précautions d'emploi 
Si le contrôle des symptômes reste insuffisant à la suite du traitement par BUDESONIDE/ FORMOTEROL SANDOZ ou si le patient dépasse les doses maximales recommandées de BUDESONIDE/FORMOTEROL SANDOZ FORSPIRO, la conduite thérapeutique devra être réévaluée (voir rubrique 4.2). L'utilisation croissante de bronchodilatateurs de secours indique une aggravation de la condition sous-jacente et justifie une réévaluation du traitement de l'asthme. Une détérioration soudaine ou progressive du contrôle des symptômes d'asthme ou de la BPCO nécessite un avis médical urgent car elle peut annoncer une évolution vers un asthme aigu grave engageant le pronostic vital. Il conviendra alors d'envisager une augmentation de la corticothérapie (avec éventuellement une cure de corticoïdes oraux) ou une antibiothérapie en cas d'infection.
Il convient d'informer les patients qu'ils doivent avoir en permanence à leur disposition leur inhalateur de secours.
Il conviendra de rappeler au patient qu'il doit prendre la dose d'entretien de BUDESONIDE/ FORMOTEROL SANDOZ régulièrement en respectant la prescription médicale, même en l'absence de symptômes d'asthme.
Dès que les symptômes de l'asthme sont bien contrôlés, une diminution progressive de la dose de BUDESONIDE/FORMOTEROL SANDOZ FORSPIRO doit être envisagée. Il est important que les patients soient suivis régulièrement lors de la phase de réduction du traitement. La dose minimale efficace de BUDESONIDE/FORMOTEROL SANDOZ FORSPIRO doit être utilisée (voir rubrique 4.2).
Le traitement par BUDESONIDE/FORMOTEROL SANDOZ FORSPIRO ne doit pas être initié pendant une exacerbation, une aggravation significative ou une détérioration aiguë de l'asthme.
Des événements indésirables graves liés à l'asthme et des exacerbations peuvent survenir au cours du traitement par BUDESONIDE/FORMOTEROL SANDOZ FORSPIRO. Il convient d'informer les patients de la nécessité de consulter un médecin tout en poursuivant leur traitement si les symptômes de l'asthme persistent ou s'aggravent après l’initiation du traitement par BUDESONIDE/FORMOTEROL SANDOZ FORSPIRO.
Aucune étude clinique n'est disponible avec l'association budésonide/formotérol chez les patients présentant une BPCO et un VEMS pré-bronchodilatateur > 50 % de la valeur prédite et un VEMS post-bronchodilatateur < 70 % de la valeur prédite (voir rubrique 5.1).
Comme avec d'autres traitements administrés par voie inhalée, une augmentation des sibilants bronchiques et de la dyspnée juste après l'administration du produit traduit un bronchospasme paradoxal qui doit conduire à l'arrêt immédiat du traitement par BUDESONIDE/FORMOTEROL SANDOZ FORSPIRO. La conduite thérapeutique devra être réévaluée pour envisager si nécessaire les traitements alternatifs. Le bronchospasme paradoxal sera traité immédiatement par un bronchodilatateur inhalé d'action rapide (voir rubrique 4.8).
La corticothérapie inhalée peut entraîner des effets systémiques, en particulier lors de traitements prolongés à fortes doses. La survenue de ces effets est néanmoins beaucoup moins probable avec la corticothérapie inhalée qu'avec la corticothérapie par voie systémique. Les effets systémiques possibles incluent un syndrome de Cushing, un tableau cushingoïde, une inhibition de la fonction surrénalienne, un retard de croissance chez les enfants et les adolescents, une diminution de la densité minérale osseuse, une cataracte et un glaucome et, plus rarement, des troubles psychologiques et comportementaux, notamment hyperactivité psychomotrice, troubles du sommeil, anxiété, dépression ou agressivité (en particulier chez l'enfant) (voir rubrique 4.8).
L'effet potentiel de la corticothérapie sur la densité minérale osseuse, en particulier lors de traitements prolongés à fortes doses, doit être pris en considération chez les patients présentant des facteurs de risque associés d'ostéoporose. Des études à long terme conduites chez des enfants recevant des doses quotidiennes moyennes de 400 µg (dose nominale) ou chez des adultes recevant des doses quotidiennes de 800 µg (dose nominale) de budésonide par voie inhalée n'ont pas montré d'effets significatifs sur la densité minérale osseuse. Il n'y a pas de donnée disponible concernant les effets de doses de budésonide/formotérol plus élevées.
En cas de suspicion d’inhibition de la fonction surrénalienne en relation avec une corticothérapie préalable par voie systémique, une attention particulière sera portée lors de la mise en route d’un traitement par BUDESONIDE/FORMOTEROL SANDOZ FORSPIRO.
L’administration de budésonide par voie inhalée favorise la diminution du recours aux corticoïdes oraux, néanmoins les patients traités préalablement par une corticothérapie orale restent à risque élevé d’insuffisance surrénale pendant longtemps. La récupération peut prendre un temps considérable après l’arrêt de la corticothérapie orale et donc les patients cortico-dépendants passant à un traitement par budésonide en inhalation peuvent garder une insuffisance adrénergique pendant longtemps. Dans ces situations, la fonction surrénalienne doit être surveillée régulièrement.
Le traitement prolongé par corticoïdes inhalés à fortes doses, notamment à des doses supérieures aux doses recommandées, peut également entraîner une inhibition de la fonction surrénalienne cliniquement significative. Une corticothérapie adaptée de supplémentation devra être envisagée dans les périodes de stress, en cas d'infection sévère ou de chirurgie programmée.
La diminution rapide de la dose de corticoïdes peut entraîner une insuffisance surrénale aiguë. Les symptômes et signes pouvant être observés lors d'une crise surrénalienne aiguë peuvent être quelque peu vagues mais peuvent inclure anorexie, douleurs abdominales, perte de poids, fatigue, céphalées, nausées, vomissements, troubles de la conscience, convulsions, hypotension et hypoglycémie.
Le traitement par corticothérapie systémique ou par budésonide inhalé ne doivent pas être interrompus brutalement.
Lors du relais de la thérapie orale par BUDESONIDE/FORMOTEROL SANDOZ FORSPIRO, une action corticoïde systémique généralement plus faible sera ressentie, ce qui peut entraîner l'apparition de symptômes allergiques ou arthritiques tels que rhinite, eczéma et douleurs musculaires et articulaires. Un traitement spécifique devra être initié dans ces conditions.
Dans de rares cas, des symptômes tels que fatigue, céphalées, nausées et vomissements peuvent être observés et doivent faire suspecter une insuffisance cortico-surrénalienne. Dans ces cas, il peut être nécessaire d’augmenter temporairement la dose de glucocorticoïdes oraux.
Afin de réduire le risque de candidose oropharyngée (voir rubrique 4.8), il sera recommandé aux patients de se rincer la bouche avec de l'eau après chaque prise du traitement d'entretien.
L'administration concomitante d'itraconazole, de ritonavir ou d'autres inhibiteurs puissants du CYP3A doit être évitée (voir rubrique 4.5). Si cela n'est pas possible, l'intervalle de temps entre l'administration des médicaments doit être aussi long que possible.
Une augmentation du risque d'effets indésirables systémiques est attendue avec l'administration concomitante d’inhibiteurs du CYP3A, dont le cobicistat. L'association de budésonide avec des inhibiteurs du CYP3A4 doit donc être évitée, sauf si le bénéfice attendu avec la corticothérapie est supérieur au risque d'effets indésirables systémiques des corticoïdes.
BUDESONIDE/FORMOTEROL SANDOZ FORSPIRO doit être administré avec précaution chez les patients présentant les pathologies suivantes : thyrotoxicose, phéochromocytome, diabète sucré, hypokaliémie non traitée, cardiomyopathie hypertrophique obstructive, sténose aortique sous-valvulaire idiopathique, hypertension artérielle sévère, anévrisme ou autres troubles cardiovasculaires sévères, tels que cardiopathie ischémique, tachyarythmies ou insuffisance cardiaque sévère.
La prudence est requise chez les patients présentant un allongement de l'intervalle QTc. Le formotérol peut lui-même provoquer un allongement de l'intervalle QTc.
Le bénéfice de la corticothérapie inhalée et sa posologie devront être réévalués en cas de tuberculose pulmonaire active ou quiescente ou d'infections respiratoires fongiques ou virales.
Des doses élevées d'agonistes des récepteurs β2-adrénergiques peuvent entraîner une hypokaliémie potentiellement grave. L’administration concomitante de β2-adrénergiques avec des médicaments hypokaliémiants ou pouvant potentialiser cet effet, tels que les dérivés xanthiques, les corticoïdes ou les diurétiques, peut induire une augmentation du risque d’hypokaliémie des agonistes des récepteurs β2- adrénergiques. La prudence est particulièrement recommandée chez les patients ayant un asthme instable et une utilisation variable de bronchodilatateurs "à la demande" pour traiter des symptômes aigus, car le risque associé peut être majoré par l'hypoxie au cours d'une crise d'asthme et par toutes les situations susceptibles d'induire une hypokaliémie. Dans ces cas, une surveillance de la kaliémie est recommandée.
Comme avec tous les récepteurs β2-adrénergiques, des contrôles supplémentaires de la glycémie peuvent être justifiés chez les patients diabétiques.
Une perturbation visuelle peut être signalée lors d’une utilisation systémique et topique de corticoïdes. Si un patient présente des symptômes tels qu’une vision trouble ou d'autres troubles visuels, le patient doit être dirigé vers un ophtalmologiste afin d'évaluer les causes possibles, ce qui peut inclure la cataracte, le glaucome ou des maladies rares et des maladies telles que la Choriorétinopathie Séreuse Centrale (CRSC), qui ont été rapportés après utilisation de corticoïdes systémiques et topiques.
Population pédiatrique
Il est recommandé de surveiller régulièrement la croissance des enfants recevant des corticoïdes inhalés à long terme. En cas de ralentissement de la croissance, le traitement devra être réévalué en vue de réduire, si possible, la dose du corticoïde inhalé à la dose minimale efficace permettant le maintien du contrôle de l’asthme. Les bénéfices de la corticothérapie et les risques possibles de ralentissement de la croissance doivent être soigneusement évalués. L’avis d’un spécialiste pneumopédiatre peut être requis.
Des données limitées issues d’études cliniques à long terme suggèrent que la plupart des enfants et des adolescents traités par du budésonide inhalé atteindront leur taille adulte prédite. Toutefois, il a été observé un léger ralentissement initial mais transitoire de la croissance (environ 1 cm), généralement pendant la première année de traitement.
Pneumonie chez les patients présentant une BPCO
Une augmentation de l’incidence des cas de pneumonie, ayant ou non nécessité une hospitalisation, a été observée chez les patients présentant une BPCO et recevant une corticothérapie inhalée. Bien que cela ne soit pas formellement démontré dans toutes les études cliniques disponibles, ce risque semble augmenter avec la dose de corticoïde administré.
Les données disponibles ne permettent pas de considérer que le niveau du risque de survenue de pneumonie varie en fonction du corticostéroïde inhalé utilisé.
Il convient de rester vigilant chez les patients présentant une BPCO, les symptômes de pneumonie pouvant s'apparenter aux manifestations cliniques d'une exacerbation de BPCO.
Le tabagisme, un âge avancé, un faible indice de masse corporelle (IMC) ainsi que la sévérité de la BPCO sont des facteurs de risques de survenue de pneumonie chez les patients présentant une BPCO.
BUDESONIDE/FORMOTEROL SANDOZ FORSPIRO contient du lactose (7,9 mg/inhalation).
Cette quantité ne cause normalement pas de problème chez les patients intolérants au lactose. L’excipient lactose contient de petites quantités de protéines de lait pouvant causer des réactions allergiques.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions 
Interactions pharmacocinétiques
Une augmentation significative des taux sanguins de budésonide peut être observée avec les inhibiteurs puissants du CYP3A4 (ex : kétoconazole, itraconazole, voriconazole, posaconazole, clarithromycine, télithromycine, néfazodone, cobicistat et inhibiteurs des protéases du VIH). La prise concomitante de ces médicaments doit être évitée. Si cette association ne peut être évitée, un intervalle de temps suffisamment long devra être respecté entre l’administration de l’inhibiteur du CYP3A4 et celle du budésonide (voir rubrique 4.4).
Les concentrations plasmatiques de budésonide ont été 6 fois plus importantes lors de l’administration concomitante de budésonide par voie orale (dose unique de 3 mg) et de kétoconazole, puissant inhibiteur du CYP3A4, à 200 mg une fois par jour. Lorsque le kétoconazole était administré 12 heures après le budésonide, les concentrations plasmatiques du budésonide n’étaient que 3 fois plus importantes, traduisant une diminution de l’interaction pharmacocinétique lorsque les produits sont administrés à distance.
Concernant cette interaction, des données limitées avec le budésonide administré à forte dose indiquent également une augmentation significative des taux plasmatiques (en moyenne d’un facteur 4) en cas d’administration concomitante d’itraconazole 200 mg en une prise par jour et de budésonide inhalé (une dose unique de 1000 µg).
Interactions pharmacodynamiques
Les bêta-bloquants peuvent diminuer ou inhiber les effets du formotérol. Sauf en cas de nécessité absolue, les bêta-bloquants (même en collyres) doivent être évités au cours du traitement par budésonide/formotérol.
L'administration concomitante de quinidine, de disopyramide, de procaïnamide, de phénothiazine, d'antihistaminiques (terfénadine), et d'antidépresseurs tricycliques peut favoriser l’allongement de l'intervalle QTc et majorer le risque d'arythmies ventriculaires.
De plus, la L-Dopa, la L-thyroxine, l'ocytocine et l'alcool peuvent diminuer la tolérance cardiaque aux β2- mimétiques.
L'administration concomitante d'IMAO, ou de produits ayant des propriétés similaires tels que la furazolidone et la procarbazine, peut favoriser les poussées hypertensives.
Le risque d'arythmie est augmenté chez les patients recevant des anesthésiques volatils halogénés.
L'administration concomitante d'autres bêta-adrénergiques ou d’anticholinergiques peut potentialiser les effets bronchodilatateurs.
L’existence d’une hypokaliémie augmente le risque d’arythmie chez les patients recevant un traitement par des digitaliques.
Il n’a pas été mis en évidence d’interaction du budésonide ou du formotérol avec les autres médicaments utilisés pour le traitement de l’asthme.
Population pédiatrique
Les études d’interaction n’ont été réalisées que chez l’adulte.
4.6. Fertilité, grossesse et allaitement 
Grossesse
Il n’existe pas de données suffisantes concernant l’utilisation du formotérol chez la femme enceinte. Dans les études animales, le formotérol a montré une toxicité dans les études de reproduction, à des niveaux d’exposition systémique très élevés (voir rubrique 5.3).
Les données recueillies sur environ 2 000 grossesses exposées n’indiquent pas d’augmentation du risque tératogène associé à l’usage de budésonide inhalé. Des études animales ont mis en évidence un effet malformatif des glucocorticoïdes (voir rubrique 5.3). Il est peu probable que ces données soient pertinentes chez l’homme aux doses recommandées.
Des études menées chez l’animal ont montré que l’exposition prénatale à un excès de glucocorticostéroïdes est associée à une augmentation du risque de retard de croissance intra-utérin, de maladies cardiovasculaires chez l’adulte et de modifications permanentes de la densité des récepteurs des glucocorticoïdes, du renouvellement des neurotransmetteurs et du comportement lors d’exposition à des doses inférieures aux doses tératogènes.
Une association fixe de budésonide et de fumarate de formotérol dihydraté ne doit être utilisée au cours de la grossesse que si le bénéfice attendu pour la mère l’emporte sur tout risque éventuel pour le fœtus. Il conviendra toujours de rechercher la dose minimale efficace de BUDESONIDE/FORMOTEROL SANDOZ FORSPIRO susceptible d’assurer un contrôle satisfaisant de l’asthme.
Allaitement
Le budésonide est excrété dans le lait maternel. Toutefois, aux doses thérapeutiques, aucun effet n’est attendu sur le nourrisson allaité. On ne sait pas si le formotérol passe dans le lait maternel.
Chez le rat, on a décelé de faibles quantités de formotérol dans le lait maternel.
L’utilisation d’une association fixe de budésonide et de fumarate de formotérol dihydraté chez la femme qui allaite ne pourrait être envisagée que si le bénéfice attendu pour la mère est plus important que le risque potentiel pour l’enfant.
Fertilité
Aucune donnée n'est disponible concernant l'effet potentiel du budésonide sur la fertilité. Les études sur la reproduction effectuées chez l'animal avec le formotérol ont montré une légère réduction de la fertilité chez les rats mâles avec des niveaux d’exposition systémique élevés (voir rubrique 5.3).
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines 
Les effets indésirables de BUDESONIDE/FORMOTEROL SANDOZ FORSPIRO sont ceux susceptibles de survenir avec chacune des substances actives qu'il contient : budésonide et formotérol. Il n'a pas été observé d'augmentation de l'incidence des effets indésirables après administration concomitante des deux composés. Les effets indésirables les plus fréquents sont les effets indésirables connus des β2-agonistes, tels que tremblements et palpitations. Ces effets indésirables sont en général d'intensité légère et disparaissent le plus souvent rapidement après quelques jours de traitement.
Les effets indésirables associés au budésonide ou au formotérol sont énumérés ci-dessous par classe de systèmes d'organes et par fréquence. La fréquence de survenue est définie comme suit : très fréquent (≥ 1/10), fréquent (≥ 1/100 à < 1/10), peu fréquent (≥ 1/1 000 à < 1/100), rare (≥ 1/10 000 à < 1/1 000) et très rare (< 1/10 000).
Tableau 1
|
Classe de système d’organe |
Fréquence |
Evènement indésirable médicamenteux |
|
Infections et infestations |
Fréquent |
Candidose oropharyngée Pneumonie (chez les patients présentant une BPCO) |
|
Affections du système immunitaire |
Rare |
Réactions d'hypersensibilité immédiate et retardée, tels que exanthème, urticaire, prurit, dermatite, angiœdème et réactions anaphylactiques |
|
Affections endocriniens |
Très rare |
Syndrome de Cushing Freinage surrénalien Retard de croissance Diminution de la densité minérale osseuse |
|
Affections du métabolisme et de la nutrition |
Rare |
Hypokaliémie |
|
Très rare |
Hyperglycémie |
|
|
Affections psychiatriques |
Peu fréquent |
Agressivité Hyperactivité psychomotrice Anxiété Troubles du sommeil |
|
Très rare |
Dépression Trouble du comportement (principalement chez l’enfant) |
|
|
Affections du système nerveux |
Fréquent |
Céphalées Tremblement |
|
Peu fréquent |
Sensations vertigineuses |
|
|
Très rare |
Dysgueusie |
|
|
Affections oculaires |
Peu fréquent |
Vision trouble (voir rubrique 4.4) |
|
Très rare |
Cataracte et glaucome |
|
|
Affections cardiaques |
Fréquent |
Palpitations |
|
Peu fréquent |
Tachycardie |
|
|
Rare |
Troubles du rythme cardiaque, tels que fibrillation auriculaire, tachycardie supraventriculaire, extrasystoles |
|
|
Très rare |
Angine de poitrine Allongement de l'intervalle QTc |
|
|
Affections vasculaires |
Très rare |
Variations de la pression artérielle |
|
Affections respiratoires, thoraciques et médiastinales |
Fréquent |
Légère irritation de la gorge Toux Dysphonie, y compris l’enrouement |
|
Rare |
Bronchospasme |
|
|
Affections gastro-intestinales |
Peu fréquent |
Nausées |
|
Affections de la peau et du tissu conjonctif |
Peu fréquent |
Ecchymoses |
|
Affections musculo-squelettiques et systémiques |
Peu fréquent |
Crampes musculaires |
La survenue de candidoses oropharyngées est liée à un dépôt du médicament sur les muqueuses. Afin de réduire leur risque d’apparition, il est recommandé au patient de se rincer la bouche à l’eau après chaque dose du traitement de fond. En général, la candidose oropharyngée peut être traitée par un antifongique local sans qu’il soit nécessaire d’arrêter le traitement par corticoïde inhalé. Si une candidose oropharyngéee survient, les patients devront également se rincer la bouche à l’eau après les inhalations prises.
Comme avec les autres produits inhalés, un bronchospasme paradoxal peut survenir dans de très rares cas (chez moins de 1 personne sur 10 000) se manifestant par une augmentation du sifflement bronchique et de la dyspnée à la suite de l’inhalation de la poudre. Le bronchospasme paradoxal cède avec la prise d’un bronchodilatateur inhalé d’action rapide, administré immédiatement. Le traitement par budésonide/formotérol doit être arrêté immédiatement et après examen clinique du patient, il conviendra d’envisager les alternatives thérapeutiques si nécessaire (voir rubrique 4.4).
La corticothérapie inhalée peut entraîner des effets systémiques, en particulier lors de traitements prolongés à fortes doses. La survenue de ces effets est néanmoins beaucoup moins probable qu’au cours d’une corticothérapie orale. Les effets systémiques possibles incluent : syndrome de Cushing, tableau cushingoïde, freination de la fonction surrénalienne, retard de croissance chez l’enfant et l’adolescent, diminution de la densité minérale osseuse, cataracte et glaucome.
Une susceptibilité accrue aux infections et une diminution de la capacité à s’adapter aux situations de stress peuvent également être observées. Ces effets sont probablement dépendants de la dose, de la durée d’exposition, d’un traitement concomitant ou antérieur par corticostéroïdes et varient en fonction de la sensibilité individuelle.
Le traitement par les agoniste des récepteurs β2-adrénergiques peut entraîner une augmentation des taux sanguins d’insuline, d’acides gras libres, glycérol et corps cétoniques.
Population pédiatrique
Il est recommandé de surveiller régulièrement la croissance des enfants recevant des corticoïdes inhalés à long terme (voir rubrique 4.4).
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : www.signalement-sante.gouv.fr.
Les effets attendus lors d'un surdosage en formotérol correspondent à une exacerbation de l'activité agoniste des récepteurs β2-adrénergiques, tels que tremblement, céphalées, palpitations. Les symptômes rapportés dans le cadre de cas isolés sont : tachycardie, hyperglycémie, hypokaliémie, allongement de l'intervalle QTc, arythmies, nausées et vomissements. Un traitement de soutien et symptomatique peut être indiqué. L'administration de 90 microgrammes de formotérol sur une période de 3 heures à des patients présentant une obstruction bronchique aiguë n'a pas entraîné d'effet délétère cliniquement significatif.
Il n'est pas attendu d'effets délétères cliniquement significatifs en cas de surdosage aigu de budésonide, même à des doses excessives. En cas d'utilisation chronique à des doses excessives, les effets systémiques des glucocorticoïdes peuvent apparaître, tels que hypercorticisme et inhibition de la fonction surrénalienne.
Si le traitement par budésonide/formotérol doit être arrêté en raison d'une dose trop importante de formotérol, il convient d'envisager un traitement adapté par corticostéroïde inhalé.
5. PROPRIETES PHARMACOLOGIQUES 
5.1. Propriétés pharmacodynamiques 
Mécanisme d’action et effets pharmacodynamiques
Les substances actives de ce médicament sont le formotérol et le budésonide, dont les mécanismes d’action sont différents et il résulte de leur association un effet additif en termes de réduction des exacerbations de l'asthme.
Budésonide
Le budésonide est un glucocorticoïde qui, administré par voie inhalée, exerce un effet anti-inflammatoire local dose-dépendant, entraînant une réduction des symptômes et du nombre d'exacerbations d'asthme. Le budésonide administré par voie inhalée induit des effets indésirables moins sévères que les corticoïdes administrés par voie systémique. Le mécanisme d'action exact à l'origine de l'activité anti-inflammatoire exercée par les glucocorticoïdes n'est pas connu.
Formotérol
Le formotérol est un agoniste sélectif des récepteurs β2-adrénergiques qui, administré par voie inhalée, entraîne une relaxation rapide et durable du muscle lisse bronchique chez les patients présentant une bronchoconstriction réversible. L'effet bronchodilatateur est dose-dépendant et débute 1 à 3 minutes après l'administration. La durée de l'effet est d'au moins 12 heures après une seule dose.
Efficacité et sécurité clinique
ASTHME
Au cours des essais cliniques réalisés chez l'adulte, il a été mis en évidence une amélioration du contrôle de l'asthme et de la fonction respiratoire ainsi qu'une réduction des exacerbations lorsque le formotérol était ajouté au traitement par budésonide.
Dans deux études de 12 semaines, l'effet de l'association budésonide/formotérol sur la fonction respiratoire était identique à celui d'un traitement associant budésonide et formotérol administrés séparément, et supérieur à celui d'un traitement par budésonide seul. Dans tous les groupes de patients comparés, un β2- mimétique à courte durée d'action était utilisé à la demande. Il n'a pas été observé d'épuisement de l'effet thérapeutique du traitement au cours du temps.
Deux études pédiatriques de 12 semaines ont été réalisées, au cours desquelles un total de 265 enfants de 6 à 11 ans ont reçu un traitement d'entretien avec l'association budésonide/formotérol (2 inhalations de 80 microgrammes/4,5 microgrammes/dose 2 fois par jour) et ont utilisé un agoniste des récepteurs bêta-2 adrénergiques " à la demande ". Dans les deux études, la fonction respiratoire a été améliorée et le traitement a été bien toléré, comparativement aux groupes traités par budésonide seul à la dose correspondante.
BPCO
Deux études cliniques de 12 mois ont évalué l’effet sur la fonction pulmonaire et la fréquence des exacerbations (définies par la prise de corticoïdes oraux et/ou la prise d’antibiotiques et/ou des hospitalisations) chez des patients souffrant de BPCO modérée à sévère. Le critère d’inclusion pour les 2 études était un VEMS pré-bronchodilatateur < 50 % de la valeur théorique. La valeur médiane du VEMS pré-bronchodilatateur à l’inclusion était de 42 % de la valeur théorique.
Le taux d’exacerbations (telles que définies précédemment) pendant l’année était significativement réduit dans le groupe traité par budésonide/formotérol par rapport aux groupes recevant formotérol seul ou placebo (taux moyen pendant l’année 1,4 par rapport à 1,8-1,9 dans les groupes placebo et formotérol seul respectivement).
Le nombre moyen de jours sous corticoïdes oraux par patient au cours des 12 mois était légèrement réduit dans le groupe budésonide/formotérol (7-8 jours/patients/an par rapport à, respectivement 11-12 et 9-12 jours dans les groupes placebo et formotérol).
En ce qui concerne les paramètres de la fonction ventilatoire tels que le VEMS, il n’a pas été mis en évidence d’effet supérieur dans le groupe budésonide/formotérol par rapport au groupe recevant le formotérol seul.
5.2. Propriétés pharmacocinétiques 
La bioéquivalence entre l’association fixe de budésonide et formotérol et les principes actifs administrés isolément par le même dispositif, a été établie en termes d’exposition systémique. Néanmoins, la diminution du cortisol plasmatique a été légèrement plus importante avec l’association fixe qu’avec chacun des produits isolément. Cette observation n’est pas considérée comme prédictive d’une différence en termes de tolérance clinique.
Il n’a pas été mis en évidence d’interaction pharmacocinétique entre le budésonide et le formotérol.
Au cours des essais, les paramètres pharmacocinétiques mesurés après l'administration séparée de budésonide et de formotérol ou des deux principes actifs associés dans l’association fixe, étaient comparables. Pour le budésonide, l’aire sous la courbe est légèrement supérieure, l'absorption plus rapide et la concentration plasmatique maximale plus élevée après l'administration de l'association fixe. Pour le formotérol, la concentration plasmatique maximale était similaire après l'administration de l'association fixe.
Le budésonide inhalé est rapidement absorbé et la concentration plasmatique maximale est atteinte dans les 30 minutes après inhalation. Dans les études, le dépôt pulmonaire moyen de budésonide après inhalation avec l'inhalateur de poudre a été de 32 % à 44 % de la dose délivrée. La biodisponibilité systémique est d'environ 49 % de la dose délivrée.
Le dépôt pulmonaire mesuré chez des enfants de 6 à 16 ans est superposable à celui observé chez les adultes pour des doses administrées du même ordre, le passage systémique qui en résulte n’a pas été déterminé.
Le formotérol inhalé est rapidement absorbé et la concentration plasmatique maximale est atteinte 10 minutes après l'inhalation. Le dépôt pulmonaire du formotérol après inhalation avec le dispositif inhalateur se situe en moyenne entre 28 % et 49 % de la dose délivrée. La biodisponibilité systémique est d'environ 61 % de la dose délivrée.
Distribution et biotransformation
La liaison aux protéines plasmatiques est d'environ 50 % pour le formotérol et 90 % pour le budésonide. Le volume de distribution est d'environ 4 L/kg pour le formotérol et 3 L/kg pour le budésonide. Le formotérol est métabolisé par conjugaison (formation de métabolites actifs O-déméthylés et de métabolites déformylés, qui sont essentiellement retrouvés sous forme de conjugués inactifs). Le budésonide subit une métabolisation importante (environ 90 %) en composé d’action glucocorticoïde réduite par effet de premier passage hépatique. L'activité glucocorticoïde des métabolites les plus importants, 6 bêta-hydroxy-budésonide et 16 alpha-hydroxy-prednisolone, est de moins de 1 % de celle du budésonide. Il n’y a pas d’éléments en faveur d’interactions métaboliques ou de déplacement des liaisons aux protéines plasmatiques entre le formotérol et le budésonide.
Élimination
Le formotérol est essentiellement métabolisé par voie hépatique avant élimination urinaire. Après inhalation, 8 à 13 % de la dose délivrée de formotérol est excrétée dans les urines sous forme inchangée. La clairance plasmatique du formotérol est élevée (environ 1,4 L/min), et sa demi-vie d'élimination tardive est en moyenne de 17 heures.
Le budésonide est métabolisé principalement par l’isoenzyme CYP3A4. Les métabolites du budésonide sont éliminés dans les urines en partie sous forme conjuguée. Le budésonide est retrouvé en quantité négligeable sous forme inchangée. La clairance plasmatique du budésonide est élevée (environ 1,2 L/min) et la demi-vie d'élimination après administration IV est en moyenne de 4 heures.
Les paramètres pharmacocinétiques du formotérol ou du budésonide ne sont pas établis chez les patients insuffisants rénaux. Les expositions systémiques au budésonide et au formotérol peuvent être augmentées en cas d’insuffisance hépatique.
Linéarité/non-linéarité
L’exposition systémique au budésonide et au formotérol est corrélée de façon linéaire à la dose administrée.
5.3. Données de sécurité préclinique 
Des malformations ont été observées au cours des études de reproduction menées chez l’animal, avec les glucocorticoïdes tels que le budésonide (fente palatine, malformations squelettiques). Toutefois, ces résultats expérimentaux observés chez l’animal ne sont pas extrapolables à l’homme aux doses recommandées.
Les études de reproduction menées avec le formotérol chez l’animal, ont mis en évidence une tendance à la réduction de la fertilité du rat mâle lorsque l’exposition systémique était élevée. Des défauts d’implantation, une diminution du taux de survie post-natale précoce ainsi qu’une diminution du poids de naissance ont également été observés lorsque les expositions systémiques étaient très supérieures à celles observées en clinique humaine. Ces résultats expérimentaux observés chez l’animal ne sont pas extrapolables à l’homme.
Lactose monohydraté (contenant des protéines de lait).
2 ans
6.4. Précautions particulières de conservation 
A conserver à une température ne dépassant pas 30°C.
6.5. Nature et contenu de l'emballage extérieur 
BUDESONIDE/FORMOTEROL SANDOZ FORSPIRO se présente sous la forme d’un inhalateur en plastique de couleur rouge/blanc. L’inhalateur contient une plaquette (OPA/Aluminium/PVC-Aluminium) de 60 doses de poudre à inhaler.
Boîte de 1, 2, 3 ou 6 inhalateurs, contenant chacun 60 doses.
Toutes les présentations peuvent ne pas être commercialisées.
6.6. Précautions particulières d’élimination et de manipulation 
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE 
49, AVENUE GEORGES POMPIDOU
92300 LEVALLOIS-PERRET
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE 
· 34009 302 230 2 4 : 60 doses de poudre sous plaquette (OPA/Aluminium/PVC-Aluminium) avec inhalateur. Boîte de 1.
· 34009 302 230 4 8 : 60 doses de poudre sous plaquette (OPA/Aluminium/PVC-Aluminium) avec inhalateur. Boîte de 2.
· 34009 302 230 5 5 : 60 doses de poudre sous plaquette (OPA/Aluminium/PVC-Aluminium) avec inhalateur. Boîte de 3.
· 34009 550 799 5 8 : 60 doses de poudre sous plaquette (OPA/Aluminium/PVC-Aluminium) avec inhalateur. Boîte de 6.
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION 
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE 
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES 
Liste I
|
| Plan du site | Accessibilité | Contact | Téléchargement | Declaration de confidentialité | Service-Public.fr | Legifrance | Gouvernement.fr |