Dernière mise à jour le 08/01/2026
FIBROVEIN 3 %, solution injectable
Indications thérapeutiques
Classe pharmacothérapeutique : vasoprotecteurs, médicaments sclérosants pour injection locale - code ATC : C05BB04.
Le nom de votre médicament est FIBROVEIN. Il contient du tétradécyl sulfate de sodium comme principe actif.
Différentes concentrations de FIBROVEIN sont utilisées pour le traitement des varices, des veinules de grande, moyenne ou petite dimension et des varicosités.
Ce produit injectable fait partie d’une classe de médicaments appelés sclérosants. Les sclérosants sont des agents chimiques, qui lorsqu’ils sont injectés dans la veine atteinte font gonfler les parois veineuses pour qu’elles adhèrent entre elles. Cela empêche la circulation du sang en transformant la veine en tissu cicatriciel. Au bout de quelques semaines, la veine disparaît.
FIBROVEIN ne peut être utilisé que chez les adultes.
Présentations
> 5 ampoule(s) en verre de 2 ml
Code CIP : 268 836-0 ou 34009 268 836 0 7
Déclaration de commercialisation : 04/12/2014
Cette présentation n'est pas agréée aux collectivités
Service médical rendu (SMR)
Pas de SMR disponible pour ce médicament ( plus d'informations dans l'aide )
Amélioration du service médical rendu (ASMR)
Pas d'ASMR disponible pour ce médicament (plus d'informations dans l'aide )
ANSM - Mis à jour le : 20/06/2024
FIBROVEIN 3 %, solution injectable
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Tétradécyl sulfate de sodium................................................................................................. 30 mg
Pour 1 mL de solution injectable.
Chaque mL de solution injectable contient 30 mg de tétradécyl sulfate de sodium.
Chaque ampoule de 2 mL contient 60 mg de tétradécyl sulfate de sodium.
Chaque flacon de 5 mL contient 150 mg de tétradécyl sulfate de sodium.
Excipient(s) à effet notoire :
Ce médicament contient 20 mg d’alcool benzylique par mL de solution injectable.
Ce médicament contient approximativement jusqu’à 3,1 mg de sodium par mL de solution injectable, c’est-à-dire qu’il est essentiellement « sans sodium ».
Ce médicament contient 0,3 mg de potassium par mL de solution injectable, c’est-à-dire qu’il est essentiellement « sans potassium ».
Pour la liste complète des excipients, voir rubrique 6.1.
Solution limpide, incolore et stérile, sans particules visibles.
pH : 7,5 - 7,9
Osmolarité : 247 – 273 mOsmol/kg.
4.1. Indications thérapeutiques
FIBROVEIN est réservé à l’adulte.
Traitement des varices primaires non compliquées, des varices récidivantes ou résiduelles suite à une intervention chirurgicale, des veines réticulaires, des veinules et des varicosités des membres inférieurs caractérisées par une dilatation simple.
4.2. Posologie et mode d'administration
Voie intraveineuse stricte. Le choix de la concentration se fera en fonction du type et du diamètre des varices à scléroser.
Les varicosités ne doivent être traitées qu’avec une solution à 0,2 %, et les veines réticulaires avec une solution à 0,5 %, la solution de 1 % est plus utile pour les varices de petit à moyen calibre et la solution à 3 % est réservée aux varices de gros calibre. Pour les varices non visibles, le diamètre doit être mesuré par échographie.
Le sclérosant est administré par voie intraveineuse en petites quantités sur plusieurs sites d’injection le long de la veine à traiter. FIBROVEIN 0,2 % et 0,5 % doivent être administrés sous forme liquide. Les solutions de FIBROVEIN 1 % et 3 % peuvent être administrée sous forme liquide ou mousse. La forme mousse (mélange sclérosant/air) est obtenue à partir des solutions à 1 % et à 3 % et doit être utilisée exclusivement pour les veines de gros calibre.
L'objectif est de parvenir à la destruction optimale de la paroi du vaisseau avec la concentration minimale de produit sclérosant nécessaire pour un résultat clinique, une concentration trop élevée risquant d’entraîner une nécrose ou d'autres séquelles indésirables.
Adultes
|
Concentration |
Volume usuel injecté par voie intraveineuse en plusieurs sites par séance |
Volume total maximum à injecter par séance |
||
|
Liquide |
Mousse * |
Liquide |
Mousse * |
|
|
FIBROVEIN 3 % |
0,5 à 2,0 mL |
0,5 à 2,0 mL |
4 mL |
16 mL |
*Le volume est la somme des composants liquide + air.
Dans les cas qui nécessitent une prudence particulière, il est recommandé de commencer une séance par l’administration d’une dose d'essai comprise entre 0,25 et 0,5 mL de FIBROVEIN et de garder le patient en observation pendant plusieurs heures avant d’administrer une deuxième dose identique ou plus élevée.
Etant donné que le volume à injecter par séance est limité, plusieurs séances sont généralement nécessaires (2 à 4 en moyenne). Il est souhaitable de commencer chaque séance d’injection par l’administration d’une faible dose test de FIBROVEIN, afin de s’assurer de l’absence d’allergie.
Administration du sclérosant sous forme de mousse
Les spécialités FIBROVEIN 1 % et 3 % peuvent être converties en une forme mousse destinée au traitement des veines de gros calibre. La mousse doit être préparée de manière extemporanée par un praticien préalablement formé à cette technique particulière de préparation et d’administration. L’administration doit être réalisée de manière idéale sous contrôle échographique.
La solution injectable ne doit être administrée que par un médecin expérimenté en anatomie veineuse et ayant les qualifications et l’expérience appropriées pour le traitement des pathologies du système veineux ; lorsque la réglementation nationale l’autorise, FIBROVEIN peut être administré par un professionnel de santé qualifié sous la surveillance d’un médecin.
Population âgée
Il n’y a aucune recommandation spécifique concernant la dose.
Population pédiatrique
La sûreté et l’efficacité de FIBROVEIN chez les enfants et les adolescents n’ont pas été établies. Aucune donnée n’est disponible.
Mode d’administration
La méthode Tessari pour préparation de la mousse est décrite à la rubrique 6.6. D’autres techniques peuvent être utilisées telles que DSS, Easyfoam et Sterivein. La plupart de ces techniques consistent à mélanger la solution sclérosante avec de l’air stérile, en effectuant des passages répétés à travers 2 seringues reliées.
Les précautions particulières de manipulation, ainsi que les critères d’une mousse propre à l’injection pour sclérothérapie sont également détaillés au paragraphe 6.6.
Des conditions d’asepsie strictes s’imposent lors de la manipulation de FIBROVEIN.
FIBROVEIN est un produit à usage unique par voie parentérale. Une fois que l’ampoule est ouverte, utiliser immédiatement et jeter toute quantité résiduelle inutilisée.
Inspecter visuellement la solution avant utilisation. Les solutions qui contiennent des particules ne doivent pas être utilisées.
· Hypersensibilité à la substance active ou à l’un des excipients mentionnés à la rubrique 6.1, et états allergiques.
· Patients immobilisés, quelle que soit la cause, ou alités.
· Patients présentant un risque élevé de thrombose : thrombophilie familiale, facteurs de risque multiples (contraception hormonale, traitement hormonal substitutif, obésité importante, tabac, immobilité prolongée, etc ).
· Episode thrombo-embolique récent (thrombose superficielle aiguë, thrombose veineuse profonde, embolie pulmonaire).
· Chirurgie récente.
· Varices induites par une tumeur pelvienne ou abdominale (sauf si la tumeur a été retirée).
· Affection systémique non contrôlée (diabète de type I, thyréotoxicose, tuberculose, asthme, tumeur, infection systémique, troubles de dyscrasie sanguine, affection respiratoire aiguë, affection cutanée).
· Cancer évolutif.
· Incompétence valvulaire significative au niveau du réseau veineux profond.
· Artériopathie oblitérante.
· Veines superficielles de très gros calibre présentant des communications importantes avec le réseau veineux profond.
· Phlébite migrante.
· Erysipèles et lymphangite aiguë au niveau de la zone à traiter.
· Infection aiguë.
· Foramen ovale perméable (FOP) symptomatique connu (si FIBROVEIN est administré sous forme de mousse).
4.4. Mises en garde spéciales et précautions d'emploi
Précautions générales
L’utilisation de FIBROVEIN doit être réservée aux médecins ; lorsque la réglementation nationale l’autorise, FIBROVEIN peut être administré sous la surveillance d’un médecin par un professionnel de santé ayant les qualifications appropriées, expérimenté en anatomie veineuse, diagnostic et traitement des pathologies affectant le système veineux et préalablement formé à la technique d’injection.
Des réactions allergiques (notamment des réactions anaphylactiques) ayant été observées, le médecin doit être préparé à la survenue possible d’une réaction anaphylactique et doit être prêt à la traiter convenablement. Le matériel de réanimation d’urgence doit être immédiatement disponible.
Avant le traitement, le médecin ou le professionnel de santé ayant les qualifications appropriées qui administre FIBROVEIN sous la surveillance d’un médecin doit rechercher les facteurs de risque et informer le patient des risques que présente la technique envisagée.
La sclérothérapie est contre-indiquée chez les patients présentant un risque élevé d’événements thromboemboliques, mais doit être évitée dans la plupart des situations à moindre risque. Elle n’est notamment pas recommandée chez les patients ayant des antécédents d’événements thromboemboliques. Néanmoins, si la sclérothérapie est jugée nécessaire, une thérapie d’anticoagulation préventive peut être initiée.
Foramen ovale perméable (FOP)
En raison de la circulation possible de produit, de bulles ou de particules dans la partie droite de cœur, la présence d’un FOP peut favoriser la survenue de graves effets artériels indésirables. Il est recommandé d’effectuer la recherche d’un FOP avant de débuter la sclérothérapie chez les patients ayant des antécédents de migraine avec aura, d’accidents cérébro-vasculaires graves, ou d’HTAP.
Chez les patients atteints de FOP connu, mais asymptomatique, il est recommandé d’utiliser des volumes plus faibles et d’éviter tout effort à glotte fermée (manœuvre de Valsalva) pendant les minutes qui suivent l’injection.
Les patients atteints d’un FOP se sont avérés être plus susceptibles de souffrir d’effets indésirables tels que des incidents neurologiques temporaires, des affections oculaires et des migraines. Un FOP symptomatique est une contre-indication pour l’usage de FIBROVEIN en mousse (voir rubrique 4.3).
Migraine
Les patients ayant des antécédents de migraine doivent être traités avec précaution. Les patients migraineux se sont avérés être plus susceptibles de souffrir d’affections oculaires et de migraine, en particulier après les injections de mousse sclérosante.
Utiliser des volumes plus faibles chez les patients ayant des antécédents de migraine.
Accident ischémique transitoire (AIT)
Les patients ayant des antécédents d’AIT doivent être traités avec précaution.
Ces patients se sont avérés plus susceptibles de souffrir de troubles visuels et de migraine, en particulier après les injections de mousse sclérosante.
Varices tronculaires
Lors du traitement de varices tronculaires, l’injection de mousse doit être effectuée à une distance minimale de 8 à 10 cm par rapport à la jonction saphéno-fémorale.
Lymphœdème
Si l’insuffisance veineuse est associée à un lymphœdème, l’injection sclérosante peut aggraver la douleur et l’inflammation locales pendant plusieurs jours ou plusieurs semaines. Les patients doivent être informés de l’éventualité de cette phase, ce qui ne compromet en aucun cas l’efficacité.
Extravasation
De graves effets indésirables au niveau local, incluant la nécrose tissulaire, peuvent se produire suite à une extravasation. Par conséquent, faire preuve d’une grande prudence lors du positionnement de l’aiguille par voie intraveineuse et utiliser le volume minimal efficace à chaque site d’injection. Une pigmentation peut être favorisée en cas d’épanchement sanguin au niveau du site d’injection (en particulier lors du traitement des veines superficielles de petit calibre) et quand la compression n’est pas utilisée.
Injection intra-artérielle
Ne jamais injecter les sclérosants dans une artère, car cela pourrait provoquer une nécrose tissulaire et conduire à l’amputation. Pour éviter des extravasations et une injection artérielle, il est recommandé d’effectuer l’injection sous échographie duplex.
Le patient doit être surveillé pendant et après l’administration de FIBROVEIN. Des manifestations d’hypersensibilité (rougeur, prurit, toux) ou des manifestations neurologiques (scotomes, amaurose, migraine avec aura, paresthésie, déficit focalisé) peuvent se produire.
Affections respiratoires
Une attention particulière doit être portée aux patients présentant une respiration difficile (asthme bronchique) ou une forte prédisposition aux allergies (voir rubrique 4.2).
Évaluation pré-injection
En raison du risque d’extension de thrombose dans le système veineux profond, il est indispensable d’évaluer soigneusement la continence valvulaire avant toute injection et d’injecter lentement de faibles quantités de produit dans la varice (pas plus de 2 mL). La perméabilité des veines profondes doit être évaluée par une méthode non invasive telle que l’échographie duplex. La sclérothérapie veineuse ne doit pas être réalisée si une incontinence valvulaire significative ou une insuffisance veineuse profonde est détectée, lors des épreuves de Trendelenburg ou de Perthes, ou lors d’une phlébographie par exemple.
Surveillance post-injection
Il est recommandé de réaliser un examen de suivi clinique et échographique à environ 1 mois, afin de contrôler l’efficacité du traitement et la survenue d’éventuels effets indésirables. En effet, des cas de thrombose veineuse profonde et d’embolie pulmonaire ont été rapportés après sclérothérapie de varices superficielles, jusqu’à 4 semaines après l’injection de tétradécyl sodium sulfate. La mise en place d’une compression adaptée après le traitement peut également être envisagée pour réduire le risque de thrombose veineuse profonde.
Affections artérielles sous-jacentes
Une extrême prudence est recommandée en cas d’utilisation chez les patients atteints d’affections artérielles sous-jacentes, notamment en cas d’athérosclérose périphérique sévère ou de thromboangéite oblitérante (maladie de Buerger).
Pied et zone malléolaire
Une extrême prudence est recommandée en cas d’injection au niveau du pied et de la zone malléolaire du fait du risque accru d’injection accidentelle intra-artérielle.
Excipients
Ce médicament contient moins de 1 mmol de sodium (23 mg) par flacon/ampoule, c’est-à-dire qu’il est essentiellement « sans sodium ».
Ce médicament contient moins de 1 mmol de potassium (39 mg) par flacon/ampoule, c’est-à-dire qu’il est essentiellement « sans potassium ».
Ce médicament contient 40 mg d’alcool benzylique par ampoule de 2 mL ou 100 mg d’alcool benzylique par flacon de 5 mL, équivalent à 20 mg/mL. L’alcool benzylique peut provoquer des réactions allergiques. Demandez à votre médecin ou à votre pharmacien si vous êtes enceinte ou si vous allaitez, ou si vous souffrez d’une maladie du foie ou du rein. De grandes quantités d’alcool benzylique peuvent s’accumuler dans votre corps et entraîner des effets secondaires (appelés « acidose métabolique »).
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Aucune étude d’interaction n’a été réalisée.
4.6. Fertilité, grossesse et allaitement
Grossesse
La sécurité d’emploi au cours de la grossesse n'est pas établie. A ce jour, il n’existe pas ou peu de données sur l'administration du tétradécyl sulfate de sodium chez la femme enceinte. Les études animales de reprotoxicité sont insuffisantes. Le traitement ne peut être initié qu’après la grossesse.
FIBROVEIN ne doit être utilisé qu'en cas de nécessité, pour le soulagement symptomatique, si les bénéfices potentiels l'emportent sur les risques potentiels pour le fœtus.
On ne sait pas si le tétradécyl sulfate de sodium est excrété dans le lait maternel. La prudence est recommandée lorsqu’il est administré chez les femmes qui allaitent.
Fertilité
On ne sait pas si le tétradécyl sulfate de sodium affecte la fertilité.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Les effets indésirables les plus fréquemment rapportés sont : douleur au point d’injection, urticaire, thrombophlébite superficielle et pigmentation cutanée temporaire après traitement. Très rarement, une décoloration permanente peut persister le long du segment de veine sclérosée. L’ulcération peut se produire suite à l’extravasation du médicament. Il est important d'utiliser la plus faible quantité et/ou concentration possible pour scléroser la veine car la plupart des effets secondaires les plus fréquents sont dus à une concentration trop élevée.
Très rarement, l’injection intra-artérielle est à l'origine d'une nécrose tissulaire importante, pouvant aller jusqu’à l’amputation.
Les effets indésirables les plus graves sont le choc anaphylactique et l'embolie pulmonaire. Des décès ont pu être rapportés chez des patients recevant du tétradécyl sulfate de sodium.
Les événements indésirables sont indiqués ci-dessous par classe organe, et fréquence estimée d’après les données cliniques publiées. Les fréquences sont définies selon la convention suivante :
· Très fréquent : ≥ 1/10.
· Fréquent : ≥ 1/100 à < 1/10.
· Peu fréquent : ≥ 1/1 000 à < 1/100.
· Rare : ≥ 1/10 000 à < 1/1 000.
· Très rare : (y compris les cas isolés) ≤ 1/10 000.
|
Affections du système immunitaire |
Utilisation forme liquide |
Utilisation forme mousse |
|
Réactions allergiques systémiques telles que choc anaphylactique, asthme, urticaire généralisée |
Très rare |
Très rare |
|
Affections du système nerveux |
Utilisation forme liquide |
Utilisation forme mousse |
|
Migraine |
Très rare |
Peu fréquent |
|
Maux de tête, trouble de la sensibilité locale (paresthésie). Réactions vaso-vagales, telles qu’évanouissement, confusion, étourdissement, perte de conscience. |
Très rare |
Rare |
|
Lésions nerveuses après l’extravasation du médicament |
Très rare |
Très rare |
|
Faiblesse (hémiparésie, hémiplégie), accident ischémique transitoire (AIT), palpitations. |
Très rare |
Très rare |
|
AVC |
Très rare |
Très rare |
|
Affections oculaires |
Utilisation forme liquide |
Utilisation forme mousse |
|
Scotome, phosphène. |
Très rare |
Peu fréquent |
|
Affections vasculaires |
Utilisation forme liquide |
Utilisation forme mousse |
|
Thrombophlébite superficielle, phlébite. |
Fréquent |
Très fréquent |
|
Matting (développement de varicosités très fines dans la zone traitée). |
Peu fréquent |
Fréquent |
|
Thrombose veineuse profonde (principalement musculaire et distale). |
Très rare |
Peu fréquent |
|
Embolie pulmonaire, vascularité, collapsus circulatoire. |
Très rare |
Très rare |
|
Nécrose tissulaire distale suite à l’injection intra-artérielle, peut conduire à la gangrène. La plupart des cas ont impliqué l'artère tibiale postérieure au-dessus de la malléole interne. Spasme artériel pouvant survenir malgré l'injection intraveineuse. |
Très rare |
Très rare |
|
Affections respiratoires, thoraciques et médiastinales |
Utilisation forme liquide |
Utilisation forme mousse |
|
Toux, essoufflement, sensation de pression/oppression dans la poitrine. |
Très rare |
Rare |
|
Affections gastro-intestinales |
Utilisation forme liquide |
Utilisation forme mousse |
|
Nausées, vomissements, diarrhée, sensation de gonflement / langue épaisse, bouche sèche. |
Très rare |
Très rare |
|
Affections de la peau et du tissu sous-cutané |
Utilisation forme liquide |
Utilisation forme mousse |
|
Décoloration de la peau (hyperpigmentation, plus rarement hématome et ecchymose). |
Peu fréquent |
Fréquent |
|
Réactions cutanées locales allergiques et non allergiques, telles qu’érythème, urticaire, eczéma, gonflement/induration. |
Peu fréquent |
Peu fréquent |
|
Desquamation locale et nécrose de la peau et les tissus. |
Rare |
Rare |
|
Troubles généraux et anomalies au site d’administration |
Utilisation forme liquide |
Utilisation forme mousse |
|
Douleur ou sensation de brûlure (à court terme au niveau du site d’injection). |
Fréquent |
Peu fréquent |
|
Fièvre, bouffées de chaleur. |
Très rare |
Très rare |
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/.
Aucun cas de surdosage systémique n'a été rapporté. L’utilisation d’une concentration plus élevée que celle recommandée dans les petites veines peut conduire à une pigmentation et/ou une nécrose tissulaire locale.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Le tétradécyl sulfate de sodium est un agent sclérosant. L'injection intraveineuse induit une inflammation de l’endothelium et la formation d’un thrombus. Cela entraîne généralement l’occlusion de la veine au niveau du site d’injection. La formation de tissu fibreux qui en résulte est à l'origine de l'oblitération veineuse partielle ou totale qui peut ou non être permanente.
Des séries de cas cliniques publiées ont démontré que FIBROVEIN converti en mousse est très efficace pour traiter les varices plus importantes, par exemple la veine grande saphène et branches collatérales. La mousse peut déplacer le sang et le sclérosant a plus de temps pour agir sur l’endothélium par rapport à la forme liquide. Certains effets indésirables surviennent plus fréquemment avec une sclérothérapie sous forme de mousse qu’avec une sclérothérapie sous forme liquide, tels que maux de tête, migraine, et troubles visuels. Des effets neurologiques indésirables peuvent également survenir, mais ils sont rares.
5.2. Propriétés pharmacocinétiques
Le tétradécyl sulfate de sodium contenu dans FIBROVEIN est administré directement dans la lumière du segment de veine/veinule isolé
Distribution
Chez l’homme, l’injection d’une dose de tétradécyl sulfate de sodium radiomarqué à 3 % dans une veine varicosée vide conduit au passage rapide d’une grande quantité de produit (75 %) dans les vaisseaux sanguins communiquants et dans les veines profondes du mollet. Chez le rat, 72 heures après l'administration intraveineuse de tétradécyl sulfate de sodium radiomarqué, les taux tissulaires de radiomarqueur trouvés dans les tissus prélevés (foie, rein, lipides et muscle squelettique) étaient extrêmement faibles.
Biotransformation
Le métabolisme du tétradécyl sulfate de sodium n'a pas été confirmé.
Élimination
Chez le rat, dans les 24 premières heures suivant l’administration intraveineuse d’une dose radiomarquée, 70 % du produit a été récupérée dans les urines. Après 72 heures, 73,5 % de la radioactivité a été récupérée dans les urines et 18,2% dans les fèces.
Insuffisance hépatique/rénale
Aucune étude pharmacocinétique n'a été réalisée chez des patients présentant une insuffisance hépatique ou rénale.
5.3. Données de sécurité préclinique
Ce médicament n’est pas compatible avec l’héparine.
En l’absence d’études de comptabilité, ce médicament ne doit pas être mélangé avec d’autres médicaments.
3 ans.
Après première ouverture, le médicament doit être utilisé immédiatement.
6.4. Précautions particulières de conservation
Ne pas congeler.
Conserver le flacon/l’ampoule dans l’emballage extérieur, à l’abri de la lumière.
6.5. Nature et contenu de l'emballage extérieur
Ampoule de 2 mL (verre de type I).
Flacon de 5 mL (verre de type I) avec bouchon (chlorobutyle) et bague en aluminium équipée d’un opercule d’étanchéité amovible (polypropylène).
Boîtes de 5 ampoules de 2 mL ou boîtes de 2, 5 ou 10 flacons de 5 mL.
Toutes les présentations peuvent ne pas être commercialisées.
6.6. Précautions particulières d’élimination et de manipulation
La mousse doit être préparée de manière extemporanée par un praticien préalablement formé à cette technique particulière de préparation et d’administration.
La préparation de la mousse doit se faire dans des conditions d’asepsie strictes.
|
|
Recommandations générales
La qualité de la mousse dépend de critères spécifiques :
1. La concentration du produit. La mousse ne peut être préparée qu’avec des concentrations de tétradécyl sulfate de sodium de 1 à 3 %.
2. La proportion liquide/air : Habituellement, cette proportion est de 1 volume de liquide pour 3 volumes d'air.
3. Le nombre de va et vient. Le médecin doit respecter avec précision le nombre de mouvements définis pour chaque technique.
4. La consistance macroscopique de la mousse. La qualité de la mousse doit être vérifiée à l'extérieur de la seringue avant son administration. La mousse doit être homogène, souple et cohésive, sans grosses bulles visibles. Si de grosses bulles sont visibles, la mousse doit être jetée avant d’en préparer une nouvelle.
5. Temps total de préparation de la mousse : La préparation dure environ 10 secondes, entre le premier et le dernier mouvement de va et vient.
6. Le temps maximum entre la préparation et l'injection. La mousse sclérosante doit être utilisée dans les soixante secondes qui suivent la production. Après soixante secondes, toute la mousse non-utilisée doit être jetée. Il faut repréparer de la mousse si nécessaire.
Préparation de la mousse (technique Tessari) :
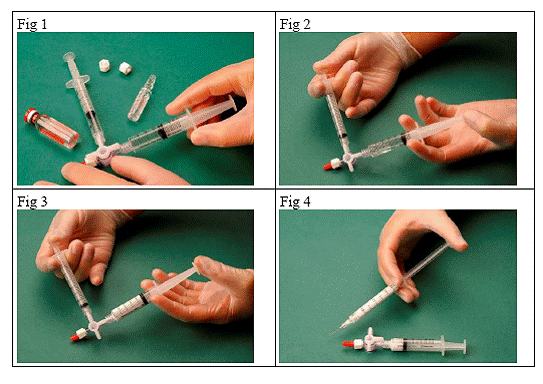
Pour préparer une mousse sclérosante, aspirer 1 mL de liquide sclérosant dans une seringue stérile et 3 mL ou 4 mL d'air stérile dans une autre seringue stérile. L'air est aspiré à travers un filtre de 0,2 µm afin d'assurer sa stérilité. Les seringues sont ensuite reliées en utilisant un système stérile de connexion à trois voies (Fig. 1). Il est conseillé d’utiliser des seringues Luer Lock et de porter des lunettes de protection lors de la préparation de la mousse. La pression peut provoquer la défaillance du système de connexion à trois voies avec les seringues Luer Slip et le produit peut jaillir de manière incontrôlée.
Le mélange sclérosant/air est alors passé d'une seringue à l'autre à travers le système de connexion à trois voies, au moins 20 fois, pour produire une mousse lisse et de bonne densité (Fig. 2 et 3).
La seringue contenant la mousse est ensuite retirée du système de connexion et la mousse est immédiatement injectée dans la veine (Fig. 4).
La mousse sclérosante doit être utilisée dans les soixante secondes qui suivent la préparation. Après soixante secondes, la mousse résiduelle doit être jetée. Il faut repréparer de la mousse si nécessaire.
La qualité de la mousse doit être vérifiée avant son administration. Elle doit avoir un aspect homogène, être de couleur blanche, sans grosses bulles visibles à l'œil nu.
Elimination
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
STD PHARMACEUTICAL (IRELAND) LIMITED
BLOCK 1, BLANCHARDSTOWN CORPORATE PARK
BALLYCOOLEN ROAD
BLANCHARDSTOWN
DUBLIN 15, D15 AKK1
IRLANDE
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 268 833 1 7 : 5 mL de solution injectable en flacon (verre) ; boîte de 2
· 34009 268 834 8 5 : 5 mL de solution injectable en flacon (verre) ; boîte de 5
· 34009 268 833 4 6 : 5 mL de solution injectable en flacon (verre) ; boîte de 10
· 34009 268 836 0 7 : 2 mL de solution injectable en ampoule (verre) ; boîte de 5
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Liste I
ANSM - Mis à jour le : 20/06/2024
FIBROVEIN 3 %, solution injectable
Tétradécyl sulfate de sodium
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin ou votre infirmier/ère.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre infirmier/ère. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
1. Qu'est-ce que FIBROVEIN 3 %, solution injectable et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant d'utiliser FIBROVEIN 3 %, solution injectable ?
3. Comment utiliser FIBROVEIN 3 %, solution injectable ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver FIBROVEIN 3 %, solution injectable ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE FIBROVEIN 3 %, solution injectable ET DANS QUELS CAS EST-IL UTILISE ?
Classe pharmacothérapeutique : vasoprotecteurs, médicaments sclérosants pour injection locale - code ATC : C05BB04.
Le nom de votre médicament est FIBROVEIN. Il contient du tétradécyl sulfate de sodium comme principe actif.
Différentes concentrations de FIBROVEIN sont utilisées pour le traitement des varices, des veinules de grande, moyenne ou petite dimension et des varicosités.
Ce produit injectable fait partie d’une classe de médicaments appelés sclérosants. Les sclérosants sont des agents chimiques, qui lorsqu’ils sont injectés dans la veine atteinte font gonfler les parois veineuses pour qu’elles adhèrent entre elles. Cela empêche la circulation du sang en transformant la veine en tissu cicatriciel. Au bout de quelques semaines, la veine disparaît.
FIBROVEIN ne peut être utilisé que chez les adultes.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D’UTILISER FIBROVEIN 3 %, solution injectable ?
N’utilisez jamais FIBROVEIN 3 %, solution injectable dans les cas suivants :
· si vous êtes allergique au tétradécyl sulfate de sodium ou à l’un des autres composants contenus dans ce médicament, mentionnés dans la rubrique 6, ou en cas d’état allergique,
· si vous être immobilisé, quelle que soit la cause, ou alité,
· si vous avez un risque élevé de développement de caillots sanguins dans vos veines, notamment en cas de :
o troubles sanguins héréditaires tels que la thrombophilie,
o contraception hormonale ou traitement hormonal,
o obésité,
o tabagisme,
o immobilisation pour une longue durée.
· si vous avez eu une thrombose récemment : caillot qui obstrue un vaisseau sanguin dans les veines superficielles ou profondes, ou dans les poumons,
· si vous avez subi une intervention chirurgicale récente,
· si vous avez des varices causées par des tumeurs pelviennes ou abdominales, sauf si la tumeur a été retirée,
· si vous avez une maladie non contrôlée, comme le diabète, l'asthme, une anomalie sanguine, un empoisonnement du sang, ou de récents problèmes de peau ou respiratoires,
· si vous avez un gonflement ou une rougeur de la peau avec sensation de chaleur et sensibilité (cellulite),
· si vous êtes atteint d’une infection de quelque nature que ce soit,
· si vous êtes atteint d’un cancer évolutif,
· si vous avez des problèmes de fermeture des valves dans les veines profondes (insuffisance valvulaire),
· si vous avez une artère obstruée,
· si vous êtes atteint de phlébite aigüe (inflammation sévère des veines des jambes),
· si vous avez une anomalie de la cloison du cœur (foramen ovale perméable) symptomatique connue (uniquement si FIBROVEIN est administré sous forme de mousse).
Avertissements et précautions
Adressez-vous à votre médecin avant d’utiliser FIBROVEIN 3 %, solution injectable en cas de :
· allergie à un aliment ou à un médicament ou à toute autre chose ; une dose-test pourra vous être administrée 24 heures avant toute poursuite du traitement,
· antécédents de caillots sanguins dans les veines superficielles ou profondes ou dans les poumons,
· anomalie asymptomatique de la cloison du cœur (foramen ovale perméable) (si le sclérosant est administré sous forme de mousse),
· anomalie symptomatique ou asymptomatique de la cloison du cœur (foramen ovale perméable) (si le sclérosant est administré sous forme liquide),
· migraines,
· problèmes au niveau des veines des jambes associés à une maladie de longue durée provoquant un gonflement des tissus de l’organisme (lymphœdème). FIBROVEIN peut aggraver la douleur et l’inflammation locales pendant plusieurs jours voire plusieurs semaines,
· difficultés respiratoires (asthme),
· antécédents d'hypertension artérielle pulmonaire,
· antécédents d’accident ischémique transitoire (AIT), d’infarctus ou d'accident vasculaire cérébral grave,
· athérosclérose (maladie de vos artères ou de vos veines),
· inflammation grave ou caillots dans les artères et les veines des mains et des pieds (maladie de Buerger).
FIBROVEIN ne doit être administré que par un médecin ; lorsque la réglementation nationale l’autorise, FIBROVEIN peut être administré sous la surveillance d’un médecin par un professionnel de santé ayant les qualifications appropriées, expérimenté en anatomie veineuse et préalablement formé à la technique d’injection. Avant d’utiliser ce produit il peut être nécessaire de vérifier si vous avez des problèmes de valves veineuses.
Votre médecin vous posera des questions relatives à votre santé et vous informera des risques d’effets indésirables liés au traitement.
Pendant le traitement
Pendant et après la sclérothérapie, Votre médecin surveillera les manifestations évocatrices d'une hypersensibilité (rougeur, démangeaison, toux) et les manifestations neurologiques (troubles visuels, migraine, sensation de fourmillements ou d’engourdissement).
Il vous demandera de revenir pour une visite de suivi.
Enfants et adolescents
La sécurité et l’efficacité de FIBROVEIN chez les enfants et les adolescents n’ont pas encore été établies.
Autres médicaments et FIBROVEIN 3 %, solution injectable
Si vous prenez des contraceptifs hormonaux (« la pilule », par ex.) ou si vous suivez un traitement hormonal substitutif (THS), vous avez plus de risques de développer des caillots sanguins dans vos veines (voir « N’utilisez jamais FIBROVEIN 3 %, solution injectable dans les cas suivants »). Informez votre médecin ou votre infirmier/ère.
Informez votre médecin ou votre infirmier/ère si vous prenez, avez récemment pris ou pourriez prendre tout autre médicament, y compris des médicaments obtenus sans ordonnance.
FIBROVEIN 3 %, solution injectable avec des aliments, boissons et de l’alcool
Sans objet.
Grossesse, allaitement et fertilité
Si vous êtes enceinte ou que vous allaitez, si vous pensez être enceinte ou planifiez une grossesse, demandez conseil à votre médecin avant de prendre ce médicament.
On ne dispose pas d'informations sur l'utilisation de FIBROVEIN chez les femmes enceintes. FIBROVEIN ne doit pas être utilisé pendant la grossesse sauf en cas de stricte nécessité. Votre médecin décidera si ce traitement vous convient.
On ne sait pas si FIBROVEIN est excrété dans le lait maternel. Si vous allaitez, le médecin décidera si FIBROVEIN doit être utilisé.
Conduite de véhicules et utilisation de machines
Après le traitement par injections, il est possible que vous deviez porter un bandage et/ou des bas de contention pour aider à réduire l'inflammation et la pigmentation de la peau, ce qui pourrait affecter votre capacité à conduire.
FIBROVEIN 3 %, solution injectable contient du sodium, du potassium et de l’alcool benzylique
Ce médicament contient moins de 1 mmol de sodium (23 mg) par flacon/ampoule, c’est-à-dire qu’il est essentiellement « sans sodium ».
Ce médicament contient moins de 1 mmol de potassium (39 mg) par flacon/ampoule, c’est-à-dire qu’il est essentiellement « sans potassium ».
Ce médicament contient 40 mg d’alcool benzylique par ampoule de 2 mL ou 100 mg d’alcool benzylique par flacon de 5 mL, équivalent à 20 mg/mL. L’alcool benzylique peut provoquer des réactions allergiques. Demandez à votre médecin ou à votre pharmacien si vous êtes enceinte ou si vous allaitez, ou si vous souffrez d’une maladie du foie ou du rein. De grandes quantités d’alcool benzylique peuvent s’accumuler dans votre corps et entraîner des effets secondaires (appelés « acidose métabolique »).
3. COMMENT UTILISER FIBROVEIN 3 %, solution injectable ?
Le traitement consiste à injecter le médicament dans la veine atteinte à l'aide d’une aiguille du plus petit diamètre possible ; le médicament doit être injecté lentement et très soigneusement pour que le sang contenu dans la veine soit expulsé.
Le médecin peut également mélanger le médicament avec de l'air au moyen de deux seringues reliées par un système de connexion pour créer une mousse. En effet, la mousse facilite l’expulsion du sang dans les veines de plus gros calibre. Dans ce cas, la mousse doit être préparée et administrée par un médecin correctement formé à cette technique spécifique.
Votre médecin doit utiliser l’échographie lors du traitement des varices non visibles et pour l'administration de la mousse sclérosante.
Votre médecin déterminera les zones à traiter et la bonne dose pour vous. Les doses recommandées sont les suivantes :
Utilisation chez les adultes et les personnes âgées
La dose varie entre 0,1 et 2 mL pour chaque injection. Pour les 3 concentrations les plus faibles (0,2 %, 0,5 % et 1 %), un maximum de 10 mL de solution par séance peut être utilisé. Avec la plus forte concentration (3 %), il ne faut pas dépasser 4 mL de solution.
En raison du volume limité de sclérosant autorisé, des séances répétées de sclérothérapie peuvent être nécessaires.
Après avoir été traité par FIBROVEIN, veuillez suivre les conseils de votre médecin. Vous pourrez avoir à porter un bandage et/ou des bas de contention pour aider à réduire l'inflammation et la pigmentation de la peau.
Si vous avez utilisé plus de FIBROVEIN 3 %, solution injectable que vous n’auriez dû
Consultez immédiatement votre médecin ou votre pharmacien.
Sans objet.
Si vous oubliez d’utiliser FIBROVEIN 3 %, solution injectable
Si vous arrêtez d’utiliser FIBROVEIN 3 %, solution injectable
Sans objet.
Si vous avez d’autres questions sur l’utilisation de ce médicament, demandez plus d’informations à votre médecin ou à votre infirmier/ère.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Des effets indésirables graves peuvent survenir. Arrêtez le traitement par FIBROVEIN et contactez immédiatement votre médecin ou rendez-vous au service des urgences le plus proche si vous présentez l’un des effets suivants :
Peu fréquents (peuvent affecter jusqu’à 1 personne sur 100) :
· Caillots de sang dans les veines profondes (thrombose veineuse profonde probablement due à une maladie sous-jacente).Les symptômes peuvent inclure douleurs, gonflement et sensibilité dans l’une de vos jambes (généralement au mollet), douleur intenses dans la zone atteinte, peau chaude dans le zone du caillot ou rougeur de la peau en particulier sur l’arrière de la jambe en-dessous du genou.
Rares (peuvent affecter jusqu’à 1 personne sur 1 000) :
· Nécrose des tissus de la peau au niveau local et plus rarement des nerfs. Les symptômes peuvent inclure douleurs, décoloration de la peau (rougeur), gonflement ou accumulation de liquide, cloques (remplies d’un liquide clair ou de sang), changement de la couleur de la peau (rouge foncé, violet ou noir), sensations anormales (fourmillements, picotements, brûlure), engourdissement ou perte de sensation.
Très rares (peuvent affecter jusqu’à 1 personne sur 10 000) :
· Forme très grave de réaction allergique (choc anaphylactique), qui peut entraîner des problèmes respiratoires ou une chute soudaine de la tension artérielle pouvant vous donner des étourdissements ou vous faire perdre connaissance. Ceci est très rare mais doit être traité immédiatement, sinon cela peut être fatal.
· Blocage d’une artère par un caillot pouvant provoquer :
o Un accident vasculaire cérébral ou une interruption de l’irrigation sanguine du cerveau ou de l’œil (accident ischémique transitoire). Les symptômes peuvent inclure faiblesse, engourdissement ou paralysie de la face, du bras ou de la jambe, généralement sur un côté du corps, troubles d’élocution ou difficulté à comprendre les autres, cécité d’un œil ou des deux yeux, ou vision dédoublée.
o Un caillot de sang dans les poumons. Les symptômes peuvent inclure essoufflement soudain, douleur soudaine et intense dans la poitrine qui peut empirer en respirant profondément ou en toussant, rythme cardiaque rapide ou respiration rapide.
Pour éviter cet effet indésirable très rare et grave, ce produit ne doit pas être administré aux patients qui présentent un risque de formation de caillots dans les veines et les artères (risque de thrombose).
· Insuffisance de la circulation sanguine. Les symptômes peuvent inclure fatigue, évanouissements, perte de connaissance, douleur à la poitrine, essoufflement, faiblesse, étourdissement, vomissements et palpitations.
· Nécrose tissulaire suite à une injection intra-artérielle. Les symptômes peuvent varier en fonction de la quantité de médicament injecté, du site d’injection et de la rapidité de l’intervention médicale. Il peut s’agir de douleurs sans dommage à long terme, ou de nécrose tissulaire sur de grandes zones, y compris le pied, conduisant à l’amputation.
Les autres effets indésirables pouvant survenir sont :
Très fréquents (peuvent affecter plus d’une personne sur 10) :
· Inflammation superficielle de la veine.
Fréquents (peuvent affecter jusqu’à 1 personne sur 10) :
· Douleur ou sensation de brûlure (à court terme au niveau du site d’injection),
· Décoloration de la peau,
· Croissance de varicosités très fines dans la zone traitée (matting).
Peu fréquents (peuvent affecter jusqu’à 1 personne sur 100) :
· Réactions cutanées locales allergiques et non allergiques, par exemple rougeur de la peau, démangeaison de la peau, éruption ou gonflement de la peau,
· Troubles visuels,
· Migraine.
Rares (peuvent affecter jusqu’à 1 personne sur 1 000) :
· Toux, essoufflement, sensation de pression/oppression dans la poitrine,
· Brûlure, picotement, fourmillement ou prurit de la peau,
· Maux de tête, sensation de faiblesse,
· Confusion, étourdissements, perte de conscience.
Très rares (peuvent affecter jusqu’à 1 personne sur 10 000) :
· Fièvre, bouffées de chaleur, prurit de la peau (urticaire),
· Nausées, vomissements, diarrhée, sensation de gonflement/langue épaisse, bouche sèche,
· Inflammation des vaisseaux sanguins, insuffisance de la circulation sanguine.
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou à votre infirmier/ère. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/.
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER FIBROVEIN 3 %, solution injectable ?
Tenir ce médicament hors de la vue et de la portée des enfants.
Ce médicament ne nécessite pas de précautions particulières de conservation concernant la température.
Ne pas congeler.
Conserver le produit injectable dans l’emballage extérieur, à l’abri de la lumière.
N’utilisez pas ce médicament après la date de péremption indiquée sur l’emballage ou la boîte après EXP. La date de péremption fait référence au dernier jour de ce mois.
Usage unique. Une fois que l’emballage est ouvert, son contenu doit être utilisé immédiatement. Tout produit restant doit être jeté.
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient FIBROVEIN 3 %, solution injectable
· La substance active est :
Tétradécyl sulfate de sodium........................................................................................... 30 mg
Pour 1 mL de solution injectable.
Chaque mL de solution injectable contient 30 mg de tétradécyl sulfate de sodium.
Chaque ampoule de 2 mL contient 60 mg de tétradécyl sulfate de sodium.
Chaque flacon de 5 mL contient 150 mg de tétradécyl sulfate de sodium.
· Les autres composants sont :
Alcool benzylique (20 mg/mL), phosphate disodique dodécahydraté, dihydrogénophosphate de potassium, eau pour préparations injectables, hydroxyde de sodium (pour ajustement du pH). Voir section 2 « FIBROVEIN 3 %, solution injectable contient du sodium et du potassium ».
Qu’est-ce que FIBROVEIN 3 %, solution injectable et contenu de l’emballage extérieur
Ce médicament est présenté sous forme de solution injectable en ampoule de verre incolore ou en flacon en verre incolore. La solution est limpide, incolore et stérile, sans particules visibles.
Boîte de 5 ampoules de 2 mL ou boîte de 2, 5 ou 10 flacons de 5 mL.
Toutes les présentations peuvent ne pas être commercialisées.
Titulaire de l’autorisation de mise sur le marché
STD PHARMACEUTICAL (IRELAND) LIMITED
BLOCK 1, BLANCHARDSTOWN CORPORATE PARK
BALLYCOOLEN ROAD
BLANCHARDSTOWN
DUBLIN 15, D15 AKK1
IRLANDE
Exploitant de l’autorisation de mise sur le marché
LABORATOIRE KREUSSLER PHARMA
18 AVENUE PARMENTIER
75011 PARIS
FRANCE
LES FJORDS - IMMEUBLE OSLO
19 AVENUE DE NORVEGE
VILLEBON SUR YVETTE
91953 COURTABOEUF CEDEX
FRANCE
Ou
CHEMISCHE FABRIK KREUSSLER & CO. GmbH
RHEINGAUSTRASSE 87-93
65203 WIESBADEN
ALLEMAGNE
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Ce médicament est autorisé dans les Etats membres de l'Espace Economique Européen sous les noms suivants :
[à compléter ultérieurement par le titulaire]
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).
Les informations suivantes sont destinées exclusivement aux professionnels de santé :
Veuillez consulter le Résumé des Caractéristiques du Produit (RCP) pour plus de détails sur ce produit.
Posologie et mode d’administration
Posologie
Voie intraveineuse (IV) stricte.
Le choix de la concentration se fera en fonction du type et du diamètre des varices à scléroser.
Les varicosités ne doivent être traitées qu’avec une solution à 0,2 %, et les veines réticulaires avec une solution à 0,5 %, la solution à 1 % est plus utile pour les varices de petit ou moyen calibre et la solution à 3 % est réservée aux varices de gros calibre. Pour les varices non visibles, le diamètre doit être mesuré par échographie.
Le sclérosant est administré en petites quantités sur plusieurs sites d’injection le long de la veine à traiter. FIBROVEIN 0,2 % et 0,5 % doivent être administrés sous forme liquide. Les solutions de FIBROVEIN 1 % et 3 % peuvent être administrées sous forme de liquide ou mousse (mélange sclérosant/air), comme décrit en détail dans le tableau ci-dessous.
L'objectif est de parvenir à la destruction optimale de la paroi du vaisseau avec la concentration minimale de produit sclérosant nécessaire pour un résultat clinique, une quantité et/ou une concentration trop importante risquant d’entraîner une nécrose ou d'autres séquelles indésirables.
Adultes
|
Concentration |
Volume usuel injecté par voie intraveineuse en plusieurs sites par séance |
Volume total maximum à injecter |
||
|
Liquide |
Mousse * |
Liquide |
Mousse * |
|
|
FIBROVEIN 3 % |
0,5 à 2,0 mL |
0,5 à 2,0 mL |
4 mL |
16 mL |
*Le volume est la somme des composants liquide + air
Dans les cas qui nécessitent une prudence particulière (voir le RCP), il est recommandé de commencer une séance par l’administration d’une dose d'essai comprise entre 0,25 et 0,5 mL de FIBROVEIN, et de garder le patient en observation pendant plusieurs heures avant d’administrer une deuxième dose identique ou plus élevée.
Etant donné que le volume à injecter par séance est limité, plusieurs séances sont généralement nécessaires (2 à 4 en moyenne). Il est souhaitable de commencer chaque séance d’injection par l’administration d’une faible dose test de FIBROVEIN, afin de s’assurer de l’absence d’allergie.
Administration du sclérosant sous forme de mousse
Les spécialités FIBROVEIN 1 % et 3 % peuvent être converties en une forme mousse destinée au traitement des veines de gros calibre. La mousse doit être préparée de manière extemporanée par un praticien préalablement formé à cette technique particulière de préparation et d’administration. L’administration doit être réalisée de manière idéale sous contrôle échographique.
Population âgée
Il n’y a aucune recommandation spécifique concernant la dose.
Population pédiatrique
La sûreté et l’efficacité de FIBROVEIN chez les enfants et les adolescents n’ont pas été établies. Aucune donnée n’est disponible.
Mode d’administration
Pour la préparation de la mousse, voir ci-dessous. La méthode Tessari pour la préparation de la mousse est décrite. D'autres techniques peuvent également être utilisées telles que DSS, Easyfoam et Sterivein.
Des conditions d’asepsie strictes s'imposent lors de la manipulation de FIBROVEIN. FIBROVEIN est un produit à usage unique par voie parentérale. Une fois que l’ampoule est ouverte, utiliser immédiatement et jeter toute quantité résiduelle inutilisée.
Inspecter visuellement la solution avant utilisation. Les solutions qui contiennent des particules ne doivent pas être utilisées.
Lorsque le sclérosant est utilisé sous forme d'une mousse, l’administration doit être réalisée par un praticien préalablement formé à cette technique particulière, idéalement sous contrôle échographique.
Incompatibilités
Ce produit n'est pas compatible avec l'héparine. En l'absence d'études de compatibilité, ce médicament ne doit pas être mélangé avec d'autres médicaments.
Mises en garde spéciales et précautions
L’utilisation de FIBROVEIN doit être réservée aux médecins ; lorsque la réglementation nationale l’autorise, FIBROVEIN peut être administré sous la surveillance d’un médecin par un professionnel de santé ayant les qualifications appropriées, expérimenté en anatomie veineuse, diagnostic et traitement des pathologies affectant le système veineux et préalablement formés à la technique d'injection.
Des réactions allergiques, telles que des chocs anaphylactiques, ayant été rapportées, le médecin doit être prêt à les traiter de façon appropriée. Le matériel de réanimation doit être disponible immédiatement. Le patient doit être adressé à l'hôpital par mesure de précaution.
De graves effets indésirables au niveau local, tels qu’une nécrose tissulaire, peuvent se produire suite à une extravasation. Faire preuve d’une grande prudence lors du positionnement de l'aiguille par voie intraveineuse et utiliser le volume minimal efficace à chaque site d’injection. La solution doit être injectée lentement.
Des précautions doivent être prises pour ne pas injecter la solution dans une artère, car cela pourrait conduire à une nécrose tissulaire (mort des tissus) et à l’amputation.
Des précautions particulières doivent être prises lors de l'injection au niveau du pied et de la zone malléolaire, en raison du risque pour l'une des artères. La compression doit être appliquée lors du traitement de petites veines car la pigmentation peut se produire si du sang est expulsé au niveau du point d'injection.
Préparation et manipulation
Recommandations générales
La qualité de la mousse dépend de critères spécifiques :
1. La concentration du produit : la mousse ne peut être préparée qu’avec des concentrations de tétradécyl sulfate de sodium de 1 à 3 %.
2. La proportion liquide/air : habituellement, cette proportion est de 1 volume de liquide pour 3 ou 4 volumes d'air.
3. Le nombre de va et vient : le médecin doit respecter avec précision le nombre de mouvements définis pour chaque technique
4. La consistance macroscopique de la mousse : la qualité de la mousse doit être vérifiée à l'extérieur de la seringue avant son administration. La mousse doit être homogène, souple et cohésive, sans grosses bulles visibles. Si de grosses bulles sont visibles, la mousse doit être jetée avant d’en préparer une nouvelle.
5. Le temps total de préparation de la mousse : la préparation dure environ 10 secondes, entre le premier et le dernier mouvement de va et vient.
6. Le temps maximum entre la préparation et l'injection : la mousse sclérosante doit être utilisée dans les soixante secondes qui suivent la production. Après soixante secondes, toute la mousse non-utilisée doit être jetée. Il faut repréparer de la mousse si nécessaire.
Préparation de la mousse (technique Tessari)
La préparation de la mousse doit se faire dans des conditions d’asepsie strictes.
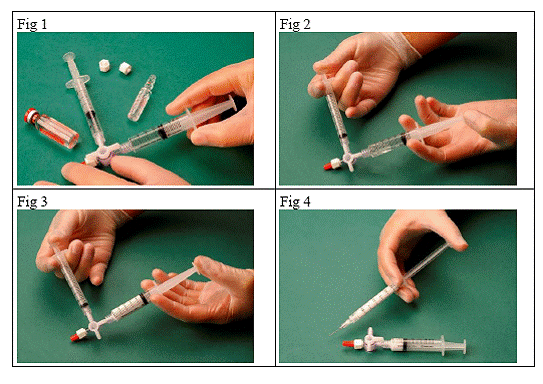
Pour préparer une mousse sclérosante, aspirer 1 mL de liquide sclérosant dans une seringue stérile et 3 mL ou 4 mL d'air stérile dans une autre seringue stérile. L'air est aspiré à travers un filtre de 0,2 µm afin d'assurer sa stérilité. Les seringues sont ensuite reliées en utilisant un système stérile de connexion à trois voies (Fig. 1). Il est conseillé d’utiliser des seringues Luer Lock et de porter des lunettes de protection lors de la préparation de la mousse. La pression peut provoquer la défaillance du système de connexion à trois voies avec les seringues Luer Slip et le produit peut jaillir de manière incontrôlée.
Le mélange sclérosant/air est alors passé d'une seringue à l'autre à travers le système de connexion à trois voies, au moins 20 fois, pour produire une mousse lisse et de bonne densité (Fig. 2 et 3).
La seringue contenant la mousse est ensuite retirée du système de connexion et la mousse est immédiatement injectée dans la veine (Fig. 4).
La mousse sclérosante doit être utilisée dans les soixante secondes qui suivent la préparation. Après soixante secondes, la mousse résiduelle doit être jetée. Il faut repréparer de la mousse si nécessaire.
La qualité de la mousse doit être vérifiée avant son administration. Elle doit avoir un aspect homogène, être de couleur blanche, sans grosses bulles visibles à l'œil nu.
|
|
Excipients
Ce médicament contient :
· Moins de 1 mmol de sodium (23 mg) par flacon/ampoule, c’est-à-dire qu’il est essentiellement « sans sodium ».
· Moins de 1 mmol de potassium (39 mg) par flacon/ampoule, c’est-à-dire qu’il est essentiellement « sans potassium ».
· 40 mg d’alcool benzylique par ampoule de 2 mL ou 100 mg d’alcool benzylique par flacon de 5 mL, équivalent à 20 mg/mL. L’alcool benzylique peut provoquer des réactions allergiques. Peut provoquer une acidose métabolique chez les femmes enceintes ou qui allaitent ou chez les patients atteints d’insuffisance hépatique ou rénale.