Dernière mise à jour le 08/01/2026
IPRATROPIUM TEVA 0,25 mg/1 ml ENFANTS, solution pour inhalation par nébuliseur en récipient unidose
Indications thérapeutiques
IPRATROPIUM TEVA peut être utilisé simultanément avec un autre type de médicament appartenant à la classe des bronchodilatateurs bêta 2-agonistes inhalés.
Le bromure d'ipratropium appartient à la catégorie des bronchodilatateurs anticholinergiques. Après administration par inhalation, le bromure d'ipratropium exerce un effet dilatateur au niveau des bronches.
Présentations
> 30 récipient(s) unidose(s) polyéthylène basse densité (PEBD) de 1 ml
Code CIP : 389 400-9 ou 34009 389 400 9 1
Déclaration de commercialisation : 23/12/2008
Cette présentation est agréée aux collectivités
- Prix hors honoraire de dispensation : 8,01 €
- Honoraire de dispensation : 1,02 €
- Prix honoraire compris : 9,03 €
- Taux de remboursement :65%
Service médical rendu (SMR)
Amélioration du service médical rendu (ASMR)
Ce médicament étant un générique, l'ASMR n'a pas été évalué par la commission de la transparence (CT), il est possible de se référer à la /aux spécialité(s) de référence du groupe générique auquel appartient ce médicament (cliquez ici pour aller à la rubrique des groupes génériques)
Autres informations
- Titulaire de l'autorisation : TEVA SANTE
- Conditions de prescription et de délivrance :
- liste I
- prescription réservée aux spécialistes et services PEDIATRIE
- prescription réservée aux spécialistes et services PNEUMOLOGIE
- réservé à l'usage en situation d'urgence selon l'article R5121-96 du code de la santé publique
- réservé à une structure d'assistance médicale mobile ou de rapatriement sanitaire
- Statut de l'autorisation : Valide
- Type de procédure : Procédure de reconnaissance mutuelle
- Code CIS : 6 666 153 6
ANSM - Mis à jour le : 05/01/2024
IPRATROPIUM TEVA 0,25 mg/1 ml ENFANTS, solution pour inhalation par nébuliseur en récipient unidose
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Bromure d’ipratropium anhydre........................................................................................... 0,250 mg
Sous forme de bromure d’ipratropium monohydraté............................................................ 0,261 mg
Pour chaque récipient unidose de 1 ml.
Pour la liste complète des excipients, voir rubrique 6.1.
Solution pour inhalation par nébuliseur, en récipient unidose.
Solution incolore transparente de pH compris entre 3,0 et 4,0 et d'osmolalité comprise entre 245 et 299 mOsmol/kg.
4.1. Indications thérapeutiques
Traitement symptomatique de l'asthme en association avec un bêta 2-mimétique inhalé.
Le bromure d’ipratropium est indiqué chez les adultes, les adolescents et les enfants âgés de 0 à 12 ans.
4.2. Posologie et mode d'administration
Voie inhalée par nébulisation exclusivement.
Posologie
IPRATROPIUM TEVA 0,25 mg/1 ml est utilisé lorsque la dose optimale correspond au contenu d'une ampoule de 1 ml.
La posologie sera adaptée aux besoins individuels du patient. IPRATROPIUM TEVA 0,25 mg/1 ml correspond au dosage adapté à l'enfant de moins de 12 ans.
Doses recommandées :
Adultes (y compris personnes âgées) et adolescents de plus de 12 ans :
0,25 à 0,50 mg (soit 1 ampoule de 0,25 mg/1 ml ou 1 ampoule de 0,50 mg/2 ml) 3 à 4 fois par jour.
Traitement des bronchospasmes aigus : 0,50 mg.
Les nébulisations peuvent être répétées jusqu'à la stabilisation de l'état clinique du patient. L'intervalle entre chaque nébulisation sera déterminé par le médecin.
Il est recommandé de ne pas dépasser la posologie quotidienne recommandée, que ce soit pendant la phase de traitement aiguë ou d'entretien. Les doses quotidiennes supérieures à 2 mg chez les adultes et les adolescents doivent être administrées sous surveillance médicale uniquement.
Population pédiatrique
Asthme
Enfants de 6 à 12 ans :
0,25 mg (soit 1 ampoule de 0,25 mg/1 ml) jusqu'à une dose quotidienne totale de 1 mg (4 ampoules de 0,25 mg/1 ml). L'intervalle entre chaque nébulisation sera adapté par le médecin en fonction de l'état clinique du patient.
Enfants de 0 à 5 ans (traitement de l'asthme aigu uniquement) :
Les données chez l'enfant étant limitées, le traitement sera administré sous surveillance médicale.
La dose préconisée est de : 0,125 mg à 0,250 mg (soit une demie à une ampoule de 0,25 mg/1 ml) jusqu'à une dose quotidienne totale de 1 mg (soit 4 ampoules de 0,25 mg/1 ml).
Chez les enfants de moins de 5 ans, les nébulisations de bromure d'ipratropium doivent être espacées d'au moins 6 heures.
En cas de bronchospasme aigu, les nébulisations peuvent être répétées jusqu'à la stabilisation de l'état clinique du patient.
Si le traitement n'apporte pas d'amélioration satisfaisante ou si l'état clinique du patient se détériore, il convient de réévaluer la conduite thérapeutique.
La survenue d'une dyspnée aiguë ou d'une aggravation brutale, doit conduire à une réévaluation de la conduite thérapeutique.
Mode d’administration
Le récipient unidose est exclusivement destiné à une administration par inhalation au moyen d’un nébuliseur adapté ; il ne doit pas être pris par voie orale ni administré par voie parentérale.
IPRATROPIUM TEVA peut être administré à l'aide d'un appareil de nébulisation ultrasonique ou à air comprimé (débit optimal : de 6 à 8 litres par minute). Les doses délivrées peuvent varier en fonction de l'appareil de nébulisation utilisé.
IPRATROPIUM TEVA peut être inhalé sous forme non diluée ou diluée dans du sérum physiologique. Dans ce cas, le volume de sérum physiologique sera adapté en fonction du nébuliseur utilisé.
Si la quantité de produit à administrer en prise unique correspond au dosage d’IPRATROPIUM TEVA, le contenu de l'ampoule pourra être inhalé en entier.
Modalités de préparation :
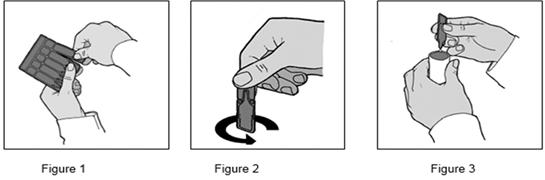
1. Préparer le nébuliseur en se conformant aux recommandations du fabricant de l'appareil.
2. Détacher une ampoule comme indiqué sur la Figure 1.
3. Ouvrir l'ampoule en plastique en opérant un mouvement de torsion comme indiqué sur la Figure 2.
4. Remplir la cuve du nébuliseur comme indiqué sur la Figure 3.
5. En fonction de l'appareil utilisé, ajouter du sérum physiologique si nécessaire.
6. Assembler le nébuliseur conformément au mode d'emploi du fabricant. La durée d'inhalation d'une dose complète est généralement comprise entre 5 et 15 minutes.
7. Après inhalation, jeter la solution restant dans la cuve et nettoyer le nébuliseur conformément aux recommandations du fabricant.
Le récipient unidose ne contient pas de conservateur et son contenu doit donc être administré dès ouverture. Une nouvelle ampoule doit être utilisée à chaque administration afin d'éviter toute contamination microbienne.
Procéder à une vérification visuelle du produit avant utilisation, en cas de décoloration ou de solution trouble, jeter la solution (voir rubrique 6.4).
Les récipients unidoses ouverts ou endommagés doivent aussi être jetés (voir rubrique 6.6).
4.4. Mises en garde spéciales et précautions d'emploi
De rares cas d’urticaire, d’angio-œdème, de rash, de bronchospasme, d’œdème oropharyngé et d’anaphylaxie ont révélé des réactions d’hypersensibilité immédiate suite à l’utilisation d’IPRATROPIUM TEVA.
Bronchospasme paradoxal
Comme d’autres médicaments inhalés, IPRATROPIUM TEVA peut entraîner un bronchospasme paradoxal pouvant engager le pronostic vital. En cas de bronchospasme paradoxal, le traitement par IPRATROPIUM TEVA doit immédiatement être arrêté et remplacé par un autre traitement.
Complications oculaires
La prudence est de mise chez les patients prédisposés au glaucome à angle étroit, bien que la survenue d'effets indésirables anticholinergiques systémiques soit extrêmement improbable avec cette voie d'administration.
De rares cas de complications oculaires (mydriase, augmentation de la pression intraoculaire, glaucome par fermeture de l'angle et douleur oculaire) ont été signalés après projection accidentelle intraoculaire de bromure d'ipratropium seul ou associé à un bêta 2-sympathomimétique.
L'apparition d'une douleur ou d'une gêne oculaire, d'une vision trouble, de la perception visuelle d'anneaux ou images colorés associés à une rougeur conjonctivale ou une congestion de la cornée sont des signes annonciateurs d'un glaucome par fermeture de l'angle et nécessite l'instillation d'un collyre myotique et un avis médical spécialisé immédiat.
Par conséquent, le patient devra être clairement informé des modalités d'utilisation adaptées d’IPRATROPIUM TEVA. La prudence est recommandée afin de parer à la projection intraoculaire du produit. De façon générale, il est préférable d'administrer la solution nébulisée d'ipratropium par l'intermédiaire d'un embout buccal. En cas d'impossibilité, un masque adapté pourra être utilisé s'il est correctement ajusté au patient. Il sera conseillé en particulier chez les patients à risque de glaucome de se protéger les yeux des éventuelles projections.
Effets rénaux et urinaires
La prudence est de mise chez les patients présentant des obstructions du système de drainage urinaire (par exemple, hypertrophie prostatique ou obstruction du col de la vessie), bien que la survenue d'effets indésirables anticholinergiques systémiques soit extrêmement improbable avec cette voie d'administration.
Troubles de la motilité gastro-intestinale
Les patients atteints de fibrose kystique peuvent être sujets à des troubles de la motilité gastro-intestinale.
Le bromure d'ipratropium sera utilisé avec prudence en cas de pathologie cardiaque.
Si des doses supérieures aux posologies recommandées sont nécessaires pour contrôler les symptômes de bronchoconstriction (ou bronchospasmes), la conduite thérapeutique devra être réévaluée.
Population pédiatrique
Voir rubrique 4.2.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
L'administration chronique d’IPRATROPIUM TEVA avec d'autres médicaments anticholinergiques n'a pas été étudiée. Les effets indésirables d'autres composés anticholinergiques peuvent être potentialisés.
Par conséquent, la co-administration chronique d’IPRATROPIUM TEVA avec d'autres médicaments anticholinergiques n'est pas recommandée.
Les bêta 2-sympathomimétiques et les dérivés de la xanthine peuvent accroître l'effet bronchodilatateur du bromure d'ipratropium.
Le risque de glaucome aigu chez les patients présentant des antécédents de glaucome à angle étroit peut être accru en cas d'administration simultanée de bromure d'ipratropium nébulisé et de bêta 2-agonistes (voir rubrique 4.4). L'administration séparée ou le port de lunettes bien ajustées peuvent réduire ce risque.
IPRATROPIUM TEVA peut être co-administré avec d'autres médicaments fréquemment utilisés dans le traitement de la bronchopneumopathie chronique obstructive, y compris les bronchodilatateurs sympathomimétiques, les méthylxanthines, les stéroïdes et le cromoglicate disodique.
IPRATROPIUM TEVA, solution pour inhalation par nébuliseur, NE DOIT PAS être mélangé à d'autres solutions pour inhalation contenant le conservateur chlorure de benzalkonium dans le même nébuliseur (voir rubrique 6.2).
4.6. Fertilité, grossesse et allaitement
Grossesse
Le risque potentiel dans l'espèce humaine n'est pas connu. En conséquence, l'utilisation d'IPRATROPIUM TEVA ne doit être envisagée au cours de la grossesse que si nécessaire.
Allaitement
On ne sait pas si le bromure d'ipratropium ou ses métabolites sont excrétés dans le lait maternel. Il est peu probable que le bromure d'ipratropium atteigne le nourrisson dans une mesure importante, en particulier s'il est administré par inhalation. Toutefois, la prudence est de mise en cas d’administration d’IPRATROPIUM TEVA à des femmes allaitantes.
Fertilité
Il n'existe pas de données cliniques sur la fertilité pour le bromure d'ipratropium.
Les études non cliniques menées avec le bromure d'ipratropium n'ont pas mis en évidence d'effet indésirable sur la fertilité (voir rubrique 5.3).
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
a) Résumé du profil de sécurité
La plupart des effets indésirables répertoriés peuvent être attribués aux propriétés anticholinergiques du bromure d'ipratropium. Comme tous les traitements par inhalation, IPRATROPIUM TEVA peut provoquer des symptômes d'irritation locale. L'incidence rapportée des effets indésirables est basée sur les données des études cliniques et de la pharmacovigilance post-commercialisation.
Les effets indésirables les plus fréquemment rapportés dans les essais cliniques ont été les sensations vertigineuses, les céphalées, l’irritation de la gorge, la toux, la bouche sèche, les troubles de la motilité gastro-intestinale (constipation, diarrhée, vomissements) et les nausées.
b) Tableau listant les effets indésirables
Les événements indésirables sont énumérés dans le tableau ci-dessous, par classe de système d'organe selon MedDRA et par catégorie de fréquence. Les fréquences sont définies comme suit : très fréquent (≥ 1/10), fréquent (≥ 1/100 à < 1/10), peu fréquent (≥ 1/1 000 à < 1/100), rare (≥ 1/10 000 à ≤1/1 000), très rare (< 1/10 000), fréquence inconnue (estimation impossible à partir des données disponibles).
|
Classe de systèmes d’organes |
Fréquence |
Symptômes |
|
Affections du système immunitaire |
Peu fréquent |
Réactions allergiques, angio-œdème, anaphylaxie |
|
Affections du système nerveux |
Fréquent |
Vertiges, céphalées |
|
Affections oculaires |
Peu fréquent |
Vision trouble, pression intraoculaire augmentée, douleur oculaire, mydriase, perception d’un halo lumineux, glaucome par fermeture de l’angle, hyperémie conjonctivale, œdème cornéen |
|
Rare |
Troubles de l’accommodation visuelle |
|
|
Affections cardiaques |
Peu fréquent |
Palpitations, tachycardie supraventriculaire |
|
Rare |
Tachycardie, fibrillation auriculaire |
|
|
Affections respiratoires, thoraciques et médiastinales |
Fréquent |
Toux, irritation locale de la gorge |
|
Peu fréquent |
Bronchospasme induit par inhalation, laryngospasme, œdème pharyngé, sécheresse de la gorge |
|
|
Affections gastro-intestinales |
Fréquent |
Sécheresse de la bouche, troubles de la motilité gastro-intestinale, nausées |
|
Peu fréquent |
Vomissements, stomatite, altération du goût |
|
|
Affections de la peau et du tissu sous-cutané |
Peu fréquent |
Rash, prurit |
|
Rare |
Urticaire |
|
|
Affections du rein et des voies urinaires |
Peu fréquent |
Rétention d’urine |
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/.
Il n'a pas été observé de symptômes spécifiques après un surdosage.
L'administration par voie locale et la marge thérapeutique large n'expose pas le patient à un risque de survenue d'effets indésirables anticholinergiques graves en cas de surdosage. Des effets indésirables d'intensité modérée liés à l'effet anticholinergique peuvent apparaître tels que sécheresse buccale, troubles de l'accommodation visuelle et tachycardie.
Les symptômes d'un surdosage sévère correspondent à une majoration des effets atropiniques tels que tachycardie, tachypnée, hyperthermie et effets sur le système nerveux central à type d'agitation, confusion et hallucinations. Il conviendra alors d'instaurer un traitement symptomatique adapté. En cas de troubles respiratoires, une assistance respiratoire doit être mise en œuvre. L'administration de physiostigmine n'est généralement pas recommandée en raison de ses effets cardiotoxiques et des risques de convulsions ; elle nécessitera une surveillance électrocardiographique par ECG et les moyens d'assurer une ventilation assistée si besoin.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Mécanisme d’action
Le bromure d’ipratropium est un ammonium quaternaire aux propriétés anticholinergiques (parasympatholytiques). Les études précliniques ont montré qu’il inhibe les réflexes à médiation vagale par un effet antagoniste sur l’action de l’acétylcholine, l’agent transmetteur libéré du nerf vagal. Les anticholinergiques empêchent l’augmentation de la concentration intracellulaire de Ca++, qui est causée par l’interaction entre l’acétylcholine et le récepteur muscarinique situé sur le muscle lisse bronchique. La libération de Ca++ est médiée par le système de second messager composé d'IP3 (inositol triphosphate) et de DAG (diacylglycérol).
Effets pharmacodynamiques
Le bromure d'ipratropium inhalé exerce un effet bronchodilatateur local au niveau des bronches.
Les études précliniques et cliniques n'ont pas mis en évidence d'effet du bromure d'ipratropium sur la sécrétion de mucus, la clairance mucociliaire ou les échanges gazeux.
Etudes cliniques
L'effet bronchodilatateur du bromure d'ipratropium dans le traitement du bronchospasme aigu associé à l'asthme a été démontré au cours d’études menées chez des adultes et des enfants âgés de plus de six ans. Dans la plupart de ces études, le bromure d'ipratropium était co-administré avec un bêta-agoniste inhalé.
Bien que les données soient limitées, le bromure d'ipratropium s'est avéré avoir un effet thérapeutique dans le traitement du bronchospasme associé à la bronchiolite virale et à la dysplasie bronchopulmonaire chez les jeunes et les très jeunes enfants.
Au cours des essais contrôlés d'une durée de 85 à 90 jours chez des patients souffrant de bronchospasme associé à une bronchopneumopathie chronique obstructive (BPCO), une amélioration significative de la fonction pulmonaire s'est produite dans les 15 minutes, a atteint son maximum dans les 1 à 2 heures et s'est maintenue pendant 4 à 6 heures.
5.2. Propriétés pharmacocinétiques
L'effet thérapeutique est produit par une action locale dans les voies respiratoires. Les temps de bronchodilatation et de pharmacocinétique systémique ne sont pas parallèles.
Après inhalation, 10 à 30 % de la dose se déposent dans les poumons, en fonction de la formulation, du dispositif et de la technique d'inhalation. La majeure partie de la dose est avalée et passe par le tractus gastro-intestinal.
Après inhalation orale, le principe actif est très rapidement absorbé. La concentration plasmatique maximale est atteinte 10 à 20 minutes après l'inhalation.
La biodisponibilité systémique totale des doses orales et des doses inhalées par voie orale est estimée à 2 % et à 7– 28 %, respectivement. La portion de la dose d'ipratropium qui est avalée ne contribue donc pas de manière pertinente à l'exposition systémique.
Distribution
Les paramètres pharmacocinétiques du principe actif ont été calculés sur la base des taux plasmatiques après administration intraveineuse. Les taux plasmatiques de bromure d'ipratropium ont révélé une diminution rapide et une évolution biphasique. Le volume de distribution (Vz) est de 338 L (correspondant à ± 4,6 L/kg). Le taux de liaison plasmatique de l'ipratropium est faible (moins de 20 %). Les données non cliniques indiquent que l'amine quaternaire d'ipratropium ne traverse ni la barrière placentaire ni la barrière hémato-encéphalique.
Biotransformation
Après administration intraveineuse, environ 60 % de la dose est métabolisée, dont la majeure partie probablement par oxydation dans le foie.
Les métabolites connus, formés par hydrolyse, déshydratation ou élimination du groupe hydroxy-méthyle dans le groupe fonctionnel de l'acide tropique, présentent une affinité très faible ou nulle pour le récepteur muscarinique et doivent être considérés comme non actifs.
Élimination
La demi-vie de la phase d'élimination terminale est d'environ 1,6 heure. La clairance totale du principe actif est de 2,3 L/minute. Environ 40 % de la clairance est rénale (0,9 L/minute). Après inhalation de bromure d'ipratropium aérosol, la clairance rénale cumulée du bromure d'ipratropium sur 24 heures était d'environ 12 %.
5.3. Données de sécurité préclinique
Chlorure de sodium, acide chlorhydrique pour ajustement du pH, eau pour préparations injectables.
2 ans
6.4. Précautions particulières de conservation
A conserver à une température ne dépassant pas 25°C.
A conserver dans l'emballage extérieur, à l'abri de la lumière.
Ne pas mettre au réfrigérateur, ne pas congeler.
Utiliser le contenu d'une ampoule d'IPRATROPIUM TEVA immédiatement après ouverture. Ne jamais utiliser une ampoule déjà ouverte ou contenant une solution décolorée ou trouble. Jeter toute ampoule d'IPRATROPIUM TEVA partiellement utilisée, ouverte ou endommagée.
6.5. Nature et contenu de l'emballage extérieur
Ampoules transparentes (PEBD) à embout sécable contenant 1 ml de solution pour inhalation par nébuliseur, conditionnées en sachet de 5 ampoules.
Boîtes de 5, 10, 15, 20, 25, 30, 40, 50 et 60 ampoules.
Toutes les présentations peuvent ne pas être commercialisées.
6.6. Précautions particulières d’élimination et de manipulation
Une fois l'inhalation terminée, la solution inutilisée restant dans la cuve doit être jetée et le nébuliseur doit être nettoyé conformément au mode d'emploi.
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
100-110, Esplanade du Général de Gaulle
92931 Paris La Défense cedex
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 389 396 1 3: 1 ml en récipient unidose (PEBD). Boîte de 5 ampoules.
· 34009 389 397 8 1: 1 ml en récipient unidose (PEBD). Boîte de 10 ampoules.
· 34009 389 398 4 2: 1 ml en récipient unidose (PEBD). Boîte de 15 ampoules.
· 34009 385 233 0 0: 1 ml en récipient unidose (PEBD). Boîte de 20 ampoules.
· 34009 389 399 0 3: 1 ml en récipient unidose (PEBD). Boîte de 25 ampoules.
· 34009 389 400 9 1: 1 ml en récipient unidose (PEBD). Boîte de 30 ampoules.
· 34009 389 401 5 2: 1 ml en récipient unidose (PEBD). Boîte de 40 ampoules.
· 34009 389 402 1 3: 1 ml en récipient unidose (PEBD). Boîte de 50 ampoules.
· 34009 389 403 8 1: 1 ml en récipient unidose (PEBD). Boîte de 60 ampoules.
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Liste I
Médicament à prescription réservée aux spécialistes en pneumologie ou en pédiatrie.
Médicament pouvant être administré par tout médecin intervenant en situation d'urgence ou dans le cadre d'une structure d'assistance médicale mobile ou de rapatriement sanitaire (article R.5143-5-8 du code de la santé publique).
ANSM - Mis à jour le : 05/01/2024
Ipratropium TEVA 0,25 mg/1 ml ENFANTS, solution pour inhalation par nébuliseur en récipient unidose
Bromure d’ipratropium
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin ou votre pharmacien.
· Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d’autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou à votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
1. Qu'est-ce que Ipratropium TEVA 0,25 mg/1 ml ENFANTS, solution pour inhalation par nébuliseur en récipient unidose et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant d'utiliser Ipratropium TEVA 0,25 mg/1 ml ENFANTS, solution pour inhalation par nébuliseur en récipient unidose ?
3. Comment utiliser Ipratropium TEVA 0,25 mg/1 ml ENFANTS, solution pour inhalation par nébuliseur en récipient unidose ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver Ipratropium TEVA 0,25 mg/1 ml ENFANTS, solution pour inhalation par nébuliseur en récipient unidose ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE Ipratropium TEVA 0,25 mg/1 ml ENFANTS, solution pour inhalation par nébuliseur en récipient unidose ET DANS QUELS CAS EST-IL UTILISE ?
IPRATROPIUM TEVA peut être utilisé simultanément avec un autre type de médicament appartenant à la classe des bronchodilatateurs bêta 2-agonistes inhalés.
Le bromure d'ipratropium appartient à la catégorie des bronchodilatateurs anticholinergiques. Après administration par inhalation, le bromure d'ipratropium exerce un effet dilatateur au niveau des bronches.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D’UTILISER Ipratropium TEVA 0,25 mg/1 ml ENFANTS, solution pour inhalation par nébuliseur en récipient unidose ?
· si vous êtes allergique au bromure d'ipratropium ou à des substances similaires à l'ipratropium telles que l'atropine, ou à l’un des autres composants contenus dans ce médicament, mentionnés dans la rubrique 6.
Avertissements et précautions
Adressez-vous à votre médecin ou à votre pharmacien avant d’utiliser IPRATROPIUM TEVA.
· si vous présentez un glaucome par fermeture de l'angle ou si l'on vous a informé que vous pourriez en développer un.
· si vous présentez un adénome de la prostate.
· si vous présentez un rétrécissement urétral (canal de la vessie).
· si vous présentez des réactions allergiques après avoir utilisé ce médicament, telles que : éruption cutanée à type d'urticaire associée à des démangeaisons, angio-œdème (gonflement soudain au niveau de la gorge et de la langue entraînant des difficultés respiratoires) ou gêne respiratoire par constriction au niveau des bronches, vous devez arrêter immédiatement d'utiliser ce médicament et consulter immédiatement votre médecin, car cela pourrait mettre votre vie en danger.
· si vous présentez une fibrose kystique. En cas d’utilisation d’anticholinergiques (bromure d’ipratropium), vous pouvez être plus sensible aux troubles gastro-intestinaux.
· si vous souffrez d'une maladie cardiaque.
Lors de l'administration d'IPRATROPIUM TEVA prenez soin d'éviter toute projection de liquide ou de brumisat dans les yeux. Si cela se produit, rincez immédiatement vos yeux à l'eau froide du robinet pendant plusieurs minutes. Il est préférable d'inhaler la solution nébulisée d'ipratropium par l'intermédiaire d'un embout buccal. Un masque d'inhalation peut également être utilisé, à condition d'être correctement ajusté. De rares problèmes oculaires ont été rapportés, à la suite de projection dans les yeux.
En cas d'apparition des symptômes suivants après inhalation d'IPRATROPIUM TEVA consulter immédiatement un médecin : douleur ou gêne oculaire, vision trouble, perception visuelle d'anneaux ou d'images colorés associés à une rougeur conjonctivale, pouvant indiquer une augmentation aiguë de la pression intraoculaire (glaucome).
Les patients exposés au risque de glaucome aigu (augmentation de la pression intraoculaire) doivent se protéger les yeux au cours de la nébulisation d'IPRATROPIUM TEVA.
Si l'utilisation d'IPRATROPIUM TEVA n'apporte pas de nette amélioration ou si les symptômes s'aggravent, consulter votre médecin.
Autres médicaments et IPRATROPIUM TEVA 0,25 mg/1 ml ENFANTS, solution pour inhalation par nébuliseur en récipient unidose
Informez votre médecin ou votre pharmacien si vous prenez, avez récemment pris ou pourriez prendre tout autre médicament.
Certains bronchodilateurs (appelés bêta-mimétiques, tels que le salbutamol ou les xanthines) peuvent augmenter l’effet d’IPRATROPIUM TEVA.
IPRATROPIUM TEVA peut être administré en même temps que d'autres médicaments fréquemment utilisés pour le traitement de certaines maladies pulmonaires (bronchite, asthme) (bêta 2-sympathomimétiques, dérivés de la xanthine, par exemple théophylline et stéroïdes).
IPRATROPIUM TEVA et d'autres solutions destinées à la nébulisation contenant le conservateur chlorure de benzalkonium ne doivent PAS être mélangés dans la même nébulisation. Un dépôt peut se former.
Si vous présentez des antécédents d'augmentation de la pression intraoculaire (glaucome), le risque peut être accru lorsque le bromure d'ipratropium et les bêta 2-sympathomimétiques sont co-administrés par l'intermédiaire d'un nébuliseur. Le risque peut être réduit en administrant les médicaments séparément ou en portant des lunettes bien ajustées au cours de la nébulisation.
IPRATROPIUM TEVA 0,25 mg/1 ml ENFANTS, solution pour inhalation par nébuliseur en récipient unidose avec des aliments et des boissons
Il n'y a pas d'interaction connue à ce jour.
Grossesse et allaitement
Si vous êtes enceinte ou que vous allaitez, si vous pensez être enceinte ou planifiez une grossesse, demandez conseil à votre médecin ou à votre pharmacien avant d’utiliser ce médicament.
Les données disponibles sont insuffisantes pour établir si l'IPRATROPIUM TEVA est nocif pendant la grossesse. N'utilisez IPRATROPIUM TEVA que s'il vous a été prescrit par votre médecin.
Il n'existe pas de données sur le passage d’IPRATROPIUM TEVA dans le lait maternel. Les données expérimentales mettent en évidence un passage de l'ipratropium dans le lait maternel en quantité très faible. Il est peu probable qu'une grande quantité d'IPRATROPIUM TEVA soit excrétée dans le lait maternel. En conséquence, l'IPRATROPIUM TEVA ne sera utilisé qu'avec prudence pendant l'allaitement.
Conduite de véhicules et utilisation de machines
Le bromure d'ipratropium ne semble pas avoir d'influence sur l'aptitude à conduire des véhicules et à utiliser des machines. L'attention des conducteurs de véhicules et des utilisateurs de machines est attirée sur le risque de survenue de vertiges et/ou de problèmes oculaires tels que la dilatation des pupilles, la difficulté à faire la mise au point du cristallin (trouble de l'accommodation) et la vision trouble. Soyez prudent(e) jusqu'à ce que vous sachiez comment vous réagissez à IPRATROPIUM TEVA.
IPRATROPIUM TEVA 0,25 mg/1 ml ENFANTS, solution pour inhalation par nébuliseur en récipient unidose contient
Sans objet.
3. COMMENT UTILISER Ipratropium TEVA 0,25 mg/1 ml ENFANTS, solution pour inhalation par nébuliseur en récipient unidose ?
Chez les adultes (y compris les personnes âgées), la dose recommandée est de 0,25 à 0,50 mg trois à quatre fois par jour. Les doses quotidiennes supérieures à 2 mg (4 x 0,50 mg) doivent être administrées sous surveillance médicale.
La dose recommandée pour le traitement de l'obstruction aiguë des voies aériennes est de 0,50 mg, administrée jusqu'à la stabilisation de l'état clinique du patient. L'intervalle entre les inhalations sera déterminé par votre médecin.
Utilisation chez les enfants et les adolescents
Adolescents
0,25 à 0,50 mg trois à quatre fois par jour. Les doses quotidiennes supérieures à 2 mg (4 x 0,50 mg) doivent être administrées sous surveillance médicale.
La dose recommandée pour le traitement de l'obstruction aiguë des voies aériennes est de 0,50 mg, administrée jusqu'à la stabilisation de l'état clinique du patient. L'intervalle entre les inhalations sera déterminé par votre médecin.
Enfants de 6 à 12 ans
1 ampoule de 0,25 mg, jusqu'à une dose quotidienne de 1 mg (4 ampoules de 0,25 mg). L'intervalle entre les inhalations sera déterminé par votre médecin.
Chez les enfants, ce médicament doit être administré sous la surveillance d’un adulte responsable.
Enfants de moins de 5 ans
IPRATROPIUM TEVA est administré sous surveillance médicale uniquement, comme suit :
0,125 à 0,250 mg (soit une demie à une ampoule de 0,25 mg/1 ml) jusqu'à une dose quotidienne totale de 1 mg (4 x 0,25 mg), pour le traitement d'une crise aiguë d'asthme uniquement. Chez les enfants de moins de 5 ans, les inhalations d’IPRATROPIUM TEVA doivent être espacées d'au moins 6 heures.
IPRATROPIUM TEVA doit impérativement être administré au moyen d'un nébuliseur ; il ne doit pas être avalé ni administré par injection. Le nébuliseur transforme la solution en fines gouttelettes, que vous pouvez alors inhaler. Avant utilisation et avant d'ouvrir l'ampoule d’IPRATROPIUM TEVA, lire attentivement le mode d'emploi du nébuliseur, afin de se familiariser avec son utilisation.
Si vous avez l'impression que l'effet d'IPRATROPIUM TEVA est trop fort ou trop faible, consultez votre médecin ou votre pharmacien.
Pour toute autre question supplémentaire sur l'utilisation de ce produit, demandez conseil à votre médecin ou à votre pharmacien.
Instructions d’utilisation
IPRATROPIUM TEVA peut être inhalé sous forme non diluée ou diluée dans du sérum physiologique à l'aide d'un nébuliseur. Le volume de sérum physiologique dépend de l'appareil utilisé. Respectez les instructions de votre médecin concernant la dilution d'IPRATROPIUM TEVA.
N'utilisez l'IPRATROPIUM TEVA que si la dose qui vous a été prescrite correspond au volume total des ampoules, c'est-à-dire à 1 ou 2 ampoules de 0,25 mg (un total de 1 ou 2 ml) ou 1 ampoule de 0,50 mg (soit 2 ml). La procédure à suivre est la suivante :
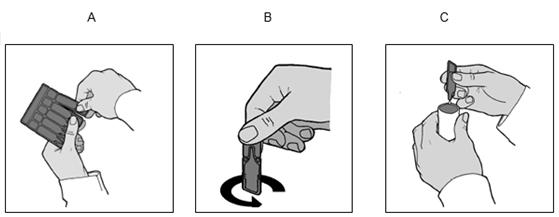
1. Assurez-vous que le nébuliseur est prêt à l'emploi.
2. Détachez une ampoule en opérant un mouvement de torsion et de traction (Schéma A).
3. Tenez l'ampoule verticale (embout vers le haut) et détachez l'embout par torsion (Schéma B).
4. Remplissez la cuve du nébuliseur comme indiqué sur le Schéma C.
5. Utilisez le nébuliseur conformément aux instructions du fabricant, car la dose délivrée peut varier d'un système à un autre ; la durée totale d'administration est comprise entre 5 et 15 minutes.
6. Une fois la séance de nébulisation terminée, la solution non utilisée restant dans la cuve doit être jetée et l'appareil doit être nettoyé conformément aux instructions du fabricant.
Si vous avez utilisé plus d’IPRATROPIUM TEVA 0,25 mg/1 ml ENFANTS, solution pour inhalation par nébuliseur en récipient unidose que vous n’auriez dû
Si vous avez utilisé ou pris trop de bromure d'ipratropium, contactez immédiatement votre médecin ou votre pharmacien. Un surdosage peut entraîner une sécheresse de la bouche ou une accélération du rythme cardiaque. Ces symptômes ne présentent absolument pas de danger. Un surdosage important peut se traduire par une accélération de la respiration, une fièvre élevée, une agitation, une confusion et des hallucinations, ainsi qu'une accélération du rythme cardiaque. En cas de surdosage important, consultez un médecin.
Si vous oubliez d’utiliser IPRATROPIUM TEVA 0,25 mg/1 ml ENFANTS, solution pour inhalation par nébuliseur en récipient unidose
Ne prenez pas de dose double pour compenser la dose que vous avez oublié de prendre. Prenez la dose au moment où vous vous apercevez de votre oubli, sauf s'il est presque l'heure de l'inhalation suivante. Dans ce dernier cas, ne prenez pas l'inhalation oubliée, mais poursuivez votre traitement normalement, comme prescrit par votre médecin. En cas de doute, demandez conseil à votre médecin ou à votre pharmacien.
Si vous arrêtez d’utiliser IPRATROPIUM TEVA 0,25 mg/1 ml ENFANTS, solution pour inhalation par nébuliseur en récipient unidose
L'arrêt du bromure d'ipratropium peut conduire à la réapparition des symptômes initiaux. N'arrêtez pas brutalement les inhalations d'IPRATROPIUM TEVA, sans avoir consulté votre médecin au préalable.
Si vous avez d’autres questions sur l’utilisation de ce médicament, demandez plus d’informations à votre médecin ou à votre pharmacien.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Fréquent : peut affecter moins d’1 personne sur 10
· Maux de tête, vertiges.
· Sécheresse de la bouche, nausées, douleur ou sensation d’inconfort au niveau de l’estomac.
· Toux et irritation de la gorge.
Peu fréquent : peut affecter moins d’1 personne sur 100
· Réactions allergiques et réactions allergiques sévères (anaphylaxie) : les signes peuvent inclure des éruptions et démangeaisons cutanées, un gonflement de la bouche et du visage, des difficultés soudaines à respirer, une baisse de la pression artérielle, une sensation d’oppression au niveau de la gorge.
· Vision trouble, pupilles dilatées (mydriase), augmentation de la pression dans l’œil (glaucome) (voir également « Avertissements et précautions »), douleur, rougeur ou gonflement oculaire (hyperémie conjonctivale), perception d’images colorées ou de lumières (halo visuel) et accumulation de liquide dans la cornée (œdème cornéen).
· Palpitations (battements cardiaques rapides ou irréguliers) ou accélération de la fréquence cardiaque (tachycardie supraventriculaire).
· Oppression inattendue du thorax (bronchospasme), spasme des cordes vocales (laryngospasme), gonflement de la gorge (œdème pharyngé), gorge sèche.
· Vomissements, constipation ou diarrhée.
· Gonflement de la bouche (œdème buccal), plaies dans la bouche ou sur les lèvres, altération du goût.
· Démangeaisons, éruptions cutanées.
· Difficultés pour uriner, en particulier si vous avez déjà eu ce type de problème.
Rare : peut affecter moins de 1 personne sur 1000
· Difficulté à faire la mise au point du cristallin (trouble de l'accommodation).
· Augmentation de la fréquence cardiaque (tachycardie), irrégularité du rythme cardiaque telle que fibrillation auriculaire.
· Urticaire.
Toute projection accidentelle de liquide ou de brumisat dans les yeux peut engendrer des douleurs, picotements ou rougeurs des yeux, une dilatation des pupilles, une vision trouble ou la perception d’images colorées ou de lumières. Si cela se produit, rincez immédiatement vos yeux à l'eau froide du robinet pendant plusieurs minutes et demandez conseil à votre médecin. Ne conduisez pas et n’utilisez pas d’outils ou de machines. Si vous avez des problèmes oculaires à n’importe quel autre moment, demandez conseil à votre médecin.
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou à votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER Ipratropium TEVA 0,25 mg/1 ml ENFANTS, solution pour inhalation par nébuliseur en récipient unidose ?
Tenir ce médicament hors de la vue et de la portée des enfants.
N’utilisez pas ce médicament après la date de péremption indiquée sur l’emballage après EXP. La date de péremption fait référence au dernier jour de ce mois.
A conserver à une température ne dépassant pas 25°C.
A conserver dans l'emballage extérieur, à l'abri de la lumière.
Ne pas mettre au réfrigérateur, ne pas congeler.
Utiliser le contenu d'une ampoule d'IPRATROPIUM TEVA immédiatement après ouverture. Ne jamais utiliser une ampoule déjà ouverte ou contenant une solution décolorée ou trouble. Jeter toute ampoule d'IPRATROPIUM TEVA partiellement utilisée, ouverte ou endommagée.
Procéder à une vérification visuelle du mélange avant utilisation, en cas de décoloration ou de solution trouble, jetez la solution et préparez un nouveau mélange.
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
· La substance active est :
Bromure d'ipratropium anhydre.................................................................................... 0,250 mg
Sous forme de bromure d'ipratropium monohydraté..................................................... 0,261 mg
Pour chaque récipient unidose de 1 ml.
· Les autres composants sont :
Chlorure de sodium, acide chlorhydrique, eau pour préparations injectables.
IPRATROPIUM TEVA se présente sous forme d'une solution pour inhalation, incolore et transparente.
Ampoules transparentes (PEBD) à embout sécable contenant 1 ml de solution pour inhalation par nébuliseur, conditionnées en sachet de 5 ampoules. Boîte de 5, 10, 15, 20, 25, 30, 40, 50 ou 60 ampoules.
Toutes les présentations peuvent ne pas être commercialisées.
Titulaire de l’autorisation de mise sur le marché
100-110, Esplanade du Général de Gaulle
92931 Paris La Défense cedex
FRANCE
Exploitant de l’autorisation de mise sur le marché
100-110, Esplanade du Général de Gaulle
92931 Paris La Défense cedex
FRANCE
Ludwig-Merckle-Str. 3
89143 Blaubeuren
ALLEMAGNE
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Ce médicament est autorisé dans les Etats membres de l'Espace Economique Européen sous les noms suivants : Conformément à la réglementation en vigueur.
[À compléter ultérieurement par le titulaire]
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).