Dernière mise à jour le 08/01/2026
LIRAGLUTIDE SUN 6 mg/mL, solution injectable en stylo prérempli
Indications thérapeutiques
Classe pharmacothérapeutique : médicaments utilisés dans le diabète, analogue du glucagon-like peptide 1 (GLP-1) - code ATC : A10BJ02
LIRAGLUTIDE SUN est utilisé seul si votre taux de sucre dans le sang n’est pas contrôlé de manière adéquate par le régime alimentaire et l’exercice physique seuls, et que vous ne pouvez pas utiliser la metformine (autre médicament antidiabétique).
LIRAGLUTIDE SUN est utilisé en association avec d’autres médicaments pour traiter le diabète lorsque ceux-ci ne suffisent pas à contrôler votre taux de sucre dans le sang. Ces médicaments peuvent être :
· des antidiabétiques oraux (tels que la metformine, la pioglitazone, les sulfamides hypoglycémiants ou les inhibiteurs du co-transporteur de sodium-glucose de type 2 (iSGLT2)) et/ou une insuline.
Présentations
> 2 cartouches en verre dans stylo pré-rempli de 3 mL
Code CIP : 34009 303 111 8 9
Déclaration de commercialisation : 16/12/2025
Cette présentation n'est pas agréée aux collectivités
Service médical rendu (SMR)
Amélioration du service médical rendu (ASMR)
Ce médicament étant un générique, l'ASMR n'a pas été évalué par la commission de la transparence (CT), il est possible de se référer à la /aux spécialité(s) de référence du groupe générique auquel appartient ce médicament (cliquez ici pour aller à la rubrique des groupes génériques)
ANSM - Mis à jour le : 17/07/2025
LIRAGLUTIDE SUN 6 mg/mL, solution injectable en stylo prérempli
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
1 mL de solution contient 6 mg de liraglutide*. Un stylo prérempli de 3 mL contient 18 mg de liraglutide.
* analogue du glucagon-lke peptide-1 (GLP-1) humain, produit par un peptide synthétisé chimiquement.
Pour la liste complète des excipients, voir rubrique 6.1.
Solution injectable en stylo prérempli (solution injectable)
Solution claire et incolore, exempte de particules visibles.
Le pH est compris entre 7,5 et 8,5.
4.1. Indications thérapeutiques
· en monothérapie, quand l’utilisation de la metformine est considérée comme inappropriée en raison d’une intolérance ou d’une contre-indication
· en association avec d'autres médicaments destinés au traitement du diabète.
Pour les résultats des études concernant les associations, les effets sur le contrôle glycémique et les évènements cardiovasculaires, ainsi que sur les populations étudiées, voir les rubriques 4.4, 4.5 et 5.1.
4.2. Posologie et mode d'administration
Afin d’améliorer la tolérance gastro-intestinale, le liraglutide sera initié à la dose de 0,6 mg par jour. Après au moins une semaine de traitement, la dose devra être augmentée à 1,2 mg. En fonction de la réponse clinique, après au moins une semaine de traitement, certains patients pourront être amenés à bénéficier d’une augmentation de la dose de 1,2 mg à 1,8 mg afin d’obtenir un meilleur contrôle glycémique. Une dose quotidienne supérieure à 1,8 mg n’est pas recommandée.
Lorsque LIRAGLUTIDE SUN est ajouté à un sulfamide hypoglycémiant ou à une insuline, une diminution de la dose du sulfamide hypoglycémiant ou de l’insuline devra être envisagée afin de réduire le risque d’hypoglycémie (voir rubrique 4.4). L’association à un sulfamide hypoglycémiant n'est valable que pour les patients adultes.
Une autosurveillance glycémique n’est pas nécessaire pour ajuster la dose de LIRAGLUTIDE SUN. Une autosurveillance glycémique est nécessaire pour ajuster la dose de sulfamide hypoglycémiant ou d’insuline, notamment lors de l’instauration du traitement par LIRAGLUTIDE SUN et de la réduction de l’insuline. L’adoption d’une approche par étapes de la réduction de la dose d’insuline est recommandée.
Populations particulières
Sujets âgés (> 65 ans)
Aucun ajustement de la dose n’est nécessaire en fonction de l’âge (voir rubrique 5.2).
Insuffisance rénale
Aucun ajustement de la dose n’est nécessaire chez les patients présentant une insuffisance rénale légère, modérée ou sévère. Il n’y a pas d’expérience clinique de ce traitement chez les patients présentant une insuffisance rénale au stade terminal. LIRAGLUTIDE SUN n’est donc pas recommandé chez ces patients (voir rubriques 5.1 et 5.2).
Insuffisance hépatique
Aucun ajustement de la dose n’est recommandé chez les patients présentant une insuffisance hépatique légère ou modérée. LIRAGLUTIDE SUN n’est pas recommandé chez les patients présentant une insuffisance hépatique sévère (voir rubrique 5.2).
Population pédiatrique
Aucun ajustement de la dose n'est nécessaire chez les adolescents et les enfants âgés de 10 ans et plus. Aucune donnée n’est disponible chez les enfants de moins de 10 ans (voir rubriques 5.1 et 5.2).
Mode d’administration
LIRAGLUTIDE SUN ne doit pas être administré par voie intraveineuse ou intramusculaire.
LIRAGLUTIDE SUN doit être administré une fois par jour, quel que soit le moment de la journée, indépendamment des repas. LIRAGLUTIDE SUN peut être injecté par voie sous-cutanée dans l’abdomen, la cuisse ou le haut du bras.
Le site d’injection et le moment de l’injection peuvent être modifiés sans ajustement de la dose. Toutefois, il est préférable d’effectuer les injections de LIRAGLUTIDE SUN à peu près au même moment de la journée, après avoir choisi l’heure la plus adaptée. Les sites d’injection doivent toujours être alternés afin de réduire le risque de dépôts amyloïdes au site d’injection (voir rubrique 4.8).
Pour les instructions plus détaillées concernant l’administration, voir la rubrique 6.6.
Hypersensibilité à la substance active ou à l’un des excipients mentionnés à la rubrique 6.1.
4.4. Mises en garde spéciales et précautions d'emploi
Le liraglutide ne peut pas se substituer à l’insuline. Des cas d’acidocétose diabétique ont été rapportés chez des patients insulino-dépendants après une interruption rapide de la prise d’insuline ou une réduction rapide de la dose d’insuline (voir rubrique 4.2).
Il n’y a pas d’expérience thérapeutique chez les patients présentant une insuffisance cardiaque congestive de classe IV New York Heart Association (NYHA), le liraglutide n’est donc pas recommandée chez ces patients.
L’expérience chez les patients présentant une maladie inflammatoire de l’intestin et une gastroparésie diabétique est limitée. L’utilisation du liraglutide n’est pas recommandée chez ces patients puisqu’elle est associée à des réactions indésirables gastro-intestinales passagères telles que nausées, vomissements et diarrhées.
Aspiration en association avec une anesthésie générale ou une sédation profonde
Des cas d'aspiration pulmonaire ont été signalés chez des patients recevant des agonistes des récepteurs du GLP-1 subissant une anesthésie générale ou une sédation profonde. Par conséquent, le risque accru de contenu gastrique résiduel en raison du retard de vidange gastrique (voir rubrique 4.8) doit être pris en considération avant de réaliser des procédures impliquant une anesthésie générale ou une sédation profonde.
Pancréatite aiguë
Des cas de pancréatites aiguës ont été observés lors de l’utilisation d’agonistes des récepteurs du GLP-1. Les patients doivent être informés des symptômes caractéristiques de la pancréatite aiguë. En cas de suspicion de pancréatite, le liraglutide devra être arrêté ; si une pancréatite aiguë est confirmée, le liraglutide ne devra pas être réadministré (voir rubriques 4.8 et 5.1).
Maladie thyroïdienne
Des effets indésirables thyroïdiens, comme un goitre, ont été rapportés dans les essais cliniques et en particulier chez les patients présentant une maladie thyroïdienne préexistante. Le liraglutide doit donc être utilisé avec précaution chez ces patients.
Hypoglycémie
Les patients traités par le liraglutide en association à un sulfamide hypoglycémiant ou à une insuline peuvent présenter une augmentation du risque d’hypoglycémie (voir rubrique 4.8). Le risque d’hypoglycémie peut être diminué en réduisant la dose du sulfamide hypoglycémiant ou de l’insuline.
Déshydratation
Des signes et des symptômes de déshydratation, incluant une insuffisance rénale et une insuffisance rénale aiguë, ont été rapportés chez des patients traités par le liraglutide. Les patients traités par le liraglutide doivent être avertis du risque potentiel de déshydratation liée aux effets indésirables gastro-intestinaux et doivent prendre des précautions pour éviter une perte hydrique.
Excipients
Ce médicament contient moins de 1 mmol (23 mg) de sodium par dose, c’est-à-dire qu’il est essentiellement « sans sodium ».
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Le léger ralentissement de la vidange gastrique observé avec le liraglutide est susceptible d’influencer l’absorption des médicaments administrés de façon concomitante par voie orale. Les études d’interaction n’ont pas mis en évidence de retard d’absorption cliniquement significatif et aucun ajustement de la dose n’est donc nécessaire. Quelques patients traités par liraglutide ont signalé au moins un épisode diarrhéique sévère. Une diarrhée peut influencer l’absorption concomitante des médicaments pris par voie orale.
Warfarine et autres dérivés de la coumarine
Aucune étude d’interaction n’a été réalisée. Une interaction cliniquement significative avec des principes actifs peu solubles ou à marge thérapeutique étroite comme la warfarine ne peut être exclue. Lors de l’initiation du traitement par le liraglutide chez les patients sous warfarine ou autres dérivés de la coumarine, il est recommandé de surveiller plus fréquemment l’INR (Rapport Normalisé International).
Paracétamol
Le liraglutide n’a pas modifié l’exposition totale au paracétamol après administration d’une dose unique de 1 000 mg. La Cmax du paracétamol a diminué de 31 % et le tmax médian a été retardé jusqu’à 15 min. Aucun ajustement de la dose n’est nécessaire en cas de prise concomitante de paracétamol.
Atorvastatine
Le liraglutide n’a pas modifié l’exposition totale à l’atorvastatine de façon cliniquement significative après administration d’une dose unique de 40 mg d’atorvastatine. Par conséquent, aucun ajustement de la dose d’atorvastatine n’est nécessaire en cas d’administration avec du liraglutide. Avec le liraglutide, la Cmax de l’atorvastatine a diminué de 38 % et le tmax médian a été retardé, passant de 1 h à 3 h.
Griséofulvine
Le liraglutide n’a pas modifié l’exposition totale à la griséofulvine après administration d’une dose unique de 500 mg de griséofulvine. La Cmax de la griséofulvine a augmenté de 37 % alors que le tmax médian n’a pas changé. Aucun ajustement de la dose de griséofulvine et des autres composés à solubilité faible et perméabilité élevée n’est nécessaire.
Digoxine
Après administration d’une dose unique de 1 mg de digoxine avec du liraglutide, l’ASC de la digoxine a été réduite de 16 % et la Cmax a diminué de 31 %. Le tmax médian de la digoxine a été retardé, passant de 1 h à 1,5 h. Ces résultats indiquent qu’aucun ajustement de la dose de la digoxine n’est nécessaire.
Lisinopril
Après administration d’une dose unique de 20 mg de lisinopril avec du liraglutide, l’ASC du lisinopril a été réduite de 15% et la Cmax a diminué de 27 %. Avec le liraglutide, le tmax médian du lisinopril a été retardé, passant de 6 h à 8 h. Ces résultats indiquent qu’aucun ajustement de la dose du lisinopril n’est nécessaire.
Contraceptifs oraux
Après administration d’une dose unique d’un contraceptif oral, le liraglutide a diminué la Cmax de l’éthinylestradiol et du lévonorgestrel de 12 et 13 % respectivement.
Pour les deux composés, le tmax a été retardé de 1,5 h avec le liraglutide. Aucun effet cliniquement significatif sur l’exposition totale à l’éthinylestradiol et au lévonorgestrel n’a été observé. Il n’est pas attendu de modification de l’effet contraceptif lors d’une administration concomitante avec le liraglutide.
Insuline
Aucune interaction pharmacocinétique ou pharmacodynamique n’a été observée entre le liraglutide et l’insuline détémir lors de l’administration d’une dose unique de 0,5 U/kg d’insuline détémir avec 1,8 mg de liraglutide à l’état d’équilibre chez des patients diabétiques de type 2.
Population pédiatrique
Les études d’interaction n’ont été réalisées que chez l’adulte.
4.6. Fertilité, grossesse et allaitement
Grossesse
Il n’existe pas de données suffisamment pertinentes concernant l’utilisation du liraglutide chez la femme enceinte. Les études effectuées chez l’animal ont mis en évidence une toxicité sur la reproduction (voir rubrique 5.3). Le risque potentiel chez l’espèce humaine n’est pas connu.
Le liraglutide ne doit pas être utilisé pendant la grossesse, période durant laquelle il est recommandé d’utiliser de l’insuline. En cas de projet de grossesse ou en cas de grossesse, le traitement par LIRAGLUTIDE SUN devra être interrompu.
On ne sait pas si le liraglutide est excrété dans le lait maternel. Les études effectuées chez l’animal ont montré que le liraglutide et les métabolites à forte homologie structurelle étaient peu transférés dans le lait. Des études non cliniques réalisées chez de jeunes rats allaités ont mis en évidence un ralentissement de la croissance néonatale lié au traitement (voir rubrique 5.3). En raison du manque d’expérience, LIRAGLUTIDE SUN ne devra pas être utilisé pendant l’allaitement.
Fertilité
Hormis une légère diminution du nombre d'embryons vivants, les études effectuées chez l’animal n’ont pas mis en évidence d’effets délétères sur la fertilité.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Les patients doivent être informés des précautions à prendre pour éviter une hypoglycémie lors de la conduite de véhicules ou l’utilisation de machines, en particulier lorsque LIRAGLUTIDE SUN est utilisé en association à un sulfamide hypoglycémiant ou à une insuline.
Résumé du profil de sécurité
Dans cinq essais cliniques de phase 3a de grande envergure et menés sur le long terme, plus de 2 500 patients adultes ont été traités, soit par liraglutide seul, soit par liraglutide en association à la metformine, à un sulfamide hypoglycémiant (avec ou sans metformine) ou à la metformine associée à la rosiglitazone.
Les réactions indésirables les plus fréquemment observées pendant les essais cliniques étaient les affections gastro-intestinales : les nausées et les diarrhées étaient très fréquentes, alors que les vomissements, la constipation, les douleurs abdominales et la dyspepsie étaient fréquents. Ces réactions indésirables gastro-intestinales peuvent survenir plus fréquemment en début de traitement. Ces réactions s’atténuent généralement en quelques jours ou quelques semaines avec la poursuite du traitement. Les céphalées et les rhinopharyngites étaient fréquentes également. De plus, les hypoglycémies étaient fréquentes, voire très fréquentes lorsque le liraglutide était associé à un sulfamide hypoglycémiant. Les cas d’hypoglycémie sévère ont principalement été observés en cas d’association à un sulfamide hypoglycémiant.
Liste tabulée des réactions indésirables
Le tableau 1 répertorie les réactions indésirables reportées lors des essais de phase 3a contrôlés à long terme, de l’essai LEADER (un essai cardiovasculaire à long terme) et les réactions indésirables rapportées spontanément (après commercialisation). La fréquence de tous les évènements a été calculée sur la base de leur incidence lors des essais cliniques de phase 3a.
Les fréquences sont définies de la manière suivante : très fréquent (≥ 1/10) ; fréquent (≥ 1/100, < 1/10) ; peu fréquent (≥ 1/1 000, < 1/100) ; rare (≥ 1/10 000, < 1/1 000) ; très rare (< 1/10 000) ; fréquence indéterminée (ne peut être estimée sur la base des données disponibles). Au sein de chaque groupe de fréquence, les réactions indésirables sont présentées suivant un ordre décroissant de gravité.
Tableau 1 : Réactions indésirables lors des essais de phase 3a contrôlés à long terme, de l’essai LEADER (essai cardiovasculaire à long terme) et réactions indésirables rapportées spontanément (après commercialisation)
|
Classes de systèmes d’organes MedDRA |
Très fréquent |
Fréquent |
Peu fréquent |
Rare |
Très rare |
Fréquence indeterminée |
|
Infections et infestations |
Rhinopharyngite Bronchite |
|
||||
|
Affections du système immunitaire |
Réactions anaphylactiques |
|
||||
|
Troubles du métabolisme et de la nutrition |
Hypoglycémie Anorexie Diminution de l’appétit |
Déshydratation |
|
|||
|
Affections du système nerveux |
Céphalées Vertiges |
Dysgeusie |
|
|||
|
Affections cardiaques |
Augmentation de la fréquence cardiaque |
|
||||
|
Affections gastro-intestinales |
Nausées Diarrhées |
Vomissements Dyspepsie Douleur abdominale haute Constipation Gastrite Flatulences Distension abdominale Reflux gastro-œsophagien Gêne abdominale Mal de dents |
Ralentissement de la vidange gastrique |
Obstruction intestinale |
Pancréatite (y compris pancréatite nécrosante) |
|
|
Affections hépatobiliaires |
Lithiase biliaire Cholécystite |
|
||||
|
Affections de la peau et du tissu sous-cutané |
Rash |
Urticaire Prurit |
Amyloïdose cutanée |
|||
|
Affections du rein et des voies urinaires |
Insuffisance rénale Insuffisance rénale aiguë |
|
||||
|
Troubles généraux et anomalies au site d’administration |
Fatigue Réactions au site d’injection |
Malaise |
|
|||
|
Investigations |
Lipase augmentée* Amylase augmentée* |
|
*Issu des essais cliniques contrôlés de phases 3b et 4, uniquement lorsque ces taux ont été mesurés.
Description de certaines réactions indésirables
Lors d’un essai clinique réalisé avec le liraglutide en monothérapie, le taux d’hypoglycémies observées avec le liraglutide était inférieur à celui rapporté pour les patients traités par le comparateur actif (glimépiride). Les réactions indésirables le plus fréquemment observées étaient les affections gastro-intestinales, les infections et les infestations.
Hypoglycémie
La plupart des épisodes d’hypoglycémie confirmée observés au cours des essais cliniques étaient mineurs. Aucun épisode d’hypoglycémie sévère n’a été observé durant l’essai réalisé avec le liraglutide utilisé en monothérapie. Les hypoglycémies sévères peuvent survenir peu fréquemment avec le liraglutide et ont principalement été observées lorsque le liraglutide était associé à un sulfamide hypoglycémiant (0,02 événement/patient-année). Quelques rares épisodes d’hypoglycémie (0,001 événement/patient-année) ont été observés lors de l’administration du liraglutide en association à des antidiabétiques oraux autres que les sulfamides hypoglycémiants. Le risque d’hypoglycémie est faible lorsque le liraglutide est utilisé en association à l’insuline basale (1,0 événement/patient-année, voir rubrique 5.1). Au cours de l’essai LEADER, les épisodes d’hypoglycémie sévère ont été rapportés à un taux plus faible avec le liraglutide par rapport au placebo (1,0 vs 1,5 évènements pour 100 patients-années ; taux estimé de ratio à 0,69 [0,51 à 0,93]) (voir rubrique 5.1). Pour les patients traités par insuline prémélangée à l’inclusion et pendant au moins les 26 semaines suivantes, le taux d’hypoglycémie sévère pour le liraglutide et le placebo était de 2,2 évènements pour 100 patients-années.
Réactions indésirables gastro-intestinales
Lorsque le liraglutide était associé à la metformine, 20,7 % des patients ont rapporté au moins un épisode nauséeux et 12,6 % des patients au moins un épisode diarrhéique. Lorsque le liraglutide était associé à un sulfamide hypoglycémiant, 9,1 % des patients ont rapporté au moins un épisode nauséeux et 7,9 % des patients au moins un épisode diarrhéique. La plupart de ces épisodes étaient d’intensité légère à modérée et dose-dépendants. Chez la plupart des patients ayant initialement présenté des nausées, la fréquence et l’intensité de celles-ci ont diminué avec la poursuite du traitement.
Les patients > 70 ans peuvent être davantage sujets aux effets indésirables gastro-intestinaux lorsqu’ils sont traités par le liraglutide.
Les patients présentant une insuffisance rénale légère et modérée (clairance de la créatinine de 60 à 90 mL/min et de 30 à 59 mL/min, respectivement) peuvent être plus sujets aux effets indésirables gastro-intestinaux lorsqu’ils sont traités par le liraglutide.
Lithiase biliaire et cholécystite
Peu de cas de lithiase biliaire (0,4 %) et de cholécystite (0,1 %) ont été rapportés au cours des essais cliniques de phase 3a, contrôlés, à long terme réalisés avec le liraglutide.
Dans l’essai LEADER, la fréquence de lithiase biliaire et de cholécystite était respectivement de 1,5 % et de 1,1 % pour le liraglutide et de 1,1 % et 0,7 % pour le placebo (voir rubrique 5.1).
Amyloïdose cutanée
Une amyloïdose cutanée peut apparaitre au site d’injection (Voir rubrique 4.2).
Sorties d’essai
Dans les essais contrôlés à long terme (26 semaines ou plus), l’incidence des sorties d’essai dues aux effets indésirables était de 7,8 % chez les patients traités par le liraglutide et de 3,4 % chez les patients traités par le comparateur. Chez les patients traités par le liraglutide, les réactions indésirables ayant le plus fréquemment conduit à une sortie d’essai étaient les nausées (2,8 % des patients) et les vomissements (1,5 %).
Réactions au site d’injection
Lors des essais cliniques contrôlés à long terme (26 semaines ou plus), environ 2 % des patients traités par liraglutide ont rapporté une réaction au site d’injection. Ces réactions étaient généralement de faible intensité.
Pancréatite
Peu de cas de pancréatite aiguë (< 0,2 %) ont été rapportés lors des essais cliniques de phase 3, contrôlés, à long terme réalisés avec le liraglutide. Des pancréatites ont également été rapportées après la commercialisation du médicament. Au cours de l’essai LEADER, la fréquence des pancréatites aigües confirmées par adjudication était respectivement de 0,4 % pour le liraglutide et 0,5 % pour le placebo (voir rubriques 4.4 et 5.1)
Réactions allergiques
Des réactions allergiques, notamment urticaire, rash et prurit, ont été rapportées lors de la commercialisation du liraglutide.
Quelques cas de réactions anaphylactiques associées à d’autres symptômes, tels qu’une hypotension, des palpitations, une dyspnée et des œdèmes, ont été rapportés lors de la commercialisation du liraglutide. Quelques cas (0,05 %) d’angiœdème ont été rapportés au cours des essais cliniques à long terme menés avec le liraglutide.
Population pédiatrique
Globalement, la fréquence, le type et la gravité des effets indésirables observés chez les adolescents et les enfants âgés de 10 ans et plus étaient comparables à ceux observés dans la population adulte. Le taux d'épisodes hypoglycémiques confirmés était plus élevé avec le liraglutide (0,58 événement/patient-année) par rapport au placebo (0,29 événement/patient-année). Chez les patients traités par insuline avant un épisode hypoglycémique confirmé, le taux était plus élevé avec le liraglutide (1,82 événements/patient-année) par rapport au placebo (0,91 événement/patient-année). Aucun épisode d'hypoglycémie sévère n'est survenu dans le groupe de traitement liraglutide.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/.
Des cas de surdosage, jusqu’à 40 fois (72 mg) la dose d’entretien recommandée, ont été rapportés lors des essais cliniques et lors de la commercialisation. Les événements rapportés incluaient des nausées sévères, des vomissements, une diarrhée ainsi qu’une hypoglycémie sévère.
En cas de surdosage, un traitement symptomatique approprié doit être initié en fonction des signes cliniques et des symptômes du patient. Les signes cliniques de déshydratation doivent être recherchés chez le patient et la glycémie doit être surveillée.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Mécanisme d’action
Le liraglutide est un analogue du GLP-1 présentant 97 % d’homologie avec le GLP-1 humain qui se lie et active le récepteur du GLP-1. Le récepteur du GLP-1 est la cible du GLP-1 natif, une hormone incrétine endogène qui potentialise de façon glucose-dépendante la sécrétion d’insuline par les cellules bêta du pancréas. Contrairement au GLP-1 natif, le liraglutide possède chez l’homme un profil pharmacocinétique et pharmacodynamique permettant son administration en une fois par jour. Après administration sous-cutanée, le profil d’action prolongée fait intervenir trois mécanismes : une auto-agrégation qui permet une absorption lente, une liaison à l’albumine et une stabilité accrue vis-à-vis de l’enzyme dipeptidyl peptidase-4 (DPP-4) et de l’enzyme endopeptidase neutre (EPN), ce qui se traduit par une longue demi-vie plasmatique.
L’action du liraglutide résulte d’une interaction spécifique avec les récepteurs du GLP-1, entraînant une augmentation de la formation d’AMPc (adénosine monophosphate cyclique). Le liraglutide stimule la sécrétion d’insuline de façon glucose-dépendante. Il diminue simultanément la sécrétion excessive de glucagon, également de façon glucose-dépendante. Ainsi, quand la glycémie est élevée, la sécrétion d’insuline est stimulée et la sécrétion de glucagon est inhibée. Inversement, lors d’une hypoglycémie, le liraglutide diminue la sécrétion d’insuline sans altérer la sécrétion du glucagon. Le mécanisme de diminution de la glycémie entraîne également un léger ralentissement de la vidange gastrique. Le liraglutide réduit le poids et la masse grasse par des mécanismes diminuant la sensation de faim et les apports énergétiques. Le GLP-1 est un régulateur physiologique de l’appétit et de la prise alimentaire, mais son mécanisme d’action exact n’est pas entièrement connu.
Lors des études effectuées chez l’animal, l’administration périphérique de liraglutide a entraîné une assimilation dans des régions cérébrales spécifiques impliquées dans la régulation de l’appétit. Le liraglutide, par l’activation spécifique du récepteur du GLP-1 (GLP-1R), a ainsi augmenté la satiété et diminué les principaux signaux de la faim, ce qui a entraîné une perte de poids.
Les récepteurs du GLP-1 sont également exprimés dans des régions spécifiques du cœur, du système vasculaire, du système immunitaire et des reins. Dans les modèles de souris ayant de l'athérosclérose, le liraglutide a permis de prévenir la progression de la plaque aortique et a réduit l'inflammation de la plaque. De plus, le liraglutide a eu un effet bénéfique sur les lipides plasmatiques. Le liraglutide n'a pas réduit la taille des plaques déjà établies.
Effets pharmacodynamiques
Le liraglutide a une durée d’action de 24 heures. Il améliore le contrôle glycémique des patients diabétiques de type 2 en diminuant la glycémie à jeun et la glycémie postprandiale.
Efficacité et sécurité clinique
L’amélioration du contrôle glycémique et la réduction de la morbidité et de la mortalité cardiovasculaire font, l’un et l’autre, partie intégrante du traitement du diabète de type 2.
Cinq essais cliniques de phase 3a chez l’adulte, contrôlés, randomisés, en double aveugle ont été réalisés afin d’évaluer les effets du liraglutide sur le contrôle glycémique (Tableau 2). Le traitement par le liraglutide a permis une amélioration statistiquement et cliniquement significative de l’HbA1c (hémoglobine glycosylée A1c), de la glycémie à jeun et de la glycémie postprandiale par rapport au placebo.
Ces essais ont inclus 3 978 patients diabétiques de type 2 (2 501 patients traités par le liraglutide), 53,7 % étaient des hommes et 46,3 % des femmes. 797 patients (508 traités par le liraglutide) étaient âgés ≥ 65 ans et 113 patients (66 traités par le liraglutide) étaient âgés ≥ 75 ans.
Des essais supplémentaires ont été réalisés avec le liraglutide chez 1 901 patients, dont quatre essais cliniques contrôlés, randomisés, en ouvert (incluant 464, 658, 323 et 177 patients par essai) et un essai clinique contrôlé, randomisé, en double aveugle chez des patients diabétiques de type 2 présentant une insuffisance rénale modérée (279 patients).
Un essai cardiovasculaire de grande envergure (l’essai LEADER) a également été réalisé avec le liraglutide chez 9 340 patients diabétiques de type 2 présentant un haut risque cardiovasculaire.
Contrôle glycémique
Monothérapie
À 52 semaines, le liraglutide en monothérapie a permis une diminution statistiquement significative et durable de l’HbA1c par rapport au glimépiride 8 mg (-0,84 % pour 1,2 mg, -1,14 % pour 1,8 mg vs- 0,51 % pour le comparateur) chez les patients précédemment traités soit par un régime alimentaire et de l’exercice physique, soit par un antidiabétique oral en monothérapie à une dose ne dépassant pas la moitié de la dose maximale tolérée (Tableau 2).
Association aux antidiabétiques oraux
À 26 semaines, le liraglutide en association à la metformine, au glimépiride ou à la metformine et rosiglitazone ou en association aux iSGLT2 ± metformine, a permis une diminution statistiquement significative et durable de l’HbA1c par rapport aux patients sous placebo (tableaux 2).
Tableau 2 : Essais cliniques de phase 3 avec le liraglutide en monothérapie (52 semaines) et en association avec des antidiabétiques oraux (26 semaines)
|
|
n |
HbA1c moyenne à l’inclusion (%) |
Variation de l’HbA1c moyenne par rapport à l’inclusion (%) |
Patients (%) ayant atteints une HbA1c<7% |
Poids moyen à l’inclusion (kg) |
Variation du poids moyen à l’inclusion (kg) |
|
Monothérapie |
|
|||||
|
Liraglutide 1,2 mg |
251 |
8,18 |
-0,84* |
42,81, 58,33 |
92,1 |
-2,05** |
|
Liraglutide 1,8 mg |
246 |
8,19 |
-1,14** |
50,91, 62,03 |
92,6 |
-2,45** |
|
Glimépiride 8 mg/jour |
248 |
8,23 |
-0,51 |
27,81, 30,83 |
93,3 |
1,12 |
|
En association à la metformine (2 000 mg/jour) |
|
|||||
|
Liraglutide 1,2 mg |
240 |
8,3 |
-0,97 |
35,31, 52,82 |
88,5 |
-2,58** |
|
Liraglutide 1,8 mg |
242 |
8,4 |
-1,00 |
42,41, 66,32 |
88,0 |
-2,79** |
|
Placebo |
121 |
8,4 |
0,09 |
10,81, 22,52 |
91,0 |
-1,51 |
|
Glimépiride 4 mg/jour |
242 |
8,4 |
-0,98 |
36,31, 56,02 |
89,0 |
0,95 |
|
En association au glimépiride (4 mg/jour) |
|
|||||
|
Liraglutide 1,2 mg |
228 |
8,5 |
-1,08** |
34,51, 57,42 |
80,0 |
0,32** |
|
Liraglutide 1,8 mg |
234 |
8,5 |
-1,13** |
41,61, 55,92 |
83,0 |
-0,23** |
|
Placebo |
114 |
8,4 |
0,23 |
7,51, 11,82 |
81,9 |
-0,10 |
|
Rosiglitazone 4 mg/jour |
231 |
8,4 |
-0,44 |
21,91, 36,12 |
80,6 |
2,11 |
|
En association à la metformine (2 000 mg/jour) + rosiglitazone (4 mg deux fois par jour) |
|
|||||
|
Liraglutide 1,2 mg |
177 |
8,48 |
-1,48 |
57,51 |
95,3 |
-1,02 |
|
Liraglutide 1,8 mg |
178 |
8,56 |
-1,48 |
53,71 |
94,9 |
-2,02 |
|
Placebo |
175 |
8,42 |
-0,54 |
28,11 |
98,5 |
0,60 |
|
En association à la metformine (2 000 mg/jour) + glimépiride (4 mg/jour) |
|
|||||
|
Liraglutide 1,8 mg |
230 |
8,3 |
-1,33* |
53,11 |
85,8 |
-1,81** |
|
Placebo |
114 |
8,3 |
-0,24 |
15,31 |
85,4 |
-0,42 |
|
Insuline glargine4 |
232 |
8,1 |
-1,09 |
45,81 |
85,2 |
1,62 |
|
En association aux iSGLT25 ± metformine (≥ 1 500 mg/jour) |
|
|||||
|
Liraglutide 1,8 mg |
203 |
8,00 |
-1,02*** |
54,8*** |
91,0 |
-2,92 |
|
Placebo |
100 |
7,96 |
-0,28 |
13,9 |
91,4 |
-2,06 |
*Supériorité (p< 0,01) vs comparateur actif ; **Supériorité (p< 0,0001) vs comparateur actif ; ***Supériorité (p< 0,001) vs comparateur actif, Non- infériorité (p< 0,0001) vs comparateur actif
1tous les patients ; 2précédente monothérapie par antidiabétique oral ; 3patients précédemment traités par régime alimentaire
5Le liraglutide en association aux iSGLT2 a été étudié sur toutes les doses approuvées de iSGLT2
4La dose de l’insuline glargine était déterminée en ouvert et était conforme à l’algorithme pour la titration de l’insuline glargine. La titration de la dose de l’insuline glargine était réalisée par le patient sur les instructions de l’investigateur :
Schéma de titration de l’insuline glargine
|
Auto-contrôles de la GAJ (glycémie à jeun) |
Augmentation de la dose de l’insuline glargine (UI) |
|
Objectif : ≤ 5,5 mmol/L (≤ 100 mg/dL) |
Aucun ajustement |
|
> 5,5 et < 6,7 mmol/L (> 100 et < 120 mg/dL) |
0 – 2 UIa |
|
≥ 6,7 mmol/L (≥ 120 mg/dL) |
2 UI |
aEn accord avec les recommandations individuelles de l’investigateur lors de la précédente visite, cela dépend par exemple si le patient a fait une hypoglycémie.
Association à l’insuline
Dans un essai clinique de 104 semaines, 57 % des patients diabétiques de type 2, traités par l’insuline dégludec en association avec la metformine, ont atteint la cible d'HbA1c < 7 %. Les patients restants ont poursuivi dans un essai clinique en ouvert de 26 semaines et ont été randomisés pour recevoir, en plus de leur traitement, soit le liraglutide soit une seule injection d'insuline asparte (lors du repas le plus copieux). Dans le bras insuline dégludec + liraglutide, la dose d’insuline a été réduite de 20 % afin de diminuer le risque d'hypoglycémie. L’ajout du liraglutide a entraîné une réduction significativement et statistiquement plus importante de l'HbA1c (-0,73 % pour le liraglutide vs -0,40 % pour le comparateur) et du poids corporel (-3,03 kg vs 0,72 kg). Le taux d'épisodes hypoglycémiques (par patient-année d'exposition) était statistiquement et significativement plus bas lors de l'ajout du liraglutide par rapport à l'ajout d'une seule injection d'insuline asparte (1,0 vs 8,15 ; ratio : 0,13 ; IC 95 % : 0,08 ; 0,21).
Dans un essai clinique de 52 semaines, l'ajout d'insuline détémir au liraglutide 1,8 mg et à la metformine, chez les patients insuffisamment contrôlés sous liraglutide et metformine seuls, a permis une diminution de 0,54 % d'HbA1c depuis l'inclusion, comparé à une diminution de 0,20 % d'HbA1c dans le groupe contrôle liraglutide 1,8 mg plus metformine. La perte de poids a été maintenue. Une faible augmentation du taux d’épisodes d’hypoglycémie mineure a été observée (0,23 versus 0,03 événements par patient-année).
Dans l’essai LEADER (voir la sous-rubrique évaluation cardiovasculaire), 873 patients étaient sous insuline prémélangée (avec ou sans ADO(s)) à l’inclusion et au moins pendant les 26 semaines suivantes. Le taux d’HbA1c moyen à l’inclusion était de 8,7 % pour le liraglutide et le placebo. À la semaine 26, la variation moyenne estimée de l’HbA1c était respectivement de -1,4 % et de -0,5 % pour liraglutide et pour le placebo, avec une différence de traitement estimée de -0,9 [-1,00 ; -0,70]IC 95 %. Le profil de sécurité du liraglutide en association avec l’insuline prémélangée était globalement comparable à celui observé pour le placebo en association avec l’insuline prémélangée (voir rubrique 4.8).
Utilisation chez les patients présentant une insuffisance rénale
Dans un essai en double aveugle comparant l’efficacité et la sécurité du liraglutide 1,8 mg par rapport au placebo, en association à l’insuline et/ou à des antidiabétiques oraux, chez des patients diabétiques de type 2 présentant une insuffisance rénale modérée, le liraglutide était supérieur au placebo en termes de diminution d’HbA1c après 26 semaines (-1,05 % vs -0,38 %). Significativement plus de patients ont atteint une HbA1c inférieure à 7 % avec le liraglutide en comparaison au placebo (52,8 % vs 19,5 %).
Dans les deux groupes, une diminution du poids a été observée : -2,4 kg avec le liraglutide vs -1,09 kg avec le placebo. Le risque d’épisodes hypoglycémiques était comparable entre les deux groupes de traitement. Le profil de sécurité du liraglutide était globalement similaire à celui observé dans d’autres études menées avec le liraglutide.
· Proportion de patients ayant obtenu une diminution de l’HbA1c
Le liraglutide seul a permis à un nombre significativement et statistiquement plus grand de patients d’atteindre un taux d’HbA1c ≤ 6,5 % à 52 semaines, par rapport aux patients ayant reçu du glimépiride (37,6 % pour 1,8 mg et 28,0 % pour 1,2 mg vs 16,2 % pour le comparateur).
Le liraglutide en association à la metformine, au glimépiride, à la metformine et rosiglitazone ou aux iSGLT2 ± metformine, a permis à un nombre significativement et statistiquement plus grand de patients d’atteindre un taux d’HbA1c ≤ 6,5 % à 26 semaines, par rapport aux patients ayant reçu ces médicaments seuls.
· Glycémie à jeun
Le liraglutide en monothérapie et en association à un ou deux antidiabétiques oraux a permis une diminution de la glycémie à jeun de 13 à 43,5 mg/dL (0,72 à 2,42 mmol/L). Cette diminution a été observée dès les deux premières semaines de traitement.
· Glycémie postprandiale
Le liraglutide diminue la glycémie postprandiale des trois principaux repas de 31 à 49 mg/dL (1,68 à 2,71 mmol/L).
· Fonction bêta-cellulaire
Les essais cliniques réalisés avec le liraglutide mettent en évidence une amélioration de la fonction bêta-cellulaire sur la base de mesures telles que le modèle d’homéostasie de la fonction bêta-cellulaire (HOMA-B) et le rapport pro-insuline/insuline. Une amélioration de la première et de la deuxième phase de sécrétion d’insuline après 52 semaines de traitement par liraglutide a été démontrée dans un sous-groupe de patients présentant un diabète de type 2 (n = 29).
· Poids
Le traitement par liraglutide en association à la metformine, à la metformine et glimépiride, à la metformine et rosiglitazone ou aux iSGLT2 associés ou non à la metformine, a permis une diminution durable du poids de 0,86 kg à 2,62 kg en comparaison au placebo.
Une perte de poids plus importante a été observée chez les patients ayant un indice de masse corporelle (IMC) élevé à l’inclusion.
· Evaluation cardiovasculaire
L’analyse post-hoc des événements indésirables cardiovasculaires majeurs graves (décès d’origine cardiovasculaire, infarctus du myocarde, accident vasculaire cérébral) survenus dans tous les essais de phases 2 et 3 de durée intermédiaire et de longue durée (de 26 semaines jusqu’à 100 semaines) a inclus 5 607 patients (dont 3 651 étaient exposés au liraglutide) et n’a pas montré d’augmentation du risque cardiovasculaire (rapport des taux d’incidence de 0,75 (IC 95% : 0,35 ; 1,63)) pour le liraglutide par rapport à l’ensemble des comparateurs.
L’essai LEADER (Liraglutide Effect and Action in Diabetes Evaluation of Cardiovascular Outcome Results) est un essai clinique multicentrique, en double-aveugle, contrôlé versus placebo. 9 340 patients ont été randomisés afin de recevoir soit du liraglutide (4 668) soit un placebo (4 672), en association avec une prise en charge standard de l’HbA1c et des facteurs de risque cardiovasculaires. Le critère primaire, ou le statut vital en fin d’essai, était disponible pour respectivement 99,7 % et 99,6 % des patients randomisés pour recevoir soit du liraglutide soit du placebo. La durée de l’observation était au minimum de 3,5 années et pouvait aller jusqu’à 5 ans maximum. La population de l’essai incluait des patients ≥ 65 ans (n = 4 329), des patients ≥ 75 ans (n = 836) et des patients présentant une insuffisance rénale légère (n = 3 907), modérée (n = 1 934) ou sévère (n = 224). L’âge moyen était de 64 ans et l’IMC moyen était de 32,5 kg/m2. L’ancienneté moyenne du diabète était de 12,8 ans.
Le critère primaire était le délai de survenue depuis la randomisation du premier évènement cardiovasculaire majeur (MACE) : mortalité cardiovasculaire, infarctus du myocarde non-fatal ou accident vasculaire cérébral non-fatal. Le liraglutide était supérieur dans la prévention du MACE par rapport au placebo (Figure 1). Le Hazard ratio estimé était constamment inférieur à 1 pour les 3 composants du MACE.
Le liraglutide a également diminué significativement le risque de MACE élargi (MACE primaire, angor instable entraînant une hospitalisation, revascularisation coronaire ou hospitalisation due à une insuffisance cardiaque) et ainsi que d’autres critères secondaires (Figure 2).
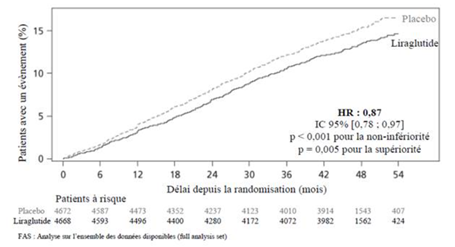
Figure 1 : Kaplan Meier du délai de survenue du premier MACE – Analyse de la population FAS
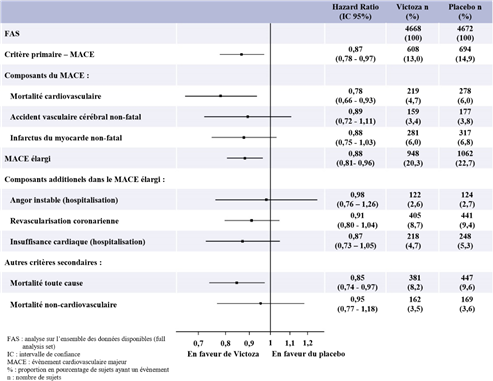
Figure 2: Analyses des types d’évènements cardiovasculaires individuels – Analyse de la population FAS
Une réduction significative et durable de l’HbA1c de l’inclusion jusqu’au 36ème mois a été observée avec le liraglutide par rapport au placebo, en ajout à une prise en charge standard (-1,16 % vs 0,77 % ; différence de traitement estimée [DTE] -0,40 % [-0,45 ; -0,34]). La nécessité d’un traitement d’intensification par insuline était diminuée de 48 % avec le liraglutide par rapport au placebo chez les patients naïfs d’insuline à l’inclusion (HR 0,52 [0,48 ; 0,57]).
· Pression artérielle et fréquence cardiaque
Sur toute la durée des essais de phase 3a, le liraglutide a diminué la pression artérielle systolique en moyenne de 2,3 à 6,7 mmHg par rapport à l’inclusion et de 1,9 à 4,5 mmHg par rapport au comparateur actif. Une augmentation moyenne de la fréquence cardiaque depuis l’inclusion de 2 à 3 battements par minute a été observée avec le liraglutide lors des essais cliniques à long terme incluant LEADER. Dans l’essai LEADER, il n’a pas été observé d’impact clinique à long terme de l’augmentation de la fréquence cardiaque sur le risque d’évènements cardiovasculaires.
· Evaluation microvasculaire
Au cours de l’essai LEADER, les évènements microvasculaires comprenaient la survenue de néphropathies et de rétinopathies. L’analyse du délai de survenue du premier évènement microvasculaire pour le liraglutide par rapport au placebo avait un HR de 0,84 [0,73, 0,97].
Le HR du liraglutide par rapport au placebo était de 0,78 [0,67, 0,92] concernant la survenue du premier évènement rénal et de 1,15 [0,87, 1,52] concernant la survenue du premier évènement oculaire.
· Immunogénicité
Compte tenu des propriétés potentiellement immunogènes des médicaments contenant des protéines ou des peptides, les patients traités par liraglutide peuvent développer des anticorps anti-liraglutide. En moyenne, 8,6 % des patients ont développé des anticorps. L’apparition d’anticorps n’a pas été associée à une perte d’efficacité du liraglutide.
Population pédiatrique
Dans une étude en double aveugle comparant l'efficacité et la sécurité du liraglutide 1,8 mg par rapport au placebo en association à la metformine ± insuline chez les adolescents et les enfants âgés de 10 ans et plus diabétiques de type 2, le liraglutide était supérieur par rapport au placebo dans la réduction du taux d'HbA1c après 26 semaines (-1,06, [-1,65, 0,46]). La différence dans le traitement pour l'HbA1c était de 1,3 % après 26 semaines supplémentaires d'extension en ouvert, confirmant le contrôle glycémique prolongé avec le liraglutide.
Le profil d'efficacité et de sécurité du liraglutide était comparable à celui observé dans la population adulte traitée par le liraglutide. Sur la base d’un contrôle glycémique adéquat ou de la tolérabilité, 30 % des patients de l’étude sont restés à une dose de 0,6 mg, 17 % ont augmenté la dose à 1,2 mg et 53 % ont augmenté la dose à 1,8 mg.
Autres données cliniques
Dans un essai clinique mené en ouvert, comparant l’efficacité et la sécurité du liraglutide (1,2 mg et 1,8 mg) et de la sitagliptine (100 mg, un inhibiteur de la DPP-4), chez des patients n’ayant pas obtenu un contrôle glycémique adéquat sous metformine (HbA1c moyenne de 8,5%), le liraglutide, aux deux doses, était statistiquement supérieur à la sitagliptine en termes de diminution d’HbA1c après 26 semaines (-1,24 %, -1,50 % vs -0,90 %, p < 0,0001). Les patients traités avec le liraglutide ont eu une diminution significative de leur poids par rapport aux patients traités par la sitagliptine (-2,9 kg et 3,4 kg vs -1,0 kg, p < 0,0001). Une plus grande proportion de patients traités par le liraglutide a eu des nausées transitoires vs les patients traités par la sitagliptine (20,8 % et 27,1 % pour les groupes liraglutide vs 4,6 % pour le groupe sitagliptine). La diminution d’HbA1c et la supériorité vs la sitagliptine, observées après 26 semaines de traitement par le liraglutide (1,2 mg et 1,8 mg), ont été maintenues après 52 semaines de traitement (-1,29 % et -1,51 % vs -0,88 %, p < 0,0001). Le transfert de patients du groupe sitagliptine vers le groupe liraglutide après 52 semaines de traitement a permis d’obtenir une diminution supplémentaire et statistiquement significative de l’HbA1c (-0,24 % et -0,45 %, IC 95 % : -0,41 à -0,07 et -0,67 à -0,23) à la semaine 78, cependant un groupe de contrôle formel n’était pas disponible.
Dans un essai clinique mené en ouvert, comparant l’efficacité et la sécurité du liraglutide 1,8 mg, en une injection par jour, et de l’exénatide 10 mcg, en deux injections par jour, chez des patients n’ayant pas obtenu un contrôle glycémique adéquat sous metformine et/ou sulfamide hypoglycémiant (HbA1c moyenne de 8,3 %), le liraglutide était statistiquement supérieur à l’exénatide en termes de diminution d’HbA1c après 26 semaines de traitement (-1,12 % vs -0,79 % ; différence estimée : -0,33 ; IC 95 % : 0,47 à -0,18). Significativement plus de patients ont atteint un taux d’HbA1c inférieur à 7 % avec le liraglutide en comparaison à l’exénatide (54,2 % vs 43,4 %, p = 0,0015). Les deux traitements ont permis une perte moyenne de poids d’approximativement 3 kg. Le transfert de patients du groupe exénatide vers le groupe liraglutide après 26 semaines de traitement a permis d’obtenir une diminution supplémentaire et statistiquement significative de l’HbA1c (-0,32 %, IC 95 % : -0,41 à -0,24) à la semaine 40, cependant un groupe de contrôle formel n’était pas disponible. Durant les 26 semaines, 12 effets indésirables graves sont survenus chez 235 patients (5,1 %) sous liraglutide, et 6 effets indésirables graves sont survenus chez 232 patients (2,6 %) sous exénatide. Il n’y a eu aucune tendance particulière en termes d’événements par classes de systèmes d’organes.
Dans un essai clinique mené en ouvert, comparant l’efficacité et la sécurité du liraglutide 1,8 mg à celles du lixisénatide 20 mcg chez 404 patients n’ayant pas obtenu un contrôle glycémique adéquat sous metformine (HbA1c moyenne de 8,4 %), le liraglutide était supérieur au lixisénatide en termes de diminution d’HbA1c après 26 semaines de traitement (-1,83 % vs -1,21 %, p < 0,0001).
Significativement plus de patients ont atteint un taux d’HbA1c inférieur à 7 % avec le liraglutide en comparaison au lixisénatide (74,2 % vs 45,5 %, p < 0,0001), ainsi qu’un taux cible d’HbA1c inférieur ou égal à 6,5 % (54,6 % vs 26,2 %, p < 0,0001). Une perte de poids a été observée dans les deux bras de traitement (-4,3 kg avec le liraglutide et -3,7 kg avec le lixisénatide).
Des effets indésirables gastro-intestinaux étaient plus fréquemment rapportés avec le traitement par liraglutide (43,6 % vs 37,1 %).
5.2. Propriétés pharmacocinétiques
L’absorption du liraglutide administré par voie sous-cutanée est lente. La concentration sérique maximale est atteinte entre 8 et 12 heures après l’injection. Après administration sous-cutanée d’une dose unique de 0,6 mg de liraglutide, la concentration sérique maximale estimée était de 9,4 nmol/L (poids corporel moyen d’environ 73 kg). Après administration de 1,8 mg de liraglutide, la concentration moyenne du liraglutide à l’état d’équilibre (ASCτ/24) était d’environ 34 nmol/L (poids corporel moyen d’environ 76 kg). L'exposition au liraglutide diminue avec l'augmentation du poids corporel. L’exposition au liraglutide a augmenté proportionnellement à la dose. Le coefficient de variation intra-individuel de l’ASC du liraglutide était de 11 % après administration d’une dose unique.
La biodisponibilité absolue du liraglutide après administration sous-cutanée est d’environ 55 %.
Distribution
Après administration sous-cutanée, le volume de distribution apparent est de 11 à 17 L. Après administration intraveineuse du liraglutide, le volume de distribution moyen est de 0,07 l/kg. Le liraglutide se lie largement aux protéines plasmatiques (> 98 %).
Biotransformation
Dans les 24 heures suivant l’administration d’une dose unique de [3H]-liraglutide radiomarqué à des patients sains, le principal composant plasmatique était le liraglutide intact. Deux métabolites plasmatiques mineurs ont été détectés (≤ 9 % et ≤ 5 % de la radioactivité plasmatique totale). Le liraglutide est métabolisé de la même manière que les grosses protéines et aucun organe en particulier n’a été identifié comme étant la voie d’élimination principale.
Élimination
Après administration d’une dose de [3H]-liraglutide, le liraglutide intact n’a pas été détecté dans les urines ni dans les fèces. Seule une proportion minime de la radioactivité administrée a été excrétée dans les urines ou dans les fèces sous forme de métabolites issus du liraglutide (6 % et 5 % respectivement). La radioactivité urinaire et fécale a été principalement excrétée pendant les 6 à 8 premiers jours respectivement, sous la forme de trois métabolites mineurs.
Après administration sous-cutanée d’une dose unique de liraglutide, la clairance moyenne est d’environ 1,2 L/h avec une demi-vie d’élimination d’environ 13 heures.
Populations particulières
Sujets âgés
L’âge n’a aucun effet cliniquement significatif sur la pharmacocinétique du liraglutide d’après les résultats d’une étude pharmacocinétique menée chez des patients sains et les résultats de l’analyse des données pharmacocinétiques de population chez des patients de 18 à 80 ans.
Sexe
Le sexe n’a aucun effet cliniquement significatif sur la pharmacocinétique du liraglutide d’après les résultats de l’analyse des données pharmacocinétiques de population chez des patients de sexe masculin et féminin et d’une étude pharmacocinétique menée chez des patients sains.
Origine ethnique
L’origine ethnique n’a aucun effet cliniquement significatif sur la pharmacocinétique du liraglutide d’après les résultats d’une analyse pharmacocinétique de population incluant des patients d’ethnie blanche, noire, asiatique et hispanique.
Obésité
L’analyse pharmacocinétique de population suggère que l’indice de masse corporelle (IMC) n’a aucun effet significatif sur la pharmacocinétique du liraglutide.
Insuffisance hépatique
La pharmacocinétique du liraglutide a été évaluée chez des patients présentant un degré variable d’insuffisance hépatique dans un essai en dose unique.
L’exposition au liraglutide a diminué de 13 à 23 % chez les patients qui présentaient une insuffisance hépatique légère à modérée par rapport aux patients sains.
L’exposition était significativement diminuée (44 %) chez les patients présentant une insuffisance hépatique sévère (score de Child Pugh > 9).
Insuffisance rénale
L’exposition au liraglutide s’est révélée plus faible chez les patients qui présentaient une insuffisance rénale par rapport aux patients ayant une fonction rénale normale. L’exposition au liraglutide a diminué de 33 %, 14 %, 27 % et 26 % chez les patients présentant respectivement une insuffisance rénale légère (clairance de la créatinine Clcr de 50 à 80 mL/min), modérée (Clcr de 30 à 50 mL/min), sévère (Clcr < 30 mL/min) et en insuffisance rénale terminale nécessitant une dialyse.
De même, dans un essai clinique de 26 semaines chez des patients diabétiques de type 2 présentant une insuffisance rénale modérée (Clcr de 30 à 59 mL/min, voir rubrique 5.1), l’exposition au liraglutide était diminuée de 26 % en comparaison aux résultats observés dans un essai clinique chez des patients diabétiques de type 2 présentant une fonction rénale normale ou une insuffisance rénale légère.
Population pédiatrique
Les propriétés pharmacocinétiques ont été évaluées au cours d'études cliniques menées dans une population pédiatrique de patients diabétiques de type 2 âgés de 10 ans et plus. L'exposition au liraglutide chez les adolescents et les enfants était comparable à celle observée chez les adultes.
5.3. Données de sécurité préclinique
Des tumeurs non létales des cellules C de la thyroïde ont été observées lors d’études de carcinogénicité sur 2 ans chez le rat et la souris. Chez le rat, aucune dose sans effet nocif observé (DSENO) n’a été observée. Ces tumeurs n’ont pas été observées chez des singes traités pendant 20 mois. Ces résultats décrits chez les rongeurs sont dus à un mécanisme non génotoxique, spécifique, médié par les récepteurs du GLP-1, auquel les rongeurs sont particulièrement sensibles. La pertinence de ces résultats pour l’homme est probablement faible mais ne peut pas être complètement exclue. Aucun autre type de tumeurs liées au traitement n’a été identifié.
Les études effectuées chez l’animal n’ont mis en évidence aucun effet délétère direct sur la fertilité mais une légère augmentation des morts embryonnaires précoces a été observée à la dose la plus élevée. L’administration de liraglutide en milieu de gestation a entraîné une perte de poids maternelle et une diminution de la croissance fœtale, avec des effets ambigus sur la cage thoracique chez le rat et une modification du squelette chez le lapin. Chez les rats exposés au liraglutide, on a observé un ralentissement de la croissance néonatale, qui a persisté après le sevrage chez le groupe recevant des doses élevées. Il n’est pas établi si le retard de croissance des jeunes rats est imputable à une consommation de lait réduite due à un effet direct du GLP-1 ou à une baisse de la production de lait maternel induite par une réduction de l’apport calorique.
Propylèneglycol (E1520)
Phénol
Acide chlorhydrique concentré (pour ajustement du pH)
Hydroxyde de sodium (pour l'ajustement du pH)
Eau pour préparations injectables
2 ans.
Après la première utilisation : 1 mois.
6.4. Précautions particulières de conservation
À conserver au réfrigérateur (entre 2°C et 8°C).
Ne pas congeler.
À conserver à distance du compartiment de congélation.
Après la première utilisation : à conserver à une température ne dépassant pas 30°C ou à conserver au réfrigérateur (entre 2°C et 8°C). Ne pas congeler.
Conserver le capuchon sur le stylo, à l’abri de la lumière.
6.5. Nature et contenu de l'emballage extérieur
Cartouche en verre incolore de type I et piston fermé par bouchon en caoutchouc bromobutyle, contenus dans un stylo injecteur constitué d’un corps bleu clair, d’un bouton bleu clair, d’un dispositif de sélection de dose jaune et d’un capuchon gris.
Chaque stylo contient 3 mL de solution, délivrant 30 doses de 0,6 mg, 15 doses de 1,2 mg ou 10 doses de 1,8 mg.
Boîtes de 1, 2, 3, 5, 10 stylos ou conditionnement multiples contenant 10 stylos préremplis (2 boîtes de 5).
Toutes les présentations peuvent ne pas être commercialisées.
6.6. Précautions particulières d’élimination et de manipulation
LIRAGLUTIDE SUN ne doit pas être utilisé si la solution n’est pas limpide ni incolore ou presque incolore.
LIRAGLUTIDE SUN ne doit pas être utilisé s’il a été congelé.
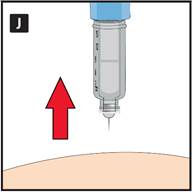
LIRAGLUTIDE SUN peut être administré avec des aiguilles d’une longueur maximale de 8 mm et d’un diamètre minimal de 32G. Le stylo est conçu pour être utilisé avec des aiguilles jetables.
Les aiguilles ne sont pas incluses.
Le patient doit être averti du fait qu’il doit jeter l’aiguille d’injection conformément à la réglementation en vigueur après chaque injection et conserver le stylo sans aiguille d’injection attachée. Ceci prévient les risques de contamination, d’infection et de fuite. Cela garantit également la précision du dosage.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
SUN PHARMACEUTICAL INDUSTRIES EUROPE B.V.
POLARISAVENUE 87
2132JH, HOOFDDORP
PAYS-BAS
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 303 111 7 2 : 3 mL de solution en cartouche (verre) dans un stylo prérempli. Boite de 1.
· 34009 303 111 8 9 : 3 mL de solution en cartouche (verre) dans un stylo prérempli. Boite de 2.
· 34009 303 111 9 6 : 3 mL de solution en cartouche (verre) dans un stylo prérempli. Boite de 3.
· 34009 551 066 1 6 : 3 mL de solution en cartouche (verre) dans un stylo prérempli. Boite de 5.
· 34009 551 066 2 3 : 3 mL de solution en cartouche (verre) dans un stylo prérempli. Boite de 10.
· 34009 551 066 3 0 : 3 mL de solution en cartouche (verre) dans un stylo prérempli. Conditionnement multiple de 10 (2 packs de 5).
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Liste I
Informations importantes
Les informations importantes disponibles pour ce médicament sont les suivantes :
- L'ANSM prend des mesures de police sanitaire à l'encontre des sites internet vendant des aGLP-1
- Lutte contre la vente et la publicité illégale de médicaments aGLP-1 : les actions de l'ANSM
- Alerte sur les risques associés à l'achat sur internet d'aGLP-1 contrefaits
- Retour d'information sur le PRAC de juillet 2024 (8 - 11 juillet)
- Analogues du GLP-1 : point sur la surveillance des effets indésirables graves et mésusages
- Retour d'information sur le PRAC d'avril 2024 (8 - 11 avril)
- Retour d'information sur le PRAC de novembre 2023 (23 - 26 octobre)
ANSM - Mis à jour le : 17/07/2025
LIRAGLUTIDE SUN 6 mg/mL, solution injectable en stylo prérempli
Liraglutide
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin, votre pharmacien ou votre infirmier/ère.
· Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d’autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin, votre pharmacien ou votre infirmier/ère. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
1. Qu'est-ce que LIRAGLUTIDE SUN 6 mg/mL, solution injectable en stylo prérempli et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant d'utiliser LIRAGLUTIDE SUN 6 mg/mL, solution injectable en stylo prérempli ?
3. Comment utiliser LIRAGLUTIDE SUN 6 mg/mL, solution injectable en stylo prérempli?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver LIRAGLUTIDE SUN 6 mg/mL, solution injectable en stylo prérempli?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE LIRAGLUTIDE SUN 6 mg/mL, solution injectable en stylo prérempli ET DANS QUELS CAS EST-IL UTILISE ?
Classe pharmacothérapeutique : médicaments utilisés dans le diabète, analogue du glucagon-like peptide 1 (GLP-1) - code ATC : A10BJ02
LIRAGLUTIDE SUN est utilisé seul si votre taux de sucre dans le sang n’est pas contrôlé de manière adéquate par le régime alimentaire et l’exercice physique seuls, et que vous ne pouvez pas utiliser la metformine (autre médicament antidiabétique).
LIRAGLUTIDE SUN est utilisé en association avec d’autres médicaments pour traiter le diabète lorsque ceux-ci ne suffisent pas à contrôler votre taux de sucre dans le sang. Ces médicaments peuvent être :
· des antidiabétiques oraux (tels que la metformine, la pioglitazone, les sulfamides hypoglycémiants ou les inhibiteurs du co-transporteur de sodium-glucose de type 2 (iSGLT2)) et/ou une insuline.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D’UTILISER LIRAGLUTIDE SUN 6 mg/mL, solution injectable en stylo prérempli?
N’utilisez jamais LIRAGLUTIDE SUN 6 mg/mL, solution injectable en stylo prérempli:
· si vous êtes allergique au liraglutide ou à l’un des autres composants contenus dans ce médicament, mentionnés dans la rubrique 6.
Avertissements et précautions
Adressez-vous à votre médecin, votre pharmacien ou votre infirmier/ère avant d’utiliser LIRAGLUTIDE SUN :
· avant d’utiliser LIRAGLUTIDE SUN.
· si vous avez ou si vous avez eu une maladie du pancréas.
Si vous savez que vous allez subir une intervention chirurgicale nécessitant une anesthésie (endormissement), veuillez informer votre médecin que vous prenez LIRAGLUTIDE SUN.
Vous ne devez pas utiliser ce médicament si vous avez un diabète de type 1 (votre organisme ne produit pas d’insuline) ou une acidocétose diabétique (une complication du diabète avec un taux élevé de sucre dans le sang et des difficultés pour respirer). Ce médicament n’est pas une insuline et ne doit donc pas être utilisé en remplacement d’une insuline.
L’utilisation de LIRAGLUTIDE SUN n’est pas recommandée si vous êtes sous dialyse.
L’utilisation de LIRAGLUTIDE SUN n’est pas recommandée si vous avez une maladie sévère du foie.
L’utilisation de LIRAGLUTIDE SUN n’est pas recommandée si vous avez une insuffisance cardiaque sévère.
Ce médicament n’est pas recommandé si vous avez une maladie sévère de l’estomac ou de l’intestin qui provoque un ralentissement de la vidange gastrique (appelée gastroparésie), ou si vous avez une maladie inflammatoire de l’intestin.
Si vous ressentez des symptômes d’une pancréatite aiguë, comme une douleur intense et persistante au niveau de l’estomac, consultez votre médecin immédiatement (voir rubrique 4).
Si vous avez une maladie de la thyroïde, notamment des nodules de la thyroïde et une augmentation de la taille de la glande thyroïdienne, consultez votre médecin.
Lorsque vous débutez un traitement avec Liraglutide SUN, vous pouvez dans certains cas être sujet à une perte d’eau/une déshydratation, par exemple en cas de vomissements, nausées et diarrhées. Il est important d’éviter la déshydratation en buvant beaucoup. Consultez votre médecin si vous avez des questions ou si vous avez un doute.
Enfants et adolescents
LIRAGLUTIDE SUN peut être utilisé chez les adolescents et les enfants âgés de 10 ans et plus. Aucune donnée n'est disponible chez les enfants de moins de 10 ans.
Autres médicaments et LIRAGLUTIDE SUN 6 mg/mL, solution injectable en stylo prérempli
Informez votre médecin, votre pharmacien ou votre infirmier/ère si vous prenez, avez récemment pris ou pourriez prendre tout autre médicament.
Prévenez en particulier votre médecin, votre pharmacien ou votre infirmier/ère si vous utilisez des médicaments contenant l’une des substances actives suivantes :
· Sulfamide hypoglycémiant (comme le glimépiride ou le glibenclamide) ou insuline. Vous pouvez faire une hypoglycémie (faible taux de sucre dans le sang) si vous utilisez LIRAGLUTIDE SUN en association à un sulfamide hypoglycémiant ou de l’insuline car les sulfamides hypoglycémiants et l’insuline augmentent le risque d’hypoglycémie. Lorsque vous utilisez cette association de médicaments pour la première fois, votre médecin pourra vous demander de réduire votre dose de sulfamide hypoglycémiant ou d’insuline. Veuillez consulter la rubrique 4, qui décrit les signes annonciateurs d’un faible taux de sucre dans le sang. Si vous prenez également un sulfamide hypoglycémiant (comme le glimépiride ou le glibenclamide) ou de l’insuline, votre médecin pourra vous demander de contrôler votre taux de sucre dans le sang. Ce contrôle aidera votre médecin à décider si votre dose de sulfamide hypoglycémiant ou d’insuline doit être modifiée.
· Si vous utilisez de l’insuline, votre médecin vous expliquera comment réduire la dose d’insuline et vous recommandera de surveiller plus régulièrement votre glycémie afin d’éviter de développer une hyperglycémie (glycémie élevée) et une acidocétose diabétique (une complication du diabète survenant lorsque l’organisme ne parvient pas à dégrader le glucose à cause d’une insuffisance d’insuline).
· Warfarine ou autres médicaments anticoagulants oraux. Des analyses de sang plus fréquentes peuvent être nécessaires afin de déterminer la capacité de votre sang à coaguler.
Si vous êtes enceinte ou que vous allaitez, si vous pensez être enceinte ou planifiez une grossesse, prévenez votre médecin. LIRAGLUTIDE SUN ne doit pas être utilisé pendant la grossesse car ses effets sur le fœtus ne sont pas connus.
Le passage de LIRAGLUTIDE SUN dans le lait maternel n’est pas établi. En conséquence, n’utilisez pas ce médicament si vous allaitez.
Conduite de véhicules et utilisation de machines
Un faible taux de sucre dans le sang (hypoglycémie) peut réduire votre capacité de concentration.
Evitez de conduire ou d’utiliser des machines si vous ressentez les signes d’une hypoglycémie. Veuillez consulter la rubrique 4, qui décrit les signes annonciateurs d’un faible taux de sucre dans le sang. Veuillez consulter votre médecin pour plus d’informations sur ce sujet.
LIRAGLUTIDE SUN 6 mg/mL, solution injectable en stylo prérempli contient moins de 1 mmol de sodium (23 mg) par dose. Cela signifie qu’il est essentiellement « sans sodium ».
3. COMMENT UTILISER LIRAGLUTIDE SUN 6 mg/mL, solution injectable en stylo prérempli?
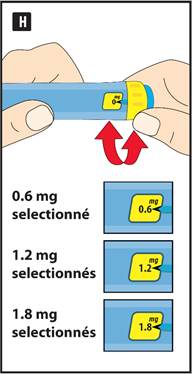
· La dose initiale est de 0,6 mg une fois par jour, pendant au moins une semaine.
· Votre médecin vous indiquera quand augmenter votre dose à 1,2 mg une fois par jour.
· Votre médecin pourra vous demander d’augmenter encore votre dose à 1,8 mg une fois par jour si la dose de 1,2 mg ne permet pas de contrôler votre taux de sucre dans le sang de façon satisfaisante.
Ne modifiez pas votre dose, sauf si votre médecin vous demande de le faire.
LIRAGLUTIDE SUN doit être administré par injection sous la peau (en sous-cutané). Ne l’injectez pas directement dans une veine ou dans un muscle. Les meilleurs endroits pour réaliser vos injections sont le dessus de la cuisse, le ventre (abdomen) ou le haut du bras. Changez l’endroit où vous injectez chaque jour pour réduire le risque de développer des grosseurs.
Vous pouvez faire vous-même votre injection, quel que soit le moment de la journée, indépendamment des repas. Lorsque vous avez identifié le moment de la journée qui vous convient le mieux, il est préférable de réaliser votre injection de LIRAGLUTIDE SUN à peu près à ce même moment chaque jour.
Avant d’utiliser le stylo pour la première fois, votre médecin ou votre infirmier/ère vous expliquera comment l’utiliser.
Vous trouverez des instructions d’utilisation détaillées au dos de cette notice.
Si vous avez utilisé plus de LIRAGLUTIDE SUN 6 mg/mL, solution injectable en stylo prérempli que vous n’auriez dû
Si vous avez utilisé plus de LIRAGLUTIDE SUN que vous n’auriez dû, prévenez immédiatement votre médecin. Vous pourriez avoir besoin d’un traitement médical. Vous pourriez avoir des nausées, des vomissements, une diarrhée ou un faible taux de sucre dans le sang (hypoglycémie). Veuillez-vous référer à la rubrique 4 pour connaître les signes annonciateurs d’un faible taux de sucre dans le sang.
Si vous oubliez d’utiliser LIRAGLUTIDE SUN 6 mg/mL, solution injectable en stylo prérempli
Si vous oubliez une dose, utilisez LIRAGLUTIDE SUN dès que vous vous en rendez compte.
Toutefois, si plus de 12 heures se sont écoulées depuis le moment où vous auriez dû utiliser LIRAGLUTIDE SUN, ne prenez pas la dose que vous avez oubliée, mais prenez votre dose habituelle le lendemain. Ne prenez pas de dose supplémentaire ou n’augmentez pas la dose du jour suivant pour compenser la dose que vous avez oublié de prendre.
Si vous arrêtez d’utiliser LIRAGLUTIDE SUN 6 mg/mL, solution injectable en stylo prérempli
N’arrêtez pas d’utiliser LIRAGLUTIDE SUN sans avoir consulté votre médecin. Si vous arrêtez de le prendre, votre taux de sucre dans le sang pourrait augmenter.
Si vous avez d’autres questions sur l’utilisation de ce médicament, demandez plus d’informations à votre médecin, votre pharmacien ou votre infirmier/ère.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Effets indésirables graves
Fréquents : pouvant affecter jusqu’à 1 personne sur 10
· Hypoglycémie (faible taux de sucre dans le sang). Les signes qui annoncent un faible taux de sucre dans le sang peuvent apparaître soudainement et peuvent être les suivants : sueurs froides, pâleur et froideur de la peau, maux de tête, rythme cardiaque rapide, nausées, sensation de faim excessive, troubles visuels, somnolence, faiblesse, nervosité, anxiété, confusion, difficultés de concentration, tremblement. Votre médecin vous expliquera comment traiter un faible taux de sucre dans le sang et ce que vous devez faire si vous remarquez ces signes annonciateurs. Cet effet indésirable risque de survenir plus fréquemment si vous prenez également un sulfamide hypoglycémiant ou une insuline. Votre médecin peut réduire la dose de ces médicaments si vous commencez à prendre LIRAGLUTIDE SUN.
Rares : pouvant affecter jusqu’à 1 personne sur 1 000
· Une forme sévère de réaction allergique (réaction anaphylactique) associée à d’autres symptômes tels que des problèmes respiratoires, un gonflement de la gorge et du visage, un rythme cardiaque rapide etc. Si vous ressentez ces symptômes, demandez immédiatement une aide médicale et informez votre médecin dès que possible.
· Obstruction de l’intestin. Il s’agit d’une forme sévère de constipation accompagnée d’autres symptômes tels que douleur au niveau de l’estomac, ballonnements, vomissements etc.
Très rares : pouvant affecter jusqu’à 1 personne sur 10 000
· Des cas d’inflammation du pancréas (pancréatite). Une pancréatite peut être une maladie grave, pouvant potentiellement menacer le pronostic vital. Arrêtez de prendre LIRAGLUTIDE SUN et contactez immédiatement un médecin si vous remarquez l’un des effets indésirables graves suivants :
Douleur intense et persistante au niveau de l’estomac qui peut s’étendre à votre dos, associée à des nausées et des vomissements, car cela peut être le signe d’une inflammation du pancréas (pancréatite).
Autres effets indésirables
Très fréquents : pouvant affecter plus de 1 personne sur 10
· Nausées. Cela disparaît généralement avec le temps.
· Diarrhées. Cela disparaît généralement avec le temps.
Fréquents : pouvant affecter jusqu’à 1 personne sur 10
· Vomissements.
Lorsque vous débutez un traitement avec LIRAGLUTIDE SUN, vous pouvez dans certains cas être sujet à une perte d’eau/une déshydratation, par exemple en cas de vomissements, nausées et diarrhées. Il est important d’éviter la déshydratation en buvant beaucoup.
· Maux de tête
· Indigestion
· Inflammation de l’estomac (gastrite), se traduisant notamment par des douleurs d’estomac, des nausées et des vomissements.
· Reflux gastro-œsophagien (RGO), se traduisant notamment par une brûlure d’estomac.
· Ventre (abdomen) douloureux ou gonflé
· Gêne abdominale
· Constipation
· Gaz (flatulences)
· Diminution de l’appétit
· Bronchite
· Rhume
· Sensation de vertige
· Augmentation de la fréquence cardiaque
· Fatigue
· Mal de dents
· Réactions au site d’injection (comme ecchymose, douleur, irritation, démangeaison et éruption cutanée).
· Augmentation des enzymes pancréatiques (telles que la lipase et l’amylase).
Peu fréquents : pouvant affecter jusqu’à 1 personne sur 100
· Réactions allergiques telles que prurit (démangeaisons) et urticaire (un type d’éruption cutanée)
· Déshydratation, quelquefois accompagnée d’une diminution de la fonction rénale
· Malaise (le fait de ne pas se sentir bien)
· Calculs biliaires
· Inflammation de la vésicule biliaire
· Changement du goût des aliments
· Ralentissement de la vidange gastrique.
Fréquence indéterminée : la fréquence ne peut être estimée à partir des données disponibles
· Des grosseurs sous la peau peuvent être causées par l’accumulation d'une protéine appelée amyloïde (amyloïdose cutanée ; la fréquence à laquelle cela se produit est indéterminée).
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin, votre pharmacien ou votre infirmier/ère. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet: https://signalement.social-sante.gouv.fr/
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER LIRAGLUTIDE SUN 6 mg/mL, solution injectable en stylo prérempli?
Tenir ce médicament hors de la vue et de la portée des enfants.
N’utilisez pas ce médicament après la date de péremption indiquée sur l’étiquette du stylo et sur l’emballage après « EXP ». La date de péremption fait référence au dernier jour de ce mois.
Avant ouverture :
À conserver au réfrigérateur (entre 2°C et 8°C). Ne pas congeler. À conserver à distance du compartiment de congélation.
En cours d’utilisation :
Vous pouvez conserver le stylo pendant 1 mois à une température ne dépassant pas 30°C ou au réfrigérateur (entre 2°C et 8°C) à distance du compartiment de congélation. Ne pas congeler. Lorsque vous n’utilisez pas le stylo, conservez le capuchon sur le stylo, à l’abri de la lumière.
N’utilisez pas ce médicament si la solution n’est pas limpide et incolore ou presque incolore.
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient LIRAGLUTIDE SUN 6 mg/mL, solution injectable en stylo prérempli
· La substance active est le liraglutide. 1 mL de solution injectable contient 6 mg de liraglutide. Un stylo prérempli contient 18 mg de liraglutide.
· Les autres composants sont le phosphate disodique dihydraté, le propylèneglycol (E1520), le phénol, l’hydroxyde de sodium (pour l'ajustement du pH), l’acide chlorhydrique concentré (pour l'ajustement du pH) et l’eau pour préparations injectables.
Solution limpide et incolore ou presque incolore dans une cartouche en verre incolore de type I et piston fermé par bouchon en caoutchouc bromobutyle, contenus dans un stylo injecteur constitué d’un corps bleu clair, d’un bouton bleu clair, d’un dispositif de sélection de dose jaune et d’un un capuchon gris.
Chaque stylo contient 3 mL de solution, délivrant 30 doses de 0,6 mg, 15 doses de 1,2 mg ou 10 doses de 1,8 mg.
LIRAGLUTIDE SUN est disponible en boîtes de 1, 2, 3, 5, 10 stylos ou en conditionnement multiples contenant 10 stylos (2 boîtes de 5).
Toutes les présentations peuvent ne pas être commercialisées.
Les aiguilles ne sont pas incluses.
Titulaire de l’autorisation de mise sur le marché
SUN PHARMACEUTICAL INDUSTRIES EUROPE B.V.
POLARISAVENUE 87
2132JH, HOOFDDORP
PAYS-BAS
Exploitant de l’autorisation de mise sur le marché
SUN PHARMA FRANCE
31 RUE DES POISSONNIERS
92200 NEUILLY-SUR-SEINE
124 Fabricii Street
400632, Cluj-Napoca
ROUMANIE
Ou
Sun Pharmaceutical Industries Europe B.V.
Polarisavenue 87
2132JH, Hoofddorp
PAYS-BAS
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Ce médicament est autorisé dans les Etats membres de l'Espace Economique Européen sous les noms suivants : Conformément à la réglementation en vigueur.
[À compléter ultérieurement par le titulaire]
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).
|
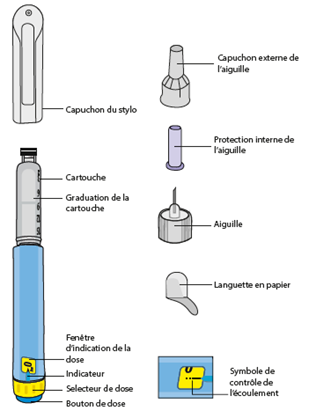
INSTRUCTIONS D’UTILISATION DU STYLO LIRAGLUTIDE SUN Veuillez lire attentivement ces instructions avant d’utiliser votre stylo. Votre stylo contient 18 mg de liraglutide. Vous pouvez sélectionner des doses de 0,6 mg, 1,2 mg et 1,8 mg. Le stylo est conçu pour être utilisé avec des aiguilles d'injection à usage unique d'une longueur maximale de 8 mm et d'un diamètre minimal de 32G (0,25 / 0,23 mm).
|
|
|
|
|
|
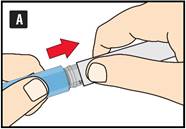
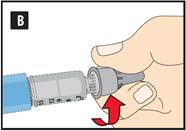
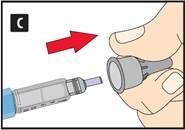
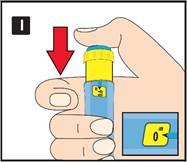
Préparation de votre stylo Contrôlez le nom et l’étiquette colorée de votre stylo pour vous assurer qu’il contient bien du liraglutide. L’utilisation d’un autre médicament peut être néfaste. Retirez le capuchon du stylo. |
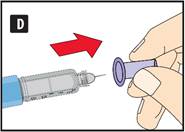
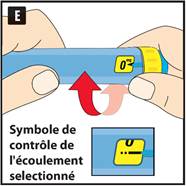
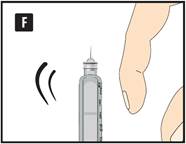
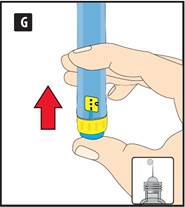
|
|
Retirez la languette en papier d’une aiguille neuve à usage unique. Vissez solidement et de manière bien droite l’aiguille sur votre stylo. |
|
|
Retirez le capuchon externe de l’aiguille et conservez-le pour plus tard. |
|
|
Retirez la protection interne de l’aiguille et jetez-la. |
|
|
|
|
|
Entretien de votre stylo · N’essayez pas de réparer votre stylo ou de le démonter. · Protégez votre stylo de la poussière, de la saleté et de toute sorte de liquides. · Nettoyez le stylo avec un chiffon imbibé de détergent doux. · N’essayez pas de le laver, de le tremper ou de le lubrifier, cela peut endommager le stylo. |
|
|
· Ne partagez pas votre stylo ou vos aiguilles avec quelqu’un d’autre. · Conservez votre stylo hors de la portée d’autres personnes, en particulier des enfants. |
|
|
Vérification de l’écoulement avec chaque stylo neuf Vérifiez l’écoulement avant votre première injection avec chaque stylo neuf. Si votre stylo est déjà en cours d’utilisation, passez à l’étape H « Sélection de votre dose ». Tournez le sélecteur de dose jusqu’à ce que le symbole de contrôle de l’écoulement se trouve en face de l’indicateur. |
|
|
Maintenez le stylo avec l’aiguille pointée vers le haut et tapotez doucement la cartouche avec votre doigt plusieurs fois. Cela fera remonter les éventuelles bulles d’air vers le haut de la cartouche. |
|
|
Gardez l’aiguille toujours pointée vers le haut et appuyez sur le bouton de dose jusqu’à ce que le 0 mg se trouve en face de l’indicateur. Une goutte de liraglutide doit apparaître au bout de l’aiguille. Si aucune goutte n’apparaît, répétez les étapes E à G jusqu’à quatre fois. Si aucune goutte de liraglutide n’apparaît, remplacez l’aiguille et répétez les étapes E à G encore une fois. N’utilisez pas le stylo si une goutte de liraglutide n’apparaît toujours pas. Le stylo est défectueux et vous devez en utiliser un neuf. |
|
|
|
|
|
Sélection de votre dose Vérifiez toujours que l’indicateur se trouve en face du 0 mg. Tournez le sélecteur de dose jusqu’à ce que la dose dont vous avez besoin se trouve en face de l’indicateur (0,6 mg, 1,2 mg ou 1,8 mg). Si vous avez sélectionné une mauvaise dose par erreur, changez-la simplement en faisant tourner le sélecteur de dose dans un sens ou dans l’autre jusqu’à ce que la dose correcte se trouve en face de l’indicateur. Prenez garde à ne pas appuyer sur le bouton de dose quand vous tournez le sélecteur de dose vers l’arrière car du liraglutide pourrait s’échapper. Si le sélecteur de dose se bloque avant que la dose dont vous avez besoin ne se trouve en face de l’indicateur, cela veut dire qu’il n’y a pas suffisamment de liraglutide restant pour une dose entière. Dans ce cas, vous avez le choix entre deux solutions : Diviser votre dose en deux injections : Tournez le sélecteur de dose dans un sens ou dans l’autre jusqu’à ce que la valeur 0,6 mg ou 1,2 mg se trouve en face de l’indicateur. Injectez la dose. Préparez ensuite un stylo neuf pour injection puis injectez le nombre de mg restant pour compléter votre dose. Vous ne pouvez diviser votre dose entre le stylo que vous utilisez et un stylo neuf que si votre professionnel de santé vous y a formé et vous l’a conseillé. Utilisez une calculatrice pour définir vos doses. Si vous divisez la dose de manière incorrecte, vous pouvez vous administrer une dose plus faible ou plus importante de liraglutide. Injecter la totalité de votre dose avec un stylo neuf : Si le sélecteur de dose se bloque avant que la valeur 0,6 mg ne se trouve en face de l’indicateur, préparez un stylo neuf et injectez la totalité de la dose avec le stylo neuf. |
|
|
Le sélecteur de dose émet des clics lorsque vous le tournez. N’utilisez pas ces clics pour sélectionner votre dose. N’utilisez pas la graduation de la cartouche pour mesurer la quantité de liraglutide à injecter, ce n’est pas suffisamment précis. |
|
|
Injection de votre dose Insérez l’aiguille dans votre peau selon la méthode d’injection indiquée par votre médecin ou votre infirmier/ère. Procédez ensuite de la façon suivante : Appuyez sur le bouton de dose pour effectuer l’injection jusqu’à ce que le 0 mg s’aligne en face de l’indicateur. Prenez garde à ne pas toucher la fenêtre d’indication de la dose avec vos autres doigts et à ne pas appuyer sur le côté du sélecteur de dose quand vous effectuez l’injection car cela pourrait bloquer l’injection. Maintenez le bouton de dose enfoncé et laissez l’aiguille sous la peau pendant au moins 6 secondes. Vous serez ainsi certain de recevoir la totalité de votre dose. |
|
|
Retirez l’aiguille. Une goutte de liraglutide peut alors apparaître au bout de l’aiguille. C’est un phénomène normal et cela n’a aucune influence sur votre dose. |
|
|
Placez l’extrémité de l’aiguille à l’intérieur du capuchon externe de l’aiguille sans toucher l’aiguille ou le capuchon externe de l’aiguille. |
|
|
Quand l’aiguille est recouverte, emboîtez complètement et avec précaution le capuchon externe de l’aiguille. Dévissez alors l’aiguille. Jetez-la avec précaution et remettez le capuchon sur le stylo. Quand le stylo est vide, jetez-le avec précaution, sans l’aiguille attachée. Veuillez jeter le stylo et l’aiguille conformément à la réglementation en vigueur. |
|
|
|
|