Dernière mise à jour le 06/11/2025
BIMATOPROST/TIMOLOL VIATRIS 0,3 mg/mL + 5 mg/mL, collyre en solution
Indications thérapeutiques
Classe pharmacothérapeutique : Médicaments ophtalmologiques – Bétabloquants - code ATC : S01ED51
BIMATOPROST/TIMOLOL VIATRIS 0,3 mg/mL + 5 mg/mL, collyre en solution contient deux substances actives différentes (bimatoprost et timolol) qui réduisent toutes deux la pression dans l’œil. Le bimatoprost, analogue de la prostaglandine, appartient à un groupe de médicaments appelés prostamides. Le timolol appartient à un groupe de médicaments appelés bétabloquants.
L’œil contient un liquide aqueux et transparent qui nourrit l'intérieur de l'œil. Ce liquide est constamment évacué de l'œil et du nouveau liquide est produit pour le remplacer. Si le liquide ne peut pas être évacué suffisamment vite, la pression à l'intérieur de l'œil augmente, ce qui risque éventuellement à la longue d’endommager la vue (une maladie appelée glaucome). BIMATOPROST/TIMOLOL VIATRIS 0,3 mg/mL + 5 mg/mL, collyre en solution agit en réduisant la production de liquide et également en augmentant la quantité de liquide évacué. Cela diminue la pression à l'intérieur de l'œil.
Le collyre BIMATOPROST/TIMOLOL VIATRIS 0,3 mg/mL + 5 mg/mL, collyre en solution est utilisé pour traiter la pression élevée dans l’œil chez l’adulte y compris le sujet âgé. Cette pression élevée peut entraîner un glaucome. Votre médecin vous prescrit BIMATOPROST/TIMOLOL VIATRIS 0,3 mg/mL + 5 mg/mL, collyre en solution quand les autres collyres contenant des bétabloquants ou des analogues des prostaglandines seuls n’ont pas été assez efficaces.
Présentations
> 1 flacon(s) compte-gouttes polyéthylène basse densité (PEBD) de 3 ml
Code CIP : 34009 301 076 8 3
Déclaration de commercialisation : 31/05/2022
Cette présentation est agréée aux collectivités
- Prix hors honoraire de dispensation : 6,62 €
- Honoraire de dispensation : 1,02 €
- Prix honoraire compris : 7,64 €
- Taux de remboursement :65 %
Service médical rendu (SMR)
Amélioration du service médical rendu (ASMR)
Ce médicament étant un générique, l'ASMR n'a pas été évalué par la commission de la transparence (CT), il est possible de se référer à la /aux spécialité(s) de référence du groupe générique auquel appartient ce médicament (cliquez ici pour aller à la rubrique des groupes génériques)
ANSM - Mis à jour le : 11/02/2025
BIMATOPROST/TIMOLOL VIATRIS 0,3 mg/mL + 5 mg/mL, collyre en solution
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Bimatoprost.......................................................................................................................... 0,3 mg
Timolol.................................................................................................................................... 5 mg
(équivalant à 6,8 mg de maléate de timolol)
Pour un mL de solution.
Excipients à effet notoire :
Chaque mL de solution contient 0,05 mg de chlorure de benzalkonium et 0,95 mg de phosphates.
Pour la liste complète des excipients, voir rubrique 6.1.
Solution incolore à légèrement jaune.
Le pH de la solution est de 6,5 à 7,8, l’osmolalité est de 260 à 320 mOsmol/kg.
4.1. Indications thérapeutiques
Réduction de la pression intraoculaire (PIO) chez les patients adultes atteints de glaucome à angle ouvert ou d’hypertension oculaire chez qui la réponse aux bétabloquants topiques ou aux analogues des prostaglandines est insuffisante.
4.2. Posologie et mode d'administration
Posologie
Posologie recommandée chez les adultes (y compris les sujets âgés)
La posologie recommandée est d’une goutte de BIMATOPROST/TIMOLOL VIATRIS 0,3 mg/mL + 5 mg/mL, collyre en solution dans l’œil ou les yeux atteint(s) une fois par jour, soit le matin, soit le soir. Elle doit être administrée chaque jour à la même heure.
Les données de la littérature pour bimatoprost/timolol suggèrent qu’une administration le soir peut être plus efficace qu’une administration le matin sur la baisse de la PIO. Cependant, le choix d’administration le matin ou le soir devra être fondé sur le meilleur potentiel d’observance (voir rubrique 5.1).
Si une dose est omise, il convient d’administrer la dose suivante comme prévu. La posologie ne doit pas dépasser une goutte par jour dans l’œil ou les yeux atteint(s).
Insuffisance rénale ou hépatique
Bimatoprost/timolol n’a pas été étudié chez les malades atteints d’insuffisance hépatique ou d’insuffisance rénale. En conséquence, il doit être utilisé avec précaution chez ces patients.
Population pédiatrique
La sécurité et l’efficacité de bimatoprost/timolol chez les enfants âgés de 0 à 18 ans n’ont pas été établies. Aucune donnée n’est disponible.
Mode d’administration
En cas d’administration concomitante de plusieurs médicaments ophtalmiques à usage local, chacun doit être administré à un intervalle d’au moins 5 minutes.
Pratiquer une occlusion nasolacrymale ou fermer les paupières pendant 2 minutes permet de réduire l'absorption systémique. Cette pratique vise à minimiser les effets secondaires systémiques et à favoriser l'action locale du collyre.
· Hypersensibilité aux substances actives ou à l’un des excipients mentionnés à la rubrique 6.1.
· Hyperactivité bronchique, incluant asthme bronchique ou antécédent d’asthme bronchique et bronchopneumopathie obstructive chronique grave.
· Bradycardie sinusale, syndrome de dysfonctionnement sinusal, bloc sino-auriculaire, bloc auriculo-ventriculaire du deuxième ou troisième degré, non contrôlé par pacemaker. Insuffisance cardiaque manifeste, choc cardiogénique.
4.4. Mises en garde spéciales et précautions d'emploi
Comme pour d’autres médicaments ophtalmiques à usage local, les substances actives (timolol/ bimatoprost) contenues dans BIMATOPROST/TIMOLOL VIATRIS 0,3 mg/mL + 5 mg/mL, collyre en solution peuvent passer dans la circulation générale. Aucune augmentation de l’absorption systémique de chaque principe actif n’a été observée. En raison de la présence d'un composant bêta-adrénergique, le timolol, des effets indésirables cardiovasculaires, pulmonaires et autres effets indésirables, similaires à ceux rapportés avec les bétabloquants par voie générale, sont susceptibles de se produire. L’incidence des effets indésirables systémiques après une administration ophtalmique topique est plus faibles qu’après une administration systémique. Pour réduire l'absorption systémique, voir rubrique 4.2.
Troubles cardiaques
Les patients souffrant de maladies cardiovasculaires (par ex. maladie coronarienne, angor de Prinzmetal ou insuffisance cardiaque) et sous traitement hypotenseur par des bétabloquants doivent être évalués de manière approfondie, et un traitement par d'autres substances actives doit être envisagé. Les patients atteints de maladies cardiovasculaires doivent être surveillés afin de dépister tout signe d’altération de leur maladie et d’effets indésirables.
En raison de leur effet négatif sur le temps de conduction, les bétabloquants doivent être administrés avec précaution aux patients atteints de bloc cardiaque du premier degré.
Troubles vasculaires
Il convient de traiter avec prudence les patients atteints de troubles/perturbations sévères de la circulation périphérique (i.e. les formes sévères de la maladie de Raynaud ou du syndrome de Raynaud).
Troubles respiratoires
Des réactions respiratoires, dont des décès dus à un bronchospasme chez des patients asthmatiques, ont été rapportées après l’administration de certains bétabloquants ophtalmiques.
BIMATOPROST/TIMOLOL VIATRIS 0,3 mg/mL + 5 mg/mL, collyre en solution doit être utilisé avec prudence chez les patients atteints de broncho-pneumopathie chronique obstructive (BPCO) légère/modérée et uniquement si le bénéfice potentiel l’emporte sur le risque potentiel.
Troubles endocriniens
Les inhibiteurs bêta-adrénergiques doivent être administrés avec prudence chez les patients ayant une tendance à l’hypoglycémie spontanée et chez les patients atteints de diabète instable, car les bétabloquants peuvent masquer les signes et symptômes d’hypoglycémie aiguë.
Les bétabloquants risquent également de masquer les signes d’hyperthyroïdie.
Maladies de la cornée
Les bétabloquants ophtalmiques peuvent provoquer une sécheresse oculaire. Les patients atteints de maladies de la cornée doivent être traités avec prudence.
Autres agents bétabloquants
L'effet sur la pression intraoculaire ou les effets connus du blocage bêta-adrénergique systémique peuvent être potentialisés lorsque le timolol est administré à des patients recevant déjà un agent bêta-bloquant systémique. La réponse de ces patients doit être étroitement surveillée. L'utilisation de deux bêta-bloquants à usage topique n'est pas recommandée (voir rubrique 4.5).
Réactions anaphylactiques
Durant un traitement par des bétabloquants, les patients qui ont des antécédents d’atopie ou de réaction anaphylactique grave à divers allergènes peuvent se montrer plus sensibles aux expositions répétées à ces allergènes ou réfractaires aux doses usuelles d’adrénaline utilisées pour traiter les réactions anaphylactiques.
Décollement de la choroïde
Un décollement de la choroïde a été rapporté après administration d'un traitement visant à réduire la sécrétion d'humeur aqueuse (par ex. timolol, acétazolamide), suite à une intervention chirurgicale de filtration.
Anesthésie chirurgicale
Les préparations ophtalmologiques de bétabloquants peuvent bloquer les effets bêta-agonistes systémiques de l'adrénaline, par exemple. L'anesthésiste doit être informé que le patient suit un traitement par timolol.
Hépatiques
Chez des patients qui avaient avant traitement un antécédent de maladie hépatique modérée ou des taux anormaux d’alanine-aminotransférase (ALAT), aspartate-aminotransférase (ASAT) et/ou bilirubine, aucun effet secondaire sur la fonction hépatique n’a été rapporté au cours d’un traitement de 24 mois par le bimatoprost. Le timolol par voie oculaire n’est associé à aucun effet indésirable connu sur la fonction hépatique.
Oculaires
Avant le début du traitement, les patients doivent être informés de la possibilité d’une périorbitopathie associée aux analogues des prostaglandines (PAP)et d’une augmentation de la pigmentation brune de l'iris, comme cela a été observé au cours des études chez les patients traités par le bimatoprost et bimatoprost/timolol. Certaines de ces modifications peuvent être permanentes et peuvent entraîner une altération du champ de vision et des différences d'apparence entre les yeux si un seul œil est traité (voir rubrique 4.8).
Des cas d'œdème maculaire, incluant des cas d’œdème maculaire cystoïde, ont été rapportés avec bimatoprost/timolol. Par conséquent, BIMATOPROST/TIMOLOL VIATRIS 0,3 mg/mL + 5 mg/mL, collyre en solution doit être utilisé avec prudence chez les patients aphaques, chez les patients pseudophaques avec rupture capsulaire postérieure et chez les patients présentant des facteurs de risque connus d’œdème maculaire (par ex. chirurgie intraoculaire, occlusions des veines de la rétine, maladie oculaire inflammatoire et rétinopathie diabétique).
BIMATOPROST/TIMOLOL VIATRIS 0,3 mg/mL + 5 mg/mL, collyre en solution doit être utilisé avec prudence chez les patients présentant une inflammation intraoculaire active (par ex. uvéite) car l’inflammation peut être exacerbée.
Peau
La croissance pileuse peut être augmentée dans les zones où la solution de BIMATOPROST/TIMOLOL VIATRIS 0,3 mg/mL + 5 mg/mL, collyre en solution entre en contact avec la surface de la peau de manière répétée. Il est donc important d’appliquer BIMATOPROST/TIMOLOL VIATRIS 0,3 mg/mL + 5 mg/mL, collyre en solution en suivant les consignes et d’éviter un écoulement le long de la joue ou sur d’autres zones cutanées.
Autres affections
Bimatoprost/timolol n’a pas été étudié chez les patients présentant un œil inflammatoire, un glaucome néovasculaire, inflammatoire, à angle étroit, à angle fermé ou congénital.
Des études portant sur bimatoprost 0,3 mg/l chez des patients présentant un glaucome ou une hypertension oculaire ont montré que l’administration de plus d’une dose quotidienne de bimatoprost dans l’œil peut avoir pour résultat une baisse moins importante de la PIO. Les patients qui utilisent BIMATOPROST/TIMOLOL VIATRIS 0,3 mg/mL + 5 mg/mL, collyre en solution avec d’autres analogues des prostaglandines doivent être surveillés pour détecter des modifications de leur pression intraoculaire.
Excipients à effet notoire
Ce médicament contient 0,05 mg de chlorure de benzalkonium par millilitre.
Le chlorure de benzalkonium peut être absorbé par les lentilles de contact souples et changer leur couleur. Le patient doit retirer les lentilles de contact avant d’appliquer le médicament et attendre au moins 15 minutes avant de les remettre.
Le chlorure de benzalkonium peut également provoquer une irritation des yeux, surtout si le patient souffre du syndrome de l’œil sec ou de troubles de la cornée (couche transparente à l’avant de l’œil). En cas de sensation anormale, de picotements ou de douleur dans les yeux après avoir utilisé ce médicament, le patient doit contacter son médecin.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Aucune étude d’interaction spécifique n’a été réalisée avec l’association fixe bimatoprost/timolol.
Des effets additifs ayant pour conséquence une hypotension et/ou une bradycardie marquée peuvent se produire quand une solution ophtalmique contenant des bétabloquants est administrée en association avec des inhibiteurs calciques oraux, la guanéthidine, des bétabloquants adrénergiques, des parasympathomimétiques, des antiarythmiques (dont l'amiodarone) et des glucosides digitaliques.
Une potentialisation du blocage bêta-adrénergique systémique (par ex., réduction de la fréquence cardiaque, dépression) a été rapportée au cours d'un traitement associant un inhibiteur du CYP2D6 (par ex., quinidine, fluoxétine, paroxétine) et le timolol.
Des mydriases dues à l'utilisation concomitante de bétabloquants ophtalmiques et d'adrénaline (épinéphrine) ont été rapportées occasionnellement.
4.6. Fertilité, grossesse et allaitement
Grossesse
Il n’existe aucune donnée pertinente concernant l’utilisation de l’association fixe bimatoprost/timolol chez la femme enceinte. BIMATOPROST/TIMOLOL VIATRIS 0,3 mg/mL + 5 mg/mL, collyre en solution ne doit pas être utilisé au cours de la grossesse, sauf en cas de nécessité absolue. Pour réduire l'absorption systémique, voir rubrique 4.2.
Bimatoprost
Il n’existe pas de données cliniques pertinentes sur l’utilisation chez la femme enceinte. Les études chez l’animal ont mis en évidence une toxicité sur la reproduction à de fortes doses maternotoxiques (voir rubrique 5.3).
Timolol
Les études épidémiologiques n’ont pas mis en évidence de signe de malformation fœtale, mais ont montré un risque de retard de croissance intra-utérin après une exposition à des bétabloquants par voie orale. De plus, des signes et symptômes évocateurs d’un blocage bêta-adrénergique (par ex. bradycardie, hypotension, détresse respiratoire et hypoglycémie) ont été observés chez le nouveau-né quand un traitement par des bétabloquants était administré avant l’accouchement. Si BIMATOPROST/TIMOLOL VIATRIS 0,3 mg/mL + 5 mg/mL, collyre en solution est administré avant l’accouchement, le nouveau-né doit être étroitement surveillé durant les premiers jours de sa vie. Les études menées avec le timolol chez l’animal ont mis en évidence des effets toxiques sur la reproduction à des doses significativement supérieures à celles qui sont utilisées dans la pratique clinique (voir rubrique 5.3).
Allaitement
Timolol
Les bétabloquants sont excrétés dans le lait maternel. Cependant, aux doses thérapeutiques du timolol en collyre, il est peu probable que des quantités suffisamment importantes soient présentes dans le lait maternel pour provoquer des symptômes cliniques de blocage bêta-adrénergique chez le nourrisson. Pour réduire l'absorption systémique, voir rubrique 4.2.
Bimatoprost
Le passage du bimatoprost dans le lait maternel humain n’est pas connu, mais le bimatoprost est excrété dans le lait des rates allaitantes. Il est donc recommandé de ne pas utiliser BIMATOPROST/TIMOLOL VIATRIS 0,3 mg/mL + 5 mg/mL, collyre en solution chez la femme allaitante.
Fertilité
Il n’existe aucune donnée sur les effets de bimatoprost/timolol sur la fertilité humaine.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
BIMATOPROST/TIMOLOL VIATRIS 0,3 mg/mL + 5 mg/mL, collyre en solution
Résumé du profil de sécurité
Les effets indésirables observés dans les études cliniques utilisant bimatoprost/timolol ont été limités à ceux rapportés antérieurement pour chacune des substances actives, bimatoprost et timolol prises séparément. Aucun autre effet indésirable spécifique à bimatoprost/timolol n’a été observé dans les études cliniques.
La plupart des effets indésirables observés dans les études cliniques utilisant bimatoprost/timolol ont été oculaires et d’intensité modérée, et aucun n’a été qualifié de grave. D’après les données cliniques obtenues sur 12 mois, l’effet indésirable le plus fréquemment rapporté est une hyperhémie conjonctivale (généralement minime à modérée et considérée comme non inflammatoire), qui s’est produite chez 26 % environ des patients et a conduit à un arrêt du traitement chez 1,5 % des patients.
Liste tabulée des effets indésirables
Le tableau 1 présente les effets indésirables qui ont été rapportés pendant les études cliniques avec bimatoprost/timolol (flacon multidose et récipient unidose) (dans chaque catégorie, les effets indésirables sont présentés dans l’ordre décroissant de gravité) ou après la commercialisation.
La fréquence des effets indésirables possibles présentés ci-dessous est définie à l’aide de la convention suivante :
|
Très fréquent |
|
|
|
Fréquent |
≥1/100 et <1/10 |
|
|
Peu fréquent |
≥1/1 000 et <1/100 |
|
|
Rare |
≥1/10 000 et 1/1 000 |
|
|
Très rare |
<1/10 000 |
|
|
Fréquence indéterminée |
La fréquence ne peut être estimée sur la base des données disponibles |
Tableau 1
|
Classe de système d’organes |
Fréquence |
Effet indésirable |
|
Affections du système immunitaire |
Fréquence indéterminée |
réactions d’hypersensibilité incluant les signes ou symptômes de dermatite allergique, angioedème, allergie oculaire |
|
Affections psychiatriques |
Fréquence indéterminée |
Insomnie2, cauchemars2 |
|
Affections du système nerveux |
Fréquent |
céphalées |
|
Fréquence indéterminée |
dysgueusie2, vertiges |
|
|
Affections oculaires |
Très fréquent |
hyperhémie conjonctivale. périorbitopathie associée aux analogues des prostaglandines |
|
Fréquent |
kératite ponctuée, érosion de la cornée2, sensation de brûlure2, irritation conjonctivale1, prurit oculaire, sensation de picotements dans l’œil2, sensation de corps étranger, sécheresse oculaire, érythème de la paupière, douleur oculaire, photophobie, écoulement oculaire, troubles visuels2, prurit de la paupière, baisse de l’acuité visuelle2, blépharite2, œdème de la paupière, irritation oculaire, augmentation de la sécrétion lacrymale, croissance des cils. |
|
|
Peu fréquent |
iritis2, œdème conjonctival2, douleur de la paupière2, sensation anormale dans l’œil1, asthénopie, trichiasis2, hyperpigmentation de l’iris2, , rétraction de la paupière2, altération de la couleur des cils (assombrissement)1 |
|
|
Fréquence indéterminée |
œdème maculaire cystoïde2, gonflement de l’œil, vision trouble2, gêne oculaire |
|
|
Affections cardiaques |
Fréquence indéterminée |
bradycardie |
|
Affections vasculaires |
Fréquence indéterminée |
hypertension |
|
Affections respiratoires, thoraciques et médiastinales |
Fréquent |
rhinite2 |
|
Peu fréquent |
dyspnée |
|
|
Fréquence indéterminée |
bronchospasme (surtout chez des patients présentant une maladie bronchospastique préexistante) 2, asthme |
|
|
Affections de la peau et du tissu sous-cutané |
Fréquent |
pigmentation palpébrale2, hirsutisme2, hyperpigmentation cutanée (périoculaire) |
|
Fréquence indéterminée |
alopécie, décoloration de la peau (périoculaire) |
|
|
Troubles généraux et anomalies au site d’administration |
Fréquence indéterminée |
fatigue |
1 Effets indésirables observés uniquement avec bimatoprost/timolol en récipient unidose.
2 Effets indésirables observés uniquement avec bimatoprost/timolol en flacon multidose.
Comme c'est le cas avec d'autres produits ophtalmiques à usage local, BIMATOPROST/TIMOLOL VIATRIS 0,3 mg/mL + 5 mg/mL, collyre en solution peut passer dans la circulation systémique. L’absorption de timolol peut provoquer des effets indésirables similaires à ceux observés avec les bétabloquants systémiques. L’incidence des effets indésirables systémiques après une administration ophtalmique locale est plus faible qu’après une administration systémique. Pour réduire l'absorption systémique, voir rubrique 4.2.
D’autres effets indésirables qui ont été rapportés avec l’une des deux substances actives (bimatoprost ou timolol), et sont donc susceptibles d’être observés avec bimatoprost/timolol, sont répertoriés ci-dessous dans le tableau 2 :
Tableau 2
|
Classe de système d’organes |
Effet indésirable |
|
Affections du système immunitaire |
réactions allergiques systémiques incluant anaphylaxie1 |
|
Troubles du métabolisme et de la nutrition |
hypoglycémie1 |
|
Affections psychiatriques |
dépression1, perte de mémoire1, hallucinations1 |
|
Affections du système nerveux |
syncope1, accident cérébrovasculaire1, aggravation des signes et symptômes de myasthénie grave1, paresthésie1, ischémie cérébrale1 |
|
Affections oculaires |
baisse de la sensibilité cornéenne1, diplopie1, ptosis1, décollement de la choroïde après chirurgie filtrante (voir rubrique 4.4)1, kératite1, blépharospasme2, hémorragie rétinienne2, uvéite2 |
|
Affections cardiaques |
bloc auriculo-ventriculaire1, arrêt cardiaque1, arythmies1, défaillance cardiaque1, insuffisance cardiaque congestive1, douleurs thoraciques1, palpitations1, oedème1 |
|
Affections vasculaires |
hypotension1, phénomène de Raynaud1, refroidissement des mains et des pieds1 |
|
Affections respiratoires, thoraciques et médiastinales |
exacerbation de l’asthme2, exacerbation de la BPCO2, toux1 |
|
Affections gastro-intestinales |
nausées1,2, diarrhée1, dyspepsie1, sécheresse buccale1, douleurs abdominales1, vomissements1 |
|
Affections de la peau et du tissu sous-cutané |
éruption psoriasiforme1 ou aggravation du psoriasis1, éruption cutanée1 |
|
Affections musculo-squelettiques et systémiques |
myalgie1 |
|
Affections des organes de reproduction et du sein |
dysfonctionnements sexuels1, baisse de la libido1 |
|
Troubles généraux et anomalies au site d’administration |
asthénie1,2 |
|
Investigations |
anomalies des tests de l’exploration fonctionnelle hépatique2 |
1 Effets indésirables observés avec le timolol en monothérapie.
2 Effets indésirables observés avec le bimatoprost en monothérapie.
Effets indésirables rapportés avec les collyres contenant du phosphate
Des cas de calcification cornéenne ont été très rarement rapportés lors de l’utilisation de collyres contenant du phosphate chez certains patients présentant des altérations significatives de la cornée.
Description des effets indésirables sélectionnés
Périorbitopathie associée aux analogues des prostaglandines (PAP)
Les analogues des prostaglandines, y compris le bimatoprost/timolol, peuvent entraîner des modifications lipodystrophiques périorbitaires qui peuvent provoquer un approfondissement du sillon palpébral, un ptosis, une énophtalmie, une rétraction de la paupière, une involution du dermatochalasis et une exposition sclérale inférieure. Ces modifications sont généralement modérées, peuvent se produire dès un mois après le début du traitement par bimatoprost/timolol et peuvent entraîner une altération du champ de vision même sans reconnaissance de la part du patient. La PAP est également associée à une hyperpigmentation ou décoloration de la peau périoculaire et à une hypertrichose. Il a été constaté que ces modifications sont partiellement ou totalement réversibles en cas d’arrêt du traitement ou de recours à un autre traitement.
Hyperpigmentation de l’iris
L’augmentation de la pigmentation de l’iris sera probablement permanente. La modification de la pigmentation est due à une augmentation de la teneur en mélanine dans les mélanocytes plutôt qu’à un nombre accru de mélanocytes. Les effets à long terme de l’augmentation de la pigmentation de l’iris ne sont pas connus. Les modifications de la couleur de l’iris observées avec l’administration ophtalmique de bimatoprost peuvent ne pas être visibles avant plusieurs mois ou plusieurs années.
Habituellement, la pigmentation brune autour des pupilles s’étend de manière concentrique vers la périphérie de l’iris, et la totalité ou une partie de l’iris prend une couleur brunâtre. Le traitement paraît ne pas affecter les nævi et les éphélides de l’iris. L’incidence de l’hyperpigmentation de l’iris après 12 mois de traitement par un collyre contenant 0,1 mg/mL de bimatoprost était de 0,5 %. Avec le collyre contenant 0,3 mg/mL de bimatoprost, l’incidence qui était de 1,5 % à 12 mois (voir rubrique 4.8, Tableau 2), n’a pas augmenté pendant les 3 années de traitement.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/.
Bimatoprost
Si bimatoprost/timolol est ingéré accidentellement, les informations suivantes peuvent être utiles : dans les études par voie orale de deux semaines menées chez des rats et des souris, des doses allant jusqu'à 100 mg/kg/jour n'ont entraîné aucune toxicité. Cette dose exprimée en mg/m2 est au moins 70 fois supérieure à la dose correspondant à l’ingestion accidentelle d’un flacon de bimatoprost/timolol par un enfant de 10 kg.
Timolol
Les symptômes d’un surdosage systémique par le timolol incluent : bradycardie, hypotension, bronchospasme, céphalées, vertiges, difficultés respiratoires et arrêt cardiaque. Une étude chez des patients présentant une insuffisance rénale a indiqué que le timolol n’est pas éliminé facilement par dialyse.
En cas de surdosage, un traitement symptomatique et de soutien doit être mis en place.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Mécanisme d’action
BIMATOPROST/TIMOLOL VIATRIS 0,3 mg/mL + 5 mg/mL, collyre en solution contient deux substances actives : le bimatoprost et le timolol. Ces deux composants réduisent la pression intraoculaire (PIO) élevée par des mécanismes d’action complémentaires, et leur effet combiné résulte en une baisse additionnelle de la PIO par comparaison à celle induite par l’un ou l’autre composé en monothérapie. BIMATOPROST/TIMOLOL VIATRIS 0,3 mg/mL + 5 mg/mL, collyre en solution a un délai d’action rapide.
Le bimatoprost est une substance active hypotensive oculaire puissante. C’est un prostamide synthétique, structurellement apparenté à la prostaglandine F2α (PGF2α) qui n’agit pas par l’intermédiaire de récepteurs aux prostaglandines connus. Le bimatoprost reproduit de façon sélective les effets de nouvelles substances biosynthétiques récemment découvertes et appelées prostamides. Cependant, la structure des récepteurs aux prostamides n’a pas encore été identifiée. Le bimatoprost réduit la pression intraoculaire chez l'homme en augmentant l'écoulement de l'humeur aqueuse par le trabeculum et en améliorant l'écoulement uvéo-scléral.
Le timolol est un inhibiteur non sélectif des récepteurs bêta1- et bêta2-adrénergiques qui n’a pas d’activité sympathomimétique intrinsèque significative, ni d'action dépressive directe sur le myocarde ou d’effet anesthésique local (activité stabilisatrice des membranes). Le timolol abaisse la PIO en réduisant la formation d’humeur aqueuse. Son mécanisme d’action exact n’est pas clairement élucidé, mais il est probable qu’il fasse intervenir une inhibition de l’augmentation de la synthèse d’AMP cyclique induite par une stimulation bêta-adrénergique endogène.
Efficacité clinique
La baisse de la PIO produite par BIMATOPROST/TIMOLOL VIATRIS 0,3 mg/mL + 5 mg/mL, collyre en solution n’est pas inférieure à celle observée avec un traitement associant le bimatoprost (une fois par jour) et le timolol (deux fois par jour).
Les données de la littérature sur bimatoprost/timolol suggèrent qu’une administration le soir peut être plus efficace qu’une administration le matin sur la baisse de la PIO. Cependant, le choix d’administration le matin ou le soir devra être fondé sur le meilleur potentiel d’observance.
Population pédiatrique
La sécurité et l’efficacité de bimatoprost/timolol chez les enfants de 0 à 18 ans n’ont pas été établies.
5.2. Propriétés pharmacocinétiques
BIMATOPROST/TIMOLOL VIATRIS 0,3 mg/mL + 5 mg/mL, collyre en solution
Les concentrations plasmatiques en bimatoprost et en timolol ont été mesurées au cours d’une étude croisée comparant les effets de ces deux monothérapies à ceux de bimatoprost/timolol, chez des sujets sains. L’absorption systémique de chaque composé pris individuellement » a été minimale ; elle n’a pas été modifiée lors de leur administration simultanée dans une même formulation.
Aucune accumulation de l’un ou l’autre des principes actifs n’a été mise en évidence durant les deux études de 12 mois au cours desquelles l’absorption systémique a été mesurée.
Bimatoprost
Le bimatoprost pénètre bien dans la cornée et la sclère humaine in vitro. Après administration par voie ophtalmique, l'exposition systémique au bimatoprost est très faible. Aucune accumulation n’est observée avec le temps. Après administration répétée pendant deux semaines d'une goutte par jour de bimatoprost 0,03 % dans les deux yeux, le pic plasmatique est obtenu 10 minutes après l’instillation. Les concentrations plasmatiques circulantes deviennent inférieures à la limite de détection (0,025 ng/mL) au bout de 1 heure 30 environ après l’instillation. Les valeurs moyennes de la Cmax et de l'ASC0-24h (Aire Sous la Courbe) ont été comparables au 7ème jour et au 14ème jour (environ 0,08 ng/mL et 0,09 ng h/mL) respectivement, indiquant qu'une concentration stable en principe actif est atteinte durant la première semaine de traitement.
Le bimatoprost est modérément distribué dans les tissus de l’organisme, et le volume de distribution systémique était de 0,67 l/kg à l’état d’équilibre chez l’Homme. Au niveau sanguin, le bimatoprost est retrouvé principalement dans le plasma sous forme liée aux protéines plasmatiques (environ 88 %).
La forme inchangée du bimatoprost représente l’entité majoritaire dans la circulation systémique après une administration oculaire. Le bimatoprost subit une métabolisation par voie oxydative (N-déséthylation et glucuronidation) aboutissant à la formation de divers métabolites.
Le bimatoprost est principalement éliminé par excrétion rénale. Chez des volontaires sains, jusqu’à 67 % de la dose administrée en une injection intraveineuse est éliminée dans l'urine et 25 % sont excrétés dans les fèces. La demi-vie d'élimination déterminée après administration intraveineuse est d'environ 45 minutes ; la clairance sanguine totale est de 1,5 l/h/kg.
Caractéristiques chez les sujets âgés
Lors de l’administration au rythme de 2 instillations par jour, l’exposition systémique au bimatoprost observée chez le sujet âgé de plus de 65 ans (ASC0-24h moyenne : 0,0634 ngh/mL) est nettement supérieure à celle observée chez l’adulte jeune (ASC0-24h moyenne : 0,0218 ngh/mL).
Toutefois, en raison du faible passage systémique par voie oculaire, cette exposition systémique au bimatoprost reste faible et sans pertinence clinique, aussi bien chez les sujets âgés que chez les sujets jeunes. Compte tenu de l’absence d'accumulation du bimatoprost dans le sang, le profil de sécurité serait comparable chez les patients âgés et les patients jeunes.
Timolol
Le pic des concentrations en timolol atteint 898 ng/mL dans l’humeur aqueuse une heure après l’administration oculaire d’un collyre en solution à 0,5 % chez des sujets soumis à un traitement chirurgical de la cataracte. Une partie de la dose passe dans la circulation générale et subit un métabolisme hépatique important. La demi-vie plasmatique du timolol est de l’ordre de 4 à 6 heures. Le timolol est partiellement métabolisé dans le foie, et excrété avec ses métabolites par les reins. Le taux de liaison du timolol aux protéines plasmatiques est faible.
5.3. Données de sécurité préclinique
Médicament BIMATOPROST/TIMOLOL VIATRIS 0,3 mg/mL + 5 mg/mL, collyre en solution
Les études de toxicité de bimatoprost/timolol en administration répétée par voie oculaire n’ont révélé aucun risque particulier pour l’Homme. Le profil de sécurité oculaire et systémique de chaque principe actif pris individuellement est bien établi.
Bimatoprost
Les données précliniques obtenues durant des études conventionnelles de pharmacologie de sécurité, de génotoxicité, de cancérogénèse n’ont pas révélé de risque particulier pour l’Homme. Dans les études chez les rongeurs, des avortements spécifiques à l'espèce ont été observés pour des niveaux d'exposition systémique 33 à 97 fois supérieurs à ceux atteints chez l'Homme après instillation oculaire.
Chez le singe, l’administration quotidienne par voie ophtalmique de bimatoprost à des concentrations ≥ 0,03 % pendant un an a entraîné une augmentation de la pigmentation de l’iris et des modifications périoculaires réversibles, dose-dépendantes, caractérisées par une proéminence des culs de sac supérieurs et/ou inférieurs et un élargissement de la fente palpébrale. Le processus d’augmentation de la pigmentation de l’iris semble être dû à une stimulation accrue de la production de mélanine dans les mélanocytes et non à une augmentation du nombre de mélanocytes. Il n’a pas été observé de modification fonctionnelle ou microscopique liée à ces effets périoculaires. Le mécanisme sous-jacent à ces effets périoculaires est inconnu.
Timolol
Les données précliniques obtenues à partir des études conventionnelles de pharmacologie de sécurité, de toxicologie en administrations répétées, de génotoxicité, de cancérogénèse et de toxicité de reproduction n’ont pas révélé de risque particulier pour l’Homme.
Chlorure de sodium,
Phosphate disodique heptahydraté,
Acide citrique monohydraté,
Acide chlorhydrique, ou hydroxyde de sodium (pour ajuster le pH),
Eau purifiée
3 ans.
Après première ouverture : 4 semaines.
6.4. Précautions particulières de conservation
Ce médicament ne nécessite pas de précautions particulières de conservation.
6.5. Nature et contenu de l'emballage extérieur
Flacon blanc en polyéthylène basse densité (PEBD) muni d’un embout compte-goutte blanc en PEBD et d’un bouchon d’inviolabilité bleu foncé en polyéthylène haute densité (PEHD).
Chaque flacon a un volume de remplissage de 3 mL.
Boîte contenant 1 ou 3 flacons.
Toutes les présentations peuvent ne pas être commercialisées.
6.6. Précautions particulières d’élimination et de manipulation
Tout médicament non utilisé ou déchet doit être éliminé conformément aux exigences locales.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
1 RUE DE TURIN
69007 LYON
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 301 076 8 3 : Flacon de 3 ml (PEBD). Boite de 1.
· 34009 301 076 9 0 : Flacon de 3 ml (PEBD). Boite de 3.
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Liste I.
ANSM - Mis à jour le : 11/02/2025
BIMATOPROST/TIMOLOL VIATRIS 0,3 mg/mL + 5 mg/mL, collyre en solution
Bimatoprost/Timolol
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin ou votre pharmacien.
· Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d’autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
1. Qu'est-ce que BIMATOPROST/TIMOLOL VIATRIS 0,3 mg/mL + 5 mg/mL, collyre en solution et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant d'utiliser BIMATOPROST/TIMOLOL VIATRIS 0,3 mg/mL + 5 mg/mL, collyre en solution ?
3. Comment utiliser BIMATOPROST/TIMOLOL VIATRIS 0,3 mg/mL + 5 mg/mL, collyre en solution ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver BIMATOPROST/TIMOLOL VIATRIS 0,3 mg/mL + 5 mg/mL, collyre en solution ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE BIMATOPROST/TIMOLOL VIATRIS 0,3 mg/mL + 5 mg/mL, collyre en solution ET DANS QUELS CAS EST-IL UTILISE ?
Classe pharmacothérapeutique : Médicaments ophtalmologiques – Bétabloquants - code ATC : S01ED51
BIMATOPROST/TIMOLOL VIATRIS 0,3 mg/mL + 5 mg/mL, collyre en solution contient deux substances actives différentes (bimatoprost et timolol) qui réduisent toutes deux la pression dans l’œil. Le bimatoprost, analogue de la prostaglandine, appartient à un groupe de médicaments appelés prostamides. Le timolol appartient à un groupe de médicaments appelés bétabloquants.
L’œil contient un liquide aqueux et transparent qui nourrit l'intérieur de l'œil. Ce liquide est constamment évacué de l'œil et du nouveau liquide est produit pour le remplacer. Si le liquide ne peut pas être évacué suffisamment vite, la pression à l'intérieur de l'œil augmente, ce qui risque éventuellement à la longue d’endommager la vue (une maladie appelée glaucome). BIMATOPROST/TIMOLOL VIATRIS 0,3 mg/mL + 5 mg/mL, collyre en solution agit en réduisant la production de liquide et également en augmentant la quantité de liquide évacué. Cela diminue la pression à l'intérieur de l'œil.
Le collyre BIMATOPROST/TIMOLOL VIATRIS 0,3 mg/mL + 5 mg/mL, collyre en solution est utilisé pour traiter la pression élevée dans l’œil chez l’adulte y compris le sujet âgé. Cette pression élevée peut entraîner un glaucome. Votre médecin vous prescrit BIMATOPROST/TIMOLOL VIATRIS 0,3 mg/mL + 5 mg/mL, collyre en solution quand les autres collyres contenant des bétabloquants ou des analogues des prostaglandines seuls n’ont pas été assez efficaces.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D’UTILISER BIMATOPROST/TIMOLOL VIATRIS 0,3 mg/mL + 5 mg/mL, collyre en solution ?
N’utilisez jamais BIMATOPROST/TIMOLOL VIATRIS 0,3 mg/mL + 5 mg/mL, collyre en solution :
· si vous êtes allergique au bimatoprost, au timolol, aux bétabloquants ou à l’un des autres composants contenus dans ce médicament et mentionnés dans la rubrique 6 ;
· si vous souffrez ou avez souffert par le passé de toute maladie respiratoire, par exemple d’asthme, de bronchite obstructive chronique sévère (maladie pulmonaire grave pouvant entraîner des sifflements, des difficultés à respirer et/ou une toux persistante) ;
· si vous avez des problèmes cardiaques, par exemple une fréquence cardiaque basse, un bloc cardiaque ou une insuffisance cardiaque.
Avertissements et précautions
Adressez-vous à votre médecin ou pharmacien avant d’utiliser BIMATOPROST/TIMOLOL VIATRIS 0,3 mg/mL + 5 mg/mL, collyre en solution, si vous présentez ou avez présenté dans le passé :
· une maladie cardiaque coronarienne (les symptômes comprennent des douleurs thoraciques ou une oppression dans la poitrine, des difficultés respiratoires ou des suffocations), une insuffisance cardiaque ou une pression sanguine basse,
· des perturbations du rythme cardiaque comme un ralentissement du rythme cardiaque,
· des problèmes respiratoires, de l’asthme ou une broncho-pneumopathie chronique obstructive,
· une mauvaise circulation du sang (comme la maladie de Raynaud ou le syndrome de Raynaud),
· un hyperfonctionnement de la glande thyroïde, car le timolol peut masquer les signes et les symptômes d’une affection de la thyroïde,
· un diabète, car le timolol peut masquer les signes et les symptômes de faibles taux sanguins de sucre,
· des réactions allergiques graves,
· des problèmes hépatiques ou rénaux,
· des altérations de la surface de l’œil,
· une séparation de l’une des couches du globe oculaire après une opération destinée à réduire la pression dans l’œil,
· des facteurs de risque connus d'œdème maculaire (gonflement de la rétine à l'intérieur de l'œil entraînant une détérioration de la vision), comme une chirurgie de la cataracte.
Avant toute anesthésie chirurgicale, veuillez indiquer à votre médecin que vous prenez BIMATOPROST/TIMOLOL VIATRIS 0,3 mg/mL + 5 mg/mL, collyre en solution, car le timolol peut modifier les effets de certains médicaments utilisés pendant l’anesthésie.
Pendant le traitement, BIMATOPROST/TIMOLOL VIATRIS 0,3 mg/mL + 5 mg/mL, collyre en solution peut entraîner une perte de graisse autour de l’œil, ce qui peut provoquer un approfondissement du pli palpébral, un enfoncement de l’œil dans l’orbite (énophtalmie), un affaissement de la paupière supérieure (ptosis), un resserrement de la peau autour de l’œil (involution du dermatochalasis) et une plus grande visibilité de la partie inférieure blanche de l’œil (exposition sclérale inférieure). Les modifications sont généralement modérées, mais si elles sont marquées, elles peuvent altérer votre champ de vision. Les modifications peuvent disparaître si vous arrêtez le traitement par BIMATOPROST/TIMOLOL VIATRIS 0,3 mg/mL + 5 mg/mL, collyre en solution.
BIMATOPROST/TIMOLOL VIATRIS 0,3 mg/mL + 5 mg/mL, collyre en solution peut également provoquer un assombrissement et un allongement de vos cils, et assombrir également la peau qui entoure vos paupières. La couleur de votre iris peut aussi s'assombrir. Ces modifications peuvent être permanentes. Le changement peut être encore plus visible si vous ne traitez qu'un seul œil. BIMATOPROST/TIMOLOL VIATRIS 0,3 mg/mL + 5 mg/mL, collyre en solution peut provoquer la pousse des poils en cas de contact avec la surface de la peau.
Enfants et adolescents
BIMATOPROST/TIMOLOL VIATRIS 0,3 mg/mL + 5 mg/mL, collyre en solution ne doit pas être utilisé chez les enfants et les adolescents de moins de 18 ans.
Autres médicaments et BIMATOPROST/TIMOLOL VIATRIS 0,3 mg/mL + 5 mg/mL, collyre en solution
L’action de BIMATOPROST/TIMOLOL VIATRIS 0,3 mg/mL + 5 mg/mL, collyre en solution peut affecter ou être affectée par l’action d’autres médicaments que vous prenez, y compris par d’autres collyres prescrits en cas de glaucome. Informez votre médecin ou pharmacien si vous prenez, avez pris récemment ou pourriez prendre tout autre médicament. Avertissez votre médecin si vous utilisez ou comptez utiliser :
- des médicaments destinés à traiter les affections du cœur et des vaisseaux sanguins, comme hypertension (pression sanguine élevée), angine de poitrine et certains troubles du rythme cardiaque (par exemple guanéthidine, amiodarone) ;
- des médicaments pour traiter le diabète ;
- de la quinidine (utilisée pour traiter les problèmes cardiaques et certains types de paludisme) ;
- des médicaments pour traiter une dépression comme la fluoxétine et la paroxétine ;
- d’autres médicaments destinés à traiter le glaucome (autres bêta-bloquants) ;
- de l’adrénaline (fréquemment utilisée pour traiter les réactions allergiques sévères).
BIMATOPROST/TIMOLOL VIATRIS 0,3 mg/mL + 5 mg/mL, collyre en solution avec des aliments et boissons
Sans objet.
Si vous êtes enceinte ou que vous allaitez, si vous pensez être enceinte ou planifiez une grossesse, demandez conseil à votre médecin ou pharmacien avant de prendre ce médicament.
Grossesse
N’utilisez pas BIMATOPROST/TIMOLOL VIATRIS 0,3 mg/mL + 5 mg/mL, collyre en solution si vous êtes enceinte, à moins que votre médecin ne le recommande.
Allaitement
N’utilisez pas BIMATOPROST/TIMOLOL VIATRIS 0,3 mg/mL + 5 mg/mL, collyre en solution si vous allaitez. Le timolol peut passer dans le lait maternel.
Pendant la période d’allaitement, demandez conseil à votre médecin avant de prendre un médicament.
Conduite de véhicules et utilisation de machines
BIMATOPROST/TIMOLOL VIATRIS 0,3 mg/mL + 5 mg/mL, collyre en solution peut entraîner chez certains patients une vision trouble. Ne conduisez pas et n’utilisez pas de machines jusqu'au retour à une vision normale.
BIMATOPROST/TIMOLOL VIATRIS 0,3 mg/mL + 5 mg/mL, collyre en solution contient des phosphates et du chlorure de benzalkonium.
Ce médicament contient 0,95 mg de phosphates par millilitre et 0,05 mg de chlorure de benzalkonium.
Si vous souffrez de dommages sévères de la couche transparente située à l’avant de l’œil (cornée) les phosphates peuvent causer, dans de très rares cas, des tâches nuageuses sur la cornée en raison de l’accumulation de calcium pendant le traitement.
Le chlorure de benzalkonium peut être absorbé par les lentilles de contact souples et changer leur couleur. Vous devez retirer les lentilles de contact avant application et attendre au moins 15 minutes avant de les remettre.
Le chlorure de benzalkonium peut également provoquer une irritation des yeux, surtout si vous souffrez du syndrome de l’œil sec ou de troubles de la cornée (couche transparente à l’avant de l’œil). En cas de sensation anormale, de picotements ou de douleur dans les yeux après avoir utilisé ce médicament, contactez votre médecin.
3. COMMENT UTILISER BIMATOPROST/TIMOLOL VIATRIS 0,3 mg/mL + 5 mg/mL, collyre en solution ?
Veillez à toujours utiliser BIMATOPROST/TIMOLOL VIATRIS 0,3 mg/mL + 5 mg/mL, collyre en solution en suivant exactement les indications de votre médecin ou pharmacien. Vérifiez auprès de votre médecin ou pharmacien en cas de doute.
La dose recommandée est d’une goutte une fois par jour, soit le matin, soit le soir dans chaque œil à traiter. Utilisez chaque jour à la même heure, en suivant les instructions données ci-dessous.
Mode d’emploi
N’utilisez pas le flacon si la capsule d’inviolabilité située sur le col du flacon a été cassée avant sa première ouverture.
|
1. |
2. |
3. |
4. |
5. |
|
|
|
|
|
|
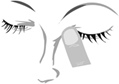
1. Lavez-vous les mains. Inclinez la tête légèrement en arrière et regardez en haut.
2. Tirez doucement la paupière inférieure jusqu'à ce qu'il y ait une petite poche.
3. Retournez le flacon à l'envers et appuyez dessus pour en détacher une goutte dans l’œil à traiter.
4. Lâchez la paupière inférieure et fermez votre œil.
5. Tout en maintenant l'œil fermé, appuyez avec votre doigt sur le coin interne de l'œil (le point de rencontre entre l’œil et le nez) et maintenez la position pendant 2 minutes. Ceci permet d’éviter que BIMATOPROST/TIMOLOL VIATRIS 0,3 mg/mL + 5 mg/mL, collyre en solution ne diffuse dans le reste du corps. Si une goutte tombe à côté de votre œil, recommencez.
Pour éviter toute contamination, ne laissez pas la pointe du flacon toucher votre œil ou quoi que ce soit. Remettez le bouchon et refermez le flacon aussitôt après l'avoir utilisé.
Si vous utilisez BIMATOPROST/TIMOLOL VIATRIS 0,3 mg/mL + 5 mg/mL, collyre en solution en même temps qu’une autre préparation ophtalmique, attendez 5 minutes au moins entre l’instillation de BIMATOPROST/TIMOLOL VIATRIS 0,3 mg/mL + 5 mg/mL, collyre en solution et celle de l’autre médicament. Toute préparation ophtalmique en pommade ou en gel doit être utilisée en dernier.
Si vous avez utilisé plus de BIMATOPROST/TIMOLOL VIATRIS 0,3 mg/mL + 5 mg/mL, collyre en solution que vous n’auriez dû
Il est peu probable que ceci entraîne des effets néfastes. Instillez la goutte suivante à l'heure habituelle. En cas d’inquiétude, parlez-en à votre médecin ou à votre pharmacien.
Si vous oubliez d’utiliser BIMATOPROST/TIMOLOL VIATRIS 0,3 mg/mL + 5 mg/mL, collyre en solution
Mettez une seule goutte dès que vous vous en rappelez, et ensuite reprenez votre traitement comme d'habitude. Ne prenez pas de dose double pour compenser la dose que vous avez oublié de prendre.
Si vous arrêtez d’utiliser BIMATOPROST/TIMOLOL VIATRIS 0,3 mg/mL + 5 mg/mL, collyre en solution
BIMATOPROST/TIMOLOL VIATRIS 0,3 mg/mL + 5 mg/mL, collyre en solution doit être utilisé chaque jour pour agir correctement.
N’arrêtez pas l’utilisation de BIMATOPROST/TIMOLOL VIATRIS 0,3 mg/mL + 5 mg/mL, collyre en solution sans en avoir parlé à votre médecin.
Si vous avez d’autres questions sur l’utilisation de ce médicament, demandez plus d’informations à votre médecin, à votre pharmacien ou à votre infirmier/ère.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Comme tous les médicaments, ce médicament peut provoquer des effets indésirables, mais ils ne surviennent pas systématiquement chez tout le monde. Vous pouvez généralement continuer de prendre le collyre sauf si les effets sont graves. En cas de doute, parlez-en à votre médecin ou à votre pharmacien. N’arrêtez pas de prendre BIMATOPROST/TIMOLOL VIATRIS 0,3 mg/mL + 5 mg/mL, collyre en solution sans l’avis de votre médecin.
BIMATOPROST/TIMOLOL VIATRIS 0,3 mg/mL + 5 mg/mL, collyre en solution est susceptible d’entraîner les effets indésirables suivants :
Effets indésirables très fréquents
Ces effets indésirables peuvent concerner plus d’un patient sur 10
Effets sur l’œil
· rougeur,
· perte de graisse autour de l’œil qui peut provoquer un approfondissement du pli palpébral, un enfoncement de l’œil dans l’orbite (énophtalmie), un affaissement de la paupière (ptosis), un resserrement de la peau autour de l’œil (involution du dermatochalasis) et une plus grande visibilité de la partie inférieure blanche de l’œil (exposition sclérale inférieure).
·
Effets indésirables fréquents
Ces effets indésirables peuvent concerner jusqu’à 1 patient sur 10
Effets sur l’œil
· sensation de brûlure,
· démangeaisons,
· picotement,
· irritation de la conjonctive (membrane transparente de l’œil),
· sensibilité à la lumière,
· douleur de l’œil, œil collé, sécheresse de l’œil, sensation de corps étranger dans l’œil,
· petites érosions à la surface de l’œil associées ou non à une inflammation,
· difficultés à voir clairement,
· rougeur et démangeaisons au niveau de la paupière,
· pousse de poils autour de l’œil,
· assombrissement de la peau de la paupière,
· coloration plus foncée de la peau autour des yeux,
· allongement des cils,
· irritation de l’œil,
· œil larmoyant,
· paupière gonflée,
· baisse de la vue.
Effets généraux
· écoulement nasal,
· maux de tête.
Effets indésirables peu fréquents
Ces effets indésirables peuvent concerner jusqu’à 1 patient sur 100
Effets sur l’œil
· sensation anormale dans l’œil,
· inflammation de l’iris,
· gonflement de la conjonctive (membrane transparente de l'œil),
· paupière douloureuse,
· yeux fatigués,
· cils incarnés,
· assombrissement de la couleur de l’iris,
· rétraction de la paupière de la surface de l’œil,
· assombrissement des cils.
Effets généraux
· essoufflement.
Effets indésirables dont la fréquence est indéterminée (dont la fréquence ne peut être estimée à partir des données disponibles)
Effets sur l’œil
· œdème maculaire cystoïde (gonflement de la rétine à l'intérieur de l'œil entraînant une détérioration de la vision),
· gonflement de l’œil,
· vision trouble,
· gêne oculaire.
Effets généraux
· difficultés respiratoires / respiration sifflante,
· symptômes de réaction allergique (gonflement, rougeur de l’œil et éruption cutanée),
· décoloration de la peau (périoculaire),
· altération du goût,
· vertiges,
· ralentissement de la fréquence cardiaque,
· élévation de la pression sanguine,
· difficultés à dormir,
· cauchemars,
· asthme,
· perte de cheveux,
· fatigue.
D’autres effets indésirables ont été rapportés chez des patients utilisant des collyres contenant du timolol ou du bimatoprost et ils sont donc susceptibles de survenir également avec BIMATOPROST/TIMOLOL VIATRIS 0,3 mg/mL + 5 mg/mL, collyre en solution. Comme les autres médicaments ophtalmiques à usage local, le timolol passe dans le sang, ce qui peut provoquer des effets indésirables similaires à ceux observés avec les bétabloquants « intraveineux » ou « oraux ». La probabilité de présenter des effets indésirables après une administration ophtalmique est plus faible qu’après une administration orale ou intraveineuse, par exemple. Les effets indésirables cités comprennent les réactions observées avec le bimatoprost et le timolol utilisés dans le traitement des maladies oculaires :
· réactions allergiques sévères accompagnées de gonflement et de difficultés respiratoires pouvant engager le pronostic vital ;
· taux de sucre bas dans le sang ;
· dépression, perte de mémoire ;
· évanouissement, accident vasculaire cérébral, diminution du flux sanguin vers le cerveau, aggravation de la myasthénie grave (augmentation de la faiblesse musculaire), sensation de picotement ;
· diminution de la sensibilité de la surface oculaire, vision double, affaissement de la paupière, séparation de l’une des couches du globe oculaire après une opération destinée à réduire la pression dans l’œil, inflammation de la surface de l’œil, saignement dans la partie postérieure de l’œil (saignement rétinien), inflammation dans l’œil, clignement plus rapide des yeux ;
· insuffisance cardiaque, irrégularité ou arrêt des battements cardiaques, battements du cœur lents ou rapides, accumulation de liquide, principalement d’eau, dans le corps, douleur thoracique ;
· baisse de la pression sanguine, gonflement ou froideur des mains, des pieds et des membres, provoqué par la constriction des vaisseaux sanguins ;
· toux, aggravation de l’asthme, aggravation de la maladie pulmonaire appelée bronchopneumopathie chronique obstructive (BPCO) ;
· diarrhée, douleurs d'estomac, nausées et vomissements, indigestion, sécheresse de la bouche ;
· plaques rouges sur la peau, éruption cutanée ;
· douleurs musculaires ;
· baisse de la libido, dysfonctionnements sexuels ;
· faiblesse ;
· résultats augmentés des tests sanguins qui reflètent le fonctionnement du foie,
· hallucinations.
Autres effets indésirables rapportés avec les collyres contenant du phosphate
Dans de très rares cas, certains patients présentant des lésions graves de la couche claire transparente située à l’avant de l’œil (la cornée) ont développé des taches opaques sur la cornée en raison d’une accumulation de calcium pendant le traitement.
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin, votre pharmacien ou à votre infirmier/ère. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/.
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER BIMATOPROST/TIMOLOL VIATRIS 0,3 mg/mL + 5 mg/mL, collyre en solution ?
Tenir ce médicament hors de la vue et de la portée des enfants.
N’utilisez pas ce médicament après la date de péremption indiquée sur l’étiquette du flacon et la boîte après EXP. La date de péremption fait référence au dernier jour de ce mois.
Ce médicament ne nécessite pas de précautions particulières de conservation.
Une fois le flacon ouvert, la solution risque de devenir contaminée, ce qui peut causer une infection de l’œil. En conséquence, vous devez jeter le flacon quatre semaines après l'avoir ouvert pour la première fois, même s'il contient encore quelques gouttes. Pour vous aider à vous en rappeler, notez la date d'ouverture dans la case prévue sur la boîte.
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient BIMATOPROST/TIMOLOL VIATRIS 0,3 mg/mL + 5 mg/mL, collyre en solution
Les substances actives sont :
Bimatoprost................................................................................................................... 0,3 mg
Timolol............................................................................................................................. 5 mg
(équivalant à 6,8 mg de maléate de timolol)
Pour un mL de solution.
· Les autres composants sont : le chlorure de benzalkonium (un conservateur), le phosphate disodique heptahydraté, le chlorure de sodium, l’acide citrique monohydraté et l’eau purifiée. De faibles quantités d’acide chlorhydrique ou d’hydroxyde de sodium sont éventuellement ajoutées pour amener la solution au pH (acidité) correct (voir rubrique 2, « BIMATOPROST/TIMOLOL VIATRIS contient des phosphates et du chlorure de benzalkonium »).
Chaque boîte contient 1 ou 3 flacons en plastique munis d’un bouchon à vis.
Chaque flacon est rempli à moitié environ et contient 3 mL de solution.
Cette quantité est suffisante pour 4 semaines d’utilisation.
Toutes les présentations peuvent ne pas être commercialisées.
Titulaire de l’autorisation de mise sur le marché
1 RUE DE TURIN
69007 LYON
Exploitant de l’autorisation de mise sur le marché
1 RUE DE TURIN
69007 LYON
1A, EROILOR STREET
OTOPENI 075100, ILFOV
ROUMANIE
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Ce médicament est autorisé dans les Etats membres de l'Espace Economique Européen sous les noms suivants : Conformément à la réglementation en vigueur.
[À compléter ultérieurement par le titulaire]
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
< {MM/AAAA}>< {mois AAAA}.>
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).