Dernière mise à jour le 01/12/2025
NORDITROPINE FLEXPRO 5 mg/1,5 ml, solution injectable en stylo prérempli
Indications thérapeutiques
Classe pharmacothérapeutique : somatropine et agonistes de la somatropine, Code ATC : H01AC01.
NORDITROPINE FLEXPRO contient de l’hormone de croissance humaine biosynthétique appelée somatropine qui est identique à l’hormone de croissance produite naturellement par le corps humain. Les enfants ont besoin d’hormone de croissance pour les aider à grandir, mais les adultes en ont également besoin pour leur état de santé général.
Chez les enfants, NORDITROPINE FLEXPRO est utilisé pour traiter les troubles de croissance :
· liés au syndrome de Turner (problème génétique qui peut affecter la croissance),
· liés à une diminution de la fonction rénale,
· chez les enfants de petite taille et nés petits pour l’âge gestationnel (PTAG),
· liés à un syndrome de Noonan (problème génétique qui peut affecter la croissance).
Chez les adultes, NORDITROPINE FLEXPRO est utilisé comme hormone de croissance de substitution
Chez les adultes, NORDITROPINE FLEXPRO est utilisé pour remplacer l’hormone de croissance si sa production a été diminuée depuis l’enfance ou si elle s’est arrêtée à l’âge adulte à cause d’une tumeur, du traitement d’une tumeur ou d’une pathologie qui touche la glande qui produit l’hormone de croissance. Si vous avez été traité pour un déficit en hormone de croissance pendant l’enfance, la persistance de ce déficit sera réévaluée une fois la croissance achevée. Si le déficit en hormone de croissance est confirmé, vous devrez continuer le traitement.
Présentations
> 1 cartouche(s) en verre de 1,5 ml dans stylo pré-rempli multidose(s) en plastique
Code CIP : 34009 301 795 4 3
Déclaration de commercialisation : 08/11/2019
Cette présentation est agréée aux collectivités
- Prix hors honoraire de dispensation : 115,89 €
- Honoraire de dispensation : 1,02 €
- Prix honoraire compris : 116,91 €
- Taux de remboursement :100 %
Enfants :
- Retard de croissance entrainé par un manque d'hormone de croissance
- Retard de croissance chez les filles présentant une maladie hormonale (appelée Syndrome de Turner).
- Retard de croissance chez les enfants avant leur puberté dû à une maladie rénale.
- Retard de croissance chez les enfants nés petits et répondant à un certain nombre de critères, à l'âge de 4 ans ou plus.
- Syndrome de Noonan avec un certain retard de croissance
Adultes :
- Déficit en homone de croissance apparu dans l'enfance
- Déficit en homone de croissance apparu à l'âge adulte pour des raisons diverses (maladie de l'hypothalamus ou de l'hypophyse, traitement aux rayons du cerveau, lésion du cerveau due à une blessure) ; JOURNAL OFFICIEL ; 08/01/20
Service médical rendu (SMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprès de la HAS (plus d'informations dans l'aide). Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Modéré | Avis du 06/07/2022 | Réévaluation SMR | Le service médical rendu par NORDITROPINE (somatropine) est modéré dans l’indication du retard de croissance (taille actuelle < -3 DS et taille parentale ajustée < -1 DS) chez les enfants nés petits pour l’âge gestationnel avec un poids et/ou une taille de naissance < -2DS, n’ayant pas rattrapé leur retard de croissance (vitesse de croissance < 0 DS au cours de la dernière année) à l’âge de 4 ans ou plus. |
| Important | Avis du 21/10/2020 | Extension d'indication | Le service médical rendu par NORDITROPINE (somatropine) est important uniquement chez les enfants atteints du syndrome de Noonan avec un retard de croissance défini par une taille actuelle < -2 SDS. |
Amélioration du service médical rendu (ASMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprés de la HAS (plus d'informations dans l'aide). Les avis et synthéses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur de l'ASMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| V (Inexistant) | Avis du 06/07/2022 | Réévaluation SMR | NORDITROPINE (somatropine) n’apporte pas d’amélioration du service médical rendu (ASMR V) dans la stratégie thérapeutique de l’enfant atteint de SGA. |
| V (Inexistant) | Avis du 21/10/2020 | Extension d'indication | Compte tenu : • de l’efficacité démontrée de NORDITROPINE (somatropine) sur la croissance à moyen terme (4 ans) avec une quantité d’effet comprise entre +0,85 et +1,84 SDS (soit 5 à 10 cm) chez les enfants traités pour un syndrome de Noonan dans une étude de phase III de comparaison de 2 doses de somatropine (GHLIQUID-4020), • et malgré : • des incertitudes sur l’efficacité de NORDITROPINE sur la taille adulte et sur sa tolérance à long terme (notamment sur le risque tumoral, de maladies cardiovasculaires et d’intolérance au glucose) dans cette indication et, • l’absence de donnée sur la qualité de vie, critère de jugement clinique pertinent dans cette maladie, la Commission considère que les spécialités NORDITROPINE (somatropine) n’apportent pas d’amélioration du service médical rendu (ASMR V) dans la stratégie de prise en charge du retard de croissance lié au syndrome de Noonan. |
Autres informations
- Titulaire de l'autorisation : NOVO NORDISK
- Conditions de prescription et de délivrance :
- liste I
- prescription initiale hospitalière annuelle
- prescription réservée aux spécialistes et services ENDOCRINOLOGIE
- prescription réservée aux spécialistes et services MALADIES METABOLIQUES
- prescription réservée aux spécialistes et services PEDIATRIE
- Statut de l'autorisation : Valide
- Type de procédure : Procédure de reconnaissance mutuelle
- Code CIS : 6 653 120 8
ANSM - Mis à jour le : 16/10/2025
NORDITROPINE FLEXPRO 5 mg/1,5 ml, solution injectable en stylo prérempli
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Un ml de solution contient 3,3 mg de somatropine.
somatropine (obtenue par la technique de l’ADN recombinant sur E-coli).
1 mg de somatropine correspond à 3 UI (Unité Internationale) de somatropine.
Pour la liste complète des excipients, voir rubrique 6.1.
Solution injectable en stylo prérempli.
Solution incolore et limpide.
4.1. Indications thérapeutiques
Retard de croissance lié à un déficit somatotrope.
Retard de croissance chez les filles présentant une dysgénésie gonadique (Syndrome de Turner).
Retard de croissance chez les enfants prépubères dû à une insuffisance rénale chronique.
Retard de croissance (taille actuelle < -2,5 DS et taille parentale ajustée < -1 DS) chez les enfants nés petits pour l’âge gestationnel (PTAG) avec un poids et/ou une taille de naissance inférieure à -2 DS, n’ayant pas rattrapé leur retard de croissance (vitesse de croissance < 0 DS au cours de la dernière année) à l’âge de 4 ans ou plus.
Retard de croissance lié au syndrome de Noonan.
Adultes :
Déficit somatotrope acquis dans l’enfance :
Une fois leur croissance achevée, la capacité sécrétoire en hormone de croissance devra être réévaluée chez les patients ayant un déficit somatotrope acquis dans l’enfance. Aucun test n’est requis chez les patients ayant plus de trois déficits hormonaux hypophysaires, chez les patients ayant un déficit somatotrope sévère dû à une cause génétique définie, dû à des anomalies structurales hypothalamo-hypophysaires, dû à des tumeurs du système nerveux central ou dû à une irradiation intra-crânienne à forte dose, ou chez les patients ayant un déficit somatotrope secondaire à une pathologie ou une atteinte hypothalamo-hypophysaire, si le dosage d’IGF-1 (Insulin-like Growth Factor 1) est < -2 DS au moins quatre semaines après l’arrêt du traitement par hormone de croissance.
Chez tous les autres patients, un dosage d’IGF-1 et un test dynamique de stimulation à l’hormone de croissance sont exigés.
Déficit somatotrope acquis à l’âge adulte :
Déficit somatotrope important dans le cadre d’une pathologie hypothalamo-hypophysaire connue, d’une irradiation intra-crânienne ou d’une lésion cérébrale traumatique. Le déficit somatotrope devra être associé à un autre axe déficitaire, autre que la prolactine. Le déficit somatotrope devra être mis en évidence lors d’une épreuve dynamique après instauration d’une substitution hormonale adéquate de tout autre déficit hormonal.
Chez l’adulte, l’hypoglycémie insulinique est l’épreuve dynamique de choix. Lorsque l’hypoglycémie insulinique est contre-indiquée, des tests dynamiques alternatifs doivent être utilisés. La combinaison arginine-GHRH est recommandée.
Le test à l’arginine ou au glucagon peut aussi être envisagé ; cependant, la valeur diagnostique de ces tests est moins bien établie que celle du test de l’hypoglycémie insulinique.
4.2. Posologie et mode d'administration
Norditropine devra être prescrit uniquement par des médecins spécialisés dans ces indications thérapeutiques.
La posologie doit être adaptée à chaque patient et doit toujours être ajustée en fonction des résultats cliniques et biologiques du traitement.
Posologies généralement recommandées :
Population pédiatrique
Retard de croissance lié à un déficit somatotrope
0,025 à 0,035 mg/kg/jour ou 0,7 à 1,0 mg/m2/jour
Si le déficit somatotrope persiste une fois la croissance achevée, le traitement par hormone de croissance devra être maintenu jusqu’au développement somatique complet de l’adulte, incluant la masse maigre et l’accrétion minérale osseuse (pour l’adaptation posologique, voir Déficit en hormone de croissance chez l’adulte).
Syndrome de Turner
0,045 à 0,067 mg/kg/jour ou 1,3 à 2,0 mg/m2/jour
Insuffisance rénale chronique
0,050 mg/kg/jour ou 1,4 mg/m2/jour (voir rubrique 4.4)
Retard de croissance chez les enfants nés petits pour l’âge gestationnel
0,035 mg/kg/jour ou 1,0 mg/m²/jour
Une dose de 0,035 mg/kg/jour est habituellement recommandée jusqu’à ce que la taille finale soit atteinte (voir rubrique 5.1). Le traitement devra être arrêté après la première année de traitement si la vitesse de croissance est inférieure à + 1 DS.
Le traitement devra être arrêté si la vitesse de croissance est < 2 cm/an et, si une confirmation est nécessaire, soit l’âge osseux > 14 ans (pour les filles) soit > 16 ans (pour les garçons), correspondant à la soudure des épiphyses.
Syndrome de Noonan
0,066 mg/kg/jour est la dose recommandée, cependant dans certains cas la dose de 0,033 mg/kg/jour peut-être suffisante (voir rubrique 5.1).
Le traitement doit être interrompu au moment de la fermeture épiphysaire (voir rubrique 4.4).
Population adulte
Déficit en hormone de croissance chez l’adulte
La posologie doit être adaptée en fonction des besoins de chaque patient.
Chez les patients ayant un déficit somatotrope acquis dans l’enfance, la dose recommandée pour réinstaurer le traitement est de 0,2 à 0,5 mg/jour. La dose devra ensuite être adaptée en fonction des concentrations en IGF-1.
Chez les patients avec un déficit somatotrope acquis à l’âge adulte, il est recommandé de débuter le traitement à une dose faible : 0,1 à 0,3 mg/jour. Il est recommandé d’augmenter la posologie progressivement par intervalles mensuels en fonction des résultats cliniques et des effets secondaires. La détermination du taux sérique d’IGF-1 peut guider l’adaptation de la posologie. Les femmes peuvent nécessiter des doses plus élevées que les hommes, les hommes montrant une sensibilité croissante à l'IGF-1 au fil du temps. Cela signifie qu'il y a un risque que les femmes, notamment celles qui reçoivent un traitement oestrogénique par voie orale, soient sous-traitées alors que les hommes sont sur-traités.
Les doses nécessaires diminuent avec l'âge. La posologie d’entretien varie considérablement d’un patient à l’autre mais elle dépasse rarement 1,0 mg/jour.
Mode d’administration
En général, il est recommandé d’administrer le médicament par voie sous-cutanée tous les soirs.
Il est nécessaire de varier le site d’injection pour prévenir l'apparition de lipoatrophies.
Hypersensibilité à la substance active ou à l’un des excipients mentionnés à la rubrique 6.1.
La somatropine ne doit pas être utilisée s’il existe le moindre élément en faveur d’une activité tumorale. Les tumeurs intracrâniennes doivent être inactives et tout traitement anti-tumoral doit être terminé avant de commencer le traitement par hormone de croissance. Le traitement devra être interrompu en cas d’élément signifiant une croissance tumorale.
La somatropine ne devra pas être utilisée pour améliorer la croissance staturale chez des enfants dont les épiphyses sont soudées.
Les patients présentant un état critique aigu souffrant de complications secondaires à une intervention chirurgicale à cœur ouvert, une intervention chirurgicale abdominale, un polytraumatisme accidentel, une insuffisance respiratoire aiguë ou à une situation similaire ne devront pas être traités par la somatropine (voir rubrique 4.4).
Chez les enfants présentant une insuffisance rénale chronique, le traitement par NORDITROPINE FLEXPRO devra être suspendu en cas de transplantation rénale.
4.4. Mises en garde spéciales et précautions d'emploi
Afin d'améliorer la traçabilité des médicaments biologiques, le nom et le numéro de lot du produit administré doivent être clairement enregistrés.
Les enfants traités par la somatropine devront être suivis régulièrement par un médecin spécialisé dans la croissance. Le traitement par la somatropine devra toujours être instauré par un médecin spécialisé et expérimenté dans le diagnostic et le traitement de l’insuffisance en hormone de croissance. Ceci est également valable pour le suivi des cas de syndrome de Turner, d’insuffisance rénale chronique, du retard de croissance chez les enfants nés petits pour l’âge gestationnel et du syndrome de Noonan. Les données sur la taille adulte définitive après traitement par Norditropine sont limitées chez les enfants présentant un syndrome de Noonan et ne sont pas disponibles pour les enfants présentant une insuffisance rénale chronique.
La dose journalière maximale recommandée ne devra pas être dépassée (voir rubrique 4.2).
La stimulation de la croissance staturale chez les enfants ne peut se faire qu’avant la soudure des épiphyses.
Traitement du déficit en hormone de croissance chez les patients présentant un syndrome de Prader-Willi
Des cas de mort subite ont été rapportés après l’initiation du traitement par la somatropine chez des patients présentant un syndrome de Prader-Willi, et qui présentaient un ou plusieurs des facteurs de risque suivants : obésité sévère, antécédents d’obstruction des voies aériennes supérieures ou d’apnée du sommeil, ou d’infection respiratoire non spécifiée.
Retard de croissance chez les enfants nés petits pour l’âge gestationnel
Chez les enfants nés petits pour l’âge gestationnel, les autres raisons médicales ou traitements pouvant expliquer un retard de croissance devront être exclus avant de commencer le traitement.
L’expérience en ce qui concerne l’initiation du traitement à proximité du démarrage pubertaire chez les enfants nés petits pour l’âge gestationnel est limitée. Par conséquent, il n’est pas recommandé d’initier le traitement à proximité du démarrage pubertaire.
L’expérience chez les patients présentant un syndrome de Silver-Russell est limitée.
Syndrome de Turner
Il est recommandé de surveiller la croissance des mains et des pieds chez les patientes présentant un syndrome de Turner et traitées par la somatropine.
Si une augmentation de la croissance des mains et des pieds est observée, une diminution de la dose vers la limite inférieure de l’intervalle de doses devra être envisagée.
Les filles présentant un syndrome de Turner présentent généralement un risque accru de développer des otites moyennes, c’est pourquoi un examen otologique est recommandé au moins une fois par an.
Insuffisance rénale chronique
La posologie chez les enfants présentant une insuffisance rénale chronique est individuelle et doit être adaptée en fonction de la réponse individuelle au traitement (voir rubrique 4.2). Le retard de croissance lié à l’insuffisance rénale devra être clairement établi avant traitement par la somatropine par le suivi de la croissance sous un traitement conservateur optimal de l’insuffisance rénale pendant un an. Le traitement de l’insuffisance rénale devra être maintenu et, si besoin, associé à la dialyse pendant la durée du traitement par la somatropine.
Les patients ayant une insuffisance rénale chronique développent habituellement une dégradation progressive de la fonction rénale liée à l’évolution naturelle de la maladie. Par prudence, lors du traitement par la somatropine, la fonction rénale devra être surveillée pour dépister une dégradation excessive ou une augmentation de la filtration glomérulaire (qui pourrait impliquer une hyperfiltration).
Scoliose
Une scoliose est connue pour être plus fréquente dans certains groupes de patients traités par somatropine comme ceux présentant un syndrome de Turner et un syndrome de Noonan. De plus, chez tous les enfants, la scoliose est susceptible d'évoluer lors d'une croissance rapide. Il n’a pas été démontré que la somatropine augmentait l’incidence ou la sévérité de scolioses. Les signes de scoliose devront être surveillés au cours du traitement.
Glycémie et insulinémie
Chez les enfants présentant un syndrome de Turner et chez les enfants nés petits pour l’âge gestationnel, il est recommandé de mesurer l’insulinémie et la glycémie à jeun avant de commencer le traitement puis annuellement. Chez les patients ayant un risque accru de diabète (par exemple : antécédents familiaux de diabète, obésité, insulino-résistance sévère, acanthosis nigricans), un test d’hyperglycémie provoqué par voie orale devra être réalisé. Si un diabète clinique apparaît, la somatropine ne devra pas être administrée.
La somatropine ayant une influence sur le métabolisme glucidique, les patients devront être surveillés afin de détecter une éventuelle intolérance au glucose.
IGF-1
Chez les enfants présentant un syndrome de Turner et chez les enfants nés petits pour l’âge gestationnel, il est recommandé de mesurer le taux d’IGF-1 avant d’instaurer le traitement et par la suite de le mesurer deux fois par an. Si, sur des mesures répétées, les taux d’IGF-1 sont supérieurs à +2 DS par rapport aux normes pour l’âge et le stade pubertaire, la dose devra être diminuée afin d’obtenir un taux d’IGF-1 dans les limites de la normale.
Une partie du gain de taille chez les enfants nés petits pour l’âge gestationnel traités par la somatropine pourrait disparaître si le traitement est arrêté avant que la taille finale ne soit atteinte.
Adultes
Déficit en hormone de croissance chez l’adulte
Le déficit en hormone de croissance chez l’adulte est une maladie chronique qui doit être traitée comme telle. Cependant, dans le déficit en hormone de croissance chez l’adulte, les données chez les patients âgés de plus de 60 ans et chez les patients traités depuis plus de cinq ans sont encore limitées.
Adultes et enfants
Pancréatite
Bien que rare, la pancréatite doit être envisagée chez les patients traités par somatropine qui développent des douleurs abdominales, en particulier chez les enfants.
Population générale
Tumeurs
Il n’y a aucune preuve en faveur d’une augmentation du risque de nouveaux cancers primitifs chez les enfants ou les adultes traités par la somatropine.
Chez les patients en rémission complète de maladie tumorale bénigne ou maligne, le traitement par la somatropine n’a pas été associé à une augmentation du taux de récidive.
Une légère augmentation globale de tumeurs secondaires a été observée chez les patients traités par hormone de croissance et ayant eu un cancer pendant l’enfance, les tumeurs intracrâniennes étant les plus fréquentes. Le facteur de risque principal pour une tumeur secondaire semble être un traitement préalable par radiothérapie.
Les patients qui ont eu une rémission complète d’une maladie tumorale maligne devront être suivis attentivement après le début de leur traitement par la somatropine afin de détecter une éventuelle récidive du processus tumoral.
Leucémies
Certains cas de leucémies ont été rapportés chez un petit nombre de patients présentant un déficit en hormone de croissance, dont certains avaient été traités par la somatropine. Cependant, il n’a pas été mis en évidence d’augmentation de l’incidence des leucémies chez les sujets recevant de la somatropine et ne présentant pas de facteurs de prédisposition.
Hypertension intracrânienne bénigne
En cas de céphalées sévères ou répétées, de troubles visuels, de nausées et/ou vomissements, il est recommandé d’effectuer un fond d'œil à la recherche d’un œdème papillaire. En cas d’œdème papillaire confirmé, il faudra envisager un diagnostic d'hypertension intracrânienne bénigne et le traitement par la somatropine devra être interrompu si nécessaire.
A l'heure actuelle, il n’y a pas suffisamment de données pour orienter la décision thérapeutique chez les patients ayant une hypertension intracrânienne résolue. Si le traitement par la somatropine est réinstauré, une surveillance attentive afin de rechercher l’apparition de signes d'hypertension intracrânienne est nécessaire.
En cas de déficit somatotrope secondaire à une lésion intracrânienne, les patients devront être examinés fréquemment afin de détecter une éventuelle progression ou récidive d’un processus malin sous-jacent.
Fonction thyroïdienne
La somatropine augmente la conversion extra-thyroïdienne de T4 en T3 et peut ainsi révéler une hypothyroïdie débutante. C’est pourquoi la surveillance de la fonction thyroïdienne devra être effectuée chez tous les patients. Chez les patients présentant un hypopituitarisme, le traitement standard substitutif doit être étroitement suivi lors de l’administration du traitement par la somatropine.
Chez les patients présentant une maladie hypophysaire évolutive, une hypothyroïdie peut se développer.
Les patientes présentant un syndrome de Turner présentent un risque accru de développement d’hypothyroïdie primaire lié à des anticorps anti-thyroïdiens. Sachant que l’hypothyroïdie interfère avec la réponse au traitement par la somatropine, les patients devront faire contrôler régulièrement leur fonction thyroïdienne et devront recevoir des hormones thyroïdiennes en traitement de substitution si nécessaire.
Sensibilité à l’insuline
La somatropine pouvant diminuer la sensibilité à l’insuline, une intolérance au glucose devra être recherchée chez les patients traités (voir rubrique 4.5). Chez les patients diabétiques, un ajustement de la dose d’insuline peut s’avérer nécessaire après initiation d’un traitement à base de somatropine. Les patients présentant un diabète ou une intolérance au glucose devront être étroitement surveillés pendant le traitement par la somatropine.
Anticorps
Comme avec tous les produits contenant de la somatropine, un faible pourcentage de patients peut développer des anticorps anti-somatropine. Le potentiel de liaison de ces anticorps est faible et il n’y a pas d’effet sur la croissance. La recherche d’anticorps anti-somatropine devra être réalisée chez tous les patients ne répondant pas au traitement.
Insuffisance surrénalienne aiguë
L'initiation du traitement par la somatropine peut entraîner une inhibition de la 11βHSD-1 et réduire les concentrations sériques de cortisol.
Chez les patients traités par la somatropine, une insuffisance surrénale centrale (secondaire) non diagnostiquée auparavant peut être découverte et un traitement substitutif par glucocorticoïde peut être nécessaire. De plus, les patients traités par glucocorticoïde pour une insuffisance surrénalienne préalablement diagnostiquée peuvent nécessiter une augmentation de leurs doses d'entretien ou de leurs doses en cas de stress, après le début du traitement par la somatropine (voir rubrique 4.5).
Utilisation avec un traitement œstrogénique oral
Si une femme traitée par somatropine débute un traitement œstrogénique par voie orale, il peut être nécessaire d'augmenter la dose de somatropine pour maintenir les taux sériques d'IGF-1 dans l’intervalle normal pour l'âge. Inversement, si une femme sous somatropine interrompt un traitement œstrogénique oral, il se peut que la dose de somatropine doive être réduite pour éviter un excès d'hormone de croissance et / ou des effets indésirables (voir rubrique 4.5).
Epiphysiolyse de la tête fémorale
Chez les patients présentant des troubles endocriniens, y compris un déficit en hormone de croissance, des épiphysiolyses de la tête fémorale peuvent apparaître plus fréquemment que dans la population générale. Un patient traité par somatropine qui se met à boiter ou se plaint de douleurs au niveau de la hanche ou du genou doit être examiné par un médecin.
Expérience issue des essais cliniques
Deux essais cliniques contrôlés versus placebo menés chez des patients hospitalisés en unités de soins intensifs ont démontré une augmentation de la mortalité chez les patients présentant un état critique aigu dû à des complications secondaires à une intervention chirurgicale à cœur ouvert ou à une intervention chirurgicale abdominale, à un polytraumatisme accidentel ou à une insuffisance respiratoire aiguë, et qui ont été traités par de fortes doses de somatropine (5,3 à 8 mg/jour). La sécurité relative à la poursuite du traitement par la somatropine chez les patients recevant des doses substitutives dans les indications validées et qui développent un état critique aigu n’a pas été établie. Par conséquent, le bénéfice potentiel de la poursuite du traitement par la somatropine chez les patients en état critique aigu devra être évalué au regard de ce risque potentiel.
Un essai clinique randomisé, en ouvert, mené chez des patients présentant un syndrome de Turner (dose de 0,045 à 0,090 mg/kg/jour) a montré une tendance de risque dose-dépendant d’otites externes et d’otites moyennes. L’augmentation des infections de l’oreille n’a pas conduit à une augmentation des opérations de l’oreille/insertions de tube de drainage tympanique par rapport au groupe ayant la plus faible dose dans l’essai.
Excipients
Norditropine contient moins de 1 mmol de sodium (23 mg) par 1,5 ml, c'est-à-dire essentiellement « sans sodium ».
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
L'hormone de croissance diminue la conversion de la cortisone en cortisol et peut mettre en évidence une insuffisance surrénale centrale non encore diagnostiquée ou rendre inefficaces de faibles doses des glucocorticoïdes (voir rubrique 4.4).
Chez les femmes sous traitement œstrogénique substitutif par voie orale, une dose plus élevée d'hormone de croissance peut être nécessaire pour atteindre l’objectif du traitement (voir rubrique 4.4).
Selon les résultats d’une étude d’interaction réalisée chez des adultes présentant un déficit en hormone de croissance, l’administration de la somatropine peut augmenter la clairance des composés connus pour être métabolisés par les isoenzymes du cytochrome P450. En particulier, la clairance des composés métabolisés par le cytochrome P450 3A4 (par exemple : hormones sexuelles stéroïdes, corticostéroïdes, anticonvulsivants et ciclosporine) peut être augmentée, entraînant une diminution des taux plasmatiques de ces composés. La conséquence clinique est inconnue.
L’effet de la somatropine sur la taille définitive peut aussi être influencé par un traitement simultané avec d’autres hormones, comme les gonadotrophines, les stéroïdes anabolisants, les estrogènes et les hormones thyroïdiennes.
Chez les patients traités par de l’insuline, un ajustement de la dose d’insuline pourra être nécessaire après l’initiation du traitement par la somatropine (voir rubrique 4.4).
Population pédiatrique
Les études d’interaction n’ont été réalisées que chez l’adulte.
4.6. Fertilité, grossesse et allaitement
Grossesse
Les études effectuées chez l’animal sont insuffisantes pour juger de l’effet sur la grossesse, le développement embryonnaire et fœtal, l'accouchement ou le développement post-natal. Il n’existe pas de données cliniques chez la femme enceinte.
Par conséquent, les produits contenant de la somatropine ne sont pas recommandés pendant la grossesse et chez les femmes en âge de procréer n’utilisant pas de méthode contraceptive.
Aucune étude clinique n’a été réalisée avec les produits contenant de la somatropine chez les femmes qui allaitent. On ne sait pas si la somatropine est excrétée dans le lait maternel humain. En conséquence, une attention particulière devra être exercée lorsque des médicaments contenant de la somatropine sont administrés chez les femmes qui allaitent.
Fertilité
Les études sur la fertilité n’ont pas été réalisées avec Norditropine.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Le déficit en hormone de croissance est caractérisé par un déficit du volume extracellulaire. Lorsqu’un traitement par la somatropine est initié, ce déficit est rectifié. Une rétention hydrique avec des œdèmes périphériques peut survenir plus particulièrement chez les adultes. Le syndrome du canal carpien est peu fréquent, mais peut apparaître chez les adultes. Ces symptômes sont normalement transitoires, sont dose-dépendants et peuvent nécessiter une diminution temporaire de la dose.
Des arthralgies modérées, des douleurs musculaires et des paresthésies peuvent également survenir mais en général ces symptômes sont autolimitants.
Les effets secondaires chez les enfants sont peu fréquents ou rares.
Selon les expériences sur les essais cliniques :
|
Classes de système d’organe |
Très fréquent (≥ 1/10) |
Fréquent (≥ 1/100, < 1/10) |
Peu fréquent (≥ 1/1 000, < 1/100) |
Rare (≥ 1/10 000, < 1/1 000) |
|
Troubles du métabolisme et de la nutrition |
|
|
Chez l’adulte, diabète de type 2 |
|
|
Affections du système nerveux |
|
Chez l’adulte, céphalée et paresthésie |
Chez l’adulte, syndrome du canal carpien. Chez l’enfant, céphalée |
|
|
Affections de la peau et du tissu sous-cutané |
|
|
Chez l’adulte, prurit |
Chez l’enfant, rash |
|
Affections musculo-squelettiques et systémiques |
|
Chez l’adulte, arthralgie, rigidité articulaire et myalgie |
Chez l’adulte, rigidité musculaire |
Chez l’enfant, arthralgie et myalgie |
|
Affections des organes de reproduction et du sein |
|
|
Chez l’adulte et l’enfant, gynécomastie |
|
|
Troubles généraux et anomalies au site d’administration |
Chez l’adulte, œdème périphérique (voir ci-dessus) |
|
Chez l’adulte et l’enfant, douleur au site d’injection. Chez l’enfant, réaction au site d’injection |
Chez l’enfant, œdème périphérique |
Chez les enfants présentant un syndrome de Turner, une augmentation de la croissance des mains et des pieds a été rapportée pendant le traitement par la somatropine.
Expérience après mise sur le marché :
En complément des effets indésirables mentionnés ci-dessus, ceux présentés ci-dessous ont été spontanément rapportés et sont globalement considérés comme potentiellement liés au traitement par Norditropine. La fréquence de ces effets indésirables ne peut être estimée sur la base des données disponibles :
· Affections du système immunitaire : hypersensibilité (voir rubrique 4.3). Formation d’anticorps dirigés contre la somatropine. Le taux de ces anticorps et leur capacité de liaison ont été très faibles et n’ont pas eu de retentissement sur la croissance après l’administration de Norditropine.
· Affections endocriniennes : hypothyroïdie. Diminution des taux sériques de thyroxine (voir rubrique 4.4).
· Troubles du métabolisme et de la nutrition : hyperglycémie (voir rubrique 4.4).
· Affections du système nerveux : hypertension intracrânienne bénigne (voir rubrique 4.4).
· Affections musculo-squelettiques et systémiques : maladie de Legg-Calvé-Perthes. La maladie de Legg-Calvé-Perthes surviendrait plus fréquemment chez les patients de petite taille.
· Investigations : augmentation du taux de phosphatase alcaline dans le sang.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/.
Un surdosage aigu peut entraîner initialement une hypoglycémie, suivie d'une hyperglycémie. L’hypoglycémie a été mise en évidence par un examen sanguin mais sans signes cliniques. Un surdosage à long terme pourrait entraîner des signes et des symptômes correspondant aux effets connus d’un excès en hormone de croissance humaine.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Classe pharmacothérapeutique : somatropine et agonistes de la somatropine, Code ATC : H01AC01.
Mécanisme d'action
NORDITROPINE FLEXPRO contient de la somatropine, l'hormone de croissance humaine produite par la technique de l’ADN recombinant. Il s’agit d’un peptide anabolisant de 191 acides aminés stabilisés par deux ponts disulfures et sa masse moléculaire est de 22 000 Daltons environ.
Les effets principaux de la somatropine sont la stimulation de la croissance osseuse et somatique ainsi qu’un effet métabolique important.
Effets pharmacodynamiques
Le traitement d'un déficit en hormone de croissance entraîne une normalisation de la composition corporelle avec une augmentation de la masse maigre et une diminution de la masse grasse.
Les actions de la somatropine s’exercent en majorité par le biais de l’IGF-1 (Insulin-like Growth Factor 1) qui est produit dans tous les tissus de l’organisme, mais essentiellement par le foie. L’IGF-1 se fixe à plus de 90 % aux protéines liantes (IGFBP), la principale d’entre elles étant l’IGFBP-3.
Cette hormone a un effet lipolytique et évite une déperdition protéique, en particulier lors d’un stress.
La somatropine favorise également le renouvellement osseux objectivé par une augmentation des taux plasmatiques des marqueurs biochimiques osseux. Chez l’adulte la masse osseuse diminue légèrement pendant les premiers mois de traitement à cause d’une résorption osseuse plus importante, cependant la masse osseuse augmente au cours d’un traitement au long cours.
Efficacité et sécurité clinique
Lors des essais cliniques chez des enfants nés petits pour l’âge gestationnel, des doses de 0,033 et 0,067 mg/kg/jour ont été utilisées jusqu’à atteinte de la taille finale. Pour 56 patients traités en continu et qui ont atteint (ou presque) leur taille finale, la variation moyenne de taille depuis le début du traitement était de +1,90 DS (0,033 mg/kg/jour) et +2,19 DS (0,067 mg/kg/jour). Les données de la littérature suggèrent une croissance tardive de 0,5 DS chez les enfants nés petits pour l’âge gestationnel non traités et sans rattrapage spontané précoce de croissance. Les données de sécurité à long terme sont encore limitées.
Un effet stimulant de la croissance a été observé après 104 semaines (critère principal) et 208 semaines de traitement avec une dose quotidienne de Norditropine de 0,033 mg/kg/jour et de 0,066 mg/kg/jour chez 51 enfants de petite taille liée au syndrome de Noonan âgés entre 3 et < 11 ans.
Une augmentation statistiquement significative de la taille moyenne en DS de l’inclusion à la semaine 104 (critère principal) a été observée à la dose de 0,033 mg/kg/jour (0,84 DS) et à la dose de 0,066 mg/kg/jour (1,47 DS). Une différence moyenne de 0,63 DS [IC à 95 % : 0,38 ; 0,88] a été observée entre les groupes à la semaine 104 ; la différence était plus importante après la semaine 208 avec une différence moyenne de 0,99 DS [IC à 95 % : 0,62 ; 1,36] (figure 1).
 Figure 1 Croissance en DS – de l’inclusion à la semaine 208
Figure 1 Croissance en DS – de l’inclusion à la semaine 208
La vitesse moyenne de croissance et la vitesse de croissance en DS ont augmenté considérablement depuis l’inclusion au cours de la première année de traitement, avec une augmentation plus importante à la dose de 0,066 mg/kg/jour par rapport à la dose de 0,033 mg/kg/jour. La vitesse de croissance moyenne en DS était maintenue au-dessus de 0 dans les deux groupes après un traitement de deux ans et également après quatre ans de traitement dans le groupe avec 0,066 mg/kg/jour. La vitesse de croissance en DS était supérieure avec 0,066 mg/kg/jour par rapport à 0,033 mg/kg/jour pendant toute la durée de l’étude (figure 2).
 Figure 2 Vitesse de croissance en DS – de l’inclusion à la semaine 208
Figure 2 Vitesse de croissance en DS – de l’inclusion à la semaine 208
Les données de la taille finale ont été collectées chez 24 patients pédiatriques (18 inclus dans une étude de deux ans, prospective, en ouverte, randomisée, en groupes parallèles et six patients ayant suivi le protocole sans randomisation). Après l’étude initiale prospective de deux ans, Norditropine a été poursuivi jusqu’à la taille finale. À la fin du traitement, la majorité des patients (16 sur 24) ont atteint une taille finale dans l’intervalle de référence nationale normale (> 2 DS).
5.2. Propriétés pharmacocinétiques
Après perfusion intraveineuse de Norditropine (33 ng/kg/min pendant 3 heures) chez neuf patients présentant un déficit en hormone de croissance, les résultats ont été les suivants : demi-vie sérique de 21,1 ± 1,7 min, clairance métabolique de 2,33 ± 0,58 ml/kg/min et volume de distribution de 67,6 ± 14,6 ml/kg.
L’injection sous-cutanée de 2,5 mg/m² de Norditropine SimpleXx (Norditropine SimpleXx est la cartouche contenant la solution pour injection de NORDITROPINE FLEXPRO) à 31 sujets sains (la somatropine endogène étant inhibée par perfusion continue de somatostatine) a donné les résultats suivants : concentration maximale d’hormone de croissance (42 à 46 ng/ml) après environ 4 heures. Puis le taux d’hormone de croissance a diminué avec une demi-vie d’environ 2,6 heures.
De plus, il a été démontré après injection sous-cutanée chez des sujets sains que les différentes concentrations de Norditropine SimpleXx étaient bioéquivalentes entre elles et avec la Norditropine pour reconstitution.
5.3. Données de sécurité préclinique
Chez le rat, il a été démontré une pharmacocinétique similaire entre Norditropine SimpleXx et Norditropine. Il a également été montré que Norditropine SimpleXx dégradé est bioéquivalent à Norditropine SimpleXx.
Aucune toxicité ni altération des tissus musculaires n’a été révélée lors des études de toxicité à doses uniques ou répétées et des études de tolérance locale avec Norditropine SimpleXx et le produit de dégradation.
La toxicité du poloxamère 188 a été testée chez la souris, le rat, le lapin et le chien et aucune toxicité particulière n’a été détectée.
Le poloxamère 188 a été rapidement absorbé au site d’injection sans rétention significative de la dose au niveau du site d’injection. Le poloxamère 188 a été excrété principalement par voie urinaire.
Norditropine SimpleXx correspond à la cartouche contenant la solution injectable dans NORDITROPINE FLEXPRO.
2 ans.
Après première ouverture : à conserver au maximum 4 semaines au réfrigérateur (entre 2°C et 8°C). Alternativement le médicament peut être conservé au maximum 3 semaines à une température ne dépassant pas 25°C.
6.4. Précautions particulières de conservation
Ne pas conserver à proximité des éléments de refroidissement.
Pour les conditions de conservation du médicament après première ouverture, voir la rubrique 6.3.
Ne pas congeler.
En cours d’utilisation, il est nécessaire de toujours replacer le capuchon sur le stylo prérempli NORDITROPINE FLEXPRO après chaque injection. Toujours utiliser une aiguille neuve lors de chaque injection.
L’aiguille ne doit pas rester vissée sur le stylo prérempli lorsqu’il n’est pas utilisé.
6.5. Nature et contenu de l'emballage extérieur
NORDITROPINE FLEXPRO 5 mg/1,5 ml est un stylo prérempli multidose jetable, qui contient une cartouche (verre incolore de type I) scellée de façon permanente dans un stylo injecteur fabriqué avec des pièces en plastique et des ressorts métalliques. La cartouche est fermée à l’extrémité inférieure par un bouchon en caoutchouc (fermetures en caoutchouc de type I) en forme de piston et à l’extrémité supérieure par un bouchon laminé en caoutchouc (fermetures en caoutchouc de type I) en forme de disque et scellé par une capsule en aluminium. Le bouton de dose du stylo injecteur est coloré en orange. Boîte de 1 stylo prérempli et un emballage multiple avec 5 x 1 stylo prérempli.
Toutes les présentations peuvent ne pas être commercialisées.
Le stylo prérempli est conditionné dans un emballage.
6.6. Précautions particulières d’élimination et de manipulation
NORDITROPINE FLEXPRO est un stylo prérempli conçu pour être utilisé avec les aiguilles à usage unique NovoFine ou NovoTwist d’une longueur maximale de 8 mm. Le système délivre un maximum de 2,0 mg de somatropine par dose, par paliers de 0,025 mg de somatropine.
Pour garantir un dosage correct et éviter toute injection d’air, vérifiez l’écoulement de l’hormone de croissance avant la première injection. N’utilisez pas NORDITROPINE FLEXPRO si aucune goutte d’hormone de croissance n’apparaît au bout de l’aiguille. La dose est sélectionnée en tournant le sélecteur de dose, jusqu’à ce que la dose désirée apparaisse dans la fenêtre d’indication de la dose. Si une mauvaise dose est sélectionnée, la dose peut être corrigée en tournant le sélecteur de dose dans le sens inverse. Pour injecter la dose, il faut appuyer sur le bouton de dose.
NORDITROPINE FLEXPRO ne doit jamais être secoué fortement.
NORDITROPINE FLEXPRO ne doit pas être utilisé si la solution injectable d'hormone de croissance est opaque ou colorée. Pour le vérifier, il faut retourner le stylo de haut en bas, une ou deux fois.
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
10-12 COURS MICHELET
92800 PUTEAUX
FRANCE
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 301 795 4 3 : 1,5 ml de solution en cartouche (verre) dans un stylo prérempli. Boîte de 1.
· 34009 301 795 5 0 : 1,5 ml de solution en cartouche (verre) dans un stylo prérempli. Boîte de 1x5.
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
Sans objet
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Liste I.
Prescription initiale hospitalière annuelle réservée aux spécialistes en pédiatrie ou en endocrinologie et maladies métaboliques exerçant dans les services spécialisés en pédiatrie ou en endocrinologie et maladies métaboliques.
ANSM - Mis à jour le : 16/10/2025
NORDITROPINE FLEXPRO 5 mg/1,5 ml, solution injectable en stylo prérempli
somatropine
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin ou votre pharmacien.
· Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d’autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
1. Qu'est-ce que NORDITROPINE FLEXPRO 5 mg/1,5 ml, solution injectable en stylo prérempli et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant d’utiliser NORDITROPINE FLEXPRO 5 mg/1,5 ml, solution injectable en stylo prérempli ?
3. Comment utiliser NORDITROPINE FLEXPRO 5 mg/1,5 ml, solution injectable en stylo prérempli ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver NORDITROPINE FLEXPRO 5 mg/1,5 ml, solution injectable en stylo prérempli ?
6. Contenu de l’emballage et autres informations.
Instructions d'utilisation du stylo NORDITROPINE FLEXPRO
1. QU’EST-CE QUE NORDITROPINE FLEXPRO 5 mg/1,5 ml, solution injectable en stylo prérempli ET DANS QUELS CAS EST-IL UTILISE ?
Classe pharmacothérapeutique : somatropine et agonistes de la somatropine, Code ATC : H01AC01.
NORDITROPINE FLEXPRO contient de l’hormone de croissance humaine biosynthétique appelée somatropine qui est identique à l’hormone de croissance produite naturellement par le corps humain. Les enfants ont besoin d’hormone de croissance pour les aider à grandir, mais les adultes en ont également besoin pour leur état de santé général.
Chez les enfants, NORDITROPINE FLEXPRO est utilisé pour traiter les troubles de croissance :
· liés au syndrome de Turner (problème génétique qui peut affecter la croissance),
· liés à une diminution de la fonction rénale,
· chez les enfants de petite taille et nés petits pour l’âge gestationnel (PTAG),
· liés à un syndrome de Noonan (problème génétique qui peut affecter la croissance).
Chez les adultes, NORDITROPINE FLEXPRO est utilisé comme hormone de croissance de substitution
Chez les adultes, NORDITROPINE FLEXPRO est utilisé pour remplacer l’hormone de croissance si sa production a été diminuée depuis l’enfance ou si elle s’est arrêtée à l’âge adulte à cause d’une tumeur, du traitement d’une tumeur ou d’une pathologie qui touche la glande qui produit l’hormone de croissance. Si vous avez été traité pour un déficit en hormone de croissance pendant l’enfance, la persistance de ce déficit sera réévaluée une fois la croissance achevée. Si le déficit en hormone de croissance est confirmé, vous devrez continuer le traitement.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D’utiliser NORDITROPINE FLEXPRO 5 mg/1,5 ml, solution injectable en stylo prérempli ?
N’utilisez jamais NORDITROPINE FLEXPRO 5 mg/1,5 ml, solution injectable en stylo prérempli :
· Si vous êtes allergique à la somatropine, au phénol ou à l’un des autres composants contenus dans ce médicament, mentionnés dans la rubrique 6
· Si vous avez subi une transplantation rénale
· Si vous avez une tumeur active (cancer). Les tumeurs doivent être inactives et vous devez avoir terminé votre traitement anti-cancéreux avant de commencer votre traitement avec NORDITROPINE FLEXPRO.
· Si vous avez un état critique aigu, tel qu’une chirurgie à cœur ouvert, une chirurgie abdominale, un traumatisme accidentel multiple ou une insuffisance respiratoire sévère
· Si vous avez arrêté de grandir (épiphyses soudées) et que vous n’avez pas de déficit en hormone de croissance.
Avertissements et précautions
Adressez-vous à votre médecin ou pharmacien avant d’utiliser NORDITROPINE FLEXPRO :
· Si vous avez un diabète
· Si vous avez déjà eu un cancer ou toute autre forme de tumeur
· Si vous avez des maux de tête récurrents, des troubles de la vision, des nausées ou si vous avez des vomissements
· Si vous avez une fonction thyroïdienne anormale
· Si vous marchez avec une boiterie ou si vous commencez à boiter pendant votre traitement par l'hormone de croissance, vous devez en informer votre médecin.
· Si vous avez plus de 60 ans, ou si vous avez reçu un traitement par somatropine à l’âge adulte pendant plus de 5 ans, car l’expérience est limitée
· Si vous souffrez d’une maladie rénale, votre fonction rénale devra être suivie par votre médecin.
· Si vous avez un traitement substitutif par des glucocorticoïdes, vous devez consulter votre médecin régulièrement, car la dose des glucocorticoïdes peut nécessiter un ajustement.
· NORDITROPINE FLEXPRO peut provoquer une inflammation du pancréas, qui entraîne de fortes douleurs dans l’abdomen et le dos. Contactez votre médecin si vous ou votre enfant ressentez des maux d’estomac après avoir pris NORDITROPINE FLEXPRO.
Autres médicaments et NORDITROPINE FLEXPRO 5 mg/1,5 ml, solution injectable en stylo prérempli
Informez votre médecin ou pharmacien si vous utilisez, avez récemment utilisé ou pourriez utiliser tout autre médicament.
En particulier, informez votre médecin si vous prenez ou avez pris récemment l'un des médicaments suivants. Votre médecin devra peut-être ajuster la dose de NORDITROPINE FLEXPRO ou des autres médicaments :
· Des glucocorticoïdes, car votre taille adulte peut être influencée si vous prenez simultanément NORDITROPINE FLEXPRO et des glucocorticoïdes,
· De la ciclosporine (immunosuppresseur), car votre dose pourra nécessiter un ajustement,
· De l’insuline, car votre dose pourra nécessiter un ajustement,
· De l’hormone thyroïdienne, car votre dose pourra nécessiter un ajustement,
· Des gonadotrophines (hormone stimulant les gonades), car votre dose pourra nécessiter un ajustement,
· Des anticonvulsivants, car votre dose pourra nécessiter un ajustement,
· Œstrogène pris par voie orale ou d'autres hormones sexuelles.
Grossesse et allaitement
Les produits contenant de la somatropine ne sont pas recommandés chez les femmes en âge de procréer n’utilisant pas de méthode contraceptive.
· Grossesse : si vous débutez votre grossesse pendant le traitement par NORDITROPINE FLEXPRO, arrêtez le traitement et informez votre médecin.
· Allaitement : n’utilisez pas NORDITROPINE FLEXPRO en cas d’allaitement car la somatropine pourrait passer dans le lait maternel.
Conduite de véhicules et utilisation de machines
NORDITROPINE FLEXPRO n’a aucun effet sur l’aptitude à conduire des véhicules et à utiliser des machines.
NORDITROPINE FLEXPRO 5 mg/1,5 ml, solution injectable en stylo prérempli contient du sodium
Norditropine contient moins de 1 mmol de sodium (23 mg) par 1,5 ml, c'est-à-dire essentiellement « sans sodium ».
3. COMMENT UTILISER NORDITROPINE FLEXPRO 5 mg/1,5 ml, solution injectable en stylo prérempli ?
Dose recommandée
Chez les enfants, la dose dépend du poids et de la surface corporelle. Après l’enfance, la dose dépendra de la taille, du poids, du sexe et de la sensibilité à l’hormone de croissance, et sera ajustée jusqu’à l’obtention de la dose optimale.
· Enfants avec une faible production ou une absence de production d’hormone de croissance : la dose usuelle est de 0,025 à 0,035 mg par kg et par jour ou 0,7 à 1,0 mg par m² de surface corporelle et par jour.
· Enfants avec un syndrome de Turner : la dose usuelle est de 0,045 à 0,067 mg par kg et par jour ou 1,3 à 2,0 mg par m² de surface corporelle et par jour.
· Enfants avec une insuffisance rénale chronique : la dose usuelle est de 0,050 mg par kg et par jour ou 1,4 mg par m² de surface corporelle et par jour.
· Enfants nés petits pour l’âge gestationnel (PTAG) : la dose usuelle est de 0,035 mg par kg et par jour ou 1,0 mg par m² de surface corporelle et par jour jusqu’à ce que la taille finale soit atteinte. (Dans les essais cliniques, les enfants nés petits pour l’âge gestationnel ont été traités avec des doses comprises entre 0,033 et 0,067 mg par kg et par jour).
· Enfants avec un syndrome de Noonan : la dose usuelle est de 0,066 mg par kg et par jour, cependant votre médecin peut décider que 0,033 mg par kg et par jour est suffisant.
· Adultes avec une faible production ou une absence de production d’hormone de croissance : si votre déficit en hormone de croissance persiste une fois la croissance achevée, le traitement devra être maintenu. La dose initiale usuelle est de 0,2 à 0,5 mg par jour. La dose sera adaptée jusqu’à l’obtention de la dose optimale. Si votre déficit en hormone de croissance débute à l’âge adulte, la dose initiale usuelle est de 0,1 à 0,3 mg par jour. Votre médecin augmentera cette dose chaque mois jusqu’à l’obtention de la dose correcte. La dose maximale usuelle est de 1,0 mg par jour.
Quand utiliser NORDITROPINE FLEXPRO
Injectez votre dose journalière sous la peau chaque soir juste avant le coucher.
Comment utiliser NORDITROPINE FLEXPRO
La solution d’hormone de croissance NORDITROPINE FLEXPRO 5 mg/1,5 ml, solution injectable en stylo prérempli se présente dans un stylo prérempli multidose jetable de 1,5 ml.
Toutes les instructions d’utilisation de votre stylo NORDITROPINE FLEXPRO 5 mg/1,5 ml, solution injectable en stylo prérempli se trouvent au dos de cette notice. Les points essentiels sont les suivants :
· Vérifiez la solution avant utilisation en tournant le stylo de haut en bas une ou deux fois. N’utilisez pas le stylo si la solution à l’intérieur est opaque ou colorée. (voir au dos de cette notice, étape A).
· NORDITROPINE FLEXPRO est conçu pour être utilisé avec les aiguilles NovoFine ou NovoTwist à usage unique d’une longueur maximale de 8 mm.
· Utilisez toujours une aiguille neuve lors de chaque injection.
· Changez le site d’injection pour ne pas endommager votre peau.
· Pour garantir un dosage correct et éviter toute injection d’air, vérifiez l’écoulement (c’est-à-dire la purge du stylo) de l’hormone de croissance avant la première injection avec un stylo neuf de NORDITROPINE FLEXPRO. N’utilisez pas le stylo si aucune goutte de solution d’hormone de croissance n’apparaît au bout de l’aiguille. (voir au dos de cette notice, étapes E à G).
· Ne partagez pas votre stylo NORDITROPINE FLEXPRO avec quelqu’un d’autre.
Combien de temps durera votre traitement
· Enfants ayant un trouble de la croissance lié à un syndrome de Turner, une insuffisance rénale chronique, nés petits pour l’âge gestationnel (PTAG) ou un syndrome de Noonan : votre médecin vous recommandera de continuer votre traitement jusqu’à ce que vous ayez arrêté de grandir.
· Enfants ou adolescents ayant un déficit en hormone de croissance : votre médecin vous recommandera de continuer votre traitement à l’âge adulte.
N’arrêtez pas NORDITROPINE FLEXPRO sans en avoir parlé préalablement à votre médecin.
Si vous avez utilisé plus de NORDITROPINE FLEXPRO 5 mg/1,5 ml, solution injectable en stylo prérempli que vous n’auriez dû
Si vous vous êtes injecté trop de somatropine, parlez-en à votre médecin. Un surdosage de somatropine à long terme peut provoquer une croissance anormale et un épaississement des traits du visage.
Si vous oubliez d’utiliser une dose de NORDITROPINE FLEXPRO 5 mg/1,5 ml, solution injectable en stylo prérempli :
Si vous arrêtez d’utiliser NORDITROPINE FLEXPRO 5 mg/1,5 ml, solution injectable en stylo prérempli :
N’arrêtez pas votre traitement par NORDITROPINE FLEXPRO sans en avoir préalablement parlé avec votre médecin.
Si vous avez d’autres questions sur l’utilisation de ce médicament, demandez plus d’informations à votre médecin ou à votre pharmacien.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Effets indésirables rapportés chez les enfants et les adultes (fréquence non connue) :
· Éruption cutanée, respiration sifflante, gonflement des paupières, du visage ou des lèvres, collapsus complet. Chacun de ces effets indésirables peut être le signe d’une réaction allergique.
· Maux de tête, troubles de la vision, nausées et vomissements. Ceci peut être le signe d’une augmentation de la pression au niveau du cerveau.
· Les niveaux de thyroxine dans le sérum peuvent diminuer.
· Hyperglycémie (taux de sucre dans le sang élevé).
Si vous avez un de ces effets, consultez dès que possible un médecin. Arrêtez d’utiliser NORDITROPINE FLEXPRO jusqu’à ce que votre médecin vous indique de le reprendre.
La formation d’anticorps agissant directement contre la somatropine a été rarement observée au cours d’un traitement par Norditropine.
Une augmentation des taux des enzymes hépatiques a été rapportée.
Des cas de leucémie et de récidive de tumeurs du cerveau ont également été rapportés chez les patients traités avec de la somatropine (la substance active de NORDITROPINE FLEXPRO), bien qu’il n’y ait pas de preuve que la somatropine en soit responsable.
Si vous pensez que vous souffrez d’une de ces maladies, parlez-en à votre médecin.
Effets indésirables supplémentaires chez les enfants :
Peu fréquents (pouvant affecter jusqu’à 1 enfant sur 100) :
· Maux de tête,
· Rougeur, démangeaisons et douleur au site d’injection,
· Augmentation du volume des seins (gynécomastie).
Rares (pouvant affecter jusqu’à 1 enfant sur 1 000) :
· Eruption cutanée,
· Douleur musculaire et au niveau des articulations,
· Gonflement des mains et des pieds lié à une rétention d’eau.
De rares cas de douleurs de la hanche, du genou ou de boiterie ont été rapportés chez les enfants prenant NORDITROPINE FLEXPRO. Ces symptômes peuvent être liés à une maladie qui affecte la partie supérieure du fémur (maladie de Legg-Calvé) ou à un glissement de l’extrémité du fémur par rapport au cartilage (épiphysiolyse de la tête fémorale) et peuvent ne pas être dus à NORDITROPINE FLEXPRO.
Chez les enfants présentant un syndrome de Turner, quelques cas d’augmentation de la croissance des mains et des pieds par rapport à la taille ont été observés dans les essais cliniques.
Un essai clinique mené chez des enfants présentant un syndrome de Turner a montré que de fortes doses de Norditropine pourraient augmenter le risque d’infections de l’oreille.
Si l'un de ces effets indésirables devient grave ou si vous remarquez un effet indésirable non mentionné dans cette notice, parlez-en à votre médecin ou pharmacien, car la dose pourrait être diminuée.
Effets indésirables supplémentaires chez les adultes :
Très fréquents (pouvant affecter plus de 1 adulte sur 10) :
· Gonflement des mains et des pieds lié à une rétention d’eau.
Fréquents (pouvant affecter jusqu’à 1 adulte sur 10) :
· Maux de tête,
· Sensation de fourmillements sur la peau et engourdissement ou douleur dans les doigts principalement,
· Douleur et raideur des articulations, douleur musculaire.
Peu fréquents (pouvant affecter jusqu’à 1 adulte sur 100) :
· Diabète de type 2,
· Syndrome du canal carpien avec picotements et douleurs dans les doigts et les mains,
· Démangeaisons (qui peuvent être intenses) et douleur au niveau du site d’injection,
· Raideur musculaire,
· Augmentation du volume des seins (gynécomastie).
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER NORDITROPINE FLEXPRO 5 mg/1,5 ml, solution injectable en stylo prérempli ?
Tenir ce médicament hors de la vue et de la portée des enfants.
N’utilisez pas ce médicament après la date de péremption indiquée sur l’emballage après EXP. La date de péremption fait référence au dernier jour de ce mois.
Conservez les stylos NORDITROPINE FLEXPRO non utilisés au réfrigérateur (entre 2°C et 8°C) dans l’emballage extérieur afin de les protéger de la lumière. Ne pas congeler ou exposer à la chaleur. Ne pas conserver à proximité des éléments de refroidissement.
En cours d’utilisation de NORDITROPINE FLEXPRO 5 mg/1,5 ml, vous pouvez :
· soit le conserver jusqu’à 4 semaines au réfrigérateur (entre 2°C et 8°C),
· soit le conserver jusqu’à 3 semaines à température ambiante (ne dépassant pas 25°C).
Ne continuez pas d’utiliser les stylos NORDITROPINE FLEXPRO s’ils ont été congelés ou exposés à des températures excessives.
Ne pas utiliser les stylos NORDITROPINE FLEXPRO, si la solution d’hormone de croissance à l’intérieur est opaque ou colorée.
Conserver toujours NORDITROPINE FLEXPRO sans l’aiguille attachée.
Gardez toujours le capuchon fermé sur le stylo NORDITROPINE FLEXPRO lorsque vous ne l’utilisez pas.
Utiliser toujours une aiguille neuve pour chaque injection.
Ne jetez aucun médicament au tout-à-l’égout ni avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient NORDITROPINE FLEXPRO 5 mg/1,5 ml, solution injectable en stylo prérempli
· La substance active est : somatropine.
· Les autres composants sont : mannitol, histidine, poloxamère 188, phénol, eau pour préparations injectables, acide chlorhydrique et hydroxyde de sodium.
NORDITROPINE FLEXPRO se présente sous forme d’une solution injectable limpide et incolore dans un stylo prérempli multidose jetable de 1,5 ml.
1 ml de solution contient 3,3 mg de somatropine.
1 mg de somatropine correspond à 3 UI de somatropine.
NORDITROPINE FLEXPRO est disponible en trois dosages :
5 mg/1,5 ml, 10 mg/1,5 ml et 15 mg/1,5 ml (soit respectivement 3,3 mg/ml, 6,7 mg/ml et 10 mg/ml) en boîtes de 1 ou 5 stylos préremplis.
Toutes les présentations peuvent ne pas être commercialisées.
Titulaire de l’autorisation de mise sur le marché
10-12 COURS MICHELET
92800 PUTEAUX
FRANCE
Exploitant de l’autorisation de mise sur le marché
NOVO NORDISK
10-12 COURS MICHELET
92800 PUTEAUX
FRANCE
NOVO ALLÉ
DK-2880 BAGSVÆRD
Noms du médicament dans les Etats membres de l'Espace Economique Européen
[À compléter ultérieurement par le titulaire]
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
< {MM/AAAA}>< {mois AAAA}.>
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).
Au verso de la notice :
Instruction d’utilisation de NORDITROPINE FLEXPRO
Veuillez lire attentivement ces informations avant d’utiliser votre stylo NORDITROPINE FLEXPRO.
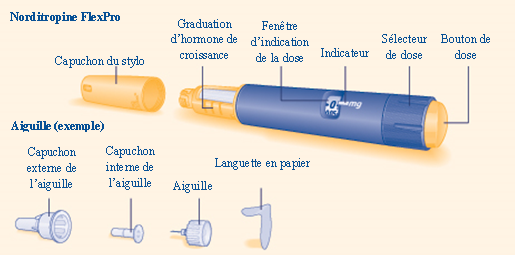
Commencez par vérifier le nom, le dosage et la couleur de l’étiquette de votre stylo NORDITROPINE FLEXPRO pour vous assurer qu’il contient le dosage d’hormone de croissance dont vous avez besoin.
Lire les instructions suivantes :
· Préparation de votre stylo NORDITROPINE FLEXPRO
· Vérification de l’écoulement de l’hormone de croissance avec chaque stylo neuf
· Sélection de votre dose
· Injection de votre dose
· Entretien de votre stylo NORDITROPINE FLEXPRO
Information importante
|
Votre stylo NORDITROPINE FLEXPRO est un stylo prérempli d’hormone de croissance. NORDITROPINE FLEXPRO contient 5 mg de solution d’hormone de croissance humaine et délivre des doses allant de 0,025 mg à 2,0 mg, par paliers de 0,025 mg. NORDITROPINE FLEXPRO est conçu pour être utilisé avec les aiguilles à usage unique NovoFine ou NovoTwist d’une longueur maximale de 8 mm. |
Préparation de votre stylo NORDITROPINE FLEXPRO
Contrôlez le nom, le dosage et la couleur de l'étiquette de votre stylo NORDITROPINE FLEXPRO pour vous assurer qu'il contient le dosage d'hormone de croissance dont vous avez besoin.
|
A Retirez le capuchon du stylo.
Vérifiez que la solution à l'intérieur du stylo est limpide et incolore en basculant le stylo de haut en bas une ou deux fois. N'utilisez pas le stylo si la solution à l’intérieur est trouble ou opaque. |
|
|
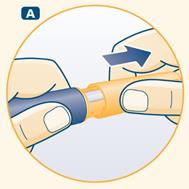
B Prenez une aiguille neuve à usage unique. Retirez la languette en papier et vissez l'aiguille de manière bien droite sur le stylo. Assurez-vous que l'aiguille soit solidement fixée. |
|
![]() Utilisez toujours une aiguille neuve lors de chaque injection. Ceci réduit le risque de contamination, d'infection, de fuite de solution, d'obstruction des aiguilles et de dose incorrecte.
Utilisez toujours une aiguille neuve lors de chaque injection. Ceci réduit le risque de contamination, d'infection, de fuite de solution, d'obstruction des aiguilles et de dose incorrecte.
![]() Prenez garde à ne jamais plier ou endommager l'aiguille.
Prenez garde à ne jamais plier ou endommager l'aiguille.
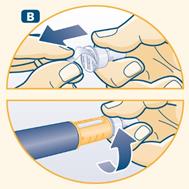
C Retirez le capuchon externe de l’aiguille et conservez-le. Après l’injection, vous en aurez besoin pour retirer correctement l’aiguille du stylo.
|
|
|
D Retirez le capuchon interne de l’aiguille et jetez-le. Si vous essayez de le remettre, vous risquez de vous piquer accidentellement avec l'aiguille. Une goutte d’hormone de croissance peut apparaître au bout de l’aiguille. Ceci est normal. |
|
Vérification de l’écoulement de l’hormone de croissance avec chaque stylo neuf
Assurez-vous de recevoir la totalité de votre dose en vérifiant l’écoulement de l’hormone de croissance avant de sélectionner et d’injecter votre première dose avec chaque stylo neuf.
|
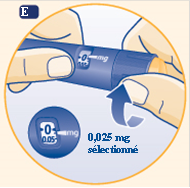
E Tournez le sélecteur de dose afin de sélectionner la dose minimale de 0,025 mg. |
|
|
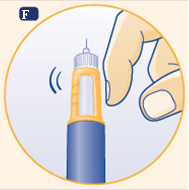
F Maintenez le stylo avec l’aiguille pointée vers le haut. Tapotez le haut du stylo plusieurs fois afin de laisser remonter les éventuelles bulles d'air vers le haut.
|
|
|
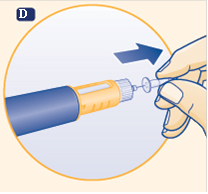
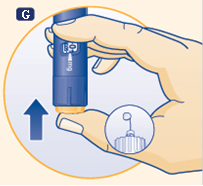
G Appuyez sur le bouton de dose jusqu’à ce que le chiffre 0 dans la fenêtre d’indication de la dose se trouve en face de l’indicateur et qu’une goutte d’hormone de croissance apparaisse au bout de l’aiguille. Si aucune goutte n’apparaît, répétez les étapes E à G jusqu’à 6 fois. Si aucune goutte n’apparaît après ces nouvelles tentatives, changez l’aiguille et répétez les étapes E à G.
|
|
N’utilisez pas le stylo si aucune goutte d’hormone de croissance n’apparaît.
![]() Assurez-vous toujours qu’une goutte apparaisse au bout de l’aiguille avant votre première injection avec chaque stylo neuf.
Assurez-vous toujours qu’une goutte apparaisse au bout de l’aiguille avant votre première injection avec chaque stylo neuf.
Sélection de votre dose
Utilisez le sélecteur de dose de votre stylo NORDITROPINE FLEXPRO pour sélectionner jusqu’à 2,0 mg par dose.
|
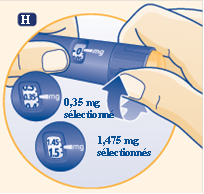
H Sélectionnez ou ajustez la dose dont vous avez besoin en tournant le sélecteur de dose dans un sens ou dans l’autre jusqu’à ce que le nombre correct de mg se trouve en face de l’indicateur. Lorsque le stylo contient moins de 2,0 mg, le sélecteur de dose se bloque au nombre de mg restant.
|
|
![]() Le sélecteur de dose émet des clics différents selon que vous le tournez dans un sens ou dans l’autre ou selon que vous dépassez le nombre de mg restant.
Le sélecteur de dose émet des clics différents selon que vous le tournez dans un sens ou dans l’autre ou selon que vous dépassez le nombre de mg restant.
![]() Combien reste-t-il d’hormone de croissance ?
Combien reste-t-il d’hormone de croissance ?
Vous pouvez utiliser la graduation d’hormone de croissance pour voir approximativement la quantité d’hormone de croissance restant dans le stylo.
Vous pouvez utiliser le sélecteur de dose pour voir exactement la quantité d’hormone de croissance restant - si le stylo contient moins de 2,0 mg :
Tournez le sélecteur de dose jusqu’à ce qu’il s’arrête. Le chiffre qui se trouve en face de l’indicateur montre le nombre de mg restant.
Si vous avez besoin de plus d’hormone de croissance que la quantité restant dans votre stylo, vous pouvez utiliser un stylo neuf ou diviser votre dose en deux entre votre stylo actuel et un stylo neuf.
![]() N’utilisez jamais les clics du stylo pour compter le nombre de mg que vous sélectionnez. Seuls la fenêtre d’indication de la dose et l’indicateur vous indiqueront le nombre exact de mg.
N’utilisez jamais les clics du stylo pour compter le nombre de mg que vous sélectionnez. Seuls la fenêtre d’indication de la dose et l’indicateur vous indiqueront le nombre exact de mg.
![]() N’utilisez jamais la graduation d’hormone de croissance pour mesurer la quantité d’hormone de croissance à injecter. Seuls la fenêtre d’indication de la dose et l’indicateur vous indiqueront le nombre exact de mg.
N’utilisez jamais la graduation d’hormone de croissance pour mesurer la quantité d’hormone de croissance à injecter. Seuls la fenêtre d’indication de la dose et l’indicateur vous indiqueront le nombre exact de mg.
Injection de votre dose
Assurez-vous de recevoir la totalité de votre dose en utilisant la technique d’injection correcte.
|
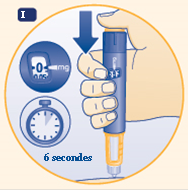
I Insérez l’aiguille dans votre peau comme vous l’a montré votre médecin ou votre infirmier/ère. Pour injecter, appuyez sur le bouton de dose jusqu’à ce que le chiffre 0 dans la fenêtre d’indication de la dose se trouve en face de l’indicateur. Pendant l’injection, vous pouvez entendre ou sentir un déclic. Gardez l’aiguille sous la peau pendant au moins 6 secondes pour vous assurer de recevoir la dose complète. Vous pouvez relâcher le bouton de dose pendant que vous attendez. |
|
|
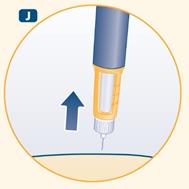
J Retirez l’aiguille de la peau. Après cela, vous pouvez éventuellement voir une goutte d’hormone de croissance au bout de l’aiguille. Ceci est normal et n’a aucune conséquence sur la dose que vous venez de recevoir.
|
|
![]() N’utilisez jamais les clics du stylo pour compter le nombre de mg que vous injectez. Seuls la fenêtre d’indication de la dose et l’indicateur vous indiqueront le nombre exact de mg.
N’utilisez jamais les clics du stylo pour compter le nombre de mg que vous injectez. Seuls la fenêtre d’indication de la dose et l’indicateur vous indiqueront le nombre exact de mg.
![]() Ne touchez jamais la fenêtre d’indication de la dose lorsque vous réalisez l’injection car cela pourrait bloquer l’injection.
Ne touchez jamais la fenêtre d’indication de la dose lorsque vous réalisez l’injection car cela pourrait bloquer l’injection.
|
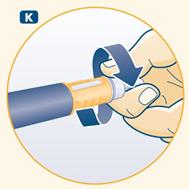
K Remettez avec précaution le capuchon externe de l'aiguille sur l'aiguille, sans toucher l'aiguille. Dévissez l'aiguille et jetez-la en respectant les précautions d'usage indiquées par votre médecin ou votre infirmier/ère. Remettez le capuchon du stylo après chaque utilisation. Lorsque le stylo est vide, jetez-le, sans aiguille attachée, comme conseillé par votre médecin ou votre infirmier/ère et les autorités de santé. |
|
![]() Ne remettez jamais la protection interne de l'aiguille une fois que vous l'avez retirée de l'aiguille. Vous risquez de vous piquer accidentellement avec l'aiguille.
Ne remettez jamais la protection interne de l'aiguille une fois que vous l'avez retirée de l'aiguille. Vous risquez de vous piquer accidentellement avec l'aiguille.
![]() Conservez toujours le stylo sans l'aiguille attachée. Ceci réduit le risque de contamination, d'infection, de fuite de solution, d'obstruction des aiguilles et de dose incorrecte.
Conservez toujours le stylo sans l'aiguille attachée. Ceci réduit le risque de contamination, d'infection, de fuite de solution, d'obstruction des aiguilles et de dose incorrecte.
Entretien de votre stylo NORDITROPINE FLEXPRO
Votre stylo NORDITROPINE FLEXPRO doit être manipulé avec soin.
· Ne laissez pas tomber votre stylo et ne le heurtez pas contre des surfaces dures. Si vous le faites tomber ou si vous avez l'impression qu'il y a un problème, vissez toujours une aiguille neuve à usage unique et vérifier l’écoulement de l’hormone de croissance avant l’injection.
· N’essayez pas de recharger votre stylo - il est prérempli.
· N’essayez pas de réparer votre stylo ou de le démonter.
· Protégez votre stylo de la poussière, des impuretés, des liquides et de la lumière directe du soleil.
· N'essayez pas de laver, tremper ou graisser votre stylo. Vous pouvez, si nécessaire, le nettoyer à l'aide d'un chiffon imbibé avec un détergent doux.
· Voir la rubrique 5 « Comment conserver NORDITROPINE FLEXPRO » pour obtenir les informations concernant la conservation de votre stylo.
![]() Information importante
Information importante
· Tenez toujours votre stylo et les aiguilles hors de la portée des autres personnes et plus particulièrement des enfants.
· Ne partagez pas votre stylo avec quelqu’un d’autre. Cela pourrait induire des infections croisées.
· Le personnel soignant devra être très attentif lors de la manipulation des aiguilles usagées afin d’éviter de se blesser ou d’attraper une infection croisée.
![]() Information importante
Information importante
Prêtez une attention particulière à ces notes car elles sont importantes pour une utilisation sûre du stylo
![]() Information complémentaire
Information complémentaire
NORDITROPINE FLEXPRO
5 mg/1,5 ml
Somatropine
Norditropine et FlexPro sont des marques déposées appartenant à Novo Nordisk Health Care AG, Suisse
NovoFine et NovoTwist sont des marques déposées appartenant à Novo Nordisk A/S, Danemark