Dernière mise à jour le 02/02/2026
ALOPEXY 2 %, solution pour application cutanée
Indications thérapeutiques
Classe pharmacothérapeutique : AUTRES MEDICAMENTS DERMATOLOGIQUES - Code ATC : D11AX01.
Ce médicament se présente sous la forme d'une solution pour application cutanée qui contient du minoxidil comme substance active.
Il est indiqué en cas de chute de cheveux modérée (alopécie androgénétique) de l'adulte, homme ou femme. Il favorise la pousse des cheveux et stabilise le phénomène de chute.
Présentations
> 3 flacon(s) polytéréphtalate (PET) jaune(brun) de 60 ml avec fermeture de sécurité enfant avec pipette(s) graduée(s) polystyrène polyéthylène
Code CIP : 34009 303 062 9 1
Déclaration de commercialisation : 24/10/2025
Cette présentation n'est pas agréée aux collectivités
> 3 flacon(s) polytéréphtalate (PET) jaune(brun) de 60 ml avec fermeture de sécurité enfant avec pipette(s) graduée(s) polystyrène polyéthylène avec pompe(s) doseuse(s) avec applicateur(s)
Code CIP : 364 307-5 ou 34009 364 307 5 4
Déclaration d'arrêt de commercialisation : 21/10/2025
Cette présentation n'est pas agréée aux collectivités
Service médical rendu (SMR)
Pas de SMR disponible pour ce médicament ( plus d'informations dans l'aide )
Amélioration du service médical rendu (ASMR)
Pas d'ASMR disponible pour ce médicament (plus d'informations dans l'aide )
ANSM - Mis à jour le : 26/11/2024
ALOPEXY 2 %, solution pour application cutanée
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Minoxidil .............................................................................................................................. 20 mg
Pour 1 ml de solution
Excipient à effet notoire : propylène glycol 50 mg, éthanol à 96% 443,9 mg.
Pour la liste complète des excipients, voir rubrique 6.1.
Solution pour application cutanée.
Solution limpide ou légèrement jaune.
4.1. Indications thérapeutiques
4.2. Posologie et mode d'administration
Posologie
Appliquer 2 fois par jour une dose de 1 ml sur le cuir chevelu en prenant pour point de départ le centre de la zone à traiter. Cette dose doit être respectée quelle que soit l’étendue de la zone concernée.
La dose quotidienne ne doit pas dépasser 2 ml.
Population spéciale
Personnes âgées
ALOPEXY n’est pas recommandé chez les patients de plus de 65 ans compte-tenu de l’absence de données concernant la sécurité et l’efficacité.
Population pédiatrique
Il n'y a pas d'utilisation justifiée du minoxidil dans la population pédiatrique pour l'indication de l'alopécie androgénétique d'intensité modérée.
Mode d’administration
Voie cutanée.
Ne pas avaler.
Utilisez l'un des systèmes d'administration (voir ci-dessous) pour appliquer ALOPEXY.
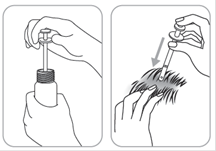
Etendre le produit avec le bout des doigts de façon à couvrir l’ensemble de la zone à traiter.
Avant et après application de la solution, se laver soigneusement les mains.
Appliquer sur des cheveux et un cuir chevelu parfaitement secs.
Méthode d’application
Le bouchon sécurité-enfant doit être retiré en appuyant sur le bouchon tout en le tournant dans le sens contraire des aiguilles d'une montre (vers la gauche). Il ne doit rester sur le flacon que le témoin d’inviolabilité.
En fonction du système de délivrance utilisé :
Utilisation de la pipette :
La pipette permet de prélever avec précision 1 ml de solution à répartir sur l’ensemble de la zone à traiter.
Utilisation de la pompe doseuse avec applicateur :
6 pulvérisations sont nécessaires afin d’appliquer une dose de 1 ml.
Ce système est adapté à l’application sur de faibles surfaces ou sous les cheveux.
Adapter par vissage la pompe doseuse au flacon.
Pour l’application : diriger la pompe vers le centre de la zone à traiter, presser une seule fois et étendre le produit avec le bout des doigts de façon à couvrir l’ensemble de la zone à traiter.
Hypersensibilité à la substance active ou à l’un des excipients mentionnés à la rubrique 6.1.
4.4. Mises en garde spéciales et précautions d'emploi
Une absorption percutanée accrue du minoxidil, pouvant provoquer des effets systémiques, est possible en cas :
· de dermatose ou lésion du cuir chevelu,
· d’augmentation de la dose appliquée et/ou augmentation de la fréquence des applications : il est impératif de respecter la posologie et le mode d’administration.
De même, bien que l’utilisation extensive du minoxidil solution n’ait pas révélé d’effets systémiques, on ne peut exclure qu’une absorption plus importante liée à une variabilité individuelle ou une sensibilité inhabituelle puisse provoquer des effets systémiques. Les patients devront en être avertis.
Les patients présentant une maladie cardiovasculaire avérée ou des arythmies cardiaques doivent contacter un médecin avant d’utiliser le minoxidil.
Chez les sujets ayant des antécédents cardiaques, le bénéfice du traitement doit être pesé. Ils devront être plus particulièrement avertis des effets indésirables potentiels afin d’interrompre le traitement dès l’apparition de l’un d’eux et d’avertir un médecin.
Ne pas appliquer de minoxidil sur une autre partie du corps.
Le minoxidil n’est pas indiqué en l’absence d’antécédents familiaux d’alopécie, en cas de chute de cheveux subite et/ou en plaques, de chute de cheveux à la suite d’un accouchement ou de chute de cheveux due à une cause inconnue.
Le patient doit arrêter d’utiliser ce médicament et consulter un médecin en cas de découverte d’une hypotension, en cas de douleur thoracique, de rythme cardiaque rapide, d’évanouissement ou d’étourdissements, de prise de poids subite inexpliquée, d’œdème des mains ou des pieds ou de rougeur ou d’irritation persistante du cuir chevelu.
Hypertrichose chez l’enfant suite à une exposition topique involontaire au minoxidil :
Des cas d’hypertrichose ont été rapportés chez des nourrissons après contact cutané au niveau des sites d’application du minoxidil de patients (soignants) utilisant du minoxidil topique. L'hypertrichose était réversible, en quelques mois, lorsque les nourrissons n'étaient plus exposés au minoxidil. Le contact entre les enfants et les sites d’application du minoxidil doit donc être évité.
Précautions d’emploi
Le minoxidil ne doit être utilisé que sur un cuir chevelu normal et sain. Il ne doit pas être utilisé si le cuir chevelu présente une rougeur, une inflammation, une infection, une irritation ou s’il est douloureux, ou si d’autres traitements sont appliqués sur le cuir chevelu.
En cas de contact accidentel avec les surfaces sensibles (œil, peau lésée, muqueuse), les excipients contenus dans la solution peuvent provoquer une sensation de brûlure et une irritation : rincer abondamment avec de l’eau courante froide.
L’inhalation de la brume pulvérisée doit être évitée.
L’ingestion accidentelle est susceptible d’entraîner des effets indésirables cardiaques graves (voir rubrique 4.9). Par conséquent, ce médicament doit être tenu hors de la portée des enfants.
Ce médicament contient 443,9 mg d’alcool (éthanol) par ml. Cela peut provoquer une sensation de brûlure sur une peau endommagée.
L’exposition solaire est déconseillée en cas d’application de minoxidil.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Les études d’interactions pharmacocinétiques chez l’homme ont montré que l’absorption percutanée du minoxidil est augmentée par la trétinoïne et l’anthraline en raison de l’augmentation de la perméabilité de la couche cornée ; le dipropionate de bétaméthasone augmente les concentrations tissulaires locales du minoxidil et diminue son absorption systémique.
Bien que non cliniquement prouvé, on ne peut exclure le risque d’apparition d’une hypotension orthostatique chez des patients traités par ailleurs par des vasodilatateurs périphériques.
Par voie cutanée, la résorption du minoxidil est contrôlée et limitée par le Stratum corneum. L’utilisation concomitante de médicaments d’application cutanée ayant un impact sur la barrière constituée par le Stratum corneum peut entraîner une augmentation de la résorption du minoxidil. Par conséquent l’utilisation concomitante d’ALOPEXY et d’autres médicaments par voie cutanée n’est pas recommandée.
4.6. Fertilité, grossesse et allaitement
Grossesse
Il n’a pas été mené d’études contrôlées adéquates chez la femme enceinte. Les études chez l’animal ont mis en évidence un risque pour le fœtus à des niveaux d’exposition très supérieurs à ceux attendus chez l’Homme. Un risque faible, bien que peu probable, d’effets délétères sur le fœtus est possible chez l’Homme (voir rubrique 5.3 Données de sécurité préclinique).
Le minoxidil topique ne doit être utilisé pendant la grossesse que si le bénéfice pour la mère est supérieur au risque potentiel pour le fœtus.
Le minoxidil absorbé au niveau systémique est excrété dans le lait maternel. Le minoxidil topique ne doit être utilisé pendant l’allaitement que si le bénéfice pour la mère est supérieur au risque potentiel pour l’enfant allaité.
Dans une étude de fertilité chez des rats mâles et femelles, une diminution dose-dépendante du taux de conception a été mise en évidence (voir rubrique 5.3). Le risque potentiel chez l'Homme est inconnu.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
ALOPEXY n’a aucun effet ou un effet négligeable sur l’aptitude à conduire des véhicules et à utiliser des machines.
Les effets indésirables suivants ont été rapportés après utilisation de la solution de minoxidil à 2 % et à 5% chez des hommes et des femmes avec une incidence supérieure à 1% et supérieure au groupe placebo dans 7 études cliniques versus placebo.
Par ailleurs les effets indésirables notifiés en post commercialisation sont rapportés avec une fréquence indéterminée.
Les effets indésirables ainsi que leur fréquence sont listés ci-dessous selon la base de données MedDRA par Classes de Systèmes d’Organes et par fréquence. Les fréquences sont définies en utilisant la classification suivante : Très fréquent (≥ 1/10) ; fréquent (≥ 1/100 ; < 1/10) ; peu fréquent (≥ 1/1 000 ; < 1/100) ; rare (≥ 1/10 000 ; < 1/1 000), très rare (< 1/10 000), indéterminée (ne peut être estimée sur la base des données disponibles).
Les réactions les plus fréquemment observées consistent en des réactions cutanées mineures.
Les applications fréquentes sur la peau peuvent provoquer des irritations et une sécheresse de la peau, en raison de la présence d’éthanol.
|
Classes de systèmes d’organes |
Effets indésirables |
|
Infections et Infestations Fréquence indéterminée |
Infection de l’oreille Otite externe Rhinite |
|
Affections du système immunitaire Fréquence indéterminée |
Hypersensibilité Réactions allergiques, y compris angioedème |
|
Affections psychiatriques Fréquent |
Dépression |
|
Affections du système nerveux Très Fréquent |
Maux de tête |
|
Fréquence indéterminée |
Névrite Sensation de picotements Dysgueusie Sensation de brûlure Sensations vertigineuses |
|
Affections oculaires Fréquence indéterminée |
Vision trouble Irritation oculaire |
|
Affections cardiaques Fréquence indéterminée |
Tachycardie Douleur thoracique Palpitations |
|
Affections vasculaires Fréquence indéterminée |
Hypotension |
|
Affections respiratoires, thoraciques et médiastinales Fréquent |
Dyspnée |
|
Affections hépato-biliaires Fréquence indéterminée |
Hépatite |
|
Affections de la peau et du tissu sous-cutané Fréquent |
Hypertrichose (à distance du site d’application) Dermatite de contact Prurit Dermatose inflammatoire Eruption cutanée acnéiforme |
|
Fréquence indéterminée |
Érythème généralisé Alopécie Répartition irrégulière des cheveux Modifications de la texture des cheveux Modifications de la couleur des cheveux. |
|
Affections musculo-squelettiques et systémiques Fréquent |
Douleurs musculo‑squelettiques |
|
Troubles généraux et anomalies au site d’administration Fréquent |
Réaction au site d’application : irritation, exfoliation cutanée, dermite, érythème, sécheresse, prurit Œdème périphérique Douleur |
|
Fréquence indéterminée |
Œdème de la face Œdème Asthénie |
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/.
Il n’existe pas de données indiquant que le minoxidil appliqué localement est absorbé en quantité suffisante pour entraîner des effets systémiques. Un surdosage est peu probable lorsque le médicament est utilisé conformément aux instructions.
Si ce médicament est appliqué sur une zone où l’intégrité de la barrière cutanée est diminuée en raison d’une blessure, d’une inflammation ou d’une pathologie de la peau, des effets systémiques de surdosage sont possibles.
Les effets indésirables ci‑dessous, très rares, peuvent survenir en raison des effets systémiques du minoxidil :
|
Classes de systèmes d’organes |
Effets indésirables |
|
Affections du système nerveux Très rare |
Sensations vertigineuses |
|
Troubles généraux et anomalies au site d’administration Très rare |
Rétention hydrique entraînant une prise de poids |
|
Affections cardiaques Très rare |
Fréquence cardiaque augmentée Hypotension |
L’ingestion accidentelle peut provoquer des effets systémiques dus à l’action vasodilatatrice du minoxidil (5 ml de solution contiennent 100 mg de minoxidil, soit la dose maximale utilisée pour une administration par voie orale chez l’adulte traité pour hypertension artérielle).
Traitement
En cas de surdosage en minoxidil, un traitement symptomatique ainsi que des mesures complémentaires doivent être mis en place.
Une rétention hydrosodée peut être traitée par une thérapeutique diurétique appropriée, une tachycardie et un angor par un agent bêtabloqueur ou un autre inhibiteur du système nerveux sympathique. Une hypotension symptomatique pourrait être traitée par une administration intraveineuse de soluté isotonique de chlorure de sodium. Il convient d’éviter l’utilisation de sympathomimétiques telles que la noradrénaline et l’adrénaline en raison d’une trop grande stimulation cardiaque.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Classe pharmacothérapeutique : AUTRES MEDICAMENTS DERMATOLOGIQUES
Code ATC : D11AX01.
Mécanisme d’action
Appliqué par voie topique, le minoxidil stimule la croissance des kératinocytes in vitro et in vivo et la pousse des cheveux chez certains sujets présentant une alopécie androgénétique.
L’apparition de ce phénomène a lieu après environ 4 mois (ou davantage) d’utilisation du produit et varie en fonction des sujets.
A l’arrêt du traitement, la repousse cesse et un retour à l’état initial est prévisible sous 3 ou 4 mois.
Le mécanisme précis d’action n’est pas connu.
Efficacité et sécurité clinique
L’application topique de minoxidil au cours des essais cliniques contrôlés chez les patients normotendus ou hypertendus n’a pas donné lieu à l’observation de manifestations systémiques liées à une absorption du minoxidil.
5.2. Propriétés pharmacocinétiques
Lorsqu'il est appliqué localement, l'absorption du minoxidil à travers la peau est limitée : l’absorption percutanée du minoxidil après application topique d’une solution à 2% hydroalcoolique, contenant du propylène glycol a été généralement rapportée entre 0,3 et 4,5% de la dose appliquée. La biodisponibilité systémique, à l’équilibre, du minoxidil 20 mg/ml solution topique (20 mg) par rapport à celui d'un comprimé oral de 2,5 mg était en moyenne de 1,4%. Suite à l’application biquotidienne de 1 ml d'ALOPEXY 20 mg/ml solution pour application cutanée pendant sept jours sur une zone de 100 cm2 du cuir chevelu de 24 volontaires sains atteints d'alopécie androgénétique, la Cmax du minoxidil s'est avérée inférieure à 2 ng/ml.
Comparativement, la dose en intra-veineuse la plus faible de minoxidil produisant un effet hémodynamique cliniquement significatif chez des patients souffrant d'hypertension légère à modérée est de 6,86 mg, correspondant à une concentration de minoxidil de 21,7 ng/ml. Lorsqu'il est administré par voie orale (dans le traitement de certaines formes d'hypertension), le minoxidil est pratiquement complètement absorbé par le tractus gastro-intestinal. Les concentrations systémiques de minoxidil après administration topique dépendent de la dose appliquée, la fréquence d'application et de la fonction barrière de la couche cornée.
L'absorption du minoxidil après application topique n'est pas influencée par le sexe, l'exposition aux ultraviolets, l’application simultanée d'hydratant, l’occlusion (port de couvre-chefs ou de prothèse capillaire), l’évaporation du solvant (sèche-cheveux) ou par la taille de la zone d’application.
Biotransformation
La biotransformation du minoxidil absorbé après application topique n’est pas entièrement connue.
Elimination
Après arrêt de l’application topique, environ 95 % du minoxidil absorbé sont éliminés en 4 jours.
5.3. Données de sécurité préclinique
Des effets cardiaques chez le chien ont été observés à de faibles doses, entraînant des effets hémodynamiques significatifs associés à des modifications cardiaques dans les études de toxicité par administrations répétées. Les données disponibles n’ont pas montré d’effets semblables chez l’Homme traité par le minoxidil, par voie orale ou cutanée.
Dans une étude de fertilité conduite par voie orale chez le rat, une réduction dose-dépendante du taux de conception a été observée à partir de la dose de 3 mg/kg/jour (au moins 12 fois l’exposition humaine). Dans une étude par voie sous-cutanée, des doses de minoxidil supérieures à 9 mg/kg/jour (au moins 36 fois l’exposition humaine) étaient associées à une diminution des taux de conception et d’implantation et à une réduction du nombre de petits vivants.
Le minoxidil n’a pas montré de potentiel tératogène chez le rat et le lapin à des doses orales allant jusqu’à 10 mg/kg/jour, et chez le rat à des doses sous-cutanées allant jusqu’à 11 mg/kg/jour (au moins 40 fois l’exposition humaine). Une toxicité pour le développement (incluant une augmentation des résorptions fœtales dans ces deux espèces, et chez le rat, des anomalies squelettiques, des mort-nés, et une diminution de la survie des petits) n’a été observée qu’à des expositions considérées comme suffisamment supérieures à l’exposition maximale chez l’Homme, indiquant une faible pertinence pour l’utilisation clinique.
g-Cyclodextrine, éthanol à 96 %, propylène glycol, eau purifiée.
Après ouverture : 1 mois.
6.4. Précautions particulières de conservation
Ce médicament ne nécessite pas de précautions particulières de conservation.
Produit inflammable.
Tenir à l’écart de la chaleur, des surfaces chaudes, des étincelles, des flammes nues et de toute autre source d’inflammation. Ne pas fumer.
6.5. Nature et contenu de l'emballage extérieur
· Flacon (PET ambré) de 60 ml fermé par un bouchon sécurité-enfant avec pipette (Polystyrène/polyéthylène) graduée à 1 ml et pompe doseuse avec applicateur. Boîte de 1 ou 3 flacon(s).
· Flacon (PET ambré) de 60 ml fermé par un bouchon sécurité-enfant avec pipette (Polystyrène/polyéthylène) graduée à 1 ml. Boîte de 1 ou 3 flacon(s).
Toutes les présentations peuvent ne pas être commercialisées.
6.6. Précautions particulières d’élimination et de manipulation
Pas d’exigences particulières.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
LES CAUQUILLOUS
81500 LAVAUR
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 362 991 6 0 : 60 ml en flacon (PET ambré) fermé par un bouchon sécurité-enfant avec pipette graduée (Polystyrène/polyéthylène) et pompe doseuse avec applicateur. Boîte de 1 flacon.
· 34009 303 062 8 4 : 60 ml en flacon (PET ambré) fermé par un bouchon sécurité-enfant avec pipette graduée (polystyrène/PE). Boîte de 1 flacon.
· 34009 364 307 5 4 : 60 ml en flacon (PET ambré) fermé par un bouchon sécurité-enfant avec pipette graduée (Polystyrène/polyéthylène) et pompe doseuse avec applicateur. Boîte de 3 flacons.
· 34009 303 062 9 1 : 60 ml en flacon (PET ambré) fermé par un bouchon sécurité-enfant avec pipette graduée (polystyrène/PE). Boîte de 3 flacons.
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
A compléter ultérieurement par le titulaire
10. DATE DE MISE A JOUR DU TEXTE
A compléter ultérieurement par le titulaire
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Médicament non soumis à prescription médicale.
ANSM - Mis à jour le : 26/11/2024
ALOPEXY 2 %, solution pour application cutanée
Minoxidil
Vous devez toujours prendre ce médicament en suivant scrupuleusement les informations fournies dans cette notice ou par votre médecin ou votre pharmacien.
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Adressez-vous à votre pharmacien pour tout conseil ou information.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
· Vous devez vous adresser à votre médecin si vous ne ressentez aucune amélioration ou si vous vous sentez moins bien.
1. Qu'est-ce que ALOPEXY 2 %, solution pour application cutanée et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant d'utiliser ALOPEXY 2 %, solution pour application cutanée ?
3. Comment utiliser ALOPEXY 2 %, solution pour application cutanée ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver ALOPEXY 2 %, solution pour application cutanée ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE ALOPEXY 2 %, solution pour application cutanée ET DANS QUELS CAS EST-IL UTILISE ?
Classe pharmacothérapeutique : AUTRES MEDICAMENTS DERMATOLOGIQUES - Code ATC : D11AX01.
Ce médicament se présente sous la forme d'une solution pour application cutanée qui contient du minoxidil comme substance active.
Il est indiqué en cas de chute de cheveux modérée (alopécie androgénétique) de l'adulte, homme ou femme. Il favorise la pousse des cheveux et stabilise le phénomène de chute.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D’UTILISER ALOPEXY 2 %, solution pour application cutanée ?
N’utilisez jamais ALOPEXY 2 %, solution pour application cutanée :
· si vous êtes allergique au minoxidil ou à l’un des autres composants contenus dans ce médicament, mentionnés dans la rubrique 6.
Avertissements et précautions
Adressez-vous à votre médecin ou pharmacien avant d’utiliser ALOPEXY.
En cas de maladies cardiaques même anciennes, il est nécessaire de consulter un médecin avant la première utilisation de minoxidil.
Des cas de pilosité excessive sur le corps de nourrissons ont été rapportés après contact cutané au niveau des sites d’application du minoxidil de patients (soignants) utilisant du minoxidil topique. La croissance des poils est revenue à la normale en quelques mois lorsque les nourrissons n'étaient plus exposés au minoxidil. Veiller à ce que les enfants n’entrent pas en contact avec des zones de votre corps où vous avez appliqué le minoxidil par voie topique.
Consultez un médecin si vous remarquez une pilosité excessive sur le corps de votre enfant pendant la période où vous utilisez des produits topiques contenant du minoxidil.
Vous ne devez pas appliquer ce médicament :
· Si vous n’avez pas d’antécédents familiaux d’alopécie, si vous avez une chute des cheveux brutale et/ou en plaques, une chute de cheveux consécutive à un accouchement ou une chute de cheveux de cause inconnue. Dans ces cas, vous devez consulter votre médecin avant de prendre ce médicament car ce traitement peut ne pas être efficace sur ces types de chutes de cheveux.
· Si votre cuir chevelu présente une rougeur, est inflammé, infecté, irrité ou douloureux. Ce médicament doit être uniquement appliqué sur le cuir chevelu sain (voir rubrique : « Comment utiliser ALOPEXY 2 % »). Chez les sujets présentant des lésions du cuir chevelu, une augmentation du passage dans le sang de la substance active (minoxidil) est possible.
· En même temps que d’autres médicaments appliqués sur le cuir chevelu.
· Sur une autre partie du corps.
Pendant le traitement
· En cas de contact accidentel avec l’œil, une plaie, une peau irritée, une muqueuse, ce médicament qui contient de l’éthanol (alcool) peut provoquer une sensation de brûlure ou une irritation : rincer abondamment avec de l’eau courante froide. En cas de signes persistants, consultez un médecin.
· N’exposez pas le cuir chevelu traité au soleil, une protection est nécessaire (chapeau).
· Ne pas avaler. L’ingestion accidentelle peut provoquer des effets cardiaques graves. Par conséquent, le produit doit être tenu hors de la vue et de la portée des enfants. CONSULTEZ RAPIDEMENT UN MEDECIN.
· Ne pas inhaler le médicament pulvérisé.
Vous devez arrêter le traitement immédiatement et consulter votre médecin :
· Si vous ressentez une baisse de la tension artérielle (hypotension), des douleurs dans la poitrine ou une accélération du pouls.
· En cas de faiblesse ou de vertiges.
· En cas de prise de poids soudaine et inexpliquée, de gonflement des mains ou des pieds (œdème).
· En cas de rougeur ou d’irritation persistante du cuir chevelu.
Il est important de respecter la posologie et le mode d'administration préconisés :
En cas de non-respect de la posologie et/ou du mode d'administration préconisés, le passage dans la circulation générale du minoxidil pourrait être augmenté et entraîner des effets indésirables tels que douleur thoracique, baisse de la tension artérielle, tachycardie (accélération du rythme cardiaque), étourdissements (sensations de vertiges), prise de poids soudaine et inexpliquée, gonflement des mains et des pieds.
Enfants et adolescents
Il n'y a pas d'utilisation justifiée de ce médicament chez les sujets de moins de 18 ans pour l'indication de l'alopécie androgénétique d'intensité modérée.
Personnes âgées
Ce médicament ne doit pas être utilisé chez les sujets de plus de 65 ans car son efficacité et sa sécurité n’ont pas été étudiées.
Autres médicaments et ALOPEXY 2 %, solution pour application cutanée
N’appliquez pas ce médicament en même temps que d’autres produits destinés à être appliqués sur le cuir chevelu, comme la trétinoïne, l’anthraline, le dipropionate de bétaméthasone, car ces produits sont susceptibles de modifier la quantité de minoxidil passant dans le sang.
Informez votre médecin ou pharmacien si vous utilisez, avez récemment utilisé ou pourriez utiliser tout autre médicament, y compris un médicament obtenu sans ordonnance.
ALOPEXY 2 %, solution pour application cutanée avec des aliments et boissons et de l’alcool
Sans objet.
Si vous êtes enceinte ou que vous allaitez, si vous pensez être enceinte ou planifiez une grossesse, demandez conseil à votre médecin ou pharmacien avant de prendre ce médicament
Grossesse
L’utilisation de ce médicament n’est pas recommandée pendant la grossesse.
Allaitement
Ce médicament ne doit pas être utilisé pendant l’allaitement.
Conduite de véhicules et utilisation de machines
ALOPEXY n'a aucun effet ou un effet négligeable sur l'aptitude à conduire des véhicules et à utiliser des machines.
ALOPEXY 2 %, solution pour application cutanée contient du propylène glycol et de l’alcool (éthanol).
Ce médicament contient 50 mg de propylène glycol par dose, équivalent à 50 mg/ml.
Ce médicament contient 443,9 mg d’alcool (éthanol) par dose, équivalent à 443,9 mg/ml. Cela peut provoquer une sensation de brûlure sur une peau endommagée.
3. COMMENT UTILISER ALOPEXY 2 %, solution pour application cutanée ?
Précaution
Produit inflammable.
Tenir à l’écart de la chaleur, des surfaces chaudes, des étincelles, des flammes nues et de toute autre source d’inflammation.
Ne pas fumer pendant l’utilisation ou la manipulation du flacon.
Posologie
Veillez à toujours utiliser ce médicament en suivant exactement les instructions de cette notice ou les indications de votre médecin ou pharmacien. Vérifiez auprès de votre médecin ou pharmacien en cas de doute.
Appliquer 2 fois par jour une dose de 1 ml sur le cuir chevelu en prenant pour point de départ le centre de la zone à traiter.
La dose quotidienne ne doit pas dépasser 2 ml, quelle que soit l'étendue de la zone à traiter.
Une application de 1 ml le matin et de 1 ml le soir.
N’augmentez pas les doses, ni les fréquences d’application.
Dans tous les cas, respectez strictement la dose.
Mode d’administration
Voie cutanée.
Usage externe.
Etaler le produit avec le bout des doigts de façon à couvrir l'ensemble de la zone à traiter en prenant pour point de départ le centre de la zone à traiter.
Avant et après application de la solution, se laver soigneusement les mains.
Appliquer sur des cheveux et un cuir chevelu parfaitement secs.
Ne pas appliquer le produit sur une autre partie du corps.
Mode d’application
Ouvrir le flacon : Le flacon est muni d'un bouchon sécurité-enfant. Voici comment l'ouvrir : appuyer sur le bouchon en plastique tout en le tournant dans le sens contraire des aiguilles d'une montre (vers la gauche). Il ne doit rester sur le flacon que le témoin d’inviolabilité.
En fonction du système de délivrance utilisé avec le flacon (pipette graduée ou pompe doseuse avec applicateur) :
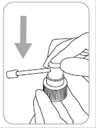
Pipette graduée à 1 ml
|
|
La pipette permet de prélever avec précision 1 ml de solution à répartir sur l’ensemble de la zone à traiter.
|
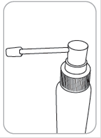
Pompe doseuse avec applicateur
Ce système est adapté à l’application sur de faibles surfaces ou sous les cheveux.
|
|
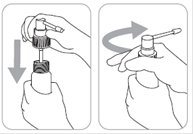
1. Encliqueter la canule dans la pompe : tenir fermement le corps de la pompe en appuyant sur la partie poussoir de la canule. |
|
|
|
|
|
2. Insérer le pulvérisateur muni de la canule dans le flacon et le visser fermement. |
|
|
3. Amorcer la pompe : le système de distribution est prêt à l’emploi. |
|
|
4. Pour l’application : diriger le pulvérisateur vers le centre de la surface à traiter ou sous les cheveux, presser une fois et étaler le produit avec le bout des doigts. Six (6) pulvérisations sont nécessaires pour appliquer une dose d’1 ml. |
Durée du traitement
Le début et le degré de la réponse au traitement varient en fonction des sujets.
Le résultat n'est pas immédiat : l'arrêt de la chute des cheveux et/ou la pousse des cheveux ne peut apparaître que quelques temps après le début du traitement (environ 3 ou 4 mois).
Si vous avez utilisé plus de ALOPEXY 2 %, solution pour application cutanée que vous n’auriez dû :
Le surdosage est peu probable en cas d’utilisation conforme à la posologie recommandée.
En cas de surdosage ou de mauvaise utilisation ou d’ingestion accidentelle : contactez immédiatement votre médecin (voir rubrique 2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D’UTILISER ALOPEXY 2% solution pour application cutanée ?).
Les signes de surdosage peuvent comprendre une baisse de la tension artérielle (hypotension) et une ’accélération du rythme cardiaque (tachycardie).
Si vous avez utilisé ALOPEXY 2 %, solution pour application cutanée plus qu’il ne fallait ou si vous/votre enfant avez ingéré accidentellement, contactez immédiatement votre centre antipoison ou votre médecin.
Si vous oubliez d’utiliser ALOPEXY 2 %, solution pour application cutanée :
N’utilisez pas de dose double pour compenser la dose que vous avez oublié d’appliquer.
Reprendre à la fréquence habituelle : 1 application le matin et 1 application le soir.
Si vous arrêtez d’utiliser ALOPEXY 2 %, solution pour application cutanée :
Sans objet.
Si vous avez d’autres questions sur l’utilisation de ce médicament, demandez plus d’informations à votre médecin ou à votre pharmacien.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Informez immédiatement votre médecin si vous remarquez l'un des symptômes suivants, car vous pourriez avoir besoin d'un traitement médical en urgence.
· Gonflement du visage, des lèvres ou de la gorge entraînant des difficultés à avaler ou à respirer. Ces symptômes pourraient être le signe d'une réaction allergique grave (fréquence indéterminée, ne pouvant être estimée à partir des données disponibles).
Les réactions les plus fréquemment observées consistent en des réactions cutanées mineures.
Les applications fréquentes sur la peau peuvent provoquer des irritations et une sécheresse de la peau, en raison de la présence d’alcool (éthanol).
Les effets indésirables suivants ont été rapportés et sont classés par fréquences :
Très fréquents (peuvent survenir chez plus d’une personne sur 10)
Maux de tête (céphalées).
Fréquents (peuvent survenir chez 1 à 10 personnes sur 100)
Réactions cutanées locales au site d’application du produit : irritation locale, desquamation (élimination des cellules mortes de la peau), démangeaisons, rougeur de la peau (érythème), dermatite, sécheresse de la peau, douleur.
Réaction allergique de la peau, réaction inflammatoire de la peau, éruptions sur la peau pouvant ressembler à de l’acné, hypertrichose (poussée excessive des poils) à distance du site d’application, douleurs musculosquelettiques, œdèmes périphériques (infiltration de liquides dans les tissus), difficultés à respirer (dyspnées) et dépression.
Fréquence indéterminée (ne pouvant être estimée sur la base des données disponibles)
Infection de l’oreille, otites externes, rhinite, hypersensibilité, inflammation d’un nerf (névrite) sensation de picotements, altération du goût (dysgueusie), sensation de brûlure de la peau, étourdissement (sensations vertigineuses), troubles de la vision, irritation oculaire, baisse de la tension artérielle, accélération du rythme cardiaque (tachycardie), palpitations, douleur thoracique, gonflement du visage (infiltration de liquides dans les tissus), rougeur généralisé, chute de cheveux et répartition irrégulière des cheveux, changement de la couleur ou de la texture des cheveux, fatigue (asthénie), inflammation du foie (hépatite).
Dans tous ces cas, il faut arrêter votre traitement et prévenir rapidement votre médecin.
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/.
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER ALOPEXY 2 %, solution pour application cutanée ?
Tenir ce médicament hors de la vue et de la portée des enfants.
N’utilisez pas ce médicament après la date de péremption indiquée sur le conditionnement extérieur après EXP. La date de péremption fait référence au dernier jour de ce mois.
Produit inflammable. Tenir à l’écart de la chaleur, des surfaces chaudes, des étincelles, des flammes nues et de toute autre source d’inflammation. Ne pas fumer.
Ce médicament ne nécessite pas de précautions particulières de conservation.
La solution doit être utilisée 1 mois maximum après première ouverture.
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient ALOPEXY 2 %, solution pour application cutanée
· La substance active est :
Minoxidil............................................................................................................................. 2 g
Pour 100 ml de solution pour application cutanée
· Les autres composants sont : g-Cyclodextrine, éthanol à 96 %*, propylène glycol*, eau purifiée.
· *Voir rubrique 2 « ALOPEXY contient »
Qu’est-ce que ALOPEXY 2 %, solution pour application cutanée et contenu de l’emballage extérieur
Ce médicament se présente sous forme de solution limpide ou légèrement jaune. Solution pour application cutanée.
Flacon de 60 ml fermé par un bouchon sécurité-enfant avec pipette graduée à 1 ml et pompe doseuse avec applicateur. Boîte de 1 ou 3 flacon(s).
Flacon de 60 ml fermé par un bouchon sécurité-enfant avec pipette graduée à 1 ml. Boîte de 1 ou 3 flacon(s).
Toutes les présentations peuvent ne pas être commercialisées.
Titulaire de l’autorisation de mise sur le marché
LES CAUQUILLOUS
81500 LAVAUR
Exploitant de l’autorisation de mise sur le marché
Parc Industriel de la Chartreuse
81100 CASTRES
PIERRE FABRE MEDICAMENT PRODUCTION
SITE PROGIPHARM
RUE DU LYCEE
45500 GIEN
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Sans objet.
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).
CONSEILS D’EDUCATION SANITAIRE
A/ Qu'appelle-t-on alopécie androgénétique ?
Normalement les cheveux ont une durée de vie de 3 à 6 ans et il tombe par jour 50 à 100 cheveux.
Une chute de cheveux plus importante peut survenir de façon saisonnière (à l'automne) ou après un accouchement : cette chute est normale, transitoire et il n'y a pas lieu de débuter un traitement.
L’alopécie se définit par une chute de cheveux supérieure à 100 cheveux par jour. On distingue deux types d’alopécies :
· Les alopécies aiguës,
· Les alopécies chroniques
Les alopécies aiguës (chute des cheveux soudaine sur une courte période) peuvent être diffuses ou par plaques (pelades) et sont le plus souvent de cause connue (soins capillaires agressifs, mauvais état général, cure d’amaigrissement mal équilibrée, certains médicaments, chocs psychiques, stress...). Ces alopécies aiguës ne doivent pas être traitées par ce médicament.
Les alopécies chroniques (au long cours) sont presque toujours diffuses.
Elles sont parfois dues à une maladie précise (thyroïde, métabolique ) et elles ne doivent pas être traitées par ce médicament.
Dans la grande majorité, ces alopécies chroniques sont d'origine mal connue, le plus souvent à caractère héréditaire : il s'agit de l'alopécie androgénétique. Seul ce type d'alopécie peut être traité par le minoxidil.
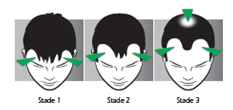
B/ Comment reconnaître une alopécie androgénétique ?
|
Chez la femme |
Chez l’homme |
|
|
|
|
L’alopécie androgénétique est diffuse : il se produit une diminution globale de la densité capillaire. La chevelure s’éclaircit progressivement à partir de la raie. |
L’alopécie androgénétique débute par un dégarnissement des golfes temporaux. Puis une légère tonsure apparaît au sommet du crâne. Ces 2 zones dépourvues de cheveux vont progressivement s’agrandir : l’alopécie évolue progressivement vers la calvitie. |
C/ Quelques conseils d'utilisation
· Utiliser un shampoing peu agressif (de préférence sans silicone).
· Si vous faites votre shampoing après l'application du minoxidil, respecter une période de 4 heures après celle-ci.
Si vous appliquez le minoxidil après le shampoing, il est recommandé de le faire sur le cuir chevelu sec. Vous pouvez utiliser un sèche-cheveux après application de minoxidil de préférence en position tiède.
· Vous pouvez utiliser des mousses, gels ou sprays coiffants en respectant un délai minimum de 1 heure entre les applications.
· Il n'y a pas d'interaction entre votre traitement par le minoxidil et vos permanentes ou soins colorants, mais il est préférable de les limiter du fait de leur agressivité sur les cheveux.
· Si vous envisagez de vous exposer au soleil après une application de minoxidil, il est recommandé de couvrir vos cheveux.
D/ Quelques informations complémentaires
· En début de traitement, sur une courte période, il est possible que se produise une augmentation de la chute des cheveux. Ces cheveux étaient destinés à tomber et le font plus rapidement. C'est un phénomène normal, continuez le traitement.
· Les premiers cheveux qui pousseront seront doux, duveteux et peu visibles. Au fur et à mesure, en poursuivant votre traitement, ils pourront changer et s'épaissir.