Dernière mise à jour le 08/01/2026
BLISSEL 50 microgrammes/g, gel vaginal
Indications thérapeutiques
Classe pharmacothérapeutique - code ATC : G03CA04
BLISSEL appartient à la famille des œstrogènes (hormones sexuelles) par voie locale (vaginale). Il fait partie d’un groupe de médicament appelé traitement hormonal substitutif (THS).
Il est utilisé pour soulager les symptômes de la ménopause au niveau vaginal tels que la sécheresse vaginale ou l’irritation vaginale. On parle « d’atrophie vaginale ». Elle est causée par une baisse du taux d’œstrogènes arrivant naturellement après la ménopause.
BLISSEL agit en remplaçant les œstrogènes qui sont normalement produits par les ovaires de la femme. BLISSEL vaginale s’insère dans le vagin, pour que l’hormone soit libérée là où elle est nécessaire. Ceci peut soulager l’inconfort vaginal.
Présentations
> 1 tube(s) aluminium de 10 g + 10 canules jetables + 1 piston réutilisable
Code CIP : 219 721-9 ou 34009 219 721 9 1
Déclaration d'arrêt de commercialisation : 31/01/2025
Cette présentation n'est pas agréée aux collectivités
> 1 tube(s) aluminium de 10 g + 1 canule réutilisable + 1 piston réutilisable
Code CIP : 34009 300 616 6 4
Déclaration de commercialisation : 24/12/2024
Cette présentation n'est pas agréée aux collectivités
Service médical rendu (SMR)
Pas de SMR disponible pour ce médicament ( plus d'informations dans l'aide )
Amélioration du service médical rendu (ASMR)
Pas d'ASMR disponible pour ce médicament (plus d'informations dans l'aide )
ANSM - Mis à jour le : 21/03/2022
BLISSEL 50 microgrammes/g, gel vaginal
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
1 g de gel vaginal contient 50 microgrammes d’estriol.
Excipients à effet notoire : 1 g de gel vaginal contient 1,60 mg de parahydroxybenzoate de méthyle sodique et 0,20 mg de parahydroxybenzoate de propyle sodique.
Pour la liste complète des excipients, voir rubrique 6.1.
Gel homogène, incolore, clair à légèrement translucide.
4.1. Indications thérapeutiques
4.2. Posologie et mode d'administration
Conseils sur la façon de débuter le traitement et sur le traitement d’entretien
BLISSEL peut être débuté à tout moment après la manifestation d’une vaginite atrophique.
Traitement initial : une dose d’applicateur de gel vaginal par jour pendant 3 semaines (de préférence au coucher). En traitement d'entretien, il est recommandé de prescrire une dose d’applicateur deux fois par semaine (de préférence au coucher). Une évaluation de la poursuite du traitement après 12 semaines doit être effectuée par le médecin.
Pour initier et poursuivre le traitement des symptômes de la post-ménopause, ce médicament doit être prescrit à la dose minimale efficace pendant la période la plus courte possible (voir également rubrique 4.4.)
Pour les produits à base d’œstrogènes pour application vaginale dont l’exposition systémique à l’œstrogène reste dans les valeurs normales de la ménopause, il n’est pas recommandé d’ajouter un progestatif (voir rubrique 4.4).
Si la patiente a oublié d’appliquer une dose, la dose oubliée doit être appliquée dès que possible, dans les 12 heures suivant l’heure habituelle de l’application. Au-delà de 12 heures, la dose oubliée ne doit pas être appliquée et la patiente doit poursuivre le schéma posologique habituel.
Administration
BLISSEL doit être appliqué dans le vagin à l’aide d’un applicateur doseur, en suivant attentivement les instructions contenues dans la notice et ci-dessous.
Une dose d’applicateur (applicateur rempli jusqu’à l’anneau qui sert de repère) délivre une dose d’1 g de gel vaginal contenant 50 microgrammes d’estriol. L’applicateur rempli doit être inséré dans le vagin et vidé, de préférence le soir.
Pour appliquer le gel, allongez-vous, avec les genoux pliés et écartés. Insérez doucement l’extrémité ouverte de l’applicateur profondément dans le vagin et enfoncez doucement le piston jusqu’au fond, aussi loin que possible pour vider le gel dans le vagin.
Après utilisation, retirez le piston de la canule puis, en fonction de la présentation, vous pouvez nettoyer ou jeter la canule comme indiqué dans les instructions de la notice.
· Hypersensibilité à la substance active ou à l’un des excipients mentionnés à la rubrique 6.1
· Cancer du sein connu ou suspecté ou antécédents de cancer du sein
· Tumeurs malignes estrogéno-dépendantes connues ou suspectées (exemple : cancer de l’endomètre)
· Hémorragie génitale non diagnostiquée
· Hyperplasie endométriale non traitée
· Antécédents de maladie thromboembolique veineuse idiopathique ou présence de maladie thromboembolique veineuse (thrombose veineuse profonde, embolie pulmonaire)
· Accident thromboembolique artériel récent ou en évolution (exemples : angor, infarctus du myocarde)
· Troubles thrombophiliques connus (par exemple déficit en protéine C, protéine S ou antithrombine, voir rubrique 4.4)
· Affection hépatique aiguë ou antécédents d’affection hépatique, jusqu’à normalisation des tests hépatiques
· Porphyrie
4.4. Mises en garde spéciales et précautions d'emploi
Dans l’indication du traitement des symptômes de la post-ménopause, l’œstrogénothérapie locale ne doit être instaurée que si les troubles sont perçus par la patiente comme altérant sa qualité de vie. Dans tous les cas, une évaluation minutieuse des risques et des bénéfices doit être entreprise au moins une fois par an et le traitement hormonal substitutif (THS) ne doit être poursuivi que tant que les bénéfices l’emportent sur les risques.
BLISSEL 50 microgrammes/g, gel vaginal ne doit pas être associé à des préparations estrogéniques administrées en traitement systémique, il n’existe aucune étude sur la sécurité et les risques liés aux concentrations en estrogènes atteintes en traitement combiné.
L’applicateur vaginal peut occasionner des traumatismes locaux mineurs, notamment chez les femmes souffrant d’une atrophie vaginale importante.
Excipients
Blissel 50 microgrammes/g, gel vaginal contient du parahydroxybenzoate de méthyle sodique (E 219) et du parahydroxybenzoate de propyle sodique (E 217), qui peuvent causer des réactions allergiques (éventuellement retardées).
Examen clinique/surveillance
Avant de débuter ou de recommencer un traitement avec estriol, il est indispensable de recueillir les antécédents médicaux personnels et familiaux de la patiente. Un examen clinique (avec examen mammaire et pelvien) doit être pratiqué, en tenant compte des antécédents médicaux de la patiente et des contre-indications et mises en garde concernant le traitement.
Pendant toute la durée du traitement, il est recommandé d’effectuer des examens réguliers, dont la nature et la fréquence seront adaptées à chaque femme. Les femmes doivent être informées du type d’anomalies mammaires à signaler à leur médecin ou à leur infirmière (voir « Cancer du sein » ci-dessous).
Des examens, incluant une mammographie, doivent être pratiqués conformément aux pratiques de dépistage actuellement en vigueur, adaptées aux besoins cliniques de la personne. Toute infection vaginale doit être traitée avant le début du traitement par BLISSEL 50 microgrammes/g, gel vaginal.
Conditions nécessitant une surveillance
Si l’une des affections suivantes survient, est survenue précédemment, et/ou s’est aggravée au cours d’une grossesse ou d’un précédent traitement hormonal, la patiente devra être étroitement surveillée. Les affections suivantes peuvent réapparaître ou s’aggraver au cours du traitement par Blissel 50 microgrammes/g, gel vaginal, en particulier :
· léiomyome (fibrome utérin) ou endométriose ;
· antécédent ou présence de facteurs de risque thromboemboliques (voir rubrique « Accidents thrombo-emboliques veineux » ci-dessous) ;
· facteurs de risque de tumeurs estrogéno-dépendantes, par exemple : 1er degré d’hérédité pour le cancer du sein ;
· hypertension artérielle ;
· troubles hépatiques (par exemple : adénome hépatique) ;
· diabète avec ou sans atteinte vasculaire ;
· lithiase biliaire ;
· migraines ou céphalées (sévères) ;
· lupus érythémateux disséminé (LED) ;
· antécédent d’hyperplasie endométriale (voir rubrique « hyperplasie endométriale ») ;
· épilepsie ;
· asthme ;
· otospongiose.
Arrêt immédiat du traitement
Le traitement doit être arrêté immédiatement en cas de survenue d’une contre-indication ou dans les cas suivants :
· ictère ou altération de la fonction hépatique ;
· augmentation significative de la pression artérielle ;
· céphalée de type migraine inhabituelle ;
· grossesse.
BLISSEL est une préparation d’estriol à faible dose et agissant localement. Par conséquent, la survenue des affections mentionnées ci-dessous est moins probable qu’avec un traitement systémique aux estrogènes.
Hyperplasie endométriale et carcinome
· Chez les femmes dont l'utérus est intact, le risque d’hyperplasie de l’endomètre et de carcinome est accru lorsque les œstrogènes systémiques sont administrés seuls pendant des périodes prolongées.
· Pour les produits à base d'œstrogènes destinés à une application vaginale dont l'exposition systémique à l'œstrogène reste dans les valeurs normales de la ménopause, il n’est pas recommandé d’ajouter un progestatif.
· La sécurité d’emploi pour l’endomètre des œstrogènes administrés par voie vaginale lors d’une utilisation à long terme (plus d’un an) ou répétée est incertaine. Par conséquent, en cas de traitement répété, il doit être réévalué au moins une fois par an.
· La survenue de métrorragies ou de « spottings » au cours du traitement doit faire rechercher une pathologie sous-jacente. Cette démarche peut nécessiter une biopsie endométriale afin d’éliminer une pathologie maligne.
· La stimulation œstrogénique non compensée peut conduire à une transformation prémaligne des foyers résiduels d’endométriose. Ce médicament doit donc être prescrit avec précaution chez les femmes ayant subi une hystérectomie suite à une endométriose, notamment chez celles ayant une endométriose résiduelle.
Les risques suivants ont été associés à un THS systémique et s’appliquent dans une moindre mesure aux produits à base d’œstrogènes avec application vaginale dont l’exposition systémique à l’œstrogène reste dans les valeurs normales de la ménopause. Cependant, ils doivent être pris en compte en cas d’utilisation à long terme ou répétée de ce produit.
Cancer du sein
Les données épidémiologiques issues d’une importante méta-analyse suggèrent l’absence d’augmentation du risque du cancer du sein chez les femmes n’ayant aucun antécédent de cancer du sein et prenant des œstrogènes par voie vaginale à faible dose. Il n’a pas été établi si les œstrogènes par voie vaginale à faible dose favorisent la récidive du cancer du sein.
Cancer de l’ovaire
Le cancer ovarien est beaucoup plus rare que le cancer du sein. Les données épidémiologiques d'une importante méta-analyse suggèrent un risque légèrement accru chez les femmes prenant un THS systémique à base d’œstrogènes seuls qui apparaît dans les cinq années suivant le début de l’utilisation et diminue progressivement après l'arrêt du traitement.
Accidents thrombo-emboliques veineux
· Les patientes présentant des troubles thrombophiliques connus ont un risque accru de TEV et le THS peut augmenter ce risque. Le THS est donc contre-indiqué chez ces patientes (voir rubrique 4.3).
· Les facteurs de risques reconnus pour les TEV sont :, , utilisation d’œstrogènes, âge avancé, chirurgie majeure, immobilisation prolongée, obésité sévère (IMC > 30 kg/m2),grossesse / période post-partum, lupus érythémateux disséminé (LED) et cancer. En revanche, il n’existe aucun consensus sur le rôle possible des varices sur le risque thrombo-embolique veineux.
Maladie des artères coronaires
Accident vasculaire cérébral ischémique
Le traitement hormonal substitutif avec des préparations à effet systémique est associé à un risque accru d’accident vasculaire cérébral ischémique. Cependant, comme le risque de base d’AVC dépend fortement de l’âge, le risque global d’AVC chez les femmes qui utilisent le THS augmentera avec l’âge (voir rubrique 4.8).
Autres précautions d’emploi
Les estrogènes à effets systémiques pouvant provoquer une rétention hydrique ou une augmentation de la concentration de triglycérides dans le plasma, les patientes présentant, respectivement, une insuffisance rénale ou cardiaque ou une hypertriglycéridémie préexistante doivent être étroitement surveillées pendant les premières semaines du traitement. BLISSEL 50 microgrammes/g, gel vaginal pour application locale contenant une faible dose d’estriol, il est peu probable qu’il ait des effets systémiques.
Les patientes atteintes d’insuffisance rénale sévère doivent être étroitement surveillées en raison de l’augmentation possible des taux circulants d’estriol.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Aucune étude d’interaction entre BLISSEL 50 microgrammes/g, gel vaginal et d’autres médicaments n’a été réalisée. En raison de l’administration par voie vaginale et d’une absorption systémique minimale, il est peu probable qu’une interaction médicamenteuse quelconque cliniquement pertinente se produise avec BLISSEL. Cependant, la possibilité d’interactions avec d’autres traitements vaginaux appliqués localement doit être prise en compte.
4.6. Fertilité, grossesse et allaitement
Aucune donnée disponible.
Grossesse
BLISSEL 50 microgrammes/g, gel vaginal n’a pas d’indication au cours de la grossesse.
La découverte d'une grossesse au cours du traitement par BLISSEL 50 microgrammes/g, gel vaginal impose l’arrêt immédiat du traitement.
Aucune donnée clinique sur des grossesses exposées à l’estriol n'est disponible.
À ce jour, la plupart des études épidémiologiques n’ont pas mis en évidence d’effet tératogène ou fœtotoxique chez les femmes enceintes ayant subi une exposition involontaire.
BLISSEL 50 microgrammes/g - gel vaginal n’a pas d’indication au cours de l’allaitement.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Des effets indésirables de l’estriol sont habituellement observés chez 3 à 10 % des patientes traitées.
En début du traitement, lorsque la muqueuse vaginale est encore atrophique, une irritation locale peut se développer sous la forme d’une sensation de chaleur et/ou de démangeaisons.
Les effets indésirables rencontrés lors des essais cliniques menés sur BLISSEL 50 microgrammes/g, gel vaginal ont été classés par fréquence :
|
Classe d’organe |
Fréquent (³ 1/100 ; < 1/10) |
Peu fréquent (³ 1/1 000 ; < 1/100) |
Rare (³ 1/10 000 ; < 1/1000) |
|
Affections des organes de reproduction et du sein |
Prurit génital |
Douleur pelvienne, rash génital |
|
|
Troubles généraux et anomalies au site d’administration |
Prurit au site d’application |
Irritation au site d’application |
|
|
Infections et infestations |
|
Candidose |
|
|
Affections du système nerveux |
|
Céphalée |
|
|
Affections de la peau et du tissu sous-cutané |
Prurit |
Prurigo |
|
BLISSEL est un gel vaginal pour traitement local qui contient une très faible dose d’estriol et est associé à une exposition systémique auto-limitée (qui s’est avérée être pratiquement négligeable après application répétée). Par conséquent, il est très improbable qu’il produise les effets les plus graves de l’œstrogénothérapie orale substitutive.
Effets de classe associés au THS systémique
Les risques suivants ont été associés à un THS systémique et s’appliquent dans une moindre mesure aux produits à base d’œstrogènes avec application vaginale (BLISSEL) dont l’exposition systémique à l’œstrogène reste dans les valeurs normales de la ménopause.
Cancer ovarien
L’utilisation d’un THS systémique a été associée à un risque légèrement accru de cancer ovarien diagnostiqué (voir rubrique 4.4).
Une méta-analyse provenant de 52 études épidémiologiques a rapporté un risque accru de cancer ovarien chez les femmes actuellement sous THS systémique par rapport aux femmes n’en ayant jamais pris (RR 1,43, IC à 95 % : 1,31– 1,56). Chez les femmes âgées de 50 à 54 ans sous THS pendant 5 ans, cela représente environ 1 cas supplémentaire pour 2 000 utilisatrices. Chez les femmes âgées de 50 à 54 ans qui ne prennent pas de THS, un diagnostic de cancer ovarien sera posé chez environ 2 femmes sur 2000 sur une période de cinq ans.
Risque d’accidents thromboemboliques veineux
Le THS systémique est associé à un risque relatif multiplié par 1,3 à 3 d’évènement thromboembolique veineux (TEV), comme une thrombose veineuse profonde ou une embolie pulmonaire. La survenue d’un tel évènement est plus probable au cours de la première année sous THS (voir rubrique 4.4). Les résultats des études WHI sont présentés :
Etudes WHI - Risque augmenté de TEV après 5 ans d’utilisation
|
Age (années) |
Incidence pour 1 000 femmes ayant pris un placebo sur une période de 5 ans |
Rapport de risque et IC à 95 % |
Cas supplémentaires pour 1 000 patientes ayant pris un THS |
|
Œstrogènes seuls par voie orale* |
|||
|
50-59 |
7 |
1,2 (0,6 – 2,4) |
1 (-3-10) |
*Étude chez des femmes hystérectomisées
Risque d’accident ischémique cérébral
· Le THS systémique est associée à un risque relatif 1,5 fois plus élevé d’accident ischémique cérébral. Le risque d’accident vasculaire cérébral hémorragique n’augmente pas pendant l’utilisation du THS.
· Ce risque relatif ne dépend pas de l’âge ou de la durée d’utilisation, mais comme le risque de référence est fortement dépendant de l’âge, le risque global d’accident vasculaire cérébral chez les femmes sous THS augmente avec l’âge (voir rubrique 4.4.)
Etudes WHI combinées - Risque augmenté d’accident ischémique cérébral* après 5 ans d’utilisation
|
Age (années) |
Incidence pour 1 000 femmes ayant pris un placebo sur une période de 5 ans |
Rapport de risque et IC à 95 % |
Cas supplémentaires pour 1 000 patientes ayant pris un THS |
|
50-59 |
8 |
1.3 (1.1 – 1.6) |
3 (1-5) |
*Aucune différence n’a été faite entre les accidents vasculaires cérébraux ischémiques et hémorragiques
D’autres réactions indésirables ont été rapportées en association avec un traitement systémique à base d'œstrogènes/progestatifs :
· Maladie de la vésicule biliaire
· Affections cutanées et sous-cutanées : chloasma, érythème polymorphe, érythème noueux, purpura vasculaire
· Démence probable après l’âge de 65 ans.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : www.signalement-sante.gouv.fr.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Classe pharmacothérapeutique : Estrogènes, code ATC : G03CA04
Efficacité clinique et sécurité d’emploi
L’efficacité du gel vaginal Blissel 50 microgrammes/g Blissel 50 mcg/g a été étudiée dans une étude multicentrique randomisée en double aveugle contrôlée par placebo chez des femmes ménopausées présentant des symptômes et des signes d’atrophie vulvovaginale.
L’application vaginale d’une faible dose d’estriol (50 microgrammes par application) améliore significativement l’indice de maturation de l’épithélium vaginal, le pH vaginal et les symptômes de l’atrophie vaginale tels que la fragilité, la sécheresse et la pâleur de la muqueuse et l’aplatissement des plis. L’analyse des réponses par symptôme (critère secondaire) a permis de constater que la signification statistique était atteinte pour la sécheresse vaginale, mais pas pour la dyspareunie, le prurit vaginal, les brûlures et la dysurie, après 12 semaines de traitement.
5.2. Propriétés pharmacocinétiques
Après 21 jours de traitement quotidien avec BLISSEL, la concentration plasmatique maximale moyenne d’estriol (±'écart-type) était de 22,80 (±15,78) pg/ml. Après le pic, les concentrations plasmatiques d’estriol diminuent de manière mono-exponentielle avec une demi-vie moyenne de 1,65 ± 0,82 h., aucune accumulation ne se produit.
L’exposition systémique à l’estriol pendant l’administration bihebdomadaire de Blissel n’a pas été étudiée.
L’estriol est lié à 90 % à l’albumine plasmatique, et très peu à la protéine de transport des hormones sexuelles (SHBG). Le métabolisme de l’estriol consiste principalement en des mécanismes de conjugaison et de déconjugaison dans la circulation entéro-hépatique. La majeure partie de l’estriol est excrétée dans les urines sous forme conjuguée. Seule une petite fraction (≤ 2 %) est excrétée dans les fèces, principalement sous forme non conjuguée.
5.3. Données de sécurité préclinique
Parahydroxybenzoate de méthyle sodique (E 219)
Parahydroxybenzoate de propyle sodique (E 217)
Polycarbophile
Carbomère
Hydroxyde de sodium (pour l’ajustement du pH)
Acide chlorhydrique (pour l’ajustement du pH)
Eau purifiée.
2 ans.
6.4. Précautions particulières de conservation
À conserver à une température ne dépassant pas 25°C.
6.5. Nature et contenu de l'emballage extérieur
Toutes les présentations peuvent ne pas être commercialisées.
Tube en aluminium de 10 g et de 30 g.
Le tube de 10 g se trouve dans une boîte en carton contenant la notice et peut être commercialisé en 2 présentations :
· une plaquette thermoformée contenant 10 canules jetables avec indicateur de remplissage et un piston réutilisable.
ou
· une plaquette thermoformée contenant 1 canule jetable avec indicateur de remplissage et un piston réutilisable.
Le tube de 30 g se trouve dans une boîte en carton contenant la notice et peut être commercialisé en 2 présentations :
· trois plaquettes thermoformées contenant chacune 10 canules jetables avec indicateur de remplissage et un piston réutilisable.
ou
· une plaquette thermoformée contenant 1 canule jetable avec indicateur de remplissage et un piston réutilisable.
6.6. Précautions particulières d’élimination et de manipulation
Pas d’exigences particulières.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
SAN RAFAEL 3
28108 ALCOBENDAS (MADRID)
ESPAGNE
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 300 616 5 7 : 30 g en tube (Aluminium) + 1 canule réutilisable + 1 piston réutilisable.
· 34009 496 954 8 5 : 30 g en tube (Aluminium) + 30 canules jetables + 1 piston réutilisable.
· 34009 300 616 6 4 : 10 g en tube (Aluminium) + 1 canule réutilisable + 1 piston réutilisable
· 34009 219 721 9 1 : 10 g en tube (Aluminium) + 10 canules jetables + 1 piston réutilisable.
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Médicament soumis à prescription médicale.
Liste II.
ANSM - Mis à jour le : 21/03/2022
BLISSEL 50 microgrammes/g, gel vaginal
Estriol
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin ou votre pharmacien.
· Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d’autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
1. Qu'est-ce que BLISSEL 50 microgrammes/g, gel vaginal et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant d'utiliser BLISSEL 50 microgrammes/g, gel vaginal?
3. Comment utiliser BLISSEL 50 microgrammes/g, gel vaginal?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver BLISSEL 50 microgrammes/g, gel vaginal?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE BLISSEL 50 microgrammes/g, gel vaginal ET DANS QUELS CAS EST-IL UTILISE ?
Classe pharmacothérapeutique - code ATC : G03CA04
BLISSEL appartient à la famille des œstrogènes (hormones sexuelles) par voie locale (vaginale). Il fait partie d’un groupe de médicament appelé traitement hormonal substitutif (THS).
Il est utilisé pour soulager les symptômes de la ménopause au niveau vaginal tels que la sécheresse vaginale ou l’irritation vaginale. On parle « d’atrophie vaginale ». Elle est causée par une baisse du taux d’œstrogènes arrivant naturellement après la ménopause.
BLISSEL agit en remplaçant les œstrogènes qui sont normalement produits par les ovaires de la femme. BLISSEL vaginale s’insère dans le vagin, pour que l’hormone soit libérée là où elle est nécessaire. Ceci peut soulager l’inconfort vaginal.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D’UTILISER BLISSEL 50 microgrammes/g, gel vaginal?
Antécédents médicaux, surveillance et contrôle réguliers
L’utilisation d’un THS (Traitement Substitutif Hormonal) entraîne des risques qui doivent être considérés avant de commencer ou de poursuivre ce type de traitement.
Avant de commencer un THS, votre médecin vous interrogera sur vos propres antécédents médicaux et ceux de votre famille. Votre médecin peut décider de procéder à un examen physique. Cela peut inclure un examen de vos seins ou de votre estomac et d’effectuer un examen gynécologique, le cas échéant.
Une fois que vous avez commencé le traitement substitutif hormonal, vous devriez consulter votre médecin pour des contrôles réguliers. Lors de ces contrôles, discutez avec votre médecin des bénéfices et des risques de continuer le traitement substitutif hormonal.
Faites régulièrement une mammographie en suivant les recommandations de votre médecin.
N’utilisez jamais BLISSEL 50 microgrammes/g, gel vaginal :
· si vous avez ou avez eu un cancer du sein, ou si pourriez en avoir un ;
· si vous avez un cancer sensible aux œstrogènes, comme un cancer de la muqueuse utérine (endomètre), ou si vous pourriez en avoir un ;
· si vous avez des saignements vaginaux inexpliqués,
· si vous avez un épaississement excessif de la muqueuse utérine (hyperplasie de l’endomètre) non traité ;
· si vous avez ou avez eu un caillot de sang dans une veine (thrombose) par exemple, des jambes (thrombose veineuse profonde) ou des poumons (embolie pulmonaire),
· si vous avez un trouble de la coagulation du sang (tel un déficit en protéine C, en protéine S, ou en antithrombine) ;
· si vous avez ou si vous avez eu récemment une maladie causée par des caillots de sang dans des artères, comme une crise cardiaque, un AVC ou une angine ;
· si vous avez ou avez eu une maladie du foie et si vos analyses de la fonction hépatique ne sont pas dans les normes ;
· si vous avez un rare problème de sang appelé « porphyrie » qui est transmis dans les familles (hérédité) ;
· si vous êtes allergique (hypersensible) à l’estriol ou à l’un des autres composants contenus dans ce médicament, mentionnés dans la rubrique 6 ;
Si l’une des conditions ci-dessus apparaît pour la première fois lors de l’utilisation de BLISSEL, n’en utilisez plus et consultez votre médecin immédiatement.
Avertissements et précautions
Ce médicament est administré par insertion d’un applicateur dans le vagin. Cela peut causer une gêne ou une irritation chez les femmes ayant une atrophie vaginale sévère (amincissement ou inflammation des parois vaginales).
Veuillez informer votre médecin si vous avez ou si vous avez eu l’un(e) des troubles/maladies suivant(e)s qui, dans de rares cas, peuvent réapparaître ou s'aggraver lors d’un traitement avec BLISSEL. Si c’est le cas, vous devriez consulter votre médecin plus souvent pour des examens :
· un taux très élevé de graisses dans le sang (triglycérides).
· fibromes de l’utérus,
· tension artérielle élevée,
· diabète,
· calculs biliaires,
· migraine ou forts maux de tête,
· maladie rare du système immunitaire appelée lupus érythémateux disséminé (LED),
· épilepsie (crises),
· asthme,
· maladie du tympan et de l’audition (otospongiose),
· rétention d'eau due à des problèmes cardiaques ou rénaux,
· risque accru de développer des caillots sanguins « voir « Développement de caillots sanguins veineux (thromboembolie veineuse »),
· risque accru de contracter un cancer sensible aux œstrogènes (comme avoir sa mère, grand-mère ou sa sœur avoir le cancer du sein),
· atteinte du foie, par exemple une tumeur bénigne du foie,
· angioœdème héréditaire ou acquis.
Contactez immédiatement votre médecin dans les cas suivants :
· ictère (vos yeux et votre peau deviennent jaunes) ou problèmes de la fonction hépatique,
· augmentation soudaine de la tension artérielle,
· apparition de migraine ou de forts maux de tête,
· grossesse,
· apparition d’un trouble mentionné dans la partie « N’utilisez jamais Blissel ».
· si vous remarquez des signes de caillot sanguin tels que :
- gonflement douloureux et rougeur des jambes
- douleur soudaine dans la poitrine
- difficultés à respirer
Dans les cas ci-dessus, votre médecin pourra décider d’arrêter le traitement et de vous indiquer une alternative.
THS et cancer
La prise de comprimés d’un traitement hormonal substitutif, passant dans le sang et uniquement à base d'oestrogènes, pendant une longue période, peut augmenter le risque de développer un cancer de la muqueuse de l'utérus (cancer de l'endomètre) ou un épaississement excessif de la muqueuse utérine (hyperplasie de l’endomètre).
Il est possible qu'il y ait un risque similaire lorsque BLISSEL est utilisé dans lecadre de traitements répétés ou à long terme (plus d'un an). Par conséquent, si le traitement est répété, il doit être évaluéau moins une fois par an par votre médecin.
Si l'apparition de saignements ou de légères pertes de sang (« spotting ») se manifeste après un certain temps soustraitement, vous devez consulter votre médecin afin d’évaluer l’endomètre et les raisons cliniques. C'est peut-être un signed'épaississement de votre endomètre.
Les risques ci-après s’appliquent aux médicaments de traitement hormonal substitutif (THS) qui circulent dans le sang. Toutefois, BLISSEL est destiné au traitement local au niveau du vagin et son absorption dans le sang est très faible. Il est peu probable que les conditions indiquées ci-dessous s’aggravent ou récidivent lors du traitement par BLISSEL, mais il convient de consulter un médecin si vous êtes concernée.
Un traitement avec des doses élevées d’estrogènes pouvant augmenter le taux d’estrogènes dans le sang (comprimés ou patchs) augmente le risque de croissance anormale de la muqueuse utérine (hyperplasie de l’endomètre), de certains types de cancer, tels que le cancer du sein ou de l’endomètre, ainsi que de caillots sanguins dans les veines.
Cancer du sein
Les données disponibles suggèrent que l’utilisation de BLISSEL n’augmente pas le risque de cancer du sein chez les femmes n’ayant pas été atteinte d’un cancer du sein par le passé. Il n’a pas été établi si BLISSEL peut être utilisé en toute sécurité chez les femmes ayant été atteintes d’un cancer du sein par le passé.
· Capitons au niveau de la peau,
· Modifications au niveau du mamelon,
· Boules éventuelles que vous pouvez voir ou sentir.
Par ailleurs, il vous est conseillé de prendre part aux programmes de mammographie de dépistage qui pourront vous être proposés.
Cancer de l’ovaire
Le cancer de l'ovaire est beaucoup plus rare que le cancer du sein. L'utilisation d'un traitement hormonal substitutif, paroestrogènes seuls a été associée à une légère augmentation du risque de cancer ovarien.
Le risque de cancer ovarien varie en fonction de l’âge. Par exemple, chez les femmes âgées de 50 à 54 ans qui neprennent pas de traitement hormonal substitutif (THS), un diagnostic de cancer ovarien sera posé chez 2 femmes sur 2000en moyenne sur une période de 5 ans. Chez les femmes ayant pris un traitement hormonal substitutif (THS) pendant 5ans, il y aura environ 3 cas sur 2000 utilisatrices (soit environ un cas supplémentaire).
Effet du traitement hormonal substitutif (THS) sur le coeur et la circulation
Développement de caillots sanguins veineux (thromboembolie veineuse)
Le risque de caillots sanguins veineux est 1,3 à 3 fois plus élevé chez les femmes prenant un traitement hormonalsubstitutif (THS) que chez les femmes n’en prenant pas, surtout pendant la première année de prise.
Ces caillots de sang peuvent être graves, et si l’un d’eux migre vers les poumons, cela peut causer des douleurs dans la poitrine, un essoufflement, un malaise, voire parfois le décès.
Vous avez plus de risque d’avoir un caillot sanguin lorsque vous vieillissez, et si l’une des situations suivantes s’applique à vous.
Signalez à votre médecin si l’une de ces situations s’applique à vous :
· vous ne pouvez pas marcher pendant une longue période en raison d’une chirurgie, blessure ou maladie grave (voirégalement section 3, « Si vous devez subir une opération chirurgicale »),
· vous êtes en surpoids sévère (IMC > 30 kg/m2),
· vous avez des problèmes de coagulation sanguine qui nécessitent un traitement à long terme avec un médicamentutilisé pour prévenir les caillots sanguins,
· un de vos parents proches a déjà eu un caillot de sang dans la jambe, le poumon ou un autre organe,
· vous avez un lupus érythémateux disséminé (LED),
· vous avez un cancer.
Pour les signes de caillot sanguin, voir rubrique « Interruption immédiate du traitement dans certains cas ».
Comparaison
Chez les femmes de la cinquantaine ne prenant pas de traitement hormonal substitutif (THS), un caillot sanguin veineux survient en moyenne chez 4 à 7 femmes sur 1000 après une période de 5 ans.
Chez les femmes de la cinquantaine qui n’ont plus leur utérus et qui ont pris un traitement hormonal substitutif (THS)contenant uniquement un œstrogène pendant plus de 5 ans, il y aura 5 à 8 cas sur 1000 utilisatrices (c’est-à-dire 1 cas supplémentaire).
Maladie du cœur
Pour les femmes qui prennent un traitement oestrogénique seul, il n’y a pas d’augmentation de risque de développer unemaladie cardiaque.
Accident vasculaire cérébral
Le risque d’avoir un accident vasculaire cérébral (AVC) est environ 1,5 fois supérieur chez les utilisatrices de traitementhormonal substitutif (THS) par rapport aux non-utilisatrices.
Le nombre de cas supplémentaires d’AVC liés à l’utilisation d’un traitement hormonal substitutif (THS) augmente avecl’âge.
Comparaison
Chez les femmes de la cinquantaine ne prenant pas de traitement hormonal substitutif (THS), un AVC est attendu enmoyenne chez 8 femmes sur 1000 sur une période de 5 ans.
Pour les femmes de la cinquantaine prenant un traitement hormonal substitutif (THS), il y aura 11 cas sur 1000 utilisatricessur une période de 5 ans (c’est-à-dire 3 cas supplémentaires).
Autres médicaments et BLISSEL 50 microgrammes/g, gel vaginal
BLISSEL contient une faible dose d’estriol et est destiné à un traitement local, il n’est donc pas supposé affecter ou être affecté par la prise d’autres médicaments. Cependant, les interactions avec d’autres traitements vaginaux appliqués localement doivent être envisagées.
Grossesse et allaitement
Si vous êtes enceinte ou que vous allaitez, si vous pensez être enceinte ou planifiez une grossesse, demandez conseil à votre médecin ou pharmacien avant de prendre ce médicament.
L’utilisation de BLISSEL est déconseillée si vous êtes enceinte.
Si vous découvrez que vous êtes enceinte au cours du traitement, informez-en immédiatement votre médecin et cessez l’utilisation de BLISSEL.
L’utilisation de BLISSEL est déconseillée au cours de l’allaitement.
Conduite de véhicules et utilisation de machines
Sans objet.
BLISSEL 50 microgrammes/g, gel vaginal contient du parahydroxybenzoate de méthyle sodique (E 219) et du parahydroxybenzoate de propyle sodique (E 217), qui peuvent causer des réactions allergiques (éventuellement retardées).
N’utilisez pas ce médicament si vous êtes allergique à l’un de ses constituants.
3. COMMENT UTILISER BLISSEL 50 microgrammes/g, gel vaginal ?
La dose habituelle durant les 3 premières semaines de traitement consiste en une dose d’applicateur par jour, de préférence avant le coucher. Après 3 semaines d’utilisation, votre gêne doit avoir diminué et les doses peuvent être réduites. Vous pourrez avoir seulement besoin d’une dose deux fois par semaine.
Utilisez l’applicateur pour insérer le gel dans le vagin (il est conseillé de le faire avant le coucher).
Les instructions suivantes indiquent comment utiliser le gel.
L'image ci-dessous montre les différents éléments du tube et de l'applicateur (piston et canule).
Tube Bouchon jetable Piston Canule Indicateur de remplissage Adaptateur 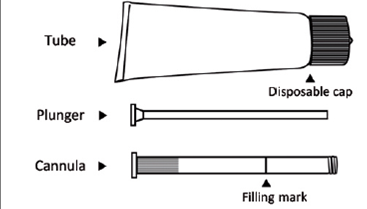
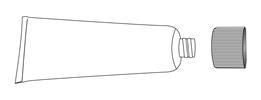
1. Retirez le bouchon du tube, retournez-le et percez l’opercule à l’aide de la pointe située à l’arrière du bouchon. A ne pas utiliser si l’opercule est détérioré.
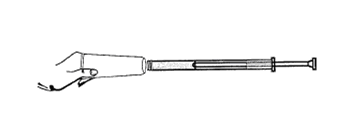
2. Prenez une canule ainsi que le piston. Insérez le piston blanc à l’intérieur de la canule. Vissez la canule sur le tube.

3. Pressez le tube pour remplir l’applicateur de gel jusqu’au niveau de l’indicateur de remplissage.
4. Dévissez la canule du tube et refermez le tube avec le bouchon.
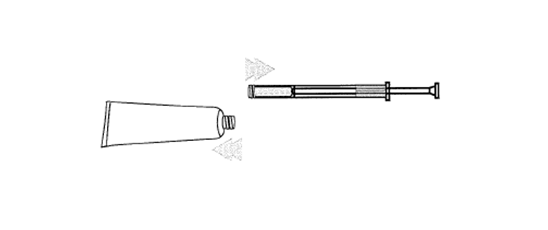
5. Pour appliquer le gel, allongez-vous, insérez l’extrémité de l’applicateur au fond du vagin et poussez lentement le piston.
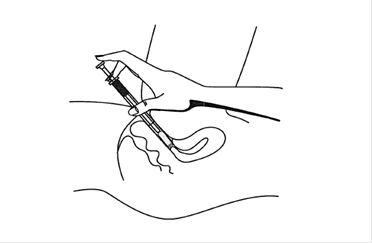
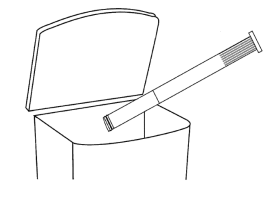
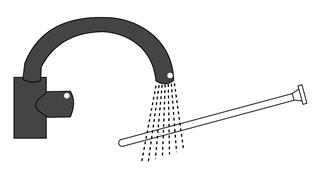
6. Après utilisation, retirez le piston de la canule, jetez la canule et rincez le piston à l’eau tiède afin de pouvoir le réutiliser pour l’application suivante.
Boite de 10 g - 1 Plaquette contenant 10 tubes réutilisables (canules) et un piston réutilisable.
Boite de 30 g - 3 Plaquette contenant 30 tubes réutilisables (canules) et un piston réutilisable.
Boîte de 10 g - Sachet contenant un tube réutilisable (canule) et un piston réutilisable.
Boîte de 30g - Sachet contenant un tube réutilisable (canule) et un piston réutilisable.
Retirez le piston de la canule. Rincez la canule et le piston à l’eau tiède afin de pouvoir le réutiliser pour la prochaine application.
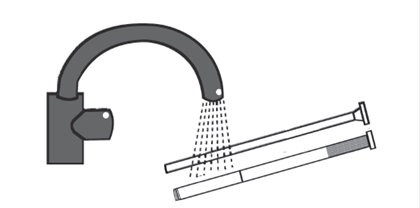
Si vous avez utilisé plus de BLISSEL 50 microgrammes/g, gel vaginal que vous n’auriez dû
Si vous avez appliqué trop de gel ou si une personne a avalé accidentellement du gel, vous n’avez pas d’inquiétude à avoir. Vous pouvez toutefois demander conseil à un médecin. Il est possible d’avoir des nausées ou de vomir et certaines femmes peuvent avoir des saignements vaginaux après quelques jours.
Si vous oubliez d’utiliser BLISSEL 50 microgrammes/g, gel vaginal que vous n’auriez dû
Appliquez la dose oubliée lorsque vous y pensez, si la prise normale aurait dû avoir lieu moins de 12 heures avant. Si la prise normale aurait dû avoir lieu plus de 12 heures avant, sautez simplement cette dose.
Ne prenez pas de dose double pour compenser la dose que vous avez oublié de prendre.
Si vous arrêtez d’utiliser BLISSEL 50 microgrammes/g, gel vaginal
Sans objet.
Si vous avez d’autres questions sur l’utilisation de ce médicament, demandez plus d’informations à votre médecin ou à votre pharmacien.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Informez immédiatement votre médecin si l’un des troubles listés dans la section AVANT D’UTILISER BLISSEL apparaît, par exemple un saignement vaginal. Votre médecin pourra décider d’arrêter le traitement et de vous indiquer une alternative.
Une irritation locale ou des démangeaisons peuvent apparaître au début du traitement. Chez la plupart des patients, ces effets indésirables disparaissent avec la poursuite du traitement. Informez votre médecin en cas de saignement vaginal, ou si l’un des effets indésirables suivants devient gênant ou continu.
Effets indésirables courants (peut affecter plus d’une patiente sur 10) :
Démangeaisons, irritation locale à l'intérieur ou autour du vagin.
Effets indésirables rares (peut affecter plus d’une patiente sur 100) :
Douleur au niveau du bas ventre, irritation cutanée, rougeurs génitales, maux de tête, candidose (muguet vaginal).
· Les affections suivantes sont signalées plus souvent chez les femmes utilisant des médicaments THS qui circulent dans le sang que chez les femmes n’utilisant pas de THS. Ces risques s’appliquent moins aux traitements administrés par voie vaginale tels que BLISSEL Caillots sanguins dans les veines des jambes ou dans les poumons (thromboembolie veineuse) : Cancer des ovaires,
· AVC,
· Pertes de mémoire probables, lorsque le traitement hormonal substitutif (THS) est commencé après l’âge de 65 ans.
Pour plus d’information sur les effets indésirables, voir rubrique 2.
· affections biliaires
· divers troubles cutanés :
- décoloration de la peau, notamment du visage ou du cou, connue sous le nom de taches de grossesse(chloasma)
- nodules cutanés rougeâtres douloureux (érythème noueux),
- éruption avec des lésions rouges en forme de cibles ou des douleurs (érythème polymorphe),
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet: www.signalement-sante.gouv.fr
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER BLISSEL50 microgrammes/g, gel vaginal ?
Tenir ce médicament hors de la vue et de la portée des enfants.
N’utilisez pas ce médicament après la date de péremption indiquée sur l’emballage après EXP. La date de péremption fait référence au dernier jour de ce mois.
À conserver à une température ne dépassant pas 25°C.
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient BLISSEL 50 microgrammes/g, gel vaginal
· La substance active est : Estriol.
L’applicateur, rempli jusqu’à l’anneau qui sert de repère, contient 1 g de gel vaginal, soit 50 microgrammes d’estriol.
· Les autres composants sont :
Glycérol (E422), parahydroxybenzoate de méthyle sodique (E 219), parahydroxybenzoate de propyle sodique (E 217), polycarbophile, carbomère, hydroxyde de sodium, acide chlorhydrique, eau purifiée.
Qu’est-ce que BLISSEL 50 microgrammes/g, gel vaginal et contenu de l’emballage extérieur
Ce médicament se présente sous la forme d’un gel vaginal incolore, clair à légèrement translucide. Boîte de 1 tube en aluminium de 10 g ou de 30 g.
· Boîte de 10 g - Plaquette contenant 10 tubes jetables (canules) et un piston réutilisable.
Boîte en carton contenant 10 g de BLISSEL et une plaquette contenant 10 tubes jetables (canules) avec un indicateur de remplissage et un piston réutilisable.
· Boîte de 10 g - Sachet contenant 1 tube réutilisable (canule) and un piston réutilisable.
Boîte en carton contenant 10 g de BLISSEL et un sac contenant 1 tube réutilisable (canule) avec un indicateur de remplissage et un piston réutilisable.
· Boîte de 30 g - Plaquette contenant 30 tubes réutilisables (canules) et un piston réutilisable.
Boîte en carton contenant 30 g de BLISSEL et 3 plaquettes contenant chacune 10 tubes réutilisables (canules) avec un indicateur de remplissage et un piston réutilisable.
· Boîte de 30 g - Sachet contenant 1 tube réutilisable (canule) et un piston réutilisable.
Boîte en carton contenant 30 g de BLISSEL et un sac contenant un tube réutilisable (canule) avec un indicateur de remplissage et un piston réutilisable.
Toutes les présentations peuvent ne pas être commercialisées.
Titulaire de l’autorisation de mise sur le marché
SAN RAFAEL 3
28108 ALCOBENDAS (MADRID)
ESPAGNE
Exploitant de l’autorisation de mise sur le marché
BATIMENT LE NEWTON
9-11, RUE JEANNE BRACONNIER
92366 MEUDON LA FORET
SAN RAFAEL 3
28108 ALCOBENDAS (MADRID)
ESPAGNE
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Sans objet.
La dernière date à laquelle cette notice a été révisée est : {MM/AAAA}
Ce médicament est autorisé dans les Etats membres de l'Espace Economique Européen sous les noms suivants : Conformément à la réglementation en vigueur.
[À compléter ultérieurement par le titulaire]
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).